
1
Wybrane niemetale
Wodór
glowce IVA: w giel i krzem
Azotowce VA:
azot i fosfor
Tlenowce VIA: tlen i siarka
Fluorowce VIIA

2
1.
Grupa VIA (16)
– g ównie b
nas interesowa O i S.
2. Konfiguracja elektronowa pow oki walencyjnej:
s
2
p
4
.
3. Elektroujemno ci Paulinga:
O
3,4
, S
2,6
, Se
2,6
,Te
2.1
, Po
2,0
4. O i S – typowe niemetale
Se i Te – pó metale
Po
–
metal
5. Bogactwo form alotropowych - tendencja do katenacji (tworzenia
cuchów
wieloatomowych) w stanie pierwiastkowym: tlen O
2
i ozon O
3
; siarka cykliczna S
8
i
cuchowa oraz S
2
w stanie pary; Se i Te maj odmiany alotropowe niemetaliczne zarówno
pier cieniowe, jak i
cuchowe; Se szary, zwany ze wzgl du na wygl d selenem
metalicznym wykazuje fotoprzewodnictwo (zastosowanie w fotokomórkach).
Tlenowce

3
Tlenowce
6. Tlen i siarka tworz wi zania jonowe z typowymi metalami (tlenki i siarczki) oraz
kowalencyjne (kowalencyjne spolaryzowane) z niemetalami. Hybrydyzacje tlenu:
sp
3
(woda,
alkohole, grupa hydroksylowa),
sp
2
(CO
2
, grupa karbonylowa),
sp
(CO); tlen nie ma orbitali d,
wi c hybrydyzacja z ich udzia em nie wyst puje. Hybrydyzacje S:
sp
3
(siarkowodór,
merkaptany, grupa tiolowa),
sp
2
(CS
2
, SO
3
, grupa tiokarbonylowa),
sp
3
d
2
(SF
6
).
7. Jony O
2-
(tlenki – jonowa sie krystaliczna) i S
2-
(siarczki – jonowa sie krystaliczna i
roztwory).
8. G ówne stopnie utlenienia: O
–II
; S
–II
,
+IV
,
+VI
9. W
ciwo ci utleniaj ce:
Tlen molekularny ma silne w
ciwo ci utleniaj ce, utlenianie jest silnie egzotermiczne
spalanie; siarka mniej reaktywna, ale wiele metali ogrzewanych w parach siarki spala si
podobnie jak w tlenie.
10. Aktywno
w stanie pierwiastkowym: O i S s aktywnymi niemetalami. Tlen ze wzgl du na
znaczn elektroujemno
i ma y rozmiar atomu oraz brak orbitali d odbiega w
ciwo ciami
od reszty pierwiastków tej grupy.

4
Tlen
O
I. Wyst powanie – w zwi zkach i w stanie wolnym.
Najbardziej rozpowszechniony pierwiastek w zewn trznych warstwach Ziemi:
46 % mas. skorupy ziemskiej (krzemiany, glinokrzemiany i krzemionka SiO
2
)
89 % mas. hydrosfery (woda)
23 % mas. atmosfery (O
2
) [76 % N
2
i 1 % Ar]
21 % obj. atmosfery (O
2
) [78 % N
2
i 1 % Ar]
63 % mas. organizmu cz owieka, niezb dny do oddychania ludzi i zwierz t, powstaje w procesie
fotosyntezy (obj to
wydzielanego O
2
jest w przybli eniu równa obj to ci asymilowanego CO
2
)
Razem (atmosfera, hydrosfera, biosfera i skorupa ziemska): 45 % masy.
Wolny tlen wyst puje w dwóch odmianach alotropowych: O
2
i O
3
(ozon).
Ozon powstaje podczas wy adowa atmosferycznych oraz pod wp ywem promieniowania UV.
Zbiera si w górnych warstwach atmosfery i poch ania promieniowanie UV, wobec czego chroni
ycie organiczne na Ziemi od szkodliwych skutków tego promieniowania.

5
Tlen
O
II. Otrzymywanie
Tlen O
2
1. Laboratoryjne
rozk ad termiczny chloranu (V) potasu KClO
3
w obecno ci MnO
2
:
2KClO
3
MnO2
2KCl + 3O
2
w reakcji KMnO
4
z wod utlenion w rodowisku kwa nym:
2 MnO
4
-
+ 8H
+
+ 5e
-
Mn
2+
+ 4H
2
O
5
H
2
O
2
2H
+
+ O
2
+ 2e
-
2MnO
4
-
+ 5H
2
O
2
+ 6H
+
2Mn
2+
+ 5O
2
+ 8H
2
O
2. Przemys owe
destylacja frakcyjna skroplonego powietrza
elektroliza wody zakwaszonej H
2
SO
4
lub zalkalizowanej NaOH.
VII
II
-I
0
Ciek y tlen
Ozon O
3
Otrzymywanie z tlenu (wy adowania elektryczne – ozonizator, dzia anie UV lub wysokiej
temperatury – optymalnie ok. 1800 K):
O
2
energia
O + O
O + O
2
O
3
a nast pnie destylacja skroplonej mieszaniny z tlenem.
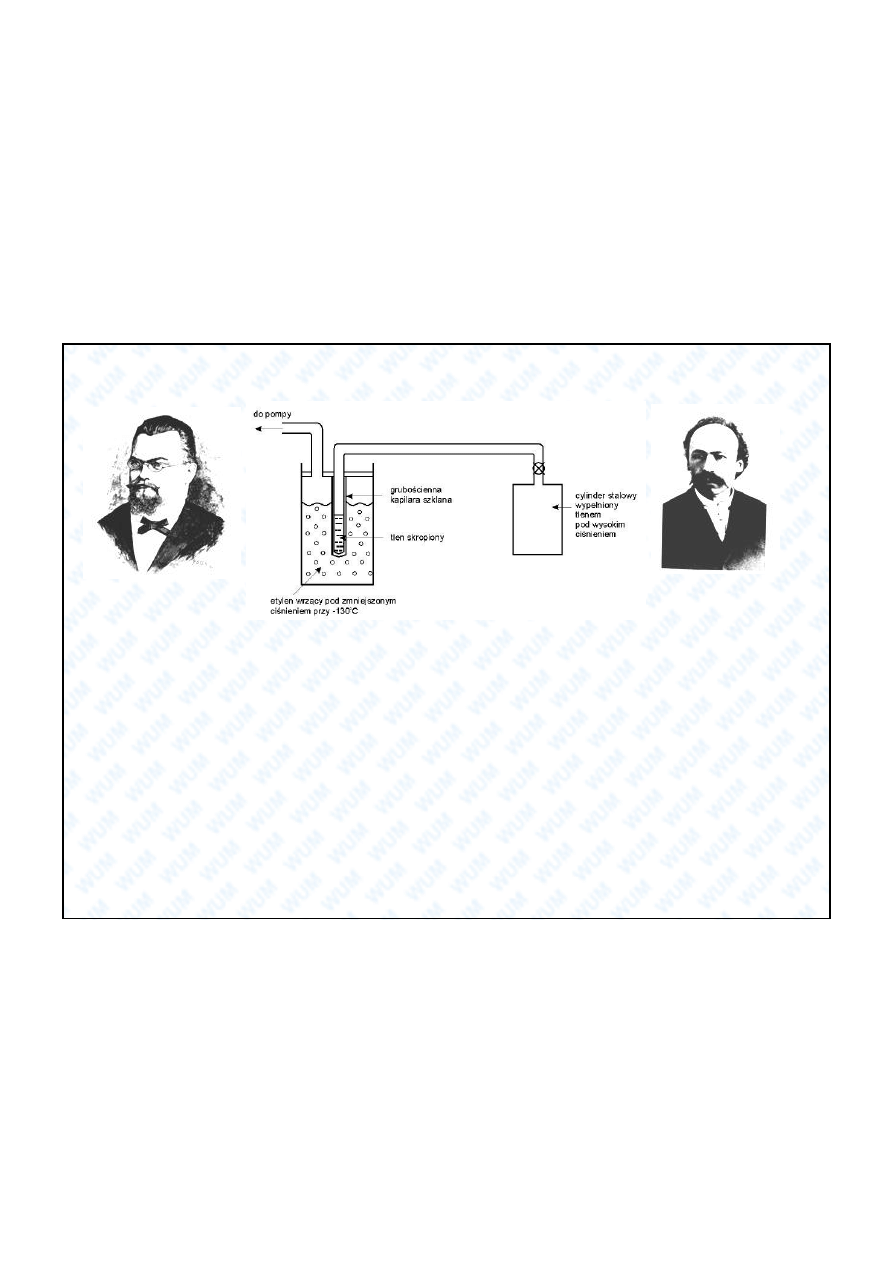
6
Pierwsze stwo pe nego skroplenia powietrza i jego sk adników przypad o w
1883
roku
Zygmuntowi
Florentemu Wróblewskiemu
i
Karolowi Olszewskiemu
, profesorom Uniwersytetu Jagiello skiego w
Krakowie. Do przech odzenia spr
onego powietrza u yli etylen wrz cy pod obni onym ci nieniem. W ten
sposób uzyskali skroplone powietrze (79 K), a nast pnie tlen (90 K) i azot (77 K). By o to pierwsze pe ne
skroplenie gazów nale
cych do grupy gazów trwa ych. Pe ne, gdy
Polacy nie zaobserwowali jedynie
ulotnej mg y, a uzyskali ciecze kriogeniczne w du ych ilo ciach pozwalaj cych na okre lenie ich
podstawowych sta ych fizycznych, obserwacj
menisku itd. Jak g osi znana w krakowskim rodowisku
naukowym anegdota, na widok niebieskawej cieczy, jaka pojawi a si w naczyniu – a by to skroplony tlen –
Olszewski i Wróblewski rzucili si
sobie w ramiona i odta czyli walca. Wróblewski zgin
tragicznie 5 lat
pó niej. W 1894 r. Olszewski skropli argon.
Tlen
O
Z. F. Wróblewski
1845 - 1888
K. Olszewski
1846 - 1915

7
Tlen
O
III. W
ciwo ci fizyczne
Tlen O
2
Gaz bezbarwny, bez zapachu i smaku, nieco ci
szy od powietrza; s abo rozpuszczalny w H
2
O
t.j. 3 % obj. w 298 K, ale to wystarcza do utrzymania ycia w zbiornikach wodnych.
t.t. = 54 K
t.w. = 90 K
Ozon O
3
Gaz barwy niebieskiej, charakterystyczny zapach, ok. 1,5 raza ci
szy od O
2
i prawie 10 razy
lepiej od niego rozpuszczalny w H
2
O, niszczy drobnoustroje a w wi kszych st
eniach jest
truj cy.
t.t. = 80 K
t.w. = 162 K
IV. W
ciwo ci chemiczne w stanie pierwiastkowym
1. Budowa elektronowa O
2
i O
3
, paramagnetyzm O
2
i tlen singletowy zosta y ju omówione.
2. W
ciwo ci utleniaj ce O
2
Tlen jest silnie elektroujemny a O
2
jako gaz ma u atwiony kontakt z innymi reagentami.
Utlenianie tlenem O
2
jest wi c silnie egzotermiczne (spalanie), chocia wymaga odpowiedniej
temperatury zap onu (inicjacja, np. grafit 970 K, diament 1070 K, siarka 520 K, wodór 720 K).
Gwa towne utlenianie, któremu towarzysz efekty wietlne i cieplne w postaci p omienia, nosi
nazw spalania. Spalanie ma mechanizm rodnikowy, np. dla wodoru:

8
Tlen
O
H
2
naczynia
cianka
H
ads
+ H
inicjacja
H + O
2
OH + O
O + H
2
OH + H
propagacja
OH + H
2
H
2
O + H
Rekombinacja rodników
terminacja
W reakcji tej bior udzia dwa bardzo silne utleniacze, tlen atomowy i rodnik wodorotlenowy
OH oraz bardzo silny reduktor w postaci wodoru atomowego
(hierarchia utleniaczy:
F
2
> OF
2
> O > OH > O
3
).
Energia wi zania O-O jest du a (ok. 500 kJ/mol), wi c do zapocz tkowania wi kszo ci
reakcji wymagana jest podwy szona temperatura lub katalizator. W temperaturze pokojowej
O
2
czy si z bia ym fosforem i metalami alkalicznymi, w temperaturze podwy szonej ze
wszystkimi niemal pierwiastkami i ogromn liczb zwi zków chemicznych.

9
Tlen
O
3. W
ciwo ci utleniaj ce O
3
Ozon atwo dysocjuje z utworzeniem reaktywnego tlenu atomowego:
O
3
O
2
+ O
Bardzo silny utleniacz. Na przyk ad, utlenia w temperaturze pokojowej PbS do PbSO
4
(zmiana barwy z
czarnej na bia ):
PbS + 4O
PbSO
4
a H
2
S do H
2
SO
4
:
H
2
S + 4O
H
2
SO
4
W roztworze wodnym O
3
jest silniejszym utleniaczem ni O
2
:
O
3
+ 2H
+
+ 2e
-
O
2
+ H
2
O
E
0
= 2,07 V
O
2
+ 4H
+
+ 4e
-
2 H
2
O
E
0
= 1,23 V
Ozon wykrywa si papierkiem jodkowym, nasyconym KI i skrobi :
1
O
3
+ 2H
+
+ 2e
-
O
2
+ H
2
O
1
2I
-
I
2
+ 2e
-
O
3
+ 2I
-
+ 2H
+
I
2
+ O
2
+ H
2
O
Reakcja ta zachodzi w rodowisku oboj tnym, wi c po obu stronach reakcji sumarycznej dodajemy 2OH
-
:
O
3
+ 2I
-
+ H
2
O
I
2
+ O
2
+ 2OH
-
Obecno
ozonu poznajemy po fioletowej barwie addycyjnego zwi zku jodu ze skrobi .
0
0
-II
-II
10
Tlen
O
V. Zwi zki tlenu (tlenki by y ogólnie omówione wcze niej)
1. Woda
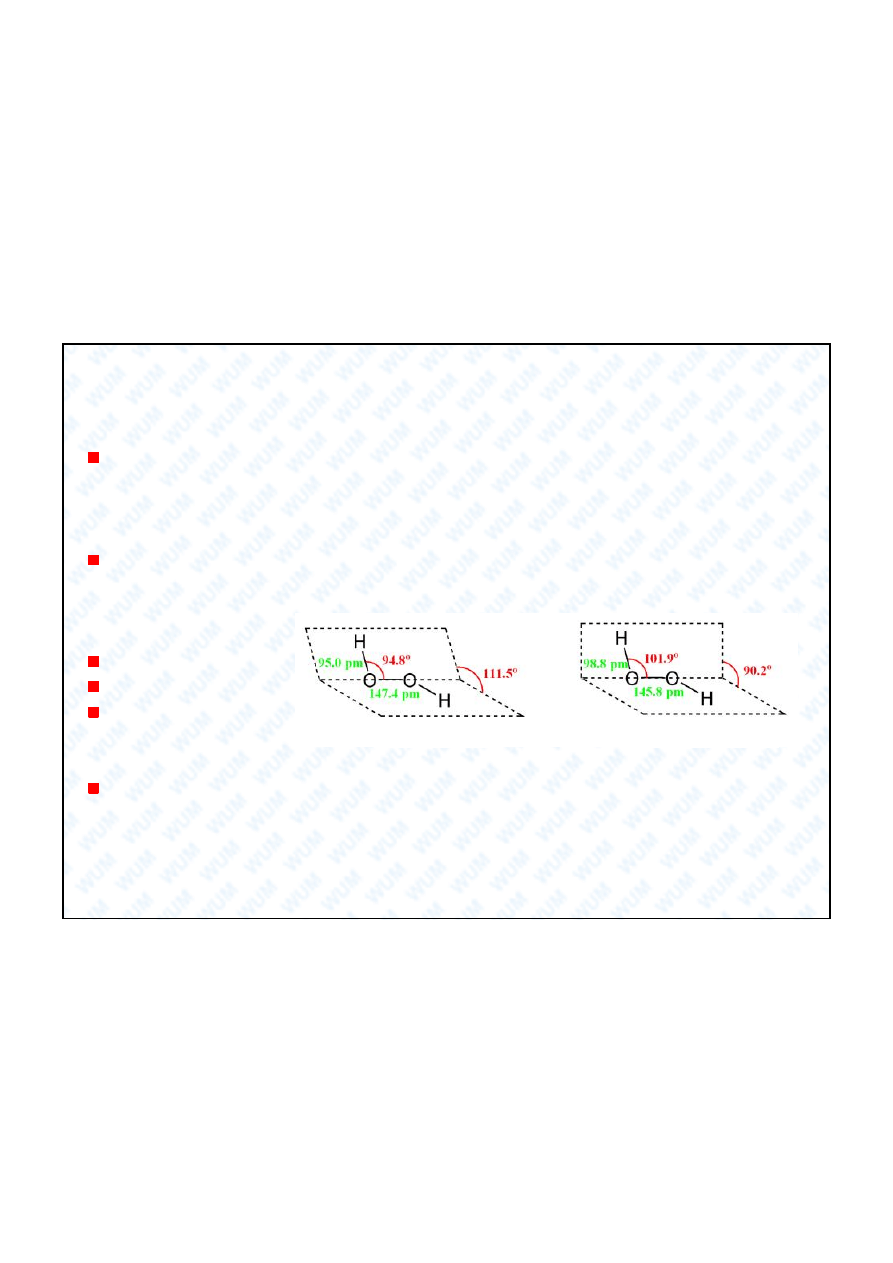
Wcze niej omówione tematy:
Budowa elektronowa i geometryczna cz steczki.
ciwo ci kwasowo-zasadowe.
Woda jako najwa niejszy rozpuszczalnik w przyrodzie.
Pozosta e sprawy do rozwa enia:
Woda krystalizacyjna i konstytucyjna w cia ach sta ych:
Woda krystalizacyjna:
CuSO
4
• 5H
2
O 5•hydrat siarczanu (VI) miedzi
Woda konstytucyjna odszczepia si podczas ogrzewania,
np. w reakcji:
KH
2
PO
4
KPO
3
+ H
2
O
Diwodorofosforan (V) potasu odszczepia tu wod przekszta caj c
si w metafosforan potasu, co mo na przedstawi schematycznie:
P
OK
O
OH
O
H
= H
2
O
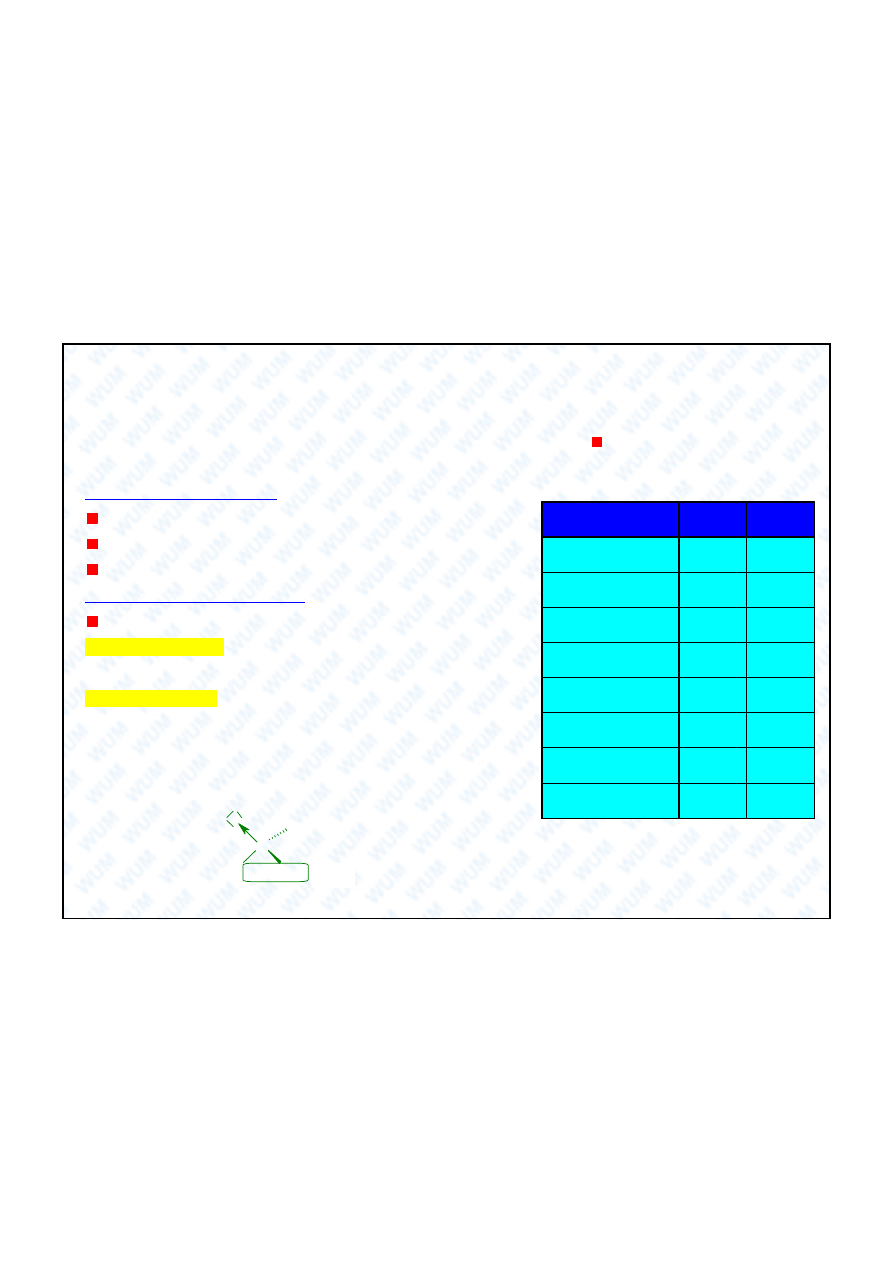
ciwo
D
2
O
H
2
O
t.t. (°C)
3,82
0,0
t.w. (°C)
101,4
100,0
d (20°C, g/ml)
1,1056
0,9982
temp. maks. d (°C)
11,6
4,0
lepko
(20°C, mPa•s)
1,25
1,005
ciep o par. (cal/mol)
10,864
10,515
(D)
1,87
1,85
pD / pH ( 25°C)
7,41
7,00
Porównanie D
2
O / H
2
O
D
2
O
tworzy silniejsze mi dzymo-
lekularne wi zania wodorowe ni H
2
O.
Ssaki gin po 1 tygodniu podawania
D
2
O, kiedy stopie
zdeuterowania
wody ustrojowej osi ga 50 %.
11
Tlen
O
2. Nadtlenek wodoru
2.1. Otrzymywanie
Laboratoryjne z nadtlenku baru:
BaO
2
+ H
2
SO
4
BaSO
4
+ H
2
O
2
Przemys owe:
Anodowe utlenianie st
onego kwasu siarkowego (VI) do kwasu peroksodisiarkowego (VI)
2 HSO
4
-
H
2
S
2
O
8
+ 2e
-
a nast pnie hydrolityczny rozk ad
H
2
S
2
O
8
+ 2H
2
O
370K
H
2
O
2
+ 2H
2
SO
4
Metoda antrachinonowa (proces cykliczny):
1
2
3
4
5
6
7
8
9
10
OH
C
2
H
5
OH
O
O
C
2
H
5
+ O
2
+ H
2
O
2
+ H
2
regeneracja
na Pd
Proces prowadzi si przepuszczaj c powietrze przez roztwór antracenodiolu w odpowiednim rozpuszczalniku
organicznym.
2-etylo-9,10-antracenodiol
2-etyloantrachinon
12
Tlen
O
2.2. W
ciwo ci fizyczne
Czysty H
2
O
2
jest g st (
d = 1,4 g/ml
), lepk , polarn (
= 2,26 D
), niebieskaw ciecz :
t.t. = 272 K (-1
O
C) t.w. = 423 K (150
O
C)
Temperatur wrzenia pod normalnym ci nieniem wyznaczono przez ekstrapolacj , gdy pod normalnym
ci nieniem rozk ada si wybuchowo; daje si destylowa bez rozk adu tylko pod obni onym ci nieniem.
Rozpuszczalny w wodzie w ka dym stosunku. Roztwory o st
eniu powy ej 60 % s wybuchowe. W
handlu wyst puje jako
30 % perhydrol
i
3 % woda utleniona
.
2.3. Budowa cz steczki
Stopie utlenienia tlenu
–I
.
Mostek nadtlenkowy.
Geometria.
2.4. W
ciwo ci chemiczne
Zwi zek nietrwa y atwo si rozk ada w temperaturze pokojowej na wod i tlen (tlen atomowy w pierwszym
etapie reakcji !):
2H
2
O
2
2H
2
O + O
2
Rozk ad przyspiesza podwy szenie temperatury, lady jonów metali ci
kich i litowców oraz katalityczne
dzia anie powierzchni. Ze wzgl du na generowanie tlenu stosowany jako rodek odka aj cy i wybielaj cy.
Gaz
Cia o sta e

13
Tlen
O
W roztworze wodnym H
2
O
2
jest s abym kwasem:
H
2
O
2
+ H
2
O
H
3
O
+
+ HO
2
-
pK
a
= 11,65 (20
o
C)
Sole nadtlenku wodoru s nadtlenkami zawieraj cymi anion O
2
2-
, np. Na
2
O
2
.
Wobec reduktorów zachowuje si jak silny utleniacz:
1
H
2
O
2
+ 2H
+
+ 2e
-
2H
2
O
E
o
= 1,78 V
1
2I
-
I
2
+ 2e
-
E
o
= -0,54 V
H
2
O
2
+ 2I
-
+ 2H
+
I
2
+ 2H
2
O
W stosunku do silnych utleniaczy dzia a redukuj co:
2
MnO
4
-
+ 8H
+
+ 5e
-
Mn
2+
+ 4H
2
O
E
o
= 1,51 V
5
H
2
O
2
2H
+
+ O
2
+ 2e
-
E
o
= -0,68 V
2MnO
4
-
+ 5H
2
O
2
+ 6H
+
2Mn
2+
+ 5O
2
+ 8H
2
O
Ta reakcja ju by a omawiana (otrzymywanie tlenu).
Powy sze reakcje zachodz w rodowisku kwa nym. W rodowisku zasadowym nadtlenek wodoru jest
abszym utleniaczem i s abszym reduktorem.
-I
-II
-I
0

14
Siarka
S
I. Wyst powanie
Siarka wyst puje na Ziemi w stanie wolnym i w minera ach,
ównie siarczkach (np. piryt FeS
2
) i siarczanach (np. gips
CaSO
4
•2H
2
O). Zawarto
w zewn trznych warstwach Ziemi
wynosi 0,04 % mas. (na 15 miejscu w ród pierwiastków).
II. Otrzymywanie
Dla siarki rodzimej metoda odkrywkowa i Frascha.
III. W
ciwo ci fizyczne
Szereg odmian alotropowych:
cyklo-oktasiarka
rozpuszczalna w CS
2
katena-polisiarka
nierozpuszczalna w CS
2
IV.
ciwo ci chemiczne w stanie pierwiastkowym
Siarka jest mniej reaktywna od tlenu, spala si w nim do SO
2
, w
temperaturze pokojowej reaguje z metalami alkalicznymi i
niektórymi szlachetnymi (Hg, Ag). Wiele metali ogrzewanych w
parach siarki spala si podobnie jak w atmosferze tlenu.
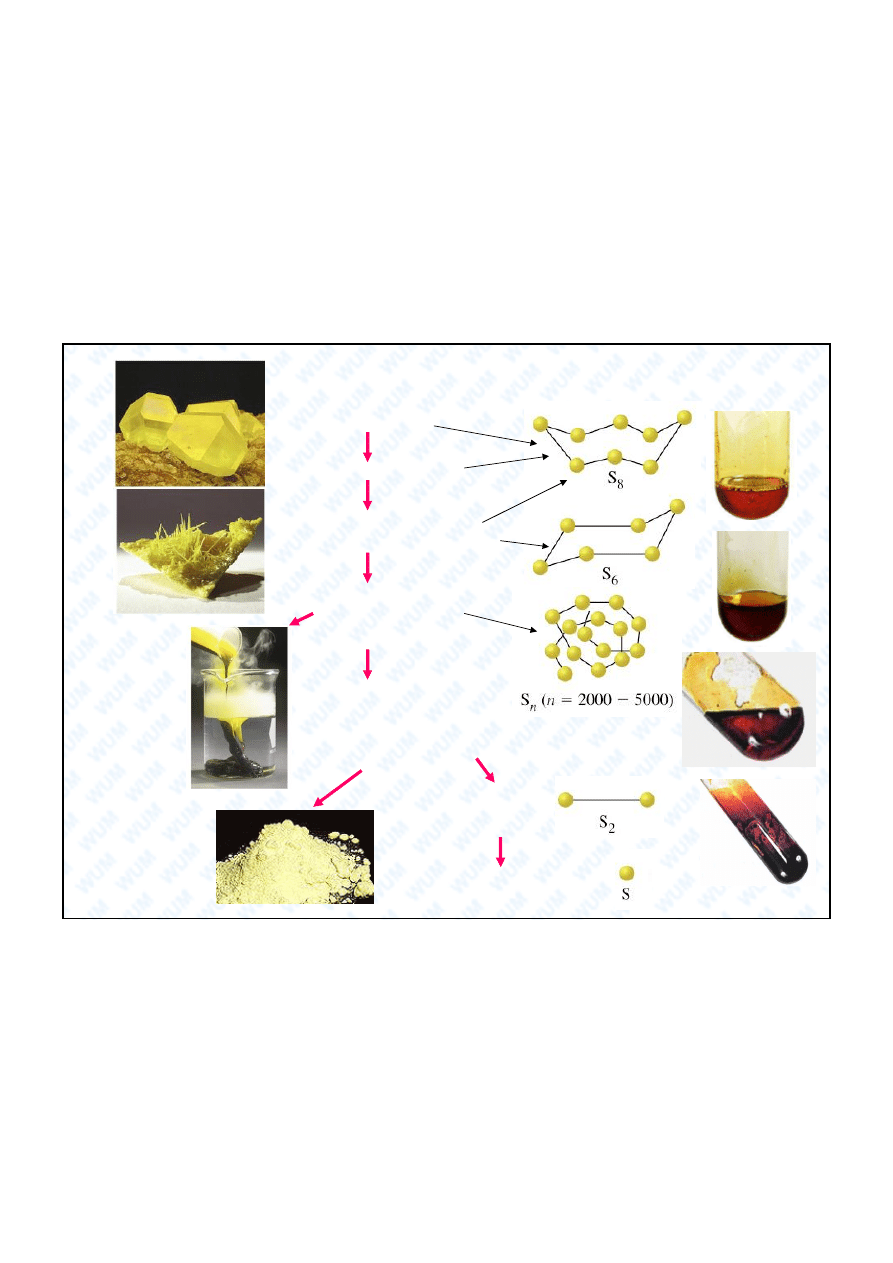
15
Alotropia siarki
S
ciecz
S
– kolor jasno-
ty do pomara czowego
ciecz
S
– lepka,
czerwonobrunatna,
maks. lepko ci 187
o
C
rombowa
S
jednosko na
S
96
o
C
119
o
C / topnienie
160
o
C
rombowa S
jednosko na S
119
o
C
160
o
C
200
o
C
445
o
C
445
o
C / wrzenie
pomara czowo-
te pary;
pocz tkowo S
8
i S
6
; w
miar
wzrostu temp.
ro nie zawarto
S
2
gwa towne
sch odzenie –
brunatna siarka
plastyczna,
ównie
cuchowa
S
niezbyt
gwa towna
kondensacja
daje
ty kwiat
siarczany
> 600
o
C
S
2
- niebieski
paramagnetyczny gaz
> 2200
o
C
S – siarka atomowa w
stanie gazowym
16
Siarka
S
V. Zwi zki siarki
1. Siarkowodór (sulfan, monosulfan) H
2
S i siarczki
Otrzymywanie H
2
S:
FeS + 2HCl
FeCl
2
+ H
2
S
ciwo ci fizyczne H
2
S: bezbarwny gaz o przykrym zapachu zgni ych jaj, toksyczny (mniej wi cej tak jak
HCN !), dobrze rozpuszczalny w wodzie (2,6 l na 1 l wody – g ównie rozpuszczanie fizyczne + reakcja z
H
2
O).
t.t. = 187 K (-86
o
C)
t.w. = 213 K (-60
o
C)
ciwo ci chemiczne H
2
S i siarczków
Budowa cz steczki H
2
S: stopie utlenienia siarki
–II
, hybrydyzacja siarki
sp
3
,
budowa k towa (
92
o
).
H
2
S jest w roztworze wodnym s abym kwasem dwuprotonowym:
H
2
S + H
2
O
H
3
O
+
+ HS
-
pK
a1
= 7 HS
-
+ H
2
O
H
3
O
+
+ S
2-
pK
a2
= 18
Siarczki litowców s dobrze rozpuszczalne w wodzie, hydrolizuj zgodnie z reakcj :
Na
2
S + H
2
O
NaHS + NaOH,
co w zapisie jonowym daje reakcj analogiczn do hydrolizy O
2-
:
S
2-
+ H
2
O
HS
-
+ OH
-
Siarczki berylowców s s abo rozpuszczalne a siarczki metali ci
kich – trudno rozpuszczalne w
wodzie (zastosowanie w analizie chemicznej).
Siarkowodór oraz siarczki s reduktorami:
Reakcja w fazie gazowej:
H
2
S + Cl
2
2HCl + S
Jodometryczne oznaczanie siarkowodoru w kwa nym roztworze:
H
2
S + I
2
2H
+
+ 2I
-
+ S
-II
0
-I
0
S
H
H
-II
0
-I
0
W roztworach o pH>8, potencja
uk adu I
2
/2I
¯
(E
0
=+0,54 V) maleje na skutek reakcji:
I
2
+ 2 OH
¯
IO
¯
+ I
¯
+ H
2
O
3 IO
¯
IO
3¯
+ 2 I
¯
(miareczkowanie odwrotne)

17
Siarka
S
2. Wielosiarczki (polisulfany)
Rozpuszczanie siarki w roztworach siarczków metali alkalicznych daje
ciecz, zawieraj
jony S
n
2-
:
S
2-
+ (n-1) S
S
n
2-
która wlana do rozcie czonego kwasu solnego daje oleist ciecz o zapachu podobnym do siarkowodoru –
polisulfan H
2
S
n
, gdzie n = 4 – 8. Polisulfan ma budow
cuchow :
H
S
S
S
S
S
H
W rodowisku alkalicznym rozk ada si na S (mleko siarkowe = siarka koloidalna) i H
2
S.
3. Dwutlenek siarki i kwas siarkowy (IV)
3.1. Otrzymywanie SO
2
Laboratoryjne
NaHSO
3
+ H
2
SO
4
SO
2
+ H
2
O + NaHSO
4
Utlenianie Cu gor cym st
onym H
2
SO
4
:
Przemys owe
Spalanie S w O
2
:
S + O
2
SO
2
Pra enie pirytu w powietrzu:
4FeS
2
+ 11O
2
2Fe
2
O
3
+ 8SO
2
1
SO
4
2-
+4H
+
+ 2e
-
SO
2
+ 2H
2
O
1
Cu
Cu
2+
+ 2e
-
Cu + SO
4
2-
+ 4H
+
SO
2
+ Cu
2+
+ 2H
2
O

18
Siarka
S
3.2. W
ciwo ci fizyczne SO
2
Gaz o charakterystycznym ostrym zapachu, daje si
atwo skropli (
t.w. = 263 K, t.j. –10
o
C
).
3.3. W
ciwo ci chemiczne SO
2
i kwasu siarkowego (IV)
Stopie utlenienia siarki
+IV
. Struktura elektronowa i geometryczna SO
2
analogiczna do O
3
.
Ciek y SO
2
jest dobrym rozpuszczalnikiem dla wielu substancji nieorganicznych.
Jest bezwodnikiem kwasowym, z wod tworzy s aby, dwuprotonowy kwas siarkowy (IV)
SO
2
+ H
2
O
H
2
SO
3
niemo liwy do wydzielenia w stanie wolnym (pK
a1
= 1,9 ; pK
a2
= 7,2).
Kwas siarkowy (IV) tworzy dwa szeregi soli, wodorosiarczany (IV), zawieraj ce jony HSO
3
-
i siarczany (IV),
zawieraj ce jony SO
3
2-
. Wszystkie wodorosiarczany (IV) s rozpuszczalne w wodzie. Siarczany (IV), z
wyj tkiem soli litowców i amonowego, s trudno rozpuszczalne.
Kwas siarkowy (IV) i jego sole s reduktorami:
Ag
2
SO
3
+ H
2
O
ogrzewanie
H
2
SO
4
+ 2Ag
(bia y osad Ag
2
SO
3
czernieje, gdy wydziela si metalicze srebro).
I IV
0
VI

19
Siarka
S
4. Tiosiarczany i kwas tiosiarkowy
4.1. Otrzymywanie
Tiosiarczany
Gotowanie roztworów siarczanów (IV) z siark :
SO
3
2-
+ S
ogrzewanie
S
2
O
3
2-
Utlenienie dwusiarczków:
Na
2
S
2
+
2
3
O
2
Na
2
S
2
O
3
Kwas tiosiarkowy
Kwas tiosiarkowy mo na otrzyma przez dzia anie chlorowodoru na Na
2
S
2
O
3
w roztworze eteru
dietylowego w temperaturze -78
o
C:
Na
2
S
2
O
3
+ 2HCl
H
2
S
2
O
3
+ 2NaCl
4.2. W
ciwo ci chemiczne
Dwa atomy S w strukturze na ró nych stopniach utlenienia:
+VI
i
–II
.
Kwas tiosiarkowy jest nietrwa y, rozk ada si powy ej 0
o
C:
H
2
S
2
O
3
H
2
S + SO
3
a tiosiarczyny rozk adaj si pod wp ywem mocnych kwasów:
S
2
O
3
2-
+ 2H
+
mocny kwas
S + SO
2
+ H
2
O
Zastosowanie roztworu tiosiarczanu sodu w technice fotograficznej jako utrwalacza (rozpuszcza
nieroz
ony fotochemicznie AgBr):
Ag
+
+ 2 S
2
O
3
2-
[Ag(S
2
O
3
)
2
]
3-
ciwo ci redukcyjne tiosiarczanów:
4 Cl
2
+ 2e
-
2 Cl
-
1
S
2
O
3
2-
+ 5H
2
O
2SO
4
2-
+ 10H
+
+ 8e
-
S
2
O
3
2-
+ 4 Cl
2
+ 5H
2
O
2SO
4
2-
+ 8Cl
-
+ 10H
+
Miareczkowanie jodu / otrzymywanie tetrationianów:
2S
2
O
3
2-
+ I
2
2I
-
+ S
4
O
6
2-
0
IV
VI i -II
VI i -II
VI
0
-I
2
3
a tiosiarczany
- bezbarwna, oleista ciecz, b. nietrwa y > 0
o
C

20
Siarka
S
5. Trójtlenek siarki i kwas siarkowy (VI)
5.1. Otrzymywanie SO
2
Laboratoryjne
Odwodnienie H
2
SO
4
za pomoc P
2
O
5
do SO
3
z utworzeniem kwasu metafosforowego (V):
H
2
SO
4
+ P
2
O
5
2HPO
3
+ SO
3
Ogrzewanie disiarczanu (VI) potasu:
K
2
S
2
O
7
ogrzewanie
K
2
SO
4
+ SO
3
Przemys owe:
SO
2
+
1
2
O
2
V2
650-850 K
O5
SO
3
5.2. W
ciwo ci fizyczne SO
2
Bezbarwna, oleista ciecz, bez zapachu. Krzepnie daj c bia e cia o sta e o wygl dzie lodu.
t.t. = 292 K (19
o
C)
t.w. = 321 K (48
o
C)
5.3. W
ciwo ci chemiczne SO
2
Jest bezwodnikiem kwasowym, reaguje gwa townie z wod daj c silny kwas dwuprotonowy
– kwas siarkowy (VI):
SO
3
+ H
2
O
H
2
SO
4
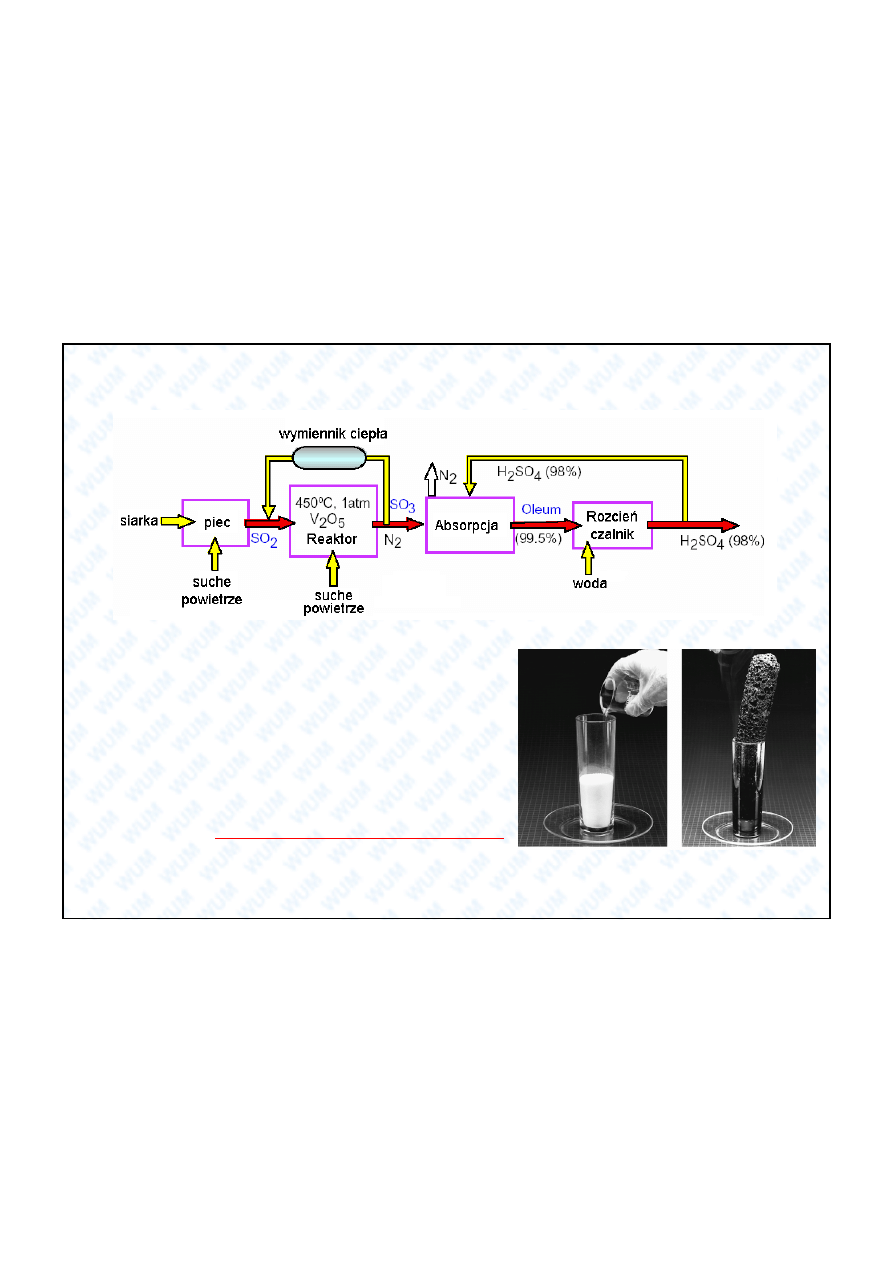
Kwas siarkowy (VI) – jeden z najwa niejszych zwi zków nieorganicznych przemys u chemicznego.
5.4. Etapy produkcji H
2
SO
4
(metoda komorowa – najbardziej popularna):
Utlenianie
SO
2
(z pra enia pirytu lub blendy cynkowej w powietrzu) do SO
3
(patrz wy ej).
SO
3
+ H
2
SO
4
H
2
S
2
O
7
oleum / kwas disiarkowy (VI)
Reakcja bezpo rednia z wod jest do celów przemys owych za powolna.
H
2
S
2
O
7
+ H
2
O
2 H
2
SO
4
SO
3
SO
3
SO
3
Reakcja bezpo rednia SO
3
z wod jest do celów przemys owych za powolna.
mocny kwas dwuprotonowy
21
Siarka
S
5.5. W
ciwo ci fizyczne H
2
SO
4
Czysty H
2
SO
4
jest bezbarwn , oleist ciecz , bez zapachu. W
sprzeda y jest st
ony 98% azeotrop. H
2
SO
4
jest bardzo
higroskopijny (dzia anie odwadniaj ce i
susz ce). Przy
rozcie czaniu wod wytwarza si bardzo du o ciep a, wi c trzeba
uwa
na rozpryskiwanie si kwasu.
Najbezpieczniej jest,
mieszaj c, ostro nie wlewa kwas do wody.
H
2
SO
4
+
cukier

22
Siarka
S
5.6. W
ciwo ci chemiczne H
2
SO
4
Silny kwas dwuprotonowy:
H
2
SO
4
+ H
2
O
H
3
O
+
+ HSO
4
-
Dla rednich st
praktycznie ca kowicie.
HSO
4
-
+ H
2
O
H
3
O
+
+ SO
4
2-
Zaledwie kilka %, pK
a2
= 2.
Roztwarza z wydzieleniem wodoru metale o ujemnym potencjale standardowym, tworz c siarczany.
St
ony kwas, zw aszcza na gor co, jest silnym utleniaczem:
2H
2
SO
4
+ Hg
HgSO
4
+ SO
2
+ 2H
2
O
2H
2
SO
4
+ C
CO
2
+ 2SO
2
+ 2H
2
O
2H
2
SO
4
+ S
3SO
2
+ 2H
2
O
Rozcie czony nie ma w
ciwo ci utleniaj cych.
Tworzy siarczany (VI), z których wi kszo
jest rozpuszczalna w wodzie (oprócz siarczanów Pb, Ba i Sr)
oraz wodorosiarczany (VI). Wodorosiarczany (VI) rozk adaj si podczas ogrzewania:
2KHSO
4
ogrzewanie
K
2
S
2
O
7
+ H
2
O
K
2
S
2
O
7
ogrzewanie
K
2
SO
4
+ SO
3
VI
VI
VI
0
0
0
II
IV
IV
IV
IV

23
Siarka
S
6. Kwasy peroksosiarkowe
Kwas peroksodisiarkowy (VI) otrzymuje si przez elektrolityczne utlenianie 50 % H
2
SO
4
na anodzie
platynowej pr dem o du ej g sto ci:
2HSO
4
-
H
2
S
2
O
8
+ 2e
-
H
2
S
2
O
8
jest bezbarwnym cia em sta ym, trwa ym w suchej atmosferze. Jest silnym utleniaczem. W wodzie
ulega hydrolizie na kwas peroksomonosiarkowy (VI), czyli kwas Caro:
H
2
S
2
O
8
+ H
2
O
H
2
SO
5
+ H
2
SO
4
Kwas Caro H
2
SO
5
jest bia ym cia em sta ym, silnie higroskopijnym, hydrolizuje dalej:
H
2
SO
5
+ H
2
O
H
2
SO
4
+ H
2
O
2
7. Struktury kwasów siarki
8. Chlorek tionylu SOCl
2
i sulfurylu SO
2
Cl
2
bezbarwnymi, ruchliwymi cieczami o przenikliwym zapachu. Hybrydyzacja siarki
sp
3
. Otrzymywanie:
PCl
5
+ SO
2
POCl
3
+ SOCl
2
SO
2
+ Cl
2
SO
2
Cl
2
Stosuje si je w chemii organicznej do wprowadzania grupy tionylowej i sulfurylowej:
S
O
S
O
S
O
O
S
O
O
grupa tionylowa
grupa sulfurylowa
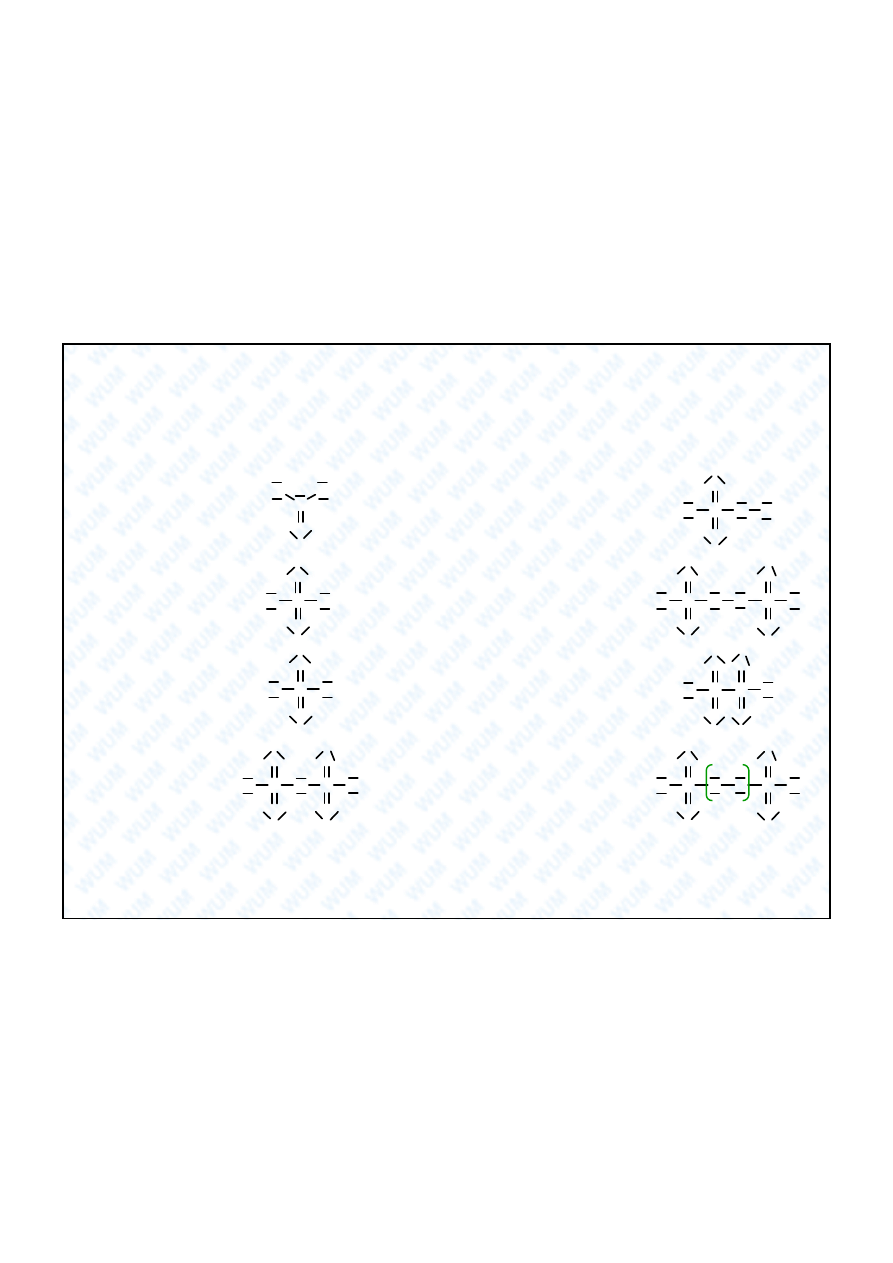
24
Kwasy tlenowe siarki
(podsumowanie)
S
S
O
OH
O
H
O
H
S
O
O
OH
O
H
S
O
S
OH
O
H
S
O
O
O OH
S
O
O
OH
O
O
H
S
O
O
S
O
O
OH
O
O
H
S
O
O
O
O
H
S
O
O
S
O
O
OH
S
O
O
OH
S
O
H
S
O
O
S
siarkowy(
IV
)
H
2
SO
3
(siarkawy)
siarkowy(
VI
)
H
2
SO
4
(siarkowy)
tiosiarkowy
H
2
S
2
O
3
(S:
VI
i
-II
)
disiarkowy(
VI
)
H
2
S
2
O
7
(pirosiarkowy)
peroksomonosiarkowy(
VI
)
H
2
SO
5
(nadtlenosiarkowy, Caro)
peroksodisiarkowy(
VI
)
H
2
S
2
O
8
(nadtlenodwusiarkowy)
ditionowy(
V
)
H
2
S
2
O
6
(podsiarkowy)
tetrationowy
H
2
S
4
O
6
(czterotionowy)
IV
VI
VI
-II
VI
VI
-I
-I
VI
-I
-I
V
V
n
H
2
S
n+2
O
6
V
0
0
Wyszukiwarka
Podobne podstrony:
Chemia ogolna i nieorg 14 2010
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 07 2010
Chemia ogolna i nieorg 12 2010
Chemia ogolna i nieorg 15 2010
Egzamin 2010 - 2011 - wymagania, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, ch
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
więcej podobnych podstron