
1
Wybrane niemetale
Wodór
glowce IVA: w giel i krzem
Azotowce VA:
azot i fosfor
Tlenowce VIA: tlen i siarka
Fluorowce VIIA

2
H
Wodór
I. Charakterystyka ogólna
1. Pierwszy pierwiastek w uk adzie okresowym, atom o najprostszej budowie.
2. Konfiguracja elektronowa pow oki walencyjnej:
s
1
.
3. Elektroujemno
2,2
t.j. bliska redniej arytmetycznej
2,35
skrajnych warto ci w uk adzie
okresowym (Fr 0,7 i F 4,0). Taka elektroujemno
sprzyja, podobnie jak dla w gla (2,6),
tworzeniu po cze z wieloma pierwiastkami.
4. Niemetal, g ówny pierwiastek we Wszech wiecie (91 % wszystkich atomów), 9-ty co do
zawarto ci w zewn trznych warstwach Ziemi (0,9 % mas.).
5. Cz steczka dwuatomowa H
2
.
6. Tworzy przede wszystkim wi zania kowalencyjne, jonowe wy cznie w wodorkach
jonowych oraz bierze udzia w wi zaniach wodorowych.
7. Stopnie utlenienia
+I
i du o rzadszy
–I
.
8. Wodór atomowy jest reduktorem.
3
H
Wodór
II. Otrzymywanie
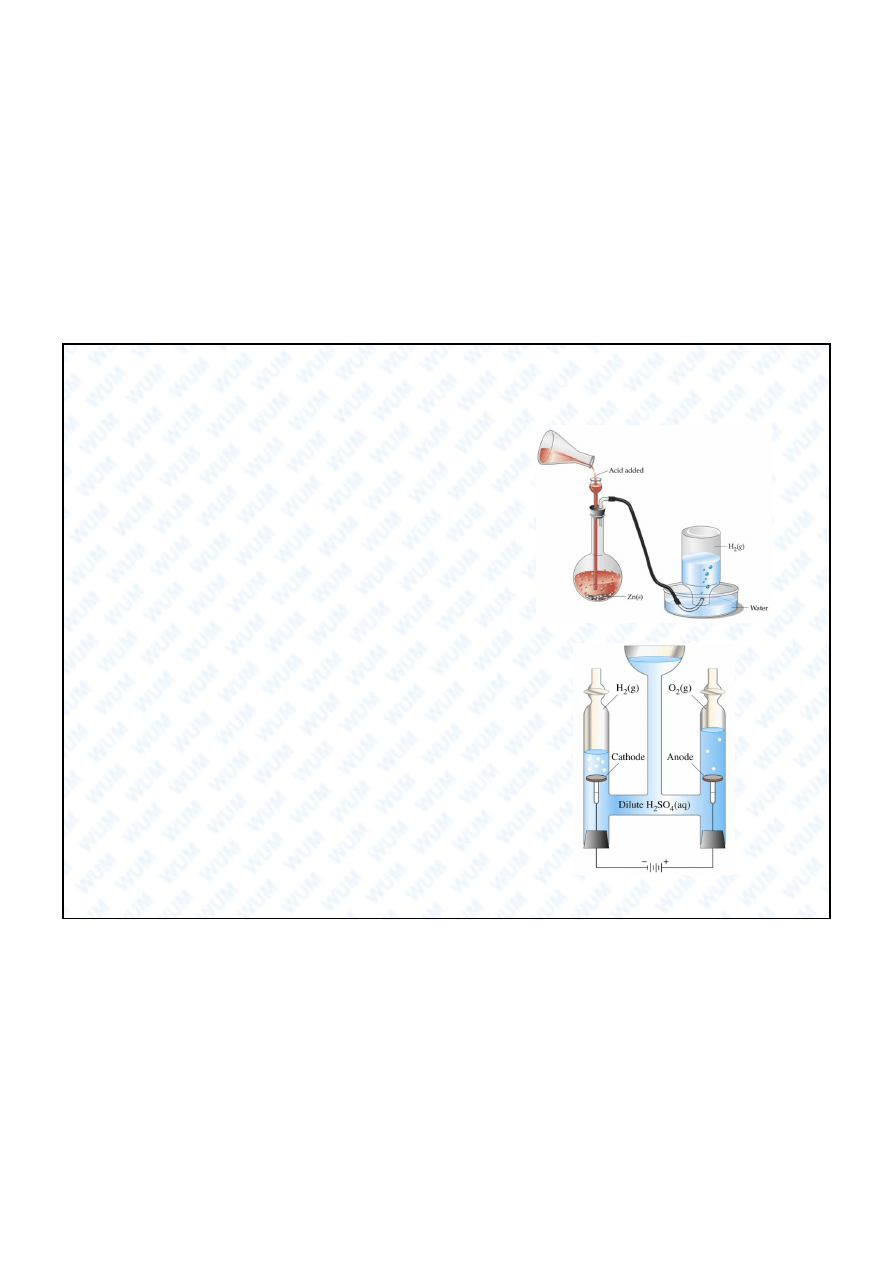
1. Laboratoryjne
Zn + 2 HCl
ZnCl
2
+ H
2
Elektroliza wody.
2. Przemys owe
Konwersja w glowodorów z par wodn :
700 K / katalizator Ni
CH
4
+ H
2
O
CO + 3H
2
CH
4
+ 2 H
2
O
CO
2
+ 4 H
2
CO + H
2
O
CO
2
+ H
2
Z gazu wodnego. Gaz wodny otrzymuje si
przepuszczaj c par wodn nad roz arzonym
koksem w temperaturze 1500 K:
C + H
2
O
CO + H
2

4
H
Wodór
III. W
ciwo ci fizyczne
1. Gaz bezbarwny, bez zapachu i smaku, bardzo s abo rozpuszczalny w wodzie, najl ejszy
gaz (14 razy l ejszy od powietrza), najwi ksza szybko
dyfuzji dla gazów.
2. Skroplony jest bezbarwn ciecz
: t.w.= 20 K; t.t. = 14 K
(tylko 6 stopni ró nicy).
3. Sk ad izotopowy:
prot
1
1
H
- prawie 100 % mas. w wodorze naturalnym
deuter
1
2
D
- tylko 1.6 × 10
-2
% mas., izotop trwa y
tryt
1
3
T
- tylko 10
-16
% mas., izotop nietrwa y – promieniotwórczy
1
3
2
3
T
He
okres po owicznego rozpadu 12,5 roku

5
H
Wodór
4. Odmiany
orto
i
para
(oddzia ywanie spinowych momentów magnetycznych j der).
bogatszy
energetycznie ubo szy
energetycznie
298
K 75
%
25
%
20 K
ok. 100 %
5. Du a rozpuszczalno
wodoru w niektórych metalach
G bka palladowa – porowaty Pd wch ania 800 razy wi ksz obj to
wodoru ni obj to
asna.
Dyfuzja (efuzja) przez blach palladow – filtr do oddzielania wodoru.
ortowodór
parawodór

6
H
Wodór
IV.
ciwo ci chemiczne
1. Wodór w temperaturze pokojowej reaguje z F
2
,
przy na wietlaniu z Cl
2
(reakcja rodnikowa).
2. W podwy szonej temperaturze reaguje z licznymi
niemetalami oraz z aktywnymi metalami (Li, Na, Ca).
3. Reakcja z tlenem:
2 H
2
+ O
2
2 H
2
O + H
H = -286 kJ/mol
jest silnie egzotermiczna, lecz w tempraturze pokojowej praktycznie nie zachodzi. Zap on
(wybuch) nast puje w temperaturze 720 K, szczególnie silny dla tzw. mieszaniny
piorunuj cej 2 : 1.
4. Wodór cz steczkowy jest silnym reduktorem w podwy szonej temperaturze, np. redukuje
tlenki metali:
420 K
CuO + H
2
Cu + H
2
O

7
H
Wodór
4. Jony
a) jon wodorowy H
+
(j dro atomu wodoru) jest najmniejszym znanym kationem,
r = 1,5 × 10
-5
Å
(1 Å = 10
-10
m);
w sieci krystalicznej wyst puje w postaci jonu oksoniowego H
3
O
+
, np. w monohydracie
kwasu chlorowego (VII), t.j. w HClO
4
·H
2
O ;
trwa y w roztworach wodnych, gdzie wyst puje w postaci jonu oksoniowego H
3
O
+
(H
9
O
4
+
)
b) jon wodorkowy H
-
(o konfiguracji elektronowej He) jest znacznie wi kszy ni wodorowy,
r = 2,1 Å
; wyst puje w sieci krystalicznej wodorków jonowych; nietrwa y w roztworach
wodnych, gdzie ulega reakcji dysproporcjonacji, która mo e by równie traktowana jako
reakcja zasada/kwas w sensie Brønsteda:
jonowo
H
-
+ H
2
O
H
2
+ OH
-
cz steczkowo
NaH + H
2
O
H
2
+ NaOH
5. Wodorki (by y ju omawiane): jonowe, kowalencyjne i niestechiometryczne (metali
przej ciowych).
6. Woda jest najwa niejszym rozpuszczalnikiem (patrz omówione wcze niej wi zania
wodorowe).
-I
+I
0

8
H
Wodór
7. Wodór atomowy
a) wykorzystanie w palnikach wodorowych
b) wodór in statu nascendi i jego w
ciwo ci
redukcyjne.
Zn + 2HCl
ZnCl
2
+ 2H
Mo na wykry nawet
10
-4
mg arsenu.
9
H
Wodór
8. Zastosowania przemys owe
a) do syntezy amoniaku metod Habera-Boscha:
3 H
2
+ N
2
2 NH
3
Warunki: T = 800 K, p = 100 – 1000 atm,
katalizator Fe z dodatkiem aktywatorów.
b) reakcje uwodornienia, np. t uszczów ciek ych
c) synteza organiczna,
kat.
np.
R
2
C=CH
2
+ CO + H
2
R
2
CH-CH
2
-CHO
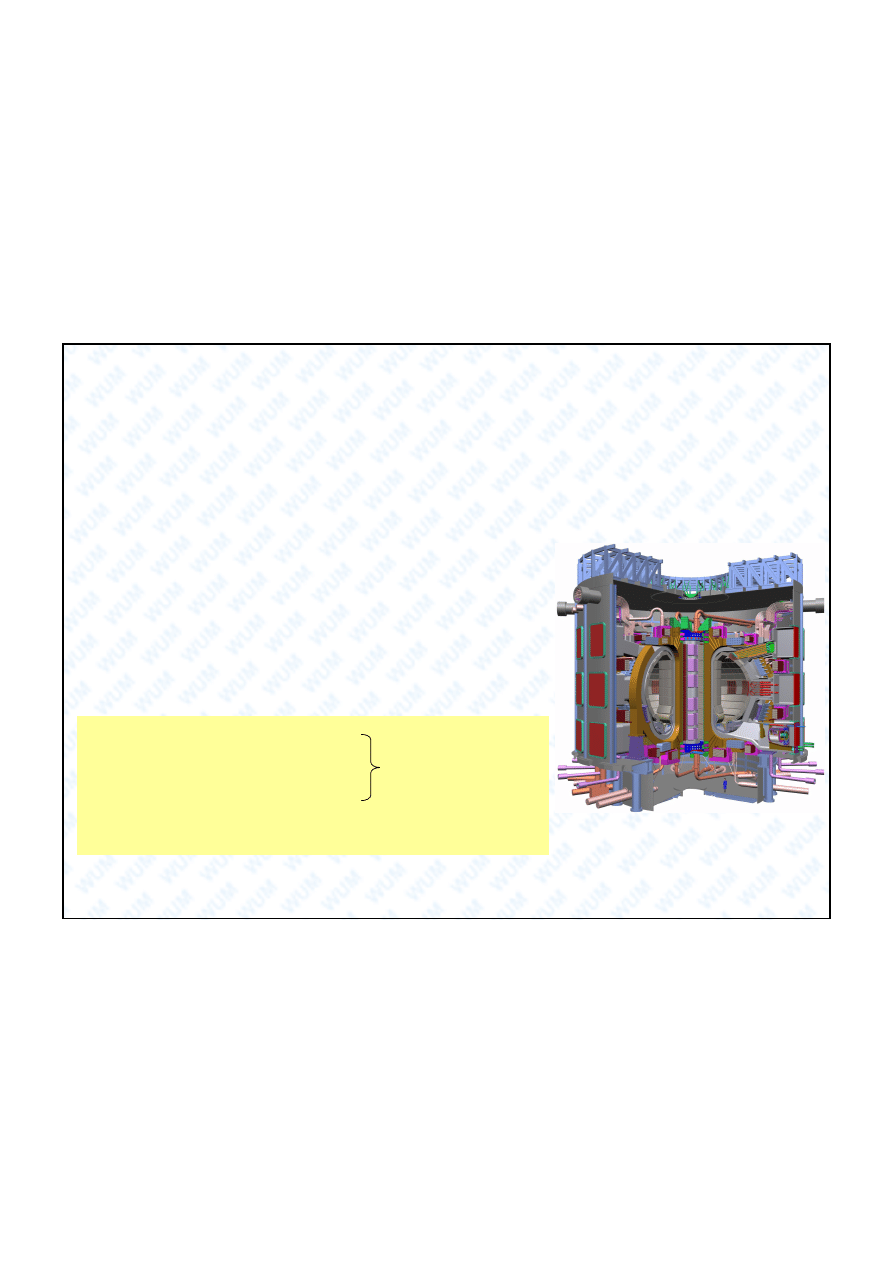
d) paliwa, perspektywicznie w energetyce termoj drowej.
e) paliwowe ogniwa wodorowe jako ród a pr du.
TOKAMAK
TOKAMAK
Eksperymentalny
Eksperymentalny
reaktor termoj
reaktor termoj
drowy
drowy
Cadarache
Cadarache
(FR)
(FR)
201
201
6
6
ITER (International Thermonuclear
Experimental Reactor) ac. droga) –
mi dzynarodowy projekt badawczy,
którego celem jest zbadanie
mo liwo ci produkowania na wielk
skal
energii z fuzji termoj drowej.
FUZJA DEUTEROWA
FUZJA DEUTEROWO-
TRYTOWA
MeV
17,59
n
He
H
H
MeV
4,03
H
H
H
H
MeV
3,27
n
He
H
H
1
0
4
2
3
1
2
1
1
1
3
1
2
1
2
1
1
0
3
2
2
1
2
1

10
glowce
1.
Grupa IVA (14)
– nas najbardziej b
interesowa C i Si.
2. Konfiguracja elektronowa pow oki walencyjnej:
s
2
p
2
.
3. Elektroujemno ci Paulinga:
C
2,6
, Si
1,9
, Ge
2,0
, Sn
1,9
, Pb
2,1
4. C – niemetal
Si, Ge – pó metale
Sn, Pb – metale
5. Kryszta y kowalencyjne (grafit, diament), molekularne (fulleren-60), metaliczne (Sn, Pb).
6. Ma a aktywno
w stanie pierwiastkowym.
7. Typ wi za i hybrydyzacja:
Dominuj wi zania kowalencyjne, zw aszcza dla C i Si. Hybrydyzacja
C: sp, sp
2
i sp
3
(ju omówiono). Si ma dost pne tak e orbitale d, wi c bior one udzia w hybrydyzacji,
np. sp
3
d
2
w [SiF
6
]
2-
.

11
Pojedyncze
wi zanie C-C ma du
energi 347 kJ/mol
, wi c w giel wykazuje siln
tendencj do tworzenia prostych, rozga zionych i zamkni tych w pier cienie
cuchów. Poza tym „lubi” tworzy wi zania wielokrotne – podwójne i potrójne. Silne
te s wi zania z H (414 kJ/mol) i O (360 kJ/mol), wi c czy si ch tnie z tymi
pierwiastkami. Po czenia bazuj ce na wi zaniach C-C, C=C, C C, C-H, C=O i C-O- s
podstaw chemii organicznej.
Krzem w przyrodzie nieo ywionej odgrywa podobn rol jak w giel w biochemii.
Wi zanie Si-Si (226 kJ/mol) jest wyra nie s absze ni wi zanie C-C
, wi c krzem nie
tworzy po cze
cuchowych bezpo rednio jak w giel. Wykorzystuje natomiast mostki
tlenowe, gdy
wi zanie Si-O ma szczególnie wysok energi (464 kJ/mol)
. Si tworzy
wi c liczne po czenia zawieraj ce
tetraedr SiO
4
4-
, czyli krzemiany oraz dodatkowo z Al
– glinokrzemiany.
glowce

12
8. Jony:
glowce nie maj tendencji do tworzenia jonów ujemnych. Tylko w giel tworzy z
typowymi metalami jonowe w gliki, np. acetylenki CaC
2
i Na
2
C
2
, w których sieci
krystalicznej wyst puj aniony C
2
2-
.
Jony dodatnie tworz szczególnie Sn i Pb. Sn
2+
i Pb
2+
istniej w roztworach i w sieci
krystalicznej. Sn
4+
i Pb
4+
istniej w roztworach w jonach kompleksowych, np. [Sn(OH)
6
]
2-
i [Pb(OH)
6
]
2-
, oraz w sieci krystalicznej.
9. Stopnie utlenienia:
W giel ma formalne stopnie utlenienia od
+IV
do
–IV
.
Pozosta e pierwiastki maj stopnie utlenienia
+II
i
+IV
.
Trwa
stopnia utlenienia
+II
ro nie, a
+IV
maleje, ze wzrostem liczby atomowej w
grupie.
10. W
ciwo ci redoks:
W stanie pierwiastkowym s reduktorami, szczególnie w giel.
W zwi zkach
na stopniu utlenienia +II s reduktorami
, np. CO jest silnym reduktorem,
tak e jon Sn
2+
.
W zwi zkach
na stopniu utlenienia +IV s utleniaczami
, np. PbO
2
(CO
2
jest utleniaczem
tylko wobec silnych reduktorów).
glowce

13
C
giel: formy alotropowe
18-ty pierwiastek co do zawarto ci w zewn trznych warstwach Ziemi (0,02 % mas.).
Wyst powanie w przyrodzie: organizmy ywe, w gle kopalne, ropa naftowa, gaz
ziemny, minera y w glanowe (wapie ), CO
2
w powietrzu (0,03 % obj.).
Najwa niejsze formy alotropowe: diament i grafit (ju omówione) oraz fulereny.
Fuleren-60
Kryszta y molekularne; izolator; temp top. > 800
o
C – sublimuje (dla porównania temp. top.
diamentu i grafitu ok. 3600
o
C); rozpuszczalny w rozpuszczalnikach aromatycznych (barwa
purpurowa), chlorowcopochodnych i CS
2
, nierozpuszczalny w wodzie.
14
C
Fulereny
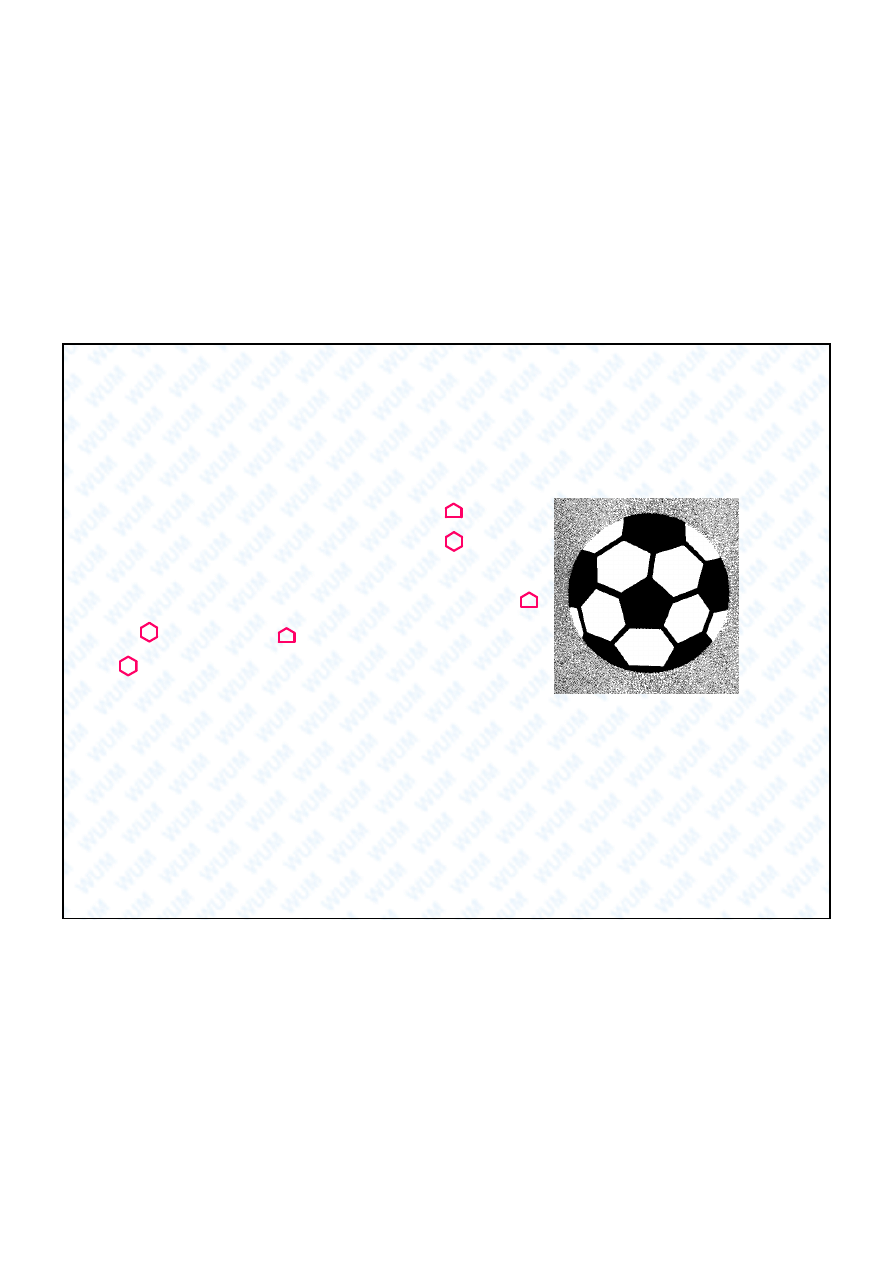
Alotropowa odmiana w gla zbudowana z cz steczek o wzorze ogólnym
C
20+2m
.
Cz steczka zawiera
12
pier cieni
5
-cz onowych
i
m
pier cieni
6
-cz onowych
.
Najtrwalszy jest fuleren-60 o wzorze
C
60
, który zawiera
12
i
20
. Ka dy pier cie
otoczony jest pi cioma pier cieniami
, a wi c
C
60
przypomina pi
futbolow o rednicy
7 Å
.
Wszystkie atomy w gla w cz steczce s równocenne, maj
hybrydyzacj zbli on do
sp
2
a orbitale 2p
z
nak adaj si , umo liwiaj c sprz
enie elektronów
. Fuleren-60 jest czarnym cia em sta ym, dobrze rozpuszczalnym w aromatycznych
rozpuszczalnikach organicznych.
Fuleren-60 odkryli w 1985 r. Kroto, Heath, O’Brien, Curl i Smalley, badaj c spektrometri mas
produkty odparowywania grafitu promieniem lasera w pró ni.

15
C
Fulereny
Nazwa fuleren pochodzi od nazwiska ameryka skiego konstruktora i matematyka Richarda
Buckminstera Fullera (1895 - 1983), który pracowa nad konstrukcj i wykorzystaniem kopu
geodezyjnych, sk adaj cych si z a urowej siatki eber pokrytych lekkim materia em. R. B.
Fuller by autorem wielu ameryka skich pawilonów na wystawach mi dzynarodowych.
W 1990 r. Kr
ä
tschmer i in. opublikowali metod otrzymywania
fulerenów w uku elektrycznym pomi dzy elektrodami grafitowymi
umieszczonymi w atmosferze gazu oboj tnego. Otrzymana sadza
jest ekstrahowana benzenem. Ekstrakt, który zawiera g ownie
C
60
,
kilka % molowych
C
70
i znikome ilo ci wy szych fulerenów, jest
nast pnie analizowany chromatograficznie.
Cz steczka
C
70
przypomina pi
do rugby (
12
+
25
). Zawiera 5 rodzajów atomów w gla
w stosunku liczbowym
10 : 10 : 20 : 20 : 10
.
Za odkrycie fulerenu-60 Curl, Kroto i Smalley otrzymali w 1996 r. nagrod Nobla z chemii.
Prof. Harold Kroto

16
C
Wy sze fulereny, nanorurki, w giel szklisty, nanopianka, ADNR
C
540
Aggregated diamond
nanorods (ADNR)
–
najtwardszy znany materia
zsyntetyzowany w 2005 r.
(C
60
, 20 GPa, 2500 K).
Nanorurka
glowa
Ferromagnetyzm przez 1 dzie
w temp. 298 K; stabilny
magnes < 90 K ! (rok odkrycia: 1997; ablacja laserem
impulsowym szklistego w gla w rozrzedzonym Ar).
giel szklisty – jeszcze
jedna forma alotropowa C,
otrzymana w 1960 r. przez
specjaln obróbk
termiczn
celulozy w 3000
o
C.
Zastosowanie: elektrody do
analizy elektrochemicznej.

17
C
Fulereny: zastosowania medyczne
Metanofulereny
aktywne biologicznie, oddzia uj na wirusy, bakterie, enzymy i ywe
komórki.
Fulereny s
zwi zkami hydrofobowymi, st d pomys zastosowania ich do blokowania
aktywno ci wirusa HIV, odpowiedzialnego za szerzenie choroby
AIDS. Po
przeprowadzeniu symulacji komputerowych przez
Friedmana
, okaza o si , e enzym
czynny wirusa ma kszta t zbli ony do otwartego na obu ko cach cylindra o rednicy
niewiele wi kszej ni
rednica C
60
. Wewn trzna cz
cylindra prawie ca kowicie
wype niona jest hydrofobowymi aminokwasami, poza dwoma resztkami kwasu
asparaginowego tworz cego centra aktywne enzymu. W
ciwo ci hydrofobowe
sprawiaj , e mo liwe jest wyst pienie silnego oddzia ywania si van der Waalsa mi dzy
cz steczk a miejscem aktywnym enzymu. C
60
mo e w lizgn
si do rodka cylindra i
zablokowa
aktywno
HIV. Po opracowaniu pochodnej fulerenu rozpuszczalnej w
wodzie uda o si
potwierdzi
teori
do wiadczeniami. Okaza o si , e ju
przy ma ych
st
eniach molowych fuleren blokuje enzym czynny HIV.
18
C
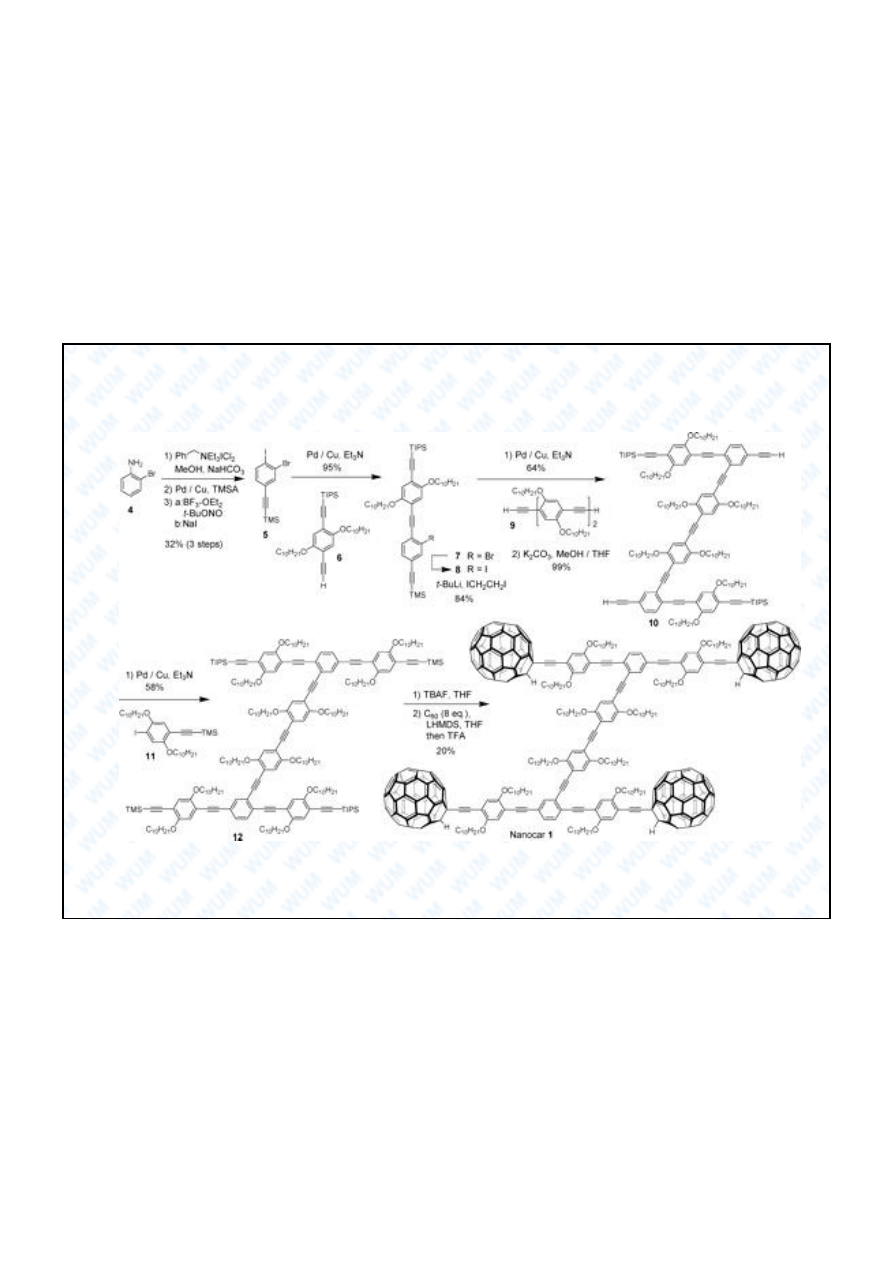
Fulereny: nanotechnologia
Yasuhiro Shirai et al., „Directional Control in Thermally Driven
Single-Molecule Nanocars”, Nano Lett. 5 (11), 2330 (2005).

19
C
Fulereny: nanotechnologia
Yasuhiro Shirai et al., „Directional Control in Thermally Driven
Single-Molecule Nanocars”, Nano Lett. 5 (11), 2330 (2005).

20
Grafeny
Grafit jest zbudowany z
warstw grafenowych.
Za badania grafenu Andriej Gejm i Konstantin
Nowosio ow (University of Manchester) otrzymali w
roku 2010 Nagrod Nobla w dziedzinie fizyki.
Jong-Hyun Ahn and Byung Hee Hong
(Sungkyunkwan University, Korea P d.)
ciwo ci: bardzo dobry przewodnik
ciep a i elektryczno ci; przezroczysty dla
wiat a; 100 razy mocniejszy ni
stal, a
zarazem tak elastyczny, e mo na go bez
szkody rozci gn
o 20 procent.
Zastosowania: elektronika, in ynieria
materia owa, materia modelowy do bada
w zakresie nowoczesnej fizyki.
Obraz grafenu zrobiony
mikroskopem STM
C

21
ciwo ci chemiczne w gla w stanie pierwiastkowym
C
1. Ma o aktywny
2. Spala si w wysokiej temperaturze do:
ditlenku w gla, przy pe nym dost pie tlenu,
tlenku w gla, przy ograniczonym dost pie tlenu.
3. W
ciwo ci redukcyjne w wysokiej temperaturze (redukcja tlenków metali do
metalu; redukcja pary wodnej
gaz wodny).
4. Tworzenie w glików:
CaO (wapno palone) + 3C (koks)
CaC
2
(karbid) + CO
CaC
2
+ 2H
2
O
Ca(OH)
2
+ HC CH
CaC
2
+ N
2
C + CaCN
2
(cyjanamid wapnia)
SiO
2
(piasek) + 2C (koks)
CO
2
+ SiC (karborund)
.
2500 K
1300 K
bia e cia o sta e
2300 K
Karborund – bardzo twarde cia o sta e o strukturze
krystalicznej diamentu.
C
C
Ca

22
Nieorganiczne zwi zki w gla
C
1. Tlenek w gla
1.1. Otrzymywanie:
HCOOH
CO
1.2. W
ciwo ci fizyczne: gaz bezbarwny, bezwonny, silnie truj cy (znacznie silniej
wi zany przez hemoglobin ni tlen molekularny), nierozpuszczalny w wodzie, nie
jest bezwodnikiem.
1.3. Wykrywanie:
sensory elektrochemiczne (wykrywacze czadu)
st
. amoniakalny roztwór CuCl:
CuCl + CO + 2H
2
O
CuCl•CO• 2H
2
O
bezbarwne kryszta y
1.4. W
ciwo ci chemiczne
Redukcyjne:
CO + PdCl
2
+ H
2
O
CO
2
+ 2HCl + Pd
CO + NaOH
HCOONa
mrówczan sodu
CO + Cl
2
COCl
2
fosgen
Tworzenie karbonylków (bezbarwne, toksyczne ciecze):
Ni + 4CO
Ni(CO)
4
Fe + 5CO
Fe(CO)
5
Warunki: wysokie T i p.
Ligand w kompleksach:
|C O|
-H
2
O
II
II
IV
0
wiat o
Wkraplanie kwasu mrówkowego
do gor cego, st
. H
2
SO
4
23
Nieorganiczne zwi zki w gla
C
Substrat reakcji organicznych:
CO + 2H
2
CH
3
OH
CO + 3H
2
CH
4
+ H
2
O
CO + H
2
benzyna syntetyczna Fischera-Tropscha
CHR=CH
2
+ CO + H
2
CH
2
RCH
2
CHO aldehyd
CHR=CH
2
+ CO + H
2
O
CH
2
RCH
2
COOH kwas
Sk adnik gazów: generatorowego i wodnego
ci
.
Fe, Zn
Ni
450 K
Co
roz arzony koks
powietrze
CO
2
, CO, N
2
C + O
2
CO
2
CO
2
+ C
2CO
400
o
C – czysty CO
2
(+N
2
)
ro nie zawarto
CO
900
o
C – czysty CO (+N
2
)
roz arzony koks
para wodna
CO, H
2
C + H
2
O
CO + H
2
Generatorowy
Wodny

24
Nieorganiczne zwi zki w gla
C
2. Ditlenek w gla, kwas w glowy, w glany
2.1. Otrzymywanie CO
2
:
C + O
2
CO
2
spalanie w gla
CaCO
3
CaO + CO
2
wypalanie wapienia
CaCO
3
+ 2HCl
CaCl
2
+ H
2
O + CO
2
wapie + silny kwas
2.2. W
ciwo ci fizyczne: gaz bezbarwny, bezwonny, nietruj cy ale dusz cy, do
dobrze jak na gaz rozpuszczalny w wodzie, zestalony < -78
o
C sublimuje
(ch odnictwo), smak kwaskowy (jest bezwodnikiem kwasowym).
2.3. Wykrywanie i oznaczanie CO
2
Ca(OH)
2
+ CO
2
CaCO
3
+ H
2
O
2.4. W
ciwo ci chemiczne CO
2
Ma o aktywny, niepalny, dzia a utleniajaco tylko wobec silnych reduktorów:
CO
2
+ 2Mg
2MgO + C
(reakcja z roz arzonym Mg)
Bezwodnik s abego, dwuprotonowego kwasu w glowego H
2
CO
3
, istniej cego tylko
w roztworze:
H
2
CO
3
+ H
2
O
H
3
O
+
+ HCO
3
-
pK
a1
= 6.37
HCO
3
-
+ H
2
O
H
3
O
+
+ CO
3
2-
pK
a2
= 10.33
„suchy lód”
W czystej wodzie w temp. 298 K
tylko 1 % rozpuszczonego CO
2
jest w formie H
2
CO
3
i produktów
jego dysocjacji.

25
Nieorganiczne zwi zki w gla
C
2.5. W glany i wodorow glany
Rozpuszczalne s tylko w glany litowców i amonu, przy czym ulegaj hydrolizie:
CO
3
2-
+ H
2
O
HCO
3
-
+ OH
-
Wodorow glany rozk adaj si podczas ogrzewania:
2NaHCO
3
Na
2
CO
3
+ H
2
O + CO
2
2.6. Disiarczek w gla i tiow glany
C + S
2
CS
2
dzia anie par siarki na w giel drzewny
CS
2
- toksyczna, mierdz ca ciecz, dobry rozpuszczalnik substancji niepolarnych
K
2
S + CS
2
K
2
CS
3
3. Zwi zki w gla z azotem
3.1. Dicyjan (CN)
2
– gaz o zapachu gorzkich migda ów, silnie truj cy
Cz steczka liniowa:
|N C-C Nl
Otrzymywanie:
Hg(CN)
2
Hg + (CN)
2
KCN + st
. roztwór CuSO
4
Cu
2+
+ 2CN
-
Cu(CN)
2
CuCN + ½ (CN)
2
ogrzewa
nie

26
Nieorganiczne zwi zki w gla
C
3.2. Cyjanowodór HCN (kwas pruski, cyklon B)
Bezbarwna, nisko wrz ca ciecz (26
o
C) o zapachu gorzkich migda ów, bardzo
truj ca (LD
50
= 1,5 mg/kg cia a).
HCN powstaje w wyniku dzia ania mocnego kwasu na cyjanki.
Z wod daje kwas s abszy od w glowego:
HCN + H
2
O
H
3
O
+
+ CN
-
pK
a
= 9,2
Odmiany izomeryczne:
H-C N|
|C N-H
cyjanowodór
izocyjanowodór
99%
1%
w temperaturze pokojowej
3.3. Cyjanki
Cyjanki litowców i berylowców s dobrze rozpuszczalne w wodzie, metali ci
kich –
na ogó trudno rozpuszczalne.
Hydroliza: CN
-
+ H
2
O
HCN + OH
-
(zapach gorzkich migda ów, odczyn staje si zasadowy)

27
Nieorganiczne zwi zki w gla
C
Cyjanki pod wp ywem wilgoci i ditlenku w gla mog
si
rozk ada na powietrzu z
wydzielaniem HCN !:
KCN + CO
2
+ H
2
O
KHCO
3
+ HCN
Ligandy w kompleksach:
Fe(II)
[Fe(CN)
6
]
4-
heksacyjano elazian(II)
ty
elazocyjanek)
Fe(III)
[Fe(CN)
6
]
3-
heksacyjano elazian(III)
jasnoczerwony
elazicyjanek)
Fe
4
III
[Fe
II
(CN)
6
]
3
- b kit pruski
3.4. Jony rodankowe SCN
-
Fe(SCN)
3
krwistoczerwony
28
Krzem
Si
1. Drugie miejsce (po tlenie) co do zawarto ci w zewn trznych warstwach Ziemi
(27% mas.). Wyst puje w licznych minera ach (krzemiany i glinokrzemiany).
2. Jedna odmiana krystalograficzna o strukturze krystalograficznej diamentu
metaloid, w
ciwo ci pó przewodnikowe. Odpowiednik grafitu jest nieznany.
3. Otrzymywanie:
SiO
2
+ 2Mg
2MgO + Si redukcja w wysokiej temperaturze
Otrzymywany tak krzem jest brunatnym proszkiem.
4. W
ciwo ci chemiczne krzemu pierwiastkowego:
•
Ma o aktywny, przyczynia si do tego warstwa SiO
2
atwo reaguje z zasadami:
Si + 2NaOH + H
2
O
Na
2
SiO
3
+ 2H
2
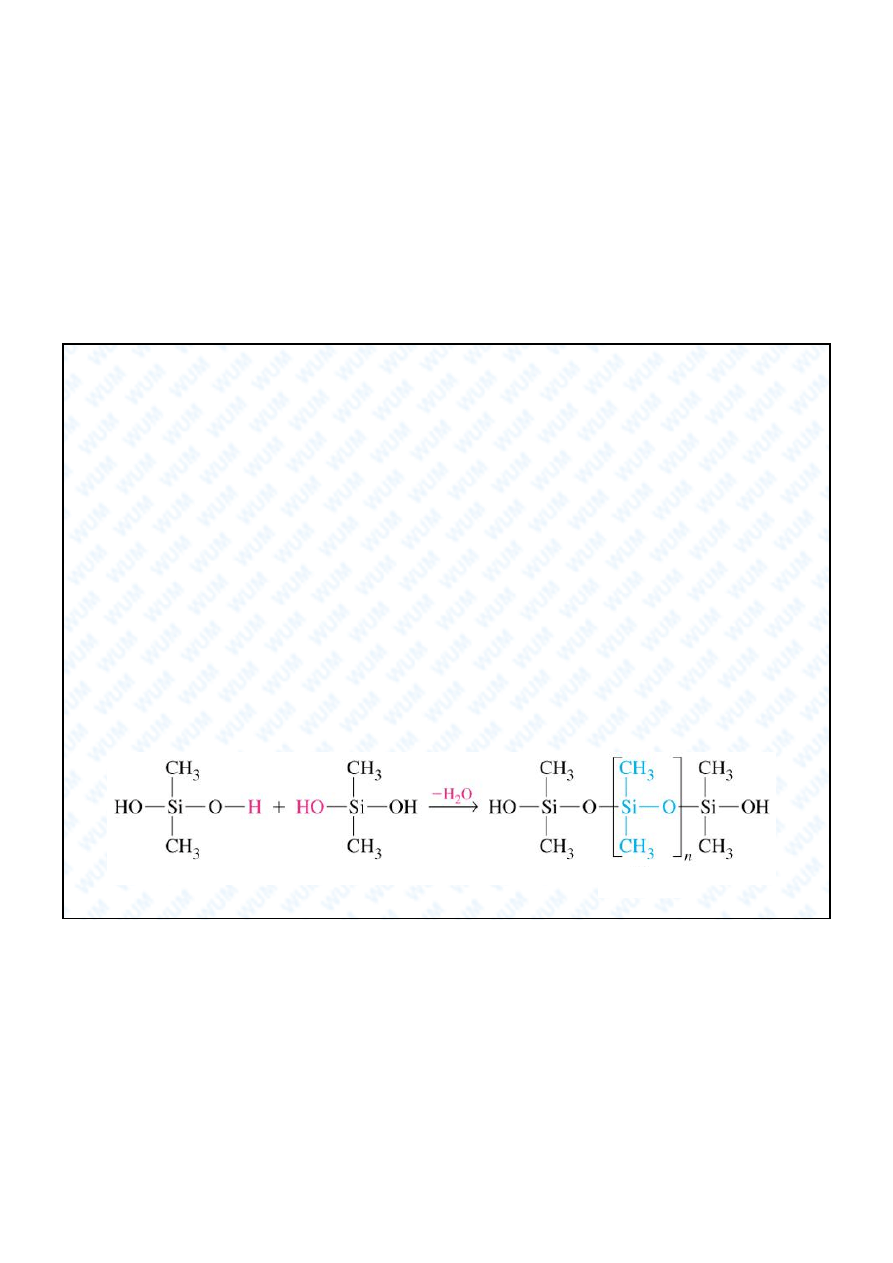
5. Siloksany
silikon
29
Krzem
Si
6. Ditlenek krzemu (krzemionka)
Cia o sta e, bezpostaciowe lub krystaliczne
(polimorfizm: kwarc, trydymit i krystobalit).
Bezwodnik ró nych, bardzo s abych kwasów
krzemowych, np. ortokrzemowego H
4
SiO
4
i
metakrzemowego H
2
SiO
3.
.
Ma a reaktywno
– stapianie z NaOH i Na
2
CO
3
(reakcje ju omówione).
Meta- i ortokrzemiany litowców s rozpuszczalne
w wodzie (szk o wodne), hydrolizuj
do kwasów
krzemowych, zwykle skondensowanych, najlepiej
dla pH = 6-7 (dodatek NH
4
Cl). Wydziela si
galaretowaty el xSiO
2
•yH
2
O, który po osuszeniu
daje tzw. silika el.
Przech odzenie stopionego SiO
2
daje szk o.
30
Krzem
Si
Sk ad chemiczny niektórych szkie (w % masowych
a
)
Rodzaj szk a
SiO
2
Al
2
O
3
MgO CaO BaO Na
2
O K
2
O PbO B
2
O
3
Kwarcowe (krzemionkowe)
99,9
—
—
—
—
—
—
—
—
Sodowo-wapniowe okienne
72,5
1,5
3,5
9,0
—
13,5
—
—
—
Sodowo-wapniowe na opakowania
71,0
1,3
1,2
9,3
1,5
15,7
—
—
—
Sodowo-wapniowe gospodarcze
74,1
0,4
—
7,9
—
17,4
—
—
—
owiowe (kryszta owe)
58,0
0,3
—
—
—
2,7
14,5 24,5
—
Borowo-krzemowe neutralne na opakowania
farmaceutyczne
72,0
6,7
—
1,3
2,1
7,8
—
—
9,3
Borowo-krzemowe optyczne
69,6
—
—
—
2,6
8,5
8,5
—
10,0
a
Bez zanieczyszcze (np. Fe
2
O
3
, barwników, rodków klaruj cych).
7. Krzemiany i glinokrzemiany: naturalne (minera y) i syntetyczne (zeolity).
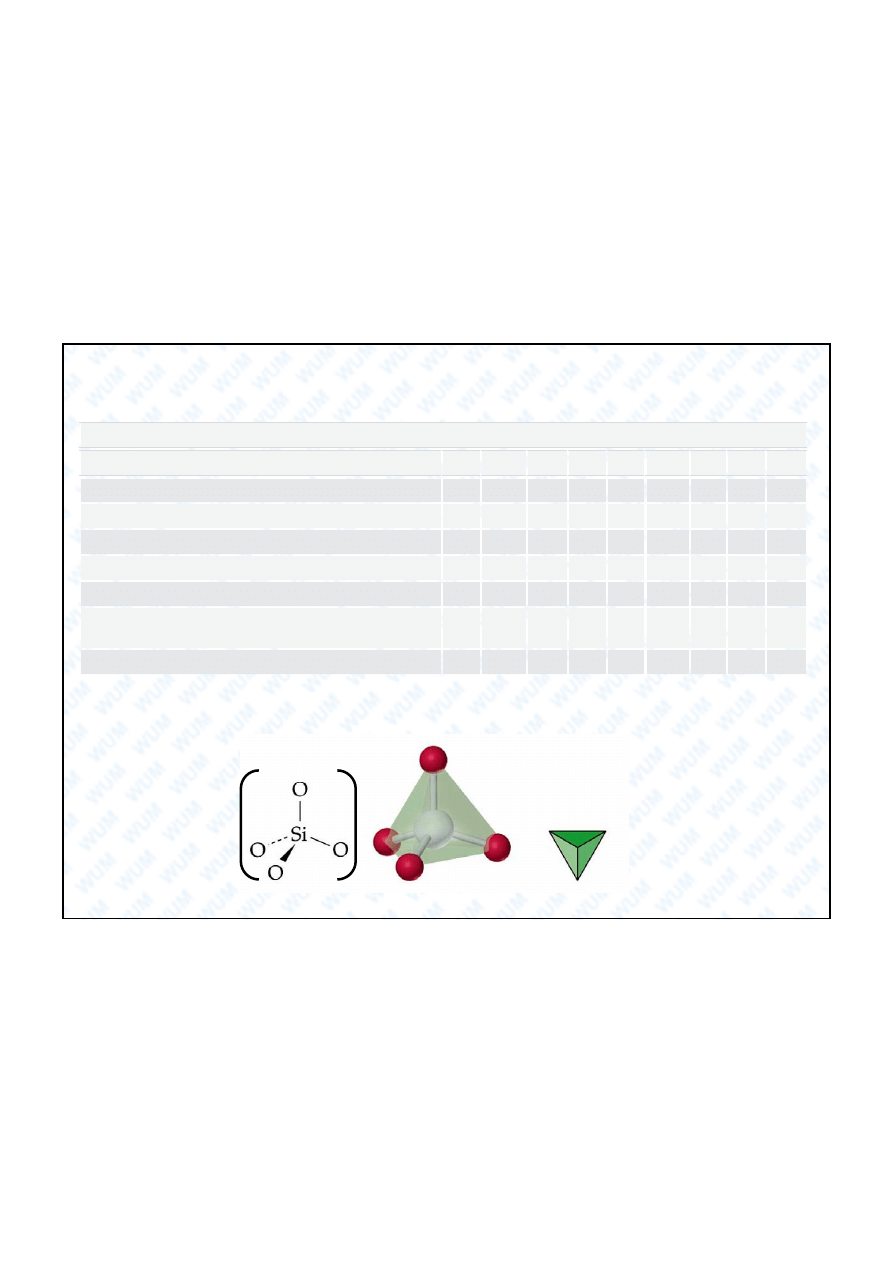
4-
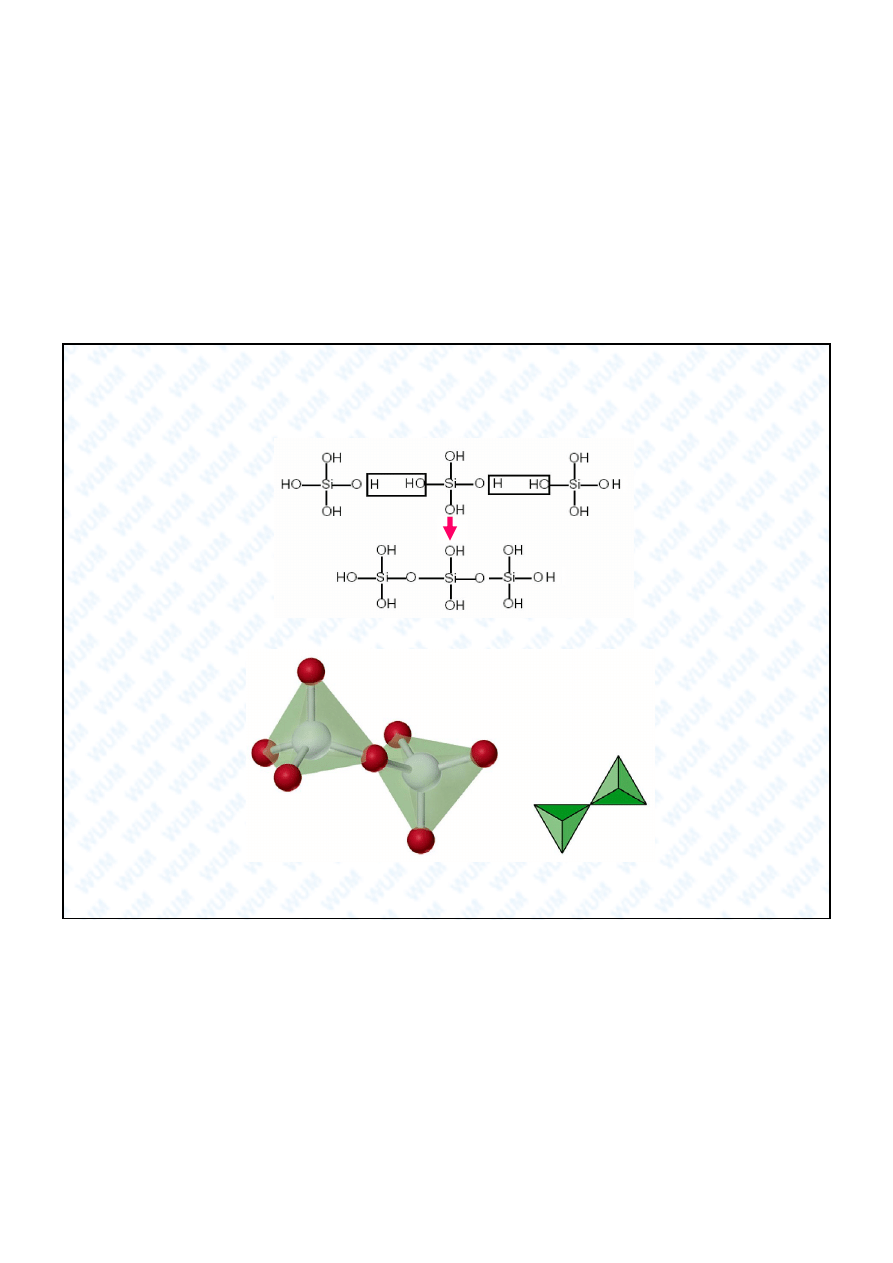
31
Krzem
Si
32
Krzem
Si
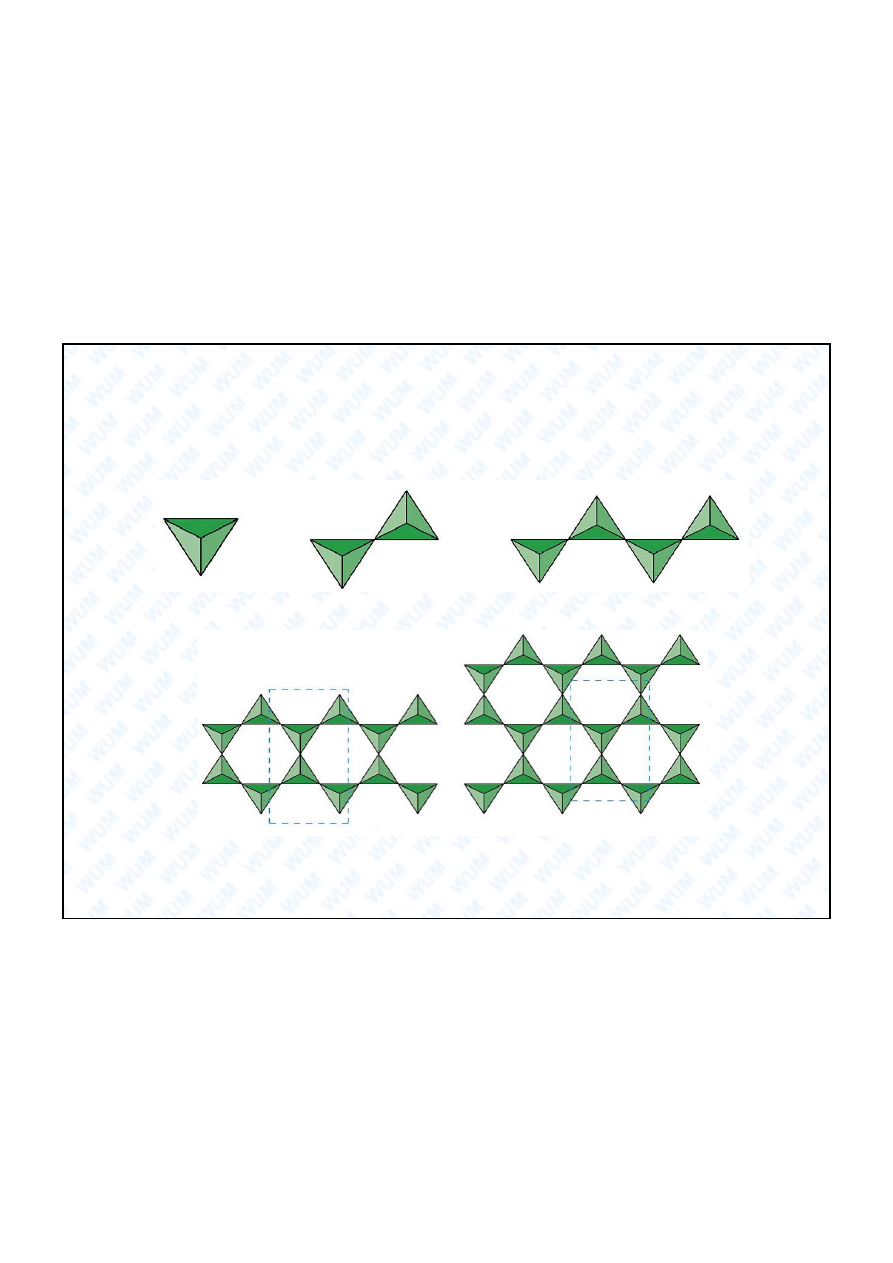
Podstawowe struktury krzemianów
Si
4
O
11
6-
Si
4
O
10
4-
33
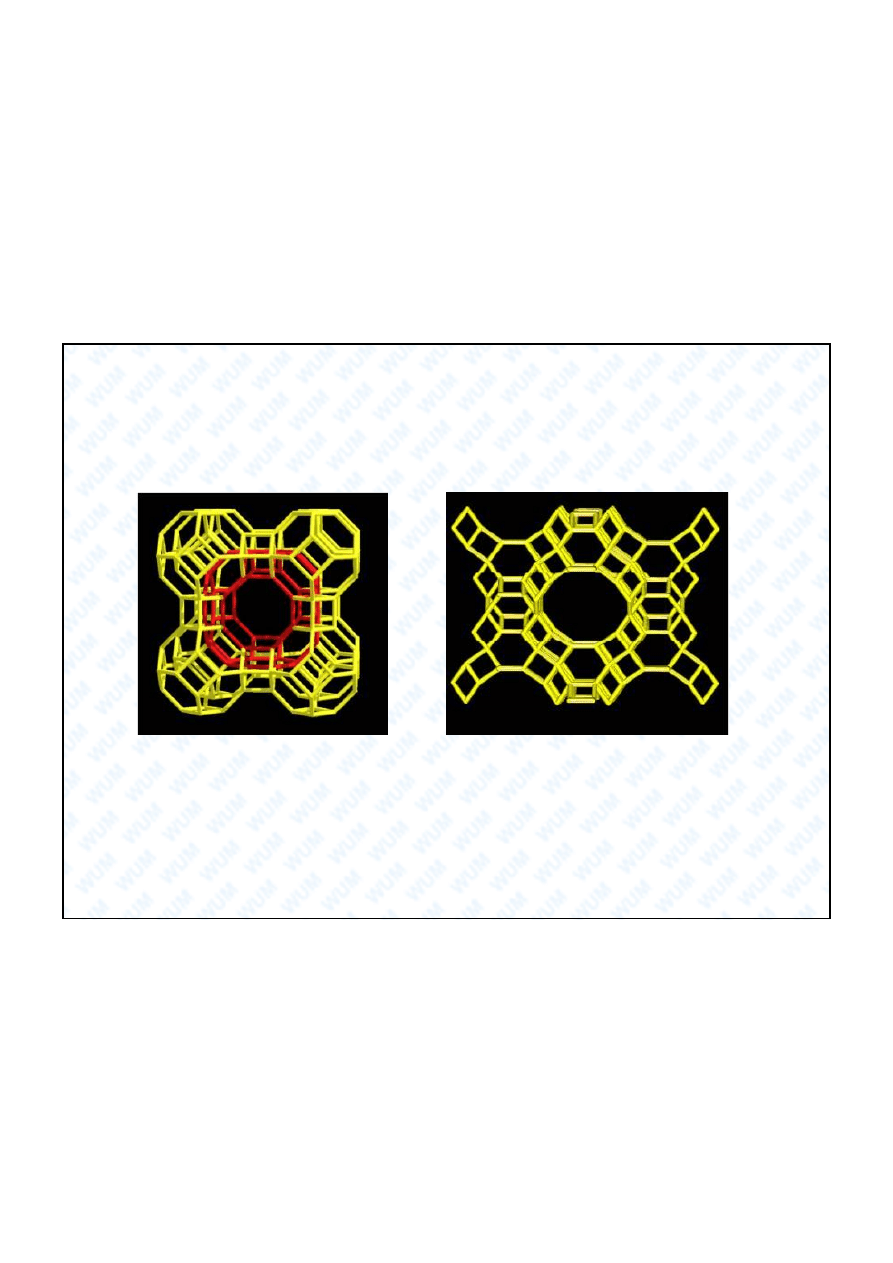
Krzem
Si
Zeolity: sita molekularne i katalizatory
Zeolit A (sito)
Zeolit ZSM-5
Produkcja benzyny z metanolu.
Si—O—Al
H+
Centrum kwasowe Brønsteda
Wyszukiwarka
Podobne podstrony:
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 07 2010
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 14 2010
Chemia ogolna i nieorg 13 2010
Chemia ogolna i nieorg 15 2010
Chemia ogolna i nieorg 14 2010
Egzamin 2010 - 2011 - wymagania, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, egzamin, ch
11 i 12, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Ćw. 12 - rozdział przez strącania - sprawko, Chemia ogólna i nieorganiczna
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
więcej podobnych podstron