
* Praca została wykonana w ramach projektu badawczego Nr 5 PO6G 045 19 finansowanego
przez Komitet Badań Naukowych w latach 2000–2002
Biotechnologia 2(1-2) 2003, 73-81
AKTYWNOŚĆ PROTEOLITYCZNA SZCZEPÓW
DROśDśY POCHODZĄCYCH Z SERÓW ROKPOL*
Agata Czajgucka, Józefa Chrzanowska, Piotr Juszczyk,
Marek Szołtysik, Maria Wojtatowicz
Streszczenie. Przedmiotem badań było 7 szczepów drożdży wyizolowanych z serów z
przerostem pleśniowym Rokpol. Należały one do takich gatunków, jak: Candida famata,
C. sphaerica, C. intermedia, C. kefyr, Geotrichum penicillatum, Yarrowia lipolytica i
Saccharomyces kluyveri. U wszystkich szczepów wykazano duże zróżnicowanie w po-
ziomie aktywności zewnątrz- i wewnątrzkomórkowych endopeptydaz. Enzymy te wyka-
zywały też różną dynamikę degradacji kazeiny. Najbardziej aktywne spośród nich były
proteazy szczepu Y. lipolytica PII6a. Najwyższą aktywność pozakomórkowe proteazy
wszystkich szczepów drożdży wykazywały wobec kazeiny w pH 7.0-7.5, a wewnątrzko-
mórkowe w pH 6.0–7.5. Ich aktywność ulegała hamowaniu pod wpływem PMSF i DFP.
Natomiast optimum aktywności zewnątrzkomórkowych enzymów degradujących hemo-
globinę przypadało w pH 3.5–4.0.
Słowa kluczowe: drożdże, sery, aktywność proteolityczna, właściwości proteaz
WSTĘP
Drożdże są ważnym składnikiem mikroflory wielu typów serów, szczególnie mięk-
kich i pleśniowych [Fleet 1987, Suzzi i in. 2001]. Stanowią one jednak bardzo zmienną
grupę mikroorganizmów, które mogą wywierać tak pozytywny jak i negatywny wpływ
na przebieg procesu dojrzewania serów [Fleet 1992].
W ostatnich latach podejmowane są szeroko zakrojone badania obejmujące charak-
terystykę metabolizmu i fizjologii drożdży izolowanych z serów [Vivier 1994, Jakobsen
i Narvhus 1996, Viljoen 1998]. Ich celem jest wyselekcjonowanie z tego środowiska
szczepów o najbardziej przydatnych z technologicznego punktu widzenia cechach dla
serowarstwa. Prowadzone są już próby wykorzystania niektórych szczepów drożdży
jako ko-starterów w produkcji serowarskiej [Wyder i Puhan 1999a,b]. Pozwoli to na
pełniejszą kontrolę tej mikroflory w serach, a tym samym może zapewnić otrzymywa-
nie produktów o wystandaryzowanych cechach jakościowych. Szczególnie przydatne,
jako szczepionki, okazały się drożdże charakteryzujące się wysoką aktywnością hydro-
lityczną, szczególnie proteolityczną [van Tempel i Jakobsen 1998]. Celem podjętych
badań była ocena uzdolnień proteolitycznych wybranych w oparciu o wcześniej prze-

A. Czajgucka i in.
Acta Sci. Pol.
74
prowadzone testy 7 spośród 113 szczepów drożdży wyizolowanych z serów pleśnio-
wych Rokpol [Czajgucka 2002, Juszczyk 2002].
METODYKA BADAŃ
Przedmiotem badań było 7 szczepów drożdży pochodzących z kolekcji Katedry Bio-
technologii i Mikrobiologii śywności Akademii Rolniczej we Wrocławiu.
Były to szczepy: Candida famata MI1a, Candida sphaerica FII7a, Geotrichum pe-
nicillatum EII6a, Yarrowia lipolytica PII6a, Candida kefyr PII1b, Saccharomyces kluy-
veri BII3a i Candida intermedia BI2a. Szczepy drożdży przechowywano w temp. +4 ºC
na skosach z podłożem YM, zawierającym w 1L: ekstrakt drożdżowy (3,0g), ekstrakt
maltozowy (3,0g), baktopepton (5,0g), glukozę (10,0g) i agar (20,0g).
Hodowle drożdży i przygotowanie zewnątrz- i wewnątrzkomórkowych ekstraktów
enzymów drożdżowych prowadzono według Gduli i in. [2002].
Oznaczanie aktywności proteolitycznej
Aktywność proteolityczną określano wobec hemoglobiny i kazeiny jako substratów
w pH odpowiednio 3.0 i 7.5 [Chrzanowska i Kołaczkowska 1998].
Wyznaczanie optimum pH i temperatury proteaz drożdżowych
Optimum pH proteaz oznaczono w 0,2 M buforze fosforanowo-cytrynianowym
wobec hemoglobiny i kazeiny jako substratów w zakresie pH od 3.0 do 8.0. Natomiast
optimum temperatury oznaczono w zakresie temperatury: od 5 ºC do 60 ºC, co 5 ºC.
Oznaczanie enzymów proteolitycznych drożdży w elektroforezie natywnej w żelu
poliakrylamidowym [Leluk i in. 1985].
Elektroforetyczny rozdział białek prowadzono w 8% żelu poliakrylamidowym w bu-
forze TRIS-glicyna (pH 8.3). Po zakończonej elektroforezie żel poliakrylamidowy z
aktywnymi enzymami drożdży nałożono na żel agarozowy z wbudowaną edestyną i
inkubowano w buforze o pH 7.5 dla proteaz zasadowych i pH 3.0 dla proteaz kwaśnych.
Po transferze enzymów żel agarozowy wybarwiano czernią amidową. W miejscach dzia-
łania enzymu edestyna była trawiona, co powodowało powstawanie przejaśnień w żelu.
Hydroliza enzymatyczna kazeiny
Hydrolizę kazeiny izoelektrycznej (1%) z udziałem proteaz drożdżowych prowa-
dzono w temp. 30 ºC przez 48 h w 50 mM buforze boraks-HCl pH 6.5. Podczas inkuba-
cji enzymu z substratem pobierano próby, w których oznaczano przyrost wolnych grup
aminowych według zmodyfikowanej metody Kuchroo i in. [1983] oraz analizowano
zmiany jakościowe metodą elektroforezy w żelu poliakrylamidowym według Andrews
[1983].
OMÓWIENIE I DYSKUSJA WYNIKÓW
W tabeli 1 przedstawiono aktywność proteolityczną 7 szczepów drożdży pochodzą-
cych z sera Rokpol, które wybrano w oparciu o wyniki badań skriningowych z kolekcji
liczącej 113 szczepów, jako potencjalnych ko-starterów serowarskich [Wojtatowicz i in.
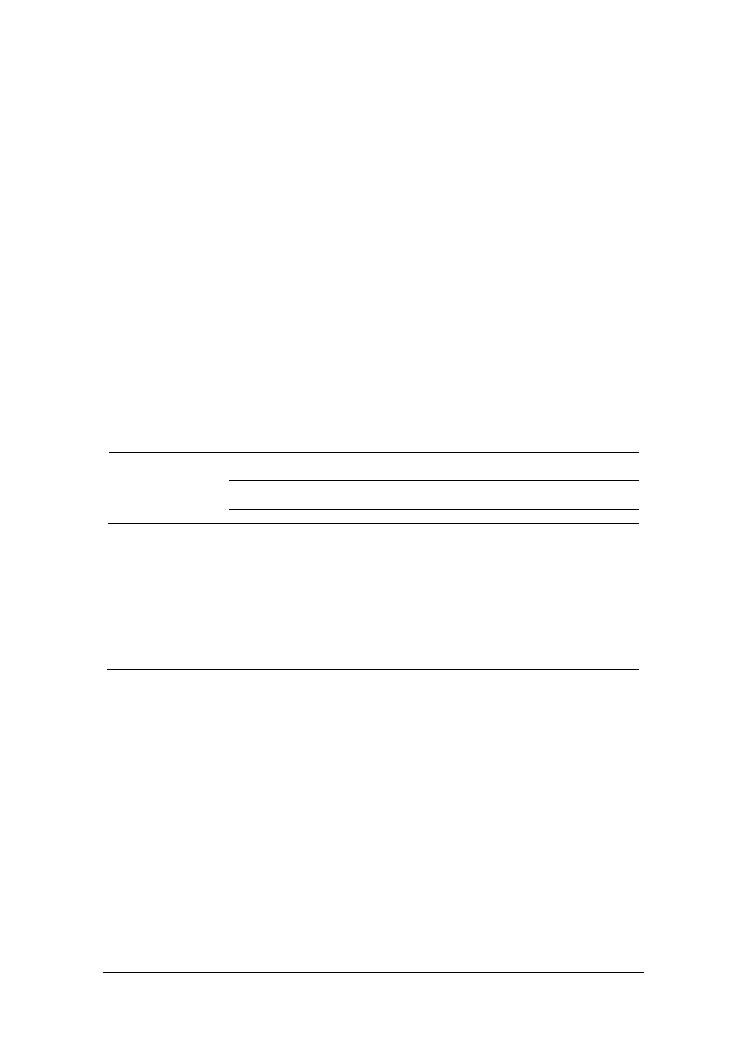
Aktywność proteolityczna ...
Biotechnologia 2(1-2) 2003
75
2000, Czajgucka 2002]. Szczepy te wykazywały istotne różnice w poziomie aktywności
pozakomórkowych proteaz. Zdecydowanie najwyższą aktywność obserwowano u droż-
dży Y. lipolytica PII6a. Ich kwaśne proteazy osiągały wartości aktywności średnio 456.0
U x mg
-1
, natomiast kazeinolityczne enzymy działające w środowisku zasadowym prze-
jawiały aktywność na poziomie 47.2 U x mg
-1
. U pozostałych szczepów drożdży ak-
tywność zewnątrzkomórkowych proteaz kwaśnych i zasadowych zawierała się w prze-
dziale odpowiednio 10.1–151.5 U x mg
-1
i 10.2–47.2 U x mg
-1
. Wyniki te są zgodne z
wcześniejszymi obserwacjami innych autorów, którzy wykazywali duże zróżnicowanie
w poziomie pozakomórkowej aktywności proteolitycznej u szczepów drożdży izolowa-
nych z serów, szczególnie w obrębie gatunku C. sphaerica i C. kefyr [Choisy i in. 1987,
Devoyod 1990, Welthagen i Viljoen 1998, Roostita i Fleet 1996]. Wielu autorów
stwierdzało też szczególnie wysokie, w porównaniu z innymi gatunkami, uzdolnienia
hydrolityczne drożdży Y. lipolytica, które zdolne są do biosyntezy pozakomórkowych
proteinaz, tak zasadowych serynowych, jak i kwaśnych aspartylowych [Ogrydziak
1993, Sinigaglia i in. 1994, Glover i in. 1997, van Tempel i Jakobsen 1998, Suzzi i in.
2001].
Tabela 1. Zewnątrz- i wewnątrzkomórkowa aktywność proteolityczna szczepów drożdży
Table 1. Extracellular and intracellular proteolytic activity of selected yeast strains
Aktywność [U x mg
-1
]
Activity [U x mg
-1
]
Zewnątrzkomórkowa
Extracellular
Wewnątrzkomórkowa
Intracellular
Szczepy drożdży
Yeast strain
pH 7,5
pH 3,0
pH 7,5
C. famata MI1a
17,2
±
1,8
11,6
±
1,8
34,7
±
3,2
C. sphaerica FII7a
17,9
±
2,1
151,5
±
4,2
27,3
±
1,0
G. penicillatum EII6a
11,2
±
0,8
15,8
±
1,3
45,8
±
0,5
C. kefyr PII1b
17,8
±
2,0
11,2
±
1,3
43,0
±
3,1
Y. lipolytica PII6a
47,2
±
3,6
456,5
±
15,2
93,3
±
5,2
C. intermedia BI2a
10,2
±
1,4
10,8
±
2,6
99,8
±
6,2
S. kluyveri BII3a
11,1
±
1,2
10,1
±
0,7
46,0
±
3,8
Aktywność wewnątrzkomórkowych proteaz degradujących kazeinę była mniej
zróżnicowana u badanych drożdży, najwyższe jej wartości stwierdzono u szczepów:
C. intermedia (99.8 U x mg
-1
) i Y. lipolytica (93.3 U x mg
-1
), a najmniejsze w granicach
27.3-34.7 U x mg
-1
u C. sphaerica i C. famata.
W celu uwidocznienia aktywnych frakcji ekstrakty enzymów proteolitycznych ba-
danych szczepów drożdży poddano rozdziałowi elektroforetycznemu w żelu poliakry-
lamidowym w warunkach natywnych, a następnie dokonano ich transferu na żel agaro-
zowy z wbudowaną edestyną. W oparciu o uzyskane zymogramy (rys. 1) można stwier-
dzić u wszystkich 7 szczepów drożdżowych pojedyncze pasma proteaz, tak poza- jak i
wewnątrzkomórkowych, zdolnych do degradacji białka roślinnego w środowisku kwa-
śnym i zasadowym. Jakkolwiek, w zależności od szczepu, proteazy te przejawiały róż-
nice w poziomie aktywności, co przejawiało się wielkością stref przejaśnień w żelu
agarozowym po strawieniu edestyny. Spośród pozakomórkowych enzymów proteoli-
tycznych największą degradację edestyny prowadziły proteazy kwaśne Y. lipolytica
A. Czajgucka i in.
Acta Sci. Pol.
76
PII6a oraz C. sphaerica FII7a, a także proteazy działające w środowisku zasadowym
pierwszego z tych szczepów. Enzymy wewnątrzkomórkowe wszystkich badanych
szczepów drożdży pozostawiały w żelu większe obszary zdegradowanego białka niż
pozakomórkowe proteazy, ale najbardziej aktywne spośród nich były protezy Y. lipoly-
tica PII6a i C. intermedia BI2a.
A./
B./
1 2 3 4 5 6 7
1 2 3 4 5 6 7
C./
1 2 3 4 5 6 7
Rys. 1. Zymogramy proteaz zewnątrzkomórkowych aktywnych w środowisku zasadowym A/ i
kwaśnym B/ oraz wewnątrzkomórkowych (zasadowych) C/ szczepów drożdży: 1/ C. fa-
mata MI1a, 2/ Y. lipolytica PII6a, 3/ C. sphaerica FII7a, 4/ C. kefyr PII1b, 5/ C. interme-
dia BI2a, 6/ G. penicillatum EII6a, 7/ S. kluyveri BII3a
Fig. 1. Zymograms of extracellular proteases active at acidic A/ and alkaline pH B/ and intra-
cellular proteases (active at alkaline pH) C/ of yeast strains: 1/ C. famata MI1a, 2/ Y. li-
polytica PII6a, 3/ C. sphaerica FII7a, 4/ C. kefyr PII1b, 5/ C. intermedia BI2a, 6/ G.
penicillatum EII6a, 7/ S. kluyveri BII3a
Wewnątrzkomórkowe proteazy wszystkich szczepów drożdży hamowane były cał-
kowicie przez PMSF (tab. 2). Podobne działanie wywierał DFP, który obniżał ich ak-
tywność do 5–25%. Natomiast EDTA jak i amid kwasu jodooctowego nie miał istotne-
go wpływu na aktywność tych enzymów. Pozakomórkowe kazeinolityczne endopepty-
dazy drożdży, podobnie jak enzymy wewnątrzkomórkowe, okazały się najbardziej
wrażliwe na działanie PMSF i DFP, ulegały też znacznemu hamowaniu przez EDTA.
Natomiast aktywność proteaz degradujących hemoglobinę w kwaśnym pH, syntetyzo-
Aktywność proteolityczna ...
Biotechnologia 2(1-2) 2003
77
wanych przez Y. lipolytica PII6a i C. sphaerica FII7a, ulegała całkowitemu hamowaniu
w obecności pepstatyny (wyniki niepodawane).
Tabela 2. Wpływ inhibitorów na aktywność wewnątrzkomórkowych proteaz drożdżowych
Table 2. Effect of the inhibitors on the intracellular proteases of yeast
Szczepy drożdży [% aktywności]
Yeast strains [% activity]
Inhibitor
Inhibitor
C. famata
MI1a
C. inter-
media
BI2a
C. kefyr
PII1b
S. kluyveri
BII3a
Y. lipo-
lytica
PII6a
C.
sphaerica
FII7a
G. penicil-
latum
EII6a
Kontrola
Control
100
100
100
100
100
100
100
Jodoacetic amid
100
100
100
100
100
100
100
PMSF
5
15
0
5
5
0
0
DFP
5
15
15
5
5
15
15
BPTI
95
80
80
100
100
100
100
EDTA
90
95
95
100
100
100
100
PMSF – fluorek fenylometylosulfonowy, DFP – diizopropylofluorofosforan, BPTI – zasadowy trzustkowy
inhibitor trypsyny, EDTA – kw. etylenodiaminotetraoctowy.
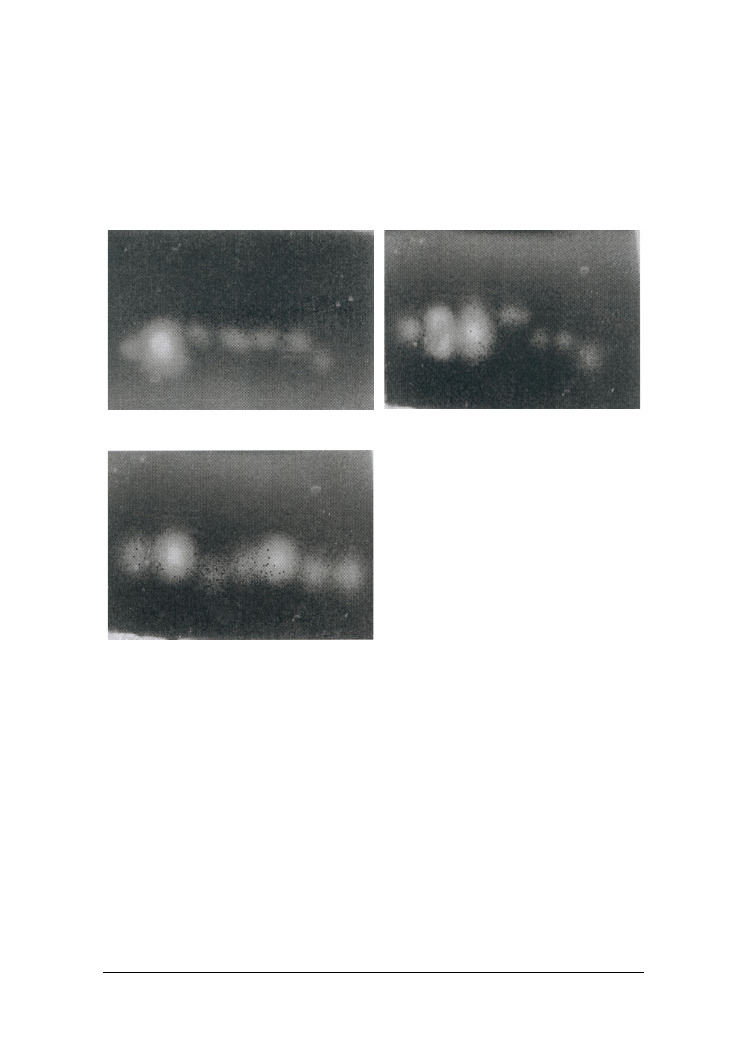
Optymalne dla działania tak zewnątrzkomórkowych jak i wewnątrzkomórkowych
kazeinolitycznych proteaz większości analizowanych szczepów drożdży było pH w
zakresie 6.5–7.5 (rys. 2). Natomiast kwaśne pozakomórkowe proteinazy z drożdży
C. sphaerica FII7a i Y. lipolytica PII6a najwyższą aktywność wobec hemoglobiny prze-
jawiały w pH 3.5, a enzymy pozostałych szczepów w pH 4.0. Optymalne dla działania
wszystkich endopeptydaz drożdżowych były temperatury w przedziale 35–45 °C (wy-
niki niepodawane).
0
10
20
30
40
50
60
70
80
90
100
4
5
6
7
8
9
pH
A
k
ty
w
n
o
ś
ć
A
c
ti
v
it
y
[%
]
C.famata MI1a
C.intermedia BI2a
C.kefyr PII1b
C.sphaerica FII7a
Y.lipolytica PII6a
G.penicillatum BI6a
S.kluyveri BII3a
Rys. 2. Optimum pH wewnątrzkomórkowych proteaz drożdżowych
Fig. 2. Optimum pH of intracellular proteases of yeasts
A. Czajgucka i in.
Acta Sci. Pol.
78
Gripon i in. [1991], badając enzymy, tak zewnątrz-, jak i wewnątrzkomórkowe
drożdży z rodzaju Kluyveromyces, Debaryomyces, Saccharomyces oraz Geotrichum,
pochodzących również z sera, stwierdził, że wykazywały one optimum aktywności
kazeinolitycznej w pH 6.0. Według Ogrydziaka [1993] natomiast pozakomórkowe za-
sadowe proteazy drożdży Y. lipolytica optymalnie działały w pH 9.0–10.0 w tempera-
turze 40 °C. Natomiast wewnątrzkomórkowe endopeptydazy syntetyzowane przez
drożdże z gatunku C. kefyr / K. marxianus, C. famata / D. hansenii oraz C. sphaerica /
K. lactis najwyższe aktywności wobec kazeiny osiągały w zakresie pH od 5.0 do 7.0
[Choisy i in. 1987, Lenoir 1984].
A./
K 0’ 30’ 60’ 90’ 120’ 180’ 24h 48h
B./
K 0’ 30’ 60’ 90’ 120’ 180’ 24h 48h
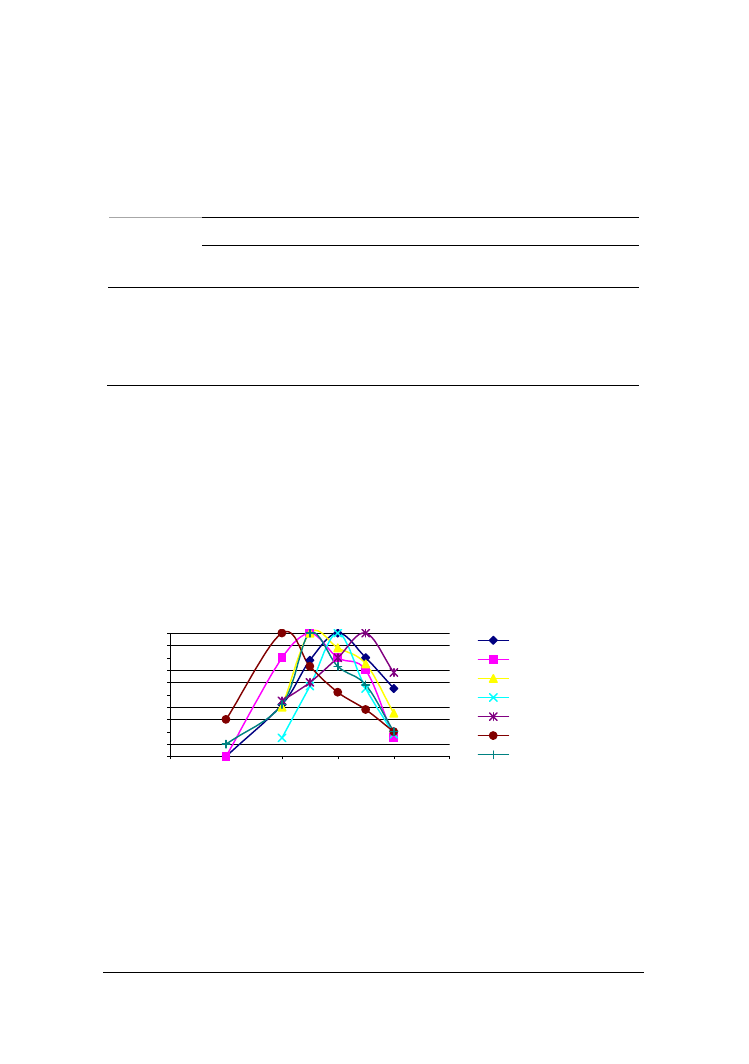
Rys. 3. Rozdział elektroforetyczny kazeiny hydrolizowanej przez wewnątrzkomórkowe proteazy
drożdży A./ C. intermedia, B./ Y. lipolytica
Fig. 3. Poliacrylamide gel electrophoresis of casein degraded by intracellular proteases of yeast
strains A/C. intermediaBI2a, B./ Y. lipolytica PII

Aktywność proteolityczna ...
Biotechnologia 2(1-2) 2003
79
Wewnątrzkomórkowe proteazy wszystkich badanych szczepów intensywniej hy-
drolizowały kazeinę niż enzymy pozakomórkowe, powodując w tym samym czasie
kilku- lub nawet kilkunastokrotnie wyższe przyrosty wolnych grup aminowych (wyniki
niepodawane). Najbardziej aktywne były endopeptydazy z drożdży Y. lipolytica Pll6a i
C. intermedia BI2a, co widoczne jest również w obrazach elektroforetycznych (rys. 3).
Bardziej podatna na działanie tych enzymów okazała się frakcja β niż α
S1
-kazeiny. Po
180 min hydrolizy prowadzonej z udziałem enzymów Y. lipolytica Pll6a następował
prawie całkowity zanik pierwszej z tych frakcji. Obserwacje te są zbieżne z wynikami
badań Guerzoni i in. [1993], które potwierdziły głębszą degradację β- niż α
S1
-kazeiny
pod wpływem zewnątrzkomórkowych proteaz pochodzenia drożdżowego. Wyniki te
wskazują na różnice między proteazami drożdżowymi a enzymami syntetyzowanymi
przez inne mikroorganizmy (np. grzyby pleśniowe), wykorzystywane w produkcji se-
rowarskiej, a których aktywność proteolityczna skierowana jest głównie wobec frakcji
α
S1
-kazeiny [Chrzanowska i in. 1993].
WNIOSKI
1. Szczepy drożdży, pochodzące z serów pleśniowych Rokpol, wykazują szcze-
gólnie duże zróżnicowanie w poziomie aktywności pozakomórkowych enzymów pro-
teolitycznych.
2. Najwyższą aktywność przejawiały proteazy tak zewnątrz- jak i wewnątrzko-
mórkowe drożdży Y. lipolytica PII6a.
3. Kazeinolityczne proteazy drożdżowe, tak poza- jak i wewnątrzkomórkowe, naj-
bardziej wrażliwe były na inhibitory proteinaz serynowych: PMSF i DFP, natomiast
kwaśne pozakomórkowe enzymy ulegały inaktywacji pod wływem pepstatyny.
4. Najkorzystniejsze warunki dla działania kazeinolitycznych proteaz drożdżo-
wych to pH w zakresie 6.5–7.5, a dla kwaśnych pozakomórkowych – w pH 3.5–4.0 oraz
temp. 35–45 °C.
PIŚMIENNICTWO
Andrews A.T., 1983. Proteases in normal bovine milk and their action on caseins. J. Dairy Res.
50, 45–55.
Choisy C., Gueguen M., Lenoir J., Schmidt J. L., 1987. The ripening of cheese microbiological
aspects, “Cheese making: Science and Technology” ed. A. Eck, Lavoisier, New York.
Chrzanowska, J. and Kołaczkowska, M., 1998. Production of extracellular proteolytic enzymes by
Beauveria bassiana, Acta Mycologica, 33, 277–285.
Chrzanowska, J., Kołaczkowska, M. and Polanowski, A., 1993. Production of exocellular prote-
olytic enzymes by various species of Penicillium, Enzyme Microb. Technol., 15, 140–143.
Czajgucka A., 2002. Charakterystyka uzdolnień hydrolitycznych szczepów drożdży wydzielo-
nych z serów pleśniowych. Praca doktorska, Akademia Rolnicza we Wrocławiu.
Devoyod, J.J., 1990. Yeasts in cheese-making, In: Yeast technology, J.F.T.Spencer &
D.M.Spencer (Eds.), Springer-Verlag.
Fleet, G.H., Mian M.A., 1987. The occurence and growth of yeasts in dairy products, Int. J. Food
Microbiol. 4, 145–155.
Fleet G.H., 1992. Spoilage Yeast’s, Crit. Rev. in Biotechnol., 12, 1–44.

A. Czajgucka i in.
Acta Sci. Pol.
80
Gdula A., Chrzanowska J., Szołtysik M., Kieżel X., Wojtatowicz M., 2002. Factors affecting
hydrolytic enzymes production by Yarrowia lipolytica strains. Acta Sci. Pol. Biotechnologia.
1–2, 81–88.
Glover D.J., McEwen R.K., Thomas C.R., Young T.W., 1997. pH-regulated expression of the
acid and alkaline extracellular proteases of Yarrowia lipolytica. Microbiology, 143, 3045–
3054.
Gripon J.C., Monnet V., Lambert G., Desmazeaud M.J., 1991. Microbial enzymes in cheese
ripening. Food enzymology in cheese ripening. Vol.1. Ed. Fox P.F.Elsevier Science Publi-
shers.LTD.
Guerzoni M.E., Lanciotti R., Marchetti, R., 1993. Survey of the physiological properties of the
most frequent yeasts associated with commercial chilled foods, Int. J. Food Microbiol. 17,
329–341.
Jakobsen, M., Narvhus, J., 1996. Yeasts and their possible beneficial and negative effects on the
quality of dairy products. Int. Dairy J., 6, 755–768.
Juszczyk P., 2002. Charakterystyka mikroflory drożdżowej serów z przerostem pleśni. Praca
doktorska, Akademia Rolnicza we Wrocławiu.
Kuchroo C.N., Rahilly J., Fox, P.F., 1983. Assessment of proteolysis in cheese by reaction with
trinitrobenzene sulphonic acid. Irish J. Food Sci Technol. 7, 129–133.
Leluk J., Pham T.C., Kielczewa J., 1985. Zastosowanie edestyny do oznaczania aktywności pro-
teolitycznej i inhibitorów proteaz. XXI Zjazd PTBioch., Kraków. Streszczenia 139–140.
Lenoir J., 1984. The surface flora and its role in the ripening of cheese. Int. Dairy Federation
Bulletin. Brussels, Belgium, 171, 3–20.
Ogrydziak, D.M., 1993. Yeast extracellular protease. Crit. Rev. Biotechnol. 13, 1–55.
Roostita R., Fleet G.H., 1996. The occurence and growth of yeasts in Camembert and Blue-
veined cheese. Int. J. Food Microbiol. 28, 393-404.
Sinigaglia M., Lanciotti R., Guerzoni, M.E., 1994. Biochemical and physiological characteristics
of Yarrowia lipolytica strains in relation to isolation source. Can. J. Microbiol. 40, 54–59.
Suzzi G., Lanorte M.T., Galgano F., Andrighetto C., Lombardi A., Lanciotti, R., Guerzoni, M.E.,
2001. Proteolytic, lipolytic and molecular characterization of Yarrowia lipolytica isolated
from cheese. Int. J. Food Microbiol. 69, 69–77.
Van den Tempel T., Jakobsen, M., 1998. Yeast associated with Danablu. Int. Dairy J. 8, 25–31.
Viljoen, B.C., 1998. The ecological diversity of yeasts in dairy products, In: FIL-IDF "Yeast in
the dairy industry: positive and negative aspects", Jakobsen M., Narvhus J., Viljoen B.C.,
(Eds.). Copenagen, Denmark, 1996, 70–77.
Vivier D., Rivemale M., Reverbel J.P., Ratomahenina R., Galzy, P., 1994. Study of the growth of
yeasts from feta cheese. Int. J. Food Microbiol. 22, 207–215.
Welthagen J.J., Viljoen B.C., 1998. Yeast profile in Gouda cheese during processing and ripen-
ing. Int. J. Food Microbiol. 41, 185–194.
Wojtatowicz M., Chrzanowska J., Juszczyk P., Skiba A., Gdula A., 2000. Identification and bio-
chemical characteristics of yeast microflora of Rokpol cheese. Int. J. Food Microbiol. 69,135–
140.
Wyder M.T., Puhan, Z., 1999a. Role of selected yeasts in cheese ripening: an evaluation in asep-
tic cheese curd slurries, Int. Dairy J. 9, 117–124.
Wyder M.T., Bachmann H.P., Puhan Z., 1999b. Role of selected yeasts in cheese ripening: an
evaluation in foil wrapped Raclette cheese. Lebensm.-Wiss. Technol. 32, 333–343.

Aktywność proteolityczna ...
Biotechnologia 2(1-2) 2003
81
PROTEOLYTIC ACTIVITY OF YEAST STRAINS ORIGINATING
FROM ROKPOL CHEESE
Abstract. The proteolytic activity of 7 yeast strains belonging to species Candida famata,
C. sphaerica, C. intermedia, C. kefyr, Geotrichum penicillatum, Yarrowia lipolytica i
Saccharomyces kluyveri were determined. It was shown big variations in the level of ac-
tivity especially of extracellular proteases of yeasts. The most active were extra- and in-
tracellular proteases of strain Y. lipolytica PII6a. Caseinolytic proteases of all strains were
inhibited by PMSF and DFP. Majority of them exhibited optimum at pH 6.5-7.5. Ex-
tracellular proteases of yeasts active against hemoglobin had optimum at pH 3.5-4.0.
Key words: yeast, cheese, proteolytic activity, protease properties
Agata Czajgucka, Józefa Chrzanowska, Marek Szołtysik, Katedra Technologii Surowców Zwie-
rzęcych; Piotr Juszczyk, Maria Wojtatowicz, Katedra Biotechnologii i Mikrobiologii śywności,
Akademia Rolnicza we Wrocławiu, ul. C.K. Norwida 25, 50-375 Wrocław
Wyszukiwarka
Podobne podstrony:
Aktywnosc hydrolityczna drozdzy z sera
Wzrost i aktywnosc enzymatyczna drozdzy w mleku
AKTYWNOŚĆ DROŻDŻY SACCHAROMYCES CEREVISIAE LIOFILIZOWANYCH Z DODATKIEM WYBRANYCH SUBSTANCJI OCHRONNY
prezentacja aktywne metody nauczania
6 PKB 2 Pomiar aktywności gospodarczej rozwin wersja
w9 aktywna polityka spoleczna
Aktywność fizyczna nastolatków
PKB 2 Pomiar aktywności gospodarczej rozwin wersja
Aktywność i bierność polityczna
Cechy drożdży winiarskich
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
Korzyści z podejmowania rekreacyjnej aktywności ruchowej przez osóby niepełnosprawne
Aktywne metody zwalczania hałasu serwisy internetowe
Makowce i ciasta z makiem, Strucla drożdżowa
Aktywny,2 przewodowy czujnik temperatury
filtry aktywne(1)
aktywność fizyczna
więcej podobnych podstron