‹#›
RJC
Wiązania Chemiczne &
Wiązania Chemiczne &
Struktura Cząsteczki
Struktura Cząsteczki
Wiązania Chemiczne &
Wiązania Chemiczne &
Struktura Cząsteczki
Struktura Cząsteczki
Teoria Orbitali & Hybrydyzacja
Teoria Orbitali & Hybrydyzacja
Teoria Orbitali & Hybrydyzacja
Teoria Orbitali & Hybrydyzacja
Slides 1 to 39
‹#›
RJC
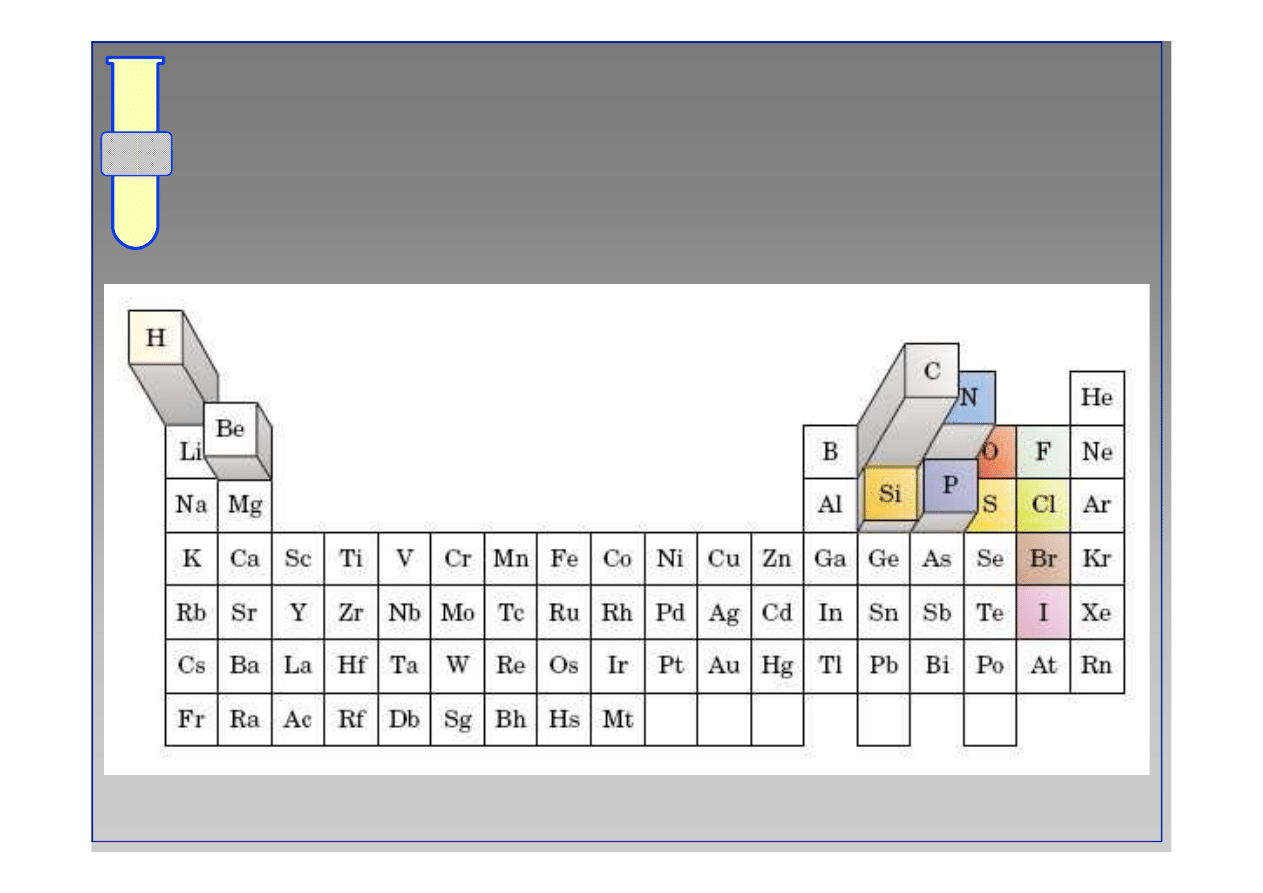
Układ okresowy pierwiastków
Układ okresowy pierwiastków
‹#›
RJC
Siły występujące w cząsteczce związku
Siły występujące w cząsteczce związku
organicznego
organicznego
Atomy w cząsteczce związku organicznego są
Atomy w cząsteczce związku organicznego są
połączone wiązaniami kowalencyjnymi
połączone wiązaniami kowalencyjnymi
‹#›
RJC
Czym jest wiązanie kowalencyjne ?
Czym jest wiązanie kowalencyjne ?
Dwa atomy dzielą wspólne pary elektronowe.
Dwa atomy dzielą wspólne pary elektronowe.
••
••
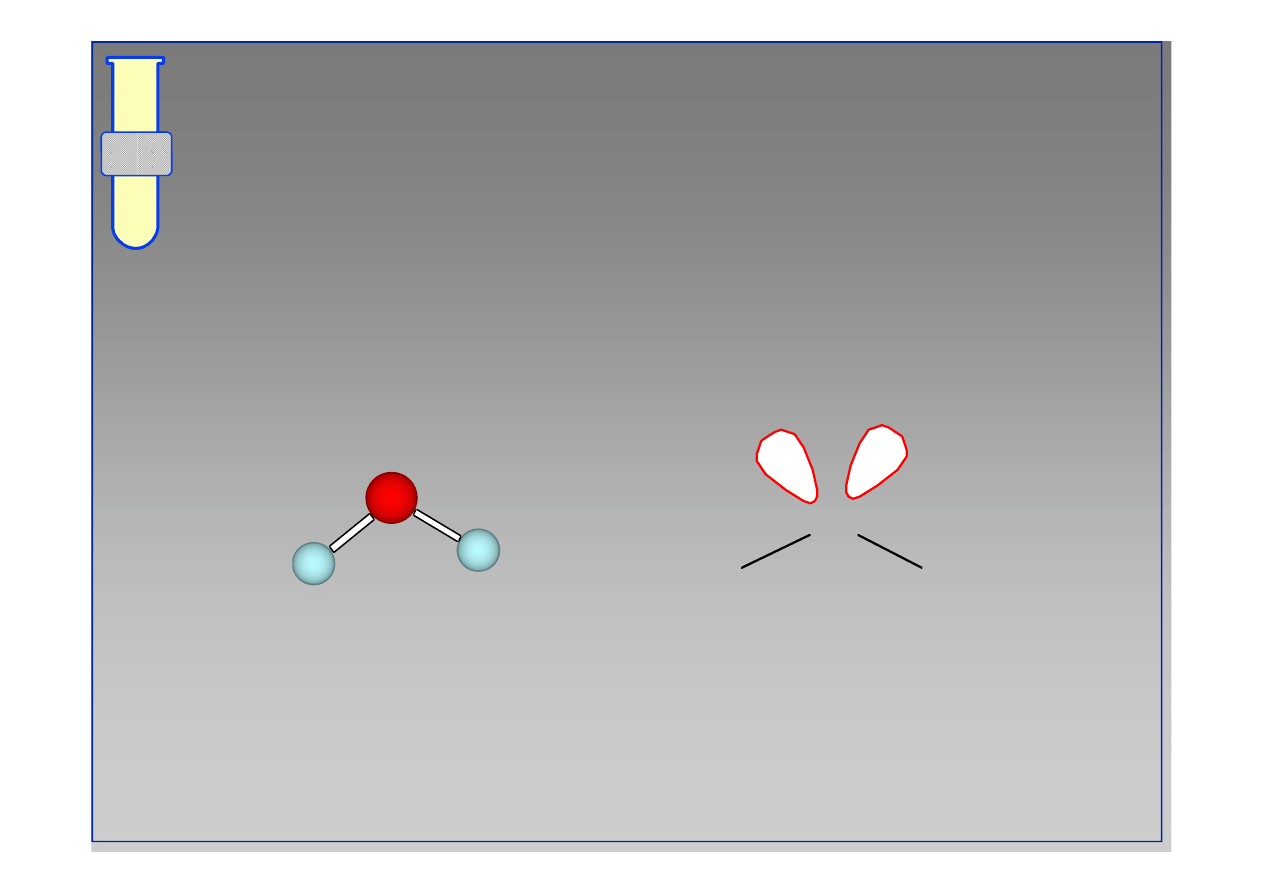
Woda H
Woda H
2
2
O
O
H
O
H
•
•
•
•
•
•
••
‹#›
RJC
Jak powstaje wiązanie kowalencyjne ?
Jak powstaje wiązanie kowalencyjne ?
... trzeba zrozumieć elektronową strukturę atomu
... trzeba zrozumieć elektronową strukturę atomu
tlen
wodór
1s
2s
2p
1s
2s
2p

‹#›
RJC
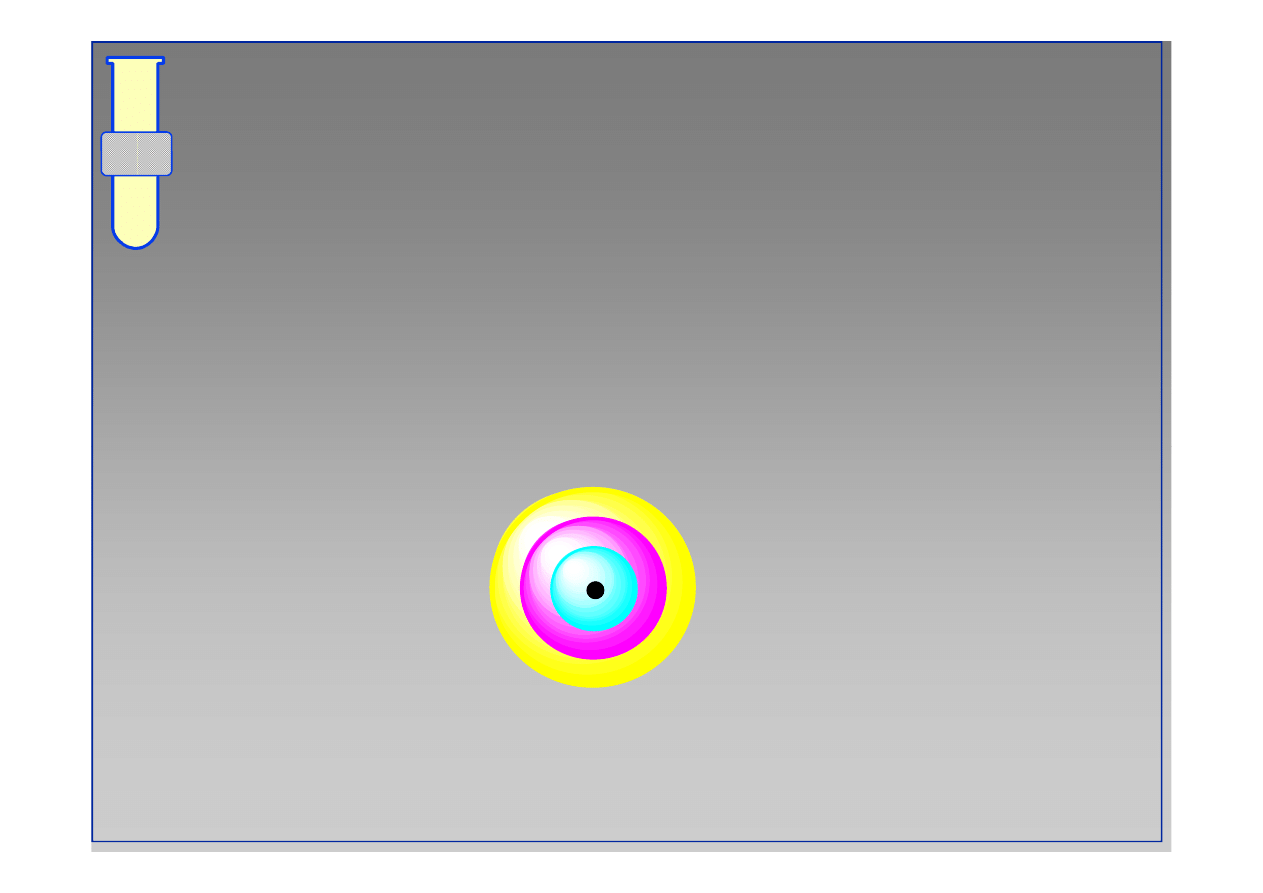
Teoria orbitali atomowych
Teoria orbitali atomowych
Przestrzeń wokół jądra atomu, gdzie występuje
Przestrzeń wokół jądra atomu, gdzie występuje
największe prawdopodobieństwo napotkania
największe prawdopodobieństwo napotkania
elektronu nazywana jest orbitalem
elektronu nazywana jest orbitalem
orbital
jądro
‹#›
RJC
Jak przedstawiany jest orbital ?
Jak przedstawiany jest orbital ?
Im dalej od jądra ulokowane są elektrony, tym
Im dalej od jądra ulokowane są elektrony, tym
wyższa jest energia orbitalu
wyższa jest energia orbitalu
1
1 2
2 3
3

‹#›
RJC
Jak przedstawiany jest orbital ?
Jak przedstawiany jest orbital ?
Kształt orbitalu zmienia się wraz z jego energią
Kształt orbitalu zmienia się wraz z jego energią
orbital typu s
orbital typu p

‹#›
RJC
Orbital 1s
Orbital 1s
Elektrony o najniższej energii obsadzają kulisty
Elektrony o najniższej energii obsadzają kulisty
orbital 1s
orbital 1s
orbital 1s

‹#›
RJC
Orbital 2s
Orbital 2s
Kulisty orbital 2s posiada wyższą energię niż 1s
Kulisty orbital 2s posiada wyższą energię niż 1s
orbital 2s

‹#›
RJC
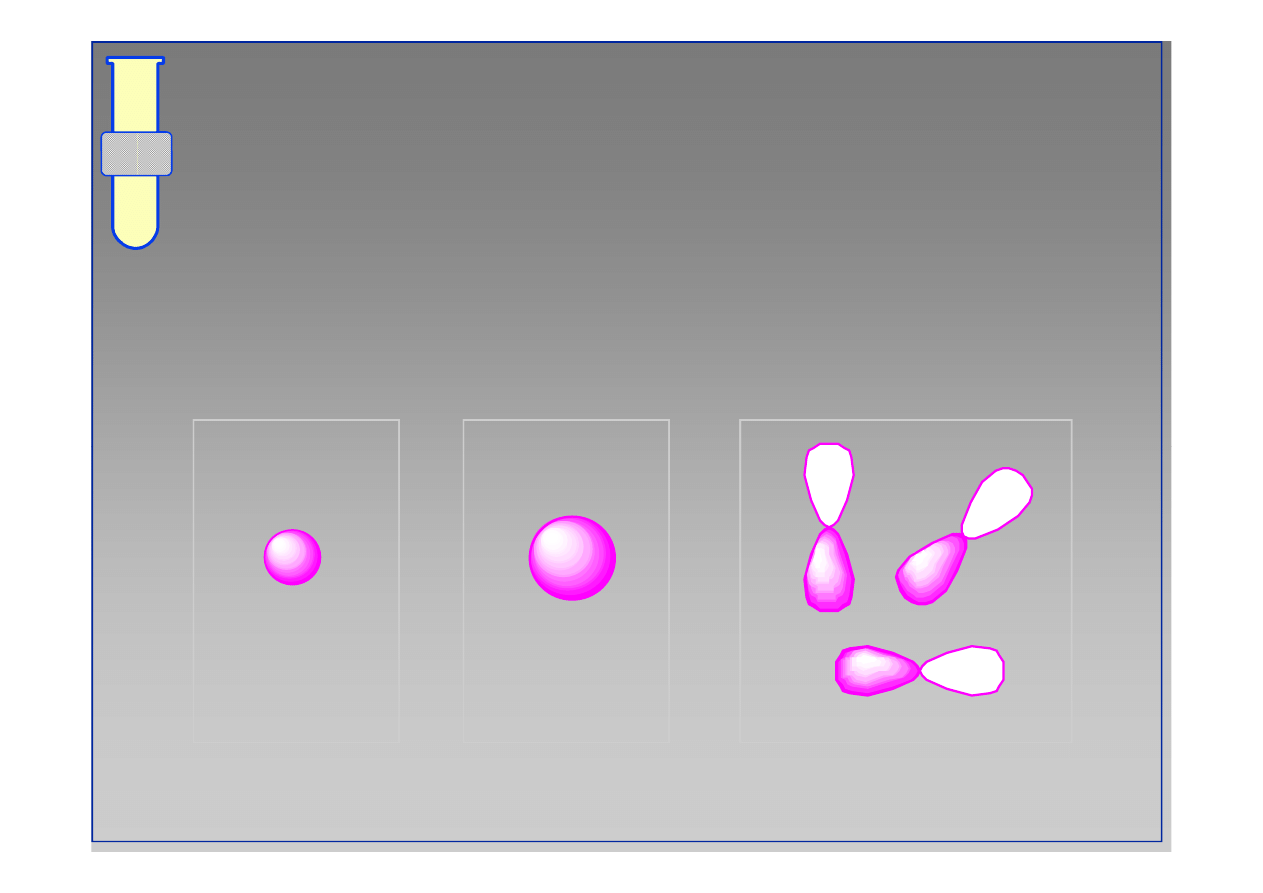
Orbitale 2p
Orbitale 2p
Orbitale 2s mają kształt ósemek (hantli) i
Orbitale 2s mają kształt ósemek (hantli) i
rozmieszczone są wzdłuż trzech współrzędnych
rozmieszczone są wzdłuż trzech współrzędnych
orbital 2p
x
orbital 2p
y
orbital 2p
z

‹#›
RJC
Orbitale 3s, 3p, 4s i 4p...
Orbitale 3s, 3p, 4s i 4p...
2s
3s
4s
2p
y
3p
y
4p
y
2s
3s
4s
‹#›
RJC
Orbitale: Chemia Organiczna
Orbitale: Chemia Organiczna
Chemia węgla dotyczy powstawania wiązań z
Chemia węgla dotyczy powstawania wiązań z
udziałem orbitali 2s oraz 2p
udziałem orbitali 2s oraz 2p
2s
2p
x
+ 2p
y
+ 2p
z
1s
‹#›
RJC
Konfiguracje elektronów
Konfiguracje elektronów
Opisują obsadę orbitali przez elektrony w atomie
Opisują obsadę orbitali przez elektrony w atomie
danego pierwiastka
danego pierwiastka
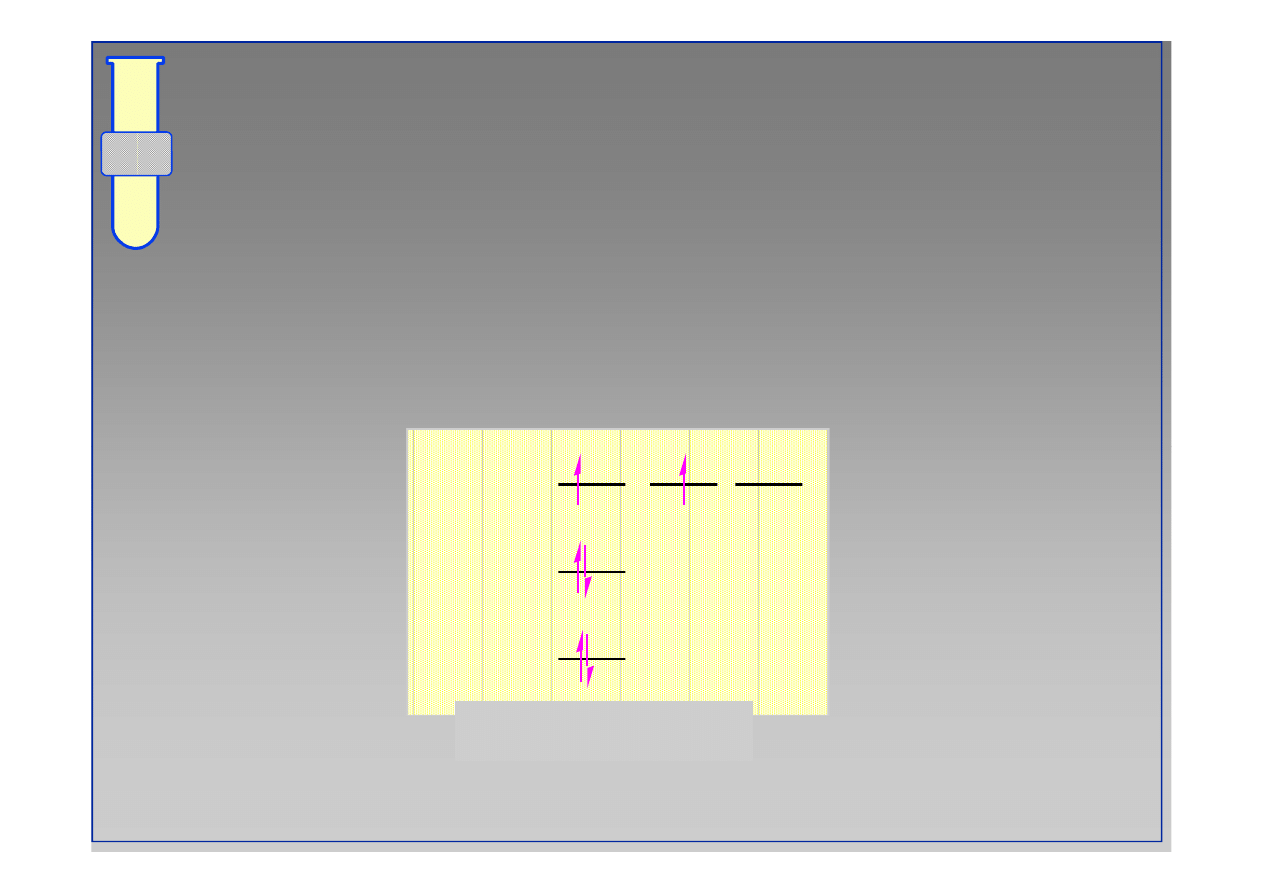
węgiel
1s
2s
2p
‹#›
RJC
Stan podstawowy
Stan podstawowy
Opisuje stan atomu o najniższej energii
Opisuje stan atomu o najniższej energii
węgiel
1s
2s
2p

‹#›
RJC
Reguły obsadzania orbitali przez
Reguły obsadzania orbitali przez
elektrony...
elektrony...
Elektrony nie obsadzają orbitali w sposób
Elektrony nie obsadzają orbitali w sposób
przypadkowy...
przypadkowy...
Kolejność obsadzania orbitali
Kolejność obsadzania orbitali
(od najniższej energii)
Zakaz Pauliego
Reguła Hunda
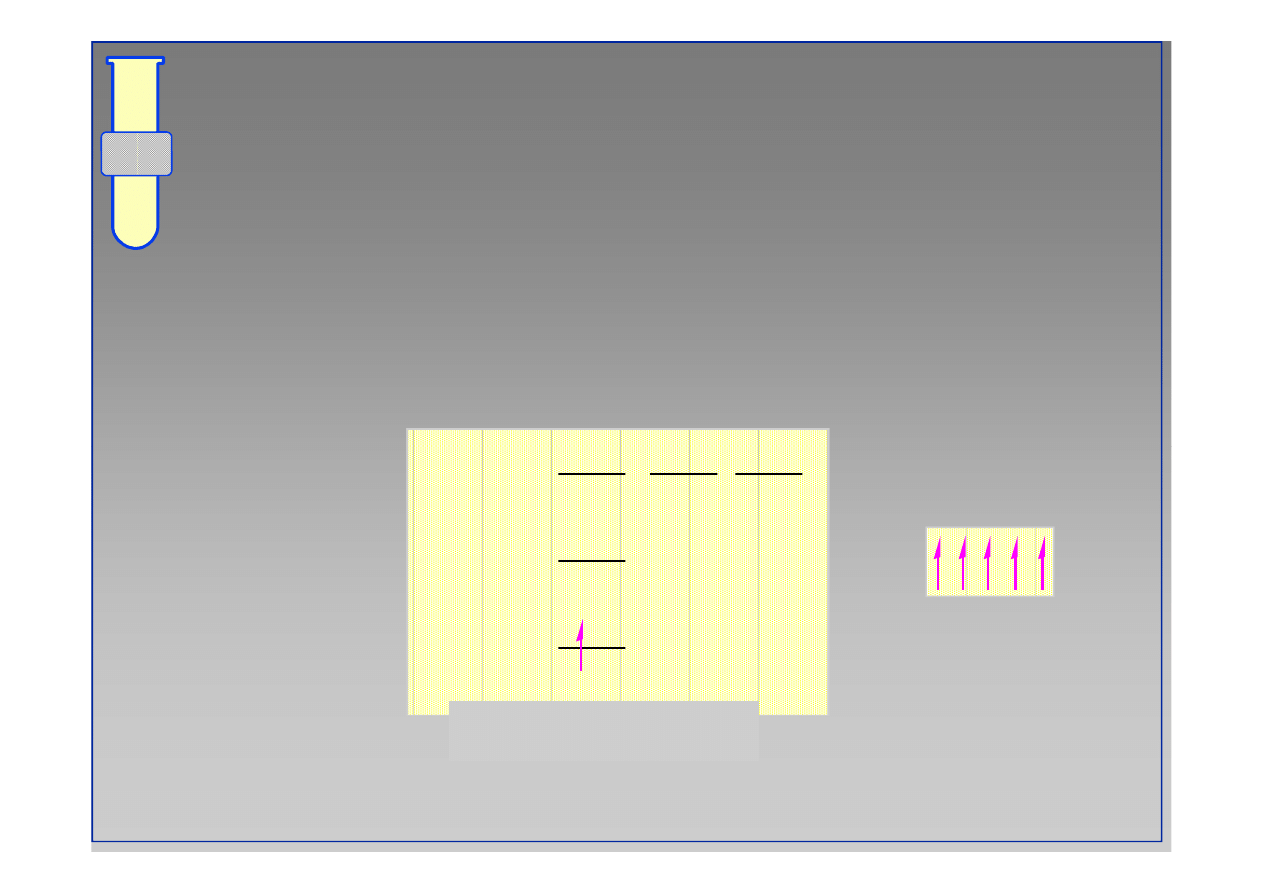
‹#›
RJC
Kolejność obsadzania orbitali
Kolejność obsadzania orbitali
Obsadzanie zawsze rozpoczyna się od orbitali o
Obsadzanie zawsze rozpoczyna się od orbitali o
najniższej energii!
najniższej energii!
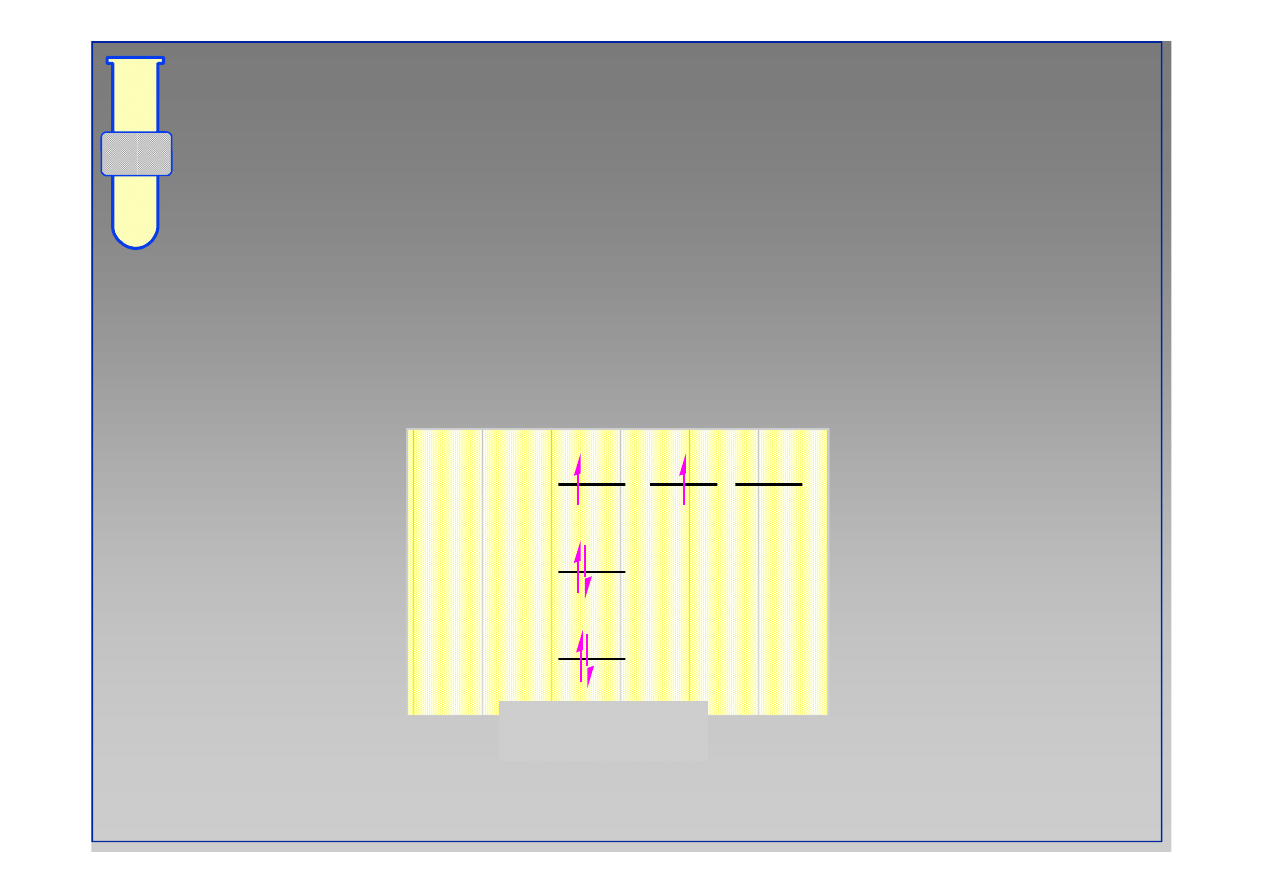
Atom węgla
1s
2s
2p
‹#›
RJC
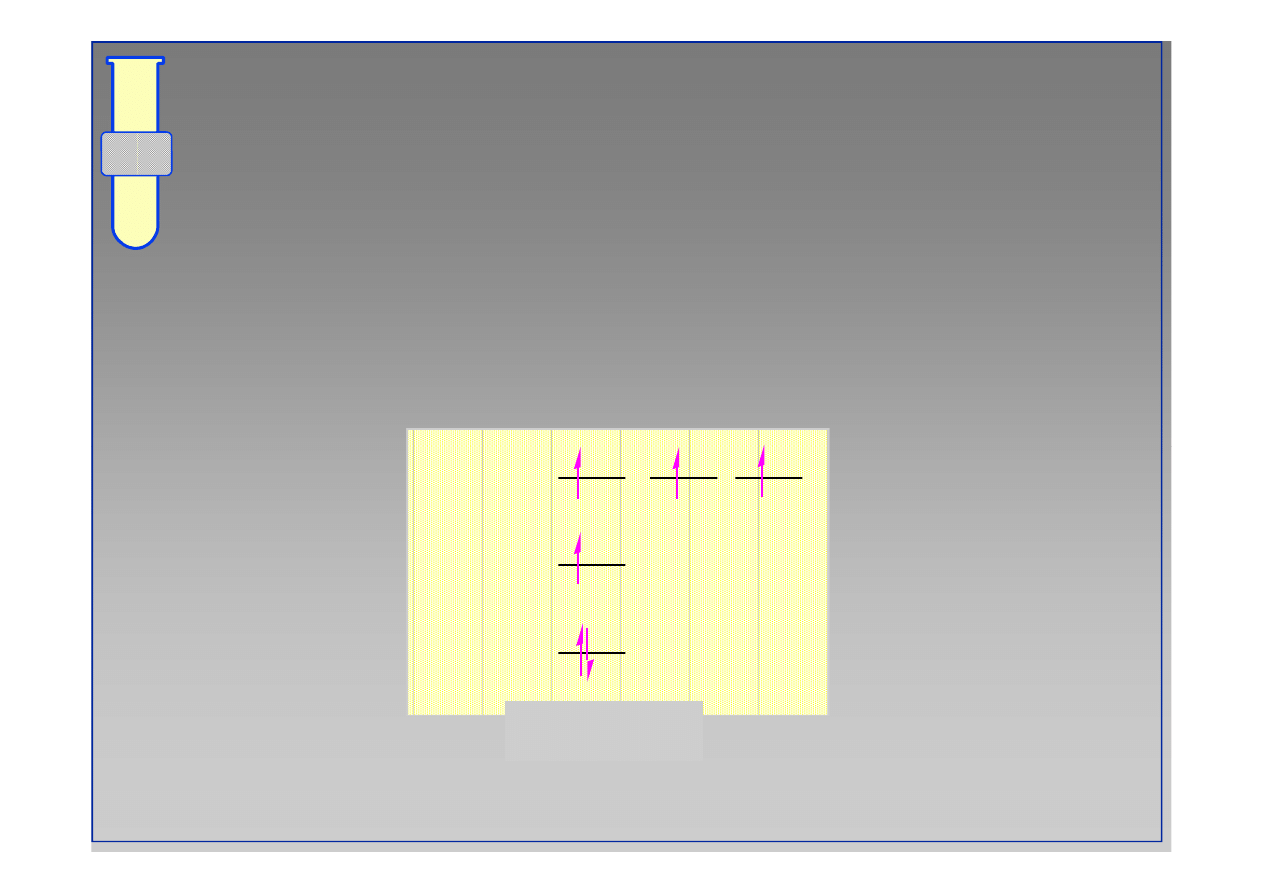
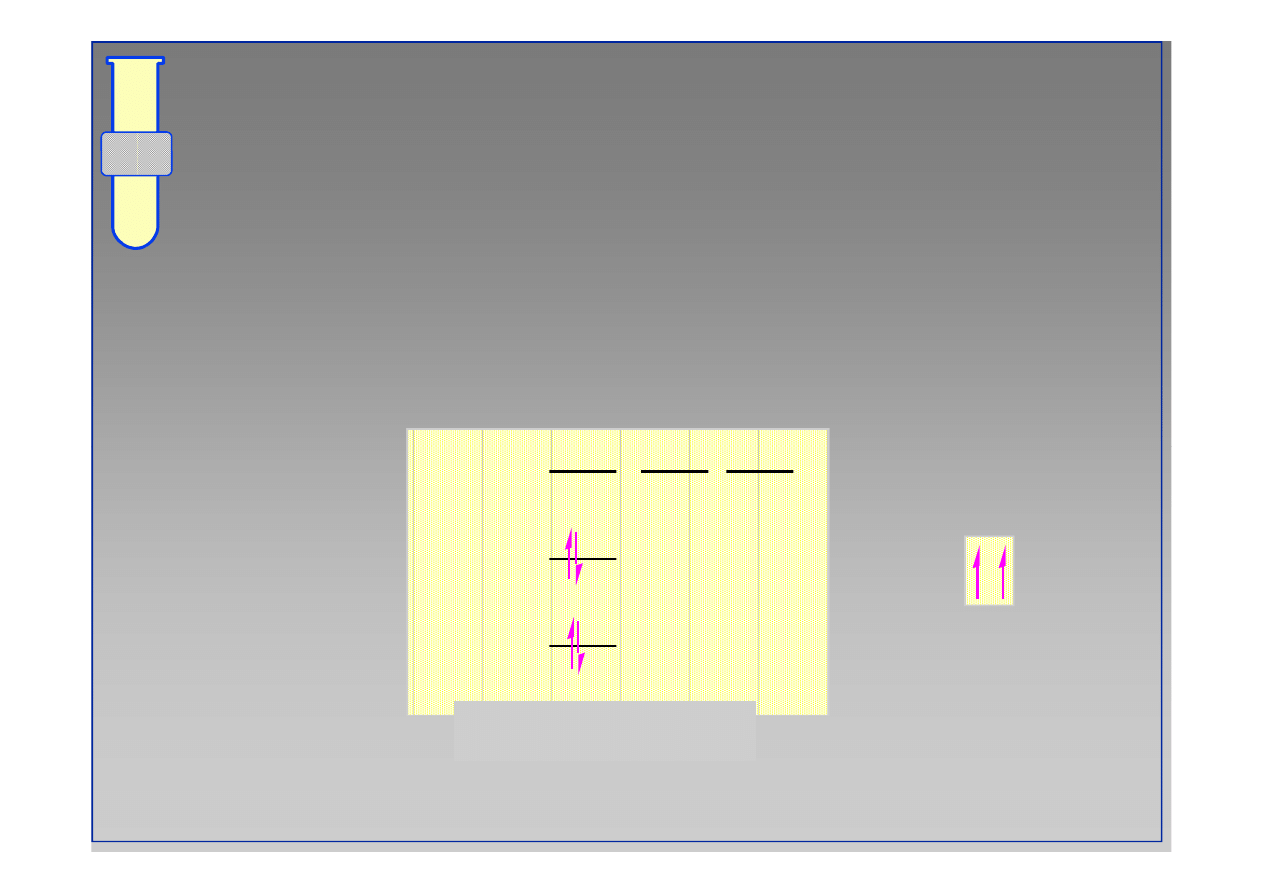
Zakaz Pauliego
Zakaz Pauliego
Na każdym orbitalu można ulokować tylko dwa
Na każdym orbitalu można ulokować tylko dwa
elektrony posiadające przeciwny spin
elektrony posiadające przeciwny spin
2p
Atom węgla
1s
2s
2p
‹#›
RJC
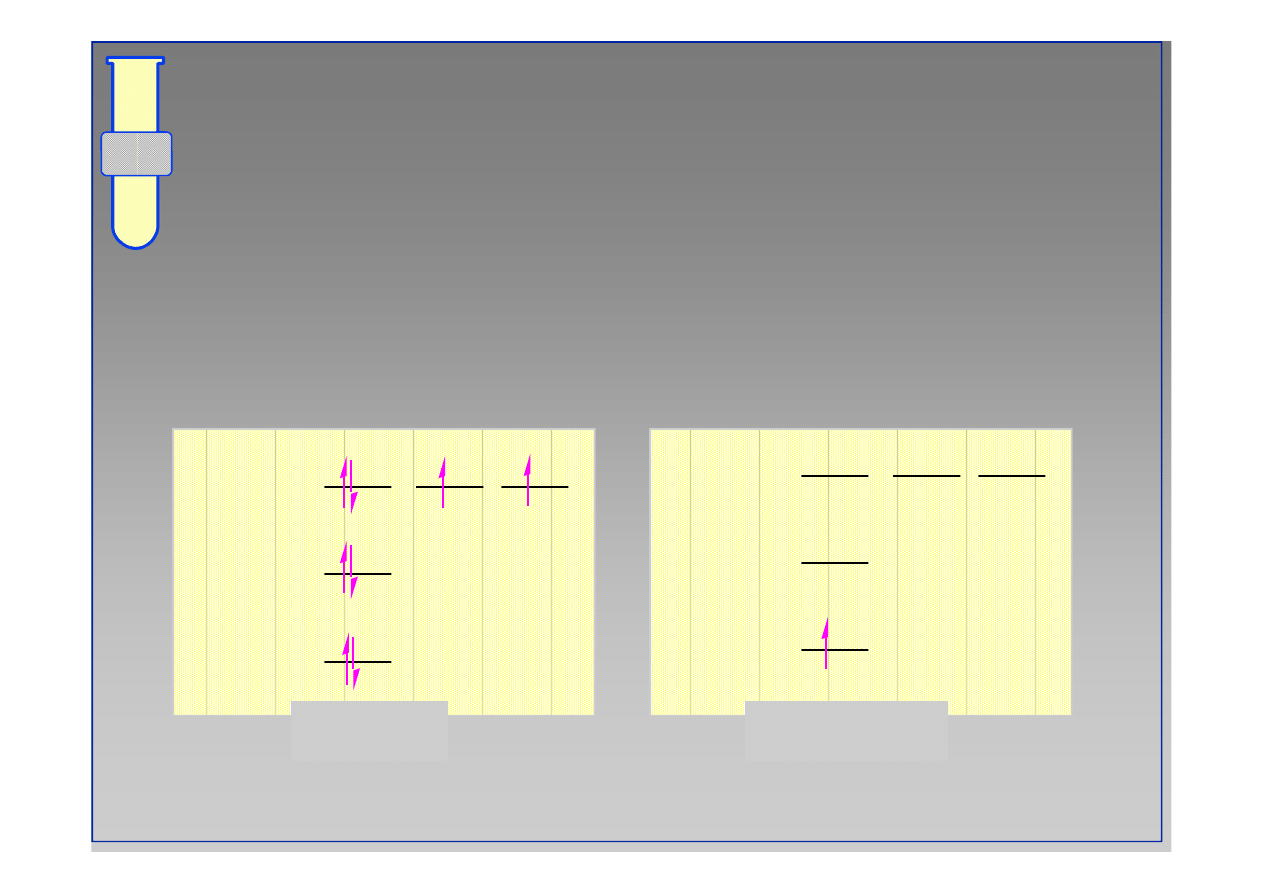
Reguła Hunda
Reguła Hunda
...w przypadku dwóch lub więcej orbitali o tej
...w przypadku dwóch lub więcej orbitali o tej
samej energii
samej energii
...orbitale zapełniane są najpierw pojedynczo.
...orbitale zapełniane są najpierw pojedynczo.
atom węgla
1s
2s
2p

‹#›
RJC
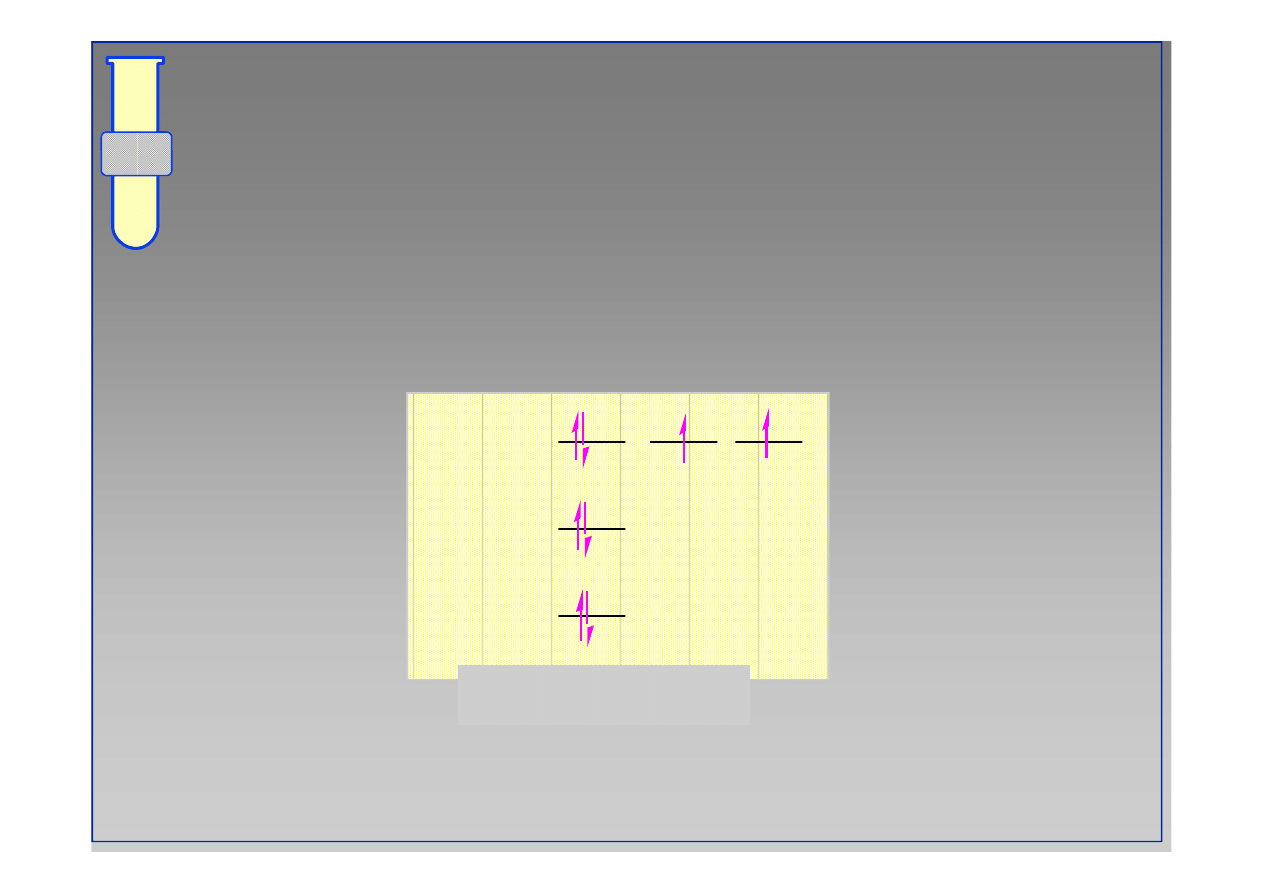
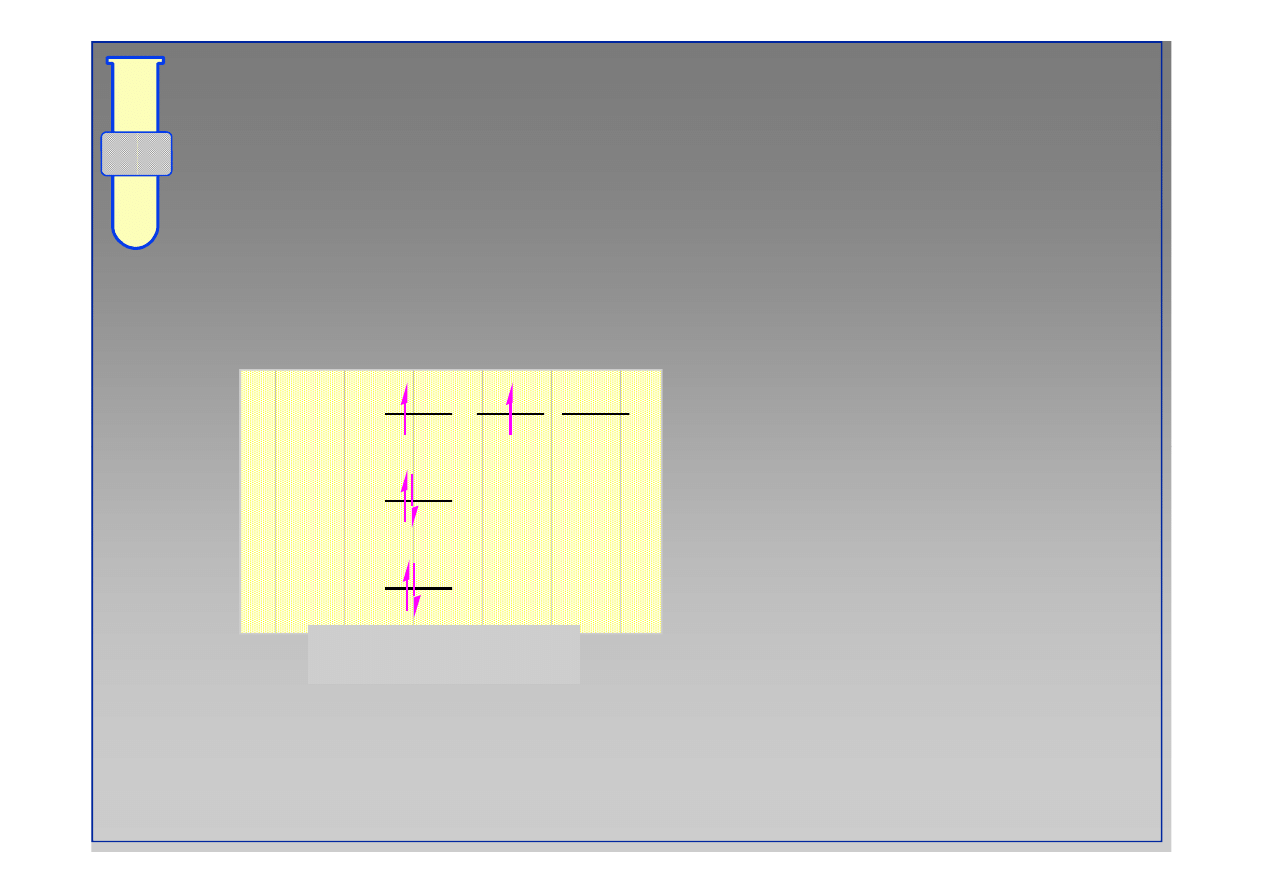
Przykładowo... Atom wodoru
Przykładowo... Atom wodoru
2p
atom wodoru
1s
2s
2p
‹#›
RJC
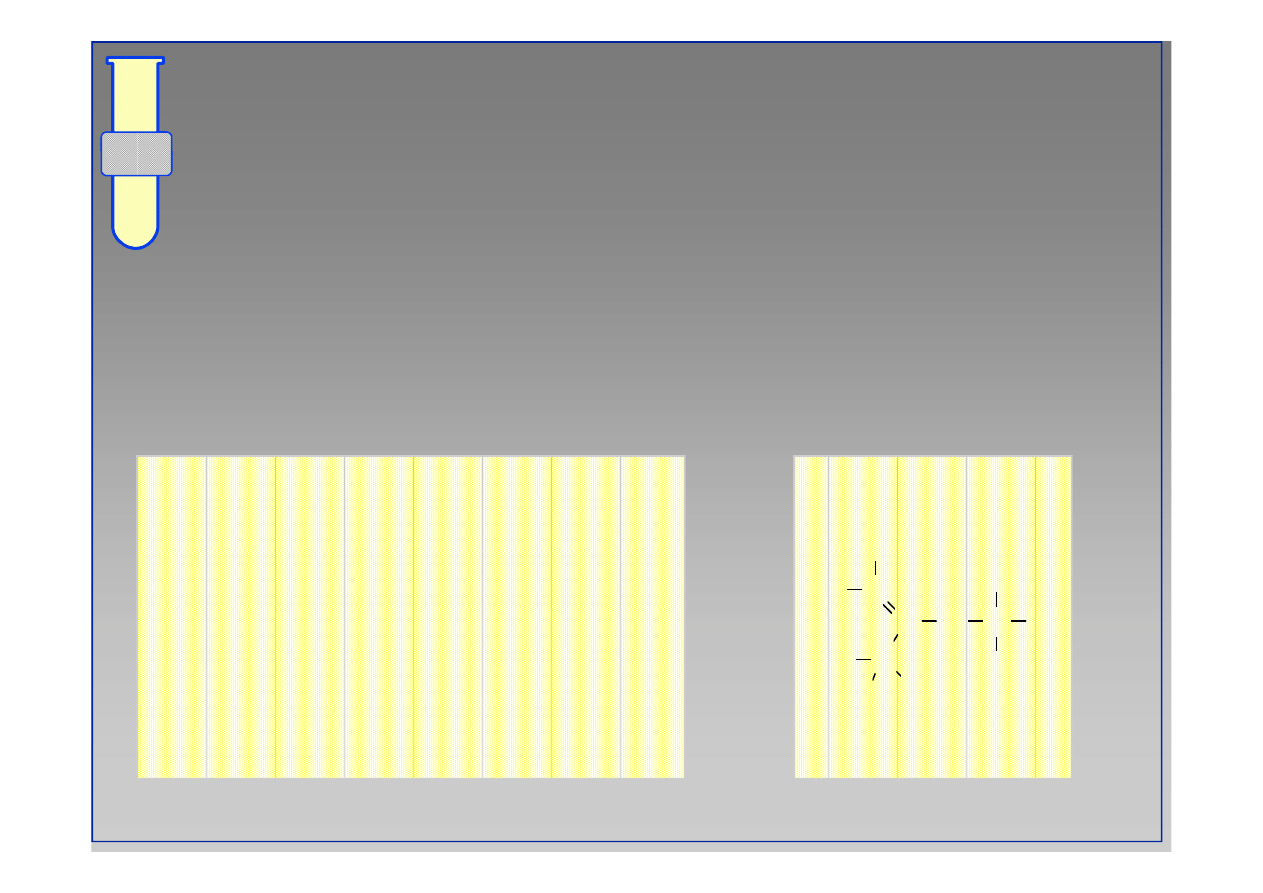
Przykładowo... Atom tlenu
Przykładowo... Atom tlenu
2p
2p
Atom tlenu
1s
2s
2p
1s
2s
2p

‹#›
RJC
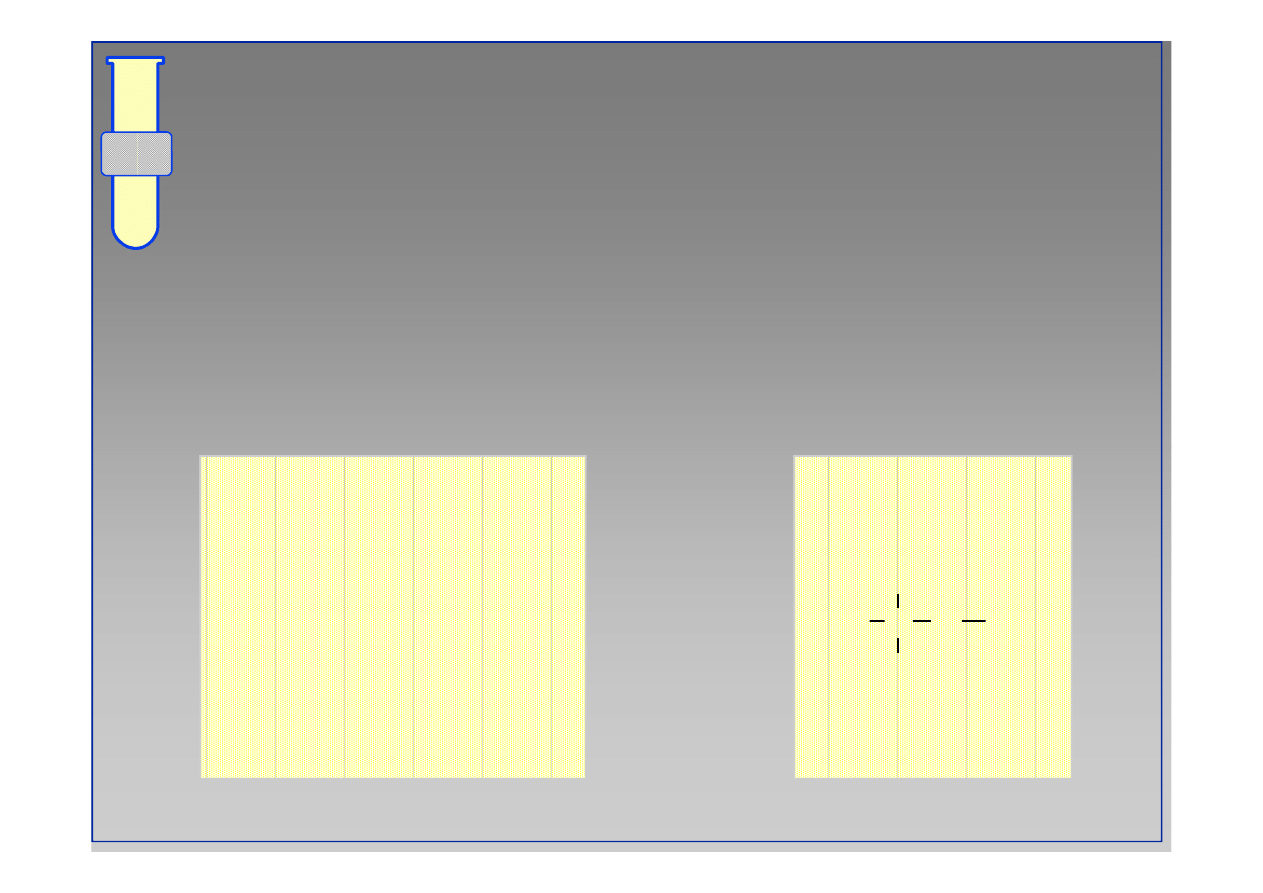
Wiązanie kowalencyjne
Wiązanie kowalencyjne
Powstaje w wyniku wspólnego użytkowania przez
Powstaje w wyniku wspólnego użytkowania przez
atomy elektronów niesparowanych z powłoki
atomy elektronów niesparowanych z powłoki
walencyjnej.
walencyjnej.
* *
2p
2p
Niesparowane elektrony walencyjne ulokowane są
na orbitalach o najwyższej energii.
atom tlenu
1s
2s
2p
1s
2s
2p

‹#›
RJC
Struktury Lewisa
Struktury Lewisa
Prosty sposób prezentacji wiązania
Prosty sposób prezentacji wiązania
kowalencyjnego, w którym ...
kowalencyjnego, w którym ...
elektrony walencyjne są przedstawione za
elektrony walencyjne są przedstawione za
pomocą kropki.
Trwała cząsteczka powstaje wtedy, gdy atom
osiąga konfigurację gazu szlachetnego.

‹#›
RJC
Cząsteczka metanu CH
Cząsteczka metanu CH
4
4
H
•
•
C
H
H
H
•
•
•
•
•
•
•
•

‹#›
RJC
Cząsteczka metanolu CH
Cząsteczka metanolu CH
3
3
OH
OH
H
•
•
• •
C
H
O
H
•
•
•
•
•
•
•
•
H
•
•
• •
• •
‹#›
RJC
Struktury Lewisa i Kekulego
Struktury Lewisa i Kekulego
...kłopotliwy nawet dla cząsteczek o średniej
...kłopotliwy nawet dla cząsteczek o średniej
wielkości
wielkości
…prostszy sposób zapisu wiązań wg Kekulego.
…prostszy sposób zapisu wiązań wg Kekulego.
C
O
•
•
•
• •
• •
C
•
•
•
•
•
•
•
•
H
H
H
C
•
•
•
•
•
H
•
•
H
C
•
•
•
•
•
•
•
•
H
H
H
C
C
C
O
C
H
H
H
H
H
H
H
H
‹#›
RJC
Struktury Kekulego
Struktury Kekulego
...wiązania kowalencyjne są przedstawiane za
...wiązania kowalencyjne są przedstawiane za
pomocą kreski, a elektrony niewiążące są pomijane.
pomocą kreski, a elektrony niewiążące są pomijane.
C
H
O
H
H
•
•
•
•
•
•
•
•
H
•
•
• •
• •
C
O
H
H
H
H
‹#›
RJC
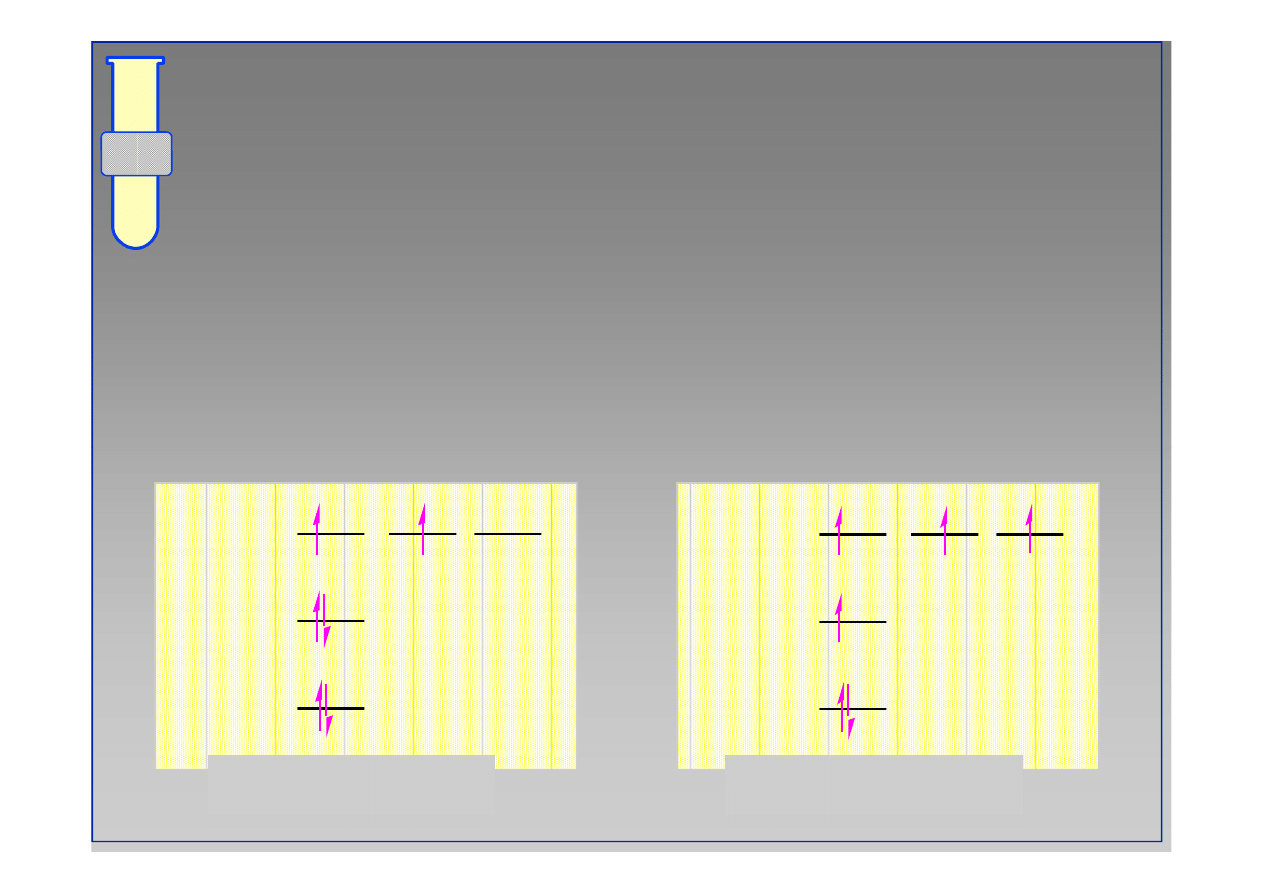
Teoria orbitali i atom węgla?
Teoria orbitali i atom węgla?
atom węgla, w stanie podstawowym, posiada tylko
atom węgla, w stanie podstawowym, posiada tylko
dwa elektrony na powłoce walencyjnej...
dwa elektrony na powłoce walencyjnej...
2p
H
...ale atom węgla tworzy cztery, a nie dwa wiązania
kowalencyjne!
atom węgla
1s
2s
C
H
H
H
H
•
•
•
•
•
•
•
•
‹#›
RJC
Konfiguracja elektronowa w stanie
Konfiguracja elektronowa w stanie
wzbudzonym
wzbudzonym
Najtrwalsza struktura cząsteczki jest osiągana
Najtrwalsza struktura cząsteczki jest osiągana
raczej poprzez udział elektronów w stanie
raczej poprzez udział elektronów w stanie
wzbudzonym, a nie podstawowym
wzbudzonym, a nie podstawowym
Stan podstawowy
Stan podstawowy
Stan wzbudzony
Stan wzbudzony
atom węgla
atom węgla
Stan podstawowy
Stan podstawowy
Stan wzbudzony
Stan wzbudzony
1s
2s
2p
1s
2s
2p
‹#›
RJC
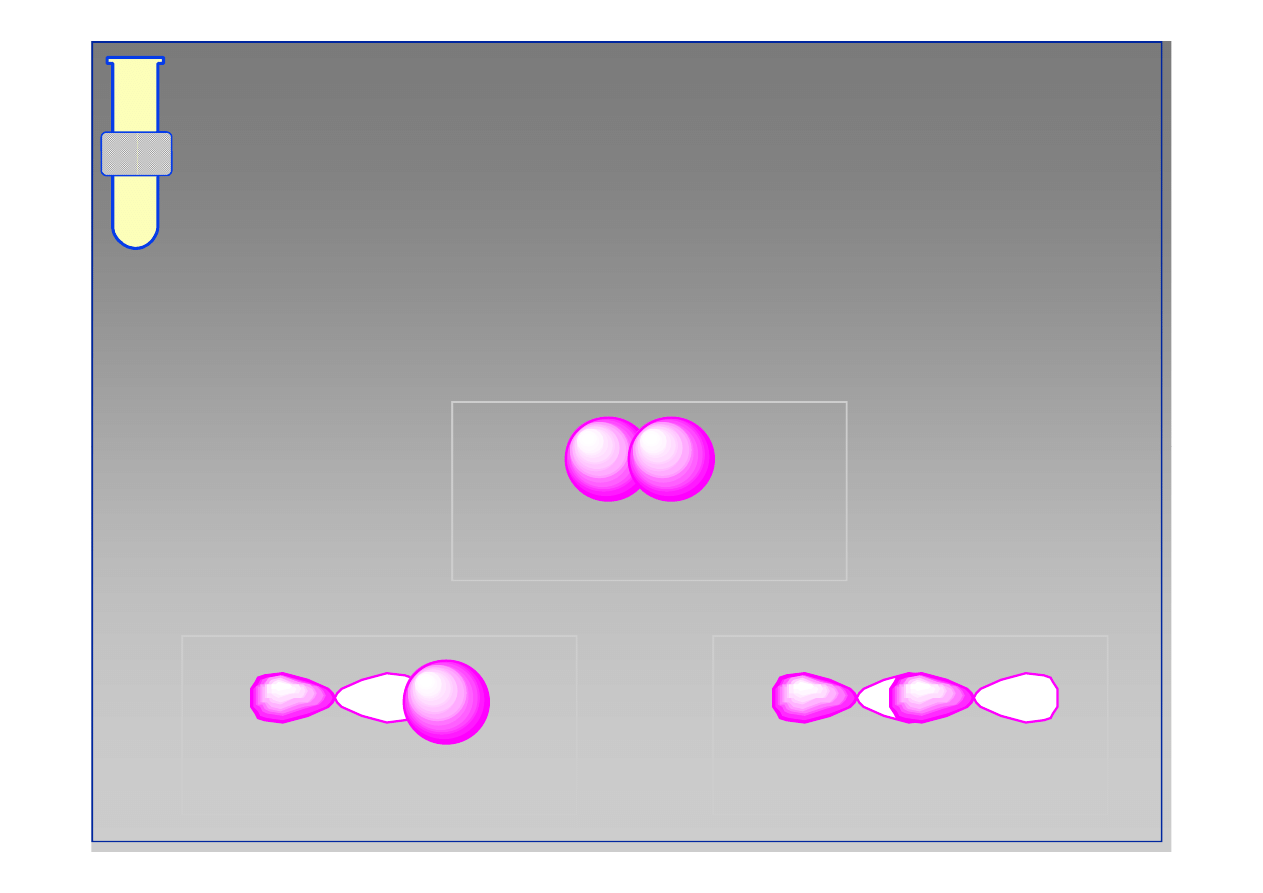
Nakładanie orbitali
Nakładanie orbitali
Siła wiązania kowalencyjnego jest określona
Siła wiązania kowalencyjnego jest określona
przez stopień nałożenia orbitali.
przez stopień nałożenia orbitali.
s
s
p
s
s
s
p
p
dobre
bardzo dobre
doskonałe
‹#›
RJC
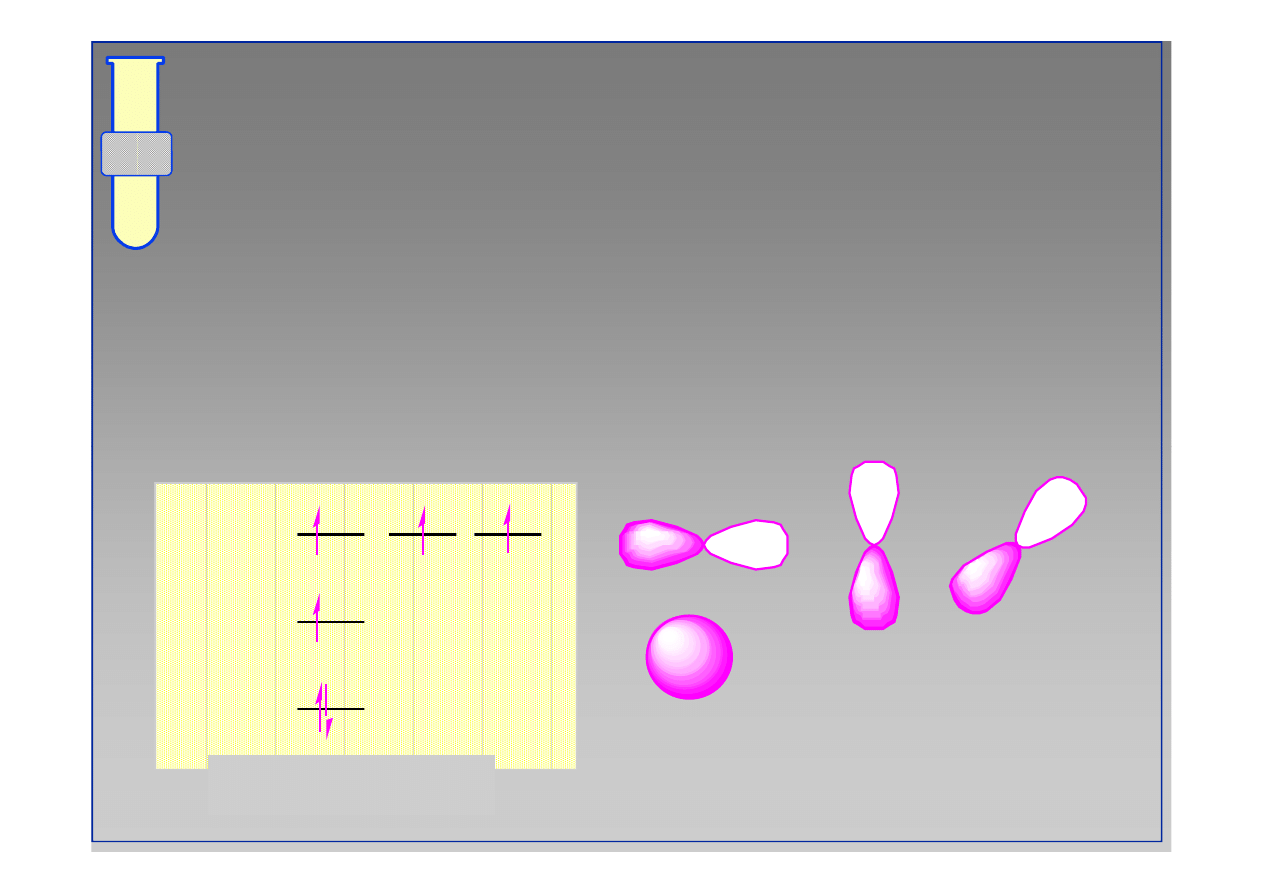
Cząsteczka metanu
Cząsteczka metanu
Atom węgla posiada jeden elektron 2s oraz 3
Atom węgla posiada jeden elektron 2s oraz 3
elektrony 2p, które mogą uczestniczyć w
elektrony 2p, które mogą uczestniczyć w
powstawaniu wiązań.
powstawaniu wiązań.
stan wzbudzony
stan wzbudzony
atom węgla
stan wzbudzony
stan wzbudzony
1s
2s
2p
‹#›
RJC
Cząsteczka metanu
Cząsteczka metanu
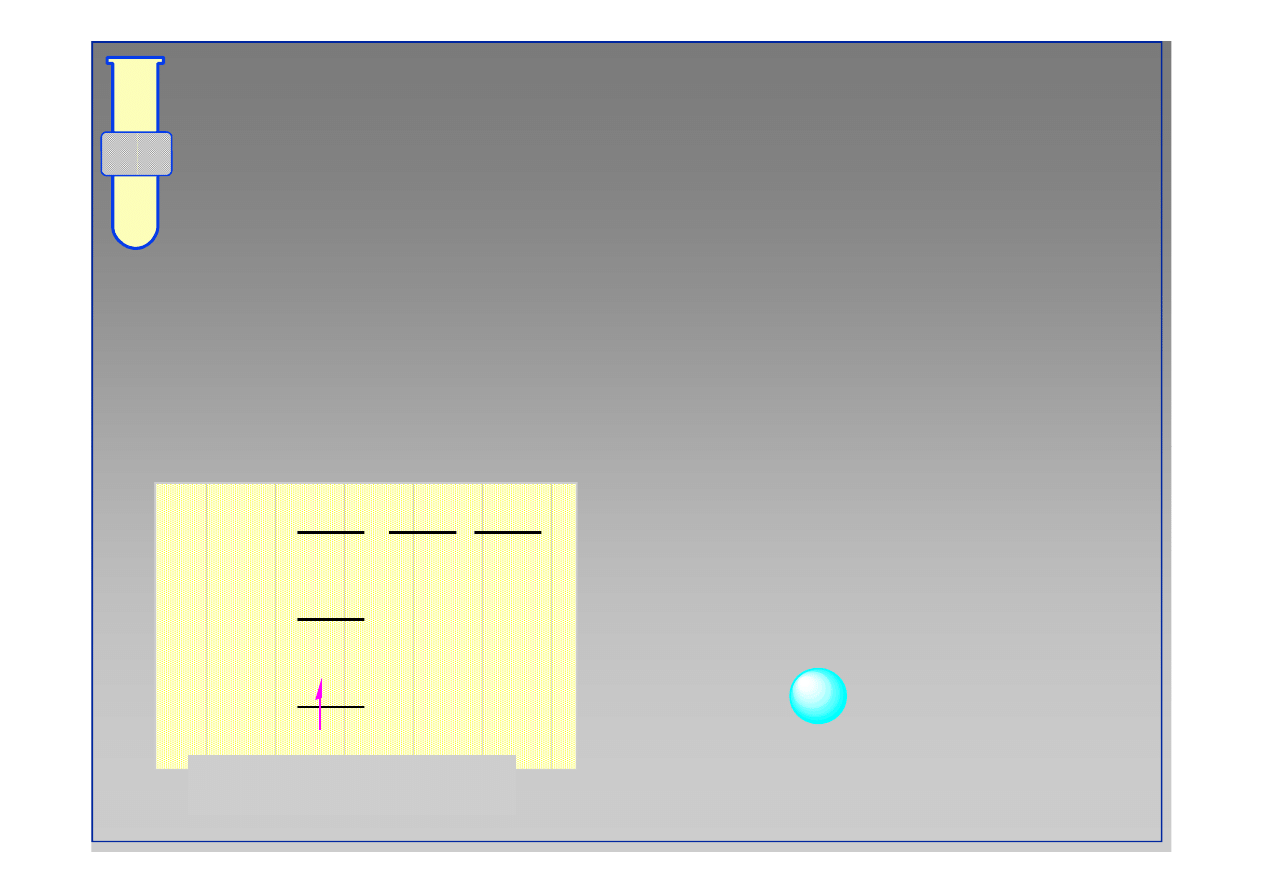
Atom wodoru posiada jeden niesparowany elektron
Atom wodoru posiada jeden niesparowany elektron
1s mogący tworzyć wiązanie kowalencyjne.
1s mogący tworzyć wiązanie kowalencyjne.
Stan wzbudzony
Stan wzbudzony
atom wodoru
Stan wzbudzony
Stan wzbudzony
1s
2s
2p
‹#›
RJC
Cząsteczka metanu
Cząsteczka metanu
Powstawanie wiązań powinno doprowadzić do
Powstawanie wiązań powinno doprowadzić do
utworzenia wiązania 2s
utworzenia wiązania 2s--1s oraz
1s oraz
trzech wiązań 2p
trzech wiązań 2p--1s .
1s .

‹#›
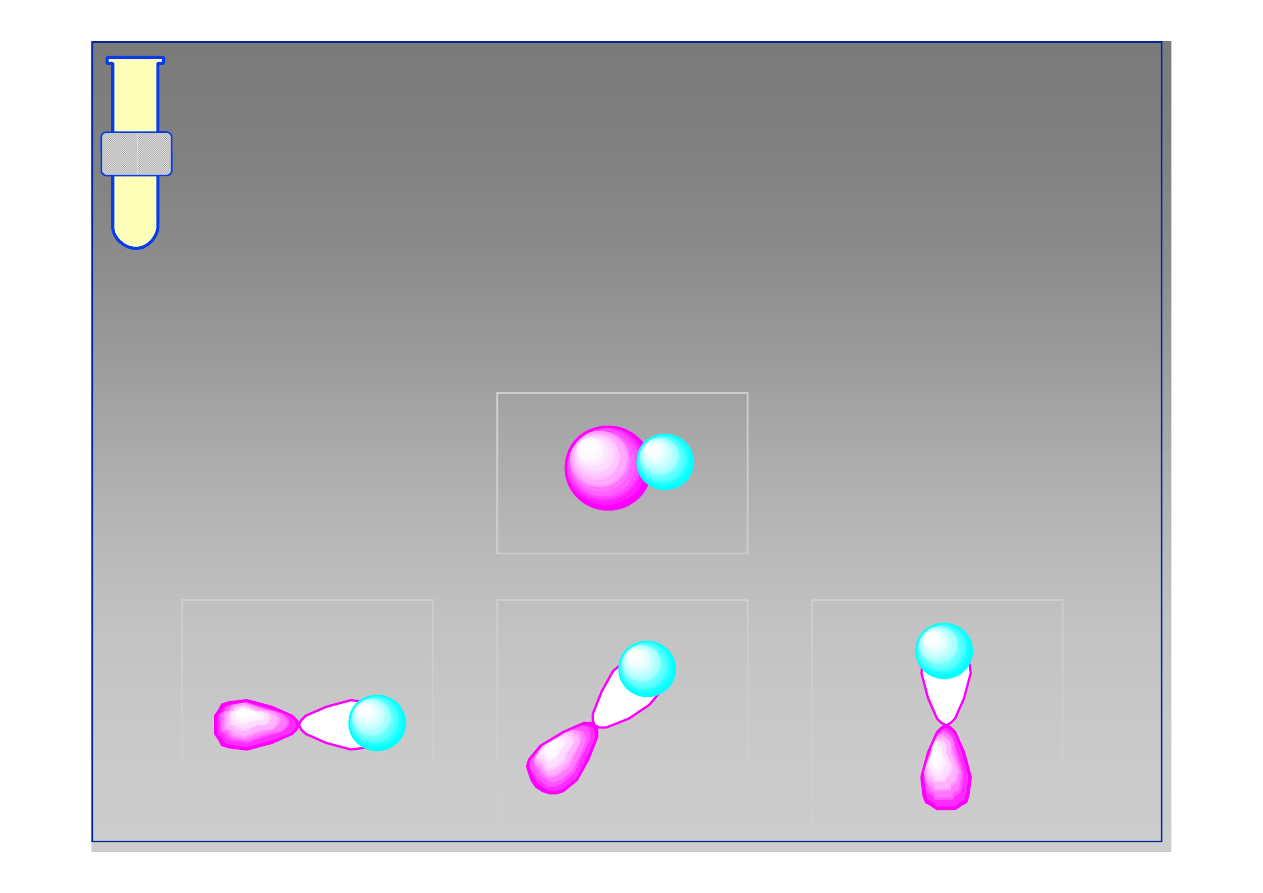
RJC
Cząsteczka metanu
Cząsteczka metanu
Należałoby oczekiwać, że 3 wiązania C
Należałoby oczekiwać, że 3 wiązania C--H (2p
H (2p--1s)
1s)
są krótsze niż pozostałe jedno (2s
są krótsze niż pozostałe jedno (2s--1s).
1s).
C
H
H
H
H
‹#›
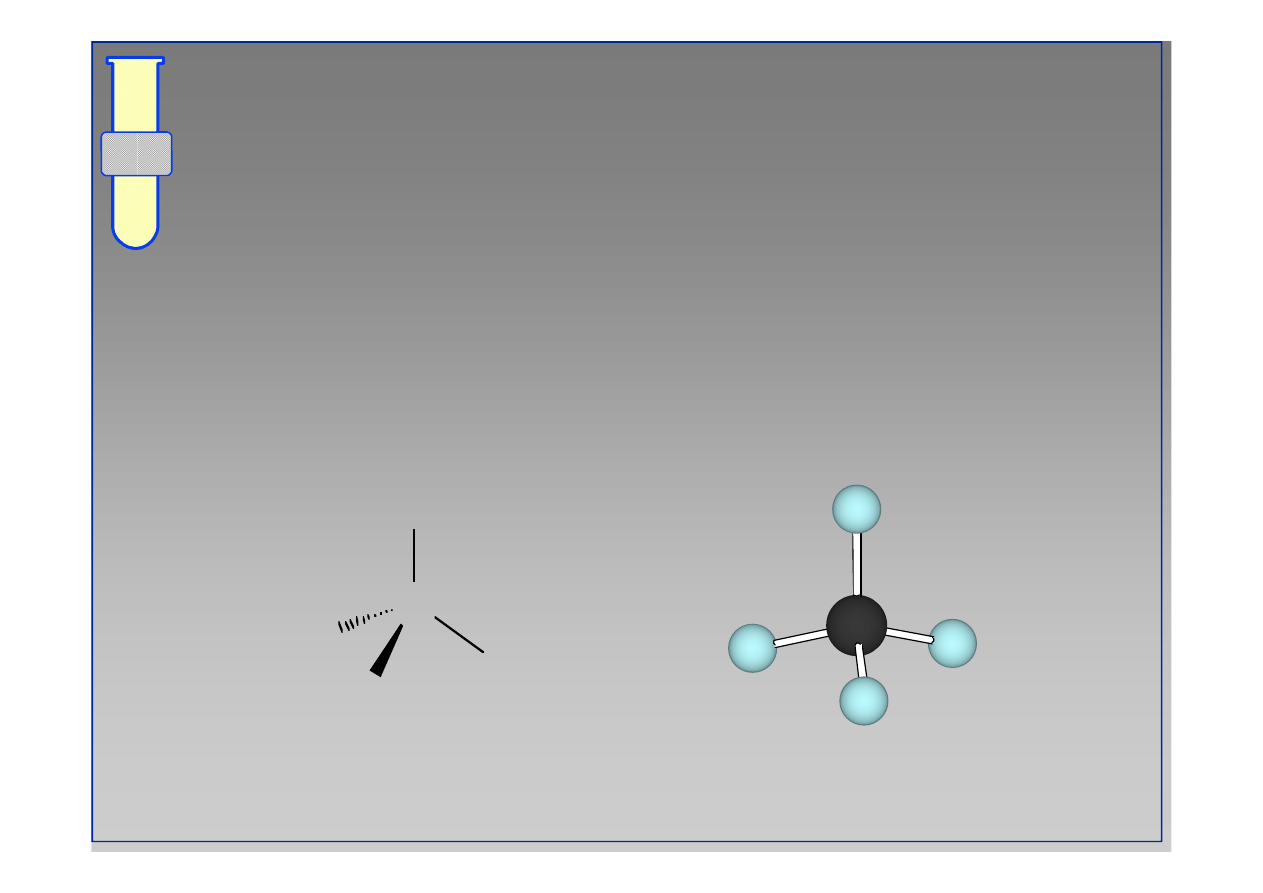
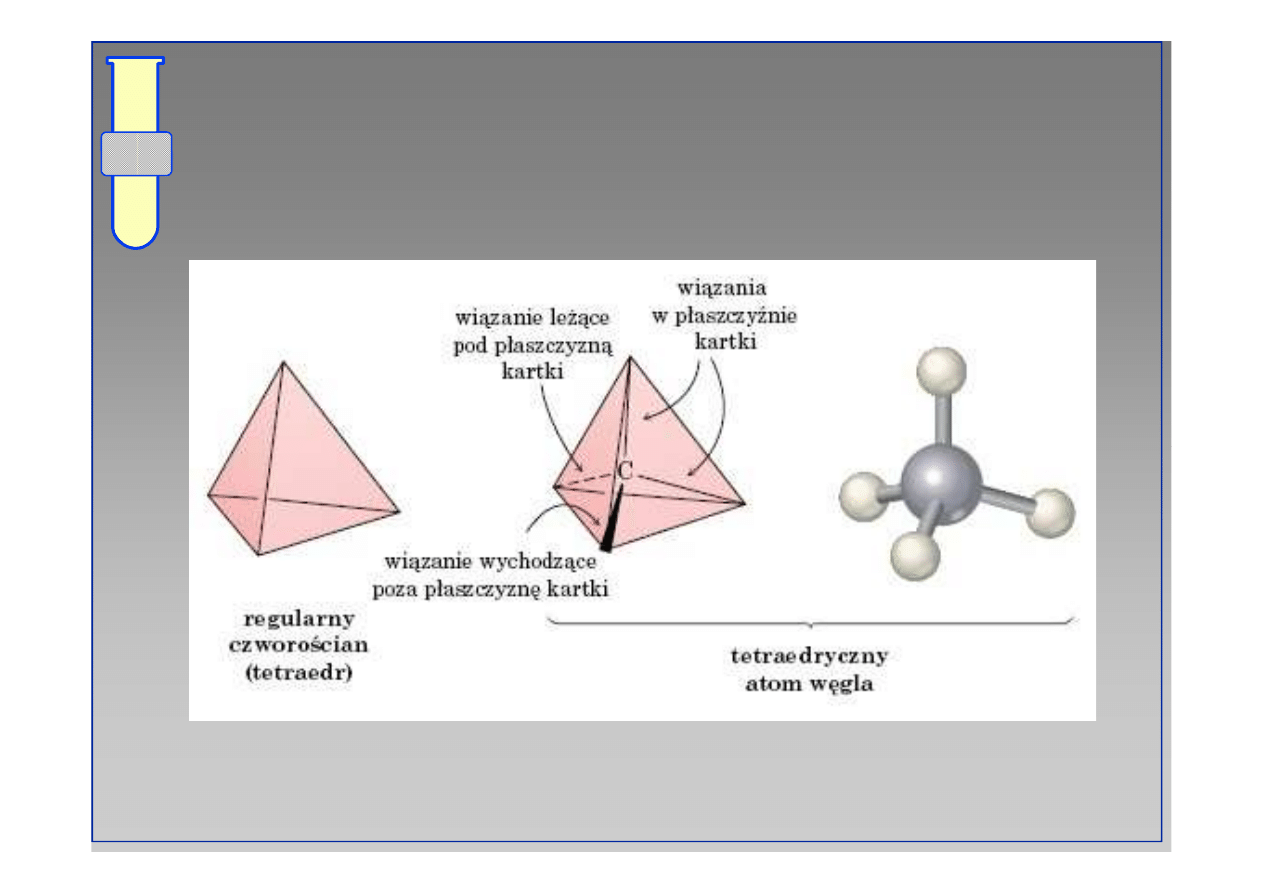
RJC
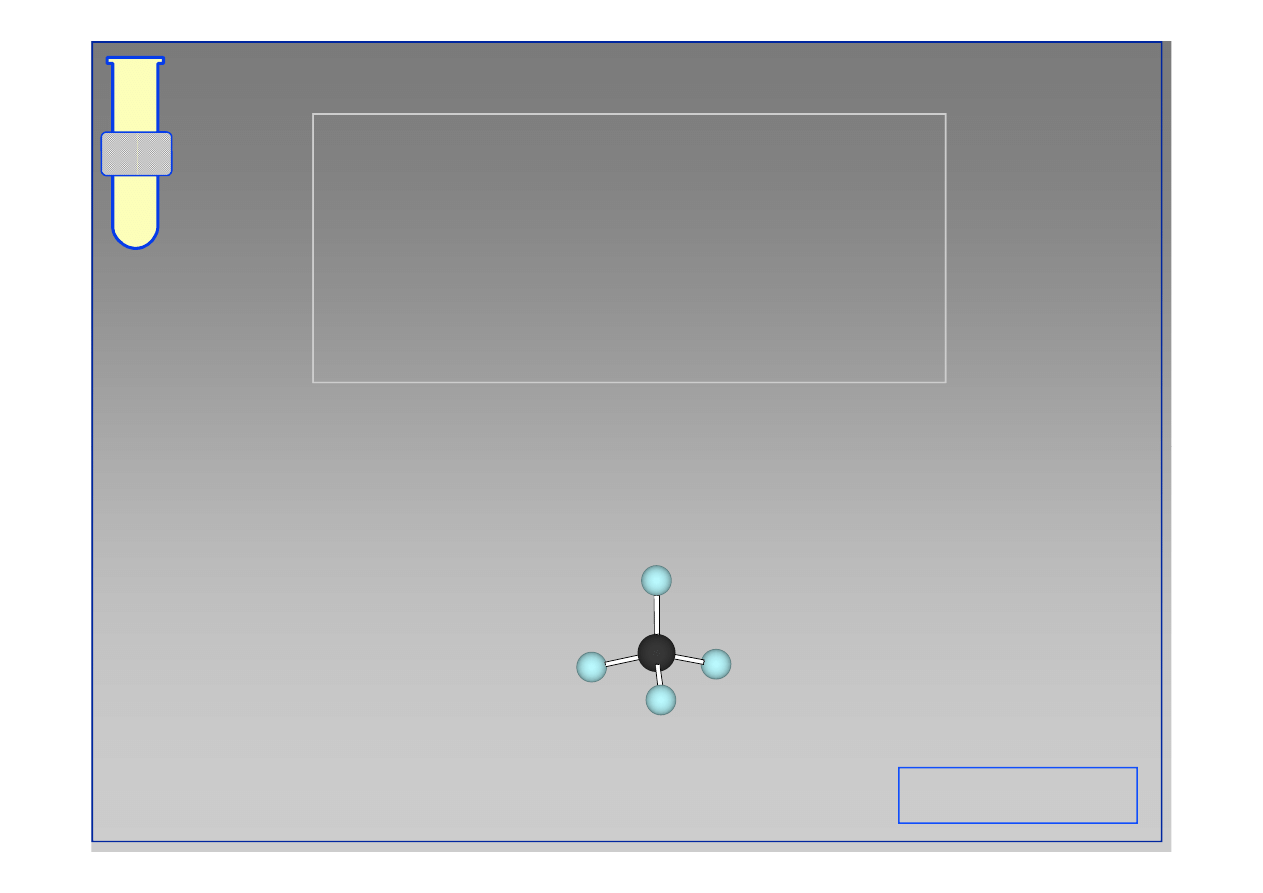
Geometria tetragonalna
Geometria tetragonalna
Eksperymentalnie wykazano, że wszystkie
Eksperymentalnie wykazano, że wszystkie
wiązania są jednakowo długie i rozlokowane
wiązania są jednakowo długie i rozlokowane
wewnątrz tetraedru (czworościanu).
wewnątrz tetraedru (czworościanu).
C
H
H
H
H
‹#›
RJC
‹#›
RJC
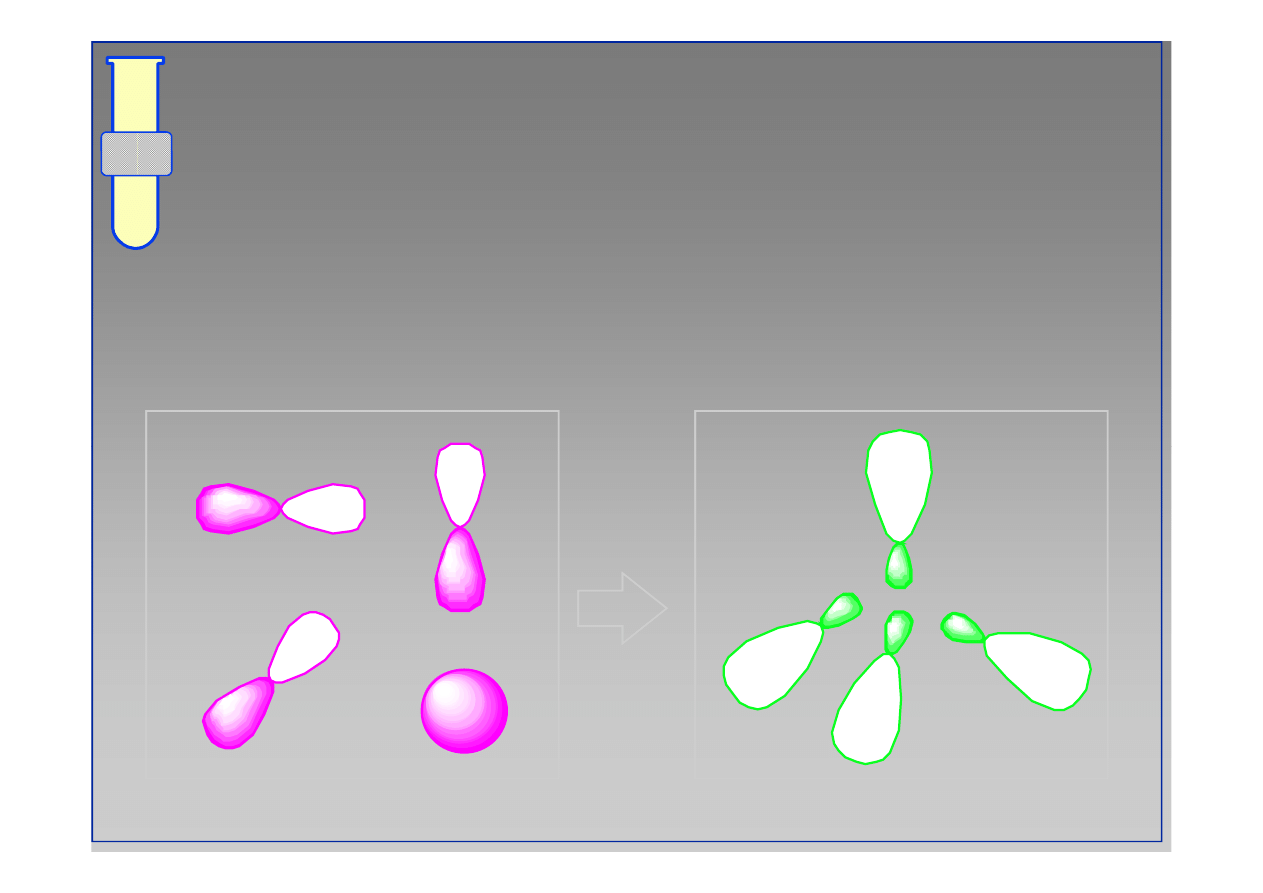
Powstawanie cząsteczki etanu
Powstawanie cząsteczki etanu
‹#›
RJC
Hybrydyzacja
Hybrydyzacja
Wiązania w metanie najlepiej jest wytłumaczyć
Wiązania w metanie najlepiej jest wytłumaczyć
przy założeniu, że orbitale 2s oraz 2p ulegają
przy założeniu, że orbitale 2s oraz 2p ulegają
hybrydyzacji dając 4 orbitale sp
hybrydyzacji dając 4 orbitale sp
3
3
..
2s + 2p + 2p + 2p
2sp
3
+ 2sp
3
+ 2sp
3
+ 2sp
3
‹#›
RJC
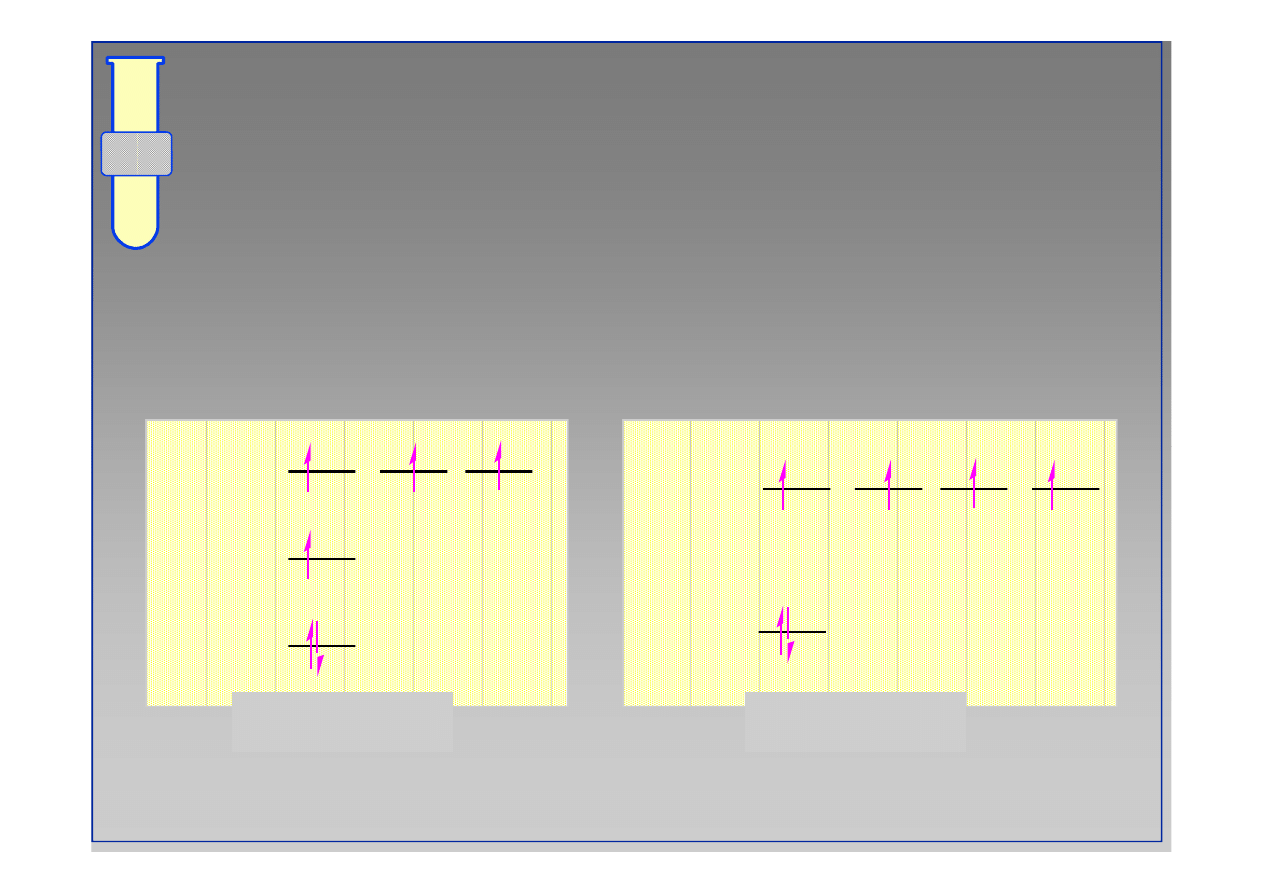
Po hybrydyzacji: konfiguracja elektronowa
Po hybrydyzacji: konfiguracja elektronowa
Stan wzbudzony
Stan wzbudzony
Po hybrydyzacji
Po hybrydyzacji
2p
Atom C
Atom C
1s
2s
2p
1s
2sp
3
‹#›
RJC
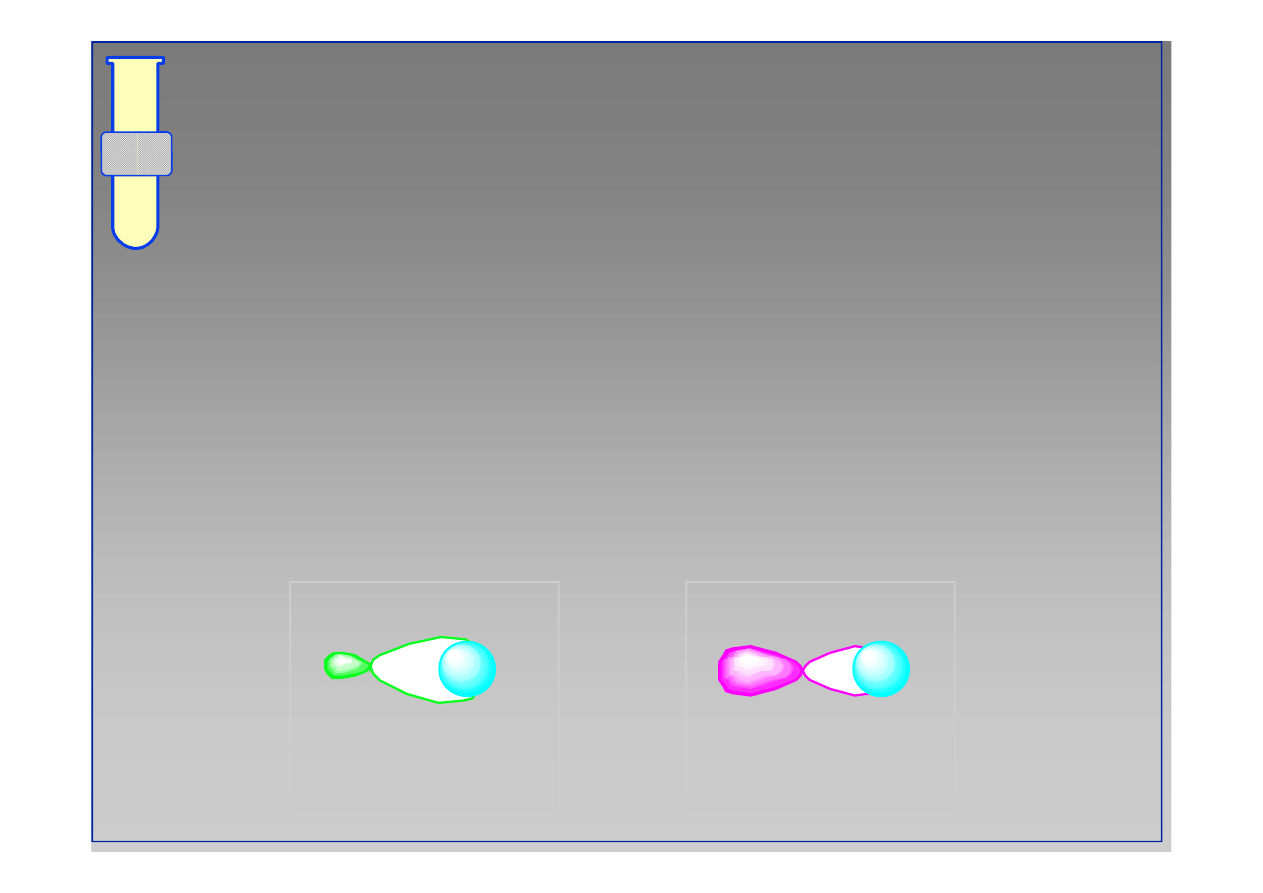
Dlaczego hybrydyzacja ? To poprawia
Dlaczego hybrydyzacja ? To poprawia
stopień nakładania orbitali !
stopień nakładania orbitali !
Siła wiązania kowalencyjnego jest uzależniona od
Siła wiązania kowalencyjnego jest uzależniona od
stopnia nałożenia orbitali...
stopnia nałożenia orbitali...
“...orbitale po hybrydyzacji nakładają się lepiej
“...orbitale po hybrydyzacji nakładają się lepiej
niż przed hybrydyzacją ...”
sp
3
s
p
s
‹#›
RJC
Wykorzystanie teorii orbitali/hybrydyzacji
Wykorzystanie teorii orbitali/hybrydyzacji
Teoria orbitali oraz hybrydyzacja pozwalają
Teoria orbitali oraz hybrydyzacja pozwalają
dobrze zrozumieć takie fakty jak kształt cząsteczki
dobrze zrozumieć takie fakty jak kształt cząsteczki
zarówno w prostych jak i skomplikowanych
zarówno w prostych jak i skomplikowanych
związkach organicznych.
związkach organicznych.
związkach organicznych.
związkach organicznych.

‹#›
RJC
Podsumowanie: podstawowe pojęcia
Podsumowanie: podstawowe pojęcia
Wiązanie kowalencyjne
Wiązanie kowalencyjne
Konfiguracja elektronowa
Konfiguracja elektronowa w stanie
podstawowym
Zasady wypełniania orbitali
Zasady wypełniania orbitali
Zakaz Pauliego
Reguła Hunda
Orbitale (s, p oraz sp
3
)
Struktury Lewisa oraz Kekulego
Hybrydyzacja
Wyszukiwarka
Podobne podstrony:
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
mechanika 3 id 290735 Nieznany
więcej podobnych podstron