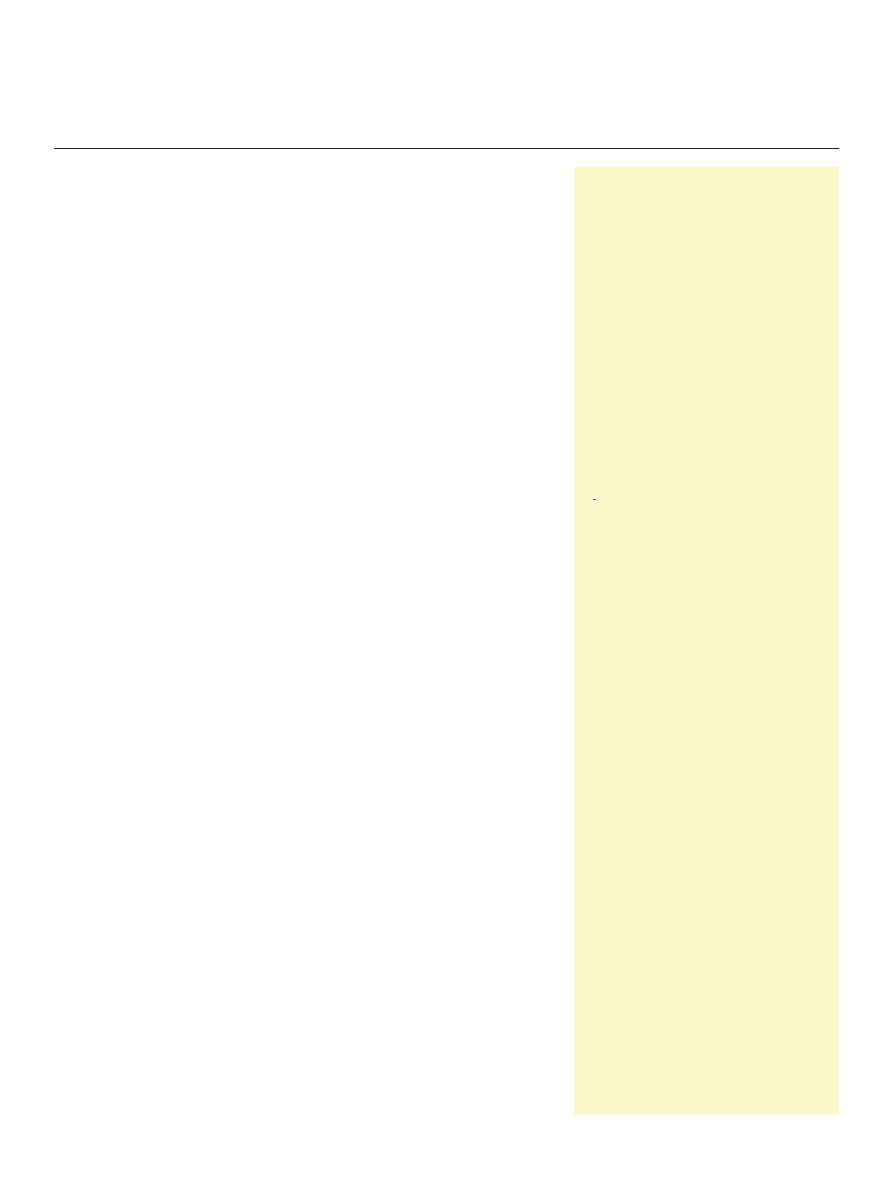
Postępy Biochemii 59 (3) 2013
305
Radosław Kitel
1
Joanna Czarnecka
1
Aleksandra Rusin
2,
1
Katedra Chemii Organicznej, Bioorga-
nicznej i Biotechnologii, Wydział Che-
miczny, Politechnika Śląska w Gliwicach
2
Centrum Badań Translacyjnych i Biologii Mo-
lekularnej Nowotworów, Centrum Onkologii
Instytut im. Marii Skłodowskiej – Curie, Od-
dział w Gliwicach
Centrum Badań Translacyjnych i Biologii
Molekularnej
Nowotworów,
Centrum
Onkologii Instytut im. Marii Skłodowskiej-
Curie, Oddział w Gliwicach, ul. Wybrzeze AK
15, 44-100 Gliwice; e-mail: arusin@io.gliwice.
pl
,
tel.: (32) 27 89 844
Artykuł otrzymano 18 grudnia 2012 r.
Artykuł zaakceptowano 23 kwietnia 2013 r.
Słowa kluczowe: hodowle 3D, hodowle trój-
wymiarowe, sferoidy,
Wykaz skrótów: 2D (ang. two-dimensional) —
dwuwymiarowe; 3D (ang. three-dimensional)
— trójwymiarowe; BAL (ang. bioartificial liver)
— sztuczna biologiczna wątroba; CSC (ang.
cancer stem cells) — nowotworowe komórki
macierzyste; EGF (ang. epidermal growth factor)
— naskórkowy czynnik wzrostu; EMT (ang.
epithelial-mesenchymal transition) — przejście
nabłonkowo-mezenchymalne; PHEMA — po-
limetakrylan 2-hydroksyetylu; PLGA — kopo-
limer kwasu mlekowego i kwasu glikolowego;
RGD — sekwencja aminokwasów: argininy,
glicyny i kwasu asparaginowego
Podziękowania: Praca ta powstała podczas
wykonywania projektu finansowanego przez
FNP (Grant VENTURES/2012-9/6 przyznany
R.K). A.R. składa podziękowania dr Piotrowi
Filipczakowi za cenne uwagi dotyczące maszy-
nopisu.
Trójwymiarowe hodowle komórek — zastosowania
w badaniach podstawowych i inżynierii tkankowej
STRESZCZENIE
T
echnika hodowli komórek
in vitro jest powszechnie stosowana w badaniach bioche-
micznych i molekularnych i wykazuje wiele zalet w porównaniu do hodowli organów
i wycinków tkanek
in vitro, zapewniając łatwy dostęp do materiału biologicznego, wysoką
powtarzalność wyników oraz wysokoprzepustowy format analiz. Jednakże dwuwymiarowe
hodowle (hodowle 2D) słabo odzwierciedlają mikrośrodowisko tkanki i są coraz częściej
zastępowane hodowlami trójwymiarowymi (hodowlami 3D), wykazującymi podobieństwo
do tkanki pod względem kontaktów międzykomórkowych, ścieżek sygnałowych i ekspresji
genów. Niniejsza praca omawia biologię hodowli sferycznych (sferoidów), ich zastosowanie
w badaniach podstawowych i biotechnologii oraz przedstawia metody otrzymywania tych
struktur.
WPRoWADZENIE
Hodowla komórek in vitro jest techniką powszechnie stosowaną w różnych
dyscyplinach naukowych, od biologii molekularnej po badania środowiskowe.
Jest także wykorzystywana w biotechnologii, między innymi w procesach pro-
dukcji szczepionek czy przeciwciał monoklonalnych. Przez wiele lat rutynowo
hodowano komórki wykazujące zdolność do przywierania do dna naczynia
(komórki adherentne) w postaci pojedynczej warstwy przykrytej pożywką, co
zapewniało im optymalne warunki wzrostu. Należy podkreślić, że brak kontak-
tu komórek z macierzą zewnątrzkomórkową na plastikowych powierzchniach
naczyń hodowlanych, a także wysoka zawartość surowicy w pożywce prowadzi
do zmiany stanu zróżnicowania komórek, utraty ich polaryzacji oraz komunika-
cji międzykomórkowej. W kulturze zaczynają dominować procesy promujące
proliferację i przypominające zjawiska zachodzące podczas gojenia ran oraz wy-
stępujące w ogniskach zapalnych.
Taki typ hodowli stwarza wiele ograniczeń jako model tkanki [1]. Od dawna
znany jest fakt, że prawidłowe komórki nabłonkowe w hodowli utrzymywa-
nej w postaci monowarstwy wykazują wiele cech komórek nowotworowych,
łącznie z ograniczeniem ich zdolności do różnicowania [2,3]. Badania zapocząt-
kowane przez Sutherlanda w latach siedemdziesiątych ubiegłego wieku poka-
zały, że trójwymiarowe hodowle komórek nowotworowych przypominają pod
wieloma względami guzy lite i są ich doskonałym modelem in vitro [4]. Autorzy
ci pokazali przewagę trójwymiarowych hodowli nad tradycyjną hodowlą 2D w
badaniach odpowiedzi biologicznej komórek na promieniowanie [5,6].
W ostatnich latach znacznie ulepszono techniki otrzymywania i hodow-
li trójwymiarowych agregatów komórkowych o powtarzalnych rozmiarach i
strukturze. Coraz częściej stosuje się trójwymiarowe hodowle (hodowle 3D),
obejmujące więcej niż jeden typ komórek, odzwierciedlające oddziaływania he-
terotypowe, charakterystyczne dla tkanek. Trójwymiarowe hodowle komórek
in vitro znajdują zastosowanie w badaniach biologii komórek nowotworowych,
oddziaływań międzykomórkowych, procesów różnicowania, ocenie toksycz-
ności substancji i skuteczności terapeutycznej potencjalnych leków, a także w
inżynierii tkankowej.
MIKRośRoDoWISKo SfERoIDóW
Jednym z modelowych układów 3D in vitro są sferyczne agregaty komórkowe
(sferoidy). Mają one charakter samoorganizujących się skupisk, powstających w
warunkach uniemożliwiających przyczepianie się komórek do podłoża. Sfero-
idy tworzą się, gdy oddziaływania komórka-komórka dominują nad oddziały-
waniami komórka–substancje macierzy zewnątrzkomórkowej [7]. Twory te nie
stanowią kolonii (nie powstają w wyniku podziałów pojedynczej komórki).
306
www.postepybiochemii.pl
Podobnie jak podczas prawidłowej embriogenezy i mor-
fogenezy tkanek, tak i podczas formowania sferoidu za-
sadniczą rolę odgrywają właściwości adhezyjne komórek.
Początkowo skupianie komórek zachodzi dzięki oddziały-
waniu integryn obecnych w błonach komórek z białkami
macierzy wydzielanymi przez komórki do pożywki lub
dodawanymi sztucznie jako jej składnik (Ryc. 1) [7]. Włók-
na macierzy międzykomórkowej bogate w motywy RGD
rozpoznawane przez integryny błonowe ułatwiają szybkie
skupianie się rozproszonych komórek. Różnice w zdolno-
ści do agregowania różnych komórek zależą zarówno od
zawartości białek macierzy wydzielanych do pożywki jak
i zawartości integryn w błonach komórek [8]. Przyleganie
komórek do siebie za pośrednictwem integryny α5β1 może
być znacznie silniejsze niż oddziaływania za pośrednic-
twem kadheryn. Ponieważ integryna α5β1 nie wykazuje
oddziaływania homofilowego, łączenie komórek następuje
za pośrednictwem włókien fibronektyny [9]. Aktywacja in-
tegryn na skutek przyłączenia ligandu jakim jest fibronek-
tyna prowadzi do uruchomienia kaskady sygnałowej obej-
mującej kinazy FAK Src, PI3K, RhoA, kinazę Rho (ROCK)
oraz fosforylację lekkiego łańcucha miozyny (MLCK). Ten
ciąg wydarzeń wpływa na aktywność kurczliwą cytoszkie-
letu aktynowego. Dynamiczna reorganizacja cytoszkieletu
aktomiozynowego w odpowiedzi na różnorodne bodźce,
leżąca u podstaw wszystkich zjawisk związanych z ruchli-
wością komórek jest zależna od wiążących GTP białek z
rodziny Rho [10,11]. Komórki rakowe tworzące zbite struk-
tury charakteryzują się wyższą kurczliwością aktomiozyny
w porównaniu do komórek tworzących luźne agregaty.
W sferoidach komórek raka jajnika charakteryzujących się
formowaniem zbitej architektury, ścieżki sygnałowe Rho/
ROCK ulegają aktywacji, prowadząc do nasilenia aktyw-
ności kurczliwej aktomiozyny [11]. W kolejnym etapie do-
chodzi do wzmożonej syntezy kadheryn i stopniowo do
powstania sferoidu o zbitej budowie [7].
Chociaż oddziaływania międzykomórkowe za pośred-
nictwem integryn i kadheryn postrzegane są jako główne
siły decydujące o przyleganiu komórek w sferoidach, inne
struktury komórkowe mają także udział w tworzeniu się
oddziaływań międzykomórkowych. Integralność mecha-
niczną sferoidu zapewniają białka cytoszkieletu, odpowia-
dające za generowanie naprężeń mechanicznych, prze-
noszonych przez wiele komórek w obrębie agregatu [12].
Białka połączeń szczelinowych (komunikacyj-
nych), koneksyny, które dotychczas uważano
jedynie za struktury uczestniczące w komuni-
kacji międzykomórkowej pełnią ważną funk-
cję także w rozpoznawaniu komórek [13].
Krytyczną wielkością sferoidu umożliwia-
jącą przeżycie komórek w jego wnętrzu jest
średnica 500–800 µm [14]. Po przekroczeniu
tego rozmiaru składniki odżywcze i tlen nie
docierają do środka struktury, co skutkuje po-
wstaniem mniej lub bardziej rozległej nekro-
zy centralnej. Martwica wewnętrzna otoczo-
na jest warstwą komórek żywych o grubości
100–300 µm. W zależności od czasu hodowli,
obserwuje się wyraźne różnice w wielkości
komórek sferoidu. Komórki znajdujące się
bliżej środka sferoidu są znacznie mniejsze od komórek
brzeżnych.
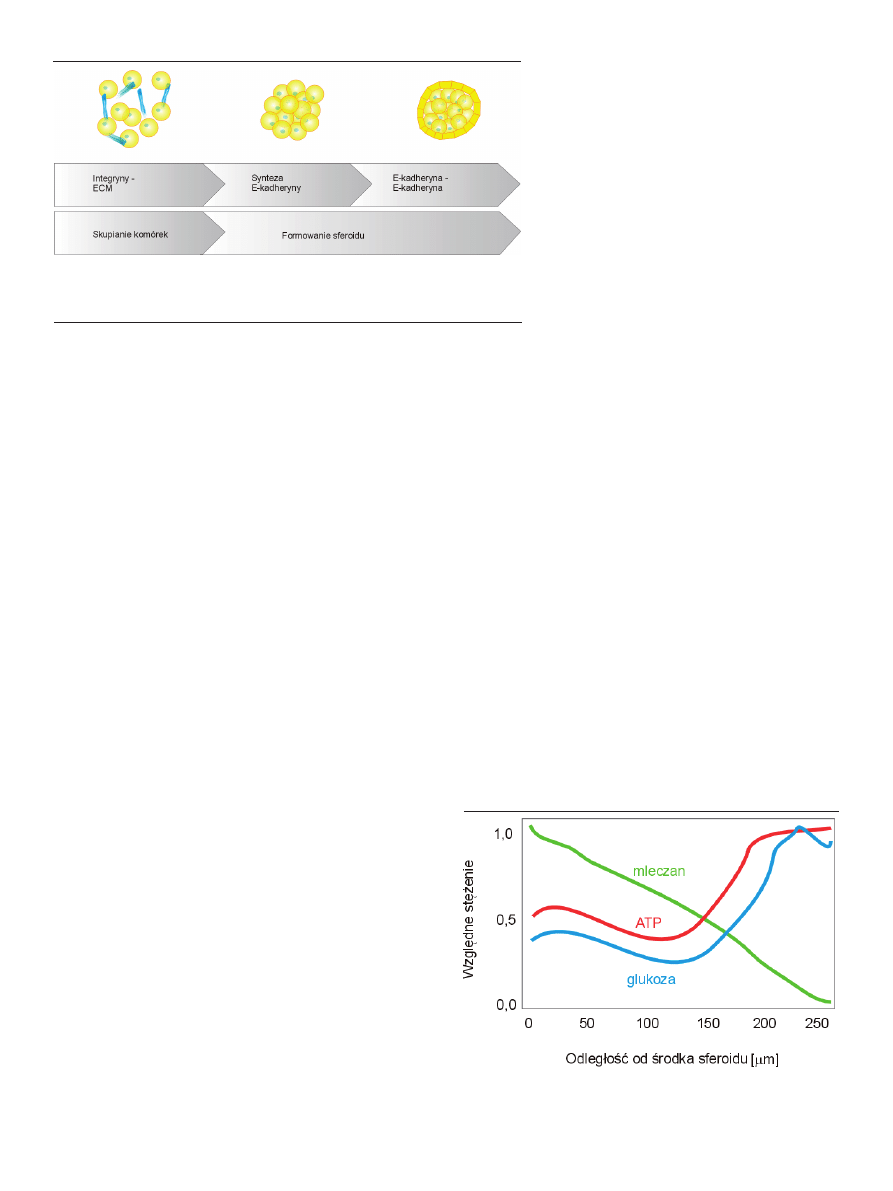
Symulacje komputerowe pokazują rozkład gradientów
stężenia metabolitów (na przykładzie mleczanu), substan-
cji odżywczych (glukozy) oraz energii (ATP) w zależności
od odległości od środka sferoidu (Ryc. 2) [15]. Założenia
teoretyczne oparto na wynikach badań eksperymental-
nych wykonanych za pomocą mikroelektrod, rezonansu
magnetycznego i wskaźników pH. Sferoidy w tym ujęciu
są traktowane jak tkanka nieunaczyniona, w której niefek-
tywny transport dyfuzyjny tlenu i drobnocząsteczkowych
substancji prowadzi do niedoboru substancji odżywczych i
akumulacji metabolitów w centralnej części.
Ukształtowane sferoidy charakteryzują się obecnością
białek macierzy zewnątrzkomórkowej, wydzielanej do
przestrzeni międzykomórkowych, międzykomórkowych
połączeń mechanicznych, takich jak desmosomy i strefy
przylegania (łac. zonula adherens) [12] oraz połączeń szcze-
linowych (komunikacyjnych), umożliwiających bezpośred-
nią sygnalizację między komórkami [16,17]. Lokalne stęże-
nie substancji macierzy zewnątrzkomórkowej, czynników
wzrostowych oraz cytokin wydzielanych przez komórki
nowotworowe sferoidu jest wyższe i dlatego sygnalizacja
parakrynna w tych tworach jest wzmocniona w porówna-
niu do kultur dwuwymiarowych.
Rycina 1. Powstawanie sferoidu. Agregacja komórek zachodzi dzięki oddziaływaniu integryn bło-
nowych z białkami macierzy obecnymi w pożywce. Następnie dochodzi do wzmożenia syntezy E-
-kadheryny, dzięki czemu sferoid przyjmuje coraz bardziej zbitą formę.
Rycina 2. Zależność między stężeniem glukozy (kolor niebieski), ATP (kolor
czerwony) oraz mleczanu (kolor zielony), a odległością od środka sferoidu. Na
podstawie [15].
Postępy Biochemii 59 (3) 2013
307
PRZyKłADy ZASToSoWANIA SfERoIDóW
W bADANIACh PoDSTAWoWyCh
SFEROIDy JAKO MODEL DO BADANIA
KANCEROGENEZy
Wielokomórkowe hodowle sferoidów komórek nowo-
tworowych są dobrym modelem in vitro guzów litych po-
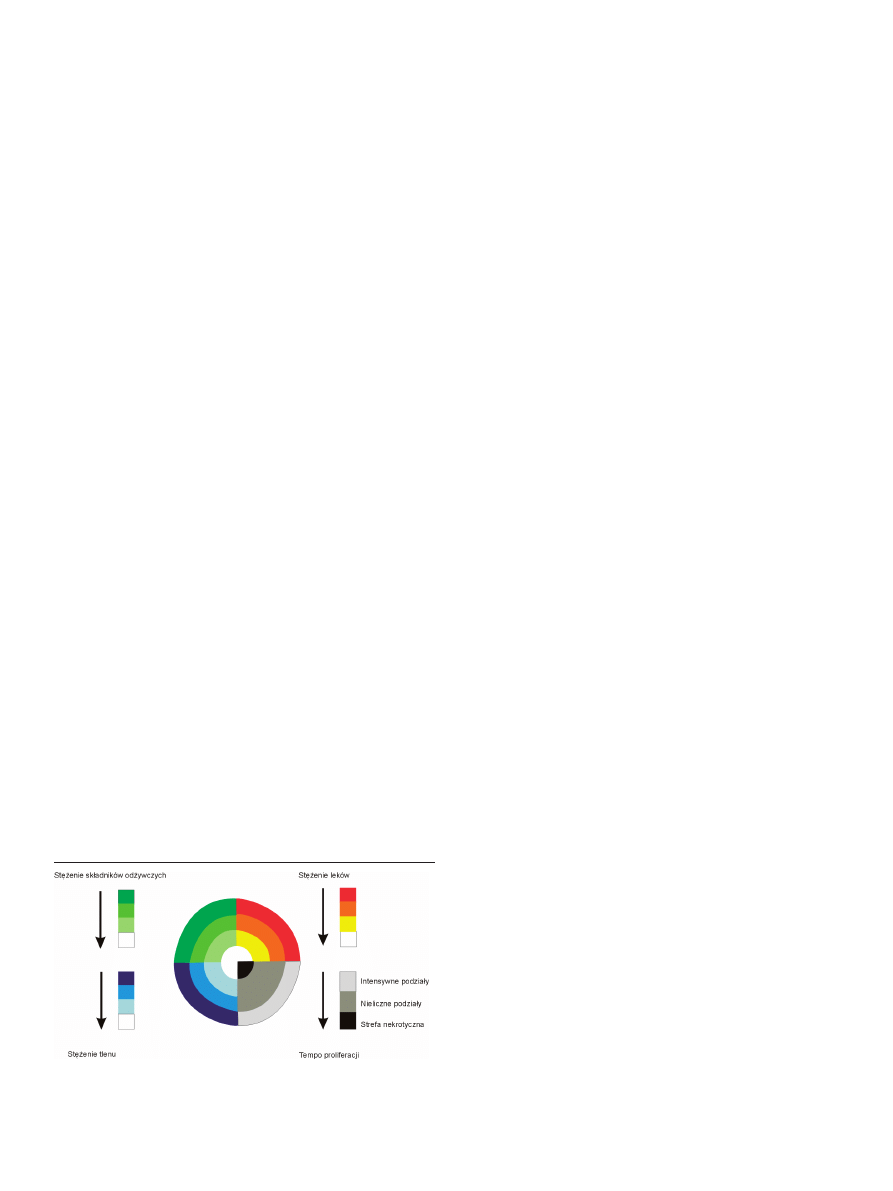
zbawionych naczyń krwionośnych [7]. Gradienty stężeń
związków odżywczych, pH i tlenu, zależne od upakowania
sferoidu sprawiają, że efekty działania chemioterapeuty-
ków są niejednorodne w obrębie struktury (Ryc. 3) [14,18],
a sferoidy odznaczają się podwyższoną opornością na che-
mo- i radioterapię w porównaniu do hodowli dwuwymia-
rowych [19,20]. Dzięki pracy wielu grup badawczych poja-
wiły się w ostatnich kilku latach wiarygodne testy do oceny
efektów biologicznych w sferoidach. Dostosowano do tego
typu hodowli testy oceniające przeżycie komórek, zdolność
do przerzutowania, inwazji, migracji, udoskonalono także
techniki obrazowania [21]. Obecnie, kilkaset artykułów na-
ukowych opisuje sferoidy jako trójwymiarowy model guza
nowotworowego stosowany do oceny wpływu leków czy
radioterapii, badania procesu angiogenezy, zdolności ko-
mórek do inwazji i mikroprzerzutowania, różnicowania
komórek nowotworowych oraz biologii nowotworowych
komórek macierzystych.
SFEROIDy W BADANIACH BIOLOGII
NOWOTWOROWyCH KOMóREK MACIERZySTyCH
Hodowle sferyczne w odróżnieniu od hodowli jedno-
warstwowych, sprzyjają utrzymaniu fenotypu nowotwo-
rowych komórek macierzystych (CSC) [22]. Nowotworowe
komórki macierzyste stanowią subpopulację komórek guza,
o zdolności do samoodnawiania i różnicowania do innych
typów komórek nowotworu. Są także motorem wzrostu no-
wotworu. CSC dzielą się stosunkowo rzadko, z czego wy-
nika ich oporność na działanie cytostatyków. Wiele modeli
doświadczalnych wskazuje, że zawartość nowotworowych
komórek macierzystych w populacji komórkowej koreluje
z przerzutami do węzłów chłonnych oraz skróconym cza-
sem przeżycia zwierząt, u których wykonano przeszczep
komórek nowotworowych. Utrzymywanie fenotypu ma-
cierzystego w komórkach izolowanych z nowotworów jest
ograniczone w hodowli dwuwymiarowej. Podwyższoną
zawartość komórek o charakterze nowotworowych komó-
rek macierzystych obserwuje się w sferoidach otrzymanych
z komórek różnych nowotworów: raka gruczołu krokowe-
go [23], jelita grubego [24], piersi [25] i w glejakach [26]. Co
ciekawe, komórki o takich cechach obserwuje się także w
sferoidach otrzymanych z komórek zarodkowych prawi-
dłowej nerki, a ich zawartość wykazuje dodatnią korelację z
tumorogennością [27].
Dotychczas nie znaleziono uniwersalnego markera, na
podstawie obecności którego można zidentyfikować CSC
każdego nowotworu. W zależności od pochodzenia, mar-
kerem nowotworowych komórek macierzystych mogą być
markery powierzchniowe należące do grupy CD (ang. clu-
ster of differentiation), jak CD133 (ostra białaczka B limfobla-
styczna dzieci; rak jelita grubego, endometrium, wątroby,
płuc, kości, jajnika, trzustki, gruczołu krokowego, mięsak
Ewinga), CD44 (rak piersi, jelita grubego, żołądka, głowy
i szyi, wątroby, jajnika, trzustki, gruczołu krokowego),
enzym cytoprotekcyjny — dehydrogenaza aldehydowa
ALDH (rak piersi, jelita grubego, głowy i szyi, kości) czy
transportery z grupy ABC, pełniące główną rolę w oporno-
ści wielolekowej. Lista markerów nowotworowych komó-
rek macierzystych wciąż się wydłuża.
Podwyższoną zawartość komórek charakteryzujących
się markerami komórek macierzystych obserwuje się za-
równo w sferoidach otrzymanych z komórek izolowanych
z guzów jak i z komórek linii ustalonych, w porównaniu do
hodowli 2D [28-32].
Coraz częściej pojawia się pogląd, że CSC mogą być in-
dukowane przez odpowiednie warunki z komórek bardziej
zróżnicowanych. Badania wskazują, że CSC mogą powsta-
wać z komórek pozbawionych charakteru macierzystego w
procesie określanym jako przejście nabłonkowo-mezenchy-
malne (EMT, ang. epithelial mesenchymal transition) [33-35].
Proces EMT został zaobserwowany w trójwymiarowych
kulturach in vitro komórek nowotworowych [36,37].
Uważa się, że podwyższona zawartość CSC w hodow-
lach sferycznych związana jest z istnieniem we wnętrzu
sferoidu mikrośrodowiska regulującego ich samoodnowę
i różnicowanie, przynajmniej częściowo przypominającego
niszę nowotworowych komórek macierzystych. Obszar ten
charakteryzuje się obecnością substancji macierzy zewnątrz-
komórkowej, czynników wzrostowych i cytokin [38], ma
odpowiednie dla CSC warunki pH i zmniejszoną dostęp-
ność tlenu (hipoksja) [39].
Wiadomo, że warunki hipoksyjne prowadzą do zwięk-
szenia zawartości komórek wykazujących ekspresję CD133
w badanej populacji [40]. Hipoksja zwiększa zdolność ko-
mórek glejaka wykazujących obecność CD133 do samood-
nowy. Utrzymywanie tych komórek w stanie hipoksji przy-
czynia się także do wzrostu zawartości komórek wykazu-
jących obecność innych markerów CSC, takich jak CXCR4
(CD184), i A2B5 oraz niską zawartość CD44 (CD44
low
).
Wzmożona zdolność do samoodnowy tych komórek po-
przedzona jest wzrostem poziomu czynnika transkrypcyj-
nego indukowanego hipoksją 1α (HIF-1α). Hipoksja odgry-
wa kluczową rolę w regulacji fenotypu CSC także poprzez
czynnik transkrypcyjny indukowany przez hipoksję 2α
(HIF-2α) i związaną z nim indukcję syntezę różnych genów
tworzących sygnaturę CSC [41]. Czynniki HIF prowadzą
Rycina 3. Gradienty stężenia tlenu, składników pokarmowych, leków i intensyw-
ność podziałów w dużych sferoidach. Strzałki wskazują malejące wartości.

308
www.postepybiochemii.pl
też do wzmożenia ekspresji genów związanych z procesem
EMT, takich jak Twist1 [42] i oksydaza lizylowa (LOX, ang.
lysyl oxidase) [43].
Powyższe przykłady wskazują, że sferoidy stwarzają
właściwe środowisko dla utrzymywania w hodowli feno-
typu komórek macierzystych, związane przede wszystkim
z hipoksją. Niewątpliwie modelowanie in vitro niszy komó-
rek nowotworowych wymaga dalszego wzbogacenia ukła-
du badawczego i dodanie do hodowli komórek podścieli-
ska. Oddziaływania komórek nienowotworowych z komór-
kami nowotworowymi w sferoidach powstałych w wyniku
kokultury różnych typów komórek zostaną omówione w
kolejnym rozdziale.
SFEROIDy W BADANIACH ODDZIAłyWAń MIęDZy
KOMóRKAMI NOWOTWOROWyMI I PRAWIDłOWyMI
Zastosowanie różnych populacji komórek do tworzenia
sferoidów, na przykład komórek nowotworowych i fibro-
blastów [44], monocytów [45], czy komórek śródbłonko-
wych [46] pozwala otrzymać hodowle naśladujące guz
nowotworowy in vivo pod względem heterogenności ko-
mórkowej. Dzięki kokulturom możliwe jest badanie in vitro
relacji między komórkami nowotworowymi a komórkami
podścieliska, pełniącymi ważne funkcje wydzielnicze i sy-
gnalizacyjne, przyspieszającymi wzrost guza, indukujący-
mi angiogenezę i wpływającymi na przerzutowanie oraz
warunkujące odpowiedź na terapię. Kokultury komórek
nowotworowych i innych typów komórek charakteryzują
się przyspieszonym wzrostem sferoidów i utrzymywaniem
komórek macierzystych w hodowli dzięki sygnalizacji pa-
rakrynnej. Sferoidy otrzymane z komórek meduloblastomy
i ependymomy o wysokiej produkcji CD133, rosnące w ko-
kulturze z pierwotnymi komórkami endotelialnymi osiąga-
ły pięciokrotnie większe rozmiary po 2 tygodniach hodowli
w porównaniu do sferoidów kontrolnych [47]. Obecność
trzustkowych komórek gwiaździstych wydzielających
morfogeny zarodkowe ułatwia powstawanie sferoidów
komórek raka trzustki in vitro oraz ich zdolność do inwazji
[48]. Tworzenie mammosfer w hodowli in vitro, charakte-
ryzujących się wysoką zawartością CSC ułatwia obecność
mezenchymalnych komórek macierzystych wydzielających
substancje sygnałowe [49].
Kokultury komórek nowotworowych z makrofagami lub
komórkami cytotoksycznymi NK pozwalają na badanie ak-
tywności komórek układu odpornościowego i ich zdolności
do migracji pomiędzy komórki nowotworowe [50].
Ciekawym modelem badania inwazyjności komórek
nowotworowych jest hodowla na podłożu powleczonym
kolagenem pary sferoidów, z których jeden złożony jest z
komórek nowotworowych, a drugi z prawidłowych komó-
rek płuc [7]. Czas penetrowania komórek nowotworowych
do sfer utworzonych z komórek prawidłowych jest miarą
ich inwazyjności.
Sferoidy komórek nowotworowych są dobrym mode-
lem do badania procesów angiogenezy zachodzącej w po-
czątkowo nieunaczynionej tkance [51]. Proces formowania
włosowatych struktur z komórek endotelialnych może być
analizowany w sferoidach otrzymanych w wyniku kokultu-
ry komórek linii ludzkiego raka piersi MDA-MB-231, śród-
błonka ludzkiej żyły pępowinowej HUVEC oraz prawidło-
wych ludzkich fibroblastów skóry NHDF. Proces angioge-
nezy może być hamowany za pomocą związków znajdują-
cych się w leczeniu klinicznym lub stymulowany za pomo-
cą odpowiednich czynników wzrostowych. Zastosowanie
tego modelu pozwoliło odkryć nową rolę fibroblastów w
angiogenezie, związaną z wytwarzaniem metaloproteina-
zy MT1-MMP, umożliwiającej wnikanie kapilar pomiędzy
komórki nowotworowe. Model ten, ze względu na wysoką
powtarzalność i łatwość kontroli warunków eksperymen-
talnych, może okazać się niezwykle sprawnym narzędziem
w badaniu procesu angiogenezy w guzie nowotworowym
w warunkach in vitro.
HODOWLA SFEROIDóW Z PRAWIDłOWyCH
KOMóREK MACIERZySTyCH
Ponad 30 lat temu zaobserwowano, że komórki zarod-
kowe izolowane z blastocysty hodowane na warstwie od-
żywczej zbudowanej z mysich fibroblastów zarodkowych
(MEF) z dodatkiem czynnika hamującego białaczkę (LIF,
ang. leukemia inhibitory factor), jako czynnika zapobiegające-
go różnicowaniu zachowują swój potencjał do samoodnowy
i pluripotencjalne właściwości. Brak warstwy odżywczej i
LIF w pożywce prowadzi do spontanicznego agregowania
komórek i powstawania tak zwanych embrioidów, czyli
agregatów, których komórki zdolne są w odpowiednich
warunkach podjąć różnicowanie do różnych typów bardziej
zróżnicowanych komórek. Do otrzymywania embrioidów
stosuje się kolby rotacyjne, technikę wiszącej kropli lub po
prostu płytki bakteryjne o dnie nieprzystosowanym do ho-
dowli adherentnej [52].
W ostatnich kilku dekadach podejmowano próby mno-
żenia mezenchymalnych komórek macierzystych w warun-
kach in vitro w celu wykorzystania ich potencjału regenera-
cyjnego do leczenia różnych urazów i chronicznych chorób.
Komórki mezenchymalne selekcjonuje się w hodowli in vi-
tro dzięki ich zdolności do przylegania do dna plastikowe-
go naczynia. Chociaż komórki te zachowują plastyczność
przez kilka pasaży, ostatecznie tracą swoją zdolność do sa-
moodnowy i ulegają różnicowaniu. Znacznie dłużej można
utrzymywać potencjał macierzysty komórek mezenchymal-
nych w hodowlach sferycznych w porównaniu do tradycyj-
nej hodowli 2D [53].
Podobnie, utrzymywanie potencjału macierzystego ko-
mórek nerwowych jest możliwe dzięki warunkom panują-
cym w hodowli 3D [54]. Komórki o charakterze macierzy-
stym mają tendencje do samoczynnego tworzenia sfer w od-
powiednich pożywkach. Zdolność komórek otrzymanych z
dysypacji sfer do tworzenia kolejnych sfer wykazujących
zróżnicowanie na różne typy komórek jest uważane za wy-
znacznik ich „macierzystości”.
UTRZyMANIE FENOTyPU ZRóżNICOWANEGO
KOMóREK W HODOWLACH SFERyCZNyCH
Komórki utrzymywane w hodowli 3D odróżnia od ko-
mórek w hodowli tradycyjnej zdolność do różnicowania.
Istnieje wiele przykładów pokazujących zarówno utratę fe-
notypu zróżnicowanego komórek w hodowli 2D jak i uzy-

Postępy Biochemii 59 (3) 2013
309
skiwanie bardziej zróżnicowanego fenotypu przez komórki
w hodowli 3D.
Niezwykle ciekawych informacji dotyczących morfoge-
nezy prawidłowej tkanki gruczołowej oraz mechanizmów
związanych z nowotworzeniem dostarcza model sferoidów
utworzonych z nietransformowanych, immortalizowanych
komórek linii MCF-10A, rosnących w środowisku bogatym
w składniki błony podstawowej [55]. Warstwa zewnętrzna
(ściana sferoidu) utworzona jest ze spolaryzowanych komó-
rek nabłonkowych, których powierzchnia szczytowa (api-
kalna) skierowana jest do pozbawionego komórek wnętrza
sferoidu. Wielokomórkowe agregaty powstają z pojedyn-
czych komórek zanurzonych w białkach macierzy w wyniku
podziałów. Po 4–5 dniach w hodowli zewnętrzne komórki
będące w kontakcie z macierzą zewnątrzkomórkową ulega-
ją polaryzacji i zatrzymują swoje podziały, a po 7–8 dniach
komórki znajdujące się we wnętrzu agregatu podejmują
proces apoptozy [56]. Podjęcie apoptozy przez te komórki
zależne jest od białka BIM, które może pełnić funkcję czuj-
nika rozpoznającego czy komórka ma kontakt z podłożem.
Dodatkowo, białko to jest indukowane w warunkach ogra-
niczonej sygnalizacji poprzez naskórkowy czynnik wzrostu
(EGF). Przypuszczalnie brak kontaktu komórek we wnętrzu
agregatu z macierzą i osłabienie sygnalizacji poprzez EGF
w sposób synergistyczny indukuje programowaną śmierć
komórek. Utrata zdolności podejmowania apoptozy przez
komórki wnętrza rozwijającego się pęcherzyka in vivo jest
typową oznaką zmian nowotworowych.
Kluczową role w utrzymywaniu polarności komórek
odgrywa białko p73. Brak tego białka lub występowanie
jego onkogennej formy DNp73 powoduje utratę polarności
komórek i nasilenie procesu przejścia nabłonkowo-
mezenchymalnego [57].
Podobne różnicowanie komórek w hodowli in vitro pole-
gające na tworzeniu światła pęcherzyka obserwuje się przy
użyciu innej nienowotworowej linii nabłonka piersi 3522 S1
[58]. Na uwagę zasługują także procesy różnicowania ob-
serwowane w sferoidach zbudowanych z komórek wywo-
dzących się z ludzkich gruczolaków okrężnicy, które two-
rzą pęcherzykowe struktury, nieobecne w hodowli 2D [59].
Brak zdolności niektórych linii komórkowych do formowa-
nia tego typu spolaryzowanych struktur może odzwiercie-
dlać utratę ich zdolności do różnicowania.
Na poziomie ultrastrukturalnym polarność komórek w
rozwijającym się pęcherzyku MCF10 jest wyrażona apikal-
ną lokalizacją aparatu Golgiego [60]. Po wyciszeniu ekspre-
sji genów białek związanych z utrzymywaniem polarności
komórek, takich jak Scribble i Pard3 komórki nie wykazują
polarności, widocznej jako apikalne umiejscowienie apara-
tu Golgiego. Co ciekawe, badane komórki nowotworowe
(nawet te, które wytwarzają pęcherzyki w hodowli) tak-
że nie wykazują apikalnej lokalizacji aparatu Golgiego, co
wskazuje na brak polarności. Dodatkową cechą komórek
niewykazujących zróżnicowania bazalno-apikalnego jest
brak zdolności do rotacyjnego ruchu. Wpływa to na niepra-
widłowe formowanie macierzy, zwłaszcza na niewłaściwe
odkładanie lamininy i przypuszczalnie ma konsekwencje
dla zdolności komórek do różnicowania [60].
Z pewnością dalsze badania z wykorzystaniem hodowli
in vitro pomogą wyjaśnić różnice w zdolności do różnico-
wania komórek prawidłowych i transformowanych nowo-
tworowo.
Zastosowanie hodowli trójwymiarowej w celu utrzyma-
nia fenotypu zróżnicowanego komórek w hodowli in vitro
jest użyteczne w badaniach funkcji wydzielniczych komó-
rek. Od dawna wiadomo, że większość komórek endokryn-
nych hodowanych w postaci monowarstwy charakteryzuje
się krótkim czasem aktywności hormonalnej, w odróżnie-
niu od hodowli komórek w postaci agregatów. Przykładem
hodowli tego typu są sferoidy wyprowadzone z komórek
szyszynki [61], gonad [62] i przysadki [63]. Utrzymywanie
komórek szyszynki w hodowli trójwymiarowej pozwala
przedłużyć zdolność do sekrecji melatoniny przez 3 tygo-
dnie [61]. Sferoidy otrzymane z komórek gonad mogą słu-
żyć do badania długotrwałego wpływu hormonów i czyn-
ników wzrostu na funkcje wydzielnicze [62]. Sferoidy utwo-
rzone z komórek przysadki mają zastosowanie w badaniach
nad wydzielaniem hormonów gonadotropowych oraz
wpływem hormonów podwzgórza na funkcje wydzielnicze
[63]. Niedawno okazało się, że zarodkowe komórki macie-
rzyste mogą tworzyć w kulturach trójwymiarowych in vitro
strukturę, która po przeszczepieniu do zwierząt doświad-
czalnych jest funkcjonalną przysadką [64]. Funkcje wy-
dzielnicze in vitro udało się także indukować w komórkach
izolowanych ze ślinianek podżuchwowych hodowanych
następnie w postaci sfer. Komórki pozyskane ze sferoidów
wykazywały zdolność do różnicowania w komórki przewo-
dów wyprowadzających oraz w komórki surowicze, produ-
kujące mucynę i amylazę [65].
Okazuje się także, że hodowle trójwymiarowe komórek
wątroby pozwalają na utrzymanie wielu funkcji detoksy-
kacyjnych, zanikających w hodowlach dwuwymiarowych
[66]. Dzięki temu możliwe jest zastąpienie w badaniach
toksykologicznych modeli zwierzęcych modelami komór-
kowymi.
PRZyKłADy ZASToSoWANIA hoDoWlI
TRóJWyMIARoWyCh W INżyNIERII TKANKoWEJ
Podobieństwa strukturalne i funkcjonalne hodowli trój-
wymiarowych i tkanek organizmu dają nadzieję na zasto-
sowanie odpowiednio uformowanych hodowli trójwymia-
rowych jako materiału do rekonstrukcji narządów. Wysił-
ki różnych zespołów skupione są na otrzymaniu hodowli
przestrzennych hepatocytów do wytworzenia sztucznej
biologicznej wątroby (ang. bioartificial liver) [67], kardiomio-
cytow do odbudowy mięśnia sercowego po stanie zawa-
łowym [68,69], osteocytow i chondrocytów do odbudowy
tkanki kostnej i chrzęstnej [70], a także tworzenia sztucznej
skóry [71]. Ponieważ piśmiennictwo dotyczące tworzenia
sztucznej skóry i chrząstki in vitro jest szczególnie obszer-
ne, a wiele artykułów przeglądowych dobrze prezentuje ten
temat w niniejszym artykule postanowiliśmy bliżej przed-
stawić jedynie hodowle trójwymiarowe komórek wątroby i
mięśnia sercowego.

310
www.postepybiochemii.pl
PROJEKT SZTUCZNEJ WąTROBy
Od wielu lat trwają badania nad wytworzeniem urządze-
nia określanego biologiczną sztuczną wątrobą (BAL, ang.
bioartificial liver) do wykorzystania w celu detoksykacji pa-
cjentów oczekujących na przeszczep wątroby [67]. Korzyst-
ne wyniki prób klinicznych pierwszej fazy stymulują dalsze
prace nad poprawą wydajności funkcjonowania aparatu
[72]. Bioreaktory tego typu zawierają warstwowo ułożone
hodowle hepatocytów w łożysku sztucznych włośniczek.
Urządzenie to wymaga dużej ilości żywych i wysoce ak-
tywnych hepatocytów. Najczęściej stosowane są pierwotne
hepatocyty świni. Ograniczeniem wydajności urządzenia
jest jednak utrata funkcji przez komórki utrzymywane w
warunkach, które nie promują różnicowania. Pewne na-
dzieje nad ulepszeniem bioreaktora niesie zastosowanie
trójwymiarowej hodowli hepatocytów, osadzonych w żelu
kolagenowym, wykazujących znacznie wyższą aktywność
wielu specyficznych dla wątroby enzymów w porównaniu
do hepatocytów rosnących w monowarstwie [73]. Wyniki
te wskazują potencjalną możliwość zastąpienia w projekcie
BAL hodowli monowarstwowej przez hodowlę trójwymia-
rową [67].
KARDIOSFERy JAKO źRóDłO KOMóREK DO
REGENERACJI MIęŚNIA SERCOWEGO
Hodowle sferyczne znajdują także zastosowanie w kar-
diologii eksperymentalnej. Wyniki badań ostatniej dekady
obalają obraz serca jako organu postmitotycznego, ukazu-
jąc, że przez całe życie człowieka podlega ono intensywnej
regeneracji, której nieodłącznie towarzyszą podziały ko-
mórkowe [74,75]. Odkrycie to stanowiło podstawę do pod-
jęcia próby wykorzystania technik inżynierii tkankowej do
odbudowy miokardium uszkodzonego na skutek zawału.
Procedura otrzymywania sferoidów z komórek sercowych
polega na pozyskaniu niewielkiej ilości nieuszkodzonego
miokardium na drodze biopsji i przeprowadzeniu kilkueta-
powej hodowli in vitro, w wyniku której uzyskuje się tak
zwane kardiosfery [76]. Są to heterogenne struktury komór-
kowe, wzbogacone w unikalne dla serca komórki macie-
rzyste (ang. Cardiac Stem Cells). Komórki te charakteryzują
się zdolnością do samoodtwarzania, wykazują potencjał
klonogenny oraz posiadają zdolność do różnicowania w
trzy podstawowe klasy komórek tworzących funkcjonalne
miokardium: kardiomiocyty, komórki mięśni gładkich na-
czyń i komórki śródbłonka [77]. Kardiosfery utworzone są
z różnorodnych populacji sercowych komórek progenito-
rowych i prekursorowych na różnym etapie zróżnicowania
oraz mezenchymalnych komórek macierzystych. Opisane
klasy wspomagają funkcje właściwych sercowych komórek
macierzystych i pomagają im zachować niezróżnicowany
fenotyp [78].
Wewnętrzna część kardiosfery wzbogacona jest w ko-
mórki wykazujące silną proliferację i równocześnie ekspre-
sję markerów macierzystości, wśród których najczęściej wy-
różnianymi są c-kit (CD117), sca-1 oraz CD34. Peryferyczne
części kardiosfery zbudowane są z komórek znajdujących
się w różnym stadium różnicowana w typy histologiczne
charakterystyczne dla miokardium i wykazujących syntezę
markerów takich jak troponina I, ANP (ang. atrial natriuretic
peptide) i CD31. Poprzez tworzenie specyficznego mikro-
środowiska wewnątrz sfery, przede wszystkim warunków
hipoksyjnych, jak również poprzez tworzenie bezpośred-
nich oddziaływań z komórkami macierzystymi (połączenia
komunikacyjne z udziałem koneksyny 43), komórki pery-
feryczne zapewniają warunki niezbędne dla podtrzymania
niezróżnicowanego fenotypu komórek macierzystych znaj-
dujących się wewnątrz kardiosfery [79].
Po wszczepieniu do serca pacjenta autologicznych ko-
mórek tworzących w hodowli in vitro kardiosferę komórki
macierzyste serca wbudowują się w pobliżu uszkodzonego
miokardium, po czym, dzięki intensywnym podziałom i
towarzyszącemu im różnicowaniu, odbudowują jego struk-
turę. Opublikowane wyniki prób klinicznych pozwalają
przypuszczać, iż techniki wykorzystujące komórki macie-
rzyste serca poprawiają wydolność tego organu, zwiększa-
jąc komfort i długość życia osób cierpiących na komplikacje
pozawałowe [68,69].
METoDy oTRZyMyWANIA SfERoIDóW
HODOWLE ROTACyJNE
Jedną z metod otrzymywania sferoidów jest hodowla
zawiesiny komórek w butelce z mieszadłem (Ryc. 4A). W
tych warunkach komórki nie mogą przyczepiać się do pod-
łoża, zaczynają agregować i tworzyć sferoidy. Jest to jedna z
najprostszych metod uzyskania sferoidów na większą ska-
lę. Zdecydowaną wadą tej metody jest długi czas hodow-
li, znaczne różnice w rozmiarach powstałych sferoidów i
mechaniczne niszczenie komórek. Odmianą tej metody jest
system rotacyjnej hodowli komórkowej, wykorzystujący
urządzenie, w którym kolba hodowlana obraca się wokół
osi poziomej. Symulowanie mikrograwitacji przy mini-
malnych siłach hydrodynamicznych sprawia, że komórki
zawiesiny nie są niszczone. System ten pozwala na otrzy-
Rycina 4. Metody otrzymywania sferoidów w hodowlach zawiesinowych. A.
Kultura w butelce z mieszadłem. Komórki poddane mieszaniu skupiają się two-
rząc sferoidy; B. Kultura na podłożu pokrytym gęstą siatką o właściwościach
przeciwadhezyjnyh. Komórki mogą poruszać się po podłożu, jednak nie mogą
się do niego przyczepiać, co prowadzi do ich agregowania; C. Przyspieszone
tworzenie sferoidów dzięki ułatwionemu skupianiu komórek na nanowłóknach
polimerowych PLGA; D. Metoda wiszącej kropli. Komórki zawiesiny komórko-
wej tworzą sferoidy na skutek grawitacyjnego opadania na dół wiszącej kropli.
Krople zawiesiny komórkowej naniesione są na wieczko standardowej płytki
hodowlanej (górny schemat) lub do specjalnych wkładek w płytkach wielodoł-
kowych (dolny schemat).

Postępy Biochemii 59 (3) 2013
311
mywanie sferoidów o stosunkowo dużych rozmiarach i
mniejszym zróżnicowaniu morfologicznym w porównaniu
do sferoidów pochodzących z kolby z mieszadłem.
HODOWLA NA PODłOżU NIEADHEZyJNyM
Równie prostą metodą otrzymywania sferoidów jest ho-
dowla komórek w naczyniu o dnie pokrytym materiałem
nieadhezyjnym (ang. Liquid overlay), na przykład agarem,
agarozą lub różnego rodzaju polimerami syntetycznymi
[80-82]. Przykładem materiału zastosowanego do pokrycia
komercyjnie dostępnych płytek w celu zapobiegania adhe-
zji komórek jest obojętny hydrożel, a płytki te są dostępne
pod nazwą płytki o nadzwyczaj słabej przyczepności (ang.
ultra-low attachment plates).
Za pomocą tej metody wiele linii komórkowych ulega
spontanicznej agregacji, jednak powstałe sferoidy są zróż-
nicowane pod względem kształtu i rozmiaru. Zastosowanie
płytek wielodołkowych o wklęsłym lub stożkowym dnie
pokrytym polimetakrylanem 2-hydroksyetylu (PHEMA)
pozwala otrzymać pojedyncze sferoidy o jednakowych
rozmiarach i morfologii [82]. Płytki z zawiesiną komórek
poddaje się wirowaniu i po 24 godzinach w każdym doł-
ku formują się sferoidy. Czas hodowli jest krótki, jednak
w przypadku wielu typów komórek konieczne jest doda-
nie do pożywki białek macierzy zewnątrzkomórkowej, aby
powstałe agregaty miały postać okrągłych, zwartych sfero-
idów o równych i jednolitych brzegach.
Odmianą metody liquid overlay jest zastosowanie na dnie
naczyń hodowlanych specjalnej siatki po której komórki mi-
grują [83]. Dostępne są płytki w formacie wielodołkowym,
pokryte polimerowymi siatkami o okach w kształcie kwa-
dratów lub sześciokątów, produkowane przez firmę Scivax
(Ryc. 4B). Komórki mogą migrować po siatce, jednak nie
mogą przyczepiać się do podłoża, przez co oddziaływania
międzykomórkowe powodują agregowanie komórek.
Należy dodać, że niektóre komórki tworzą sferoidy w po-
żywce pozbawionej surowicy, zawierającej specjalny doda-
tek B27 i czynniki wzrostowe, takie jak fibroblastowy czyn-
nik wzrostu, bFGF i naskórkowy czynnik wzrostu, EGF.
Taka pożywka jest rutynowo stosowana do otrzymywania
neurosfer (agregatów komórek nerwowych), mammosfer
(agregatów komórek nabłonka piersi) i sferoidów komórek
raka jajnika, charakteryzujących się wysoką zawartością ko-
mórek macierzystych, CSC.
ZASTOSOWANIE DODATKU NANOWłóKIEN
POLIMEROWyCH DO ZAWIESINy KOMóRKOWEJ
Ciekawym rozwiązaniem sprzyjającym agregowaniu ko-
mórek w zawiesinie jest dodanie do pożywki nanowłókien
zbudowanych z biodegradowalnego oraz biokompatybil-
nego kopolimeru kwasu mlekowego i kwasu glikolowego
(PLGA) [84] (Ryc. 4C). Po 12 godzinach hodowli można
zaobserwować agregowanie komórek na nanonitkach poli-
merowych i stopniowe powstawanie sferoidów. Wydajność
tworzenia sferoidów w tej metodzie jest znacznie wyższa
w porównaniu do zawiesiny pozbawionej włókien PLGA.
Czynnikiem ułatwiającym formowanie sferoidów jest ad-
sorbowanie na powierzchni nanowłókien fibronektyny po-
chodzącej z surowicy, co sprzyja przyłączaniu komórek.
METODA WISZąCEJ KROPLI
W ostatnich latach ponownie zainteresowano się metodą
wiszącej kropli, jako sposobem otrzymywania hodowli sfe-
rycznych (Ryc. 4D) [85]. W najprostszym wydaniu polega
ona na naniesieniu kropli zawiesiny komórek na wewnętrz-
ną stronę pokrywki płytki hodowlanej. Po odwróceniu
płytki krople utrzymywane są dzięki napięciu powierzch-
niowemu, a mikrograwitacja powoduje skupianie komó-
rek na dole kropli. Metoda ta pozwala uzyskać w krótkim
czasie dużą liczbę sferoidów o jednorodnych rozmiarach,
nie wymaga użycia skomplikowanej aparatury i przede
wszystkim jest tania. Metoda charakteryzuje się prawie
100% wydajnością, z jednej wiszącej kropli powstaje jeden
sferoid o równych brzegach (obserwacje własne autorów).
Przepustowość metody można zwiększyć stosując specjalne
płytki hodowlane (Ryc. 4D), dostępne w formacie 96 lub 384
otworowym, ułatwiające wymianę pożywki. Płytki te pro-
dukowane są przez InSphero oraz Biomatrix.
OTRZyMyWANIE SFEROIDóW NA RUSZTOWANIACH
Bardzo popularnym typem rusztowań są żele białkowe
lub peptydowe, w których zawieszone są komórki. żele
tego typu mogą być utworzone z kolagenu [86], mieszaniny
białek macierzy zewnątrzkomórkowej określanej jako Ma-
trigel [87,88] lub nanowłókien powstałych dzięki samozło-
żeniu syntetycznych oligopeptydow tworzących hydrożel
[89,90]. Niekiedy hydrożele stosuje się jako dodatek obniża-
jący lepkość pożywek i tym samym ułatwiający skupianie
komórek w agregaty. Technologia ta jest zastosowana w
dodatku HappyCell (ASM) i jest rozwiązaniem pośrednim
między kulturą zawiesinową a rusztowaniem żelowym.
Często do otrzymywania sferoidów stosowane są ruszto-
wania o charakterze gąbki. Trójwymiarowa geometria rusz-
towania sprawia, że znajdujące się w nim komórki mogą
wchodzić w kontakt z innymi komórkami w przestrzeni.
Gąbki tego typu wykonane są z materiałów syntetycznych
lub naturalnych, takich jak na przykład polistyren [91], algi-
nian [92], kompozyty kolagenu z chitozanem, glikozamino-
glikanami lub elastyną [93] i innymi dodatkami.
Niekiedy powierzchnie kontaktu z komórkami pokrywa-
ne są dodatkowo białkami macierzy lub peptydami zawie-
rającymi motywy RGD [94].
W przypadku zastosowania prefabrykowanych gąbek
zawiesinę komórek wylewa się do dołków, na których
dnie umieszczone są krążki o porach wielkości od 100 do
500 uM. Pory wypełniane są przez dzielące komórki za-
wiesiny wylanej na gąbkę i stopniowo tworzące hodowle
trójwymiarowe.
PoDSuMoWANIE
Możliwość odtwarzania i modyfikowania oddziaływań
międzykomórkowych w układzie modelowym, jakim jest
hodowla in vitro pozwala na znacznie lepsze i szybsze zro-

312
www.postepybiochemii.pl
zumienie procesów biologicznych zachodzących podczas
nowotworzenia i różnicowania w organizmie. Trójwymia-
rowe hodowle in vitro stanowią kompromis między trady-
cyjnymi hodowlami dwuwymiarowymi, zapewniającymi
łatwy dostęp do materiału biologicznego i wysokoprzepu-
stowy format doświadczeń, ale słabo oddającymi warunki
w tkankach, a hodowlami fragmentów pierwotnych tkanek
czy organów, które co prawda stanowią model dobrze od-
twarzający rzeczywiste warunki, w jakich komórki znajdu-
ją się in vivo, jednak nie znajdują szerokiego zastosowania
ponieważ wycinki tkanek szybko obumierają w hodowli, a
dostęp do nich jest ograniczony. Równocześnie, wraz z roz-
wojem technik hodowli 3D otwierają się nowe możliwości
dla inżynierii tkankowej, przede wszystkim w dziedzinie
rekonstrukcji narządów, ponieważ kultury 3D zapewniają
optymalne warunki dla różnicowania tkanek in vitro.
PIśMIENNICTWo
1. Pampaloni F, Reynaud EG, Stelzer EH (2007) The third dimension
bridges the gap between cell culture and live tissue. Nat Rev Mol Cell
Biol 8: 839-845
2. Petersen OW, Ronnov-Jessen L, Howlett AR, Bissell MJ (1992) Interac-
tion with basement membrane serves to rapidly distinguish growth
and differentiation pattern of normal and malignant human breast
epithelial cells. Proc Natl Acad Sci USA 89: 9064-9068
3. Bissell MJ (1981) The differentiated state of normal and malignant cells
or how to define a “normal” cell in culture. Int Rev Cytol 70: 27-100
4. Sutherland RM, McCredie JA, Inch WR (1971) Growth of multicell
spheroids in tissue culture as a model of nodular carcinomas. J Natl
Cancer Inst 46: 113-120
5. Sutherland RM, Inch WR, McCredie JA, Kruuv J (1970) A multi-com-
ponent radiation survival curve using an in vitro tumour model. Int J
Radiat Biol Relat Stud Phys Chem Med 18: 491-495
6. Sutherland RM, Durand RE (1976) Radiation response of multicell
spheroids — an in vitro tumour model. Curr Top Radiat Res Q 11: 87-
139
7. Lin RZ, Chang Hy (2008) Recent advances in three-dimensional multi-
cellular spheroid culture for biomedical research. Biotechnol J 3: 1172-
1184
8. Lin RZ, Chou LF, Chien CC, Chang Hy (2006) Dynamic analysis of
hepatoma spheroid formation: roles of E-cadherin and beta1-integrin.
Cell Tissue Res 324: 411-422
9. Robinson EE, Zazzali KM, Corbett SA, Foty RA (2003) Alpha5beta1
integrin mediates strong tissue cohesion. J Cell Sci 116: 377-386
10. Klopocka W, Baranska J (2005) The role of Rho family proteins in con-
trolling the migration of crawling cells. Postepy Biochem 51: 36-43
11. Sodek KL, Ringuette MJ, Brown TJ (2009) Compact spheroid forma-
tion by ovarian cancer cells is associated with contractile behavior and
an invasive phenotype. Int J Cancer 124: 2060-2070
12. Salvatori L, Caporuscio F, Verdina A, Starace G, Crispi S, Nicotra MR,
Russo A, Calogero RA, Morgante E, Natali PG, Russo MA, Petrange-
li E (2012) Cell-to-cell signaling influences the fate of prostate cancer
stem cells and their potential to generate more aggressive tumors.
PLoS One 7: e31467
13. Bao B, Jiang J, yanase T, Nishi y, Morgan JR (2011) Connexon-media-
ted cell adhesion drives microtissue self-assembly. FASEB J 25: 255-264
14. Walenta S, Doetsch J, Mueller-Klieser W, Kunz-Schughart LA (2000)
Metabolic imaging in multicellular spheroids of oncogene-transfected
fibroblasts. J Histochem Cytochem 48: 509-522
15. Milotti E, Chignola R (2010) Emergent properties of tumor microenvi-
ronment in a real-life model of multicell tumor spheroids. PLoS One 5:
e13942
16. Westhoff MA, Zhou S, Bachem MG, Debatin KM, Fulda S (2008) Iden-
tification of a novel switch in the dominant forms of cell adhesion-me-
diated drug resistance in glioblastoma cells. Oncogene 27: 5169-5181
17. Cottin S, Ghani K, de Campos-Lima PO, Caruso M (2010) Gemcitabine
intercellular diffusion mediated by gap junctions: new implications for
cancer therapy. Mol Cancer 9: 141
18. Hirschhaeuser F, Menne H, Dittfeld C, West J, Mueller-Klieser W,
Kunz-Schughart LA (2010) Multicellular tumor spheroids: an undere-
stimated tool is catching up again. J Biotechnol 148: 3-15
19. Dufau I, Frongia C, Sicard F, Dedieu L, Cordelier P, Ausseil F, Ducom-
mun B, Valette A (2012) Multicellular tumor spheroid model to evalu-
ate spatio-temporal dynamics effect of chemotherapeutics: application
to the gemcitabine/CHK1 inhibitor combination in pancreatic cancer.
BMC Cancer 12: 15
20. Khaitan D, Chandna S, Arya MB, Dwarakanath BS (2006) Establish-
ment and characterization of multicellular spheroids from a human
glioma cell line; Implications for tumor therapy. J Transl Med 4: 12
21. Vinci M, Gowan S, Boxall F, Patterson L, Zimmermann M, Court W,
Lomas C, Mendiola M, Hardisson D, Eccles SA (2012) Advances in es-
tablishment and analysis of three-dimensional tumor spheroid-based
functional assays for target validation and drug evaluation. BMC Biol
10: 29
22. Robertson FM, Ogasawara MA, ye Z, Chu K, Pickei R, Debeb BG, Wo-
odward WA, Hittelman WN, Cristofanilli M, Barsky SH (2010) Ima-
ging and analysis of 3D tumor spheroids enriched for a cancer stem
cell phenotype. J Biomol Screen 15: 820-829
23. Rybak AP, He LZ, Kapoor A, Cutz JC, Tang D (2011) Characteriza-
tion of sphere-propagating cells with stem-like properties from DU145
prostate cancer cells. Biochim Biophys Acta 1813: 683-694
24. Wei B, Han Xy, Qi CL, Zhang S, Zheng ZH, Huang y, Chen TF, Wei
HB (2012) Coaction of spheroid-derived stem-like cells and endothe-
lial progenitor cells promotes development of colon cancer. PLoS One
7: e39069
25. Ponting C, Jackson AP (2005) Evolution of primary microcephaly ge-
nes and the enlargement of primate brains. Curr Opin Genet Dev 15:
241-248
26. Pellegatta S, Poliani PL, Corno D, Menghi F, Ghielmetti F, Suarez-Me-
rino B, Caldera V, Nava S, Ravanini M, Facchetti F, Bruzzone MG, Fi-
nocchiaro G (2006) Neurospheres enriched in cancer stem-like cells are
highly effective in eliciting a dendritic cell-mediated immune response
against malignant gliomas. Cancer Res 66: 10247-10252
27. Debeb BG, Zhang X, Krishnamurthy S, Gao H, Cohen E, Li L, Rodrigu-
ez AA, Landis MD, Lucci A, Ueno NT, Robertson F, Xu W, Lacerda L,
Buchholz TA, Cristofanilli M, Reuben JM, Lewis MT, Woodward WA
(2010) Characterizing cancer cells with cancer stem cell-like features in
293T human embryonic kidney cells. Mol Cancer 9: 180
28. Fang DD, Kim yJ, Lee CN, Aggarwal S, McKinnon K, Mesmer D,
Norton J, Birse CE, He T, Ruben SM, Moore PA (2010) Expansion of
CD133(+) colon cancer cultures retaining stem cell properties to enable
cancer stem cell target discovery. Br J Cancer 102: 1265-1275
29. Saadin K, White IM (2013) Breast cancer stem cell enrichment and iso-
lation by mammosphere culture and its potential diagnostic applica-
tions. Expert Rev Mol Diagn 13: 49-60
30. Guttilla IK, Phoenix KN, Hong X, Tirnauer JS, Claffey KP, White BA
(2012) Prolonged mammosphere culture of MCF-7 cells induces an
EMT and repression of the estrogen receptor by microRNAs. Breast
Cancer Res Treat 132: 75-85
31. yeung TM, Gandhi SC, Wilding JL, Muschel R, Bodmer WF (2010)
Cancer stem cells from colorectal cancer-derived cell lines. Proc Natl
Acad Sci USA 107: 3722-3727
32. Qi L, Bellail AC, Rossi MR, Zhang Z, Pang H, Hunter S, Cohen C, Mo-
reno CS, Olson JJ, Li S, Hao C (2011) Heterogeneity of primary gliobla-
stoma cells in the expression of caspase-8 and the response to TRAIL-
-induced apoptosis. Apoptosis 16: 1150-1164
33. May CD, Sphyris N, Evans KW, Werden SJ, Guo W, Mani SA (2011)
Epithelial-mesenchymal transition and cancer stem cells: a dangero-
usly dynamic duo in breast cancer progression. Breast Cancer Res 13:
202
34. Polyak K, Weinberg RA (2009) Transitions between epithelial and
mesenchymal states: acquisition of malignant and stem cell traits. Nat
Rev Cancer 9: 265-273

Postępy Biochemii 59 (3) 2013
313
35. Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou Ay, Brooks M,
Reinhard F, Zhang CC, Shipitsin M, Campbell LL, Polyak K, Brisken
C, yang J, Weinberg RA (2008) The epithelial-mesenchymal transition
generates cells with properties of stem cells. Cell 133: 704-715
36. Chen C, Wei y, Hummel M, Hoffmann TK, Gross M, Kaufmann AM,
Albers AE (2011) Evidence for epithelial-mesenchymal transition in
cancer stem cells of head and neck squamous cell carcinoma. PLoS
One 6: e16466
37. Giarnieri E, De Vitis C, Noto A, Roscilli G, Salerno G, Mariotta S, Ricci
A, Pierdonato B, Russo G, Laurenzi A, Giovagnoli MR, Ciliberto G,
Mancini R (2013) EMT markers in lung adenocarcinoma pleural effu-
sion spheroid cells. J Cell Physiol 228: 1720-1726
38. Borovski T, De Sousa EMF, Vermeulen L, Medema JP (2011) Cancer
stem cell niche: the place to be. Cancer Res 71: 634-639
39. Lock FE, McDonald PC, Lou y, Serrano I, Chafe SC, Ostlund C, Apari-
cio S, Winum Jy, Supuran CT, Dedhar S (2012) Targeting carbonic an-
hydrase IX depletes breast cancer stem cells within the hypoxic niche.
Oncogene
40. Soeda A, Park M, Lee D, Mintz A, Androutsellis-Theotokis A, McKay
RD, Engh J, Iwama T, Kunisada T, Kassam AB, Pollack IF, Park DM
(2009) Hypoxia promotes expansion of the CD133-positive glioma
stem cells through activation of HIF-1alpha. Oncogene 28: 3949-3959
41. Seidel S, Garvalov BK, Wirta V, von Stechow L, Schanzer A, Meletis K,
Wolter M, Sommerlad D, Henze AT, Nister M, Reifenberger G, Lunde-
berg J, Frisen J, Acker T (2010) A hypoxic niche regulates glioblastoma
stem cells through hypoxia inducible factor 2 alpha. Brain 133: 983-995
42. yang MH, Wu MZ, Chiou SH, Chen PM, Chang Sy, Liu CJ, Teng SC,
Wu KJ (2008) Direct regulation of TWIST by HIF-1alpha promotes me-
tastasis. Nat Cell Biol 10: 295-305
43. Schietke R, Warnecke C, Wacker I, Schodel J, Mole DR, Campean V,
Amann K, Goppelt-Struebe M, Behrens J, Eckardt KU, Wiesener MS
(2010) The lysyl oxidases LOX and LOXL2 are necessary and sufficient
to repress E-cadherin in hypoxia: insights into cellular transformation
processes mediated by HIF-1. J Biol Chem 285: 6658-6669
44. Osterholm C, Barczyk MM, Busse M, Gronning M, Reed RK, Kusche-
-Gullberg M (2009) Mutation in the heparan sulfate biosynthesis enzy-
me EXT1 influences growth factor signaling and fibroblast interactions
with the extracellular matrix. J Biol Chem 284: 34935-34943
45. Ksiazkiewicz M, Gottfried E, Kreutz M, Mack M, Hofstaedter F, Kunz-
-Schughart LA (2010) Importance of CCL2-CCR2A/2B signaling for
monocyte migration into spheroids of breast cancer-derived fibrobla-
sts. Immunobiology 215: 737-747
46. Ho DN, Kohler N, Sigdel A, Kalluri R, Morgan JR, Xu C, Sun S (2012)
Penetration of endothelial cell coated multicellular tumor spheroids by
iron oxide nanoparticles. Theranostics 2: 66-75
47. Calabrese C, Poppleton H, Kocak M, Hogg TL, Fuller C, Hamner B,
Oh Ey, Gaber MW, Finklestein D, Allen M, Frank A, Bayazitov IT, Za-
kharenko SS, Gajjar A, Davidoff A, Gilbertson RJ (2007) A perivascular
niche for brain tumor stem cells. Cancer Cell 11: 69-82
48. Lonardo E, Frias-Aldeguer J, Hermann PC, Heeschen C (2012) Pancre-
atic stellate cells form a niche for cancer stem cells and promote their
self-renewal and invasiveness. Cell Cycle 11: 1282-1290
49. Klopp AH, Lacerda L, Gupta A, Debeb BG, Solley T, Li L, Spaeth E,
Xu W, Zhang X, Lewis MT, Reuben JM, Krishnamurthy S, Ferrari M,
Gaspar R, Buchholz TA, Cristofanilli M, Marini F, Andreeff M, Wo-
odward WA (2010) Mesenchymal stem cells promote mammosphere
formation and decrease E-cadherin in normal and malignant breast
cells. PLoS One 5: e12180
50. Gottfried E, Kunz-Schughart LA, Andreesen R, Kreutz M (2006) Brave
little world — Spheroids as an in vitro model to study tumor-immune-
-cell interactions. Cell Cycle 5: 691-695
51. Correa de Sampaio P, Auslaender D, Krubasik D, Failla AV, Skepper
JN, Murphy G, English WR (2012) A heterogeneous in vitro three di-
mensional model of tumour-stroma interactions regulating sprouting
angiogenesis. PLoS One 7: e30753
52. Kurosawa H (2007) Methods for inducing embryoid body formation:
in vitro differentiation system of embryonic stem cells. J Biosci Bioeng
103: 389-398
53. Baraniak PR, McDevitt TC (2012) Scaffold-free culture of mesenchy-
mal stem cell spheroids in suspension preserves multilineage poten-
tial. Cell Tissue Res 347: 701-711
54. Kornblum HI (2007) Introduction to neural stem cells. Stroke 38: 810-
816
55. Debnath J, Muthuswamy SK, Brugge JS (2003) Morphogenesis and
oncogenesis of MCF-10A mammary epithelial acini grown in three-
-dimensional basement membrane cultures. Methods 30: 256-268
56. Mailleux AA, Overholtzer M, Brugge JS (2008) Lumen formation du-
ring mammary epithelial morphogenesis: insights from in vitro and in
vivo models. Cell Cycle 7: 57-62
57. Zhang y, yan W, Jung yS, Chen X (2012) Mammary epithelial cell po-
larity is regulated differentially by p73 isoforms via epithelial-to-me-
senchymal transition. J Biol Chem 287: 17746-17753
58. Plachot C, Chaboub LS, Adissu HA, Wang L, Urazaev A, Sturgis J,
Asem EK, Lelievre SA (2009) Factors necessary to produce basoapical
polarity in human glandular epithelium formed in conventional and
high-throughput three-dimensional culture: example of the breast epi-
thelium. BMC Biol 7: 77
59. Verayannont P, Hagg U, Wong RW, McGrath C, yeung S (2010) Asses-
sment of maxillary position. Implant vs cephalometric methods. Angle
Orthod 80: 876-883
60. Wang H, Lacoche S, Huang L, Xue B, Muthuswamy SK (2013) Rota-
tional motion during three-dimensional morphogenesis of mammary
epithelial acini relates to laminin matrix assembly. Proc Natl Acad Sci
USA 110: 163-168
61. Khan NA, Shacoori V, Havouis R, Querne D, Moulinoux JP, Rault B
(1995) Three dimensional culture of pineal cell aggregates: a model of
cell-cell co-operation. J Neuroendocrinol 7: 353-359
62. Gregoraszczuk EL (1990) The advantage of the aggregate culture of
isolated ovarian cell types over the monolayer culture. Cytotechnolo-
gy 4: 195-200
63. Shacoori V, Saiag B, Girre A, Rault B (1995) Stimulatory effect of perhe-
xiline maleate on the basal and LHRH-stimulated luteinizing hormone
release from rat pituitary cell aggregates in vitro. Res Commun Mol
Pathol Pharmacol 87: 115-123
64. Suga H, Kadoshima T, Minaguchi M, Ohgushi M, Soen M, Nakano T,
Takata N, Wataya T, Muguruma K, Miyoshi H, yonemura S, Oiso y,
Sasai y (2011) Self-formation of functional adenohypophysis in three-
-dimensional culture. Nature 480: 57-62
65. Lombaert IM, Brunsting JF, Wierenga PK, Faber H, Stokman MA, Kok
T, Visser WH, Kampinga HH, de Haan G, Coppes RP (2008) Rescue
of salivary gland function after stem cell transplantation in irradiated
glands. PLoS One 3: e2063
66. Ma M, Xu J, Purcell WM (2003) Biochemical and functional changes
of rat liver spheroids during spheroid formation and maintenance in
culture: I. morphological maturation and kinetic changes of energy
metabolism, albumin synthesis, and activities of some enzymes. J Cell
Biochem 90: 1166-1175
67. Chamuleau RA (2009) Future of bioartificial liver support. World J Ga-
strointest Surg 1: 21-25
68. Bolli R, Chugh AR, D’Amario D, Loughran JH, Stoddard MF, Ikram S,
Beache GM, Wagner SG, Leri A, Hosoda T, Sanada F, Elmore JB, Go-
ichberg P, Cappetta D, Solankhi NK, Fahsah I, Rokosh DG, Slaughter
MS, Kajstura J, Anversa P (2011) Cardiac stem cells in patients with
ischaemic cardiomyopathy (SCIPIO): initial results of a randomised
phase 1 trial. Lancet 378: 1847-1857
69. Makkar RR, Smith RR, Cheng K, Malliaras K, Thomson LE, Berman D,
Czer LS, Marban L, Mendizabal A, Johnston PV, Russell SD, Schuleri
KH, Lardo AC, Gerstenblith G, Marban E (2012) Intracoronary cardio-
sphere-derived cells for heart regeneration after myocardial infarction
(CADUCEUS): a prospective, randomised phase 1 trial. Lancet 379:
895-904
70. Tortelli F, Cancedda R (2009) Three-dimensional cultures of osteoge-
nic and chondrogenic cells: a tissue engineering approach to mimic
bone and cartilage in vitro. Eur Cell Mater 17: 1-14

314
www.postepybiochemii.pl
Three-dimensional cell cultures. Applications
in basic science and biotechnology
Radosław Kitel
1
, Joanna Czarnecka
1
, Aleksandra Rusin
2,
1
Department of Organic Chemistry, Bioorganic Chemistry and Biotechnology, Faculty of Chemistry, Silesian Technical University, 4 Krzywo-
ustego St., 44-100 Gliwice, Poland
2
Center for Translational Research and Molecular Biology of Cancer, Maria Sklodowska-Curie Memorial Cancer Center and Institute of Oncolo-
gy, Branch Gliwice, ul. Wybrzeze AK 15, 44-100 Gliwice, Poland
e-mail: arusin@io.gliwice.pl
Key words: 3D culture, three-dimensional culture, spheroids
AbSTRACT
The tissue culture technique is widely used in biochemical and molecular studies, offering accessibility to biological material, high reproduc-
ibility of results and high throughput format, comparing with organ cultures. however, traditional, two-dimensional cultures (2D cultures)
poorly represent the microenvironment of a tissue, and they are gradually replaced with 3D cultures, that enable formation of intercellular
contacts, signaling pathways and gene expression characteristic for tissue
in vivo. This paper presents the biology of three-dimensional cul-
tures (spheroids), their applications in basic science and biotechnology and methods of spheroids formation.
71. Brohem CA, Cardeal LB, Tiago M, Soengas MS, Barros SB, Maria-En-
gler SS (2011) Artificial skin in perspective: concepts and applications.
Pigment Cell Melanoma Res 24: 35-50
72. yu CB, Pan XP, Li LJ (2009) Progress in bioreactors of bioartificial li-
vers. Hepatobiliary Pancreat Dis Int 8: 134-140
73. Kim y, Rajagopalan P (2010) 3D hepatic cultures simultaneously ma-
intain primary hepatocyte and liver sinusoidal endothelial cell pheno-
types. PLoS One 5: e15456
74. Kajstura J, Rota M, Cappetta D, Ogorek B, Arranto C, Bai yN, Fer-
reira-Martins J, Signore S, Sanada F, Matsuda A, Kostyla J, Caballero
MV, Fiorini C, D’Alessandro DA, Michler RE, del Monte F, Hosoda T,
Perrella MA, Leri A, Buchholz BA, Loscalzo J, Anversa P (2012) Car-
diomyogenesis in the aging and failing human heart. Circulation 126:
1869-U1238
75. Kajstura J, Gurusamy N, Ogorek B, Goichberg P, Clavo-Rondon C,
Hosoda T, D’Amario D, Bardelli S, Beltrami AP, Cesselli D, Bussani
R, del Monte F, Quaini F, Rota M, Beltrami CA, Buchholz BA, Leri A,
Anversa P (2010) Myocyte turnover in the aging human heart. Circu-
lation Res 107: 1374-1386
76. Smith RR, Barile L, Cho HC, Leppo MK, Hare JM, Messina E, Gia-
comello A, Abraham MR, Marban E (2007) Regenerative potential of
cardiosphere-derived cells expanded from percutaneous endomy-
ocardial biopsy specimens. Circulation 115: 896-908
77. Leri A, Kajstura J, Anversa P (2011) Role of cardiac stem cells in cardiac
pathophysiology: a paradigm shift in human myocardial biology. Cir-
culation Res 109: 941-961
78. Davis DR, Zhang y, Smith RR, Cheng K, Terrovitis J, Malliaras K, Li
TS, White A, Makkar R, Marban E (2009) Validation of the cardiosphe-
re method to culture cardiac progenitor cells from myocardial tissue.
PLoS One 4: e7195
79. Loughran JH, Elmore JB, Waqar M, Chugh AR, Bolli R (2012) Cardiac
stem cells in patients with ischemic cardiomyopathy: discovery, trans-
lation, and clinical investigation. Curr Atheroscler Rep 14: 491-503
80. Ho Wy, yeap SK, Ho CL, Rahim RA, Alitheen NB (2012) Development
of multicellular tumor spheroid (MCTS) culture from breast cancer cell
and a high throughput screening method using the MTT assay. PLoS
One 7: e44640
81. Kunz-Schughart LA, Schroeder JA, Wondrak M, van Rey F, Lehle K,
Hofstaedter F, Wheatley DN (2006) Potential of fibroblasts to regulate
the formation of three-dimensional vessel-like structures from endo-
thelial cells in vitro. Am J Physiol Cell Physiol 290: C1385-1398
82. Ivascu A, Kubbies M (2006) Rapid generation of single-tumor sphe-
roids for high-throughput cell function and toxicity analysis. J Biomol
Screen 11: 922-932
83. yoshii y, Waki A, yoshida K, Kakezuka A, Kobayashi M, Namiki H,
Kuroda y, Kiyono y, yoshii H, Furukawa T, Asai T, Okazawa H, Ge-
lovani JG, Fujibayashi y (2011) The use of nanoimprinted scaffolds as
3D culture models to facilitate spontaneous tumor cell migration and
well-regulated spheroid formation. Biomaterials 32: 6052-6058
84. Shin Jy, Park J, Jang HK, Lee TJ, La WG, Bhang SH, Kwon IK, Kwon
OH, Kim BS (2012) Efficient formation of cell spheroids using polymer
nanofibers. Biotechnology Lett 34: 795-803
85. Foty R (2011) A simple hanging drop cell culture protocol for genera-
tion of 3D spheroids. J Vis Exp 51: pii: 2720, doi: 10.3791/2720
86. Meng D, Erol M, Boccaccini AR (2010) Processing technologies for 3D
nanostructured tissue engineering scaffolds. Advanced Biomaterials
12: B467-B487
87. Harma V, Virtanen J, Makela R, Happonen A, Mpindi JP, Knuuttila M,
Kohonen P, Lotjonen J, Kallioniemi O, Nees M (2010) A comprehen-
sive panel of three-dimensional models for studies of prostate cancer
growth, invasion and drug responses. PLoS One 5: e10431
88. Sodunke TR, Turner KK, Caldwell SA, McBride KW, Reginato MJ,
Noh HM (2007) Micropatterns of Matrigel for three-dimensional epi-
thelial cultures. Biomaterials 28: 4006-4016
89. Nagai y, yokoi H, Kaihara K, Naruse K (2012) The mechanical stimu-
lation of cells in 3D culture within a self-assembling peptide hydrogel.
Biomaterials 33: 1044-1051
90. Nagayasu A, yokoi H, Minaguchi JA, Hosaka yZ, Ueda H, Takehana
K (2012) Efficacy of self-assembled hydrogels composed of positively
or negatively charged peptides as scaffolds for cell culture. J Biomater
Appl 26: 651-665
91. Knight E, Murray B, Carnachan R, Przyborski S (2011) Alvetex(R): po-
lystyrene scaffold technology for routine three dimensional cell cultu-
re. Methods Mol Biol 695: 323-340
92. Ahn SH, Lee HJ, Puetzer J, Lawrence J, Geun B, Kim H (2012) Fabrica-
tion of cell-laden three-dimensional alginate-scaffolds with an aerosol
cross-linking process. J Mater Chem. 22: 18735-18740
93. Parenteau-Bareil R, Gauvin R, Berthod F (2010) Collagen-Based Bio-
materials for Tissue Engineering Applications. Materials 3: 1863-1887
94. Danesin R, Brun P, Roso M, Delaunay F, Samouillan V, Brunelli K,
Iucci G, Ghezzo F, Modesti M, Castagliuolo I, Dettin M (2012) Self-
assembling peptide-enriched electrospun polycaprolactone scaffolds
promote the h-osteoblast adhesion and modulate differentiation-asso-
ciated gene expression. Bone 51: 851-859
Wyszukiwarka
Podobne podstrony:
I CSK 305 10 1 id 208211 Nieznany
I CSK 305 10 1 id 208211 Nieznany
304 305 id 34716 Nieznany
314 315 id 35089 Nieznany
314 326 id 35090 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron