Postępy Biochemii 58 (3) 2012
353
Joanna Trojanek
*
Zakład Mikrobiologii i Immunologii Kli-
nicznej, Instytut „Pomnik-Centrum Zdrowia
Dziecka”, Warszawa
*
Zakład Mikrobiologii i Immunologii
Klinicznej,
Instytut
„Pomnik-Centrum
Zdrowia Dziecka”, Al. Dzieci Polskich 20,
04-730 Warszawa; tel: (22) 815 71 67, e-mail:
trojanekj@yahoo.com; j. trojanek@czd.pl
Artykuł otrzymano 13 lutego 2012 r.
Artykuł zaakceptowano 20 czerwca 2012 r.
Słowa kluczowe: macierz zewnątrzkomórko-
wa, metaloproteinazy macierzy zewnątrzko-
mórkowej, inhibitory tkankowe metaloprote-
inaz, przebudowa, zwłóknienie, układ MMP/
TIMP
Wykaz skrótów: ECM (ang. extracellular ma-
trix) — macierz zewnątrzkomórkowa; MMP
(ang. matrix metalloproteinase) — metalopro-
teinaza macierzy; ROS (ang. reactive oxygen
species) — reaktywne formy tlenu; TIMP (ang.
tissue inhibitor of metalloproteinase) — tkankowy
inhibitor metaloproteinaz; TNF-α (ang. tu-
mor necrosis factor alpha) — czynnik martwicy
nowotworów; MT-MMP (ang. membrane-type
matrix metalloproteinase) — metaloproteinaza
macierzy typu błonowego
Podziękowania: Praca powstała w trakcie
realizacji projektu badawczego 2011/01/B/
NZ6/02661 finansowanego ze środków przy-
znanych przez Narodowe Centrum Nauki.
Metaloproteinazy macierzy zewnątrzkomórkowej i ich tkankowe inhibitory
STRESZCZENIE
M
etaloproteinazy macierzy zewnątrzkomórkowej (MMP), zwane inaczej matryksyna-
mi, są to endoproteinazy, które degradując białkowe składniki macierzy zewnątrzko-
mórkowej (ECM) powodują jej odnowę i przebudowę. W ten sposób zachowują właściwą
strukturę macierzy zewnątrzkomórkowej oraz błony podstawnej, zarówno podczas proce-
sów fizjologicznych, jak i patologicznych. Zmiany w strukturze ECM towarzyszą procesom
fizjologicznym, takim jak embriogeneza, angiogeneza, apoptoza oraz rozwój i odbudowa
tkanki łącznej. W warunkach fizjologicznych, aktywność MMP jest regulowana na poziomie
transkrypcji, aktywacji prekursorowych zymogenów proMMP i oddziaływań z endogen-
nymi inhibitorami (TIMP, tkankowe inhibitory metaloproteinaz). Zaburzenia równowagi
w układzie MMP/TIMP wpływają na rozwój wielu chorób, między innymi nowotworów,
zwłóknień, zapalenia stawów, chorób sercowo-naczyniowych, neurologicznych i autoimmu-
nologicznych. W publikacji opisano typy metaloproteinaz, ich strukturę, funkcje i sposoby
regulacji aktywności oraz endogenne inhibitory MMP.
WPROWADZENIE
Metaloproteinazy macierzy zewnątrzkomórkowej (matryksyny) są to cynko-
wo-zależne białka o funkcji endoproteaz, wykazujące działanie degradujące i
destabilizujące składniki macierzy zewnątrzkomórkowej oraz błony podstaw-
nej, będącej wyspecjalizowaną formą macierzy zewnątrzkomórkowej. MMP
trawiąc białka macierzy, likwidują strukturalne bariery tworząc przestrzeń
umożliwiającą migrację komórek na przykład układu odpornościowego oraz
zmieniają aktywność wielu cząsteczek sygnałowych, jak czynniki wzrostu,
cytokiny i chemokiny. Zmiany dotyczące przebudowy ECM towarzyszą pro-
cesom fizjologicznym, takim jak embriogeneza, angiogeneza, apoptoza, rozwój
kości, szkliwa zębów i systemu nerwowego, gojenie się ran, naprawa uszko-
dzeń rdzenia kręgowego, przebudowa endometrium w cyklu miesięcznym
oraz rozwój i implantacja zarodka podczas ciąży [1-9]. Oprócz uczestnictwa w
procesach fizjologicznych, metaloproteinazy odgrywają również istotną rolę w
etiologii i przebiegu stanów zapalnych, chorób nowotworowych, dysplazjach
kości, dystrofiach mięśniowych, miażdżycy, zawałach mięśnia sercowego, tęt-
niakach, nadciśnieniu, w chorobach autoimmunologicznych, degeneracyjnych,
reumatoidalnym zapaleniu stawów (RZS), stwardnieniu rozsianym, schorze-
niach neurologicznych oraz w przewlekłej obturacyjnej chorobie płuc (POChP)
[10-17]. Metaloproteinazy macierzy zidentyfikowano u ptaków, płazów (proces
metamorfozy): ropuchy afrykańskiej (Xenopus laevis), ryb: Danio pręgowanego
(Danio rerio, ang. zebrafish), owadów: muszki owocowej (Drosophila melanogaster)
i bezkręgowców: jeżowca (Paracentrotus lividus), nicienia (Caenorhabditis elegant)
oraz stułbi (Hydra vulgaris). Ich homologi opisano także u alg i niektórych gatun-
ków roślin, jak rzodkiewnik (Arabidopsis thaliana), ogórek (Cucumis sativus), soja
(Glycine max), tytoń (Nicotiana tabacum) czy sosna (Pinus taeda) [18,19]. Większość
MMP, w tym także metaloproteinazy błonowe jest wydzielana przez komórki
i wykazuje aktywność w środowisku zewnątrzkomórkowym. Jednak enzymy
te pełnią funkcję również we wnętrzu komórki: w jądrze, cytoplazmie oraz w
organellach komórkowych [20].
BUDOWA I KLASYFIKACJA MMP
U człowieka zidentyfikowano 23 różne metaloproteinazy oraz 24 kodujące je
geny, gdyż MMP-23 jest kodowana przez 2 identyczne geny zlokalizowane na
chromosomie 1. Jako endopeptydazy zewnątrzkomórkowe lub błonowe, meta-
loproteinazy są enzymami wielodomenowymi, ale wszystkie zawierają peptyd
sygnałowy, prodomenę i domenę katalityczną, z miejscem aktywnym zawiera-
jącym jon cynku (Ryc. 1).

354
www.postepybiochemii.pl
Domena katalityczna, odpowiada za aktywność prote-
olityczną enzymu. Na poziomie drugorzędowej struktury
białka domena ta składa się z pięciu struktur β oraz trzech
helis α. Zawiera dwa jony cynku (katalityczy i strukturalny)
oraz od jednego do czterech jonów wapnia Ca
2+
. W katali-
tycznym centrum aktywnym jon cynku jest koordynowany
przez trzy reszty histydyny, obecne w obrębie sekwencji:
HEXXHXXGXXH [21].
Domena hemopeksynowa zawdzięcza swoją nazwę po-
dobieństwu sekwencji do hemopeksyny, białka wiążące-
go i transportującego hem. Metaloproteinazy MMP-7, 23
i 26 nie zawierają tej domeny, natomiast MMP-12 traci ją
krótko po aktywacji, lecz bez wpływu na aktywność [22].
Niekiedy domena ta jest istotna do prawidłowego rozpo-
znania substratu, natomiast w podrodzinie kolagenaz jest
niezbędna w procesie proteolizy kolagenu. Ważną funkcją
domeny hemopeksynowej jest zdolność do wiązania tkan-
kowego inhibitora metaloproteinaz TIMP przez MMP-9,
a także aktywacja proMMP-2. Jony wapnia, sodu i chloru
występujące niekiedy w pozycji centralnej tej domeny bio-
rą prawdopodobnie udział w stabilizacji enzymu [23]. W
przypadku metaloproteinazy MMP-9 domena hemopek-
synowa uczestniczy w tworzeniu charakterystycznych dla
tej metaloproteinazy form dimerów, tj. homo- i heterodi-
merów [24].
Domena katalityczna jest połączona z domeną hemo-
peksynową poprzez elastyczny łącznik zbudowany z 15-65
reszt aminokwasowych. Jego zasadniczą funkcją jest utrzy-
mywanie stabilnej struktury cząsteczki enzymu, ale także
udział w wiązaniu i degradacji niektórych substratów me-
taloproteinaz, na przykład kolagenu.
Trzy powtórzenia fibronektyny typu II umiejscowione w
samym środku domeny katalitycznej, wzmacniają wiązanie
substratu przez żelatynazy, co prowadzi do efektywnej de-
gradacji kolagenu typu IV, elastyny, i żelatyny, natomiast
nie mają wpływu na proces hydrolizy małych peptydów.
Powtórzenia te są również istotne dla aktywności kolagenaz
[25].
Białka MMP wykazują dużą zmienność na poziomie
struktury czwartorzędowej. Zmienność ta wynika z różnic
w budowie podjednostek, co wpływa na ich właściwości.
Ze względu na specyficzność substratową oraz mechanizm
działania, metaloproteinazy można podzielić na cztery pod-
stawowe klasy (istotna jest klasyfikacja numeryczna).
Kolagenazy: MMP-1 (Kolagenaza I, śródmiąższowa, in.
fibroblastowa); MMP-8 (Kolagenaza II, in. neutrofilowa) i
MMP-13 (Kolagenaza III) degradują kolagen typu I, II, III,
VII, VIII, X, żelatynę, IL-1b, L-selektynę, proteoglikany,
proMMP-2, proMMP-9 i fibronektynę.
Żelatynazy: MMP-2 (in. Żelatynaza A lub neutrofilowa)
i MMP-9 (Żelatynaza B) degradują kolagen typu IV, V, VII,
IX, fibronektynę, proteoglikany, plazminogen, działają sy-
nergistycznie z kolagenazami.
Stromielizyny/matrylizyny: MMP-3 (Stromielizyna 1,
Tranzyna); MMP-10 (Stromielizyna 2) i MMP-11 (Stromie-
lizyna 3) trawią kolagen błony podstawnej, proteoglikany
i glikoproteiny macierzy zewnątrzkomórkowej; natomiast
MMP-7 (Matrylizyna 1, in. PUMP-1) i MMP-26 (Matrylizy-
na 2) degradują kolagen typu I i IV, żelatynę, lamininę, ela-
stynę, fibronektynę, proteoglikany, pro-MMP, pro-TNFα,
E-kadhedrynę.
Metaloproteinazy typu błonowego MT-MMP (ang. mem-
brane-type matrix metalloproteinases) charakteryzujące się wy-
stępowaniem C-końcowej domeny transbłonowej, utrzy-
mującej enzym w strukturze błony komórkowej. Do grupy
tej należą: MT1-MMP (MMP-14), która degraduje kolagen
typu I, II III, żelatynę, fibronektynę, lamininę, witronekty-
nę, proteoglikany, pro-MMP-2 i pro-MMP-13; MT2-MMP
(MMP-15), MT3-MMP (MMP-16), MT4-MMP (MMP-17)
oraz MT5-MMP (MMP-24), które aktywują pro-MMP-2;
MT6-MMP (MMP-25), która degraduje żelatynę [26]. Nie-
które z tych enzymów (MT4- i MT6-MMP) są zakotwiczone
w błonie poprzez glikozylofosfatydyloinozytol (GPI) [27].
Pozostałe metaloproteinazy nie zaliczone do powyższych
grup, tj. metaloelastazę MMP-12, Kolagenazę 4 (MMP-18),
Rycina 1. Budowa domenowa metaloproteinaz rozpuszczalnych (cytoplazma-
tycznych) i błonowych. PS — peptyd sygnałowy, Pro — propeptyd, Katalityczna
— domena katalityczna, Zn — miejsce wiązania cynku, Hpx — domena hemo-
peksynowa, Fn II — domena zawierająca powtórzenia podobne do fibronektyny
typu II, F — miejsce wrażliwe na furynę, Vn — domena podobna do witronekty-
ny, TB — domena transbłonowa, C — domena cytoplazmatyczna, GPI — domena
„zakotwiczająca” w błonie przez glikozylofosfatydyloinozytol, Cys — sekwencja
bogata w reszty cysteiny, Ig — domena podobna do immunoglobuliny.

Postępy Biochemii 58 (3) 2012
355
MMP-19, -21, -27 oraz epilizynę MMP-28 sklasyfikowano
jako „inne” (Tab. 1).
Specyficzność substratowa metaloproteinaz nie jest w
pełni poznana. Domena hemopeksynowa warunkuje wyso-
kie powinowactwo wiązania tych enzymów z większością
składników ECM: fibronektyny, witronektyny, lamininy,
plazminogenu oraz kolagenu typu I-X i XIV. Degradacja
tych substratów w niektórych stanach patologicznych pro-
wadzi do uszkodzenia błony podstawnej naczyń krwio-
nośnych i w konsekwencji migracji komórek śródbłonka
[27,28]. Oprócz białek macierzy zewnątrzkomórkowej, me-
taloproteinazy degradują także inne struktury powierzch-
niowe komórek, tj. białka adhezyjne, mediatory apoptozy,
receptory, chemokiny, cytokiny, czynniki wzrostu, prote-
azy, białka połączeń międzykomórkowych i białka struk-
turalne [26], a także inhibitory proteaz serynowych i inne
metaloproteinazy regulując w ten sposób ich aktywność
[29,30]. Najbardziej znanymi i powszechnie używanymi do
badań in vitro substratami MMP są kazeina i żelatyna, czyli
zdenaturowany pod wpływem wysokiej temperatury kola-
gen. Synteza i aktywność metaloproteinaz macierzy podle-
ga ścisłej kontroli (regulacji) i zachodzi na wielu poziomach:
aktywacji enzymu, lokalizacji w komórce, transkrypcji oraz
oddziaływań ze swoistymi endogennymi inhibitorami [20].
AKTYWACJA MMP I EKSPRESJA
KODUJĄCYCH JE GENÓW
Większość syntetyzowanych de novo metaloproteinaz
występuje w postaci enzymatycznie nieaktywnych czą-
steczek prekursorowych, tzw. zymogenów (pro-MMP). W
odcinku N-końcowym wykazują one obecność propeptydu
o masie cząsteczkowej od 9–20 kD (w zależności od typu
metaloproteinazy) [23,25]. Propeptyd ten (in. prodomena)
składa się z trzech α helis połączonych elastycznymi pętla-
mi narażonymi na autoproteolizę. W przypadku MMP-1
oraz MMP-2 rejon hydrolizy znajduje się między pierwszą
i drugą helisą. Za trzecią helisą znajduje się zachowana w
ewolucji sekwencja zwana „przełącznikiem cysteinowym”
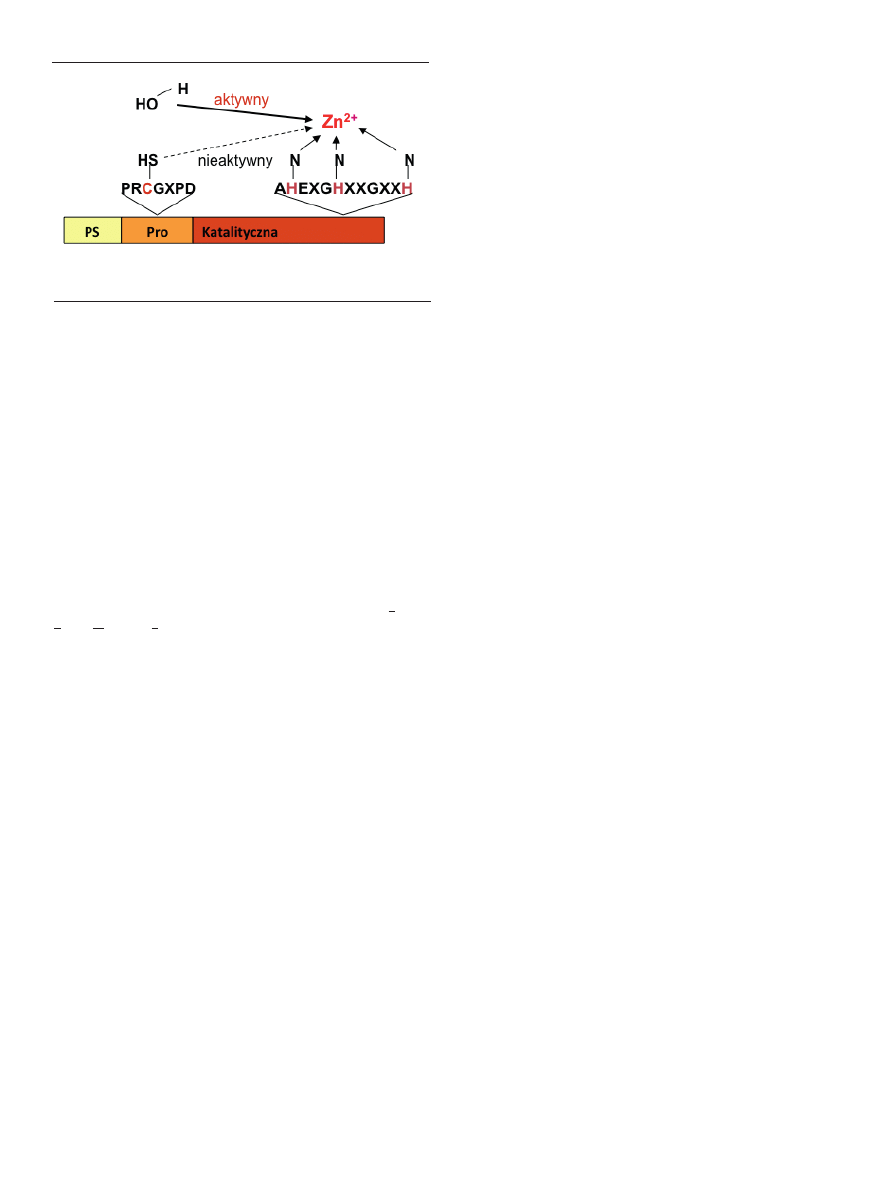
(PRCGXPD), która utrzymuje MMP w formie zymogenu.
Jedynie MMP-23 nie posiada tej sekwencji.
Propeptyd utrzymuje enzym w postaci nieaktywnej
przez oddziaływanie reszty cysteiny z tego fragmentu z
ugrupowaniem cynku w miejscu aktywnym enzymu. Prze-
Tabela 1. Metaloproteinazy macierzy zewnątrzkomórkowej.
Klasa
Nazwa
zwyczajowa
Numer MMP
Substrat
— kolagen
Inne substraty
Piśmiennictwo
Kolagenazy
kolagenaza
śródmiąższowa
kolagenaza
neutrofilowa
kolagenaza
śródmiąższowa
MMP-1
MMP-8
MMP-13
I, II, III, VII,
VIII, X
I, II, III, V,
VII, VIII, X
I, II, III, IV,
V, VII, IX, X
żelatyna, MMP-2, -9, proteoglikany,
fibronektyna, laminina, pro TNFa
żelatyna, fibronektyna, proteoglikany,
ADAMTS-1, proMMP-8
żelatyna, laminina, proteoglikany,
fibrinogen, proMMP-9, -13
[43]
[66]
[67]
Żelatynazy
żelatynaza A
żelatynaza B
MMP-2
MMP-9
I, II, III, IV,
V,VII,X,XI
III, IV V,
VII, X,XI
żelatyna, fibronektyna, laminina, elastyna, proMMP-9,
-13, IGFBPs, IL-1β, TGF-β, α1-antyproteinaza
żelatyna, elastyna, laminina, fibronektyna,
witronektyna, CXCL5, IL-1β, TGF-β, plazminogen
[28,37,51]
[24,28,51]
Stromielizyny/
Matrylizyny
stromielizyna 1
stromielizyna 2
stromielizyna 3
matrylizyna 1
matrylizyna 2
MMP-3
MMP-10
MMP-11
MMP-7
MMP-26
III, IV, V, VII,
IX, X, XI
I, III. IV,
V, IX, X
IV
I, IV
I, IV
żelatyna, fibronektyna, laminina proMMP-1, -7, -8, -9,
-13, proTNFα, E-kadheryna, L-selektyna,tenaktyna
żelatyna, laminina, kazeina, MMP-
1, -8, fibronektyna, proteoglikany
żelatyna, fibronektyna, laminina
żelatyna, laminina, elastyna, fibronektyna,
proteoglikany, proMMPs, proTNFα, E-kadheryna
żelatyna, laminina, elastyna, fibronektyna,
proteoglikany, proMMPs, proTNFα, E-kadheryna
[13]
[68]
[69]
[35]
[39]
Metaloproteinazy
błonowe
MT1-MMP
MT2-MMP
MT3-MMP
MT4-MMP
MT5-MMP
MT6-MMP
MMP-14
MMP-15
MMP-16
MMP-17
MMP-24
MMP-25
I, II, III
żelatyna, fibronektyna, laminina, witronektyna,
proteoglikany, proMMP-2 i proMMP-13
proMMP-2
proMMP-2
proMMP-2
proMMP-2
żelatyna
[2]
[70]
[71,72]
[73]
[74]
[75]
Inne
metaloproteinazy
metaloelastaza
makrofagowa
kolagenaza 4
Xenopus
RASI-1
epilizyna
MMP-12
MMP-18
MMP-19
MMP-21,
-27
MMP-28
IV
I
IV
elastyna, fibronektyna, żelatyna,
proteoglikany, plazminogen
żelatyna
elementy błon podstawnych
żelatyna
żelatyna, kazeina autokataliza
proTNF-β
[17,59]
[76]
[77]
[78]
[78]
356
www.postepybiochemii.pl
kształcenie prekursora do aktywnego enzymu, czyli proces
aktywacji polega na całkowitej zmianie konformacji czą-
steczki w wyniku proteolitycznego odszczepienia sekwen-
cji propeptydu i odsłonięcia centrum aktywnego. Proces ten
zachodzi dzięki działaniu proteaz serynowych (trypsyny,
chymotrypsyny), plazminy, elastazy, a także innych MMP
(-1, -2, -8, -9), aktywatora plazminogenu lub konwertazy
pro-hormonu, furyny [31]. Grupa tiolowa -SH reszty cyste-
inylowej propeptydu oddziałuje z jonem Zn
2+
w centrum
aktywnym utrzymując proenzym w stanie nieaktywnym
(Ryc. 2). Reszta kwasu glutaminianowego w obrębie se-
kwencji trójhistydynowej (HEXXHXXGXXH) w domenie
katalitycznej aktywuje związaną z Zn
2+
cząsteczkę wody,
która jest niezbędna dla aktywności MMP [32].
Proteolityczna aktywacja MMP następuje także pod
wpływem działania wielu czynników niespecyficznych,
jak: octan 4-aminofenylortęciowy (APMA, ang. p-amino-
phenylmercuric acetate), chlorek rtęci, utleniony glutation,
N-etylomaleimid, SDS, aktywne związki tlenu, niskie pH
lub podwyższona temperatura [12,23]. Tlenek azotu może
aktywować pro-MMP-9 w czasie udaru niedokrwiennego
mózgu przez działanie grup tiolowych w reszcie cysteiny
i tworzenia pochodnych S-nitrozylowanych, co sugeruje
chemiczną aktywację pro-MMP in vivo [12]. Warunki środo-
wiska (temperatura, obecność jonów lub detergentów) oraz
typ czynnika indukującego (enzymatyczny lub chemiczny)
kształtują stan równowagi między aktywacją i degradacją
MMP. Niektóre czynniki proteolityczne (MT1-MMP lub
APMA) selektywnie wpływają na aktywność enzymatycz-
ną MMP-2 i siłę wiązania enzymu z inhibitorem [20].
Pro-MMP-2 nie jest bezpośrednio aktywowany przez
proteinazy. Aktywacja zachodzi na powierzchni komórki
przy udziale MT1-MMP i TIMP-2. Pro-MMP-2 tworzy silny
kompleks z TIMP-2 poprzez oddziaływanie domeny hemo-
peksynowej z C-końcową domeną inhibitora, która nie ma
bezpośrednio udziału w hamowaniu. Jednocześnie na po-
wierzchni komórki TIMP-2 wiąże się z błonową formą MT1-
-MMP poprzez wolną N-końcową domenę inhibitorową.
Przyłączona do powierzchni komórki pro-MMP-2 jest na-
stępnie aktywowana przez MT1-MMP lub jeżeli MT1-MMP
jest hamowany przez TIMP-2, to działa jako „receptor” dla
pro-MMP-2. Kompleks: MT1-MMP-TIMP-2-proMMP-2
jest następnie prezentowany najbliższemu wolnemu MT1-
-MMP do aktywacji. Dwie cząsteczki MT1-MMP oddziałują
ze sobą na powierzchni komórki poprzez domeny hemo-
peksynowe, tworząc tetrameryczny kompleks aktywacyjny:
pro-MMP-2-TIMP-2-2MT1-MMP, z czego jedna cząsteczka
MT1-MMP działa jako receptor kompleksu: proMMP-2-
TIMP-2, a druga jako aktywator proMMP-2 [33].
Aktywacja MMP zachodzi także przy udziale systemu
aktywatora plazminogenu PAS (ang. Plasminogen Activa-
tor System). System PAS składa się z dwóch aktywatorów
plasminogenu (PA), urokinazy (uPA) oraz aktywatora typu
tkankowego (tPA). PAS indukuje przejście plazminogenu
do postaci aktywnej proteinazy serynowej, plazminy. Pla-
zmina działa bezpośrednio, przez proteolizę składników
macierzy ECM — fibronektyny i proteoglikanów oraz po-
średnio, aktywując inne proteazy (przez trawienie ich pro-
domen), między innymi MMP-3, MMP-12 i MMP-13 [32,34].
LOKALIZACJA W KOMÓRCE
Aktywność MMP podlega ścisłej kontroli przez liczne
oddziaływania makrocząsteczkowe. W wyniku tych od-
działywań odpowiednie enzymy są kierowane do właści-
wych obszarów w przestrzeni zewnątrzkomórkowej, na
powierzchnię komórek lub do miejsc wewnątrz komórki.
Czynnikami wiążącymi MMP w tych obszarach są: kolagen,
laminina, fibronektyna, elastyna, białka korowe i łańcuchy
glikozaminoglikanów (GAG, ang. glycosaminoglycans) w
macierzy zewnątrzkomórkowej. Taka lokalizacja regulu-
je aktywność MMP przez ich gromadzenie w pobliżu lub
na substratach docelowych. Przykładem są oddziaływania
MMP-1, -2, -7, -8, -9 i -13 z heparyną i siarczanem heparyny
zachodzące poprzez domenę hemopeksyny HPX. MMP-7
nie posiada domeny HPX i oddziaływania zachodzą wprost
przez domenę katalityczną i prodomenę, przez co wiązanie
łańcuchów GAG jest dużo mocniejsze niż w przypadku in-
nych MMP [35].
Innym sposobem regulacji aktywności MMP jest wiąza-
nie ich form rozpuszczalnych (cytoplazmatycznych) do bło-
ny komórkowej. Może to prowadzić do aktywacji enzymu
(jak w przypadku opisanej powyżej pro-MMP-2), albo też
do migracji i inwazji komórki poprzez błonę podstawną i
tkanki. Wiązanie MMP z błoną komórkową może induko-
wać różne szlaki sygnałowe prowadzące od błony, przez
wnętrze komórki aż do jądra aktywując specyficzne czyn-
niki transkrypcyjne, co jest funkcją dodatkową, niezwiąza-
ną z ich właściwościami proteolitycznym [36]. W pewnych
typach komórek, miocytach, neuronach, komórkach śród-
błonka, fibroblastach i hepatocytach, niektóre z metalopro-
teinaz (MMP-2, -3, -9, -13 i MT1-MMP) wykazują lokalizację
jądrową. Mechanizm przemieszczenia tych metaloprote-
inaz do jądra komórkowego nie jest znany. Przypuszcza się,
że sekwencja zlokalizowana w pobliżu C-końcowej domeny
MMP-2 jest odpowiedzialna za lokalizację jądrową tego en-
zymu. Natomiast w przypadku MMP-3 jądrowa sekwencja
sygnałowa znajduje się w domenie katalitycznej [20].
Jądrowa lokalizacja metaloproteinaz może być także
związana ze zjawiskiem apoptozy. Na przykład aktyw-
ność żelatynazy MMP-2 jest indukowana przez reak-
tywne związki tlenu i azotu uwalniane w czasie palenia
tytoniu [37]. Natomiast w przypadku niedokrwiennego
uszkodzenia mózgu zarówno u szczurów, jak i u ludzi na-
Rycina 2. Aktywacja MMPs, oddziaływanie zachowanej ewolucyjnie reszty cy-
steiny w propeptydzie z jonem cynku domeny katalitycznej. Opis w tekście.

Postępy Biochemii 58 (3) 2012
357
stępuje wzrost aktywności MMP-2, -9 i -13 w jądrach neu-
ronów, co powoduje zaburzenia oksydacyjnego systemu
naprawy DNA [38]. Metaloproteinazy macierzy wykazu-
ją także lokalizację cytoplazmatyczną, w pobliżu organel-
li komórkowych. Dotyczy to zwłaszcza proaktywnych i
aktywnych postaci MMP-1 umiejscowionych w pobliżu
mitochondriów skupionych wokół jądra komórkowego
[20]. W przypadku MMP-26 (Matrylizyna 2/endometaza)
unikalna sekwencja „przełącznika cysteinowego”(PRC-
GXPD) zastąpiona jest sekwencją: PHCGVPD. Sekwencja
ta, podobnie jak inne nietypowe struktury może ułatwiać
aktywność autokatalityczną enzymu wewnątrz komórki.
Poza tym, MMP-26 posiada dwa miejsca wiązania wap-
nia, jedno o wysokim, a drugie o niskim powinowactwie.
Zakłada się, że normalny poziom wapnia w komórce
utrzymuje MMP-26 w stanie nieaktywnym, przechodząc
w formę aktywną podczas gwałtownego napływu wap-
nia do komórki [39].
REGULACJA EKSPRESJI GENÓW METALOPROTEINAZ
Podstawowym mechanizmem regulującym ekspresję ge-
nów MMP jest transkrypcja. Większość genów metalopro-
teinaz zawiera w swoich promotorach podobne elementy.
W związku z tym, częstym zjawiskiem jest ich wzajemna
koekspresja w odpowiedzi na różne czynniki indukcyjne
(czynniki wzrostu i cytokiny zapalne), jak i jednoczesne za-
hamowanie ekspresji, indukowane przez inhibitory ekspre-
sji genów: glukokortykoidy i analogi witaminy A, retinole.
Według nowej klasyfikacji, niezależnej od podziału
względem specyficzności substratowej, MMP dzielą się w
zależności od mechanizmu regulacji ekspresji genów na
trzy grupy. Grupa 1 obejmuje geny większości MMP: MMP-
1, -3, -7, -9, -12, -13, -19 i -26. Charakteryzuje ją obecność
kasety TATA box i miejsca wiążącego czynnik AP-I (biał-
kowy aktywator transkrypcji 1, ang. Activator Protein) w
proksymalnej części genu — około 70 bp (par zasad, ang.
base pairs) od promotora, do którego wiążą się czynniki
transkrypcyjne typu Fos i Jun. Grupa 2, do której należą
geny MMP-8, -11 i -21 także zawiera kasetę TATA box, ale
nie posiada sekwencji wiążącej czynnik AP-1. W grupie 3
obejmującej geny MMP-2, MMP-14 i MMP-28 nie występuje
żadna z tych sekwencji. Geny metaloproteinaz należące do
tej grupy podlegają z reguły konstytutywnej ekspresji, choć
w niektórych chorobach obserwuje się nadmierną ekspresję
tych genów [40].
Promotory wszystkich MMP zawierają wiele elementów,
które współdziałają ze sobą indukując lub hamując ekspre-
sję genów. Należą do nich sekwencje: ETS (ang. Erythroblast
Transformation Specific), Sp1 (ang. Specificity Protein 1), NFkb
(ang. Nuclear Factor kappa-light-chain-enhancer of activated B
cell) i dodatkowo AP-1 [41]. W warunkach fizjologicznych
podstawowy poziom ekspresji genów MMP jest niski, z
gwałtownym wzrostem w odpowiedzi na uraz tkankowy,
np. zranienie, owulację lub resorpcję macicy po ciąży. W
stanach patologicznych często dochodzi do zaburzeń syste-
mu kontroli ekspresji genów MMP i zaczynają na nią wpły-
wać inne mechanizmy lub czynniki, takie jak cytokiny za-
palne, czynniki wzrostu, mechaniczne przemieszczenie lub
fagocytoza [42].
Wzrost poziomu transkrypcji jest wynikiem wzmożo-
nej indukcji wielu szlaków sygnałowych działających na
poszczególne elementy promotora i zachodzi jako reakcja
po ekspozycji na bodziec. Przeciwnie, blokowanie szlaków
sygnałowych hamuje transaktywację, wyciszając ekspresję
genów. To wyciszanie ekspresji jest bezpośrednim efektem
braku wiązania czynników transkrypcyjnych do promo-
tora poprzez redukcję ich syntezy, przez rekrutację białek
supresorowych do tych miejsc oraz w wyniku hamowania
fosforylacji, blokując ich przejście w formę aktywną. Struk-
tura promotorów genów MMP warunkuje ich wrażliwość
na różne typy czynników oraz to, w jaki sposób te czynniki
wpływają na transkrypcję. Na przykład, w komórkach me-
zenchymy i monocytach czynniki zapalne, takie jak cytoki-
ny: IL-1b, TNFa, onkostatyna M (należąca do rodziny IL-6),
RANKL, ligand aktywatora receptora jądrowego czynnika
κB (ang. Receptor Activator of Nuclear factor κB Ligand) i pro-
dukty mikroorganizmów jak lipopolisacharyd (LPS) należą
do najmocniejszych aktywatorów transkrypcji metaloprote-
inaz MMP-1, MMP-3, MMP-9, MMP-13 i MMP-14 [41].
Pierwszą metaloproteinazą, której regulacja genu została
szczegółowo poznana jest MMP-1. Aktywacja MMP-1 jest
skomplikowanym procesem obejmującym zarówno samą
transkrypcję, jak i mechanizmy regulacji potranskrypcyj-
nej. Do aktywacji transkrypcji genu MMP-1 potrzebne jest
współdziałanie wielu czynników, takich jak NF-κB, białka,
Bcl-3 (ang. B-cell lymphoma 3-encoded protein) i C/EBP-β (ang.
CCAAT/enhancer-binding protein beta) oraz LPS i IL-1β. W
trakcie zapalenia, rekrutacja czynników transkrypcyjnych
do promotora MMP-1 zachodzi przez aktywację pośredni-
ków sygnałowych jak NF-κB, kinazy MAPK (ang. Mitogen-
Activated Protein Kinases) oraz rodziny białek STAT (ang.
Signal Transducer and Activator of Transcription) i Smad [43].
REGULACJA METALOPROTEINAZ
PRZEZ INHIBITORY TKANKOWE
Endogenne inhibitory tkankowe metaloproteinaz, TIMP,
zapewniają konieczną równowagę zapobiegającą nadmier-
nej degradacji ECM. TIMP tworzą wiązania koordynacyjne
z MMP w stosunku stechiometrycznym 1:1 lub 2:2. Są one
stabilne i odwracalne, a mechanizm tego hamowania polega
na zablokowaniu dostępu substratu do miejsca katalitycz-
nego metaloproteinazy. TIMP u ssaków charakteryzują się
masą cząsteczkową w zakresie od 21 do 29 kD (184-194aa).
U kręgowców zidentyfikowano cztery rodzaje TIMP. Ich
homologi znaleziono także u muszki owocowej Drosophila,
nicienia Caenorhabditis elegant, oraz płazów i ryb. TIMP u
bezkręgowców znacznie różnią się ewolucyjnie od homolo-
gów występujących u kręgowców. Synteza inhibitorów jest
regulowana we wszystkich procesach rozwoju i przebudo-
wy tkanek, także w warunkach fizjologicznych [33]. TIMP
1, 2 i 4 tworzą formy rozpuszczalne i są wykrywane w su-
rowicy krwi, natomiast TIMP-3 jest nierozpuszczalny i za-
kotwiczony w ECM. Pomimo podobieństwa strukturalnego
TIMP różnią się między sobą profilem aktywności. TIMP-1
jest bogatą w mannozę glikoproteiną o masie cząsteczkowej
23 kD, o strukturze zachowanej w ewolucji i bardzo stabil-
ną, gdyż proces glikozylacji nie wpływa na jej aktywność.

358
www.postepybiochemii.pl
TIMP-1 hamuje wszystkie MMP (szczególnie silnie MMP-
9), za wyjątkiem metaloproteinaz błonowych MT1-MMP,
MT3-MMP, MT5-MMP i MMP-19, co jest jego cechą wyróż-
niająca. TIMP-1 wykazuje wrażliwość na działanie proteaz
serynowych, takich jak trypsyna i chymotrypsyna. Więk-
szość komórek organizmu posiada zdolność syntezy tego
inhibitora. Drugi inhibitor, białko TIMP-2 jest wydzielane
przez fibroblasty i komórki śródbłonka. Natomiast TIMP-3
o masie cząsteczkowej 30 kD, hamuje aktywność: MMP-2,
-3, -7 i -9 . Strukturalna homologia między TIMP-3 a TIMP-
1 i -2 jest niewielka i wynosi odpowiednio 37% i 42% [44].
TIMP-4 (23kD) reguluje aktywność MMP-9 i wykazuje
znaczną homologię z TIMP-2 i podobnie jak TIMP-2 posia-
da zdolność wiązania proMMP-2. Oddziaływania MMP-2
z TIMP-1 i TIMP-2 znacznie się różnią. TIMP-2 wykazuje
silne wiązanie z zymogenem MMP-2 (proMMP-2) tworząc
kompleks, który jest istotny dla aktywacji proMMP-2, pod-
czas gdy TIMP-1 tworzy analogiczny kompleks o wysokiej
specyficzności z proMMP-9.
Model hamowania aktywności metaloproteinaz przez
TIMP opracowano na podstawie obrazu rentgenowskiego
struktury krystalograficznej kompleksu TIMP-1 z domeną
katalityczną MMP-3. Zgodnie z tym modelem, cząsteczka
TIMP-1 dzięki swoistej budowie przestrzennej reaguje z
domeną katalityczną oraz z miejscem wiązania substratu
w cząsteczce MMP-3. W tym kompleksie większość (75%)
wzajemnych oddziaływań między enzymem i inhibitorem
pochodzi z regionu kowalencyjnej struktury pętli związa-
nej mostkiem dwusiarczkowym pomiędzy resztami Cys1 i
Cys70. Istotne jest tu współdziałanie grup karboksylowej i
a
-aminowej reszty Cys w sekwencji N-końcowej cząstecz-
ki TIMP-1, które z dwóch stron otaczają cząsteczkę cynku
katalitycznego MMP-3 w taki sposób, aby uniemożliwić ak-
tywację cząsteczki wody niezbędnej w katalizie [33].Ważną
cechą oddziaływań między MMP i TIMP jest wysokie po-
winowactwo oraz różnice w specyficzności TIMP do MMP.
Zjawisko to nie może być wyczerpująco zinterpretowane w
oparciu o poznane dotychczas struktury białek.
Hamowanie aktywności metaloproteinaz zachodzi nie
tylko pod wpływem działania specyficznych, endogennych
inhibitorów TIMP. Istnieje szereg nieswoistych inhibitorów
tych enzymów: α
2
-makroglobulina, C-terminalny fragment
proteinazy prokolagenu hamujący MMP-2, białko prekur-
sorowe β-amyloidu, glikoproteina RECK (ang. reversion-in-
ducing-cysteine-rich protein with kazal motifs) hamująca MMP-
2, MMP-9 i MMP-14, kortykosteroidy, kwas retinowy, hepa-
ryna, czy też interleukina IL-4 [23,25].
Ze względu na właściwość hamowania aktywności meta-
loproteinaz, TIMP mają szczególne znaczenie w procesach
nowotworowych m. in. wpływając hamująco na inwazję ko-
mórek rakowych, wzrost nowotworu, powstawanie prze-
rzutów i angiogenezę [33]. Wzrost ekspresji genów TIMP
wiąże się nie tylko z hamowaniem wzrostu guza, a także
ze znaczym zmniejszeniem ilości przerzutów odległych.
Przeciwnie, obniżenie ekspresji tych genów prowadzi do
zaostrzenia procesu nowotworowego, powodując szybszy
wzrost i proliferację komórek nowotworowych i drastycz-
nie zwiększając liczbę przerzutów [32]. Stężenie TIMP-1 w
osoczu chorych może tym samym służyć jako niezwykle
ważny, niezależny czynnik prognostyczny dla pacjentów
pozwalający określić ich rokowania przy zastosowaniu
określonej terapii, na przykład stosowany w przypadku
osób chorych na raka żołądka [45].
Aktywacja i ekspresja genów TIMP (podobnie jak MMP)
regulowana jest przez stymulatory przebudowy naczyń ja-
kimi są bodźce hemodynamiczne, stres oksydacyjny, czyn-
niki pro- i przeciwzapalne (cytokiny, czy też środki wa-
zoaktywne), zakłócając w ten sposób równowagę między
MMP i TIMP [46]. Zaburzenia równowagi pomiędzy syn-
tezą metaloproteinaz i ich tkankowych inhibitorów wiążą
się najczęściej z postępującymi zmianami patologicznymi.
Na podstawie przekrojowych badań struktury i funkcji
metaloproteinaz, wiele rodzajów inhibitorów zostało za-
projektowanych i zsyntetyzowanych. Z uwagi na szereg
innych właściwości biologicznych TIMP (czynniki wzrostu
linii komórkowych, działanie mitogenne, swoiste czynniki
transkrypcyjne, aktywatory szlaków metabolicznych, czyn-
niki pro- lub anty-apoptotyczne [47]) ich ewentualne tera-
peutyczne zastosowanie w leczeniu znajduje się wciąż we
wczesnej fazie badań [48].
ZNACZENIE I ROLA MMP W TKANCE I ORGANIZMIE
Wszystkie tkanki ustroju wykazują syntezę metaloprote-
inaz, a większość typów komórek może je wydzielać. Nale-
żą do nich komórki nabłonkowe, fibroblasty, miocyty, ke-
ratynocyty, komórki nowotworowe, komórki śródbłonka,
osteoblasty, płytki krwi, makrofagi oraz komórki nacieku
zapalnego: monocyty, leukocyty i limfocyty jednojądrza-
ste [45,49,50]. Żelatynaza MMP-2 (72 kDa) wykazuje stały
poziom, natomiast poziom syntezy żelatynazy MMP-9 (92
kDa) wzrasta w wyniku indukcji w wielu typach komórek,
w tym miocytach mięśni gładkich ściany naczyniowej. Że-
latynazy trawią kolagen typu IV i V, elastynę i inne białka
ECM, co wskazuje na ich ważną rolę w metabolizmie błony
podstawnej naczyń [48,51]. Poprzez niszczenie tej barie-
ry tworzy się przestrzeń umożliwiająca migrację komórek
podczas morfogenezy oraz przemieszczanie się leukocytów
do miejsc zapalnych [28]. Aktywność MMP jest także regu-
lowana przez czynniki wpływające na przebudowę ściany
naczyń tętniczych, do których należą zmiany ciśnienia tęt-
niczego, uszkodzenia naczyń, cytokiny zapalne (interleuki-
na IL-1β, interleukina IL-6, czynnik martwicy nowotworów
TNF-α), transformujący czynnik wzrostu TGF-β, czynnik
wzrostowy naskórka EGF, płytkowo-pochodny czynnik
wzrostu PDGF, czynnik wzrostu fibroblastów FGF, związki
reaktywne tlenu ROS oraz oddziaływania ze specyficznymi
komponentami ECM. [12,52-54].
Metaloproteinazy macierzy odgrywają bardzo ważną
rolę w fizjologii neuronów, szczególnie w ich plastyczno-
ści uczestnicząc w przebudowie połączeń synaptycznych.
Dotyczy to zwłaszcza syntezy TIMP i MMP-24 w móżdżku
oraz MMP-9. W stymulowanym hipokampie obserwowano
masywną aktywację i wzrost produkcji MMP-9 zarówno na
poziomie białka, jak i mRNA co wskazuje na uczestnictwo
tej metaloproteinazy w plastyczności neuronów i remode-
lingu połączeń synaptycznych, a dalej w procesach uczenia
się i zapamiętywania. Wpływ na regulację ekspresji genu
MMP-9 odgrywa czynnik transkrypcyjny AP-1 kontrolują-

Postępy Biochemii 58 (3) 2012
359
cy także TIMP-1. Prawdopodobnie wpływ na uwalnianie
białka tutaj ma także plazmina wraz z aktywatorami pla-
zminogenu: tPA i uPA [55].
Oprócz wpływu na procesy fizjologiczne, zmiany syn-
tezy MMP i ich inhibitorów mają znaczenie w patogenezie
wielu chorób układu nerwowego, takich jak stwardnienie
rozsiane, udary (zarówno krwotoczne, jak i niedokrwien-
ne), uszkodzenie rdzenia nerwowego, ale także epilepsja,
depresja, schizofrenia czy choroba Alzheimera [56,57].
Nadmierna ekspresja genów kodujących MMP przyczy-
nia się do zniszczenia bariery krew–mózg, co prowadzi do
zmian prozapalnych w obrębie centralnego układu nerwo-
wego, a w konsekwencji demielinacji i neurotoksyczności.
W doświadczalnym zwierzęcym modelu autoimmunolo-
gicznego zapalenia mózgu podanie egzogennych inhibito-
rów łagodziło lub cofało neurodegenerację. Wykazano, że
jednym z potencjalnych mechanizmów prozapalnego dzia-
łania MMP-9 i MMP-12 jest degradacja białek wiążących
insulino-podobny czynnik wzrostu, IGFBP (ang. insulin-like
growth factor binding proteins), w tym bioaktywnego insuli-
no-podobnego czynnika wzrostu — IGF-1 (ang. insulin-like
growth factor-1) potrzebnego w procesie powstawania mie-
liny [58].
W ostatniej dekadzie dowiedziono, że ekspresja genów
metaloproteinaz macierzy ulega znacznym zmianom w
przebiegu przewlekłej obturacyjnej choroby płuc (PO-
ChP), w tym szczególnie rozedmy płuc. MMP w tym pro-
cesie proteolitycznie trawią ściany pęcherzyków płucnych
[17]. Rozedmę wywoływano doświadczalnie u wybranych
szczepów myszy, przez ekspozycję zwierząt na cząstki stałe
zawarte w dymie papierosowym lub spalinach samochodo-
wych [59]. Rozedmę płuc obserwowano także w przebiegu
mukowiscydozy u genetycznie zmodyfikowanych myszy
wykazujących nadekspresję w genie regulatorowym cAMP-
-zależnego przekaźnika jonów chlorkowych kontrolującego
nabłonkowy kanał sodowy [60]. We wszystkich tych przy-
padkach stwierdzono zwiększoną syntezę makrofagowej
MMP-12, zarówno na poziomie białka, jak i transkryptu oraz
znaczne zmiany degeneracyjne w drogach oddechowych.
Można twierdzić, że selektywne zahamowanie aktywności
MMP-12 mogłoby być skuteczną terapią w leczeniu roze-
dmy płuc, aczkolwiek biorąc pod uwagę subtelne różnice w
funkcjonowaniu MMP-12 u ludzi i zwierząt, ewentualne ba-
dania kliniczne musiałyby być przeprowadzone ze znaczną
ostrożnością [17].
INNE PROTEINAZY POKREWNE MMP
Najważniejsze proteinazy, które są pokrewne MMP, ada-
malizyny (ADAM, ang. a disintegrin and metalloproteinases).
Podobnie jak metaloproteinazy należą do nadrodziny bia-
łek zależnych od cynku, zwanych metyzynami. Na pod-
stawie różnic w ich budowie metyzyny dzielą się na cztery
odrębne podrodziny: astracyny, matryksyny, adamalizyny
i serralizyny (proteazy bakteryjne). Najbardziej spektaku-
larnym przedstawicielem tej grupy jest metaloproteinaza
wyizolowana z jadu węża (SVMP, ang. Snake Venom Metallo
Protease) [61]. Admalizyny wykazują znaczną homologię se-
kwencyjną zarówno do SVMP, jak i do dezintegryn. Nale-
ży do nich około 30 glikoprotein zakotwiczonych w błonie,
które w swojej strukturze zawierają N-końcową sekwencję
sygnałową, prodomenę metaloproteinazową, domenę dez-
integrynową, region bogaty w reszty cysteiny i zawierający
powtórzenia EGF, domenę błonową i C-końcową. Dzięki
takiej budowie łączą w sobie funkcje proteaz i białek ad-
hezyjnych. Ważną rolę odrywają w oddziaływaniach mię-
dzykomórkowych, procesach adhezji i fuzji komórek oraz
procesach złuszczania białek z powierzchni komórkowych
[62]. ADAM-17/TACE (ang. Tumor Necrosis Factor-Alpha
Converting Enzyme), ADAM 9 (MDC, ang. Metalloprotease/
Disintegrin/Cysteine-rich protein 9) i ADAM 10 (KUZ, ang.
Kuzbanian) ze względu na zdolność złuszczania białek z po-
wierzchni komórkowych zwane są czynnikami złuszczają-
cymi. Najlepiej poznaną adamalizyną tej grupy jest ADAM
17, która aktywuje pro-TNFα.
ADAMT (ang. ADAM with Thrombospondin type-1 motifs)
stanowią grupę 19 białek, które oprócz klasycznych domen
wykazują obecność sekwencji trombospondyny [63]. Nie-
które z nich zidentyfikowano i określono ich funkcje bio-
logiczne. Na przykład ADAMT 2 znany jako N-proteinaza
prokolagenu bierze udział w rozwoju prawidłowej skóry.
ADAMTs 4 i 11 zwane agrekanazami 1 i 2 posiadają zdol-
ność degradacji dużych proteoglikanów jak agrekan, utrzy-
mujący mechaniczne właściwości chrząstki. Postępująca
degradacja i wyczerpanie chrząstek stawowych powoduje
rozwój chorób degeneracyjnych i zapalnych stawów (RZS)
[41]. Natomiast ADAMT 1, znany jako METH-1 posiada ak-
tywność antyangiogenną i pełni funkcję w regulacji rozwoju
naczyń [61,64]. Inhibitorami białek ADAMs i ADAMTs są
TIMP. Szczególnie TIMP-3, który jest efektywnym inhibi-
torem dla ADAM-17 (TACE), ADAM-10 i ADAM-12 oraz
ADAMT -1, -4 i -5 [23,25].
PODSUMOWANIE
Metaloproteinazy wykazują aktywność endopeptydaz,
zależnych od jonów cynku i wapnia. Enzymy te zaangażo-
wane są w procesy przebudowy i modelowania macierzy
zewnątrzkomórkowej, poprzez proteolizę białek, składo-
wych ECM. Przebudowa ECM jest kluczowym etapem
procesów fizjologicznych takich jak morfogeneza, angio-
geneza, apoptoza, regulacja wzrostu, czy zmiana ruchli-
wości komórek [65]. MMP są również zaangażowane w
patogenezę wielu chorób, zwłaszcza związanych z proce-
sem zapalnym. ECM stanowi rodzaj rusztowania dla wielu
tkanek ustroju i zawiera szereg składowych, wrażliwych
na działanie MMP. Należą do nich białka tj. elastyna, la-
minina, kolagen, fibronektyna i proteoglikany. Oddziałują
one z wieloma typami komórek, co reguluje procesy ich
wzrostu, różnicowania i odnowy. ECM jest środowiskiem
dla wielu czynników biologicznie czynnych, zaangażowa-
nych w procesy przebudowy tkanek, takich jak cytokiny,
czynniki pro-angiogenne (VEGF, TGF-β), czynniki wzro-
stowe. Stąd też MMP, działając mniej lub bardziej selek-
tywnie na białka ECM, mają znaczny wpływ na przebu-
dowę i odnowę tkanek zarówno w stanach fizjologicznych
jak i patologicznych.
Metaloproteinazy mają wspólny schemat budowy.
Wszystkie zawierają: peptyd sygnałowy, prodomenę i do-

360
www.postepybiochemii.pl
menę katalityczną, z miejscem aktywnym zawierającym jon
cynku. W zależności od swoistości substratowej wyróżnia
się różne podgrupy MMP, z których najważniejsze to: ko-
lagenazy, żelatynazy, stromielizyny, matrylizyny i metalo-
proteinazy typu błonowego. MMP syntetyzowane są przez
wiele typów komórek w formie enzymatycznie nieaktyw-
nych proenzymów – zymogenów. Ich aktywacja polega na
proteolitycznej hydrolizie wiązania pomiędzy grupą tiolo-
wą reszty cysteiny w sekwencji prodomeny, a jonem cynku
w domenie katalitycznej.
Aktywność i synteza MMP podlegają ścisłej kontroli na
poziomie transkrypcji, obróbki potranslacyjnej, aktywacji
zymogenów oraz oddziaływań ze specyficznymi inhibi-
torami. Większość MMP podlega regulacji na poziomie
transkrypcji, za wyjątkiem MMP-2 (regulacja postranskryp-
cyjna). Transkrypcja MMP wzmagana jest przez cytokiny
prozapalne, hormony, czynniki wzrostowe, infekcyjne,
białka szoku cieplnego, LPS, IL-1β lub przedłużające się
niedotlenienie tkanek. Blokada transkrypcji zachodzi pod
wpływem działania kortykosterydów, retinoli, hormonów
tarczycy, hormonów płciowych oraz IL-4, IL-10 i IL-13 (cy-
tokiny przeciwzapalne)
Przechodzenie zymogenów do form enzymatycznie ak-
tywnych zależy od proteolitycznego odszczepienia ich do-
meny propeptydowej przez proteinazy obecne w tkankach
i surowicy. Głównym, fizjologicznym aktywatorem MMP
jest plazmina, generowana w przebiegu aktywacji układu
krzepnięcia i fibrynolizy, a także inne czynniki: reaktywne
formy tlenu, proteazy serynowe (trypsyna, chymotrypsyna
i trombina), elastaza oraz MMP (-1, -2, -8, -9).
Blokowanie czynnych enzymatycznie form MMP zależy
od działania nieswoistych, endogennych inhibitorów pro-
teinaz (α2- makroglobulina) oraz swoistych inhibitorów
MMP, tj. białek TIMP. Zidentyfikowano 4 formy tych białek
(TIMP1-4). TIMP oddziałuje z domeną katalityczną MMP,
co powoduje inaktywację enzymu. Oddziaływania TIMP/
MMP nie są selektywne, z wyjątkiem TIMP-1, wykazują-
cym szczególnie wysokie powinowactwo do MMP-9 i bar-
dzo słabe w stosunku do błonowych MT-MMP. TIMP-1, -2
i -4 występują w postaci rozpuszczalnej, natomiast TIMP-3
związany jest z ECM. TIMP uwalniane są przez szereg ko-
mórek takich jak miocyty mięśniówki gładkiej, makrofagi i
płytki, a także inne komórki (limfocyty, granulocyty). Po-
ziom aktywności TIMP jest wzmagany przez cytokiny takie
jak PDGF, TGF-β, podlega regulacji również przez szereg
innych cytokin i mediatorów zapalenia. Zachowanie rów-
nowagi MMP/TIMP ma kluczowe znaczenie dla utrzyma-
nia integralności w zakresie wszystkich podstawowych
układów narządowych ustroju.
Kolejnym ważnym problemem jest ocena poziomu meta-
loproteinaz i ich inhibitorów w leukocytach. Niektóre z me-
taloproteinaz i ich inhibitorów (zwłaszcza MMP-9 i TIMP-1,
2) są syntetyzowane przez leukocyty, a poziom ich produk-
cji może być wykładnikiem stanu aktywacji tych komórek.
Natomiast powiązanie poziomu syntezy metaloproteinaz w
leukocytach z poziomem syntezy innych cytokin (zwłasz-
cza IL-17) może wskazywać na aktywację komórek układu
odpornościowego już we wczesnych etapach procesu za-
palnego między innymi w rozwoju nadciśnienia, procesów
nowotworowych, chorób płuc oraz zmian reumatoidalnych
w stawach.
PIŚMIENNICTWO
1. Parks WC, Mecham RP (1998) Matrix metalloproteinases. Academic
Press, San Diego
2. Aplin AC, Zhu WH, Fogel E, Nicosia RF (2009) Vascular regression
and survival are differentially regulated by MT1-MMP and TIMPs in
the aortic ring model of angiogenesis. Am J Physiol Cell Physiol 297:
C471-C480
3. Ruiz V, Ordonez RM, Berumen J, Ramirez R, Uhal B, Becerril C, Pardo
A, Selman M (2003) Inbalanced collagenases/TIMP-1 expression and
epithelial apoptosis in experimental lung fibrosis. Am J Physiol Cell
Physiol 285: L1026-L1036
4. Higa R, Kurtz M, Capobianco E, Martinez N, White V, Jawerbaum A
(2011) Altered matrix metalloproteinases and tissue inhibitors if metal-
loproteinases in embryos from diabetic rats during early organogene-
sis. Reprod Toxicol 32(4): 449-462
5. Stevens LJ and Page-McCaw A (2012) A secreted MMP is required for
reepithelialization during wound healing. Mol Biol Cell 23(6): 1068-
1079
6. Liu Y, Min D, Bolton T, Nure V, Twigg SM, Yue DK, McLennan SV
(2009) Increased matrix metalloproteinases-9 predicts poor wound he-
aling in diabetic foot ulcers. Diabetes Care 32: 117-119
7. Zhang H, Chang M, Hansen CN, Basso DM, Noble-Haeusslein LJ
(2011) Role of matrix metalloproteinases and therapeutic benefits of
their inhibition in spinal cord injury. Neurotherapeutics 8: 206-220
8. Surnani DP, Chavan-Gautam PM, Pisal HR, Mehendale SS, Joshi SR
(2012) matrix metalloproteinases-1 and -9 in human placenta during
spontaneous vaginal delivery and caesarean sectioning in preterm
pregnancy. PLoS One 7: e29855-e29891
9. Vu TH, Werb Z (2000) Matrix metalloproteinases: effectors of develop-
ment and normal physiology. Genes Dev 14: 2123-2133
10. Mandal M, Mandal A, Das S, Chakraborti T, Chakraborti S (2003) Cli-
nical implications of matrix metalloproteinases. Mol Cel Biochem 252:
305-329
11. Nghia TVL, Xue M, Castelnoble LA, Jackson CJ (2007) The dual per-
sonalities of matrix metalloproteinases in inflammation. Front Biosc
12: 1475-1487
12. Raffetto JD, Khalil RA (2008) Matrix metalloproteinases and their in-
hibitors in vascular remodelling and vascular disease. Biochem Pharm
75: 346-359
13. Yamashita CM, Dolgonos L, Zemans RL, Young SK, Robertson J,
Briones N, Suzuki T, Campbell MN, Gauldie J, Radisky DC, Riches
DW, Yu G, Kaminski N, McCulloch CA, Downey GP (2011) Matrix
metalloproteinase 3 is a mediator of pulonary fibrosis. Am J Pathol
179: 1733-1745
14. Mizoguchi H, Yamada K, Nabeshima T (2011) Matrix metalloprote-
inases contribute to neuronal dysfunction in animal models of drug
dependence, Alzheimer’s disease, and epilepsy. Biochem Res Int, w
druku
15. Decock J, Thirkettle S, Wagstaff L, Edwards DR (2011) Matrix metal-
loproteinases: protective roles in cancer. J Cel Mol Med 15: 1254-1265
16. Groblewska M, Tycińska A, Mroczko B, Musiał W, Szmitkowski M
(2011) Metaloproteinazy macierzy zewnątrzkomórkowej w chorobach
układu krążenia. Pol Merk Lek 178: 235-240
17. Churg A, Zhou S, Wright JI (2012) Matrix metalloproteinases in COPD.
ERJ 39: 197-209
18. Meng-Huee L, Murphy G (2004) Matrix metalloproteinases at a glance.
J Cell Sci 117: 4015-4016.
19. Marino G, Funk C (2012) Matrix metalloproteinases in plants: a brief
overview. Physiol Plant 145: 196-202
20. Hadler-Olsen E, Fadnes B, Syle I, Uhin-Hansen L, Winberg JO (2011)
Regulation of matrix metalloproteinase activity in health and disease
FEBS J 278: 28-45.

Postępy Biochemii 58 (3) 2012
361
21. Brinckerhoff CE, Matrisian LM (2002) Matrix metalloproteinases: a tail
of frog that became a prince. Nat Rev Mol Cell Biol 3: 207-214
22. Piccard H, Van den Steen PE, Opdenakker G (2007) Hemopexin do-
mains as multifunctional liganding modules in matrix metalloprotein-
ases and other proteins. J Leukoc Biol 81: 870-892
23. Lipka D, Boratyński J (2008) Metaloproteinazy MMP. Struktura i funk-
cja. Postepy Hig Med Dosw 62: 328-336
24. Olson MW, Bernardo MM, Pietila M, Gervasi DC, Toth M, Kotra LP,
Massova I, Mobashery S, Fridman T (2000) Characterization of the mo-
nomeric and dimeric forms of latent and active matrix metalloprotein-
ase-9. Differential rates for activation by stromelysin-1. J Biol Chem
275: 2661-2668
25. Nagase H, Visse R, Murphy G (2006) Structure and function of matrix
metalloproteinases and TIMPs. Cardiovasc Res 69: 562-573
26. Cauwe B, Van den Steen, Opdenakker G (2007) The biochemical, bio-
logical, and pathological kaleidoscope of cell surface substrates pro-
cessed by matrix metalloproteinases. Cri Rev Biochem Mol Biol 42:
113-185
27. Visse R, Nagase H (2003) Matrix metalloproteinases and tissue inhibi-
tors of metalloproteinases: structure, function, and biochemistry. Circ
Res 92: 827-839
28. Hrabec E, Naduk J, Stręk M, Hrabec Z (2007) Kolagenazy typu IV
(MMP-2 i MMP-9) i ich substraty — białka macierzy pozakomórko-
wej, hormony, cytokiny i ich receptory. Postepy Biochem 53: 37-45
29. Butler GS, Overall CM (2009) Updated biological roles for matrix me-
talloproteinases and new “intracellular” substrates revealed by degra-
domics. Biochemistry 48: 10830-10845
30. Morrison CJ, Butler GS, Rodriguez D, Overall CM (2009) Matrix me-
talloproteinase proteomics: substrates, targets, and therapy. Curr Op
Cell Biol 21: 645-653
31. Nagase H, Woessner JF (1999) Matrix metalloproteinases J Biol Chem
274: 21491-21494
32. Olszyński K, Zimowska M (2009) Budowa i funkcja metaloproteinaz
macierzy zewnątrzkomórkowej. Postepy Biochem 55: 76-84
33. Brew K, Dinakarpandian D, Nagase H (2000) Tissue inhibitors of me-
talloproteinases: evolution, structure and function. Biochim Biophys
Acta 1477: 267-283
34. Baker EA, Leaper DJ (2003) The plasminogen activator and matrix
metalloproteinase system in colorectal cancer: relationship to tumour
pathology. Eur J Cancer 39: 981-988
35. Yu WH, Woessner JF Jr (2000) Heparan sulfate proteoglycans as extra-
cellular docking molecules for matrilysin (matrix metalloproteinase 7).
J Biol Chem 275: 4183-4191
36. D’Alessio S, Ferrari G, Cinnante K, Scheerer W, Galloway AC, Roses
DF, Rozanov DV, Remacle AG, Oh ES, Shiryaev SA et al (2008) Tissue
inhibitor of metalloproteinases-2 binding to membrane-type 1 matrix
metalloproteinase indices MAPK activation and cell growth by a non-
-proteolytic mechanism. J Biol Chem 283: 87-99
37. Aldonyte R, Brantly M, Block E, Patel J, Zhang J (2009) Nuclear locali-
zation of active matrix metalloproteinase-2 in cigarette smoke-exposed
apoptotic endothelial cells. Exp Lung Res 35: 59-75
38. Yang Y, Candelario-Jalil E, Thompson JF, Cuadrado E, Estrada EY, Ro-
sell A, Montaner J, Rosenberg GA (2010) Increased intranuclear matrix
metalloproteinase activity in neurons interferes with oxidative DNA
repair in focal cerebral ischemia. J Neurochem 112: 134-149
39. Lee S, Park HI, Sang QX (2007) Calcium regulates tertiary structure
and enzymatic activity of human endometase/matrilysin-2 and its
role in promoting human breast cancer cell invasion. Biochem J 403:
31-42
40. Mancini A, Di Battista JA (2006) Transcriptional regulation of matrix
metalloproteinase gene expression in health and disease. Front Biosci
11: 423-446
41. Vincenti MP, Brinckerhoff CE (2007) Signal transduction and cell-type
specific regulation of matrix metalloproteinase gene expression: Can
MMPs be good for you? J Cell Physiol 213: 355-364
42. Yan C, Boyd DD (2007) Regulation of matrix metalloproteinase gene
expression. J Cell Physiol 211: 19-26
43. Raymond I, Eck S, Mollmark J, Hays E, Tomek I, Kantor S, Elliott S,
Vincenti M (2006) Interleukin-1 beta induction of matrix metallopro-
teinase-1 transcription in chondrocytes requires ERK-dependent acti-
vation of CCAAT enhancer-binding protein-beta. J Cell Physiol 207:
683-688
44. Palosaari H, Pennington CJ, Larmas M, Edwards DR, Tjäderhane L,
Salo T (2003) Expression profile of matrix metalloproteinases (MMPs)
and tissue inhibitors of MMPs (TIMPs) in mature human odontoblasts
and pulp tissue. Eur J Oral Sci 111: 1–11
45. Łukaszewicz-Zając M, Mroczko B, Szmitkowski M (2009) Znaczenie
metaloproteinaz i ich inhibitorów w raku żołądka. Postepy Hig Med.
Dosw 63: 258-265
46. Yaghooti H, Firoozrai M, Fallah S, Khorramizadeh MR (2010) Angio-
tensin II differentially induces matrix metalloproteinase-9 and tissue
inhibitor of metalloproteinase-1 production and disturbs MMP/TIMP
balance. Avicenna J Med Biotech 2: 79-85
47. Baker AH, Edwards DR, Murphy G (2002) Metalloproteinase inhibi-
tors: biological actions and therapeutic opportunities J Cell Sci 115:
3719-3727
48. Ganea E, Trifan M, Laslo AC, Putina G, Cristescu C (2007) Matrix me-
talloproteinases: useful and deleterious. Biochem Soc Transc 35: 689-
691
49. Page-McCaw A, Ewald AJ, Werb Z (2007) Matrix metalloproteinases
and the regulation of tissue remodelling. Nat Rev Mol Cell Biol 8: 221-
33
50. Miossec , Korn T, Kuchroo VK (2009) Interleukin-17 and type 17 helper
T cells. N Engl J Med 361: 888-898
51. Derosa G, D’Angelo A, Ciccarelli L, Piccinni MN, Pricolo F, Salvadeo
S, Montagna L, Gravina A, Ferrari I, Galli S, Paniga S, Tinelli C, Cicero
A (2006) Matrix metalloproteinase-2, -9, and tissue inhibitor of metal-
loproteinase-1 in patients with hypertension. Endothelium 13: 227-231
52. Peeters ACTM, Netea MG, Janssen MCH, Kullberg BJ, Van der Meer
WM, Thien T (2001) Pro-inflammatory cytokines in patients with es-
sential hypertension. Eur J Clin Invest 31: 31-36
53. Chon H, Gaillard CAJM, van der Meijden BB, Dijstelbloem HM, Kraai-
jenhagen RJ, van Leenen D, Holstege FCP, Joles JA, Bluyssen HAR,
Koomans HA, Braam B (2004) Broadly altered gene expression in
blood leukocytes in essential hypertension is absent during treatment.
Hypertension 43: 947-951
54. Pauletto P, Rattazzi M (2006) Inflammation and hypertension: the
search for a link. Nephrol Dial Transplant 21: 850-853
55. Kaczmarek L, Lapińska-Dzwonek J, Szymczak S (2002) Matrix metal-
loproteinases in the adult brain physiology: a link between c-Fos, AP-1
and remodeling of neuronal connections? EMBO J 21: 6643-6648
56. Yong VW, Power C, Forsyth P, Edwards DR (2001) Metalloproteinases
in biology and pathology of the nervous system. Nat Rev Neurosci 2:
502-511
57. Mizoguchi H, Yamada K, Nabeshima T (2011) Matrix metallopro-
teinases contribute to neuronal dysfunction in animal models of drug
dependence, Alzheimer’s disease, and epilepsy. Biochem Res Int, w
druku
58. Yong VW, Agrawal SM, Stirling DP (2007) Targeting MMPs in acute
and chronic neurological condition. Neurotherapeutics 4: 580-589
59. Cobos-Correa A, Trojanek JB, Diemer S, Mall MA, Schultz C (2009)
Membrane-bound FRET probe visualizes MMP12 activity in pulmo-
nary inflammation. Nature Chem Biol 5: 628-630
60. Mall MA, Harkema JR, Trojanek JB, Treis D, Livraghi A, Schubert
S, Zhou Z, Kreda SM, Tilley SL, Hudson EJ, O’Neal WK, Boucher
RC (2008) Development of chronical bronchitis and emphysema in
β-epithelial Na
+
channel- overexpressing mice. Am J Respir Crit Care
Med 177: 730-742
61. Żebrowska A, Wysoczyńska K, Waszczykowska E (2005) Adamalizy-
ny — metaloproteinazy biorące udział w patofizjologii chorób skóry.
Alergia Astma Immunologia 10: 187-193
62. Edwards DR, Handsley MM, Pennington CJ (2008) The ADAM metal-
loproteinases. Mol Asp Med 29: 258-289

362
www.postepybiochemii.pl
Matrix metalloproteinases and their tissue inhibitors
Joanna Trojanek
*
Departament of Microbiology and Clinical Immunology, The Children’s Memorial Health Institute, 20 Aleja Dzieci Polskich; 04-730 Warsaw,
Poland
*
e-mail: trojanekj@yahoo.com; j.trojanek@czd.pl
Key words: extracellular matrix, extracellular matrix metalloproteinases, tissue inhibitors, remodeling, fibrosis, MMP/TIMP ratio
ABSTRACT
Matrix metalloproteinases (MMPs), also known as matrixins are endoproteinases that degrading protein components of the extracellular ma-
trix (ECM), cause its restoration and reconstruction. In this way, retain the appropriate structure of the ECM and basement membrane during
both: physiological processes and pathological conditions. Changes in the structure of the ECM are accompanied by physiological processes
such as embryogenesis, angiogenesis, apoptosis, and development and rebuilding of connective tissue. Under physiological conditions, the
activity of MMPs is regulated at the transcriptional level, activation of proMMP precursor zymogens and interactions with endogenous in-
hibitors (tissue inhibitors of metalloproteinases, TIMPs). The imbalance in the system of MMPs/TIMPs induces the development of many
diseases, including cancer, fibrosis, arthritis, cardiovascular diseases, neurological and autoimmune disorders. The publication describes the
types of metalloproteinases, their structure, function and regulation of activity and endogenous inhibitors of MMPs.
63. Apte SS (2004) A disintegrin-like and metalloprotease (reprolysin
type) with trombospondin type 1motifs: the ADAMTS family. IJBCB
36: 981-985
64. Tang BL, Hong W (1999) ADAMTs: A novel family of proteases with
an ADAM protease domain and thrombospondin 1 repeats. FEBS Lett
445: 223-225
65. Clark IM, Swingler TE, Sampieri CL, Edwards DR (2008) The regula-
tion of matrix metalloproteinases and their inhibitors. Internat J Bio-
chem Cell Biol 40: 1362-1378
66. Sorsa T, Tervahartiala T, Leppilahti J, Hernandez M, Amonal J, Atu-
omainen AM, Lauhio A, Pussinen PJ, Mäntylä P (2011) Collagenase-2
(MMP-8) as a point-of-care biomarker in periodontitis and cardiovas-
cular diseases. Therapeutic response to non-antimicrobial properties
of tetracyclines. Pharmacol Res 63: 108-113
67. Troeberg L, Nagase H (2012) Proteases involved in cartilage matrix
degradation in osteoarthritis. Biochim Biophys Acta 1824: 133-45
68. Rodriguez JA, Orbe J, Martinez de Lizarrondo S, Calvayrac O, Rodri-
guez C, Martinez-Gonzalez J, Paramo JA (2008) Metalloproteinases
and atherothrombosis: MMP-10 mediates vascular remodeling pro-
moted by inflammatory stimuli. Front Biosci 13: 2916-2921
69. Motrescu ER, Rio MC (2008) Cancer cells, adipocytes and matrix me-
talloproteinase 11: a vicious tumor progression cycle. Biol Chem 389:
1037-1041
70. Ito E, Yana I, Fujita C, Irifune A, Takeda M, Madachi A, Mori S, Hama-
da Y, Kawaguchi N, Matsuura N (2010) The role of MT2-MMP in can-
cer progression. Biochem Biophys Res Commun 393: 222-227
71. Ferraro GB, Morrison CJ, Overall CM, Strittmatter SM, Fournier AE
(2011) Membrane-type matrix metalloproteinase-3 regulates neuronal
responsiveness to myelin through Nogo-66 receptor 1 cleavage. J Biol
Chem 286: 31418-31424
72. Tatti O, Arjama M, Ranki A, Weiss SJ, Keski-Oja J, Lehti K (2011)
membrane-type-3 matrix metalloproteinase (MT3-MMP) functions as
a matrix composition-dependent effector of melanoma cell invasion.
PLoS One 6: e28325
73. Sohail A, Marco M, Zhao H, Shi Q, Merrman S, Mobashery S, Fridman
R (2011) Characterization of the dimerization interface of membrane
type 4 (MT4)-matrix metalloproteinase. J Biol Chem 286: 33178-33189
74. Folgueras AR, Valdes-Sanchez T, Llano E, Menendez L, Baamonde A,
Denlinger BL, Belmonte C, Juarez L, Lastra A, Garcia-Suarez O, Astu-
dillo A, Kirstein M, Pendas AM, Farinas I, Lopez-Otin C (2009) Metal-
loproteinase MT5-MMP is an essential modulator of neuro-immune
interactions in thermal pain stimulation. Proc Natl Acad Sci USA 106:
16451-16456
75. Sohail A, Sun Q, Zhao H, Bernardo MM, Cho JA, Fridman R (2008)
MT4-(MMP17) and MT6-MMP (MMP25), a unique set of membrane-
anchored matrix metalloproteinases: properties and expression in can-
cer. Cancer Metastasis Rev 27: 289-302
76. Tomlinson ML, Garcia-Morales C, Abu-Elmagd M, Wheeler GN (2008)
Three matrix metalloprotenases are required in vivo for macrophage
migration durng embryonic development. Mech Dev 125: 1059-1070
77. Brauer R, Beck IM, Roderfeld M, Roeb E, Sedlacek R (2011) Matrix
metaloproteinase-19 inhibits growth of endothelial cells by generating
angiostatin-like fragments from plasminogen. BMC Biochem 12: 38
78. Suomela S, Koljonen V, Skoog T, Kukko H, Böhling T, Saarialho-Kere
U (2009) Expression of MMP-10, MMP-21, MMP-26, and MMP-28 in
Merkel cell carcinoma. Virchows Arch 455: 495-503
Wyszukiwarka
Podobne podstrony:
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
mechanika 3 id 290735 Nieznany
więcej podobnych podstron