
Ośrodek Szkolenia i Dokształcania
Techniczne Bezpieczeństwo Pracy
Praca Kontrolna
Korazja, rodzaje korozji oraz ochrona metali
przed korozją.
Kamil Makowski 1BHP r. 2013/2014 sem. I
Kościan dn. 24.01.2014

Kamil Makowski 1BHP r. 2013/2014 sem. I
1
I. KOROZJA I JEJ SKUTKI.
1. DEFINICJA ZJAWISKA KOROZJI
Korozją jest nazywane oddziaływanie fizykochemiczne i elektrochemiczne między
materiałem metalowym a otaczającym środowiskiem, w wyniku którego następuje
uszkodzenie korozyjne powodujące zmniejszenie własności metalu. Ze względu na typ reakcji
powodujących zniszczenie metalu lub stopów może być dokonany podstawowy podział
korozji metali i stopów na elektrochemiczną i chemiczną.
Niekiedy korozja towarzyszy zjawiskom fizycznym erozji, zużycia ciernego lub kawitacji.
W takich przypadkach, łącznego oddziaływania czynników fizycznych i chemicznych,
zjawiska niszczenia metali są określane odpowiednio jako korozja erozyjna (korozjo–erozja),
korozja cierna lub korozja kawitacyjna.
2. SKUTKI KOROZJI
Postępująca korozja może powodować znaczne obniżenie własności mechanicznych
i użytkowych maszyn, urządzeń i elementów, np. kotłów parowych, konstrukcji mostów,
łopatek turbin, istotnie zmniejszając bezpieczeństwo ich stosowania. Dotyczy to blisko 30%
ogólnej liczby produktów z metali i ich stopów.
Korozja powoduje również bardzo duże straty ekonomiczne, wynikające np. z niszczenia
rurociągów,
mostów,
statków,
instalacji
chemicznych,
zbiorników,
tłumików
samochodowych i części maszyn. Straty ekonomiczne bezpośrednio są związane
z koniecznością dokonywania wymiany uszkodzonych konstrukcji maszyn i urządzeń lub ich
elementów, wykorzystywania odpowiednio stopów odpornych na korozję lub pokryć
antykorozyjnych, osuszania magazynów i stosowania innych środków przeciwdziałających
lub opóźniających przebieg korozji.
Straty bezpośrednie powstają nie tylko podczas użytkowania metalowych konstrukcji maszyn
i urządzeń, lecz również w procesie ich wytwarzania. Przykładowo – ok. 7÷10% ogólnej
produkcji stali ulega zniszczeniu w wyniku tworzenia się zgorzeliny podczas operacji obróbki
plastycznej, głównie zaś walcowania i kucia. Znaczne straty z tej samej przyczyny wywołuje
również obróbka cieplna wykonywana w urządzeniach bez atmosfer ochronnych.
Straty ekonomiczne pośrednie są związane z przerwami w eksploatacji różnych urządzeń
w celu dokonania wymiany części lub usunięcia uszkodzeń, ze stratami materiałów
np. w wyniku przecieków olejów, gazów i wody, zmniejszeniem wydajności urządzeń,
np. wymienników ciepła – wskutek osadzania się produktów korozji na ich ściankach, a także
z zanieczyszczaniem elementów urządzeń produktami korozji.
Ostatecznym efektem korozji może być zniszczenie korozyjne, powodujące, że dany układ
techniczny przestaje całkowicie funkcjonować. Około 10% produkowanych na świecie metali
i ich stopów ulega nieodwracalnemu zniszczeniu w wyniku korozji, gdyż metale te tylko
w części można odzyskać w procesie hutniczym ze skorodowanych elementów konstrukcji,
maszyn i urządzeń. Do strat powodowanych korozją należy zaliczyć również straty
energetyczne i straty pracy ludzkiej, związane z procesami naprawy, a także wytwarzania
metali i ich stopów oraz gotowych urządzeń, które muszą zastąpić urządzenia uszkodzone
wskutek korozji.
Kamil Makowski 1BHP r. 2013/2014 sem. I
2
II. RODZAJE USZKODZEŃ KOROZYJNYCH
1. USZKODZENIA KOROZYJNE
Ze względu na wygląd zewnętrzny i zmiany własności fizycznych spośród uszkodzeń
korozyjnych można wyróżnić kilka zasadniczych odmian (rys. 1).
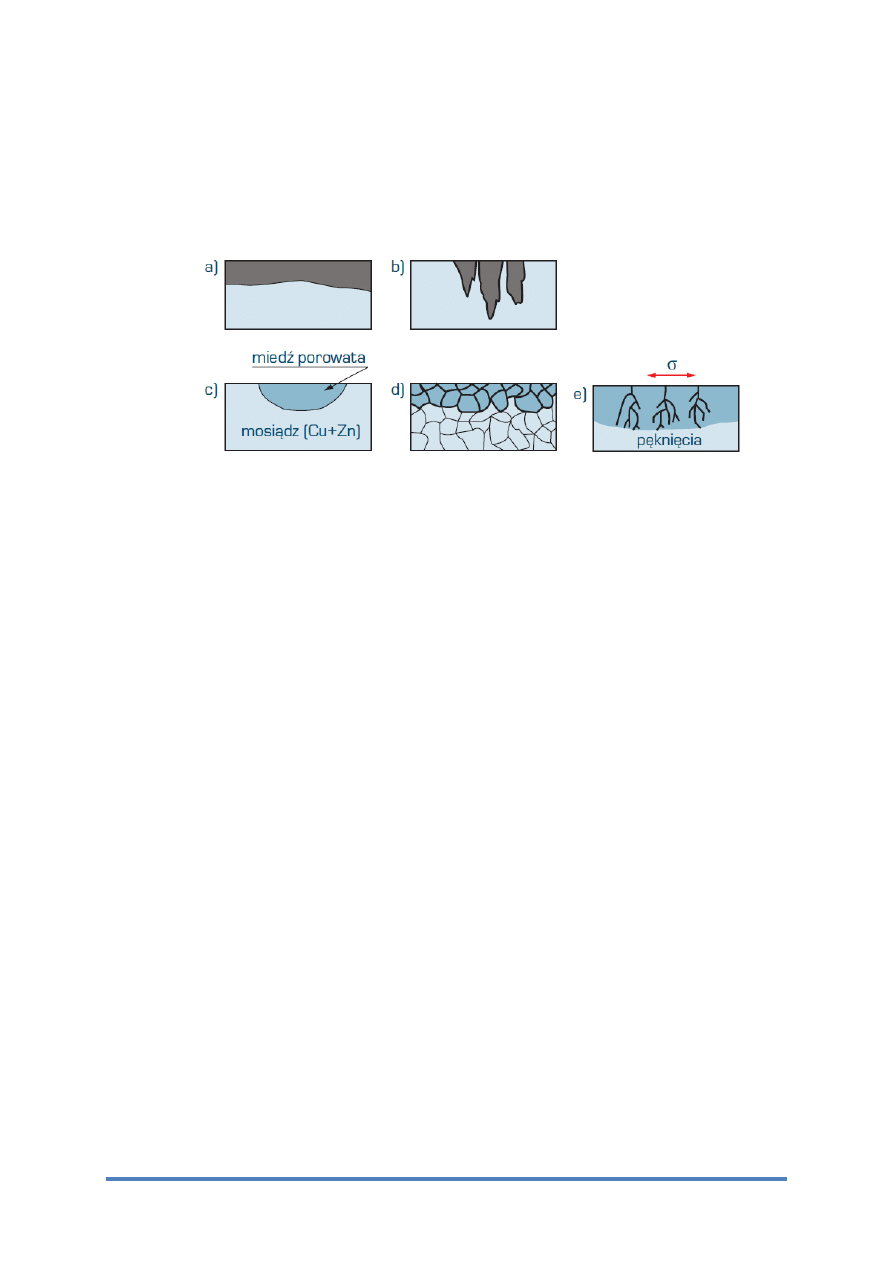
Rys. 1 Typowe uszkodzenia korozyjne – zaciemniono strefę objętą tym rodzajem korozji: a) korozja
równomierna, b) korozja wżerowa, c) korozja selektywna, d) korozja międzykrystaliczna, e) pękanie korozyjne
1.1. KOROZJA RÓWNOMIERNA
Korozja równomierna (rys. 1a) polega na niemal jednostajnym na całej powierzchni
niszczeniu metalu w miarę upływu czasu. Szybkość korozji równomiernej υKR jest podawana
w mm/rok, niekiedy także w mg/dm
2
⋅doba.
Metale lub stopy cechujące się szybkością korozji równomiernej nie większą niż 0,15 mm/rok
mogą być stosowane na szczególnie odpowiedzialne elementy urządzeń narażonych na
zniszczenie korozyjne, np. gniazda zaworów silników spalinowych lub wirniki pomp. Gdy
szybkość korozji równomiernej jest większa niż 1,5 mm/rok, to takich metali i ich stopów nie
można stosować na elementy urządzeń narażone na zniszczenie korozyjne.
1.2. KOROZJA LOKALNA I WŻEROWA
Korozja lokalna charakteryzuje się zróżnicowaniem szybkości niszczenia metalu lub stopu
w różnych obszarach jego powierzchni. Przykładem takiego uszkodzenia korozyjnego jest
korozja wżerowa (rys. 1b). Stosunek największej głębokości wżerów do głębokości średniej,
wynikającej z ubytku masy próbki, nosi nazwę współczynnika korozji wżerowej WKW (dla
korozji równomiernej WKW = 1). Innym przykładem korozji lokalnej jest tzw. korozja
nożowa przebiegająca w wąskiej strefie granicznej między materiałem macierzystym a spoiną
złącza spawanego lub lutowanego.
1.3. KOROZJA SELEKTYWNA
Korozja selektywna (rys. 1c) polega na niszczeniu jednej lub kilku faz stopu ze znacznie
większą szybkością od szybkości uszkadzania osnowy stopu. W wyniku tego porowata
pozostałość zachowuje wprawdzie pierwotny kształt produktu, lecz jego wytrzymałość ulega
znacznemu zmniejszeniu. Korozja selektywna występuje m.in. w stopach metali szlachetnych
(np. Au–Ag i Au–Cu), w żeliwach szarych (korozji ulega faza metaliczna, a pozostaje grafit),
a przykładem tego zjawiska jest również odcynkowanie mosiądzów (rys. 1c).

Kamil Makowski 1BHP r. 2013/2014 sem. I
3
1.4. KOROZJA MIĘDZYKRYSTALICZNA
Korozja międzykrystaliczna (rys. 1d) przebiega głównie na granicach ziarn metali lub ich
stopów, postępując z bardzo dużą szybkością i sięgając na dużą głębokość. Korozja
międzykrystaliczna powoduje nierzadko katastrofalne zniszczenia w wyniku znacznego
zmniejszenia wytrzymałości i ciągliwości metalu, bez wyraźnie widocznych zewnętrznie
objawów.
1.5. KOROZJA NAPRĘŻENIOWA I ZMĘCZENIOWA
Pękanie korozyjne (rys. 1e) jest powodowane jednoczesnym działaniem środowiska
korozyjnego i naprężeń rozciągających stałych lub zmiennych. Gdy na metal lub stop
poddany stałemu naprężeniu rozciągającemu działa środowisko korozyjne, występuje korozja
naprężeniowa. Naprężenie rozciągające powodujące korozję naprężeniową może być
przyłożone z zewnątrz lub być naprężeniem wewnętrznym wywołanym obróbką plastyczną,
cieplną lub spawaniem. Naprężenia powodujące pęknięcia w wyniku korozji naprężeniowej
są znacznie mniejsze od granicy plastyczności i wytrzymałości metali i stopów.
W przypadku gdy element metalowy, zanurzony w środowisku korozyjnym, jest poddawany
zmiennym naprężeniom rozciągającym, może ulegać korozji zmęczeniowej.
2. KOROZJA ELEKTROCHEMICZNA I JEJ MECHANIZM
Rys. 2 Schemat rozmieszczenia lokalnych ogniw korozyjnych na powierzchni metalu
Procesy korozji najczęściej mają charakter elektrochemiczny. Powierzchnię każdego metalu
lub stopu można bowiem traktować jako zbiór elektrod dodatnich i ujemnych, krótko
zwartych przez sam metal (rys. 2). Między tymi elektrodami, którymi są elementy struktury
metali lub stopów, występuje różnica potencjałów. Gdy na metal działa elektrolit, którym
może być woda lub roztwory wodne soli, kwasów i zasad, tworzą się lokalne mikroogniwa
i następuje lokalny przepływ prądu elektrycznego. Towarzyszą temu reakcje chemiczne
redukcji i utleniania. Reakcja chemiczna redukcji (reakcja katodowa) zachodzi na elektrodzie
zwanej katodą i jest związana z przepływem umownego prądu dodatniego z roztworu
elektrolitu do elektrody (czyli w rzeczywistości przepływem elektronów w kierunku
przeciwnym), np.:
Na elektrodzie zwanej anodą przebiega reakcja chemiczna utleniania (reakcja anodowa)
związana z przepływem dodatnich ładunków elektrycznych z elektrody do elektrolitu, np.:

Kamil Makowski 1BHP r. 2013/2014 sem. I
4
W czasie przepływu prądu elektrycznego następuje więc przepływ jonów, przy czym kationy,
np. H
+
, Fe2
+
, dążą do katody, natomiast aniony, np. Cl
–
, OH
–
, SO
4
2–
, dążą do anody.
W wyniku procesów elektrochemicznych zachodzących w mikroogniwach na powierzchni
metalu poddanego działaniu elektrolitu przebiega proces korozji. Korozja następuje tylko na
anodach mikroogniw, gdzie zwykle tworzą się sole lub wodorotlenki metali, osadzające się na
elektrodzie lub przechodzące do roztworu (rys. 3). W miarę trwania korozji dodatnie i ujemne
powierzchnie elektrod zmieniają w sposób ciągły swoje położenie. Zatem korozja
elektrochemiczna może być również równomierna.
Rys. 3 Schemat procesów zachodzących na dwuch elektrodach w czasie korozji żelaza
w roztworze kwasu (według A.G. Guya)
2.1. RODZAJE OGNIW KOROZJI ELEKTROCHEMICZNEJ
Ogniwa występujące na powierzchni metali lub stopów i decydujące o przebiegu korozji
elektrochemicznej mogą być trojakiego rodzaju; najczęściej stanowią połączenie ogniw
dwóch lub trzech rodzajów.
Ogniwa o różnych elektrodach tworzą stykające się ze sobą elementy z dwóch różnych metali
i stopów lub połączone elementy z tego samego metalu, z których jeden jest zgnieciony,
a drugi – wyżarzony. Mikroogniwa tworzą się także w stopach wielofazowych oraz metalach
polikrystalicznych. Mikroogniwa mogą bowiem stanowić np. zanieczyszczenia, wtrącenia,
różne fazy stopowe, a nawet ziarna tej samej fazy o różnej orientacji krystalograficznej.
Ogniwa stężeniowe są tworzone przez identyczne elektrody, zanurzone w elektrolitach
różniących się stężeniem. Stężeniowe ogniwo solne tworzą dwie elektrody, np. miedziane,
zanurzone w wodnym roztworze soli (np. siarczanu miedzi) o różnym stężeniu w pobliżu
każdej z elektrod. W wyniku reakcji zachodzących na elektrodach występuje dążenie do
wyrównania stężenia obu roztworów.
Stężeniowe ogniwo tlenowe stanowi przyczynę korozji wżerowej licznych metali i stopów
odpornych na korozję w innych warunkach. Tworzą je dwie identyczne elektrody,
np. żelazne, zanurzone w rozcieńczonym wodnym roztworze soli (np. chlorku sodu) o tym
samym stężeniu, lecz w różnym stopniu nasyconych tlenem. Mechanizm ten tłumaczy korozję
szczelinową na granicy dwóch elementów połączonych złączką śrubową, tworzenie się
wżerów pod warstwą produktów korozji lub osadów na żelazie lub stali niskowęglowej
(korozja podosadowa) lub na granicy faz woda–powietrze na produktach ze stali węglowej
zanurzonych w wodzie (korozja na linii wodnej).
Różnicowe ogniwa temperaturowe są złożone z elektrod z jednakowego metalu, lecz
o różnej temperaturze, zanurzonych w elektrolicie o tym samym składzie chemicznym.
Ogniwa takie występują głównie w kotłach parowych, grzejnikach, wymiennikach cieplnych.
Kamil Makowski 1BHP r. 2013/2014 sem. I
5
2.2. ŚRODOWISKA SPRZYJAJĄCE KOROZJI ELEKTROCHEMICZNEJ
O przebiegu korozji elektrochemicznej decyduje również środowisko korozyjne. Mechanizm
korozji elektrochemicznej może występować nie tylko w przypadku oddziaływania
elektrolitów, którymi są środowiska wodne lub wodne roztwory kwasów, soli i zasad. Korozji
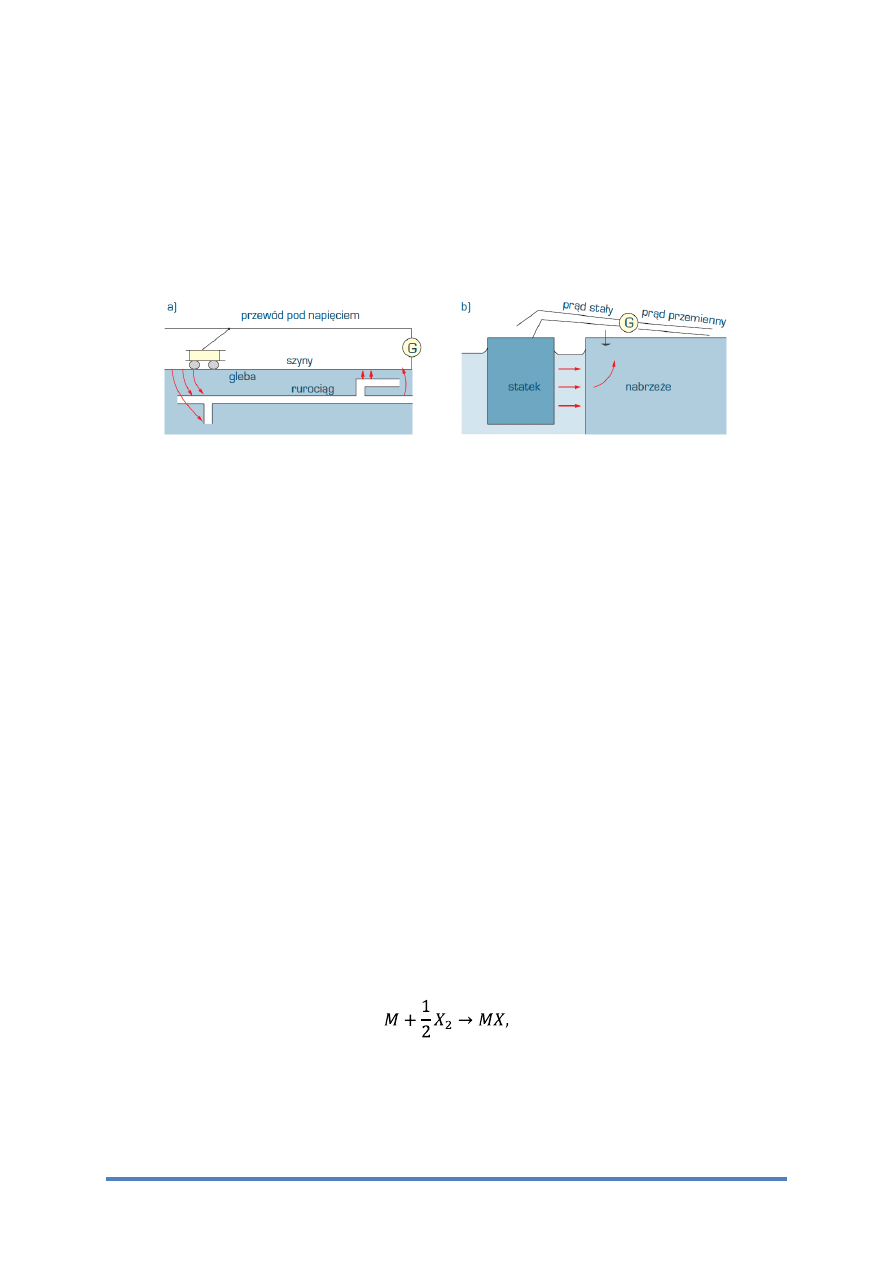
elektrochemicznej ulegają również metale i stopy zakopane w glebie, nierzadko podlegające
działaniu prądów błądzących. Źródłami prądów błądzących mogą być elektryczne linie
kolejowe lub tramwajowe, elektryczne urządzenia spawalnicze, galwanizernie, a także
uziemione linie wysokiego napięcia prądu przemiennego (rys. 3).
Rys. 3 Korozja w wyniku prądów błądzących: a) rurociągu zakopanego w ziemi,
b) statku (według H.H. Uhliga) G – generator prądu
3. KOROZJA GAZOWA
3.1. ISTOTA I SKUTKI KOROZJI GAZOWEJ
Korozja gazowa w środowisku zawierającym jedynie suchy gaz, np. tlen lub powietrze, azot,
siarkę i jej związki, spaliny i pary, jest najczęstszym przykładem korozji chemicznej. Procesy
korozji chemicznej polegają na niszczeniu metali i stopów w wyniku reakcji chemicznych.
W odróżnieniu od korozji elektrochemicznej korozja chemiczna przebiega na sucho, bez
udziału elektrolitu.
Korozja gazowa przynosi szczególnie dotkliwe straty w przemysłach chemicznym,
energetycznym, w transporcie samochodowym i lotniczym – wszędzie tam, gdzie wiele
elementów konstrukcyjnych jest narażonych na działanie gorących par i gazów. Korozja
gazowa powoduje również znaczne straty w procesie wytwarzania metali, głównie wskutek
tworzenia się zgorzeliny podczas obróbki plastycznej i cieplnej metali i stopów, zwłaszcza
stali, stając się tym samym przedmiotem szczególnego zainteresowania technologów obróbki
plastycznej i cieplnej.
Podstawowym typem reakcji powodującej korozję gazową przede wszystkim podczas obróbki
plastycznej i cieplnej jest reakcja chemiczna utleniania, którą dla najprostszego przypadku
utleniania czystego metalu dwuwartościowego można przedstawić następująco:
gdzie:
M – metal,
X
2
– utleniacz, np. O
2
, S
2
, N
2
.

Kamil Makowski 1BHP r. 2013/2014 sem. I
6
Reakcja chemiczna utleniania metalu jest złożona ze sprzężonych ze sobą kilku lub
wszystkich elementarnych procesów cząstkowych, do których należą:
adsorpcja (tj. gromadzenie się na powierzchni metalu substancji będącej składnikiem
atmosfery) i chemisorpcja (tj. gromadzenie się na powierzchni metalu substancji
będącej składnikiem atmosfery w wyniku tworzenia powierzchniowych połączeń
chemicznych z metalem) gazu utleniającego na powierzchni ciągłej i cienkiej warstwy
produktu utleniania, powstałej w początkowej fazie procesu,
powstawanie jonów utleniacza na powierzchni adsorbującej warstwy zgorzeliny
i wbudowywanie się ich w sieć krystaliczną zgorzeliny,
dyfuzja (czyli przepływ) jonów metalu z równoważną liczbą elektronów z fazy
metalicznej do zgorzeliny,
dyfuzja odrdzeniowa jonów metalu i elektronów od granicy faz rdzeń metalowy–
zgorzelina do powierzchni warstwy przez defekty sieci krystalicznej w niej
występujące,
dyfuzja dordzeniowa jonów utleniacza od granicy faz utleniacz–zgorzelina do granicy
zgorzelina–rdzeń metalowy, połączona z dyfuzją elektronów w kierunku przeciwnym,
jednoczesna dyfuzja jonów metalu oraz jonów utleniacza w przeciwnych kierunkach,
połączona z odpowiednią dyfuzją elektronów,
dyfuzja metalu, a szczególnie utleniacza – w postaci jonów, atomów lub cząsteczek –
wzdłuż granic ziarn w zgorzelinie oraz metalu.
3.2. CZYNNIKI WPŁYWAJĄCA NA KOROZJĘ GAZOWĄ
O przebiegu korozji gazowej decyduje wiele czynników. Dotychczas omówiono najprostsze
przypadki, najczęściej spotykane – przede wszystkim podczas obróbki plastycznej metali i ich
stopów. Do głównych czynników wpływających na korozję gazową należą:
Stan powierzchni
Na szybkość przebiegu korozji w sposób istotny wpływa stan powierzchni metalowego
elementu. W szczególności przyspieszenie przebiegu korozji może być spowodowane
uprzywilejowaną orientacją krystalograficzną powierzchni metalu narażonej na działanie
atmosfery utleniającej.
Obróbka mechaniczna, powodująca wzrost naprężeń własnych, zwiększenie liczby defektów
sieciowych w zewnętrznej warstwie metalu lub stopu oraz umożliwiająca wprowadzenie
drobnych cząsteczek wyrwanych z narzędzia, np. ze ściernicy, a także utworzenie warstewek
tlenków lub wodorotlenków w wyniku lokalnego nagrzania metalu, również może ułatwić
proces korozji gazowej.
Podobny wpływ wywiera obróbka chemiczna lub elektroerozyjna, powodująca np. zmianę
składu chemicznego warstwy powierzchniowej metalu lub stopu w wyniku selektywnego
wytrawiania albo tworzenia cienkich warstewek tlenków oraz absorpcję niektórych
czynników, np. wodoru.
Większe wymiary i bardziej nieregularne kształty nierówności utworzonych w wyniku
niedokładnej obróbki powierzchni metalu lub stopu utrudniają równomierne narastanie
zgorzeliny i jej odkształcenie plastyczne bez pęknięć i mikroszczelin. Sprzyja to zatem
przyspieszonej korozji gazowej.

Kamil Makowski 1BHP r. 2013/2014 sem. I
7
Skład chemiczny atmosfery korozyjnej.
O charakterze reakcji chemicznych i wielkości uszkodzeń korozyjnych decyduje głównie
skład atmosfery. Obecności utleniaczy, których wpływ omówiono w poprzednich rozdziałach,
mogą towarzyszyć agresywne pary lub inne agresywne gazy. Do najczęściej spotykanych
mieszanin gazowych powodujących intensywny przebieg korozji należą: powietrze, para
wodna, związki węgla, np. mieszaniny CO–CO
2
i węglowodory, związki siarki, np. H
2
S, SO
2
i SO
3
, spaliny, zawierające głównie siarkę i popioły, a także chlorowce, azot i amoniak.
Atmosfery przemysłowe zawierają często substancje stałe i ciekłe zawieszone w strumieniu
gazów.
W licznych przypadkach korozyjne środowisko gazowe jest mieszaniną wieloskładnikową.
Tworzą się wówczas złożone zgorzeliny – w nielicznych przypadkach zwarte, najczęściej
wielowarstwowe. Zgorzeliny te składają się z mieszanin oraz roztworów związków
powstających w przypadku działania pojedynczych gazów lub z innych związków
występujących w układach wieloskładnikowych metalu i składników atmosfery gazowej.
Reakcje chemiczne decydujące o powstawaniu zgorzelin w tych warunkach są uzależnione od
wielu czynników, do których należą:
powinowactwo chemiczne między metalem a składnikami atmosfery korozyjnej,
szybkość powstawania poszczególnych związków tworzących zgorzelinę,
własności związków wchodzących w skład zgorzeliny, przede wszystkim ich stan
skupienia i wzajemna rozpuszczalność w stanie stałym oraz podatność na tworzenie
związków wieloskładnikowych,
zwartość lub porowatość tworzącej się zgorzeliny i jej przenikalność dla atmosfery
oraz jej składników.
Tworzenie się zgorzelin w warunkach działania wieloskładnikowych mieszanin gazowych
jest więc procesem bardzo złożonym i dlatego stale trwają prace badawcze, których celem jest
pełne poznanie mechanizmów zużycia korozyjnego w różnych środowiskach.

Kamil Makowski 1BHP r. 2013/2014 sem. I
8
III. OCHRONA METALI PRZED KOROZJĄ
1. ŚRODKI ZABEZPIECZAJĄCE PRZED KOROZJĄ
Znajomość mechanizmów korozji oraz środowisk korozyjnych, w których mają pracować
maszyny i urządzenia lub ich elementy wykonane z metali i stopów, umożliwia zastosowanie
odpowiednich i najskuteczniejszych środków zabezpieczających przed korozją. Z reguły
niemożliwe jest zupełne wyeliminowanie zniszczeń korozyjnych, chociaż zwykle daje się
zmniejszyć znacznie szybkość i rozmiary korozji. Do głównych środków zabezpieczających
przed korozją należą:
dobór składu chemicznego stopów pracujących w warunkach korozji,
ochrona katodowa,
ochrona protektorowa,
ochrona anodowa,
stosowanie inhibitorów,
powłoki i warstwy ochronne,
ograniczenie oddziaływania środowiska korozyjnego.
1.1. ZASADY DOBORU SKŁADU CHEMICZNEGO STOPÓW WCELU
ZWIĘKSZENIA ODPORNOŚCI NA KOROZJĘ:
a) Elektrochemiczną
Podatność metali i stopów na korozję elektrochemiczną jest zależna od składu chemicznego
i struktury fazowej stopu. Odpowiedni dobór składu chemicznego może spowodować
przesunięcie standardowego potencjału elektrodowego stopu do dodatnich wartości,
zapewniając wysoką odporność na korozję. Działanie takie wywołuje np. dodatek ok. 13% Cr
w stali.
Wysoką odporność na korozję elektrochemiczną wykazują stopy lub metale jednofazowe,
gdyż nie występują na ich powierzchni mikroogniwa między dwiema fazami. Dążenie do
uzyskania struktury jednofazowej stanowi więc jedną z zasad komponowania składów
chemicznych stopów odpornych na korozję elektrochemiczną.
b) Gazową
Skład chemiczny stopu i jego zdolność do tworzenia zgorzeliny, która odgrywa jednocześnie
rolę warstwy ochronnej, należy do najistotniejszych czynników decydujących o przebiegu
korozji gazowej. Dobre własności ochronne wykazuje zgorzelina w postaci ciągłej warstwy
jednofazowej związku – np. BX – utworzona na powierzchni stopu przez dodatek stopowy
o znacznym powinowactwie chemicznym z utleniaczem. Dodatkami takimi są np. Zn, Al, Si,
Cr, Be i Mg. Istotne jest przy tym, by związek BX ściśle przylegał do metalicznego rdzenia
i nie tworzył niskotopliwych eutektyk z innymi produktami korozji. Warstwa ochronna, której
skład fazowy zależy od rodzaju stopu, nie powinna również wykazywać pęknięć
i mikroszczelin, umożliwiających dyfuzję cząstkową i dysocjacyjny przebieg tworzenia
zgorzelin wielowarstwowych.
Kamil Makowski 1BHP r. 2013/2014 sem. I
9
W niektórych przypadkach skład stopu należy dobierać tak, aby w wyniku działania tlenu
w stopie występowała strefa utleniania wewnętrznego polepszająca żaroodporność. Niekiedy
skład stopu należy dobierać w taki sposób, aby zostało zapewnione utworzenie
w zewnętrznej warstwie zgorzeliny ścisłej strefy związków typu spineli, utrudniających
dyfuzję utleniacza. Może to ponadto polepszyć żaroodporność stopu.
Jednocześnie liczne dodatki stopowe sprzyjają przyspieszeniu przebiegu korozji. Przykładem
może być węgiel jako podstawowy składnik stopowy stali, decydujący o uzyskiwaniu przez te
stopy wymaganych własności mechanicznych. Selektywne utlenianie węgla powoduje
odwęglenie, natomiast przewaga utleniania żelaza wpływa na dodatkowe nawęglenie stali.
W obydwu przypadkach powoduje to zmianę jej składu fazowego, własności fizycznych
i mechanicznych oraz wielokrotnie przyspieszone zużycie eksploatacyjne w warunkach
korozji.
1.2. OCHRONA KATODOWA
Do najważniejszych metod ochrony przed korozją należy ochrona katodowa.
Metodą tą można chronić:
stale, miedź, ołów, mosiądze, pracujące w roztworach wodnych lub glebie,
metale i stopy pasywne, takie jak aluminium lub stal odporna na korozję, podlegające
korozji wżerowej,
metale i stopy, takie jak mosiądze, stale odporne na korozję, stale niskowęglowe,
magnez i aluminium, ulegające korozji naprężeniowej,
metale i stopy, ulegające korozji zmęczeniowej,
stale kwasoodporne i duraluminium, ulegające korozji międzykrystalicznej,
mosiądze, podlegające odcynkowaniu.
Metodę ochrony katodowej stosuje się do rurociągów i kabli podziemnych, a także śluz,
skraplaczy, okrętów, zbiorników na wodę, doków pływających i urządzeń chemicznych.
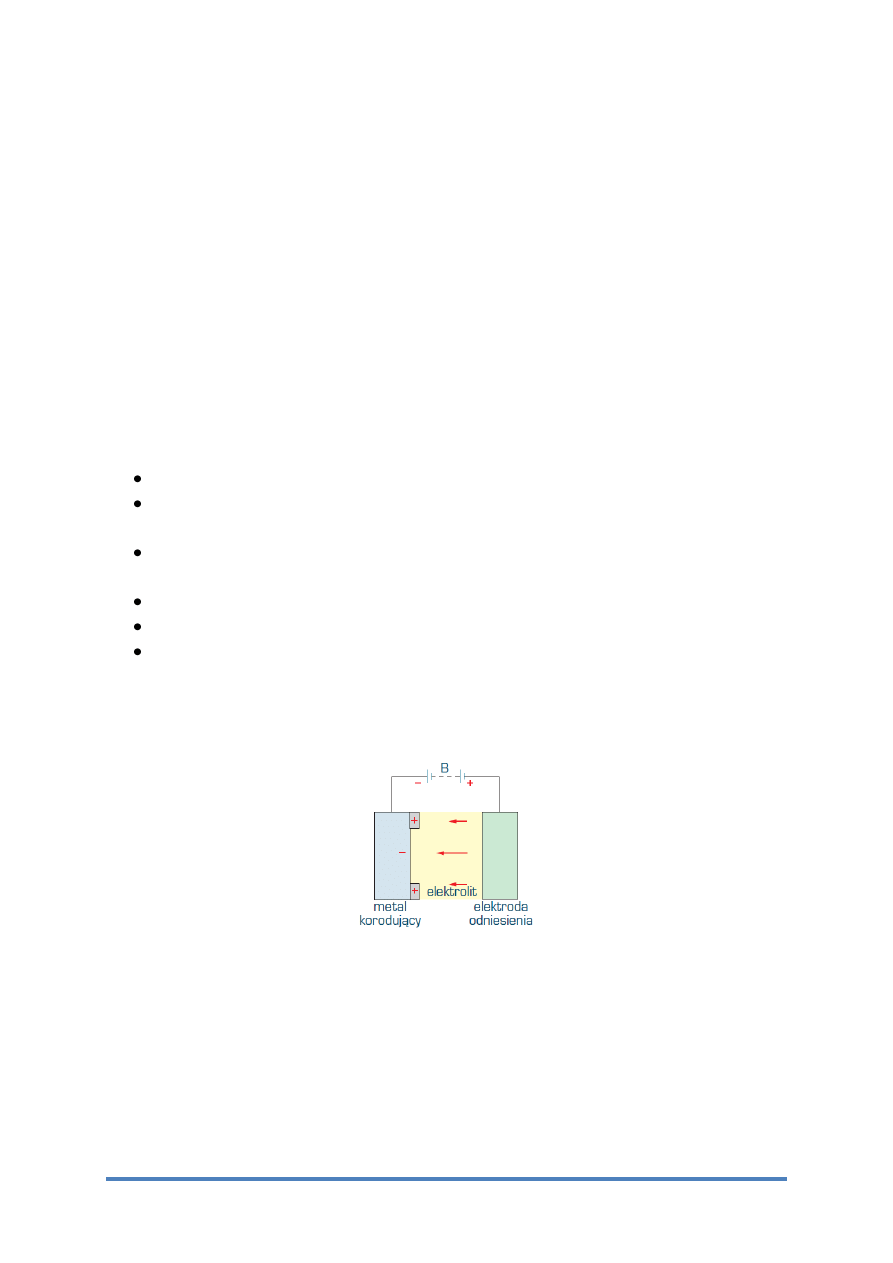
Ochrona katodowa polega na polaryzacji zewnętrznym prądem metalu, na powierzchni
którego występują lokalne ogniwa korozji elektrochemicznej.
Rys. 4 Ochrona katodowa - schemat układu elektrycznego
Prąd ze źródła prądu stałego B (rys. 4) płynie przez elektrodę pomocniczą – anodę,
z dowolnego metalu i elektrolit do metalu korodującego, a następnie do źródła prądu.
W wyniku polaryzacji elektrody katodowe występujące na powierzchni metalu korodującego
osiągają potencjał anody ogniwa otwartego. Następuje zatem wyrównanie potencjału na całej
powierzchni metalu i nie występuje przepływ prądu korozyjnego, a zatem nie przebiega
korozja. Przykład ochrony katodowej rurociągu przedstawiono schematycznie na rysunku 5.
Kamil Makowski 1BHP r. 2013/2014 sem. I
10
Rys. 5 Schematy ochrony katodowej
1.3. OCHRONA PROTEKTOROWA
Ochrona protektorowa jest odmianą ochrony katodowej. Jeżeli zewnętrzna elektroda
charakteryzuje się niższym standardowym potencjałem elektrodowym w szeregu
napięciowym niż chroniony metal, nie trzeba stosować zewnętrznego źródła prądu stałego.
Anoda taka, zwana protektorową, którą zwykle stanowi magnez, cynk lub aluminium,
wykazuje w stosunku do stali niewielką różnicę potencjału, np. w wodzie morskiej od
ok. –1,3 Vdla Mg do –0,8 Vdla Zn.
Jedna anoda protektorowa umożliwia ochronę niewielkiej tylko powierzchni metalu.
W zależności od rezystancji środowiska korozyjnego należy więc stosować odpowiednio dużą
liczbę anod protektorowych.
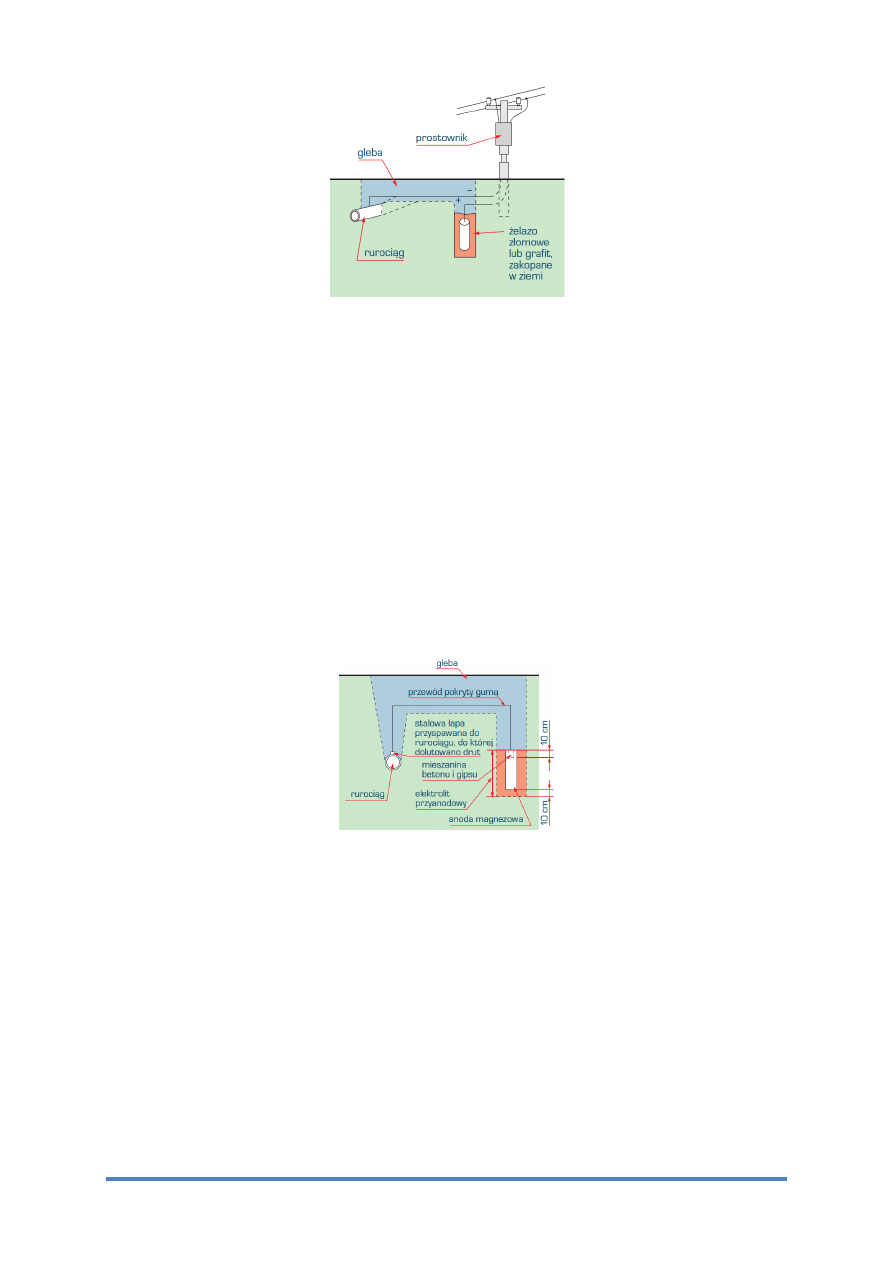
Przykład zastosowania protektorowej anody magnezowej chroniącej rurociąg przedstawiono
na rysunku 6.
Rys. 6
Schematy ochrony protektorowej rurociągu zakopanego w ziemi (według H.H. Uhliga)
.
1.4. OCHRONA ANODOWA
Metale przejściowe i ich stopy łatwo ulegające pasywacji mogą być skutecznie chronione,
gdy są anodą, a ich potencjał osiąga wartość odpowiadającą obszarowi pasywnemu zgodnie
z krzywą potencjostatyczną. Potencjał pasywny jest regulowany automatycznie za pomocą
potencjostatu.
Ochrona anodowa znacznie zmniejsza szybkość korozji, lecz nie powoduje jej całkowitego
ustania. Metodą tą mogą być chronione zbiorniki i cysterny do przewozu i magazynowania
kwasów siarkowego i fosforowego, wodorotlenków oraz roztworów soli, np. siarczanów.
Ochrony anodowej nie można stosować w przypadku działania na stale kwasu solnego
i roztworów wodnych chlorków. Ochrona anodowa nie może być stosowana do cynku,
manganu, srebra, miedzi i ich stopów.

Kamil Makowski 1BHP r. 2013/2014 sem. I
11
1.5. INHIBITORY
Inhibitorem jest nazywana substancja chemiczna, która po dodaniu do środowiska
korozyjnego wpływa na zmniejszenie szybkości korozji. W zależności od sposobu działania
rozróżnia się: pasywatory, inhibitory niepasywujące, np. trawienia, oraz inhibitory lotne.
a) Pasywatory
Pasywatorami są np. jony występujące w roztworach chromianów CrO
4
2–
, azotynów NO
2
–
,
molibdenianów MoO
4
2–
, wolframianów WO
4
2–
, żelazianów FeO
4
2–
, lub nadtechnetanów
TeO
4
–
. Po zetknięciu się z powierzchnią metalu chronionego przed korozją pasywatory
wywołują na powierzchni anodowej dużą gęstość prądu, tak że zostaje przekroczony prąd
krytyczny powodujący pasywację metalu.
b) Inhibitory trawienia
Inhibitorami trawienia są zwykle związki organiczne zawierające grupy z N, S i OH oraz
aminy. Inhibitory te wpływają w niewielkim stopniu na potencjał korozyjny. Tworzą na
powierzchni metalu bardzo cienkie zaadsorbowane warstwy, hamujące rozpuszczanie się
metalu. Adsorpcja przebiega zarówno w obszarach katodowych, jak i anodowych,
a polaryzacja ma charakter mieszany, z tym że prąd korozyjny jest przesuwany do znacznie
mniejszych wartości. Przykładowo – inhibitorami dodawanymi do środowisk działających na
stale są: jodek chinolinowy, tolilotiomocznik, siarczek propylu, dwuamyloamina
i formaldehyd.
c) Inhibitory lotne
Inhibitory lotne to substancje o odpowiednio małej prężności par, które tworzą na
powierzchni metalu warstwę zaadsorbowaną, zabezpieczającą przed dostępem wody lub
tlenu. Należą do nich azotyn dwucykloheksyloaminy, węglan cykloheksyloaminy oraz
mieszanina mocznika i azotynu sodowego. Środki te są używane do czasowego
zabezpieczenia przed korozją takich elementów, jak np. łożyska kulkowe i umożliwiają ich
stosowanie bez czyszczenia.
Konieczność utrzymania wymaganej prężności par inhibitora lotnego wymaga stosowania
szczelnych opakowań, np. z papieru impregnowanego.
1.6. ŚRODKI KONSERWACYJNE
Podobny wpływ jak inhibitory trawienia wywierają oleje, smary lub woski z odpowiednimi
dodatkami organicznymi, stosowane jako środki do zabezpieczania przed korozją elementów
stalowych w czasie transportu i magazynowania. Związki organiczne dodawane do środków
konserwacyjnych są adsorbowane na powierzchni i tworzą cienką warstwę zabezpieczającą
przed korozją.
Kamil Makowski 1BHP r. 2013/2014 sem. I
12
2. POWŁOKI I WARSTWY OCHRONNE
Powszechnym sposobem zabezpieczania przed korozją, i to zarówno elektrochemiczną jak
i chemiczną, jest stosowanie powłok ochronnych. W zależności od użytych na nie materiałów
rozróżnia się:
powłoki metalowe,
powłoki nieorganiczne,
powłoki organiczne.
2.1 POWŁOKI METALOWE
Powłoki metalowe mogą być uzyskane następującymi sposobami:
galwanicznie – z wodnych roztworów lub z roztopionych soli,
chemicznie – w wyniku reakcji wymiany,
natryskowo,
naparowywaniem w próżni,
metodą platerowania wybuchowego lub przez walcowanie,
dyfuzyjnie – z proszków stopionych metali, z fazy gazowej lub lotnych związków
metali.
Powłoki metalowe są stosowane do ochrony przed korozją elektrochemiczną i chemiczną.
W przypadku korozji elektrochemicznej powłoki mogą być szlachetne, czyli katodowe, lub
protektorowe, czyli anodowe.
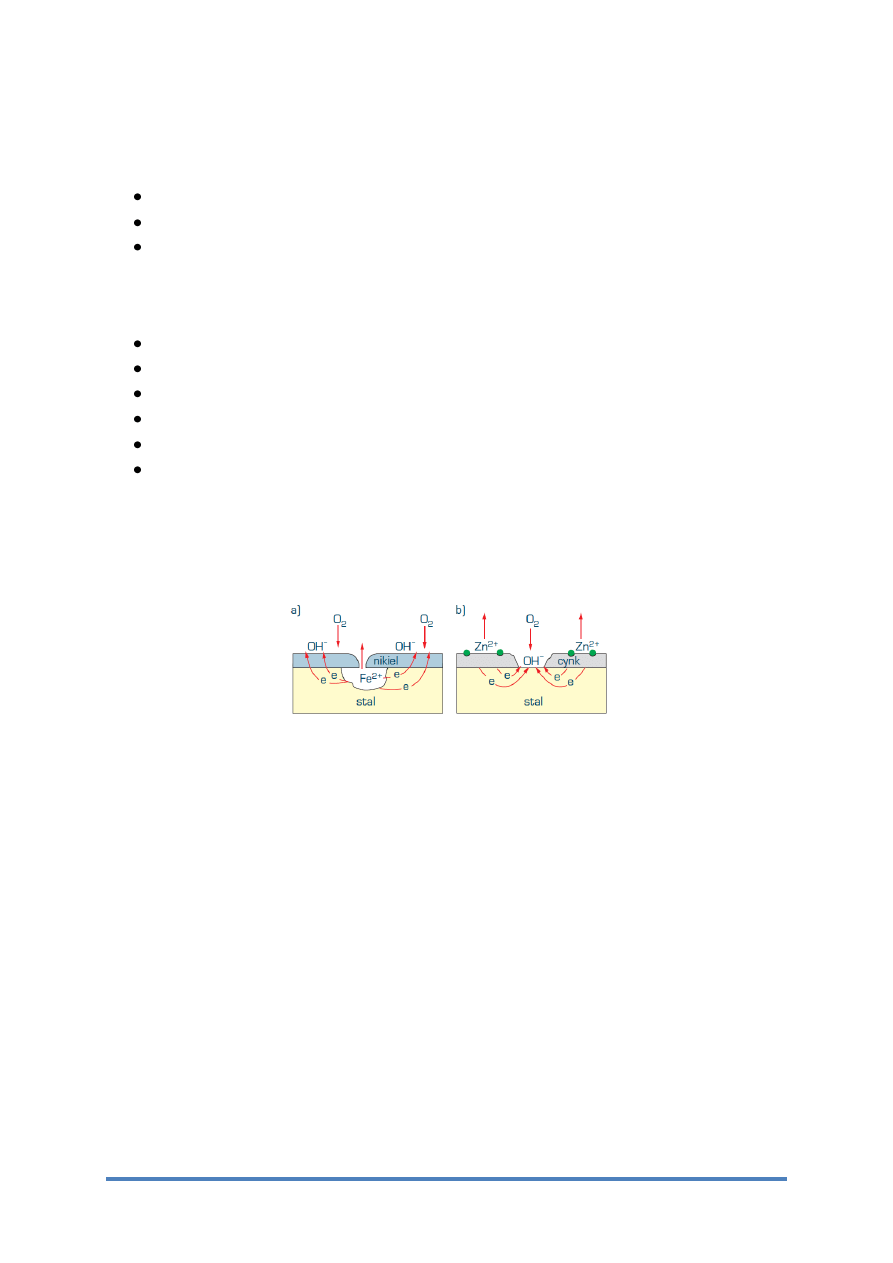
Rys. 7 Schemat ogniw korozyjnych tworzących się w przypadku uszkodzenia powłoki
ochronnej a) katodowej z niklu, b) anodowej z cynku
Powłoki szlachetne, np. na stali – niklowe, srebrne, miedziowe, ołowiowe lub chromowe, są
tworzone przez metale o dodatnim lub wyższym standardowym potencjale elektrodowym od
metalu podłoża. Powłoka taka musi być odpowiednio gruba, gdyż w przypadku odsłonięcia
metalu podłoża przez pory w powłoce – wskutek powstawania ogniwa metal podłoża – metal
powłoki (rys.7) – bardzo intensywnie przebiega korozja elektrochemiczna.
Powłoki protektorowe, np. na stali – cynkowe, kadmowe, a w niektórych środowiskach także
aluminiowe
lub
cynowe,
powodują
ochronę
katodową
metalu
podłoża.
Warunkiem skuteczności ochrony jest trwały styk powłoki z metalem podłoża oraz
odpowiednio wysoki prąd płynący w utworzonym ogniwie galwanicznym od powłoki do
metalu podłoża (rys. 7). Grubość powłoki decyduje o czasie ochrony katodowej podłoża.
W roztworach o dużym przewodnictwie elektrycznym, np. w wodzie morskiej, ochrona
powłoki jest skuteczna w znacznej odległości od powłoki, nawet do kilku metrów. W wodzie
miękkiej lub destylowanej, bardzo słabo przewodzącej prąd, gęstość prądu katodowego
zwykle maleje wraz ze zwiększeniem odległości od powłoki, nie zapewniając skutecznej
ochrony przed korozją, gdy nieciągłości powłoki wynoszą kilka milimetrów.
Kamil Makowski 1BHP r. 2013/2014 sem. I
13
W przypadku korozji chemicznej warstwa powłoki, podobnie jak zgorzelina o własnościach
ochronnych, powinna cechować się dobrą zwartością i przyczepnością do podłoża. Ponadto
dyfuzja składników środowiska korozyjnego, metalu chronionego i powłoki w warstwie
powłoki powinna być mała. Na powłoki te są stosowane pierwiastki, które na powierzchni
chronionego metalu tworzą warstwy związków ulegające selektywnemu utlenianiu. Dzięki
temu na powierzchni powłoki powstaje ochronna warstwa tlenków.
Korzystnymi własnościami charakteryzują się powłoki, na powierzchni których powstają
złożone tlenki typu spineli.
Ochronne działanie powłoki metalowej zależy od jej grubości. W wysokiej temperaturze
własności ochronne powłoki zmieniają się w wyniku zachodzących reakcji chemicznych oraz
dyfuzji. Przykłady niektórych powłok odpornych na utlenianie w wysokiej temperaturze oraz
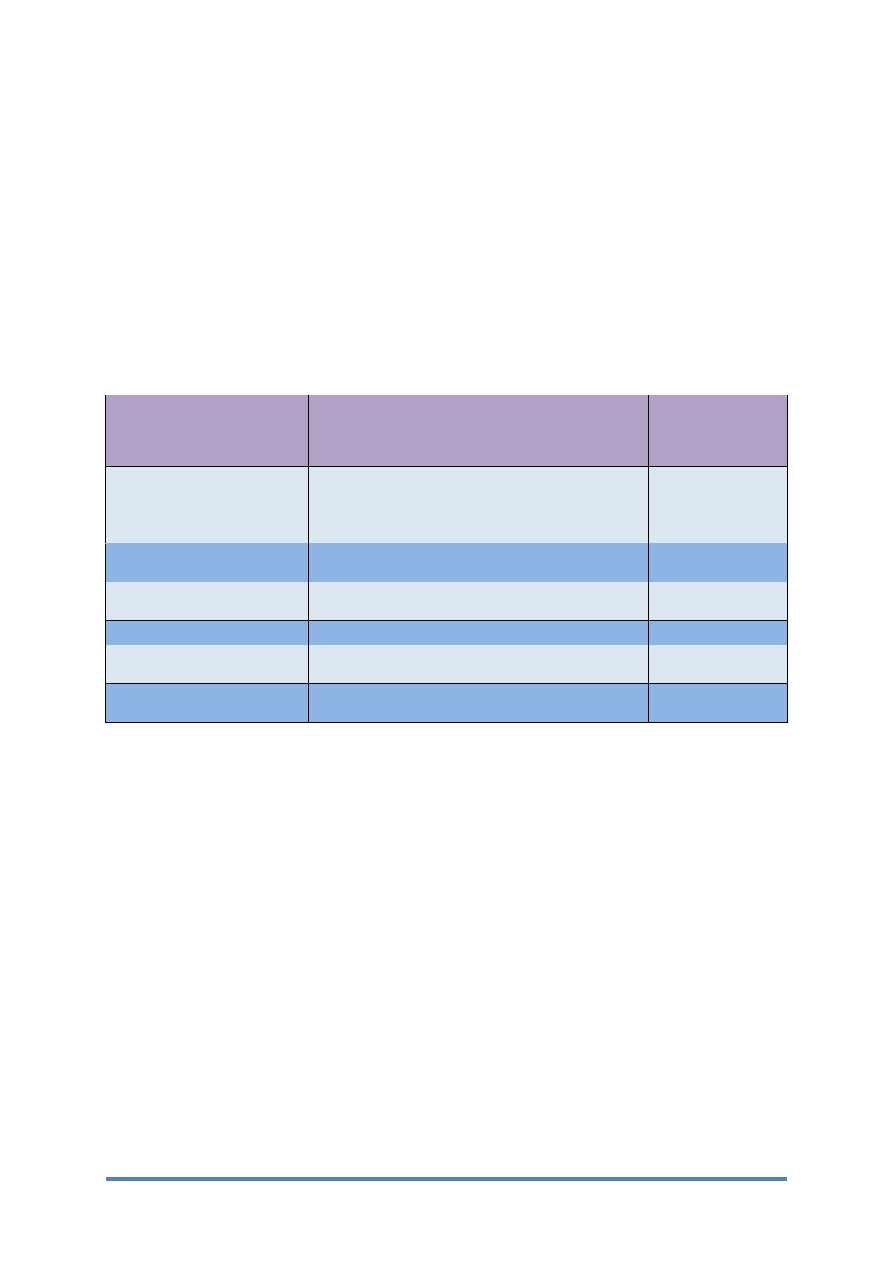
najczęściej stosowane metody ich otrzymywania podano w tablicy 1.
Rodzaj powłoki
Metoda otrzymywania
Temperatura
przyspieszonego
utleniania, [°C]
Aluminiowa
zanurzanie w roztopionym metalu, metalizacja
natryskowa, powlekanie farbami aluminiowymi i
wyżarzanie dyfuzyjne, powlekanie
galwaniczne,nakładanie z fazy gazowej
500 ÷1100
Chromowa
powlekanie galwaniczne, nakładanie z fazy
gazowej
1100÷1700
Niklowa
powlekanie galwaniczne, chemiczne z fazy
gazowej, metalizacja natryskowa
1100÷1400
Krzemowa
nakładanie z fazy gazowej
1100÷1400
Chromowo–niklowa
powlekanie galwaniczne z wyżarzaniem
dyfuzyjnym, nakładanie z fazy gazowej
>1150
Chromowo–aluminiowo–
niklowa
nakładanie z fazy gazowej, galwaniczne z
wyżarzaniem dyfuzyjnym
>1150
Tabl. 1 Przykłady powłok odpornych na utlenianie w wysokiej temperaturze
2.2. POWŁOKI NIEORGANICZNE
Najczęściej stosowanym rodzajem powłok nieorganicznych są powłoki ceramiczne. Powłoki
z emalii szklistych chronią materiały metalowe, głównie stal, a także wolfram, molibden
i tytan, przed korozją w wielu środowiskach.
Bardzo dobre własności powłok ceramicznych polegają na całkowitej nieprzepuszczalności
dla wody i tlenu. Stosuje się je w celu zabezpieczenia przed utlenianiem w temperaturze nie
wyższej niż ok. 750°C, np. w układach wylotowych silników lotniczych, naczyniach
kuchennych, a także w celu zapobieżenia korozji elementów pracujących w glebach.
Na stali często są stosowane warstwy fosforanowe, uzyskiwane w roztworze ortofosforanów
cynku lub magnezu, na które następnie nakłada się warstwy malarskie.
Warstwy ochronne zapobiegające przede wszystkim korozji gazowej mogą być tworzone
przez wysokotopliwe tlenki, a także cermetale oparte na układach równowagi metale–tlenki,
uzyskiwane metodą metalurgii proszków. Powłoki tlenkowe i z cermetali mogą być
nanoszone metodą natryskiwania płomieniowego lub plazmowego.

Kamil Makowski 1BHP r. 2013/2014 sem. I
14
2.3. POWŁOKI ORGANICZNE
Powszechnie stosowany sposób zapobiegania korozji, zwłaszcza elektrochemicznej, polega
na pokrywaniu metalu powłokami malarskimi, stanowiącymi mieszaninę nierozpuszczalnych
cząstek pigmentów w nośniku organicznym lub wodzie. Nośniki olejowe w zetknięciu
z tlenem polimeryzują, żywice syntetyczne polimeryzują lub wysychają przez odparowanie
rozpuszczalnika, tworząc na powierzchni cieniutką błonę zapobiegającą korozji. Warstwy
malarskie powinny stanowić barierę dla dyfuzji par gazów, wykazywać własności inhibitora
korozji oraz dużą trwałość. Własności te są poprawiane przez odpowiednio dobrane
pigmenty.
Uzyskanie wymaganej odporności na korozję wymaga szczególnie starannego nałożenia
powłok malarskich oraz unikania mechanicznego ich zdzierania podczas eksploatacji.
Elementy metalowe można zabezpieczyć przed działaniem ciekłych i gazowych środowisk
korozyjnych również przez pokrycie warstwą gumy lub tworzyw sztucznych. Rury
przeznaczone dla przemysłu chemicznego oraz okrętownictwa są powlekane elektrostatycznie
tworzywami sztucznymi. Blachy powlekane tworzywami sztucznymi również znajdują coraz
szersze zastosowanie. W ochronie przed korozją są stosowane takie tworzywa sztuczne, jak
policzterofluoroetylen (teflon), polietylen, polichlorek winylu, kauczuk neoprenowy, żywice
epoksydowe oraz komponenty poliuretanowe.
3. INNE SPOSOBY ZAPOBIEGANIA KOROZJI
Ochrona przed korozją może polegać również na ograniczeniu oddziaływania środowiska
korozyjnego na pracujące elementy maszyn i urządzeń. Przykładem może być odpowiednie
uzdatnienie wody stosowanej w urządzeniach energetycznych, głównie w kotłach. Podobnie,
tworzenia się zgorzeliny, np. w procesach obróbki cieplnej, można uniknąć przez
zastosowanie atmosfer ochronnych w urządzeniach do obróbki cieplnej.
***
Wyszukiwarka
Podobne podstrony:
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
wyklad 12nowy procesy elektrodowe i korozja
KOROZJA BIOLOGICZNA II
korozja i tarcie
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
14 Korozja metali i stopów
1 2085 (2316+S) odporna na korozję na formy
korozja teoria
korozja teoria(1)
21 Wykonywanie zabezpieczeń przed korozją biologiczną i działaniem ognia
Korozja metali, Energetyka, Chemia
Korozja betonu, budownictwo pk, sem 1, chemia
Inhibitory korozji metali
egzamin korozja mat bud
karta oceny ryzyka zaw na hałas i drgania mechaniczne
Standardowe has a Bios
KorozjaV2
MK7 Naprawa korozji polki akumulatora i wentylatora nawiewu
więcej podobnych podstron