
Ćwiczenie 2
Potencjometria
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie z metodyką wyznaczania pH roztworów, stałej
dysocjacji słabego elektrolitu, pojemności buforowej oraz sporządzania krzywych
miareczkowania.
Zagadnienia teoretyczne
Współczynnik aktywności jonów w roztworach elektrolitu, siła jonowa, pH roztworów
buforowych, równanie Hendersona - Hasselbacha, pojemność buforowa.
W roztworach rozcieńczonych, z którymi rozpuszczone cząsteczki wzajemnie na
siebie oddziaływują są tak małe, że można je pominąć. Roztwory nieelektrolitów osiągają
doskonały stan rozcieńczenia poniżej stężeń 0,01 mol/dm
3
.
W roztworach elektrolitów nawet przy znacznie mniejszych stężeniach, istotną rolę
odgrywają siły przyciągania elektrostatycznego, zarówno międzyjonowe jak również siły
oddziaływań solwatacyjnych. Stan doskonałego rozcieńczenia w tych wypadkach nie jest
praktycznie osiągany. Roztwory elektrolitów spełniają prawa roztworów doskonałych
wówczas, gdy w miejsce stężenia C wprowadzi się aktywność substancji rozpuszczonej.
a = c
.
f
(9.1)
Współczynnik f nazywamy współczynnikiem aktywności, natomiast c wyraża stężenie
molowe danego elektrolitu. Współczynnik aktywności charakteryzuje stopień ograniczenia
ruchów poszczególnych rodzajów cząsteczek i określa jaką część molowego stężenia stanowi
stężenie aktywne. Jeżeli przyjmiemy, że współczynnik aktywności elektrolitu HX wynosi 0,5
to w 0,1 molowym roztworze stężenie aktywne jest równe a:
a = 0,1 M/dm
3
.
0,5 = 0,05 M/dm
3
.
W silnie rozcieńczonych roztworach elektrolitów (stężenie mniejsze niż 0,01 mol/dm
3
)
współczynnik f zbliża się do 1 i aktywność w przybliżeniu odpowiada stężeniu molowemu
elektrolitu. Tak więc przy obliczaniu pH, jedynie dla roztworów o stężeniu 0,001 mol/dm
3
lub
mniejszych, można korzystać ze wzoru:
pH = -lg [H
+
]
(9.2)
natomiast dla określenia kwasowości roztworów bardziej stężonych w miejsce stężenia we
wzorze 9.2 powinno wprowadzać się wartości aktywności:
p H
a
H
lg
(9.3)

Przybliżoną wartość współczynnika aktywności f można obliczyć jeżeli znana jest siła jonowa
elektrolitów (u)
2
2
2
2
2
1
1
2
1
n
n
z
c
z
c
z
c
u
(9.4)
gdzie: c
1
, ...c
n
są stężeniami molowymi wszystkich jonów w roztworze, a z
1
, ... z
n
to ładunki
tych jonów.
Znając wartości u można wyliczyć współczynnik aktywności f przekształcając wzór:
u
u
z
f
H
1
509
,
0
log
2
(9.5)
Przy obliczaniu pH roztworów buforowych wykorzystuje się równanie Hendersona -
Hasselbacha. Dla roztworu buforowego złożonego ze słabego kwasu i jego soli z mocną
zasadą równanie to przyjmuje postać:
kwasu
soli
a
c
c
pK
pH
log
(9.6)
to samo równanie dla roztworu złożonego ze słabej zasady i jej soli z mocnym kwasem ma
postać:
p H
p K
p K
c
c
w
b
z a s a d y
s o l i
l o g
(9.7)
co pozwala po przekształceniu wzorów 9.6 i 9.7 obliczyć stałe dysocjacji kwasu K
a
lub
zasady K
b
.
Zdolność buforowania jakiegoś roztworu określa pojemność buforowa B wyrażana
jako stosunek liczby dodanych równoważników kwasu lub zasady do wywołanej zmiany pH
w 1 dm
3
roztworu.
n
p H
(9.8)
gdzie: n oznacza liczbę wprowadzonych moli kwasu lub zasady, a pH wywołane zmiany
pH.
Sprzęt:
pehametr,
1 zlewka (250 cm
3
)
6 zlewek (50 cm
3
)
pipeta (25 cm
3
)
pipety (5 i 10 cm
3
pełna i miarowa).

Odczynniki:
H
2
SO
4
roztwory 0,1; 0,01 i 0,001 molowe;
HCl roztwór 0,1 M;
NaOH roztwór 0,1 M;
CH
3
COOH roztwory 0,1 i 0,2 molowe;
CH
3
COONa roztwór 0,2 M;
NH
4
OH roztwór 0,1 M;
NH
4
Cl roztwór 0,1 M.
Wykonanie ćwiczenia
1. Pomiar pH kwasu siarkowego
Przed pomiarami kwasowości roztworów badanych należy dokonać pomiaru pH
wzorcowego roztworu buforowego. Następnie do 3 zlewek nalewamy roztwory kwasu
siarkowego o stężeniach 0,1; 0,01 i 0,001 mol/dm
3
i mierzymy pH. Wyniki zestawiamy w
tabeli 1.
Tabela 1
stężenie roztworu (mol/dm
3
)
0,1
0,01
0,001
pH zmierzone
pH obliczone ze wzoru 9.3
Odpowiedz: jaka może być przyczyna różnic w wartościach pH zmierzonych doświadczalnie
i obliczonych?
2. Wyznaczanie krzywej miareczkowania mocnego kwasu
Do zlewki o poj. 250 cm
3
nalewamy 25 cm
3
0,1 mol/dm
3
HCl. Po zmierzeniu pH
roztworu dodajemy porcjami 0,1 mol/dm
3
NaOH w następujących ilościach: 5; 5; 5; 5; 1; 1;
1; 1; 0,5; 0,5; 0,5; 0,5; 1; 1; 2; 5 i 5 cm
3
mierząc pH roztworu po każdorazowym dodaniu
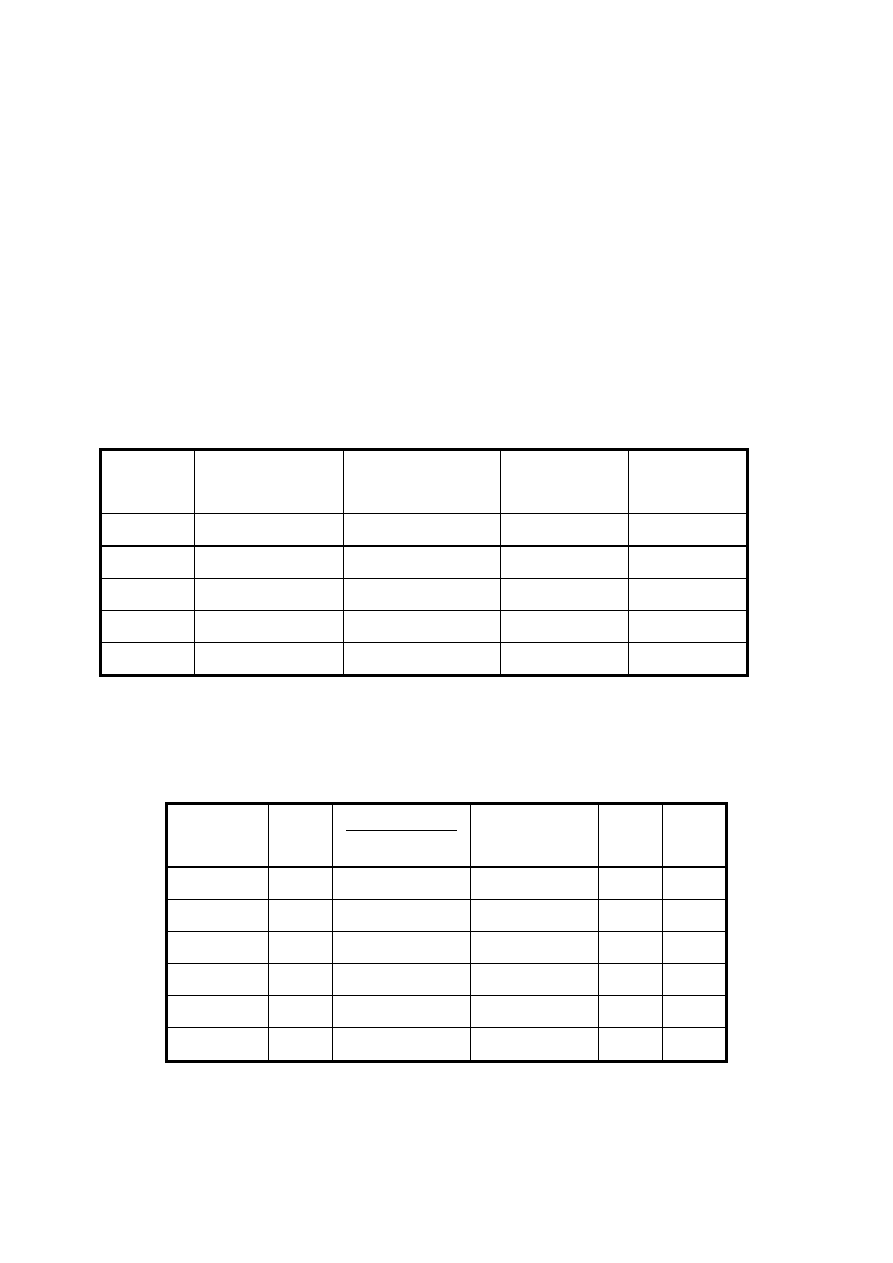
jednej porcji NaOH. Wyniki zestawić w tabeli 2.
ilość cm
3
0,1 mol/dm
3
NaOH
pH roztworu
3. Wyznaczanie krzywej miareczkowania słabego kwasu mocną zasadą
Do zlewki (250 cm
3
) nalewamy 25 cm
3
0,1 mol/dm
3
CH
3
COOH. Następnie
wprowadzamy odpowiednie ilości 0,1 mol/dm
3
NaOH i wykonujemy pomiary pH jak w
poprzednim przypadku. Uzyskane wyniki przedstawiamy graficznie odkładając na osi
odciętych liczbę cm
3
dodanej zasady, a na osi rzędnych pH roztworu. Po wykreśleniu
krzywych określić pH odpowiadające punktowi równoważnikowemu.
4. Wyznaczanie stałej dysocjacji K słabego kwasu (zasady)
W zlewkach o poj. 50 cm
3
(100 cm
3
) przygotować roztwory buforowe: CH
3
COOH i
CH
3
COONa lub NH
4
OH i NH
4
Cl o składzie podanym w tabeli 3 (jeden bufor do wyboru).
nr zlewki
0,2 M CH
3
COOH
(cm
3
)
0,2 M CH
3
COONa
(cm
3
)
0,1 M NH
4
OH
(cm
3
)
0,1 M NH
4
Cl
(cm
3
)
1
19
1
18
2
2
16
4
15
5
3
11
9
10
10
4
6
14
6
14
5
1
19
2
18
Po wymieszaniu należy zmierzyć pH roztworów (roztwory pozostawić w zlewkach).
Znając wartości pH roztworów, po obliczeniu stężenia kwasu i soli (zasady i soli) można
obliczyć średnie stałe dysocjacji słabego kwasu (zasady). Wyniki przedstawić w tabeli:
nr roztworu
pH
s tę ż e n ie so li
s tę ż e n ie kw a s u
stała dysocjacji
pK
a
pK
aśr.
1
2
3
4
5
6
5. Wyznaczanie pojemności buforowej
Do 5 roztworów buforowych z poprzedniego ćwiczenia dodać po 5 cm
3
0,1 mol/dm
3
HCl (NaOH). Zmierzyć pH otrzymanych roztworów. Znając pH roztworu przed
wprowadzeniem HCl (NaOH) i po ich dodaniu można obliczyć pH a następnie pojemność
buforową dla pięciu badanych roztworów.
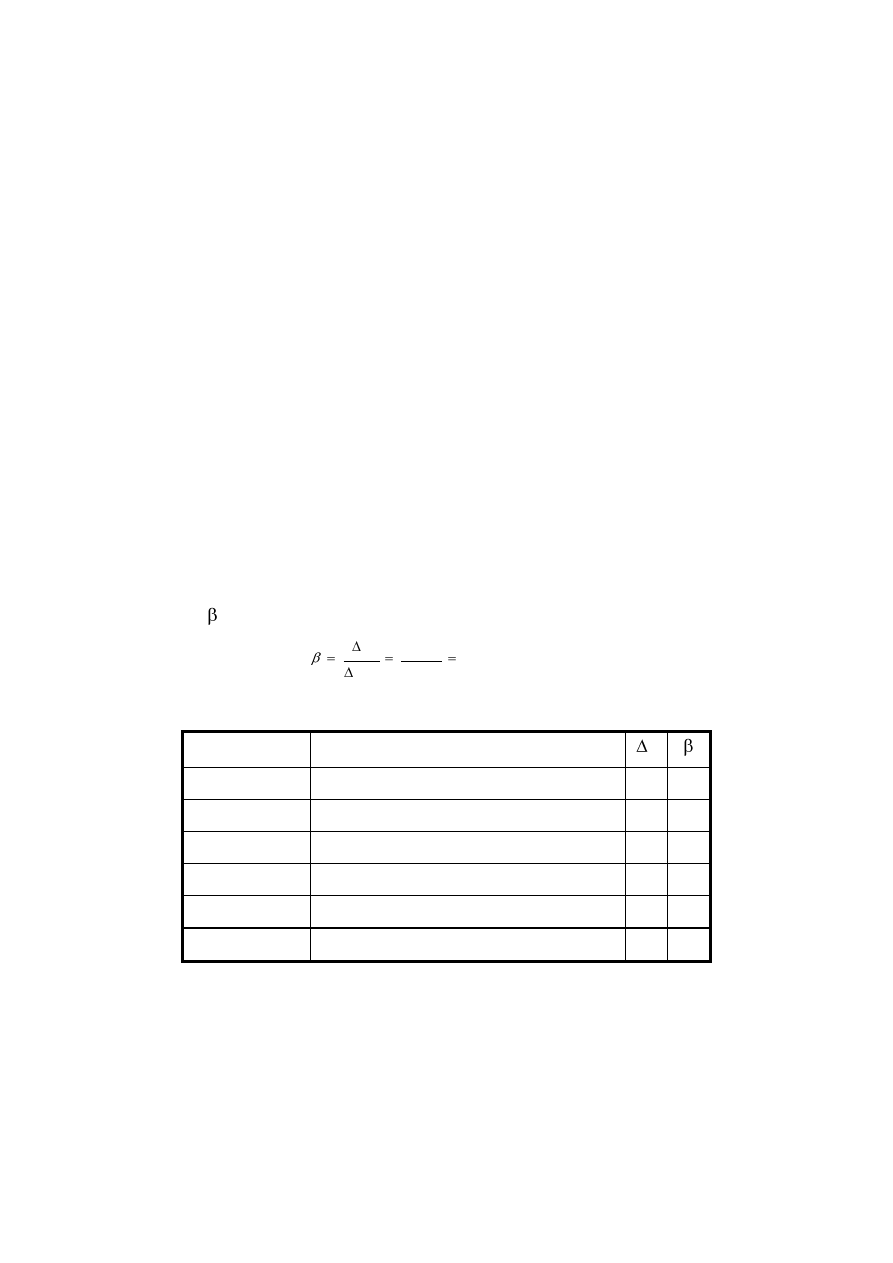
Przykład obliczeń:
Obliczyć pojemność buforową jeżeli 5 cm
3
0,1 mol/dm
3
HCl zmienia pH 20 cm
3
roztworu buforowego o 0,5 jednostek pH.
1. Ilość moli wprowadzonego kwasu n
n= c
.
V = 0,1 M/dm
3
.
0,005 dm
3
= 0,0005 mol
1. Jeżeli 0,0005 mola kwasu zmieniło pH 0,02 dm
3
buforu to z proporcji można obliczyć jaka
liczba kwasu będzie potrzebna do zmiany pH 1 dm
3
roztworu.
0,0005 M HCl
zmieniło pH
0,02 dm
3
buforu
x
1 dm
3
buforu
x = 0,025 M
3. Obliczamy z zależności 9.8
n
p H
0 0 2 5
0 5
0 0 5
,
,
,
Wyniki podajemy w tabeli
roztwór
pH roztworu po dodaniu kwasu (zasady)
n
1
2
3
4
5
6
Wyszukiwarka
Podobne podstrony:
potencjometria 1 id 378818 Nieznany
Potencjalni Kienci AVON id 3787 Nieznany
POTENCJAL CZYNNOSCIOWY id 37876 Nieznany
potencjal wezlowy id 378783 Nieznany
Potencjalni Kienci AVON id 3787 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron