
1
Ćwiczenie 7
Mechanizmy bakteryjnej oporności na antybiotyki i chemioterapeutyki
1. Typy oporności
Bakterie mogą być oporne na antybiotyki i chemioterapeutyki w sposób:
naturalny
nabyty
Oporność naturalna – jest stałą cechą gatunku, rodzaju, rodziny drobnoustrojów i może ona wynikać:
- z braku lub niskiego powinowactwa do struktury będącej celem działania leku
przeciwbakteryjnego, np. antybiotyki β-laktamowe nie działają na Mycoplasma pneumoniae,
Chlamydia pneumoniae (brak struktury ściany komórkowej); cefalosporyny i penicyliny
izoksazolowe nie działają na Enterococcus spp.
- z braku lub niskiej penetracji/transportu antybiotyku przez ścianę komórkową, np. makrolidy,
glikopeptydy nie działają na Enterobacteriaceae, aminoglikozydy nie działają na Enterococcus spp.
- z wytwarzania enzymu inaktywującego antybiotyk, np. β-laktamaza o aktywności karbapenemazy u
Stenotrophomonas maltophilia powoduje rozkład karbapenemów.
Oporność nabyta – rozwija się w wyniku wielu procesów genetycznych, które zachodzą u bakterii w wyniku
presji selekcyjnej, związanej z powszechnym stosowaniem antybiotyków. Oporność drobnoustrojów na
antybiotyki i chemioterapeutyki może być determinowana informacją genetyczną zawartą w chromosomie
i/lub elementach ruchomych jak: plazmidy, transpozony, integrony.
W obrębie oporności nabytej wyróżnia się więc oporność chromosomalną i oporność plazmidową.
Oporność chromosomalna powstaje w wyniku:
- mutacji – spontanicznej zmiany fragmentu sekwencji DNA genomu bakteryjnego, np. mutacje w
genie gyrazy i wynikająca z tego oporność na chinolony szczepów Staphylococcus aureus,
Pseudomonas aeruginosa
- nabycia genu oporności, np. w wyniku procesu transformacji obcogatunkowego DNA – nabycie
genu oporności na penicyliny przez Streptococcus pneumoniae na drodze transformacji od szczepów
paciorkowca zieleniącego jamy ustnej.
Oporność plazmidowa powstaje w wyniku przeniesienia plazmidów (lub mniejszych ruchomych
fragmentów DNA – transpozony, integrony) z komórki na komórkę tego samego lub odrębnego
taksonomicznie gatunku drobnoustrojów na drodze:
- koniugacji – bezpośrednie przeniesienie genów oporności przez kontakt komórka-komórka
- transdukcji – przeniesienie genów oporności przez wirus bakteryjny (bakteriofag)
- transformacji – bezpośrednie wnikanie DNA komórki dawcy ulegającej lizie na komórkę biorcy.
Plazmidy są to dodatkowe, ruchome fragmenty kolistego DNA, zlokalizowane poza chromosomem,
charakteryzujące się niezależną od chromosomu replikacją oraz zdolnością do przenikania do innych
komórek. Informacja zawarta w plazmidach związana jest najczęściej z syntezą czynników zjadliwości lub
opornością na antybiotyki. Transpozony, mniejsze od plazmidów nośniki genów oporności, mogą się
przemieszczać z chromosomem na plazmid, stanowiąc z nim część integralną. Jeśli lokalizują się na
plazmidzie koniugacyjnym mogą być przenoszone razem z nim na inne komórki. Transpozony mogą być
przenoszone również odwrotnie, tj. z plazmidu na chromosomalne DNA.
2. Ekspresja fenotypowa oporności na antybiotyki
Komórka bakteryjna po nabyciu genu oporności na antybiotyki bądź grupę antybiotyków manifestuje nowo
nabytą cechę przez:
syntezę enzymu, który inaktywuje lub modyfikuje lek przed lub po jego przedostaniu się do
komórki bakteryjnej, np.
enzym rozkładający antybiotyk - β-laktamaza rozkładająca β-laktamy
enzym modyfikujący antybiotyk – acetylotransferaza, adenylotransferaza, fosfotransferaza –
modyfikujące aminoglikozydy
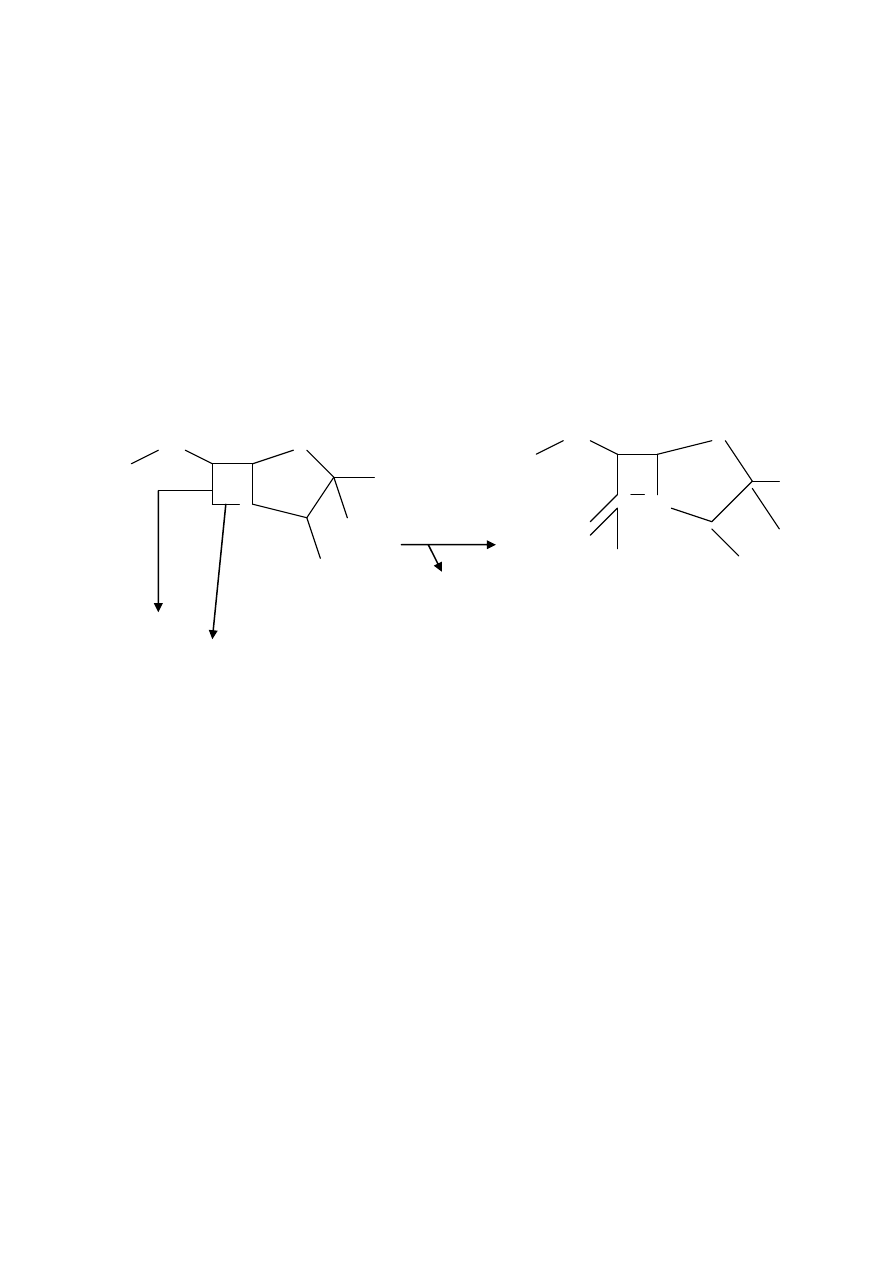
2
antybiotyk wnika do komórki; najczęściej dotyczy całej grupy antybiotyków, np. oporność
Pseudomonas aeruginosa na aminoglikozydy
modyfikacja miejsca docelowego działania antybiotyków (receptora wiążącego antybiotyk),
np. białek wiążących penicyliny PBP u Streptococcus pneumoniae, warunkująca oporność na
β-laktamy
synteza nowego białka wiążącego penicyliny PBP, które nie ma powinowactwa i nie wiąże
antybiotyku – oporność na metycylinę Staphylococcus aureus.
ominięcie ogniwa zablokowanego przez chemioterapeutyk (sulfonamidy)
aktywne usuwanie antybiotyku z komórki na zasadzie „pompy” (active efflux) – oporność
niskiego stopnia na chinolony
3. Przykłady oporności
a) Oporność enzymatyczna
- oporność na antybiotyki β-laktamowe
Jest wynikiem syntezy przez bakterie Gram-ujemne i Gram-dodatnie enzymu β-laktamazy
odpowiedzialnej za oporność na penicyliny i cefalosporyny
CH
2
S CH
2
S
R R
CH
3
CH
3
N C HN
CH
3
β-laktamaza
O
CH
3
COOH
H
2
O
OH COOH
pierścień β-laktamowy
wiązanie amidowe
β-laktamazy bakterii Gram-dodatnich są najczęściej kodowanymi plazmidowo enzymami o
profilu penicylinaz. Są wytwarzane przez gronkowce, znacznie rzadziej przez enterokoki. Oporność
ta związana jest z syntezą β-laktamazy, która niszczy antybiotyk β-laktamowy w środowisku
zewnątrzkomórkowym, czego konsekwencją jest spadek stężenia aktywnej postaci leku w tym
środowisku. Oporność ta jest zjawiskiem populacyjnym – liczna populacja jest znacznie bardziej
oporna niż mała, a gen odpowiedzialny za syntezę enzymu jest indukcyjny, co oznacza, że w
obecności leku ilość wytwarzanego enzymu znacznie wzrasta.
Wykrywanie penicylinazy gronkowcowej przeprowadzić można testem cefinazowym z krążkiem wysyconym
nitrocefiną. Umieścić na szkiełku podstawowym zwilżony jałową wodą destylowaną krążek z nitrocefiną.
Rozetrzeć następnie na krążku kilka kolonii zebranych ze świeżej 18-24 godzinnej hodowli badanego szczepu
(z podłoża stałego lub z obrzeża strefy zahamowania wzrostu szczepu w metodzie dyfuzyjno-krążkowej z
penicyliną 1U). Szkiełko umieścić w pustej płytce Petriego i pozostawić w temperaturze pokojowej do 30
minut. Powstanie różowoczerwonego zabarwienia na krążku świadczy o wytwarzaniu penicylinazy (β-
laktamazy) przez badany szczep.
W metodzie dyfuzyjno-krążkowej z penicyliną 1U: S ≥ 26 mm
R ≤ 26 mm.
Gronkowce penicylinazo-dodatnie są oporne na: penicyliny naturalne, amino-, karboksy- i ureidopenicyliny.
β-laktamazy bakterii Gram-ujemnych podzielono na kilka grup w zależności od wielu różnych
cech. Niektóre są aktywne tylko wobec penicylin, inne wobec cefalosporyn, a jeszcze inne oddziałują
na obydwie grupy leków. Zewnętrzna warstwa ściany komórkowej bakterii Gram-ujemnych opóźnia
wnikanie antybiotyków do komórki, a β-laktamaza pozostaje w przestrzeni okołoplazmatycznej,
każda więc komórka jest odpowiedzialna za swoją własną ochronę. Niewielka ilość bakterii może
być więc tak samo oporna jak duża. Geny odpowiedzialne za ich syntezę mogą znajdować się na
plazmidach
(plazmidowe
β-laktamazy) lub w chromosomie bakterii (chromosomalne
cefalosporynazy).
3
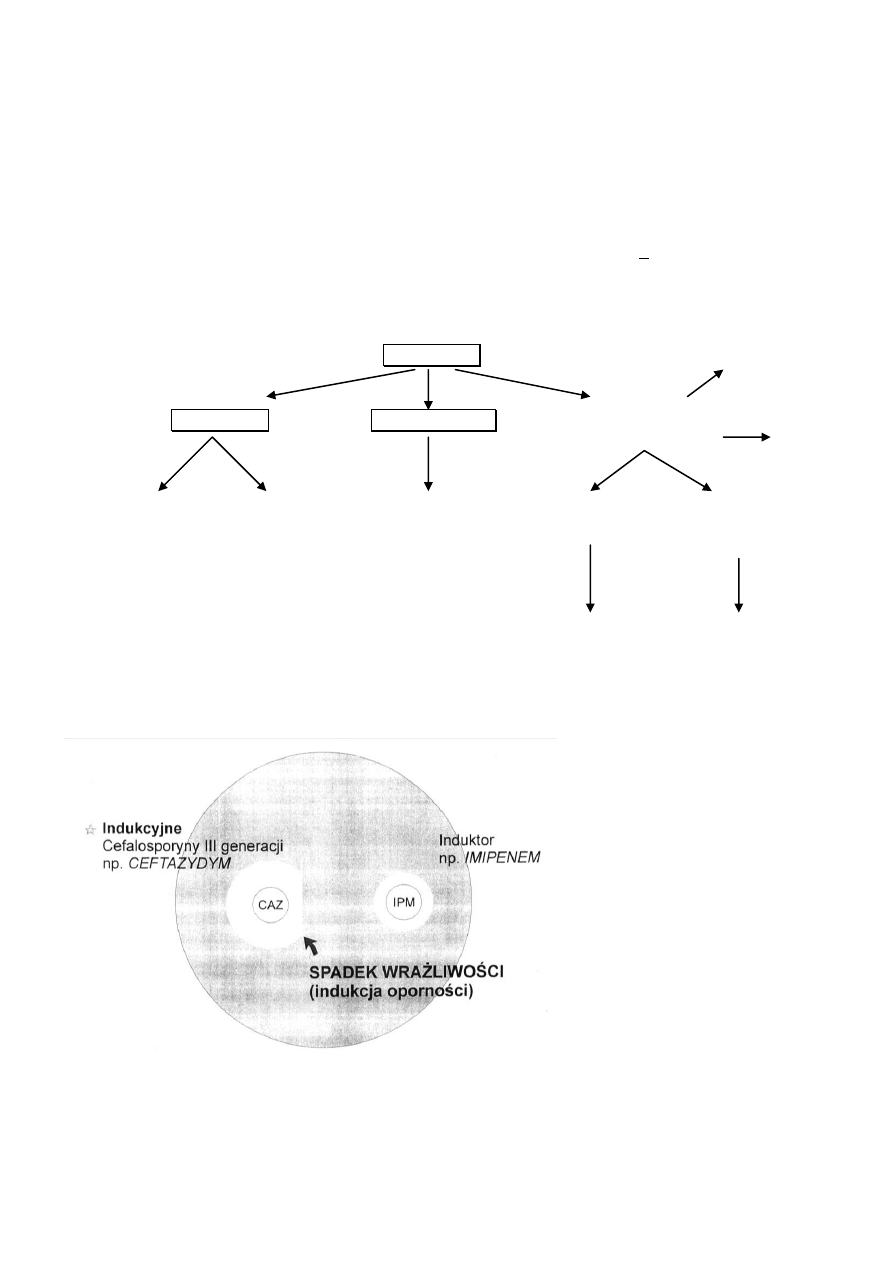
- Chromosomalne cefalosporynazy mogą być wytwarzane przez wszystkie bakterie Gram-ujemne
za wyjątkiem szczepów Salmonella. Wyróżnia się dwa główne typy cefalosporynaz: konstytutywne –
synteza enzymu odbywa się na tym samym niskim poziomie i jest niezależna od obecności
antybiotyku w środowisku (często u Escherichia coli i Klebsiella pneumoniae)
indukcyjne – typowe dla szczepów Enterobacter, Citrobacter, Serratia, Proteus indolo (+). Synteza
enzymu ulega przyspieszeniu lub zwiększeniu w obecności antybiotyku – induktora. Po usunięciu
induktora synteza enzymu wraca do poziomu podstawowego z wyjątkiem szczepów, u których
doszło do trwałej derepresji genu chromosomalnej cefalosporynazy. Szczepy te są oporne na
wszystkie antybiotyki β-laktamowe z wyjątkiem karbapenemów (chociaż opisano już tzw.
chromosomalne cefalosporynazy o rozszerzonym spektrum, zdolne także do inaktywacji
karbapenemów).
β-laktamazy
MBL
plazmidowe
penicylinazy
cefalosporynazy
β-laktamazy
o szerokim spektrum
KPC
plazmidowe
plazmidowe chromosomalne
chromosomalne
klasyczne
enzymy o poszerzonym
(S. aureus)
(Bacteroides
(Pseudomonas
(TEM, SHV) spektrum
Moraxella)
Enterobacter
substratowym
Serratia
Proteus indolo (+))
plazmidowe
plazmidowe
(Haemophilus
(Klebsiella
Enterobacteriaceae Escherichia coli)
Pseudomonas)
Rycina 1. Wykrywanie indukcyjnych cefalosporynaz chromosomalnych
- Plazmidowe β-laktamazy to enzymy o szerokim spektrum substratowym, wytwarzane głównie
przez pałeczki Gram-ujemne, w niewielkim stopniu przez Gram-dodatnie. Plazmidowe β-laktamazy
o szerokim spektrum substratowym dzielą się na klasyczne typu TEM-1, SHV-1, OXY-1 oraz na
enzymy o rozszerzonym spektrum substratowym ESβL (extender spectrum β-lactamase), które są
zmutowanymi formami enzymów klasycznych.
4
Klasyczne β-laktamazy TEM, SHV rozkładają wszystkie antybiotyki β-laktamowe z
grupy penicylin (penicylinę, ampicylinę – w wysokim stopniu, karbenicyliny – słabiej,
ureidopenicyliny: mezlocylinę, azlocylinę, piperacylinę – znacznie słabiej) i w mniejszym
stopniu z grupy cefalosporyn I generacji.
Aktywność wobec szczepów wytwarzających ten enzym wykazują: cefalosporyny II,III,IV generacji,
monobaktamy, karbapenemy, penicyliny z inhibitorami β-laktamaz.
Ten typ enzymu spotyka się najczęściej u opornych na ampicylinę szczepów Escherichia coli,
Salmonella spp., Shigella spp., Proteus mirabilis a także u Haemophilus influenzae i Neisseria
gonorrhoeae.
Rycina 2. Wykrywanie klasycznych β-laktamaz typu TEM, SHV. Charakterystyczna oporność na tikarcylinę (TIC), ale wrażliwość
na skojarzenie tikarcyliny z inhibitorem β-laktamaz (kwas klawulanowy)- TIM
Tikarcylina (TIC) – penicylina o szerokim Tikarcylina + inhibitor (kw. klawulanowy = Timentin (TIM))
spektrum substratowym
β-laktamazy o rozszerzonym spektrum substratowym ESβL wykazują oporność na
wszystkie penicyliny, cefalosporyny, monobaktamy, przy zachowanej wrażliwości na
karbapenemy i blokujące działanie inhibitorów β-laktamaz (wykorzystywane jako cecha
diagnostyczna).
Enzymy te wytwarzają szczepy występujące przede wszystkim w środowisku szpitalnym, głównie
Klebsiella pneumoniae i Escherichia coli, ale należy rutynowo oznaczać wytwarzanie ESβL u
wszystkich pałeczek Enterobacteriaceae, wykonując przeglądowy test wstępny z antybiotykami
należącymi do III generacji cefalosporyn (ceftazydym, cefotaksym, ceftriakson) i monobaktamem
(aztreonam) – zmniejszenie strefy zahamowania wzrostu poza wyznaczoną granicę zobowiązuje do
wykonania testów potwierdzających (test dwóch krążków, E-testy ESβL, testy automatyczne).
TIC
C
TIM
wrażliwy (W)
oporny (O)

5
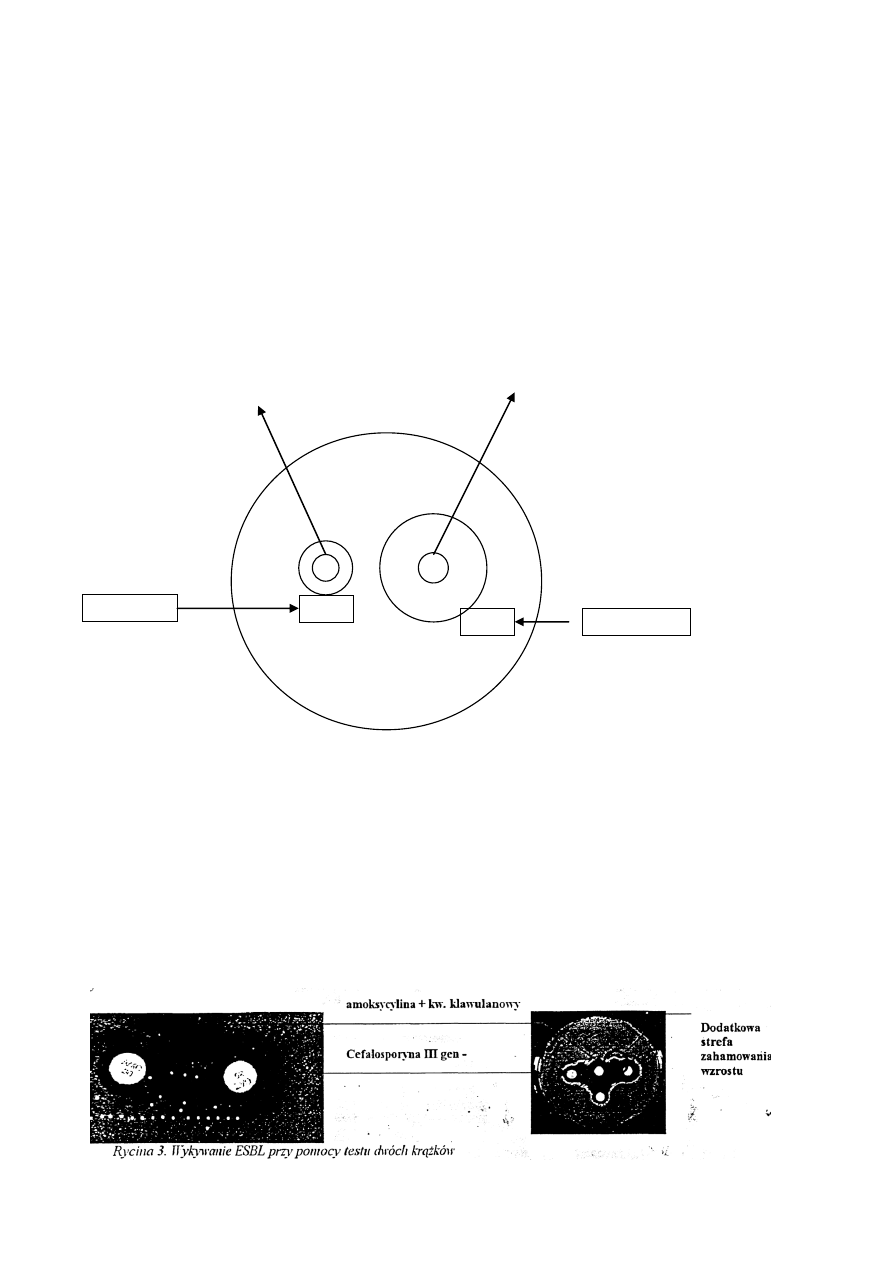
- Test dwóch krążków jest klasyczną metodą wykrywania β-laktamazy ESβL i polega na wykorzystaniu
zjawiska dyfuzji antybiotyku w żelu agarowym. Na podłożu Mueller-Hinton z posianym badanym
szczepem umieszcza się w odległości 20 mm od penicyliny z inhibitorem β-laktamaz
(amoksycylina/kwas klawulanowy) 2 krążki zawierające cefalosporyny III generacji: ceftazydym i
cefotaksym.
Pojawienie się dodatkowej strefy świadczącej o wzroście aktywności cefalosporyny od strony
działania inhibitora, pozwala wnioskować o wytwarzaniu przez szczep β-laktamazy ESβL (ryc. 3).
- stosowane są także testy (tylko dla E.coli, Klebsiella spp.) wykorzystujące różnicę w strefie zahamowania
wzrostu wokół krążka z samą cefalosporyną III generacji (cefotaksym, ceftazydym) a krążkiem zawierającym
łącznie cefalosporynę III generacji i inhibitor β - laktamaz (ceftazydym + kw.klawułanowy, cefotaksym + kw.
klawulanowy). Jeśli szczep wytwarza ESBL to średnica strefy wokół krążka zawierającego ceafalosporynę III gen +
inhibitor jest większa o 5mm od średnicy wokół krążka z samą cefalosporyną.
- E - testy pozwalające wykrywać ESβL
Pasek E-test ESβL jest nośnikiem gradientu stężeń dwóch antybiotyków: ceftazydymu (TZ) (cefalosporyna III
generacji) i ceftazydymu z kwasem klawulanowym (TZL) oraz cefotaksymu (CT) (cefalosporyna III generacji) i
cefotaksymu z kwasem klawulanowym (CTL).
Przyjmuje się że:
ESβL jest ujemny (-) jeśli stosunek MIC TZ/TZL<8 i CT/CTL<8
ESβL jest dodatni (+) jeśli MIC dla CT≥0.5 i stosunek CT/CTL ≥8 lub MIC dla TZ≥ 1 i
stosunek TZ/TZL≥8. Niewyraźna strefa zahamowania wzrostu lub zniekształcenie elipsy CT
lub TZ wskazuje na produkcję ESBL.
- metoda półautomatyczna – test ATB BLSE (bio Merieux)
- metoda automatyczna – test VITEK GNS-NT (bio Merieux), test Phoenix Panel Gram-negative NMIC/5
ID (Becton Dickinson)
DROBNOUSTROJE WYTWARZAJĄCE β-LAKTAMAZY
-Gronkowce koagulazo (+) i koagulazo (-) - 80-85% szczepów
-Enterococcus faecalis
-Moraxella catarrhalis- 70-90% szczepów
-Neisseria gonorrhoeae (występowanie regionalnie zróżnicowane)
-Haemophilus influenzae 10-40 % szczepów
-Pałeczki z rodziny Enterobacteriaceae - ok. 60% szczepów
Inhibitory β-Iaktamaz (nazywane,, cząsteczkami samobójcy „)
Inhibitory
β
-laktamaz mają strukturę antybiotyków
β-
laktamowych, nie wykazują aktywności przeciwbakteryjnej,
potęgują natomiast aktywność antybiotyków
β
-laktamowych. Inhibitory
β
-laktamaz mają zdolność blokowania aktywności
enzymów plazmidowych, w tym penicylinaz gronkowcowych i enterokokowych, natomiast nie hamują cefalosporynaz
chromosomalnych (z wyjątkiem wytwarzanych przez pałeczki beztlenowe Bacteroides fragilis). Skojarzone z
antybiotykiem
β
-laktamowym chronią go przed hydrolizą i sprawiają, że może być aktywny wobec szczepów opornych
wytwarzających
β
-laktamazy plazmidowe. Do inhibitorów
β
-laktamaz należy:
• kwas klawulanowy
• tazobaktam
• sulbaktam
Metaloenzymy - Karbapenemazy (MBL - metallo-
β
-lactamase).
β
-laktamzy o specyficznej strukturze, zawierające w swym miejscu aktywnym metal (najczęściej Zn
2+
).
Hydrolizują penicyliny, penicyliny z inhibitorami, cefalosporyny (niższa aktywność wobec IV generacji i cefsulodyny) i
karbapenemy. Produkcji karbapenemaz MBL możemy spodziewać się u opornych na karbapenemy szczepów
Pseudomona aeruginosa, innych szczepów pałeczek Gram - ujemnych za wyjątkiem Stenotrophomonas matophilia,
który syntetyzuje karbapenemazy naturalnie.

6
Wykrywanie karbapenemaz
• metoda dyfuzyjno - krążkowa
Test wykonuje się na dwóch płytkach z podłożem Meuller-Hinton:
- na pierwszą z płytek z posianym szczepem badanym nakłada się dwa krążki: z ceftazydymem w odległości około 4 cm,
następnie w odległości około 2 cm od środków krążków nakładamy jałowy krążek bez antybiotyku, na który nakrapia się
2μl kwasu 2-merkaptopropionowego
- na drugą płytkę z posianym jak wyżej szczepem badanym nakłada się analogicznie dwa krążki z imipenemem, a
na jałowy krążek nakrapia się l0 μl 0,5 M roztworu EDTA
O produkcji MBL świadczy pojawienie się wyraźnie powiększonej strefy zahamowania wzrostu wokół krążka z
ceftazydymem/imipenemem od strony krążka zawierającego inhibitor karbapenemaz (kw. 2-merkaptopropionowy, 0,5 M
EDTA)
• E - testy MBL
Pasek E-test MBL jest nośnikiem gradientu stężeń dla impenemu IP (karbapenem) oraz imipenemu i stałego stężenia
EDTA (inhibitor karbapenemaz) —IPI . Wynik jest dodatni dla MBL kiedy stosunek MIC IP/IPI wynosi >8. Deformacja
elipsy IP również oznacza obecność MBL. E-test MBL jest akceptowaną metodą wykrywania MBL, jednakże wszystkie
pozytywne fenotypy MBL należy przesłać do laboratorium referencyjnego w celu potwierdzenia testem
genotypowym.
a)
b)
Rycina 4. Wykrywanie ESBL przy pomocy E-testu: a) MIC IP IPI=16 <1= 16- >MBL(+)
b) deformacja elips dla IP świadczy o MBL(+)
β-laktamazy – karbapenemazy KPC – to enzymy hydrolizujące wszystkie karbapenemy
(imipenem, meropenem, ertapenem, doripenem), a więc antybiotyki uważane za leki ostatniej
szansy w leczeniu zakażeń wywoływanych przez pałeczki Gram-ujemne, a także wszystkie
pozostałe antybiotyki β-laktamowe (penicyliny, cefalosporyny, monobaktamy). Enzymy te są
stosunkowo słabo hamowane przez inhibitory β-laktamaz (kwas klawulanowy, sulbaktam,
tazobaktam), dlatego połączenia inhibitorów z β-laktamami nie znajdują żadnego
zastosowania.
Enzymy te wytwarzane są najczęściej przez szczepy Klebsiella pneumoniae, ale zaobserwowano już
ich wytwarzanie przez szczepy Klebsiella oxytoca, Raoultella spp., Escherichia coli, Citrobacter
freundii, Enterobacter spp., Serratia marcescens, Salmonella enterica, a nawet Pseudomonas
aeruginosa i Pseudomonas putida. Szczepy Klebsiella pneumoniae KPC+ są zazwyczaj wrażliwe
jedynie na kolistynę, tygecyklinę, gentamycynę i niekiedy na amikacynę. Brak jest jednak obecnie
badań klinicznych udowadniających skuteczność tych antybiotyków w leczeniu zakażeń wywołanych
przez szczepy KPC+ (są one stosowane z powodu braku innych opcji terapeutycznych).
- Oporność na aminoglikozydy wynikająca z enzymatycznej modyfikacji leku
Niektóre drobnoustroje mają zdolność wytwarzania enzymów: acetylotransferazy, fosforylazy, nukleotydazy,
które modyfikują aminoglikozydy, czyniąc je niezdolnymi do wiązania się z docelowym rybosomem. Enzymy
modyfikujące znajdują się na powierzchni błony cytoplazmatycznej, modyfikacji ulegają więc tylko te cząsteczki
leku, które są transportowane przez błonę cytoplazmatyczną.

7
2. Oporność na antybiotyki β-laktamowe związana ze zmianą powinowactwa miejsca docelowego
działania antybiotyku
Mechanizm działania antybiotyków β-laktamowych polega na zahamowaniu syntezy ściany komórkowej.
Enzymy, które biorą udział w syntezie (karboksypeptydazy, transpeptydazy) z uwagi na zdolność wiązania się z
antybiotykami β-laktamowymi nazwano białkami wiążącymi penicyliny PBP. Liczba PBP w komórce jest różna i
charakterystyczna dla określonego gatunku, a poszczególne antybiotyki wykazują zróżnicowane do nich
powinowactwo. Oporność na antybiotyk może być skutkiem pojawienia się w komórce nowego białka PBP, o
niskim powinowactwie do antybiotyków β-laktamowych, ale nadal zachowanej funkcji biologicznej w syntezie
ściany komórkowej. Białko takie (PBP 2a określne również PBP 2’) występuje u tzw. metycylinoopornych
szczepów Staphylococcus aureus (MRSA - Methicillin Resistant S. aureus) i gronkowców koagulazo-
ujemnych (MRCNS - Methicillin Resistant Coagulase-Negative Staphylococci)
Szczepy gronkowców o takim mechanizmie oporności na metycylinę są oporne:
na wszystkie antybiotyki β-laktamowe: penicyliny, cefalosporyny, cefamycyny, karbapenemy, penicyliny
skojarzone z inhibitorami
Szczepy te mogą być również krzyżowo oporne z:
• makrolidami, linkozamidami, aminoglikozydami, chinolonami
Wykrywanie gronkowców opornych na metycylinę
Metoda dyfuzyjno-krążkowa
• Przygotować zawiesinę badanego szczepu gronkowca o gęstości odpowiadającej 0,5 jednostek w skali Mc
Farlanda
• Nanieść na podłoże Mueller-Hinton (MHA) badany szczep (jałową wymazówką nanieść badany szczep na
całą powierzchnie płytki 3-krotnie obracając ją o 60° ). Nałożyć krążek z cefoksytyną (30ug)
•
Po 24 godzinnej inkubacji zmierzyć strefę zahamowania wzrostu gronkowca (odczyt w przepuszczonym świetle w
świetle odbitym), którą należy porównać z podanymi kryteriami.
Wykazano, że cefoksytyna może być lepszym wskaźnikiem oporności na metycylinę. Krążkiem z cefoksytyną mogą być
wykrywane również tzw. szczepy preMRSA, które posiadają gen mec A, natomiast są
wrażliwe in vitro na metycylinę. Na
podstawie wyniku oznaczenia uzyskanego z zastosowaniem cefoksytyny (30ug) można identyfikować oporność na
metycylinę u wszystkich gatunków gronkowców.
Dla innych niż Staphylococcus epidermidis gronkowców koagulazo - ujemnych metoda dyfuzyjno-
krążkowa może dawać wyniki fałszywej oporności (pomimo braku obecności genu mec A szczep wykazuje
oporność na metycylinę). W związku z tym zalecane jest, aby dla szczepów MRCNS opornych na metycylinę
wykonywać identyfikacje genu mec A metodą PCR.
Metoda przeglądowa z oksacyliną (tylko dla Staphylococcus aureus)
Na podłoże MHA z oksacyliną w stężeniu 6mg/l i dodatkiem 4% NaCl nanieść zawiesinę bakteryjną o gęstości 0,5
McFarlanda. Wzrost więcej niż jednej kolonii oznacza oporność na metycylinę. Odczytywać w świetle przechodzącym!
-
Testy polegające na wykrywaniu białka PBP 2A (PBP2') - testy pozwalają na wykrycie nowego
białka, produktu genu mec A, warunkującego oporność na metycylinę.
• MRSA - Screen - Denka Seiken (Innogenetics)
• Slidex MRSA Detection (bio Merieux)
• Oxoid PBP2' - DR900M (Oxoid)
-
Metody automatyczne
• test ATB OXA lub ATB STAPH (bio Merieux)
• test Cristal MRSA ID
• test Phoenix Panel Gram Positive PMIC/5 ID(Becton Dickinson)
Oporność na glikopeptydy
Oprócz drobnoustrojów naturalnie opornych na glikopeptydy (Pałeczki Gram - ujemne, Pediococcus,
Lactobacillus, Neisseria) coraz częściej spotyka się szczepy Enterococcus oporne na glikopeptydy (VRE) oraz
szczepy gronkowców o obniżonej wrażliwości na wankomycynę VISA (vancomycin - intermediate
8
Staphylococcus aureus). Geny oporności zlokalizowane są na chromosomie lub plazmidach, transpozonach i
wyróżniamy:
- Gen Van A - wysoka oporność indukowana na wankomycynę i oporność na teikoplaninę (gen
przenoszony na plazmidzie dotyczy enterokoków, gronkowców, paciorkowców, Listerii)
- Gen Van B - średnia oporność na wankomycynę i wrażliwość na teikoplaninę
- Gen Van C - oporność konstytuowana (wrodzona) na wankomycynę i wrażliwość na teikoplaninę
(E.gallinarum, E. casseliflavus, E. flavescens)
- Gen Van D - konstytutywna oporność na wankomycynę i oporność na małe stężenia teikoplaniny
- Gen Van E - niska oporność na wankomycynę i wrażliwość na teikoplaninę
Oporność ma makrolidy, linozamidy i streptograminy
Trzy grupy wymienionych antybiotyków, chociaż maja inną strukturę chemiczną, działają identycznie na
komórkę bakterii i mają wspólny mechanizm oporności. U bakterii Gram-dodatnich występują aż trzy odrębne
mechanizmy oporności oznaczające krzyżową oporność na makrolidy, linkozamidy, streptograminy. Oporność
MLS może być konstytuowana lub indukcyjna i składa się na nią:
- modyfikacja miejsca docelowego działania
- enzymatyczna modyfikacja antybiotyku
- aktywne usuwanie antybiotyku z komórki
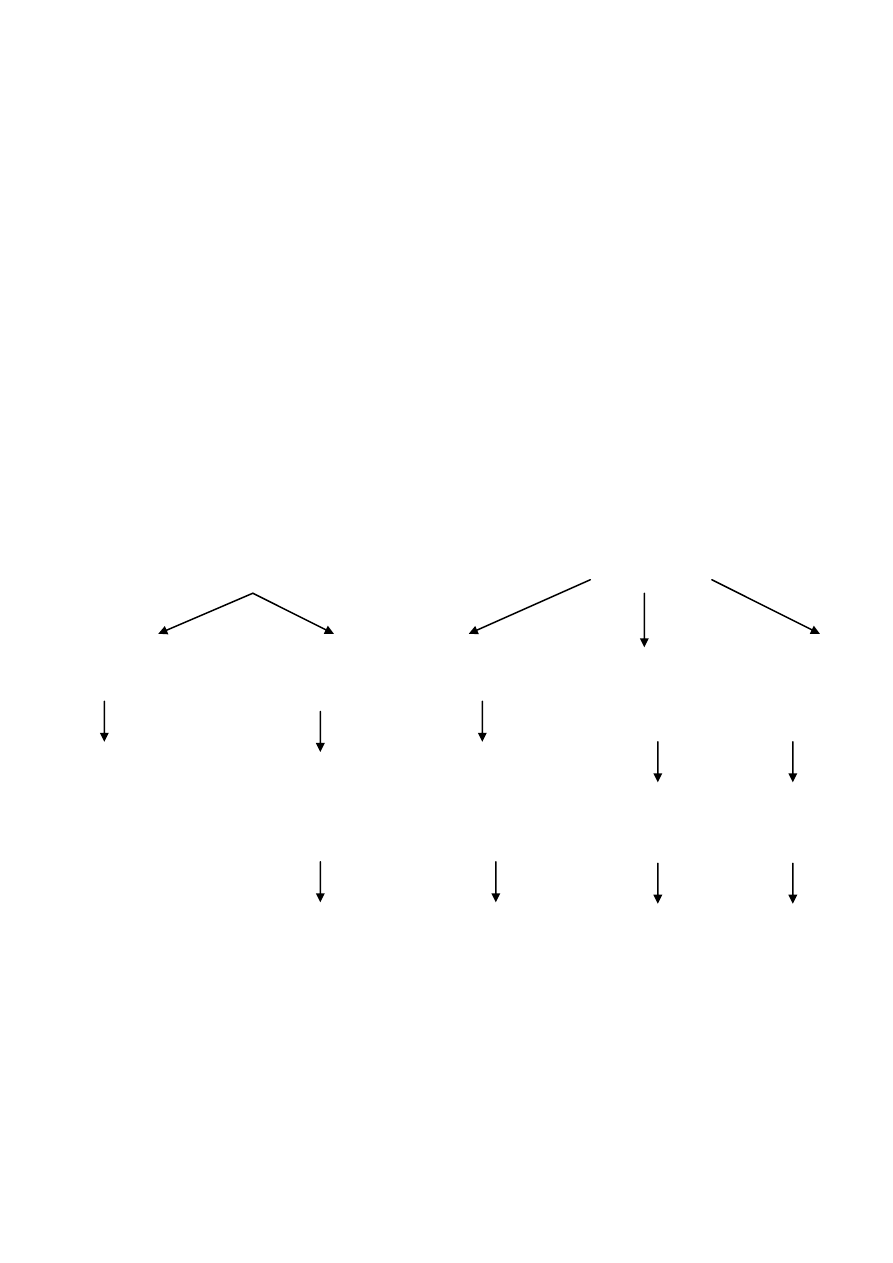
Identyfikacja fenotypu oporności na makrolidy i linkozamidy
Erytromycyna W
Erytromycyna O
Klindamycyna W
Klindamycyna O
Klindamycyna O
Klindamycyna W KlindamycynaW
spłaszczenie strefy brak spłaszczenia trefy
zahamowania wzrostu
Szczep wrażliwy
L-fenotyp lub błąd oznaczenia
mechanizm oporności mechanizm oporności mechanizm oporności
(zalecane powtórzenie badania)
MLS
B
konstytutywny MLS
B
indukcyjny
MS
B
nie stosować linkozamidów nie stosować makrolidów nie stosować makrolidów nie stosować
i linkozamidów i linkozamidów makrolidów
14 i 15-węglowych
9
Wykrywanie MLS
B
Metoda dyfuzyjno - krążkowa
Na posianą płytkę z badanym szczepem klinicznym nakłada się w odległości około 2 cm krążek z
erytromycyną (15μg) i klindamycyną (2μg). Jeżeli badany Gram-dodatni szczep jest oporny na
erytromycynę i widoczne jest ścięcie strefy zahamowania wzrostu dla klindamycyny od strony
erytromycyny, można przypuszczać oporność typu MLS
B
.
Coraz częściej stosuje się do wykrywania genu oporności sondy genetyczne. Ma to szczególne znaczenie u
drobnoustrojów wolno rosnących, u których w trakcie terapii pojawia się oporność (np. Mycobacterium tuberculosis -
prątki gruźlicy) lub u drobnoustrojów, u których mamy wątpliwości co do występującego mechanizmu oporności.
Warto pamiętać, że w komórce bakteryjnej mogą funkcjonować dwa lub trzy różne mechanizmy oporności na
antybiotyki z tej samej grupy
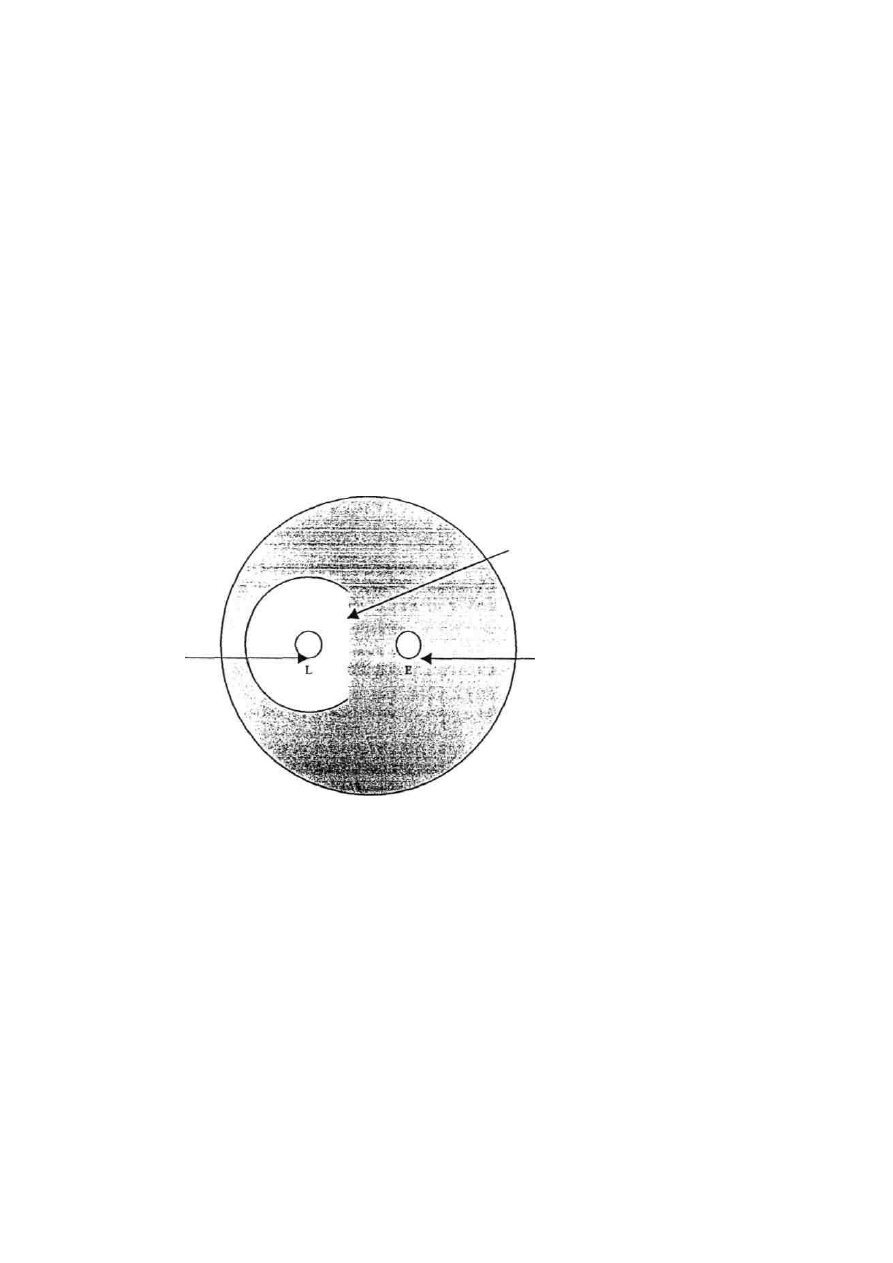
Rycina 5. Szczep Staphylococcus aureus wykazujący mechanizm oporności typu MLS
B
L – linkomycyna (linkozamid)
E – erytromycyna (makrolid)
Widoczne ścięcie strefy zahamowania
wzrostu dla linkomycycny
10
Część praktyczna
1. Wykonaj test cefinazowy dla wykrycia penicylinazy gronkowcowej.
Nałóż na szkiełko podstawowe krążek z nitrocefną, zwilż go jałową wodą destylowaną, rozetrzyj kilka
kolonii z 18-24-godzinnej hodowli badanego szczepu. Szkiełko umieść w pustej płytce Petriego i
inkubuj w temperaturze pokojowej 10-30 minut. Powstanie różowo-czerwonego zabarwienia świadczy o
wytwarzaniu
β-laktamazy (penicylinazy). Wynik zapisz w tabeli punktu 2.
2. Wykonaj badanie wrażliwości gronkowców na metycylinę metodą dyfuzyjno-krążkową z cefoksytyną
(30 μg).
Przygotuj zawiesinę szczepu gronkowca
o gęstości 0,5 jMcF w 0,9% jałowym roztworze NaCl (porównaj
zmętnienie z wzorcem). Jałową wymazówkę zanurz w zawiesinie, odciśnij nadmiar płynu o ściankę
probówki, a następnie wykonaj posiew drobnoustrojów na podłożu Mueller-Hinton (trzy razy obracając
płytkę o 60
o
). Odczekaj 15 minut i nanieś przy pomocy pęsety krążek z cefoksytyną. Po 15 minutowej
preinkubacji w temperaturze pokojowej, płytki włóż do cieplarki nastawionej na temperaturę 35
o
C.
Odczytaj średnicę strefy zahamowania wzrostu bakterii po 24- godzinnej inkubacji. Strefę zahamowania
wzrostu oglądaj w świetle odbitym.
Wpisz uzyskane średnice do tabeli i zinterpretuj wynik w oparciu o zamieszczone poniżej kryteria
Strefa
zahamowania
wzrostu w mm
Interpretacja*
Obecność
penicylinazy
Wnioski
Szczep 1
Szczep 2
* O – oporny (resistant)
W – wrażliwy (susceptible)
„+” – wytwarza penicylinazę
„-” – nie wytwarza penicylinazy
Kryteria interpretacji dla szczepu badanego Staphylococcus aureus.
Antybiotyk/stężenie
Średnica strefy zahamowania wzrostu w mm
Wrażliwy
MSSA
średnio
wrażliwy
Oporny
MRSA
Cefoksytyna 30 μg
≥ 22
-
< 22
3. Odczytaj i zinterpretuj wyniki badania wrażliwości szczepu Staphylococcus aureus na
makrolidy, linkozamidy (podane antybiotyki wchodzą w skład antybiogramu
podstawowego dla Staphylococcus aureus).
Antybiotyk
Oporny (o)
Wrażliwy (w)
Wynik w mm
Interpretacja*
Erytromycyna 15 μg
< 18
≥ 21
Klindamycyna 2 μg
< 18
≥ 21
* O – oporny (resistant) W – wrażliwy (susceptible)
Wynik oznaczenia wrażliwości na erytromycynę jest reprezentatywny dla roksytromycyny,
klarytromycyny, azytromycyny. Krążek z linkozamidem (klindamycyną 2
μg) należy układać
obok krążka z erytromycyną w celu identyfikacji indukowanej oporności na makrolidy, linkozamidy,
streptograminy MLS
B
.

11
4. Odczytaj i zinterpretuj wynik testu dwóch krążków wykrywającego ESβL u pałeczek z
rodziny Enterobacteriaceae.
Antybiotyk/stężenie
Wynik
Interpretacja
Amoksycylina/kw.
klawulanowy (AMC)
Ceftazydym (CAZ)
Cefotaksym (CTX)
Aztreonam (ATM)
„+” – wynik pozytywny – pojawienie się dodatkowej strefy zahamowania wzrostu przy krążku
CAZ, CTX, ATM od strony krążka z inhibitorem AMC wskazuje na aktywność ESβL
„-„ – wynik ujemny
Wyszukiwarka
Podobne podstrony:
osnowa - ćwiczenia a rozciągnięcie mięśni barkowych, konspekty AWF,WF, konspekty, konspekty, konspe
PODZIAŁ ĆWICZEŃ GIMNASTYCZNYCH, wf konspekty
prak ćwiczenia, konspekty AWF,WF, konspekty, Gimnastyka korekcyjna, GIMNASTYKA
Cwiczenia kształtujuące, KONSPEKTY WF, GIMNASTYKA
Ćwiczenia korekcyjne na lekcji wf, Korektywa
ćwiczenia sprawnościowe, konspekty AWF,WF, konspekty, Gimnastyka korekcyjna, GIMNASTYKA
prak ćwiczeniaok, konspekty AWF,WF, konspekty, Gimnastyka korekcyjna, GIMNASTYKA
Zestaw ćwiczeń ze współćwiczącym, Edukacja w Sporcie, Metodyka WF
metodyka WF ćwiczenia - semestr III, Wychowanie fizyczne (hasł awf)
gimnastyka - ćwiczenie kształtujące, konspekty AWF,WF, konspekty, konspekty, konspekty, gimnastyka
Ćwiczenia koordynacyjne z elementami techniki piłki siatkowej, WF, Piłka siatkowa
Ćwiczenia z gazetami(1), WF
Cwiczenie 10 WF id 99059 Nieznany
Ćwiczenia na drabinkach, WF
więcej podobnych podstron