
Chemia z elementami
chemii fizycznej
1
Korozja chemiczna i elektrochemiczna
Zapobieganie korozji

Chemia z elementami
chemii fizycznej
2
Korozja chemiczna i elektrochemiczna. Zapobieganie korozji
Korozją
nazywa się proces niszczenia
(degradacji) materiałów w wyniku reakcji
chemicznej lub elektrochemicznej, które
przebiegają na granicy kontaktu materiału
z
otaczającym środowiskiem.
Terminem korozja określa się głównie
niszczenie
metali. Często również niszczenie
materiałów niemetalicznych, np.: materiałów
budowlanych, drewna, tworzyw sztucznych,
spowodowane działaniem otaczającego
środowiska nazywa się korozją.
Korozja metali
, w
zależności od mechanizmu
procesu, dzieli się na
chemiczną
i
elektrochemiczną.

Chemia z elementami
chemii fizycznej
3
Korozja chemiczna i elektrochemiczna. Zapobieganie korozji
Korozja chemiczna
jest wynikiem reakcji
chemicznych, przebiegających na
granicy faz metal–
środowisko.
Ulegają jej metale w obecności
agresywnych gazów
(np. żelazo lub
aluminium w
obecności fluorowców) lub
cieczy nie będących elektrolitami (np.
aluminium w
tetrachlorku węgla).

Chemia z elementami
chemii fizycznej
4
Korozja chemiczna i elektrochemiczna. Zapobieganie korozji
Korozja elektrochemiczna
jest procesem,
któremu towarzyszy przepływ ładunków
elektrycznych przez granicę faz metal–elektrolit
(np. korozj
ę metali w roztworach kwasów, soli).
Przepływ ładunków elektrycznych jest
wynikiem działania mikro- lub makroogniw
galwanicznych na granicy faz metal–elektrolit.
Ogniwa
takie tworzą się wskutek
niejednorodności powierzchni metalu (np.
niejednorodność składu chemicznego, defekty
strukturalne) bądź niejednorodności
występujących w elektrolicie (np. różnice
w
składzie elektrolitu, różne stężenie tlenu).

Chemia z elementami
chemii fizycznej
5
Korozja chemiczna i elektrochemiczna. Zapobieganie korozji
W miejscach będących lokalnymi półogniwami
o ładunku ujemnym następuje przejście atomów
metalu M do elektrolitu w postaci jonów M
n+
z jednoczesnym oddaniem n elektronów e
–
:
M → M
n+
+ ne
–
W miejscach będących lokalnymi półogniwami
o ładunku dodatnim zachodzi proces, w którym
uwolnione elektrony są pobierane przez
depolaryzator, najczęściej tlen rozpuszczony
w elektrolicie (depolaryzacja tlenowa) lub jony
wodorowe (depolaryzacja wodorowa).
Odpowiednie schematy reakcji
biegnących
w tych półogniwach są następujące:
O
2
+ 4e
–
+ 2H
2
O
→ 4OH
–
2H
+
+ 2e
–
→ H
2

Chemia z elementami
chemii fizycznej
6
Korozja chemiczna i elektrochemiczna. Zapobieganie korozji
Rozróżnia się korozję równomierną oraz korozję
lokalną (plamową, wżerową, międzykrystaliczną,
śródkrystaliczną).
Szybkość korozji równomiernej
określa się
ubytkiem masy metalu z jednostkowej
powierzchni, w jednostkowym czasie i
wyraża
w
g/(cm
2
·godz.)
lub grubością warstwy
skorodowanej w jednostce czasu —
mm/rok
.
Miarą korozji lokalnej
są rozmiary i gęstość
rozmieszczenia ognisk korozji. Miarą korozji
międzykrystalicznej i śródkrystalicznej mogą
być np. zmiany wytrzymałości lub przewodności
elektrycznej metalu.

Chemia z elementami
chemii fizycznej
7
Korozja chemiczna i elektrochemiczna. Zapobieganie korozji
Ze względu na charakter fizykochemiczny środowiska
rozróżnia się korozję:
gazową,
korozję w elektrolitach,
korozję w nieelektrolitach,
korozję atmosferyczną,
korozję biologiczną, zw. biokorozją (np. w wodzie
morskiej.),
korozję w glebie.
Szybkość korozji (jak każdej reakcji) zależy m.in. od
temperatury, wilgotności powietrza, zanieczyszczenia
środowiska, stężenia czynnika agresywnego.
Proces
korozji może zachodzić również w wyniku
jednoczesnego działania środowiska i innych
czynników, np. naprężenia (korozja naprężeniowa),
prądów błądzących.
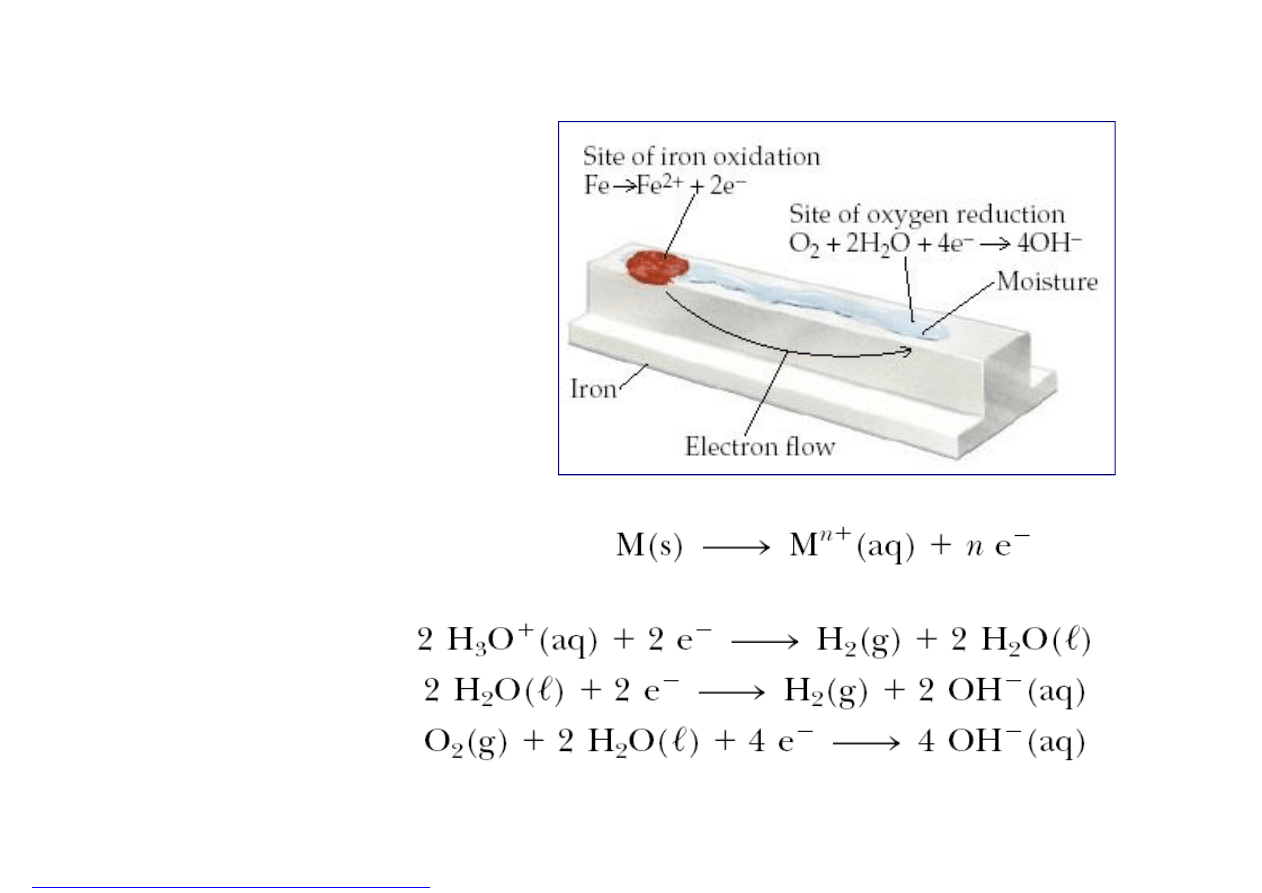
Chemia z elementami
chemii fizycznej
8
Reakcja utleniania metalu:
Reakcje redukcji jonu wodorowego lub tlenu:
Korozja
elektrochemiczna
stali

Chemia z elementami
chemii fizycznej
9
Korozja stali bez dostępu tlenu
Korozja stali na powietrzu (z udziałem tlenu)
Korozja elektrochemiczna stali
W obecności tlenu korozja elektrochemiczna przebiega 100 razy
szybciej

Chemia z elementami
chemii fizycznej
10
Korozja elektrochemiczna stali
Skutki korozji elektrochemicznej prętów zbrojeniowych
w wodzie morskiej

Chemia z elementami
chemii fizycznej
11
Korozja elektrochemiczna
Skutki korozji elektrochemicznej rury stalowej i prętów
zbrojeniowych w wodzie morskiej

Chemia z elementami
chemii fizycznej
12
Zapobieganie korozji
Stosuje się kilka sposobów zabezpieczania metali przed
korozją:
•
1) odizolowanie metalu od środowiska korozyjnego
przez zastosowanie powłok ochronnych, tzw.
środków ochrony czasowej (np. warstwy farb
organicznych lub nieorganicznych, opakowania
ochronne, pasywacja)
;
•
2) zmniejszenie aktywności środowiska korozyjnego
przez usunięcie depolaryzatora lub wprowadzenie
substancji hamujących korozję — tzw. inhibitorów;
•
3) zabezpieczenie przed korozją metodami
elektrochemicznymi, polegającymi na nadaniu
chronionemu metalowi potencjału ujemnego
utrudniającego przejście metalu w postaci kationów
do roztworu.

Chemia z elementami
chemii fizycznej
13
Zapobieganie korozji
PASYWACJA
- proces chemiczny lub
elektrochemiczny, powodujący zwiększenie
odporności korozyjnej metalu przez wytworzenie na
jego powierzchni bardzo cienkiej (ale szczelnej
i
dobrze związanej z podłożem) warstewki tlenków lub
soli. Wytworzenie
tej warstewki powoduje zmianę
potencjału elektrycznego metalu. Pasywacja
niektórych metali, np. chromu, niklu, aluminium,
zachodzi samorzutnie (
samopasywacja
) pod
działaniem tlenu zawartego w powietrzu. Zwykle
jednak pasywację przeprowadza się w kąpielach
utleniających (
oksydowanie
).
Wprowadzenie do
żelaza określonej ilości metalu
samopasywującego
się zwiększa zdolność
powstałego stopu do pasywacji, dlatego np. stosuje
się chrom i nikiel jako dodatki do stali nierdzewnych.

Chemia z elementami
chemii fizycznej
14
Zapobieganie korozji
INHIBITOR KOROZJI
- substancja, która dodana
w
niewielkiej ilości do środowiska reakcji chemicznej
powoduje zmniejszenie szybkości lub niekiedy
całkowite zatrzymanie biegu reakcji.
Działanie inhibitorów polega najczęściej na zwiększeniu
energii aktywacji reakcji chemicznej
(elektrochemicznej) lub zablokowaniu mechanizmów
transportu masy.
Inhibitory są często stosowane w praktyce, np.
inhibitory dodawane do polimerów zapobiegają
dalszej ich polimeryzacji, inhibitory starzenia gumy
przeciwdziałają jej utlenianiu, tzw. inhibitory korozji
chronią metale przed niszczącym działaniem
środowiska.

Chemia z elementami
chemii fizycznej
15
Zapobieganie korozji
Ochrona elektrochemiczna
Ochronę elektrochemiczną
osiąga się w wyniku
polaryzacji katodowej, przez włączenie metalu
chronionego jako
katody
(elektroda ujemna) w obwód
zewn
ętrznego źródła prądu (
ochrona katodowa
) lub
przez połączenie chronionego metalu z metalem mniej
szlachetnym Zn, Mg, Al. (
ochrona protektorowa
).
O
bydwa rodzaje ochrony mają duże znaczenie
w
zabezpieczaniu przed korozją rurociągów,
kadłubów okrętów, zbiorników, mostów, budynków
stalowych.
W
przypadku metalu ulegającego pasywacji można
chroniony metal włączyć jako anodę (elektrodę
dodatnią) w obwód zewnętrznego źródła prądu
(
ochrona anodowa
).
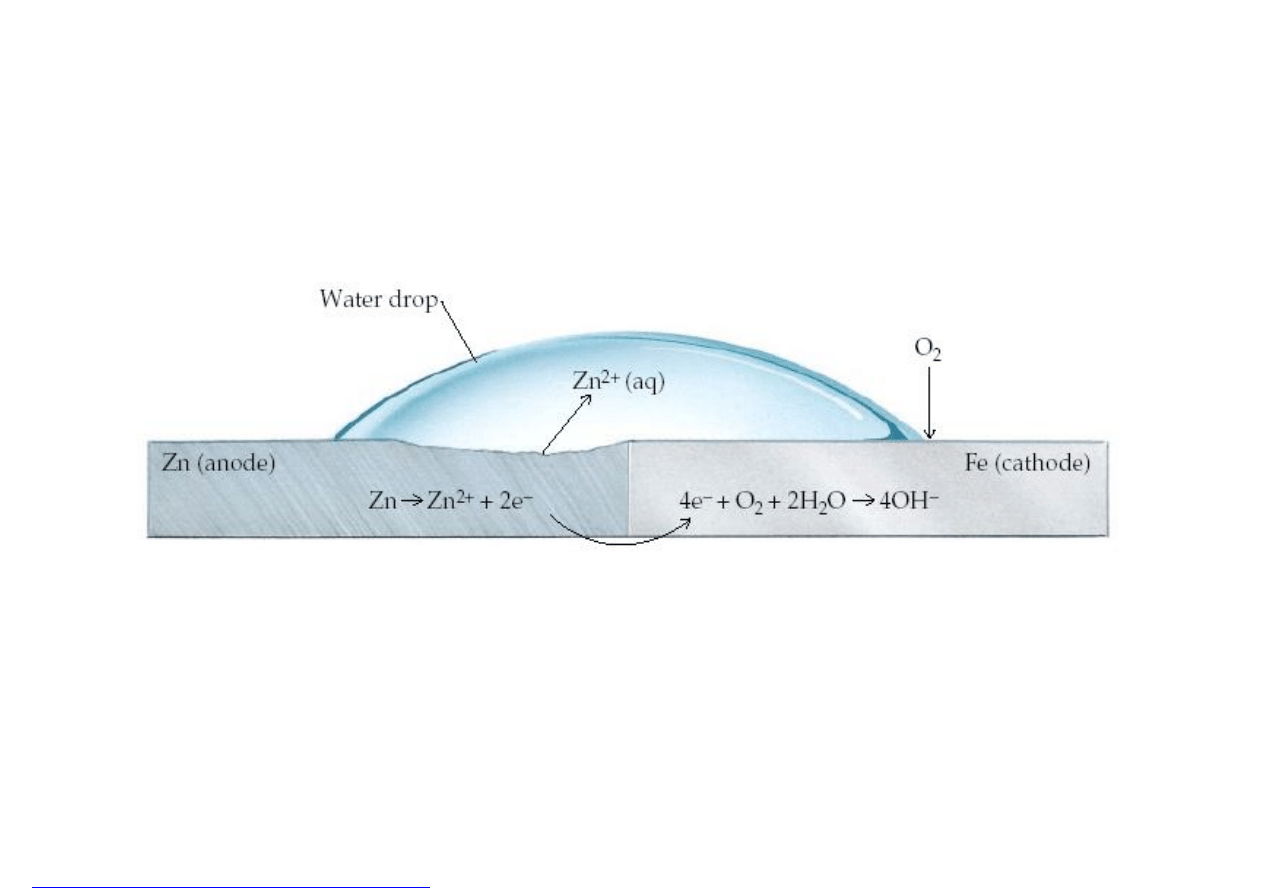
Chemia z elementami
chemii fizycznej
16
Zapobieganie korozji elektrochemicznej
Mechanizm ochronnego działania cynku
Gdy element stalowy znajduje się w kontakcie z cynkiem lub magnezem najpierw
rozpuszcza się cynk (magnez) nadając ujemny potencjał elementowi stalowemu.
Ujemny potencjał stali zapobiega przechodzeniu jonów żelaza do roztworu,
a tym samym zapobiega korozji stali.
Wyszukiwarka
Podobne podstrony:
Agresja wśród dzieci oraz sposoby jej zapobiegania, Agresja wśród dzieci oraz sposoby jej zapobiegan
Agresja wśród dzieci oraz sposoby jej zapobiegania, Agresja wśród dzieci oraz sposoby jej zapobiegan
korupcja i jej zapobieganie
Korozja i jej rodzaje
1 Ch Lab Miar KZ Bud 2010 SN
Przyczyny zanieczyszczenia hydrosfery i sposoby jej zapobiegania
Korozja metali i jej sposoby zapobiegania, technik bhp
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
kk, ART 105 KK, Postanowienie SN z dnia 28 lipca 2010 r
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA I ZAPOBIEGANIE KOROZJI
kkw, ART 24 KKW, Postanowienie SN z dnia 29 września 2010 r
kk, ART 228 KK, Postanowienie SN z dnia 30 września 2010 r
Długoterminowe badania laboratoryjne wpływu inhibitorów korozji na tempo jej rozwoju w prętach zbroj
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
KOROZJA PODSTAWY TEORETYCZNE I SPOSOBY ZAPOBIEGANIA
więcej podobnych podstron