LABORATORIUM Z BIOCHEMII
Aminokwasy
Aminokwasy
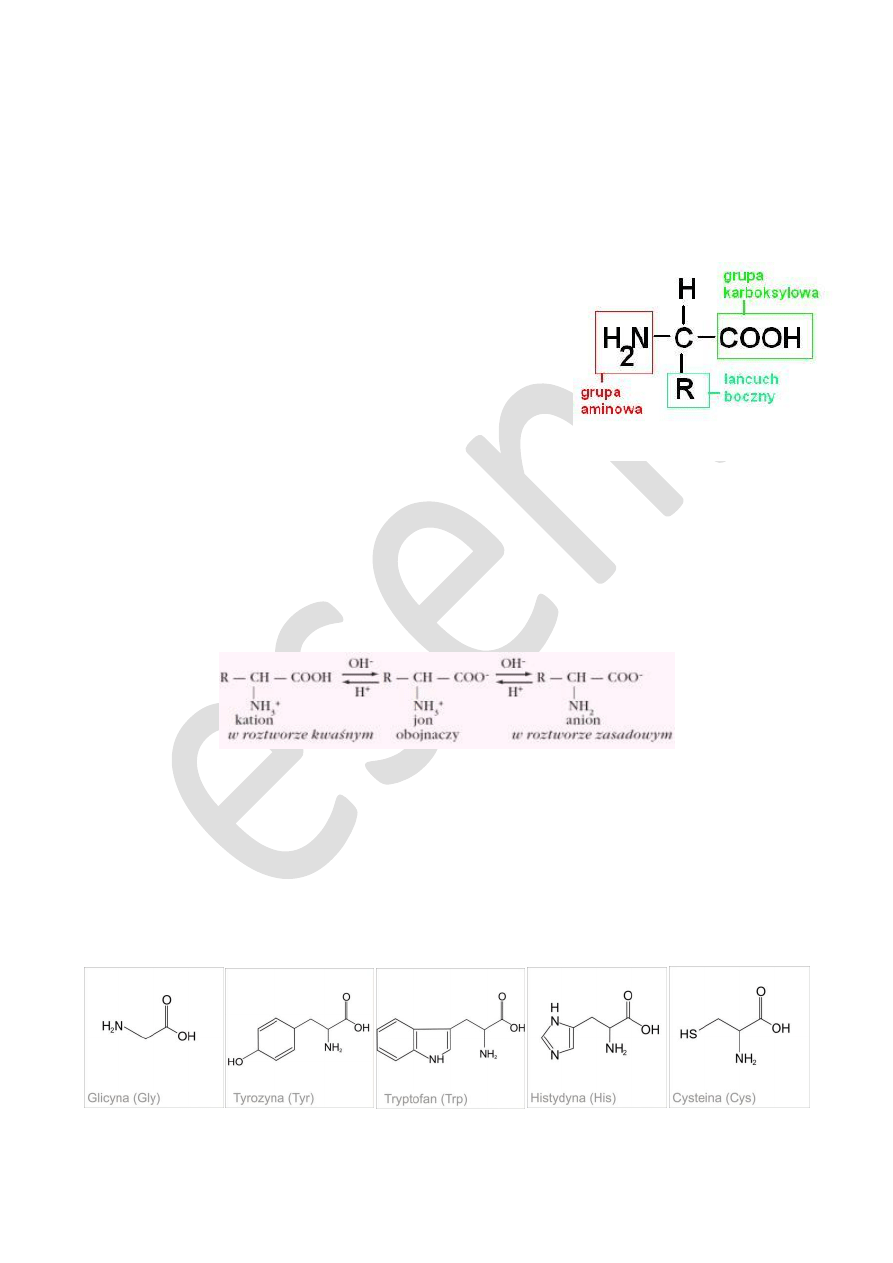
– są małocząsteczkowymi związkami organicznymi, które zawierają dwie grupy funkcyjne:
aminową
(-NH
2
),
oraz kwasową
(karboksylową –COOH); są zatem aminowymi pochodnymi niższych kwasów tłuszczowych.
Ich podstawową biologiczną funkcją jest udział w tworzeniu białek, które są ważnym składnikiem każdej żywej komórki.
Aminokwasy proteinogenne
– są to aminokwasy niezbędne w biosyntezie białka, standardowe aminokwasy białek.
Aminokwasy proteinogenne można podzielić na endogenne (takie, które produkowane są przez organizm człowieka, np.
alanina, cysteina, glicyna), egzogenne (nie są syntetyzowane przez organizm człowieka, muszę być dostarczane wraz z
pożywieniem, np. fenyloalanina, leucyna, lizyna).
Asymetryczny atom węgla (chiralny)
– atom węgla połączony z cztere-
ma różnymi podstawnikami (hybrydyzacja sp
3
). Atom taki stanowi cen-
trum chiralności cząsteczki. Jeżeli w cząsteczce występuje tylko jeden
asymetryczny atom węgla to cały układ nie ma płaszczyzny symetrii ani
środka symetrii i wykazuje czynność optyczną.
Amfoteryczność aminokwasów
– ważną właściwością aminokwasów jest
ich amfoteryczny charakter. Związkami amfoterycznymi (amfoterami, am-
folitami) określane są substancje, które zachowują się zarazem jak
kwas i
zasada
. Aminokwasy spełniają ten warunek dzięki jednoczesnej obecności w cząsteczce grup kwasowych (protonodaw-
ców) oraz zasadowych (protonobiorców).
Aminokwasy, podobnie jak kwasy i zasady, ulegają dysocjację i występują w postaci cząsteczek naładowanych. W za-
leżności od odczynu środowiska roztworze aminokwasu przeważa albo obdarzona ładunkiem dodatnim forma kationowa (słaby
kwas) albo ujemnie naładowana forma anionowa (słaba zasada) lub postać jonu obojnaczego (amfijonu), posiadająca wypadko-
wy ładunek równy zero (ilość ładunków dodatnich i ujemnych cząsteczki jest taka sama).
Punkt izoelektryczny (pI) aminokwasu
– to taka wartość pH, przy której roztwór aminokwasu wykazuje najniższe
przewodnictwo elektryczne.
pH<pI kation (AK
+
) (słaby kwas) pH=pI (AK
0
) (amfijon) pH<pI anion (AK
-
) (słaba zasada)
Podział aminokwasów ze względu na właściwości łańcucha bocznego.
aminokwasy niepolarne (o alifatycznym łańcuchu bocznym:
glicyna, alanina, walina, leucyna, izoleucyna
oraz
prolina
i
aromatyczna
fenyloalanina
)
aminokwasy polarne lecz nie zjonizowane (zawierające siarkę
: cysteina i metionina
; posiadające grupę hydroksylową:
seryna, treonina, tyrozyna
oraz
tryptofan
z ugrupowaniem indolowym)
aminokwasy „kwasowe” (zawierające dodatkową grupę karboksylową:
kwas asparaginowy i glutaminowy
)
aminokwasy „zasadowe” ( z dodatkową grupą aminową
lizyna, arginina
z ugrupowaniem guanidynowym oraz
histydyna
z silnie zasadowym pierścieniem imidazolowym).
wzór ogólny aminokwasów
Zasady oznaczeń aminokwasów.
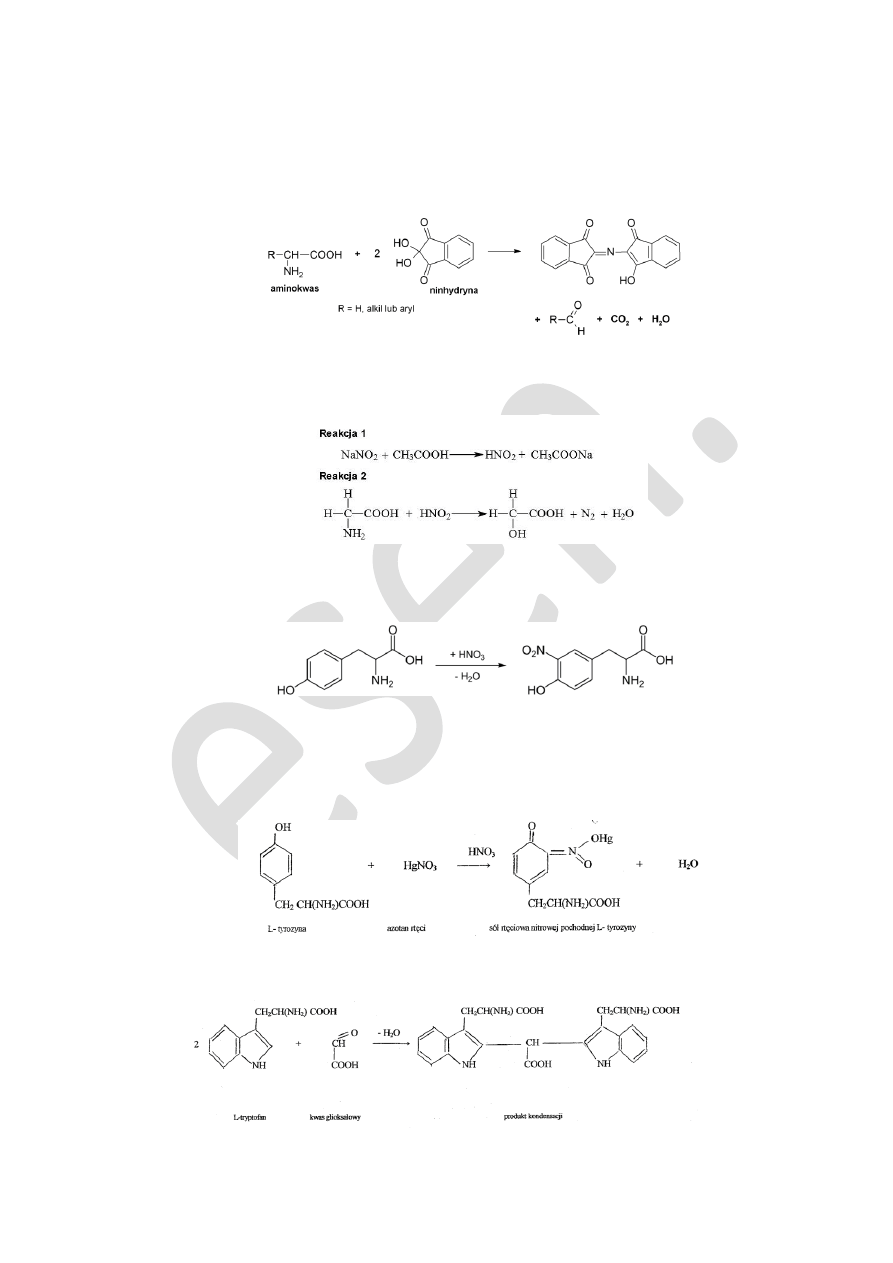
Odczyn ninhydrynowy.
Odczyn ninhydrynowy należy do metod ogólnych analizy aminokwasów. Istotą oznaczenia jest złożona reakcja amino-
kwasów z ninhydyrną, obejmująca dwa etapy. W pierwszym etapie pod wpływem ninhydyrny cząsteczka aminokwasu utlenia się
i przemienia do uboższego o jeden atom węgla aldehydu. Wydziela się amoniak i dwutlenek węgla. Następnie w wyniku konden-
sacji, za pośrednictwem uwolnionej z aminokwasu cząsteczki amoniaku, cząsteczek zredukowanej i utlenionej ninhydyrny po-
wstaje barwny związek. Intensywność zabarwienia próby jest wprost proporcjonalna do ilości uwolnionego amoniaku, a w konse-
kwencji do zawartości aminokwasu w próbie.
Reakcja z kwasem azotowym wg. Van Slyke’a.
Aminokwasy pod wpływem kwasu azotowego (III), tworzącego się według reakcji pierwszej, ulegają reakcji deaminacji,
której produktami są: azot cząsteczkowy (wydzielający się w formie gazowej) oraz odpowiedni hydroksykwas. Deaminacja α-
aminokwasu przebiega zgodnie z drugą reakcją:
Reakcja ksantoproteinowa. (dla aminokwasów aromatycznych)
Podczas ogrzewania aminokwasów aromatycznych ze stężonym kwasem azotowym pierścień aromatyczny ich łańcucha
bocznego ulega nitrowaniu. Powstałe nitrowe pochodne wykazują w środowisku zasadowym intensywnie żółtopomarańczowe
zabarwienie.
Reakcja Millon’a. (dla tyrozyny)
Reakcja Millona jest charakterystyczna dla tyrozyny. Badany roztwór zabarwia się na czerwono. W przypadku białek
zawierających tyrozynę powstają pomarańczowe lub czerwone strąty. Następuje reagowanie jonów rtęciowych ze słabo kwaśną
grupą fenolową. Należy pamiętać, że dodatnią reakcję z odczynnikiem Millona dają fenole. Jest to tzw. rtęciowanie pierścienia
fenolowego. Odczynnik Millona zawiera azotan rtęciowy, azotan rtęciawy i wolny kwas azotowy.
Reakcje charakterystyczne dla tryptofanu. A – reakcja wg. Rosenheim’a, B – reakcja wg. Adamkiewicza Hopkins’a.
Pierścień indolowy, charakterystyczny dla łańcucha bocznego tryptofanu, tworzy w obecności czynnika utleniającego
barwne produkty kondensacji, powstające za pośrednictwem reszty aldehydu mrówkowego lub kwasu glioksalowego.

Odczyn Pauly’ego dla histydyny.
Reakcja prowadząca do otrzymania barwnej pochodnej diazowej powstałej w wyniku sprzęgania wytworzonego z kwasu
sulfanilowego diazozwiązku ze składową azową, którą stanowi reszta histydyny zawierająca silnie zasadowy pierścień imidazo-
lowy. Wytworzony produkt wykazuje intensywnie czerwone (o odcieniu żółtoczerwonym) zabarwienie. Podobny odczyn daje
również tyrozyna.
Reakcja cystynowa.
W trakcie ogrzewania białek z ługiem dochodzi do ich hydrolizy, zaś zawarta w cystynie i cysteinie siarka ulega uwol-
nieniu w postaci jonów siarczkowych, które to z jonami Pb
2+
dają czarny osad PbS. Metionina (inny aminokwas siarkowy) nie
daje dodatniego wyniku, gdyż jej atom siarki jest osłonięty grupą metylenową i w warunkach oznaczenia nie odłącza się od czą-
steczki.
Wyszukiwarka
Podobne podstrony:
aminokwasy teoria 15
AMINOKWASY teoria id 59145 Nieznany
2Filtry analogowe, Elektrotechnika AGH, Semestr V zimowy 2014-2015 - MODUŁ C, semestr V (moduł C), T
Teoria Informacji Wykład 6 (08 04 2015)
11. Wykład z teorii literatury - 26.01.2015, Teoria literatury, Notatki z wykładu dr hab. Skubaczews
Teoria Pola laboratorium 2, Informatyka WEEIA 2010-2015, !!!Materiały!!!, Podstawy grafiki komputero
teoria bia-ka i aminokwasy, AMINOKWASY I BIAŁKA
kolokwium2-ts, Elektrotechnika AGH, Semestr V zimowy 2014-2015 - MODUŁ C, Teoria i Przetwarzanie Syg
10. Wykład z teorii literatury - 12.01.2015, Teoria literatury, Notatki z wykładu dr hab. Skubaczews
FiltryAdaptacyjne sprawozdanie, Elektrotechnika AGH, Semestr V zimowy 2014-2015 - MODUŁ C, Teoria i
filtracja adaptacyjna, Elektrotechnika AGH, Semestr V zimowy 2014-2015 - MODUŁ C, Teoria i Przetwarz
FIRy, Elektrotechnika AGH, Semestr V zimowy 2014-2015 - MODUŁ C, Teoria i Przetwarzanie Sygnałów, Ko
EGZAMIN-ANATOMIA-2015-weterynaria, I ROK 2014-2015, Anatomia, EGZAMIN, Teoria
projekty-2011-2012, Elektrotechnika AGH, Semestr V zimowy 2014-2015 - MODUŁ C, semestr V (moduł C),
Wywieranie wplywu na ludzi Teoria i praktyka dodruk 2015 bez CD Cialdini Robert
skrypt cz I teoria Jak wspolpracowac z absolwentami(2015)
więcej podobnych podstron