
Spalanie

Chemia spalania
Typy Reakcji chemicznych:
1. Jednocząsteczkowe (I – rzędu)
A→B+C
(np.: C2H6→2CH3)
2. Dwucząsteczkowe (II – rzędu)
A+B→C+D
(np.: C+O2→CO
2
)
3. Trójcząsteczkowe (III – rzędu)
A+B+C→D+E
(np.: 2NO +O
2
→
2NO
2
)

Składniki reakcji chemicznych
(reagenty)
1. Cząstki stabilne:
O
2
, H
2
, N
2
,…
2. Cząstki wzbudzone
O2*, CO
2
*, N
2
*,…
3. Rodniki:
O, N, H, C, OH, HO2, CH, CH3, …
Rodniki - atomy lub cząsteczki posiadające jeden lub więcej
wolnych (niesparowanych) elektronów
Stężenie rodników w płomieniu jest niewielkie (10
-5
-10
-12
mol/m
3
)
ale ich rola jest bardzo ważna ponieważ są bardzo reaktywne i
niosą dużą energię

Jak powstają rodniki
1. Reakcje dysocjacji termicznej
NH
4
Cl → NH
3
+ HCl
(chlorek amonu na amoniak i chlorowodór)
2. Reakcje dysocjacji foto
NO2+νh→NO+O
3. Reakcje rozgałęzienia:
H+O2→O+OH
O+H2→H+OH

Szybkość reakcji – wpływ stężeń
I – rzędu A→B+C
Gdzie: k –stała szybkości reakcji; C
A
stężenie A [mol/m
3
]
II – rzędu) A+B→C+D
III – rzędu A+B+C→D+E
A
A
C
k
dt
dC
⋅
−
=
B
A
A
C
C
k
dt
dC
⋅
−
=
C
B
A
A
C
C
C
k
dt
dC
⋅
−
=

Szybkość reakcji – wpływ ciśnienia
Stężenie czynnika C
A
określa się w [mol/m3], co jest
proporcjonalne do gęstości (kg/m3), a gęstość z równania stanu
gazu jest proporcjonalna do ciśnienia p:
więc szybkość reakcji zależy od ciśnienia i rzędu reakcji:
n – rząd reakcji
n
A
p
dt
dC
−
≈
pRT
ρ
=

Szybkość reakcji – wpływ temperatury
Prawo Arrheniusa
Gdzie: k
o
–współczynnik przedekspotencjalny;
E – energia aktywacji (J/mol);
T – temperatura (K);
R – uniwersalna stała gazowa (J/(mol i K)
)
/( RT
E
o
e
k
k
−
⋅
=

Reakcje elementarne
Reakcja elementarna w chemii to nazwa pojedynczego aktu
zrywania lub powstawania poszczególnych wiązań chemicznych,
które mają miejsce w trakcie rzeczywistych reakcji chemicznych
H+O
2
→
H
2
O
Są to przede wszystkim reakcje rodnikowe, jak wyżej. Rząd ich
reakcji odpowiada liczbie składników reakcji

Reakcje złożone
Reakcja złożona to zapis między stabilnymi substratami, dającymi
stabilne produkty, np.:
CH
4
+2O
2
→
CO
2
+2H
2
O
Jest to zapis związku substraty produkty do którego dochodzi w
wyniku zaistnienia wielu reakcji elementarnych (rodnikowych).

Typy reakcji rodnikowych
1.Reakcje rozgałęzienia (rodników R):
R+A→R1+R2
2.Reakcje propagacji:
R+A→R2+B
3.Reakcje rekombinacji:
R+A+M→AB+M
Reakcje trójcząsteczkowe (rekombinacji):
A+B+M→C+M
M – trzecie ciało (O
2
, N
2
, H
2
, H
2
O, …) pochłaniające energię
przebudowy związku.
H+O
2
+M→HO
2
+M
H+OH+M→H
2
O+M

Mechanizm spalania: układ H
2
+O
2
Reakcje z tego układu występują w reakcjach wszystkich paliw
kopalnych
H+O
2
→
O+OH
r. rozgałęzienia
O+H
2
→
H+OH
r. rozgałęzienia
OH+H
2
→
H+H
2
O
r. propagacji
H+O
2
+M →H
2
O+M
r. rekombinacji

Mechanizm spalania: układ H
2
+O
2
Rekombinacja rodników wnosi największy wkład do energii
wewnętrznej spalin w strefie płomiennej:
H+H+M→H
2
+M
H+OH →H
2
O+M
OH+HO
2
+M →H
2
O+O
2
M

Mechanizm spalania: utlenianie CO
CO jest półproduktem spalania wszystkich paliw kopalnych i
utlenia się powoli. W płomieniu CO utlenia się prawie wyłącznie
w reakcji:
CO+OH →CO
2
+H
Z tego względu dla utleniania CO potrzebna jest w strefie reakcji
woda. Dodatkowo występuje równierz reakcja trójmolekólarna :
CO+O+M →CO
2
+M
mająca marginalne znaczenie dla szybkości spalania CO

Mechanizm spalania: węglowodory
Paliwa kopalne składaja się z węglowodorów, których utlenianie
obejmuje bardzo złożone mechanizmy. Możemy je podzielić na
dwie grupy:
•Mechanizm utleniania niskotemperaturowy (zimne płomienie,
silniki diesla)
•Mechanizm utleniania wysokotemperaturowy (spalanie
wysokotemperaturowe)

Wysokotemperaturowe utlenianie
węglowodorów
W spalaniu płomiennym ważny jest mechanizm
wysokotemperaturowy utleniania węglowodorów (RH, R – rodnik)
Utlenianie węglowodorów zaczyna się od reakcji rodników:
RH + H → R + H
2
RH + OH → R + H
2
O
RH + O→R + OH
W dalszym ciągu następuje rozbicie rodników R na mniejsze
rodniki, które w kolejnych reakcjach przekształcają się do
pólproduktów spalania CHO i CO, utlenianych na końcu do CO
2
i H
2
O.
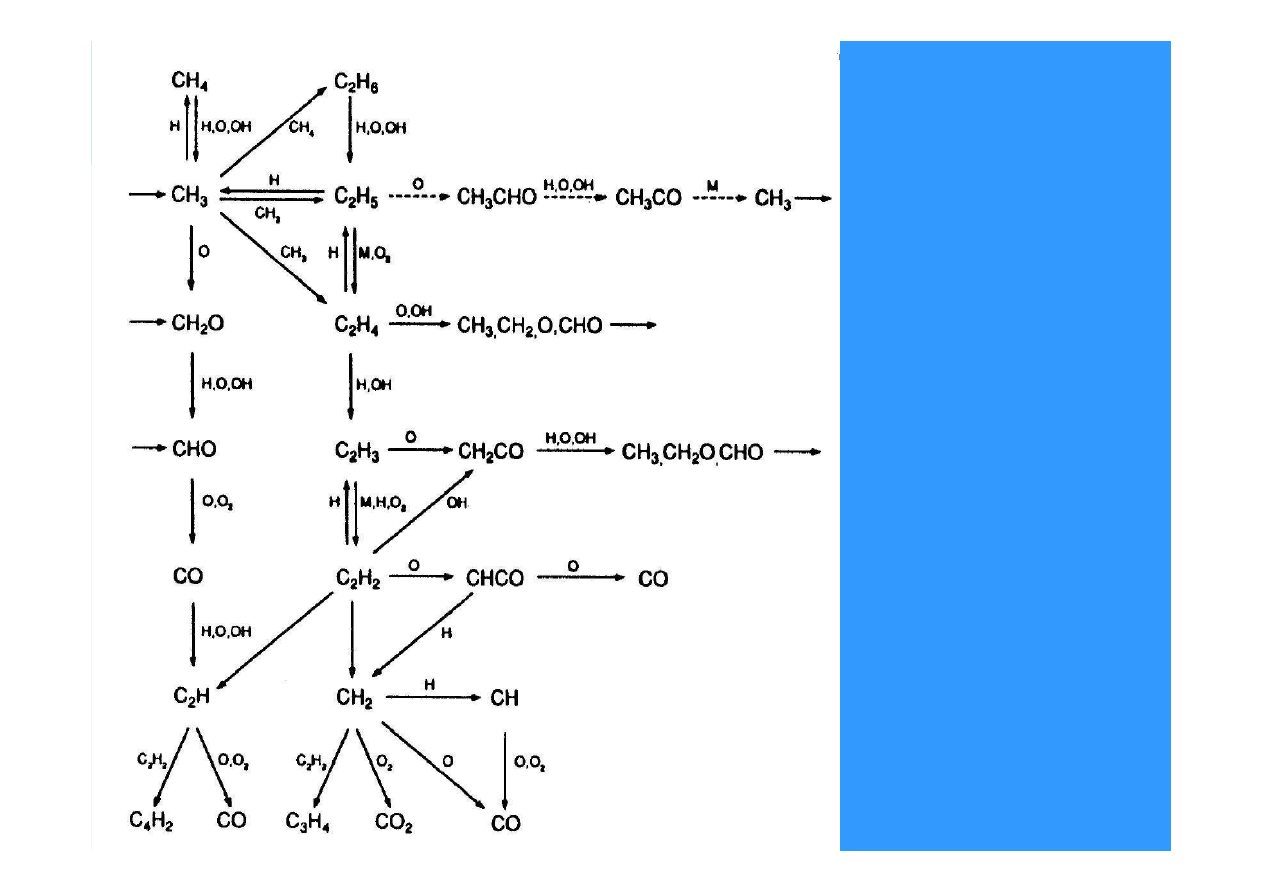
Liczba reakcji
Liczba reakcji
elementarnych
utleniania
węglowodorów
zależy od ich
budowy i zawiera
się w przedziale od
kilkuset do kilku
tysięcy

Termiczny mechanizm tworzenia NO
x
Mechanizm ten polega na tworzeniu NO
x
poprzez reagowanie
z O
2
i N
2
w wysokiej temperaturze
Decydujące znaczenie ma reakcjia dysocjacji tlenu:
O2 + M → O + O + M
Dostarcza ona rodników „do ataku” atomów O na cząstki N
2
O + N2 → NO + N
N + O2→NO + O
W pomienu zachodzi dodatkowo jeszcze reakcja:
OH + N → NO + H

Termochemia spalania
I ZASADA TERMODYNAMIKI
dQ = dH – Vdp
Q – ciepło
H - entalpia wewnętrzna
V – objętość
P - ciśnienie
W przemianach izobarycznych: dp = 0
dQ = dH
dH = c
p
dT
→
dQ = c
p
dT

Efekt cieplny spalania
Efekt cieplny spalania jest wynikiem wyzwalania ciepła reakcji
utleniania paliwa.
1. Ważnym składnikiem energii wewnętrznej ciała jest jego
energia chemiczna wynikającą z budowy chemicznej.
2. Zmiana tej budowy chemicznej ciała wiąże się ze zmianą tej
części energii wewnętrznej.

Energia chemiczna związku
Każda substancja chemiczna ma swą indywidualną energię
chemiczną, która może być określona jako ciepło jej syntezy.
Wyraża się je jako entalpię tworzenia, h
tw
[J/mol]
W celu ułatwienia porównania entalpii tworzenia związków
określa się je w warunkach standardowych:
p = 0,1 MPa, T = 298 K,
i oznacza się ją: h
tw,st
Wartości entalpii tworzenia h
tw,st
związków chemicznych
podane są w tablicach chemicznych.

Energia chemiczna związku
Znajomość ciepła (entalpii) tworzenia związków pozwala
obliczyć ciepło reakcji ∆h
r
tw,st
zapisanej ogólnie:
Σ
i
ν
i
A
i
= 0
(ν
i
– współczynniki stechiometryczne)
jako sumę entalpii tworzenia reagentów ∆h
i
tw,st
:
∆
h
r
tw,st
=
Σ
i
ν
i
∆
h
i
tw,st
gdzie ν
i
przyjmuje się ν
i
> 0 dla substratów i ν
i
< 0 dla
produktów, a indeks „st” odnosi się do warunków
standardowych.

Typy reakcji chemicznych:
egzotermiczne
endotermiczne
Przykłady (utlenianie węgla):
C + O2 → CO2 – 393,5 kJ/mol egzoter
C + 0,5O2 → CO – 110,5 kJ/mol egzoter
C + CO2 → 2CO + 172,5 kJ/mol endoter
Efekt cieplny reakcji:
prawo Hessa
Efekt cieplny reakcji zależy tylko od stanu początkowego
i końcowego układu reagującego, a nie zależy od drogi
przemian..

Ciepło spalania i wartość
opałowa
Wartość energetyczną danego paliwa określa się dwoma
parametrami:
• ciepło spalania: Q
c
[kJ/kg]
• wartość opałowa: Q
w
[kJ/kg]
Ciepła spalania i wartości opałowe typowych paliw są podane w
tablicach cieplnych.
Ciepło spalania
Ciepło spalania jest wynikiem zmiany energii wewnętrznej
substratów biorących udział w procesie spalania.
W pewne związki znikają, a na ich miejsce powstają nowe
związki. Zmienia się więc energia chemiczna układu.

Ciepło spalania definicja
Ciepło spalania (Q
c
; W
g
; W
t
itp.) jest to ilość ciepła jaka
wywiązuje się przy całkowitym spaleniu 1 kg lub m
3
paliwa,
produkty spalania węgla (C) i siarki (S) są w stanie gazowym
w postaci dwutlenków (spalanie całkowite i zupełne), nie
nastąpiło przy tym utlenianie azotu (N), wszystkie produkty
spalania mają temperaturę taką samą jak substraty przed
spaleniem,
zaś
woda,
która
znalazła
się
w produktach spalania, jest w stanie ciekłym.
Krócej:
Ciepło spalania jest to ilość ciepła, która się wyzwala przy
spaleniu zupełnym i całkowitym jednostki masy (1 kg) lub
objętości (1m
3
) paliwa, po ochłodzeniu produktów spalania do
temperatury początkowej paliwa i skropleniu pary wodnej.

Ciepło spalania
Cechami dobrego spalania, w pełni wykorzystującego paliwo,
jest spalanie zupełne i całkowite.
Spalanie zupełne charakteryzuje się, w przypadku paliw
energetycznych, obecnością w produktach spalania związków
niepalnych: CO2, SO2, H2O, przy równoczesnym braku w
spalinach związków palnych, jak np.: CO, CH4, H2.
Przyczyną spalania niezupełnego jest przede wszystkim brak
dostatecznej ilości tlenu.

Ciepło spalania
Spalanie całkowite polega na utlenieniu całej masy zawartego
w paliwie węgla, wodoru i siarki (palnej). Niecałkowite spalanie
objawia się np. przesypem części paliwa stałego przez ruszt do
popielnika, obecnością części palnych w żużlu, unoszeniem
przez spaliny tzw. lotnego koksiku.
Warunki umożliwiające dobre spalanie, to przede wszystkimi
1) dobre wymieszanie paliwa z powietrzem,
2) dostateczna ilość powietrza,
3) wysoka temperatura.

Ciepło spalania
Wartość
ciepła
spalania
paliwa
określa
się
metodą
bezpośrednią,
spalając
próbkę
paliwa
w
warunkach
laboratoryjnych w bombach kalorymetrycznych ( paliwa stałe
i ciekłe) lub w kalorymetrze Junkersa (paliwa gazowe).
Metoda pośrednia określania wartości ciepła spalania polega
na obliczeniu go na podstawie składu pierwiastkowego masy
paliwa i znanego ciepła spalania poszczególnych pierwiastków.
Jest to metoda mniej dokładna.

Ciepło spalania
Wzory do obliczania ciepła spalania paliw energetycznych są
wzorami empirycznymi. Błąd jakim jest obarczony wynik
obliczenia jest tym większy im skład masy paliwa bardziej
odbiega od przeciętnego składu danego rodzaju paliwa.

Ciepło spalania
Wzory empiryczne do obliczania ciepła spalania niektórych
paliw:
•torf
Q
c
=37 200·C + 111 500·H - 14 500·O + 9200·S [kJ/kg]
•węgiel brunatny
Q
c
=36 450 · C + 109 000 · H - 13 600 · O + 9200 · S [kJ/kg]
•węgiel kamienny
Q
c
=37 750 · C + 107 000 · H - 13 400 · O + 9200 · S [kJ/kg]
•olej opałowy i gaz ziemny
Q
c
=37 200 · C + 106 000 · H - 14 000 · O + 9200 · S [kJ/kg]
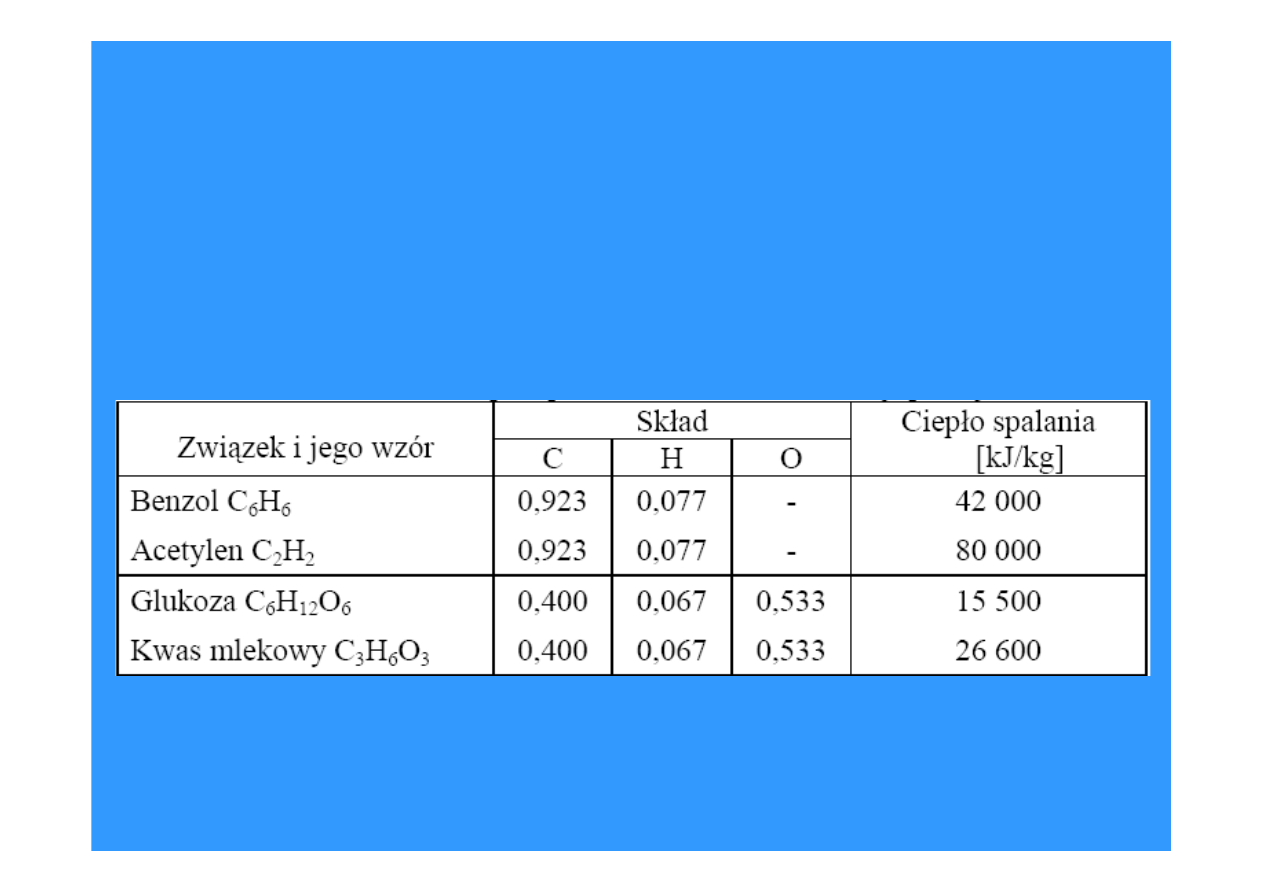
Ciepło spalania
Skład pierwiastkowy paliwa nie decyduje o wartości jego ciepła
spalania nawet w przypadku prostych węglowodorów o znanej
budowie chemicznej
Q
c

Wartość opałowa
W obliczeniach technicznych występuje dość często pojęcie
wartości opałowej.
Wartość opałowa paliwa (Q
w
[kJ/kg]) jest mniejsza od ciepła
spalania o ciepło parowania wody zawartej w spalinach.
Podczas spalania wodór w paliwie utlenia się - z l kg wodoru
otrzymuje się 9 kg pary wodnej. Powstająca woda wraz z wodą
wynikającą z wilgoci paliwa, odparowując, pobiera pewną ilość
ciepła rw
c
(ciepło parowania r = 2500 kJ/kg, w
c
– całkowita
masa pary wodnej w spalinach). Definicja wartości opałowej
jest zatem analogiczna jak definicja ciepła spalania z tą różnicą,
ż
e woda zawarta w spalinach pozostaje w postaci pary

Wartość opałowa
Q
w
= Q
c
– 2500 · (9 H + W) [kJ/kg],
Gdzie:
9 H - woda powstająca ze spalenia wodoru (H) zawartego w
paliwie, kg/kg,
W - wilgoć zawarta w paliwie, kg/kg
Zatem Q
w
<Q
c
!

Konwencjonalne wzory Związku Techników w
Niemczech
Pozwalają na oszacowanie ciepła spalania i wartości opałowej
drewna, torfu, węgla brunatnego, oraz węgla kamiennego:
C, H, O, S, W- odpowiednio zawartość procentowa węgla,
wodoru, tlenu i siarki w substancji organicznej paliwa w stanie
roboczym,
S
O
H
C
Q
c
⋅
+
−
⋅
+
⋅
=
67
,
104
8
1
89
,
1431
13
,
339
kg
kJ
W
S
O
H
C
Q
w
⋅
−
⋅
+
−
⋅
+
⋅
=
12
,
25
67
,
104
8
1
89
,
1431
13
,
339
kg
kJ

Wartość opałowa
Powyższe wzory nie są zbyt dokładne, szczególnie gdy dotyczą
takich rodzajów paliwa jak drewno, torf i węgiel brunatny które
charakteryzują się dużą zawartością tlenu w substancji
organicznej.

Wzory Langbeina
Opracowane zostały dla drewna i celulozy. Dają też dobrą
zgodność z wynikami pomiarów kalorymetrycznych również
dla węgla brunatnego
O
S
H
C
Q
c
⋅
−
⋅
+
⋅
+
⋅
=
76
,
106
67
,
104
44
,
1130
3558
)
94
,
8
(
95
,
24
76
,
106
67
,
104
44
,
1130
3558
W
H
O
S
H
C
Q
w
−
⋅
⋅
−
⋅
−
⋅
+
⋅
+
⋅
=
kg
kJ
kg
kJ

Wzór Dulonga
(
)
⋅
+
⋅
−
⋅
+
−
⋅
+
⋅
⋅
=
H
W
S
O
H
C
Q
w
9
2550
9290
8
144030
34080
100
1
kg
kJ

Niemiecki wzór związkowy VDI
kg
kJ
(
)
⋅
+
⋅
−
⋅
+
−
⋅
+
⋅
⋅
=
H
W
S
O
H
C
Q
w
9
2550
10400
8
144030
33900
100
1

Wartość opałowa
Do obliczeń praktycznych wartości opałowej paliw w stanie
suchym w środowisku energetyków niemieckich
wykorzystywane są dość często trzy następujące wzory
(zarówno węgiel kamienny jak i brunatny):
O
S
H
C
Q
w
⋅
−
⋅
+
⋅
+
⋅
=
7
,
117
7
,
117
8
,
941
6
,
351
O
S
H
C
Q
w
⋅
−
⋅
+
⋅
+
⋅
=
8
,
151
7
,
104
2
,
11214
1
,
339
O
S
H
C
Q
w
⋅
−
⋅
+
⋅
+
⋅
=
9
,
127
6
,
104
2
,
1214
1
,
339
Wzór Boie
Wzór VID poprawić
Wzór Steuer
Wyszukiwarka
Podobne podstrony:
paliwa i przetwarzaie energii 6
paliwa i przetwarzaie energii 5
paliwa i przetwarzaie energii 7
paliwa i przetwarzaie energii 0
paliwa i przetwarzaie energii 6
1f Cyfrowe przetwarzanie sygnal Nieznany
Pozyskiwanie i przetwarzanie ro Nieznany
OII05 Badanie przemian energii Nieznany
SCIAGA reczna, Maszyna jest to urządzenie techniczne zawierające mechanizmy we wspólnym kadłubie słu
III05 Badanie przemian energii Nieznany
lab5 Przetwarzanie wspolbiezne Nieznany
Zadania do testu, Elektrotechnika AGH, Semestr IV letni 2013-2014, Elektromechaniczne Przetwarzanie
1 ziarno zboz i przetworyid 87 Nieznany
sprawozdanieAGH vel Czaro, Elektrotechnika AGH, Semestr IV letni 2013-2014, Elektromechaniczne Przet
05 Opis ruchu & Rownanie energi Nieznany (2)
Cyfrowe Przetwarzanie Sygnalow Nieznany
więcej podobnych podstron