
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
158
WYBRANE ZAGADNIENIA
z
SYSTEMATYKI PIERWIASTÓW
d - i f - elektronowych
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
159
TYTANOWCE - grupa 4. (IVB)
Tytan Ti
3d
2
4s
2
gęstość 4,5 g/cm
3
T
topn
1940 K
Stopnie utlenienia: najtrwalszy +4
(+2, +3)
9 –ty pierwiastek pod względem
rozpowszechnienia (0,56 %)
Ti i Zr znaleziony w meteorytach
w próbkach skał pobranych na
Księżycu (w jednej z nich aż 12 % Ti)
Rudy tytanu: ilmenit FeTiO
3
rutyl TiO
2
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
160
Właściwości fizyczne i chemiczne:
- srebrzystobiały metal
- trudno topliwy
- plastyczny (łatwo obrabialny)
- stosunkowo mała gęstość (4,5 g/cm
3
) i duża
wytrzymałość mechaniczna
w związku z tym zastosowanie:
- w konstrukcji samolotów odrzutowych,
- rakiet,
- cienkowarstwowych układów scalonych,
- dodatek do stali w formie stopu z Fe – ferrotytanu)
poprawia elastyczność i wytrzymałość stali,
- jako tlenek (TiO
2
) farba „ biel tytanowa”
W temp. pokojowej chemicznie bierny -
Ti pasywuje tworząc warstewkę TiO
2
metal nieszlachetny:
roztwarza się w H
2
SO
4
(na zimno)
HCl (na gorąco)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
161
reaguje z HF (wodny roztwór):
Ti + 4 H
+
+ 6F
-
= [TiF
6
]
2-
+ 2H
2
heksafluorotytanian(IV)
W podwyższonych temperaturach Ti
reaguje z wieloma pierwiastkami, z:
tlenem ===> ditlenek TiO
2
Cl
2
===> tetrachlorek TiCl
4
(ciecz)
azotem ===> azotki TiN
węglem ===> węgliki TiC
Azotki i węgliki – wysoka temp. topnienia i
bardzo twarde
tworzą tzw. fazy międzywęzłowe
Ti tworzy niestechiometryczne wodorki o
maksymalnym składzie TiH
2
(
trwałe w obecności wody)
rozkład tych wodorków w wysokich temp.(> 600 K)
wykorzystywany do kontrolowanego uzyskiwania
wodoru

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
162
Tlenek (TiO
2
) i wodorotlenek tytanu (TiO
2
· nH
2
O)
są amfoteryczne.
Tytaniany: (raczej tlenki podwójne)
CaTiO
3
tytanian wapnia - (struktura perowskitu)
BaTiO
3
tytanian baru
- mają wysoką przenikalność dielektryczną -
stosowane w produkcji kondensatorów
Reakcje otrzymywania tytanianów – przykład
reakcji w fazie stałej:
BaCO
3
(s)
+ TiO
2
(s)
= BaTiO
3
(s)
+ CO
2
(g)
o kinetyce decyduje szybkość dyfuzji substratów przez
warstwę stałego produktu reakcji
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
163
Struktura perowskitu
CaTiO
3
Tytanian wapnia minerał perowskit
Struktura przestrzenna: układ regularny
regularny sześcian, w narożach są atomy Ca.
Atomy O - w środkach ścian
Atom Ti - w środku sześcianu
Każdy atom Ti otoczony 6 atomami O
(ośmiościan koordynacyjny).
Atom Ca otoczony 12 atomami tlenu (lk = 12)
W sieci perowskitu nie ma oddzielnych jonów TiO
3
2-
(jak w sieci CaCO
3
)
CaTiO
3
= TiO
2
·CaO
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
164
WANADOWCE - grupa 5. (VB)
Wanad V
3d
3
4s
2
gęstość 6,1 g/cm
3
T
topn
2180 K
Stopnie utlenienia: od -1 do +5
najtrwalsze: +4,+5
23 –ci pierwiastek pod względem
rozpowszechnienia (0,012 %)
Właściwości fizyczne i chemiczne:
- metal o barwie szarej
- trudno topliwy
- dużej twardości
- ciągliwy
- odporny na działanie HCl i H
2
SO
4
(pasywacja wanadu)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
165
Tlenki wanadu:
V
2
O
5
właściwości kwasowe => H
3
VO
4
VO
2
ditlenek wanadu
właściwości amfoteryczne
V
2
O
3
tritlenek diwanadu
właściwości zasadowe
VO
tlenek wanadu
właściwości zasadowe
---------------------------------------------------------------
Roztwory wodne wanadu(V)
zależność od pH roztworu:
pH
>12
VO
4
3-
= ortowanadan(V) (an !)
12 – 10,6
2VO
4
3-
+ 2H
+
⇔ [V
2
O
7
]
4-
+ H
2
O
9 - 6,5
3[V
2
O
7
]
4-
+ 6H
+
⇔ 2[V
3
O
9
]
3-
+ 3H
2
O
4[V
3
O
9
]
3-
⇔ 3[V
4
O
12
]
4-
6,5 – 2
[V
4
O
12
]
4-
[H
2
V
10
O
28
]
4-
<2
[VO
2
]
+
= kation dioksowanadu(V)
[H
2
V
10
O
28
]
4-
+ 14H
+
⇔ 10[VO
2
]
+
+ 8H
2
O
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
166
Anion ortowanadanu(V) [VO
4
]
3-
istnieje w roztworach silnie alkalicznych, pH>12
Kation dioksowanadu(V)
[VO
2
]
+
istnieje w roztworach silnie kwaśnych, pH < 2
Aniony:
[V
2
O
7
]
4-
= heptaoksodiwanadan(V) oraz
[V
3
O
9
]
3-
, [V
4
O
12
]
4-
, [H
2
V
10
O
28
]
4-
- to aniony IZOPOLIKWASÓW wanadu(V)
=produkty kondensacji kwasu ortowanadowego
H
3
VO
4
(przebiegającej z odszczepieniem wody)
Izopolikwasy – polikwasy zawierające tylko jeden
pierwiastek kwasotwórczy
(heteropolikwasy zawierają więcej pierwiastków, np.
V i P lub Mo, W)
Izopolikwasy wanadowe
są trudne do wydzielenia w czystej postaci
znacznie łatwiej wydzielić sole
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
167
W zależności od warunków krystalizacji
otrzymuje się poliwanadany o różnym składzie
np. metawanadan(V) amonu NH
4
VO
3
- sól zawierająca pierścieniowy anion
tetrametawanadanowy
[V
4
O
12
]
4-
Wanad (IV)
VO
2
- właściwości amfoteryczne
tworzy sole zawierające
VO
2+
= kation oksowanadu(IV)
kation wanadylowy
np. VOSO
4
· 5H
2
O
5 hydrat siarczanu oksowanadu(IV)
w roztworach występuje jako
[VO(H
2
O)
5
]
2+
jon pentaakwaoksowanadu(IV)
(wiązanie V=O)
l.k. wanadu = 6
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
168
Leki Wanadowe
-
Biomimetyki Insulinowe
Zastosowanie kompleksów V
+4
i V
+5
jako
potencjalnych leków doustnych zwiększających
poziom insuliny
(leki antydiabetyczne - antycukrzycowe )
(Insulina podawana doustnie jest nieaktywna,
musi być podawana w zastrzykach).
Pierwsze zastosowanie wanadu leczącego cukrzycę - we
Francji w 1899 r. Był to metawanadan sodu, NaVO
3
,
(V
5+
) podawany doustnie – działa podobnie do insuliny
(jednak jest toksyczny).
Dopiero w 1985 roku badania naukowe na myszach
potwierdziły, że ortowanadan sodu Na
3
(VO
4
) działa
podobnie do insuliny.
Jony VO
2+
lub [VO
4
]
3-
podawane doustnie
powodują:
- trwałe obniżenie poziomu glukozy
- są mało toksyczne
- obniżają poziom trójglicerydów i cholesterolu
we krwi.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
169
CHROMOWCE - grupa 6. (VI B)
Chrom Cr
3d
5
4s
1
gęstość 7,2 g/cm
3
T
topn
2180 K
E
0
Cr
3+
/Cr
- 0,744 V
Stopnie utlenienia: od -2 do +6
najtrwalsze: + 3, + 6
20 –ty pierwiastek pod względem
rozpowszechnienia (0,02 %)
Właściwości fizyczne i chemiczne:
- metal srebrzystobiały
- trudno topliwy
- o dużej twardości
- dobry przewodnik elektryczności
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
170
- metal nieszlachetny,
pasywuje pod wpływem HNO
3
i stęż. H
2
SO
4
roztwarza się na zimno w rozc. HCl i H
2
SO
4
2Cr + 6H
+
= 2 Cr
3+
+ 3H
2
- właściwości amfoteryczne, roztwarza się też w
zasadach:
2Cr + 2OH
-
+ 6H
2
O = 2[Cr(OH)
4
]
-
+ 3H
2
tetrahydroksochromian(III)
Związki na + 3 stopniu utlenienia
Cr
2
O
3
i Cr(OH)
3
właściwości amfoteryczne:
H
+
OH
-
Cr
3+
, [Cr(OH)]
2+
, [Cr(OH)
2
]
+
⇔ Cr(OH)
3
⇔
⇔ [Cr(OH)
4
]
-
, [Cr(OH)
6
]
3-
Í wzrost kwasowości wzrost zasadowości Î
--------------------------------------------------------------------
CrCl
3
, Cr
2
(SO
4
)
3
sole chromu(III)
W roztworze :
[Cr(H
2
O)
6
]
3+
kation heksaakwachromu(III)
[CrCl(H
2
O)
5
]
2+
kation pentaakwachlorochromu(III)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
171
Związki na + 6 stopniu utlenienia
CrO
3
właściwości kwasowe
H
2
CrO
4
- kwas chromowy(VI)
Aniony CrO
4
2
-
ulegają słabej hydrolizie:
CrO
4
2
-
+ H
2
O
⇔ HCrO
4
-
+ OH
-
Równowagi jonowe w roztworach Cr(VI)
2CrO
4
2-
+ 2H
+
⇔
Cr
2
O
7
2-
+ H
2
O
żółty pomarańczowy
Í wzrost zasadowości wzrost kwasowości Î
żółty roztwór
CrO
4
2-
po zakwaszeniu przybiera
barwę pomarańczową (Cr
2
O
7
2-
)
W roztworach silnie kwaśnych tworzą się jony
polichromianowe, np.
2Cr
2
O
7
2-
+ 2H
+
⇔
[Cr
4
O
13
]
2-
+ H
2
O
czerwony
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
172
Redukcja Cr
+6
⇒ Cr
3+
chromiany(VI) i CrO
3
mają działanie silnie utleniające
środowisko kwaśne:
CrO
4
2-
+ 8H
+
+ 3e → Cr
3+
+ 4 H
2
O
E
0
= + 1,33 V
środowisko alkaliczne:
CrO
4
2-
+ 4H
2
O + 3e → [Cr(OH)
6
]
3-
+ 2OH
-
E
0
= - 0,13 V
redukcja łatwiejsza w środowisku kwaśnym
Chromiany działają utleniająco na substancje organiczne.
Związki Cr(VI) są bardzo toksyczne
- niszczą naskórek,
-
pyły
(powst. w czasie przesypywania chromianów)
mogą uszkodzić przegrodę nosową
- są genotoksyczne (prowadzą do choroby
nowotworowej)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
173
MANGANOWCE - grupa 7. (VIIB)
Mangan Mn
3d
5
4s
2
gęstość 7,4 g/cm
3
T
topn
1517 K
E
0
Mn
2+
/Mn
- 1,180 V
(pomiędzy glinem E
0
= -1.662 a cynkiem E
0
= -0.763 V)
Stopnie utlenienia: od -1 do +7
najtrwalszy: + 2,
12 –ty pierwiastek pod względem
rozpowszechnienia (0,095 %)
(po żelazie najbardziej rozpowsz. metal ciężki)
metal nieszlachetny, reaktywny
roztwarza się łatwo w HCl
Mn + 2H
+
= Mn
2+
+ H
2
Tlenki manganu
Mn
2
O
7
właściwości kwasowe => HMnO
4
MnO
2
ditlenek manganu
właściwości amfoteryczne
Mn
2
O
3
tritlenek dimanganu
właściwości zasadowe
MnO
tlenek manganu
właściwości zasadowe
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
174
Podstawowe sole manganu:
MnCl
2
, MnSO
4
KMnO
4
manganian(VII) potasu
Redukcja Mn
+7
MnO
4
-
silne działanie utleniające
środowisko kwaśne:
MnO
4
-
+ 8H
+
+ 5e Mn
2+
+ 4H
2
O
fioletowy
bezbarwny
E
0
= +1,51 V
podstawowa reakcja w manganometrii
środowisko słabo zasadowe (obojętne):
MnO
4
-
+ 2H
2
O + 3e MnO
2
+ 4OH
-
fioletowy
brunatny osad E
0
= +0,59 V
środowisko silnie zasadowe:
MnO
4
-
+ e
MnO
4
2-
fioletowy zielony E
0
= +0,56 V
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
175
ŻELAZOWCE - grupa 8. (VIII)
ŻELAZO Fe
3d
6
4s
2
gęstość 7,9 g/cm
3
T
topn
1811 K
E
0
Fe
3+
/Fe
- 0,037 V
E
0
Fe
2+
/Fe
- 0,447 V
Stopnie utlenienia: od +2 do +6
najtrwalszy: + 2, + 3
4 –ty pierwiastek pod względem
rozpowszechnienia (5,6 %)
(najbardziej rozpowsz. metal ciężki)
Właściwości fizyczne i chemiczne:
- metal srebrzystobiały (chemicznie czyste Fe)
- kowalny, ciągliwy
- ciężki (gęstość = 7,9 g/cm
3
)
- występuje w kilku odmianach alotropowych,
odmiana
α-Fe = trwała do 1179 K,
ma właściwości ferromagnetyczne do temp.
1033 K (temperatura Curie).
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
176
- metal nieszlachetny: w roztworach kwasów
mineralnych roztwarza się z wydzieleniem
wodoru:
Fe + 2H
+
= Fe
2+
+ H
2
- w suchym powietrzu nie koroduje
- w wilgotnym powietrzu ulega korozji
Korozja jest procesem elektrochemicznym
funkcję elektrolitu spełnia wilgoć – krople wody
Stal zawsze zawiera drobne wtrącenia fazy niemetalicznej
– np. tlenków, siarczków. Związki te wykazują względem
elektrolitu inny potencjał niż żelazo.
Powstaje ogniwo lokalne (tzw. krótko spięte)
Anoda: Fe Fe
2+
+ 2e
oraz
Fe
2+
Fe
3+
+ e
Katoda: O
2
+ 2H
2
O + 4e 4OH
-
siarczek lub tlenek
----------------------------------------------------------
Jony OH
-
i jony Fe
2+
i Fe
3+
strącają się w
postaci wodorotlenków żelaza Fe(OH)
3
lub
FeO(OH).
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
177
Powłoka z metalu szlachetnego:
np. żelazo pokryte blachą miedzianą.
Jeżeli jest otwarty styk Fe i Cu,
żelazo działa jak anoda i roztwarza się
Î przyspieszona korozja
-------------------------------------------------------------
Powłoka z metalu mniej szlachetnego:
np. żelazo pokryte blachą cynkową (E
0
= -0.76 V)
Cynk stanowi ochronę nawet wtedy, kiedy powłoka
nie jest szczelna.
W tym ogniwie cynk jest anodą (ulega korozji)
żelazo jest katodą
wykorzystane do ochrony okrętów:
(szczególnie narażone na rdzewienie w słonej wodzie morskiej)
Kadłub okrętu jest połączony z zanurzoną w wodzie
płytą cynkową, magnezową lub aluminiową, która
staje się anoda i ulega korozji.
-------------------------------------------------------------
szerokie zastosowanie - stopy żelaza:
żeliwo 96 – 97 % Fe 4 – 3 % C
stal 98 – 99,5 % Fe 2 – 0,5 % C
stal nierdzewna:
73 – 79 % Fe, 14 – 18 % Cr, 7 – 9 % Ni
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
178
Tlenki żelaza
Fe
2
O
3
tlenek żelaza(III)
Fe
3
O
4
tlenek żelaza(II,III) magnetyt
FeO skład niestechiometryczny (np. Fe
0,946
O)
Wodorotlenki żelaza:
Fe(OH)
2
i Fe(OH)
3
bardzo słabo rozpuszcz. w H
2
O
Podstawowe sole żelaza:
+2 st. utl. FeS
2
(piryt), FeCl
2
, FeSO
4
(utlenia do Fe
3+
)
+3 st. utl. FeCl
3
, Fe
2
(SO
4
)
3
, Fe(NO
3
)
3
Związki kompleksowe żelaza:
Większość związków koordynacyjnych żelaza
zawiera kompleksy oktaedryczne
Dla Fe(II) (jon d
6
):
większość ligandów daje kompleksy wysokospinowe
i paramagnetyczne np. [Fe(H
2
O)
6
]
2+
,
konfiguracja elektron. (t
2g
)
4
(e
g
)
2
(dwa niesparowane elektrony na poziome e
g
i dwa niesparowane elektrony na poziome t
2g
)
w przypadku ligandów wytwarzających szczególnie
silne pole (np. CN
-
, bipirydyl) powstają
kompleksy niskospinowe i diamagnetyczne,
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
179
jon d
6
: konfiguracja elektron. (t
2g
)
6
(sparowane elektrony na poziome t
2g
)
np: [Fe(CN)
6
]
4-
, [Fe(bpy)
3
]
2+
Podobnie zachowują się kompleksy Fe(III) d
5
:
wysokospinowy kompleks: FeF
6
3
-
niskospinowy kompleks: Fe(CN)
6
3
-
----------------------------------------------------------------
w roztworach wodnych kation Fe
3+
hydrolizuje:
[Fe(H
2
O)
6
]
3+
+ H
2
O Á [Fe(OH)(H
2
O)
5
]
2+
+ H
+
kation pentaakwahydroksożelaza(III)
sole żelaza(III) mają odczyn kwaśny
-----------------------------------------------------------------------
reakcje Fe
3+
z tiocyjanianem amonu NH
4
SCN Î
[Fe(SCN)(H
2
O)
5
]
2+
kation pentaakwatiocyjanianożelaza
czerwony
[Fe(SCN)
6
]
3-
heksatiocyjanianożelazian(III)
krwistoczerwony
charakterystyczna reakcja dla Fe
3+
, wykrywa nawet
śladowe ilości żelaza
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
180
(Dodatkowe reakcje w identyfikacji Fe
2+
i Fe
3+
)
+2 +3
reakcje z K
4
[Fe(CN)
6
] i K
3
[Fe(CN)
6
]
Fe(CN)
6
4-
heksacyjanożelazian(II)
Fe(CN)
6
3-
heksacyjanożelazian(III)
+2 +3 +2
3[Fe(CN)
6
]
4
-
+ 4Fe
3+
Fe
4
[Fe(CN)
6
]
3
osad błękit pruski
+3 +2 +3
2[Fe(CN)
6
]
3-
+ 3Fe
2+
Fe
3
[Fe(CN)
6
]
2
osad błękit Turnbulla
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
181
NIKLOWCE - grupa 10. (VIII)
NIKIEL Ni
3d
8
4s
2
gęstość 8,9 g/cm
3
T
topn
1728 K
E
0
Ni
2+
/Ni
- 0,257 V
Stopnie utlenienia: +2 +3, +4
najtrwalszy: + 2
rozpowszechnienie: 0,0084 % skorupy ziemskiej
Właściwości fizyczne i chemiczne:
- metal biały, z odcieniem żółtawym
- kowalny, ciągliwy
- ciężki (gęstość = 8,9 g/cm
3
)
- ferromagnetyk w temp. pokojowej
(temp. Curie – temp. przejścia ferromagnetyku w
paramagnetyk jest niska, 627 K)
- metal nieszlachetny E
0
Ni
2+
/Ni
= - 0,257 V
- chemicznie bardziej odporny niż żelazo,
nie ulega korozji w wilgotnym powietrzu
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
182
- stosowany jako dodatek do stali, jako powłoki
ochronne
- w stężonych kwasach utleniających pasywuje
- reaguje z kwasami mineralnymi:
Ni + 2H
+
= Ni
2+
+ H
2
Związki chemiczne niklu:
NiO, Ni(OH)
2
, Ni(NO
3
)
2
, NiCl
2
, NiS
Związki kompleksowe niklu
Kompleksy zawierające Ni
2+
mają struktury:
- oktaedryczne (lk = 6) d
2
sp
3
- tetraedryczne (lk = 4) sd
3
(podobne do sp
3
)
- kwadratowe (lk = 4) dsp
2
[Ni(H
2
O)
6
]
2+
kation heksaakwaniklu(II)
struktura oktaedryczna, konfig. elektr. (t
2g
)
6
(e
g
)
2
- 2 niesparowane elektrony na poziomie e
g
,
- kompleks wysokospinowy
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
183
płaskie kompleksy (kwadratowe) Ni(II) są zawsze
diamagnetyczne - niskospinowe
np. Ni(CN)
4
2-
tetracyjanoniklan(II)
w odróżnieniu od żelaza ma lk =4
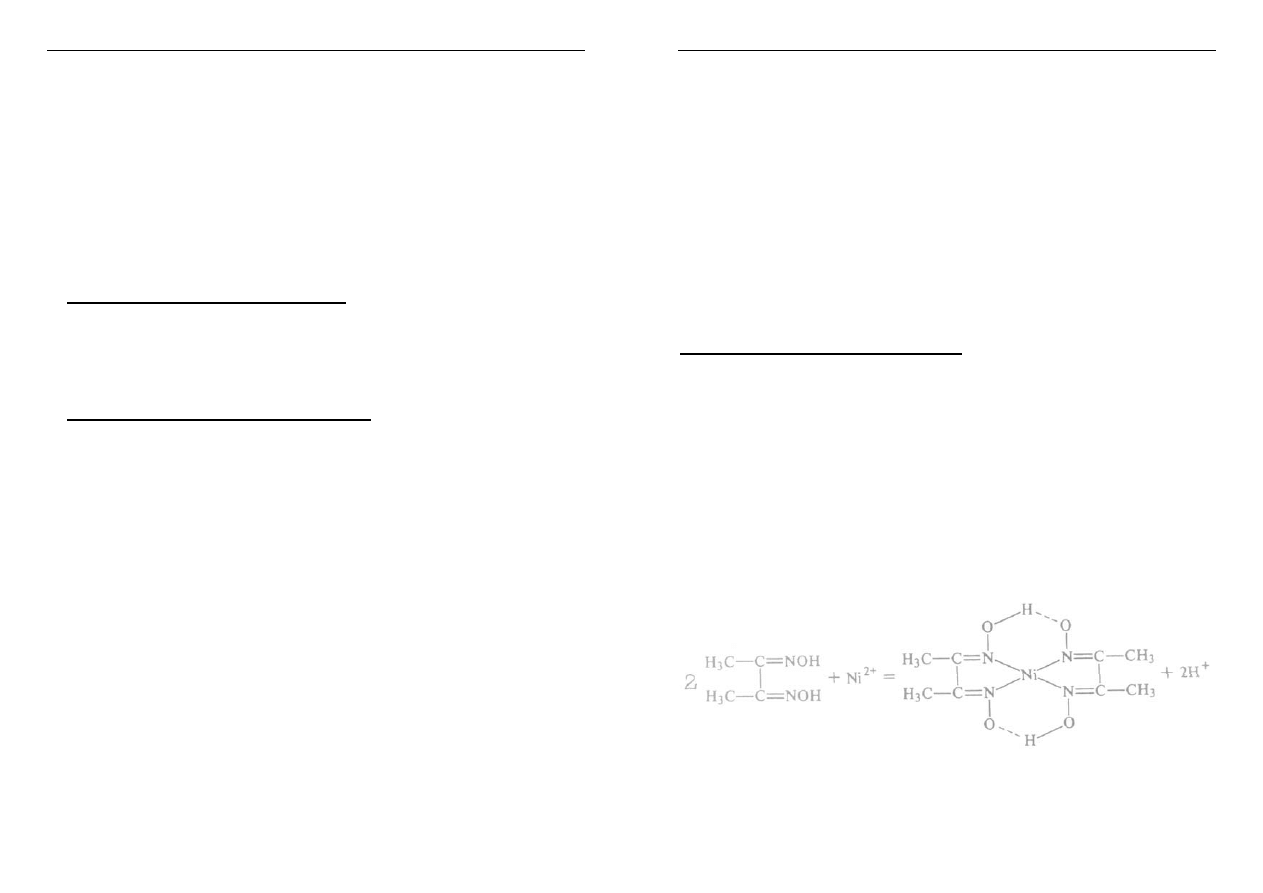
Ni (II) wykazuje tendencję do tworzenia
kompleksów chelatowych np. Ni(Hdmg)
2
H
2
dmg = dimetyloglioksym
otrzymany kompleks chelatowy (osad) ma różową barwę
(bardzo czuła reakcja, charakterystyczna dla Ni
2+
,
reakcja Czugajewa)

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
184
MIEDZIOWCE - grupa 11. (IB)
Cu Ag Au
MIEDŹ Cu
3d
10
4s
1
gęstość 8,93 g/cm
3
T
topn
1358 K
E
0
Cu
2+
/Cu
+ 0,342 V
Stopnie utlenienia: +1 +2
Stanowi 0,006 % skorupy ziemskiej (26 miejsce wśród
wszystkich pierwiastków).
Występuje w rudach siarczkowych CuS, Cu
2
S CuFeS
2
(m.in. w Legnicko-Głogowskim Zagłębiu Miedziowym)
Właściwości fizyczne i chemiczne:
- metal o barwie różowej
- kowalny, ciągliwy
- ciężki (gęstość = 8,9 g/cm
3
)
- bardzo dobry przewodnik ciepła i elektryczności
- metal szlachetny (dodatni potencjał standardowy)
metal odporny na działanie kwasów mineralnych
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
185
- roztwarza się w kwasach utleniających z
wydzieleniem tlenków, np. w HNO
3
:
3Cu + 8H
+
+ 2NO
3
-
= 3Cu
2+
+ 2NO + 4H
2
O
w stężonym, gorącym H
2
SO
4
:
Cu + 4H
+
+ SO
4
2
-
= Cu
2+
+ SO
2
+ 2H
2
O
-
na powietrzu pokrywa się cienką warstwą Cu
2
O
(czerwony)
później patyną (zielona powłoka)
= zasadowe węglany miedzi
CuCO
3
·Cu(OH)
2
(malachit – krystaliczny, zielony)
Miedź używana jest głównie w postaci stopów:
Mosiądz 67 - 90 % Cu 33 – 10 % Zn
(cynk)
Brąz 70 - 95 % Cu, 18 – 1 % Sn
(cyna)
ponadto: Zn, P, Al, Si
Konstantan 60 % Cu 40 % Ni
(opór elektryczny minimalnie zależy
od temp. – budowa opornic)

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
186
Związki Cu
+
konfig. elektr.
3d
10
(4s
0
)
Związki miedzi(I) są diamagnetyczne:
Cu
2
O, CuCl, CuI, Cu
2
S
mają zwykle strukturę tetraedryczną
(w hybrydyzacji sp
3
kation Cu
+
(d
10
) wykorzystuje
wolne orbitale 4s i 4p)
W roztworach wodnych jony Cu
+
są
nietrwałe,
ulegają dysproporcjonowaniu:
2Cu
+
= Cu + Cu
2+
--------------------------------------------------------
Związki Cu
2+
konfig. elektr.
3d
9
(4s
0
)
jon o takiej konfiguracji elektronowej wykazuje
efekt Jahna-Tellera
W kompleksach oktaedrycznych, w wyniku
deformacji oktaedru, występują cztery krótkie
wiązania Cu – L leżące w płaszczyźnie
i dwa długie wiązania Cu – L trans)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
187
Przykłady związków Cu
2+
CuO czarny
Cu(OH)
2
jasnoniebieski
ogrzewanie
Cu(OH)
2
CuO + H
2
O
CuSO
4
· 5H
2
O
5 hydrat siarczanu miedzi(II)
siarczan(VI) miedzi - woda (1/5)
duże niebieskie kryształy
pod wpływem ogrzew. w temp. 375 K stopniowo traci wodę:
CuSO
4
· 3H
2
O
CuSO
4
· H
2
O
CuSO
4
(dopiero w 470 K) - niebieskobiały proszek
silnie higroskopijny
Miedź (II) reaguje z jodkami:
Cu
2+
+ 2I
-
= CuI + ½ I
2
wydzielony jod miareczkuje się r-rem tiosiarczanu potasu:
I
2
+ 2S
2
O
3
2
-
= 2I
-
+ S
4
O
6
2
-
Związki kompleksowe miedzi(II):
Cu(H
2
O)
6
2+
kation heksaakwamiedzi(II)
[Cu(H
2
O)
2
(NH
3
)
4
]
2+
kation
diakwatetraaminamiedzi(II)
(charakter. intensywnie nieb. zabarwienie)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
188
SREBRO Ag
4d
10
5s
1
gęstość 10,5 g/cm
3
T
topn
1234 K
E
0
Ag
+
/Ag
+ 0,800 V
Stopnie utlenienia: +1 (+2)
rozpowszechnienie: 7,5 · 10
-6
% skorupy ziemskiej
występuje w postaci siarczków (Ag
2
S) w rudach miedzi.
Właściwości fizyczne i chemiczne:
- metal biały, błyszczący
- kowalny, ciągliwy
- ciężki (gęstość = 10,5 g/cm
3
)
- najlepszy znany przewodnik elektryczności i ciepła
- metal szlachetny (dodatni potencjał standardowy)
- nie ulega działaniu tlenu atmosferycznego
- reaguje z S i H
2
S, co powoduje czernienie srebra
(Ag
2
S)
- roztwarza się w kwasach utleniających z
wydzieleniem tlenków, np. w HNO
3
:
3Ag + 4H
+
+ NO
3
-
= 3Ag
+
+ NO + 2H
2
O
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
189
Związki Ag
+
konfig. elektr.
3d
10
(4s
0
)
są diamagnetyczne:
Ag
2
O:
Ag
+
+ 2OH
-
= Ag
2
O + H
2
O
czarny
AgNO
3
AgCl AgBr AgI
I
rAgCl
= 1,7 ·10
-10
rozpuszczalność maleje
I
rAgBr
= 5,2 ·10
-13
I
rAgI
= 1,0 ·10
-16
Rozkładają się pod wpływem światła
h
ν
AgBr Ag + ½ Br
2
(mechanizm
rodnikowy)
AgBr – do produkcji klisz fotograficznych
Ag(I) z ligandami jednokleszczowymi tworzy
liniowe kompleksy (hybrydyzacja sp)
Ag(NH
3
)
2
+
kation diaminasrebra
[Ag(CN)
2
]
-
dicyjanosrebrzan(I)
[Ag(S
2
O
3
)
2
]
3
-
bis(tiosiarczano)srebrzan(I)
ditiosiarczanosrebrzan(I)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
190
CYNKOWCE - grupa 12. (IIB)
CYNK Zn
3d
10
4s
2
gęstość 7,1 g/cm
3
T
topn
693 K
E
0
Zn
2+
/Zn
- 0,761 V
Stopnie utlenienia: +2
(nie ma +3, ani +4)
rozpowszechnienie: 0,007 % skorupy ziemskiej
(22 miejsce wśród pierwiastków).
W Polsce bogate złoża koło Olkusza i Bytomia.
Właściwości fizyczne i chemiczne:
- metal z odcieniem niebieskim
- łatwo topliwy
- kruchy w temp. pokojowej
- daje się walcować w temp. 370 – 420 K
- w temp. ponad 470 K znowu kruchy
( można go sproszkować)
-
na powietrzu traci połysk - pasywuje
(pokrywa się warstwą tlenku, ZnO)
- metal nieszlachetny E
0
Zn
2+
/Zn
= - 0,761 V
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
191
- służy do powlekania wyrobów żelaznych, blach
stalowych
blacha ocynkowana -chroni żelazo przed korozją.
Cynk ma niższy potencjał standardowy od żelaza,
działa jak anoda – ulega roztwarzaniu.
- reaguje z kwasami mineralnymi
Zn + 2H
+
= Zn
2+
+ H
2
- roztwarza się w gorących zasadach:
Zn + 2OH
-
+ 2H
2
O = [Zn(OH)
4
]
2
-
+ H
2
tetrahydroksocynkan
Związki chemiczne cynku – barwy białej:
ZnO, Zn(OH)
2
, Zn(NO
3
)
2
, ZnCl
2
, ZnS
Zn(OH)
2
roztwarza się w nadmiarze zasad
Zn(OH)
2
+ 2OH
-
= [Zn(OH)
4
]
2
-
roztwarza się też w amoniaku
Zn(OH)
2
+ 4NH
3
·H
2
O = [Zn(NH
3
)
4
]
2+
+ 2OH
-
+ 4H
2
O
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
192
Związki kompleksowe cynku
Zn
2+
w związkach kompleksowych ma
najczęściej liczbę koordynacyjną 4
- związki o strukturze tetraedrycznej,
hybrydyzacja sp
3
np.
[Zn(NH
3
)
4
]
2+
kation tetraaminacynku
[Zn(CN)
4
]
2
-
tetracyjanocynkan
(ale może również tworzyć kompleksy
oktaedryczne, o l.k = 6)
np.
[Zn(H
2
O)
6
]
2+
kation tetraakwacynku
[ZnCl
4
(H
2
O)
2
]
2-
diakwatetrachlorocynkan
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
193
SKANDOWCE - grupa 3. (III B)
Symbol Nazwa
Walenc.
Konfig.
Elektr.
Promień
Atomowy
(pm)
Promień
Jonowy
(pm)
Sc
skand 3d
1
4s
2
161
75
Y
itr
4d
1
5s
2
181
90
La
*
lantan 5d
1
6s
2
188
103
Ac** aktyn
6d
1
7s
2
112
W związkach występują wyłącznie na stopniu
utlenienia +3
gr. 3. gr. 4.
21 Sc Ti rozbudowują powłokę 3d
39 Y Zr 4d
57 La
(14 pierwiastków po lantanie 58...71 mają inne
właściwości, rozbudowują powłokę 4f - lantanowce)
89 Ac
(14 pierwiastków po aktynie 90...103 mają inne
właściwości, rozbudowują powłokę 5f - aktynowce)

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
194
Lantanowce
Konfiguracje elektronowe (rzeczywiste) i promienie
(atomowe i jonowe)
Symbol Nazwa
Walenc.
Konfig.
Elektr.
(rzeczywista)
Promień
Atomowy
pm
Promień
Jonowy
(lk = 6)
pm
La
Lantan
5d
1
6s
2
188
103
Ce
Cer
4f
1
5d
1
6s
2
182
101
Pr
Prazeodym 4f
3
6s
2
183
99
Nd
Neodym
4f
4
6s
2
182
98
Pm Promet
4f
5
6s
2
181
97
Sm Samar
4f
6
6s
2
180
96
Eu
Europ
4f
7
6s
2
204
95
Gd Gadolin
4f
7
5d
1
6s
2
180
94
Tb
Terb
4f
9
6s
2
178
92
Dy
Dysproz
4f
10
6s
2
177
91
Ho
Holm
4f
11
6s
2
177
90
Er
Erb
4f
12
6s
2
176
89
Tm Tul
4f
13
6s
2
175
88
Yb
Iterb
4f
14
6s
2
194
87
Lu
Lutet
4f
14
5d
1
6s
2
173
86
W kolejności od La do Lu następuje zmniejszenie
promieni jonowych (o około 20 pm).
Promienie atomowe też maleją.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
195
Kontrakcja lantanowców:
Zmniejszanie się atomowych i jonowych promieni
lantanowców w miarę wzrostu liczby atomowej.
(anomalia dużych wartości promieni dla Eu i Yb –
w metalach tych atomy wiążą się w odmienny sposób w
porównaniu do innych lantanowców)
Co jest przyczyną kontrakcji lantanowców?
Promienie atomowe i jonowe zależą ogólnie od:
1) ładunku jądra atomowego
2) liczby powłok elektronowych w atomie
3) zapełnienia powłok elektronowych
W szeregu skandowców (Sc, Y, La) promień atomowy i
jonowy rośnie od skandu do lantanu
(w miarę wzrostu Z i liczby powłok elektronowych).
W szeregu lantanowców –promień jonowy M
3+
systematycznie maleje
W lantanowcach:
a) liczba powłok elektronowych nie ulega zmianie
b) wpływ zwiększania elektronów na podpowłoce f
na rozmiar atomów - jest bardzo słaby

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
196
c) decydującym czynnikiem jest przyciąganie
elektronów walencyjnych przez jądro, którego
ładunek wzrasta przy przejściu od Ce do Lu.
Skutki kontrakcji lantanowcowej:
pierwiastki d-elektronowe 5 i 6 okresu upodabniają się do
siebie: podobieństwo właściwości chemicznych Nb i Ta
(gr. 5.), Mo i W(6.), Pd i Pt (10.)
Pytanie: czy lantan i aktyn są skandowcami?
Lu (lutet) – ostatni lantanowiec jest bardziej podobny
do skandu i itru niż lantan
Podobnie Lr (lorens) – ostatni aktynowiec jest
bardziej podobny do skandu niż aktyn
Propozycja klasyfikacji (New Scientist 1993)
Sc ? Ca Sc
Y ? Sr Y
La ? Ba* Lu
Ac ? Ra** Lr
Ba*: szereg od La do Yb (iterbu)
Ra** szereg od Ac do No (nobla)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
197
Właściwości lantanowców (symbol Ln):
- metale srebrzystobiałe, miękkie i kowalne
- standardowe potencjały elektrochemiczne
E
0
Ln
3+
/Ln
około –2.3 V
- metale wykazują silne właściwości redukujące
- bardzo podobne właściwości chemiczne i fizyczne
(trudno je rozdzielić)
- występują głównie na +3 stopniu utlenienia
ponadto +4 Ce: CeO
2
, Ce(NO
3
)
4
Pr: PrO
2
Tb: TbO
2
+2
jony: Sm
2+
trwałe w roztworach
Eu
2+
wodnych
Yb
2+
Jony Sm(II), Eu(II) i Yb(II) mają silne właściwości redukujące,
w roztworach kwasów:
2Ln
2+
+ 2H
+
= Ln
3+
+ H
2
- jony lantanowców, z wyjątkiem jonów o
konfiguracji f
0
(La
3+
, Ce
4+
) oraz f
14
(Yb
2+
, Lu
3+
)
wykazują silny paramagnetyzm
- tworzą tlenki Ln
2
O
3
, wodorotlenki Ln(OH)
3
chlorki LnCl
3
· 6H
2
O (jonowy charakter)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
198
Aktynowce:
90
Th
91
Pa
92
U
93
Np
94
Pu
95
Am...
tor, protaktyn, uran, neptun, pluton, ameryk
(pierwiastki transuranowe – o liczbach atomowych
Z> 92)
Tor i uran mają izotopy o okresie półtrwania
zbliżonym do wieku Ziemi (4,5 – 4,6 · 10
9
lat)
Tor Th
6d
2
7s
2
stopnie utlenienia +3, +4
Właściwości toru:
- srebrzystobiały metal (podobny do Pt)
- miękki i ciągliwy
- T
topn.
2023 K
ogrzewany w powietrzu utlenia się do ThO
2
Związki toru:
ThO
2
ditlenek toru T
topn.
3490 K (!)
materiał wysokoogniotrwały
ThCl
4
tetrachlorek toru
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
199
Uran U
5f
3
6d
1
7s
2
stopnie utlenienia +3, +4, +5, +6
elektrony 5f są słabiej związane w atomach aktynowców
niż elektrony 4f , dlatego są łatwiej oddawane –szczególnie
w przypadku aktynowców lżejszych (U).
Właściwości uranu:
- srebrzystobiały metal
- duża gęstość (18,95 g/cm
3
)
- w atmosferze pokrywa się warstwą tlenku
- roztwarza się łatwo w rozcieńczonych kwasach
- mało odporny chemicznie
- reaktywny w podwyższonych temperaturach
Do celów energetyki jądrowej konieczne jest
rozdzielenie izotopów
238
U i
235
U.
Tylko
235
U ulega rozszczepieniu pod wpływem
neutronów ( łańcuchowy wybuch atomowy).
Uran otrzymany z rudy uranowej zawiera 99,3 % izotpou
238
U, który nie ulega rozszczepieniu jądra, ale może
pochłaniać neutrony przechodząc w
239
Np albo
239
Pu
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
200
Związki uranu
+6 st. utlenienia:
UO
3
tritlenek uranu
(barwa jasnożółta –
do pomarańczowej)
UF
6
heksafluorek uranu
UO
2
2+
kation uranylowy
UO
2
(NO
3
)
2
· 6H
2
O 6 hydrat azotanu uranylu
UO
2
(OH)
2
wodorotlenek uranylu
------------------------------------------------------------
+4 st. utlenienia:
UO
2
ditlenek uranu (brunatny)
Ponadto:
U
3
O
8
oktatlenek triuranu (blenda smolista)
z rudy uranu
Otrzymywanie uranu:
red. wodorem HF
Ruda uranu U
3
O
8
UO
2
UF
4
UF
4
+ 2Mg = U + 2MgF
2
Metal przetapia się w tyglach korundowych
Wyszukiwarka
Podobne podstrony:
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
mechanika 3 id 290735 Nieznany
więcej podobnych podstron