Imię i Nazwisko:
Damian Kaproń
AKADEMIA GÓRNICZO-HUTNICZA
Zaliczenie
Grupa:
P2
Maszyny i urządzenia energetyczne
Ćwiczenia laboratoryjne
SPRAWOZDANIE
Uwagi
Data ćwiczenia:
24.04.2013r
Temat ćwiczenia:
Wyznaczanie wartości ciepła spalania paliwa
stałego.
1. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie ciepła spalania pastylki kwasu benzoesowego C
7
H
6
O
2
za
pomocą bomby kalorymetrycznej .
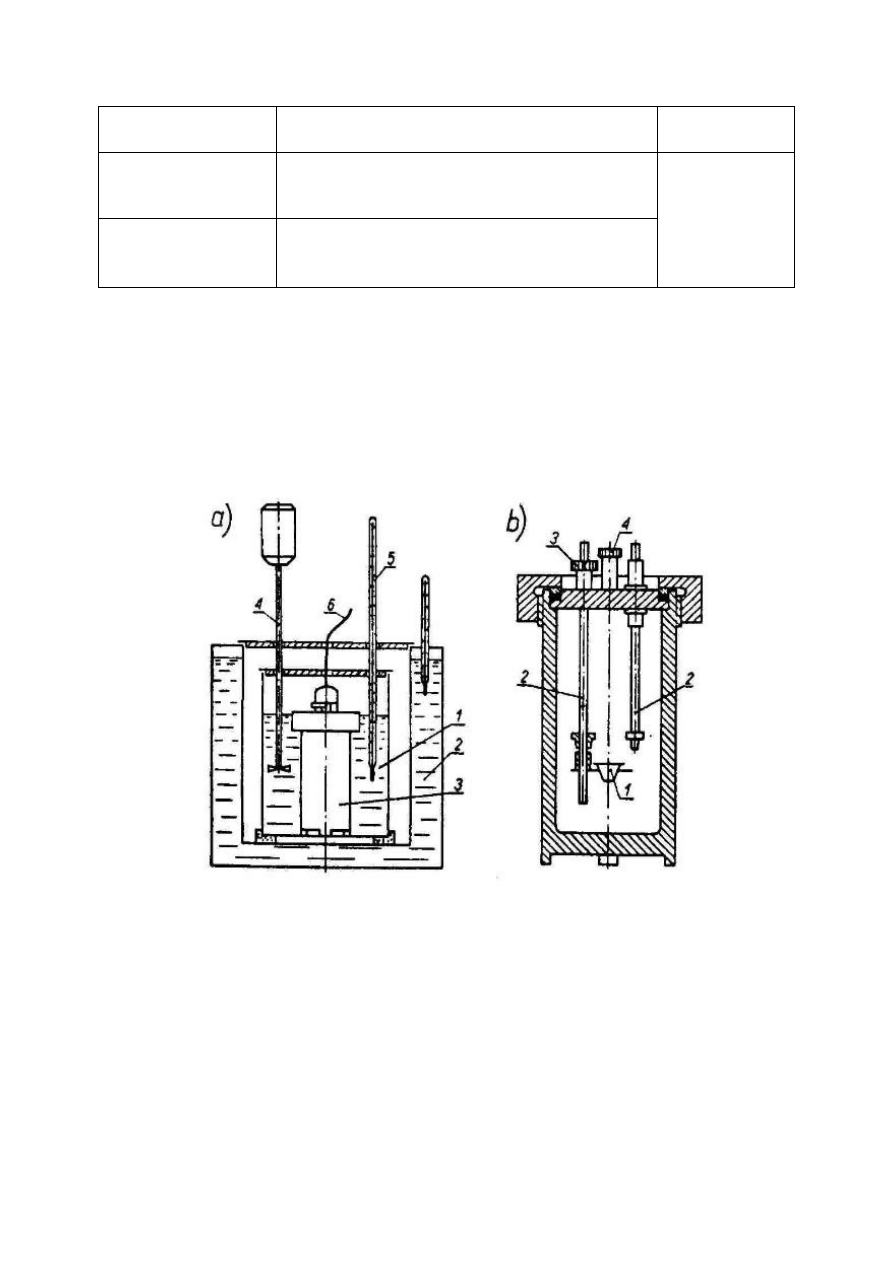
2. Schemat stanowiska pomiarowego.
a) Układ kalorymetryczny do oznaczania ciepła spalania
1- naczynie kalorymetryczne
2- płaszcz wodny
3-bomba kalorymetryczna
4-mieszadło
5-termometr
6-przewody zapłonowe
b) Bomba kalorymetryczna :
1-tygiel
2-elektrody
3-zawór wylotowy
4-zawór do napełniania tlenem

3.Dane i wielkości znamionowe
M
dp
= 0,0087 g
- masa drutu przed spaleniem
M
dk
= 0,0036 g
- masa drutu po spaleniu
M
d
= 0,0051 g
- różnica masy druta przed i po spaleniu
M=1,2297 g
- masa pastylki i druta
M- M
dp
= M
p
= 1,2210 g
- masa paliwa (pastylki) przed spaleniem
t1 = 23,803
o
C
- temperatura początkowa
t2 = 23,841
o
C
- temperatura w momencie zapłonu
t3 = 26,338
o
C
- najwyższa temperatura osiągnięta w czasie pomiaru
t4 = 26,330
o
C
- temperatura końcowa
x = 11
- liczba pomiarów w okresie głównym
S = 13337 J/K
- stała kalorymetru
Q
sd
= 6698,9 kJ/kg
- ciepło spalania drutu
- wartość tablicowa ciepła spalania kwasu benzoesowego
4. Wzory i obliczenia
5. Wnioski
Względny błąd pomiaru jaki uzyskaliśmy wynosi 3,4%. W czasie pomiaru nie
braliśmy pod uwagę dodatkowego efektu cieplnego, czyli ciepła tworzenia się kwasu
siarkowego oraz azotowego. Wzięliśmy pod uwagę ciepło spalania drutu oporowego oraz
poprawkę temperatury wynikającej z wymiany ciepła układu kalorymetrycznego z
otoczeniem. Błędne pomiary również mogły przyczynić się na zwiększenie błędu
pomiarowego. Aczkolwiek moim zdaniem otrzymany wynik jest wiarygodny.

Wyszukiwarka
Podobne podstrony:
ICh S cieplo paliwa spalanie id Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron