
Ćwiczenie 5
Wyjaławianie, dezynfekcja, antyseptyka
I. Część teoretyczna
Kontrola mikroorganizmów jest niezbędna w wielu dziedzinach życia i działalności
człowieka, takich jak: medycyna, przemysł farmaceutyczny, spożywczy, kosmetyczny,
elektroniczny, mech
aniki precyzyjnej a także środowisko domowe. Eliminację lub ograniczenie
zanieczyszczenia mikrobiologicznego (bio-
burden) prowadzi się w celu zapobieganie wystąpieniu
zakażeń, leczenia infekcji, zapobiegania psuciu się żywności i innych produktów przemysłowych.
Od wieków ludzie poszukiwali sposobów niszczenia niekorzystnych dla nich drobnoustrojów.
W XIX wieku Ludwik Pasteur, francuski mikrobiolog, niszczył drobnoustroje poprzez wielokrotne
gotowanie. Do dnia dzisiejszego w przemyśle spożywczym znajduje zastosowanie proces o
nazwie pasteryzacja. W tym samym wieku niemiecki uczony Robert Koch rozwijał metody
dezynfekcji i sterylizacji. Używał w tym celu tak środków chemicznych, jak i fizycznych, w tym
suche gorące powietrze oraz parę wodną. Również obecnie w niszczeniu drobnoustrojów
używane są aparaty Kocha. Pierwsze pojemniki do sterylizacji skonstruował i wdrożył Kurt
Schimmelbusch. Zorganizował on w Berlinie w końcu XIX wieku pierwszy dział sterylizacji przy
sali operacyjnej, w którym stosowano autoklaw skonstruowany przez Mateusza Lautenschlägera.
Myśl naukowa tych uczonych dała podwaliny dzisiejszej sterylizacji.
Do usuwania lub ograniczania liczby drobnoustrojów stosuje się czynniki fizyczne lub
chemiczne, które wpływają niekorzystnie na struktury i/lub funkcje mikroorganizmów wywierając
efekt bakteriobójczy (niszczenie komórki) lub bakteriostatyczny (zahamowanie namnażania się
komórek), bądź fizycznie oddzielają komórki drobnoustrojów od danej materii (filtracja).
Z czynników fizycznych w niszczeniu lub zahamowaniu rozwoju drobnoustrojów znalazły
zastosowanie: temperatura (wilgotne ciepło: gotowanie, dekoktacja, tyndalizacja, pasteryzacja,
gorąca para nasycona; suche ciepło: spalanie, suche gorące powietrze), ciśnienie osmotyczne,
promieniowanie ( joniz
ujące, UV), mikrofale, ultradźwięki, wysuszanie, filtracja.
Do
czynników chemicznych wywierających niekorzystny wpływ na drobnoustroje zaliczamy
środki dezynfekcyjne, antyseptyki, chemioterapeutyki, środki konserwujące.
Zabiegi mające na celu usuwanie drobnoustrojów z różnych środowisk lub obniżanie ich liczby
do bezpiecznego poziomu przeprowadza się stosując poniższe procesy:
dekontaminacja
– proces prowadzący do usunięcia lub zabicia drobnoustrojów z przedmiotów
prowadzący do tego, że przedmioty są bezpieczne w użyciu lub jako odpad; do metod
dekontaminacji należą: oczyszczanie/sanityzacja, dezynfekcja, sterylizacja
oczyszczanie
– gruntowne usuwanie widocznych zanieczyszczeń (organicznych i
nieorganicznych) wraz ze znaczną częścią drobnoustrojów; czyszczenie może być
prowadzone manualnie lub mechanicznie z użyciem wody z detergentem lub produktów
enzymatycznych;
sanityzacja -
zmniejszanie liczby drobnoustrojów za pomocą środków myjących i czyszczących
na przedmiotach codziennego użytku w środowisku domowym lub miejscach publicznych
dezynfekcja (odkażanie) - proces zmierzający do maksymalnego zmniejszenia liczby
drobnoustrojów lecz nie zawsze przetrwalników; proces zmierzający do usuwania
drobnoustrojów za pomocą środków chemicznych ze skóry, błon śluzowych i ran to
antyseptyka;
dezynfekcja wysokiego poziomu
– proces, w wyniku którego zniszczone są wszystkie
drobnoustroje, z wyjątkiem małej liczby przetrwalników;
wyjaławianie (sterylizacja) - proces niszczenia wszystkich form życia drobnoustrojów (form
wegetatywnych i przetrwalnych)
2
konserwowanie -
hamowanie wzrostu i rozmnażania drobnoustrojów za pomocą schładzania,
ogrzewania i/lub środków konserwujących oraz podwyższonego ciśnienia osmotycznego
Podstawą zapobiegania zakażeniom i skażeniom np. produktów leczniczych jest aseptyka.
Aseptyka
to postępowanie mające na celu zapobieganie zakażeniom i skażeniom
drobnoustrojami. Na postępowanie aseptyczne składa się nie tylko używanie jałowego sprzętu
czy odpowiedniej jakości surowców ale także prawidłowe posługiwanie się jałowym sprzętem,
odpowiednia technika postępowania, przygotowanie pomieszczenia do pracy aseptycznej oraz
przygotowanie personelu (odzież ochronna)
W profilaktyce i zwalczaniu zakażeń szpitalnych dezynfekcja i sterylizacja zmniejszają ryzyko
prze
niesienia drobnoustrojów ze źródła lub chronią wrażliwy organizm.
Właściwy wybór metody dekontaminacji zależy od ryzyka przeniesienia zakażenia. Według
zaleceń CDC (Center for Diseases Control), w zależności od stopnia ryzyka przeniesienia
zakażenia, wszystkie przedmioty i sprzęt stosowany w opiece medycznej podzielono jako
przedmioty wysokiego, średniego lub niskiego ryzyka przeniesienia zakażenia.
Przedmioty wysokiego ryzyka to takie, które kontaktują się z jałowymi tkankami. Są to np.
instrumenty chirur
giczne, cewniki moczowe i naczyniowe, implanty, sondy używane do
jałowych jam ciała itp. W stosunku do tych przedmiotów wymagana jest jałowość.
Przedmioty średniego ryzyka to takie, które kontaktują się z błonami śluzowymi i z uszkodzoną
skórą. Do tej grupy należą np. endoskopy, respiratory, cystoskopy itp. Te przyrządy powinny
być wolne od drobnoustrojów, dopuszczalne jest jednak niewielkie zanieczyszczenie.
Wymagają one dezynfekcji wysokiego poziomu z użyciem chemicznych środków
dezynfekcyjnych takich jak: aldehyd glutarowy, nadtlenek wodoru, ortho-phthalaldehyde, kwas
nadoctowy z nadtlenkiem wodoru.
Przedmioty niskiego ryzyka to takie, które kontaktują się z nieuszkodzoną skórą ale nie z
błonami śluzowymi. Wśród nich wyróżnia się sprzęt mający kontakt bezpośredni z chorym
(stetoskopy, aparaty do mierzenia ciśnienia krwi, miednice). W przypadku tej grupy
wystarczające jest mycie i dezynfekcja niskiego poziomu z użyciem np. alkoholi, podchlorynu
sodu, związków fenolowych, jodoforów lub czwartorzędowych soli amoniowych. Jeśli ten sprzęt
stosowany jest u chorych z obniżoną odpornością zalecana jest dezynfekcja wyższego
poziomu. Druga grupa to powierzchnie, które nie mają bezpośredniego kontaktu z chorym np.
podłogi, ściany, meble, wazony, ramy łóżek. Te powierzchnie, które są często dotykane mogą
stanowić pośrednia drogę przenoszenia zakażeń (ręce personelu). W tym przypadku również
zalecane jest mycie i dezynfekcja niskiego poziomu.
Zarówno proces sterylizacji, jak i dezynfekcji jest procesem złożonym, zależnym od wielu
czynników. Najważniejsze opisano poniżej.
Liczba drobnoustrojów. Im bardziej zanieczyszczony materiał tym więcej czasu lub wyższe
stężenie środka są niezbędne do zniszczenia drobnoustrojów.
Umiejscowienie drobnoustrojów. Przedmioty składające się z wielu części powinny być przed
myciem, dezynfekcją czy sterylizacją rozmontowane. Z takich przedmiotów jak endoskopy, które
maja szczeliny, złączenia i kanały trudniej usuwać drobnoustroje niż z powierzchni płaskich gdyż
utrudniona jest penetracja czynnika przeciwdrobnoustrojowego.
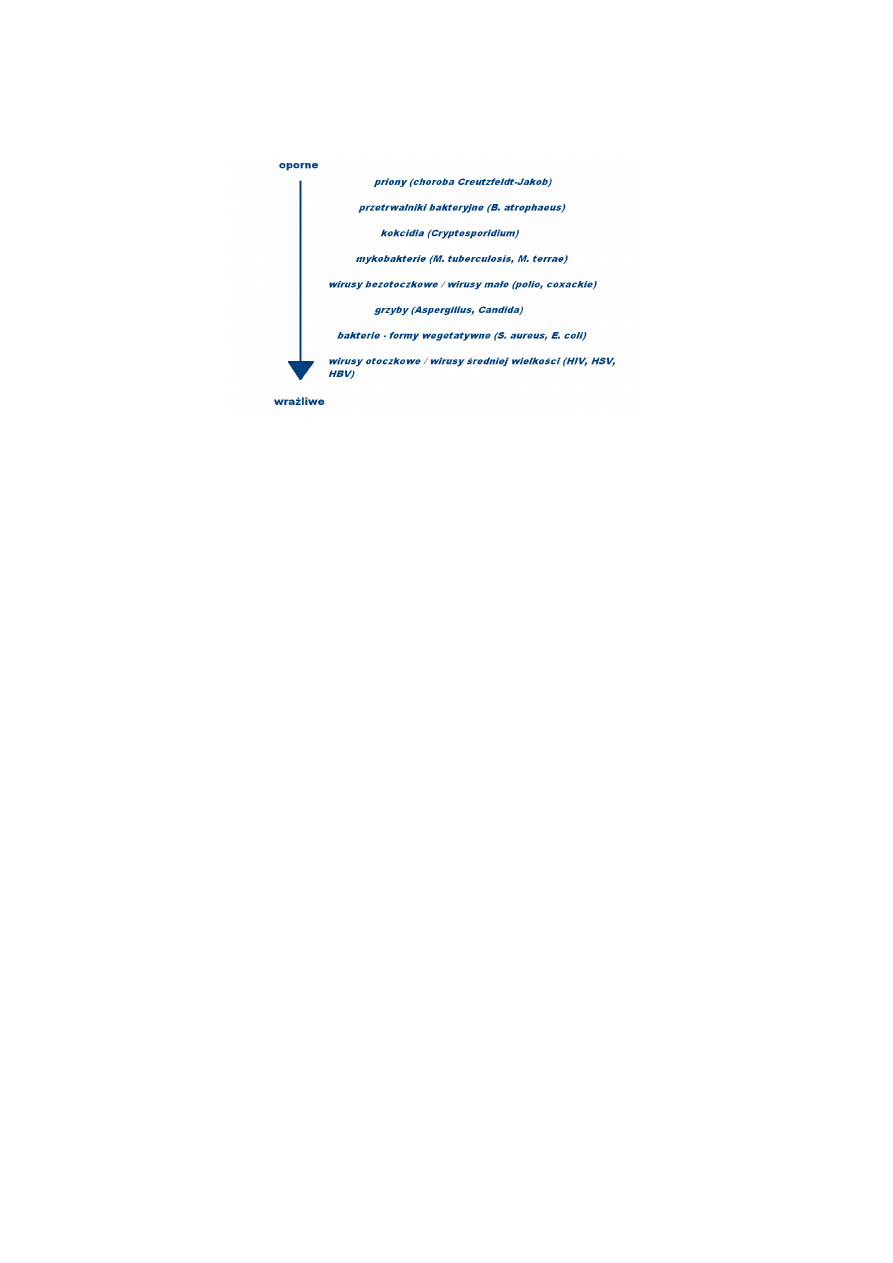
Naturalna oporność drobnoustrojów na czynniki przeciwdrobnoustrojowe Oporność
drobnoustrojów na środki przeciwdrobnoustrojowe jest bardzo zróżnicowana (Rycina 1.). Spory
bakteryjne, posiadające grubą ścianę komórkową są bardziej oporne niż komórki wegetatywne.
Woski mykobakterii czy błona zewnętrzna bakterii Gram-ujemnych również stanowią barierę dla
środków przeciwdrobnoustrojowych. Wśród mikroorganizmów, za wyjątkiem prionów,
przetrwalniki bakteryjne są najbardziej oporne na chemiczne środki przeciwbakteryjne, następnie
kokcydia (np. Cryptosporidium spp.), mykobakterie (np. M. tuberculosis)
, bezosłonkowe lub małe
wirusy (np. wirus polio, coxackie), grzyby (Aspergillus spp.), bakterie (formy wegetatywne) i wirusy
3
osłonkowe lub średnie (np. wirusy herpes, HIV). Oporność bakterii Gram-dodatnich i Gram-
ujemnych jest zbliżona z wyjątkiem niektórych drobnoustrojów np. P. aeruginosa.
Rycina 1. Oporność drobnoustrojów na środki dezynfekcyjne i sterylizujące
Stężenie i aktywność środków dezynfekcyjnych Generalnie, im stężenie środka
dezynfekcyjnego jest większe, tym wyższa jest jego aktywność i krótszy czas niezbędny do
zabicia drobnoustrojów. Korelacja między tymi zmiennymi nie jest taka sama dla wszystkich
preparat
ów. Na przykład, użycie związków fenolu w tym samym stężeniu co czwartorzędowej soli
amoniowej wymaga trzydziestodwukrotnego wydłużenia czasu ekspozycji. Czas dezynfekcji
zależy więc od mocy środka dezynfekcyjnego.
Czynniki fizyczne i chemiczne Te czynnik
i to: temperatura, pH, wilgotność względna, twardość
wody. Aktywność większości środków dezynfekcyjnych rośnie wraz ze wzrostem temperatury.
Jednakże zbyt wysoka temperatura może powodować rozkład środka i tym samym spadek
skuteczności dezynfekcji. Wyższe pH może zwiększać aktywność przeciwdrobnoustrojową
niektórych środków (np. aldehyd glutarowy, czwartorzędowe sole amoniowe) lub obniżać (fenole,
związki chloru, związki jodu) modyfikując cząsteczkę związku lub wpływając na powierzchnie
komórki. Wilgotność względna ma znaczenie w procesie sterylizacji gazowej tlenkiem etylenu.
Dwuwartościowe kationy (magnez, wapń), zawarte w wodzie twardej reagują cząsteczkami
środka dezynfekcyjnego tworząc nierozpuszczalne precypitaty co powoduje obniżenie
skuteczności dezynfekcji.
Materia organiczna i nieorganiczna Materia organiczna (krew, ropa, wydaliny, wydzieliny i inne)
oddziałują ze środkami dezynfekcyjnymi co najmniej na dwa sposoby. Po pierwsze może
nastąpić reakcja chemiczna miedzy materia i środkiem, w wyniku której powstaje nieaktywny lub
o
znacznie zmniejszonej aktywności produkt. Szczególnie podatne na tego typu interakcje są
związki chloru i jodu. Po drugie materia organiczna może chronić mikroorganizmy przed środkiem
przeciwdrobnoustrojowym tworząc barierę fizyczną.
Biofilm
Drobnoustroje na powierzchniach tworzą wielowarstwowe, ściśle przylegające kolonie
zawarte w macierzy zewnątrzkomórkowych polimerów. Ta forma bytowania bakterii nazwana jest
biofilmem.
Bakterie w biofilmie są ok. 1000 razy bardziej oporne na środki przeciwbakteryjne niż
żyjące w formie planktonicznej (zawiesina). Oporność drobnoustrojów w biofilmie wynika z wielu
mechanizmów takich jak; fizyczne cechy biofilmu, zmienność genotypowa bakterii, produkcja
enzymów neutralizujących, fizjologiczne zróżnicowanie (np. różne pH) wewnątrz biofilmu.
Spośród środków dezynfekcyjnych , związki chloru są aktywne w stosunku do bakterii żyjących w
formie biofilmu. Niektóre enzymy i detergenty mogą powodować degradacje biofilmu i obniżać
liczbę drobnoustrojów.

4
WYJAŁAWIANIE (STERYLIZACJA)
Celem procesu sterylizacji jest usuniecie lub zniszczenie wszelkich form mikroorganizmów
na/w sterylizowanych materiałach, tak aby były one bezpieczne w zastosowaniu. Jałowość
(sterylność) jest definiowana jako nieobecność zdolnych do życia mikroorganizmów: bakterii (w
tym mikoplazm) i ich przetrwalników, grzybów i ich zarodników oraz wirusów. Proces
wyjaławiania odgrywa istotną rolę w tych obszarach, gdzie zachodzi konieczność pracy w wolnym
od drobnoustrojów środowisku, posługiwania się jałowymi narzędziami, aparatami, lekami itp.
Wyjaławianiu poddaje się ciała stałe, płynne i gazowe. Dobór metody sterylizacji zależy od
rodzaju i właściwości sterylizowanej materii, a w przypadku produktów leczniczych także od
sposobu ich wytwarzania.
Prawdopodobieństwo przeżycia drobnoustrojów jest funkcją wielu zmiennych: liczby i rodzaju
drobnoustrojów, ich oporności na czynnik sterylizujący, czasu ekspozycji oraz środowiska, w
którym drobnoustroje bytują w czasie procesu (np. obecność substancji organicznych, natura
sterylizowanego materiału).
Z tego powodu przyjęto, że za jałowy w praktyce uznaje się materiał, dla którego
prawdopodobieństwo przeżycia pojedynczych mikroorganizmów jest mniejsze niż umowna,
wprowadzona dla ilościowej oceny procesu, wartość SAL - „poziom zapewnienia jałowości”
(Sterility Assurance Level). Dla danego procesu
SAL wyraża prawdopodobieństwo uzyskania
niejałowej jednostki sterylizowanej w populacji. W procesie sterylizacji wartość SAL musi być nie
mniejsza niż 10
-6
, co oznacza prawdopodobieństwo przeżycia jednej komórki drobnoustrojów na
1x10
6
sterylizowanych jednostek. Dla każdego sterylizowanego produktu wartość SAL powinna
być ustalona w badaniach walidacyjnych.
Gwarancję sterylności materiałów uzyskuje się przez: zachowanie właściwego toku
postępowania z materiałem przed sterylizacją (czyszczenie i dezynfekcja, pakowanie),
prawidłowe przeprowadzenie procesu sterylizacji i suszenia, prawidłowo przeprowadzoną
kontrolę procesu oraz właściwe postępowanie z materiałem po sterylizacji (transport,
przechowywanie, otwieranie).
W przypadku materiałów masywnie zanieczyszczonych drobnoustrojami (np.: sprzętu
medycznego wielokrotnego użycia po zastosowaniu) właściwe postępowanie przygotowawcze
powinno obejmować: oczyszczanie z dezynfekcją wstępną; mycie właściwe; dezynfekcję
właściwą, a następnie sterylizację.
Sterylizacja
osiąga pełny efekt, jeżeli czynnik sterylizujący oddziałuje na cały sterylizowany
materiał (wszystkie powierzchnie) przez ściśle określony czas. Zależność między liczbą
przeżywających komórek drobnoustrojów, a parametrami procesu określa tzw. wartość D, czyli
czas (lub np. dawka w przypadku promieniowania jonizującego) niezbędny do dziesięciokrotnej
redukcji liczby drobnoustrojów (np. z 100 000 do 10 000). Można tę zależność wyrazić wzorem:
t
D = ------------------
log N
o
– log N
gdzie:
D
– współczynnik dziesięciokrotnej redukcji komórek drobnoustrojów
t
– czas procesu
N
o
– początkowa liczba żywych drobnoustrojów
N -
liczba żywych drobnoustrojów po procesie
Kolejną wartością, która charakteryzuje proces sterylizacji jest wartość Z. Wartość Z określa
zmianę temperatury wymaganą do dziesięciokrotnej zmiany wartości D. W przypadku sterylizacji

5
parowej wartość Z zależy od oporności drobnoustroju na zmiany temperatury. Wartość tę
wyznaczamy ze wzoru:
T
1
– T
2
Z = -------------------------------
logD
2
– logD
1
gdzie: T
1
– temperatura wyższa
T
2
-
temperatura niższa
D
1
– wartość D dla drobnoustroju w temperaturze T
1
D
2
– wartość D dla drobnoustroju w temperaturze T
2
Współczynnik F (process lethality) – jest to czas wyrażony w minutach, wymagany do
zniszczenia, w określonej temperaturze, określonej liczby drobnoustrojów charakteryzujących się
określoną wartością współczynnika Z. Każdy drobnoustrój charakteryzuje się określoną wartością
współczynnika Z. Im drobnoustrój jest bardziej oporny na dany czynnik sterylizacji (im trudniej go
zniszczyć) tym wartość Z dla tego drobnoustroju jest wyższa.
Obliczenia wartości współczynnika F dokonuje się wg poniższego wzoru:
F= D
t
(logN
0
– logN)=D
t
log IF
IF
– współczynnik inaktywacji
N
0
IF = ------- = 10
t/D
N
Istotne znaczenie, z punktu widzenia skuteczności procesu sterylizacji ma rodzaj użytego
opakowania. Opakowanie sterylizacyjne powinno spełniać następujące kryteria: być przenikliwe
dla czynnika sterylizującego i umożliwiać wyjałowienie całej jego zawartości, zabezpieczać
sterylizowany materiał przed wtórnym zanieczyszczeniem zarówno w czasie procesu
(manipulacje po sterylizacji), jak i przechowywania, umożliwiać pewne zamknięcie zawartości
oraz odpowiednie dla danego procesu ułożenie materiału, nie ulegać zniszczeniu w czasie
procesu, zapobiegać przeniknięciu niepożądanych substancji (nadruki, klej, test chemiczny) do
sterylizowanego materiału, być łatwe w obsłudze, nadawać się do przechowywania po sterylizacji,
umożliwiać otwarcie z zachowaniem aseptyki, informować o zawartości, pozwalać na łatwą
identyfikację otwartego opakowania.
Prawidłowe prowadzenie procesu sterylizacji wymaga zarówno stosowania odpowiedniej
aparatury, jak również odpowiednio wykwalifikowanego personelu obsługującego. Posługiwanie
się nieodpowiednią aparaturą, niewłaściwe prowadzenie procesu, brak bieżącej kontroli
sterylizacji, kontroli technicznej aparatu czy walidacji procesu może być przyczyną uzyskania
niejałowego produktu.
Oprócz liczby i umiejscowienia drobnoustrojów
Sterylizację możemy prowadzić metodami fizycznymi i chemicznymi.
Idealny środek sterylizujący powinien charakteryzować się następującymi cechami:
wysoką aktywnością przeciwdrobnoustrojową
szybkim działaniem
dużą zdolnością penetracji sterylizowanych materiałów
pozostawać obojętny wobec sterylizowanych materiałów (nie reagować)
być nietoksyczny, niedrażniący, bezpieczny dla środowiska
nie obniżać swojej aktywności przeciwdrobnoustrojowej w obecności substancji organicznej
przenikać przez opakowanie
metoda z użyciem tego środka powinna być prosta i bezpieczna w obsłudze
być ekonomiczny

6
Każda ze znanych metod ma swoje zalety i ograniczenia i każda może być metodą z wyboru dla
jałowienia określonego materiału. Przy wyborze metody sterylizacji należy brać pod uwagę taką,
której zalety przewyższają wady i jest odpowiednia dla sterylizowanego sprzętu.
W sterylizacji obowiązuje zasada, że dla materiału, który można wyjaławiać parą wodną pod
ciśnieniem nie należy stosować innej metody sterylizacji.
METODY STERYLIZACJI
1. Wilgotne ciepło
Ciepło niszczy drobnoustroje poprzez denaturację i koagulację białek (niszczenie
trzeciorzędowej struktury).
1.1. Tyndalizacja
W procesie tyndalizacji materiał eksponuje się w wolnym strumieniu pary wodnej (ciśnienie
atmosferyczne) w 100
o
C przez 20 do 45 minut w trzech kolejno następujących po sobie dniach.
Pomiędzy kolejnymi ekspozycjami materiał inkubuje się w 37
o
C. Gorąca para niszczy formy
wegetatywne. Ewentualne obecne w materiale spory kiełkują w czasie inkubacji, po czym zostają
zniszczone w następnym ogrzewaniu w 100
o
C. Powtarzanie procesu przez trzy kolejne dni
zwiększa pewność, że wszystkie obecne w materiale przetrwalniki zostaną zniszczone.
Tyndalizacja uważana jest za jedną z metod sterylizacji stosowanych do wyjaławiania
termolabilnych materiałów. Może być stosowana tylko do takich roztworów, w których kiełkują
przetrwalniki np. pożywki bakteriologiczne. Nie znajduje jednak zastosowania do sterylizacji
roztworów leków.
1.2. Sterylizacja gorącą nasyconą parą wodną
Do jałowienia stosuje się gorącą nasyconą parę wodną pod ciśnieniem, nie zawierającą
powietrza. Takie warunki uzyskuje się w autoklawie.
Proces sterylizacji można podzielić na trzy fazy: 1) odpowietrzanie komory (aparaty przelotowe) i
przeznaczonego do sterylizacji materiału lub wytworzenie próżni w komorze (aparaty próżniowe);
2) właściwa sterylizacja – ekspozycja; 3) obróbka końcowa – suszenie.
Parametry wyjaławiania, czyli czas i temperaturę ustala się dla danego urządzenia i dla
określonego rodzaju materiału, jego objętości i opakowania. Działanie pary wodnej w
temperaturze 115-135
o
C powoduje szybkie zniszczenie wszystkich form drobnoustrojów. W
Europie najczęściej stosowane temperatury w sterylizacji szpitalnej to 121
o
C i 134
o
C. Tak
wysokie temperatury pary wodnej możemy uzyskać poprzez podwyższenie ciśnienia w komorze
sterylizatora.
Czas sterylizacji ulega zmianie w zależności od temperatury, rodzaju sterylizowanego materiału,
opakowania. Całkowity czas sterylizacji składa się z:
a)
czasu wyrównania temperatur – zależy od rodzaju opakowania, ciężaru, stopnia załadowania
i wielkości sterylizatora; jest on ustalany przez producenta i osobę odpowiedzialną za sterylizację;
w trudniejszych przypadkach można go wyznaczyć doświadczalnie na podstawie pomiaru
temperatur termosondą;
b) czasu zabicia -
(jest on określony dla poszczególnych szczepów drobnoustrojów) wyznacza
się doświadczalnie dla różnych bakterii i ich spor;
c)
zapas bezpieczeństwa – ustalany jest przez producenta i osobę odpowiedzialną za
sterylizację
Dla temperatury 121
o
C stosowany zwykle czas to 20-30 minut. W
przypadku niektórych
materiałów można skrócić czas wyjaławiania (b+c) np. sterylizację roztworów o objętości do

7
1000,0 ml można prowadzić przez 15 minut. Należy zawsze jednak pamiętać o istotnej roli jaką
odgrywa czas wyrównania temperatury ładunku z temperaturą komory. Jest to szczególnie ważne
w przypadku sterylizacji pojemników z płynami.
Ważnymi czynnikami prawidłowo prowadzonego procesu sterylizacji jest jakość pary oraz proces
suszenia zawilgoconych materiałów. Para wodna jest prawie idealnym czynnikiem sterylizującym.
Jest nietoksyczna, nie osadza się na sterylizowanych produktach, nie zanieczyszcza środowiska,
jej wytworzenie jest stosunkowo tanie. Najskuteczniejsze działanie bójcze dla drobnoustrojów ma
nasycona para wodna powstająca z parującej wody.
W parze nasyconej pod ciśnieniem można wyjaławiać niewrażliwe na wysoką temperaturę
wodne roztwory, przedmioty metalowe, szklane, gumowe, niektóre tworzywa sztuczne, materiały
opatrunkowe i szewne, odzież i bieliznę.
2. Suche ciepło
Suche ciepło niszczy drobnoustroje przez utlenianie.
2.1. Spalanie
Jedną z najprostszych metod sterylizacji suchym ciepłem jest spalanie. Metoda ta jest
stosowana na przykład przy wyjaławianiu ezy w płomieniu palnika.
2.2. Sterylizacja za pomocą suchego, gorącego powietrza
Suche, gorące powietrze wykazuje znacznie słabsze bójcze działanie na drobnoustroje w
porównaniu do ciepła wilgotnego. Dlatego wymagany jest dłuższy czas i wyższa temperatura
sterylizacji niż przy wykorzystaniu gorącej nasyconej pary wodnej aby uzyskać ten sam efekt.
Jest to związane z gorszym przewodzeniem ciepła do chłodnych materiałów w suchym powietrzu
niż w parze wodnej. Długi czas sterylizacji w wysokiej temperaturze powoduje większe
uszkodzenia materiałów niż w parze wodnej.
Referencyjne warunki sterylizacji, o ile nie podano inaczej, to 160
o
C w czasie nie krótszym
niż 2 godziny, 170
o
C w czasie nie krótszym niż 1 godzina, 180
o
C w czasie nie krótszym niż
30 minut.
Inne temperatury i czas mogą być użyte pod warunkiem, że uzyska się
satysfakcjonu
jący efekt (SAL minimum 10
-6
). Parametry sterylizacji suchym gorącym powietrzem
powinny być wyznaczone doświadczalnie ponieważ uzależnione są od typu sterylizatora, rodzaju
i właściwości wyjaławianych materiałów.
Ta metoda sterylizacji powinna być stosowana wyłącznie w przypadku gdy sterylizowany
materiał może ulec uszkodzeniu w parze nasyconej lub gdy SA to materiały nieprzenikliwe dla
ciepła wilgotnego. W suchym gorącym powietrzu można wyjaławiać termostabilne materiały takie
jak: szkło, metal, ceramika, substancje niezawierające wody – oleje, parafinę oraz związki
mineralne , jak np. tlenek cynku, talk.
Należy zwracać uwagę na to aby materiał poddawany sterylizacji był suchy, umieszczony w
sposób umożliwiający przenikanie i cyrkulację powietrza, czas sterylizacji uwzględniał czas
wyrównania temperatur (dłuższy czas wymagany jest np. dla pojemników z olejami i podłożami
maściowymi), drzwi komory były szczelnie zamknięte w czasie całego cyklu.
Jest to metoda długotrwała, nieekonomiczna. Występujące w niektórych sterylizatorach znaczne
różnice temperatury w komorze oraz brak blokady drzwi (możliwość otwarcia komory w trakcie
procesu) nie gwarantuje zachowania odpowiednich warunków wyjaławiania.

8
3. Sterylizacja radiacyjna
W sterylizacji znalazło zastosowanie promieniowanie beta oraz promieniowanie gamma.
Pierwszy rodzaj promieniowania jest promieniowaniem elektronowym (strumień elektronów) o
dużej energii, drugi jest promieniowaniem elektromagnetychnym. Oba rodzaje promieniowania
powodują destrukcję drobnoustrojowego DNA i nieodwracalnie uszkadzają błony komórkowe.
Promieniowanie jonizujące o krótkiej długości fali (gamma), powoduje niszczenie chemicznej
struktury molekuł komórkowych oraz jonizację wody w cytoplazmie, prowadząc do wytworzenia
toksycznych form tlenu (nadtlenek wodoru, rodniki nadtlenkowe, rodniki hydroksylowe)
powodujących biochemiczne niszczenie komórek drobnoustrojów. Promieniowanie to znajduje
zastosowanie do sterylizacji ze względu na dużą energię oraz przenikliwość.
Siła działania bójczego energii jonizującej zależy od ilości energii zaadsorbowanej
(pochłoniętej dawki) przez wyjaławiany materiał. Energie tę mierzy się w grejach.
Niewątpliwą zaletą sterylizacji radiacyjnej jest możliwość stosowania nieprzepuszczalnych dla
gazów (powietrza) opakowań, co znacznie wydłuża czas półtrwania wyjaławianych produktów.
Wadą tej metody jest wysoki koszt. Dlatego znajduje ona zastosowanie głównie w przemyśle do
sterylizacji: materiałów opatrunkowych, sprzętu jednorazowego użytku (strzykawki, igły itp.),
implantów, kosmetyków. Stosowanie promieniowania jonizującego do sterylizacji leków jest
ograniczone. Powodem tego jest możliwość wystąpienia zmian fizyko-chemicznych w produkcie
pod wpływem promieniowania.
4. Sterylizacja gazowa
Sterylizacja
gazowa
nale
ży, podobnie jak sterylizacja radiacyjna do procesów
niskotemperaturowych. Można ją przeprowadzać tlenkiem etylenu lub gazowym formaldehydem.
4.1. Sterylizacja tlenkiem etylenu
Tlenek etylenu jest gazem o silnych właściwościach toksycznych, karcinogenny, łatwopalny i
wybuchowy. Najczęściej stosuje się go w mieszaninie z CO
2
(domieszka CO
2
zapobiega
tworzeniu się mieszaniny wybuchowej). Niszczy drobnoustroje poprzez wiązanie się z
cząsteczkami ich białek funkcjonalnych, zarówno cytoplazmatycznych, jak i jądrowych , i prowadzi
do nieodwracalnego ich uszkodzenia.
Stosując sterylizację tlenkiem etylenu należy przestrzegać kryteriów dotyczących: stężenia
substancji aktywnej, wilgotności, zakresu temperatury, czasu ekspozycji. Parametry wyjaławiania
powinny być ustalane indywidualnie dla każdego materiału. Ważne jest także zapewnienie
penetracji gazu, sposób opakowania, rodzaj opakowania oraz stopień jego wysuszenia.
Tlenek etylenu działanie najefektywniejsze działanie bójcze na drobnoustroje wykazuje w
określonym stężeniu. Zazwyczaj stosuje się stężenia od 600 do 1500 mg/l w zależności od
stosowanej metody. Zbyt małe stężenie gazu nie niszczy wszystkich mikroorganizmów, natomiast
zwiększenie stężenia ponad wartość normatywną nie powoduje wzrostu aktywności bójczej.
Tlenek etylenu może przenikać przez grubą i suchą ścianę przetrwalników pod warunkiem jej
nawilżenia. Działanie bójcze tlenku etylenu można osiągnąć już przy wilgotności większej niż
30%. Zazwyczaj stosuje się zakres wilgotności względnej powietrza od 50 do 90%.
Kolejny czynnik wpływający na proces sterylizacji tlenkiem etylenu to temperatura. Wzrost
temperatury pozwala na skrócenie czas sterylizacji. Najczęściej stosuje się temperaturę od 37
do 60
o
C.
Czas sterylizacji jest wyznaczany eksperymentalnie
i dostosowywany do metody. Jest on zależny
od stężenia gazu oraz temperatury procesu. Może on wynosić od 2 – 7 godzin, zwykle 2 – 4
godzin.

9
Skuteczne działanie bójcze można osiągnąć w czasie 4-6 godzin, przy stężeniu tlenku etylenu
do 1200 mg/l powietrza, w temperaturze 40-56
o
C i wilgotności 30-50%.
Sterylizację tlenkiem etylenu prowadzi się w odpowiedniej aparaturze, w pomieszczeniach
posiadających odpowiednią wentylacje ze względu na właściwości stosowanych gazów.
W procesie sterylizacji tlenkiem etylenu
końcowym etapem jest odgazowywanie lub desorbcja –
aktywne lub pasywne usuwanie tlenku etylenu, który został pochłonięty przez sterylizowany
materiał. Degazacja można prowadzić w temperaturze pokojowej przez 7 dni lub w temperaturze
50
o
C przez 12 godzin.
S
terylizacja tlenkiem etylenu stanowi drugą, po sterylizacji parą wodną, co do powszechności
stosowania metodę sterylizacji wyrobów medycznych w polskich szpitalach. Używany jest on do
wyjaławiania przedmiotów wykonanych z metalu, gumy, tworzyw sztucznych, materiałów
opatrunkowych, szewnych, niektórych substancji leczniczych, sprzętu diagnostycznego
(bronchoskopy, endoskopy), zastawki sercowe, stymulatory .
Zaletą tlenku etylenu jest jego przenikliwość przez papier, cienkie warstwy tworzyw sztucznych
(folia
poliestrowa, polipropylenowa, polietylenowa), natomiast wadą jest adsorbowanie gazu
przez wiele materiałów (guma, tworzywa sztuczne), z których przed użyciem musi być usunięty
oraz możliwość zachodzenia reakcji chemicznych z wytworzeniem związków toksycznych.
4.2. Sterylizacja gazowym formaldehydem
Formaldehyd, podobnie jak tlenek etylenu, jest związkiem wysoce reaktywnym, toksycznym,
palnym, w połączeniu z powietrzem może tworzyć mieszaninę wybuchową.
Jego działanie bójcze polega na alkilacji białek, co prowadzi do nieodwracalnych zmian w
komórkach i utraty zdolności rozmnażania się mikroorganizmów.
Na skuteczność sterylizacji gazowym formaldehydem wpływa stężenie substancji aktywnej,
czas ekspozycji oraz temperatura i wilgotność. Zazwyczaj stosuje się stężenie formaldehydu
od 2
– 5%. W większych stężeniach przekształca się on w nieczynny paraformaldehyd.
Wilgotność względna podczas procesu nie powinna być niższa niż 80%. Czas sterylizacji zależy
od stężenia, zwykle wynosi od 2 do 4 godzin. Przy stężeniu formaldehydu 2 mg/l niezbędne jest
prowadzenie 24 godzinnej sterylizacji
. Formaldehyd wytwarza się wewnątrz specjalnych,
ogrzewanych, szczelnych szafek z tabletek paraformaldehydu ogrzewanych do temperatury 60-
80
o
C.
Wadą formaldehydu jest brak takich właściwości penetrujących jakie posiada tlenek etylenu i
trudności w usuwaniu go ze sterylizowanych sprzętów.
Gazowy formaldehyd stosowany jest głównie do sterylizacji materiałów termolabilnych,
niektórych narzędzi lekarskich, książek, odzieży, bielizny i pościeli. Nie zaleca się stosowania
formaldehydu do sterylizacji przedmiotów o skomplikowanej geometrii (wąskie światła, ściski,
gwinty) i dużych powierzchniach niejawnych.
Niewątpliwie zaletą formaldehydu jest jego większa, niż w przypadku tlenku etylenu, zdolność
desorbcji, krótszy czas degazacji, niska agresywność wobec sterylizowanych powierzchni, niski
koszt cyklu sterylizacyjnego. Jest on również wyczuwalny przez człowieka w niższych dawkach
niż zagrażające życiu, co ma ogromne znaczenie dla bezpieczeństwa.
5. Sterylizacja za pomocą roztworów preparatów chemicznych
Sterylizację można przeprowadzać również za pomocą roztworów preparatów chemicznych
takich jak: aldehyd glutarowy, aldehyd mrówkowy, nadtlenek wodoru, kwas nadoctowy. Ze
względu na stosowanie powyższych związków zarówno w procesie sterylizacji, jak i dezynfekcji
opis zamieszczono w punkcie dezynfekcja.

10
6. Sterylizacja plazmowa
W związku z nowymi technologiami stosowanymi w medycynie nastąpiła intensyfikacja badań
w celu znalezienia nowych m
etod niskotemperaturowych. Jedną z metod ostatnio
wprowadzonych do stosowania jest sterylizacja za pomocą plazmy gazowego H
2
O
2
.
Plazma jest czwartym stanem skupienia materii. Jest zjonizowanym gazem wytwarzanym w
warunkach próżni pod wpływem pola elektromagnetycznego. Cząsteczki gazu w próżni
wzbudzane energią w polu elektromagnetycznym przechodzą w stan plazmy.
Plazma niszczy drobnoustroje poprzez uszkadzanie DNA, RNA, enzymów, fosfolipidów.
Obecnie istnieją dwa systemy sterylizacji plazmowej. W pierwszym plazma wytwarzana jest
bezpośrednio w komorze sterylizatora. W drugim plazma wytworzona poza komorą sterylizatora
jest do niej wprowadzana.
Do uzyskania plazmy wykorzystywany jest np. nadtlenek wodoru. Po wytworzeniu próżni w
komorze sterylizatora następuje wtrysk H
2
O
2
, jego parowanie i dyfuzja. Cząsteczki H
2
O
2
osiadają
na wyjaławianym materiale. Jest to pierwsza faza biobójcza. Następnie włączane jest źródło
energii o wysokiej częstotliwości i z H
2
O
2
wytwarzana jest plazma
– druga faza biobójcza (trwa
ona 10
–15 min w temp. max. 44
0
C). Na koniec następuje faza wentylacji i wyrównania ciśnień.
Cały cykl trwa ok. 75 min w temperaturze ok. 40
0
C. Sterylizowany materiał nie wymaga degazacji,
a po procesie powstają H
2
O
i O
2
związki przyjazne dla środowiska.
M
etodą tą nie można sterylizować materiałów zawierających celulozę, materiałów porowatych
oraz płynów. Materiał przygotowany do sterylizacji powinien być idealnie suchy. Nie można
sterylizować sprzętu o zamkniętych przewodach. Sprzęt o średnicy poniżej 3 mm i długości
powyżej 30 cm wymaga zastosowania dodatkowego ładunku H
2
O
2
. Należy stosować specjalny
materiał opakowaniowy.
7. Wyjaławianie metodą filtracji
Filtracja polega na przepuszczaniu płynów lub gazów przez materiał o mikroskopijnych porach,
nieprz
epuszczalnych dla drobnoustroju. Polega więc ona na fizycznym oddzieleniu
mikroorganizmów od przepuszczanej substancji. Proces ten stosowany jest do sterylizacji
termolabilnych płynów, powietrza oraz innych gazów.
Zaletą wyjaławiania płynów metodą sączenia jest między innymi usuwanie z roztworów
zarówno drobnoustrojów żywych, jak i martwych oraz większych fragmentów komórek.
Do sterylizacji płynów stosuje się filtry porcelanowe lub ze szkła spiekanego (Schotta) oraz filtry
membranowe.
Wyjaławianie za pomocą filtrów membranowych prowadzi się po wmontowaniu ich do
specjalnych aparatów. Aparaty te wykonane są ze stali nierdzewnej, szkła lub innych materiałów.
Są one podłączone do odbieralnika, a sączenie odbywa się w podciśnieniu lub nadciśnieniu
zależnie od konstrukcji zastawu.
Do wyjaławiania powietrza stosuje się filtry HEPA – high-efficiency particulate air filter, które
zatrzymują mikroorganizmy większe niż 0,3 m.
KONTROLA PROCESU STERYLIZACJI
1. Metody kontroli procesu sterylizacji
Pomimo, iż nowoczesne urządzenia sterylizacyjne umożliwiają dokładne wyznaczenie i
sterowanie parametrami fizycznymi, niezbędne jest prowadzenie kontroli procesu wyjaławiania.
11
Kontrolę procesu sterylizacji przeprowadza się za pomocą wskaźników fizycznych, chemicznych i
biologicznych
Wskaźniki fizyczne - termometry, manometry, zegary, mierniki wilgotności, karty kontrolne,
kontrolki świetlne i inne przyrządy wmontowane do urządzenia sterylizującego informują o stanie
technicznym sterylizatora. Mierzą punktowo dany parametr. Oprócz obserwacji wskazań tych
przyrządów coraz częściej stosuje się system rejestracji podstawowych parametrów fizycznych w
postaci wydruków, wykresów lub raportów.
Wskaźniki chemiczne zawierają substancję chemiczną, która po osiągnięciu wymaganych
par
ametrów sterylizacji trwale, wyraźnie i jednoznacznie zmienia swoje właściwości fizyczne (np.
barwę). Wskaźniki chemiczne informują jedynie czy w danym cyklu pracy zostały osiągnięte
warunki sterylizacji, nie dają one gwarancji, że poddany sterylizacji materiał został wyjałowiony
Wskaźniki chemiczne można podzielić na:
wskaźniki chemiczne procesu (dawniej zwane sprawdziany sterylizacji) – przeznaczone
głównie do użycia zewnętrznego; wykazują one jedynie, że materiał został poddany procesowi
sterylizacji; zm
iana barwy następuje pod wpływem osiągnięcia jednego z parametrów
sterylizacji np. temperatury (nie wykazują jak długo ta temperatura się utrzymywała); pozwalają
na wizualne odróżnienie materiału, który był poddany sterylizacji od nie wyjałowionego; do
teg
o typu wskaźników należą taśmy kontrolne samoprzylepne lub wskaźniki chemiczne
umieszczone na opakowaniach jednorazowych.
wskaźniki chemiczne wielu zmiennych – wkładane do wnętrza pakietu; wykazują, że wewnątrz
ładunku zostały osiągnięte wartości wszystkich lub kilku (przynajmniej dwóch) krytycznych
parametrów procesu sterylizacji; informują o prawidłowości przebiegu procesu (np.
Zintegrowany Test TST, Rurka Brown’a typ 5)
Ze względu na liczbę kontrolowanych parametrów sterylizacji wskaźniki chemiczne podzielono na
pięć grup.
Wskaźniki biologiczne – zawierają określone liczby żywych, zdolnych do przejścia w formy
wegetatywne, wysoce opornych na dany rodzaj czynnika wyjaławiającego przetrwalników
bakteryjnych.
Wskaźniki stosowane do kontroli biologicznej zawierają:
kontrola sterylizacji gorącą nasyconą parą wodną pod ciśnieniem - Geobacillus
stearothermophilus (
wcześniejsza nazwa Bacillus stearothermophilus); liczba zdolnych do
przejścia w formy wegetatywne przetrwalników na nośniku przekracza 5 x 10
5
, a w
skaźnik D
w 121
o
C przekracza 1,5 minuty;
kontrola sterylizacji suchym gorącym powietrzem - Bacillus atrophaeus (wcześniejsza nazwa
Bacillus subtilis subsp. niger
); liczba zdolnych do przejścia w formy wegetatywne
przetrwalników na nośniku przekracza 1 x 10
5
, a wskaźnik D w 160
o
C wynosi od 5 do 10
minut; w przypadku sterylizacji i depirogenizacji szkła stosuje się często temperaturę wyższą
niż 220
o
C i w tym przypadku zamiast wskaźnika biologicznego można stosować wskaźnik
redukcji o 3log endotoksyn bakteryjnych;
kontrola sterylizacji tlenkiem etylenu - Bacillus atrophaeus
(wcześniejsza nazwa Bacillus
subtilis subsp. niger
); liczba zdolnych do przejścia w formy wegetatywne przetrwalników na
nośniku przekracza 5 x 10
5
, a wskaźnik D przekracza 2,5 minuty przy stężeniu 600mg tlenku
etylenu, temperaturze 54
o
C i wilgotności względnej 60%;
kontrola
sterylizacji
nadtlenkiem
wodoru,
kwasem
nadoctowym
-
Geobacillus
stearothermophilus (
wcześniejsza nazwa Bacillus stearothermophilus); liczba zdolnych do
przejścia w formy wegetatywne przetrwalników na nośniku przekracza 5 x 10
5
;
kontrola sterylizacji promieniowaniem jonizującym - Bacillus pumilis; liczba zdolnych do
przejścia w formy wegetatywne przetrwalników na nośniku przekracza 1 x 10
7
; mogą być
12
stosowane jako dodatkow
y sposób oceny efektywności dostarczonej dawki energii
radiacyjnej; wskaźnik D wynosi wiecej niż 1,9kGy.
Wskaźniki te informują o fakcie zabicia drobnoustrojów (spor wyselekcjonowanych szczepów
bakterii wysoce opornych na dany czynnik sterylizacyjny). Wsk
aźniki biologiczne dają gwarancję
jałowości - jeżeli użyte w teście przetrwalniki zostały zabite oznacza to, iż zostały zabite wszystkie
bardziej wrażliwe drobnoustroje zanieczyszczające sterylizowany materiał.
Dla uzyskania pełnej informacji niezbędne jest monitorowanie procesu sterylizacji za pomocą
wszystkich trzech metod. Wskaźniki fizyczne określają stan techniczny urządzenia, chemiczne -
warunki procesu informując o jego nieprawidłowościach, pozwalając na ich korygowanie zanim
uzyska się wyniki kontroli przy użyciu testów biologicznych. Jedynie wskaźniki biologiczne
informują o bójczym działaniu procesu i dają pełną gwarancję jałowości.
2. Kontrola aparatów do filtracji - testy integralności filtrów
Metody fizyczne
Metoda pęcherzykowa
Metoda pęcherzykowa (tzw. bubble point) polega na pomiarze ciśnienia, przy którym ciśnienie
kapilarne cieczy znajdującej się we wnętrzu sączka zostanie pokonane. Służy jako wskaźnik
wielkości por oraz wskaźnik zdolności sączka do zatrzymywania cząstek. Wartość ciśnienia
(‘bubble point”) zależy od płynu użytego do zwilżenia membrany. Przy określonej wielkości por
będzie ono wyższe dla cieczy o większym napięciu powierzchniowym (np. woda) niż dla cieczy
o niższym (np. alkohol izopropylowy). Wartości ciśnienia ‘bubble point” oznaczamy dla
ciśnienie, przy którym pojawiają się pęcherzyki gazu pochodzące z największych por.
Metoda szybkości dyfuzji
Metoda pomiaru szybkości dyfuzji polega na ocenie czasu przepływu gazu przez mokry
sączek pod wpływem określonego ciśnienia.
Metoda biologiczna
Metoda biologiczna polega na sączeniu zawiesiny kultur bakteryjnych o wielkości komórek do
0,3
m, o odpowiedniej gęstości inoculum i ocenie jałowości przesączu. Zazwyczaj stosuje się
inoculum szczepu Brevundimonas diminuta
(wcześniejsza nazwa Pseudomonas diminuta) o
gęstości 107 komórek na każdy centymetr kwadratowy sączka. W badaniu testowym stosuje się
sączki o deklarowanej wielkości porów 0,22 m.
3. Częstotliwość i sposób wykonania kontroli procesów sterylizacji
Kontroli powinien być poddawany każdy sterylizator.
Kontrola okresowa
Kontrola okresowa zewnętrzna wykonywana przez stacje sanitarno-epidemiologiczne z
częstotliwością raz na kwartał, przy użyciu testów biologicznych. Trzy wskaźniki biologiczne
(w przypadku małych autoklawów dopuszcza się dwa) umieszcza się wewnątrz trzech
największych pakietów reprezentatywnych dla sterylizowanego materiału.
Kontrola okresowa wewnętrzna prowadzona jest przez użytkownika. Sterylizatory parowe i na
suche gorące powietrze zaleca się kontrolować co najmniej raz na miesiąc, w miarę potrzeb i
możliwości częściej. Sposób wykonania jak w kontroli zewnętrznej.
Kontrola bieżąca
Kontrola bieżąca wykonywana jest przez użytkownika przy użyciu wskaźników chemicznych
wielu zmiennych i wskaźników chemicznych procesu. Użytkownik ma obowiązek kontroli każdego
procesu sterylizacji. W przypadku sterylizatorów gazowych z użyciem tlenku etylenu nie wszystkie

13
parametry procesu można wyznaczyć w sposób fizyczny dlatego każdy proces musi być
kontrolowany za pomocą wskaźnika biologicznego.
DEZYNFEKCJA
Dezynfekcja jest procesem, w wyniku którego następuje zabicie drobnoustrojów (nie zawsze
spor bakterii) znajdujących się na przedmiotach, powierzchniach lub rękach.
Jest to proces złożony, którego przebieg zależy od:
właściwości czynnika dezynfekcyjnego - rodzaj czynnika (w zależności od rodzaju środki
dezynfekcyjne
wykazują różną aktywność bójczą: od podstawowego zakresu
bakteriobójczego, po szeroki prątkobójczy, grzybobójczy i wirusobójczy); zastosowane
parametry
czasu ekspozycji
stężenia (substancje chemiczne)
czynnika biologicznego: rodzaju drobnoustrojów, ich wrażliwości na czynniki dezynfekcyjne i
ich liczby (prawdopodobieństwo skutecznej dezynfekcji jest tym większe, im mniejsza liczba
drobnoustrojów znajduje się na odkażanym przedmiocie)
warunków środowiska: temperatury i pH, które mogą oddziaływać zarówno na komórki, jak i
na właściwości środka dezynfekcyjnego; obecności substancji organicznych lub innych
zanieczyszczeń, które mogą zmniejszać stężenie środka w roztworze albo uniemożliwiać
dotarcie czynnika dezynfekującego do komórki drobnoustroju; rodzaju dezynfekowanego
materiału
Duże znaczenie ma również „czynnik ludzki”, ponieważ to personel musi wybrać odpowiednią
metodę i prawidłowo przeprowadzić dezynfekcję. Zmiana parametrów , np. obniżenie stężenia,
temperatury, skrócenie czasu dezynfekcji, niekorzystnie wpływa na końcowy efekt procesu.
Proces dezynfekcyjny dotyczy środowiska nieożywionego, antyseptyka to działanie odkażające
żywe powierzchnie i tkanki.
W proce
sie dezynfekcji wykorzystanie znalazły czynniki fizyczne takie jak: ciepło,
promieniowanie nadfioletowe oraz czynniki chemiczne -
środki chemiczne.
1. Dezynfekcja za pomocą czynników fizycznych
1.1. Metody termiczne
Pasteryzacja
– jest postępowaniem mającym na celu eliminowanie drobnoustrojów w płynach
(najczęściej mleku); polega na ogrzewaniu płynu w temperaturze 65
o
C przez 30 minut;
szybka pasteryzacja polega na ogrzaniu płynu do 72
o
C na 15-20 sekund i szybkim
schłodzeniu
Dezynfekcja parą wodną w temperaturze 105 – 110
0
C, nadciśnienie 0,45 – 0,50 atm –
stosowana do dezynfekcji sprzętu poddanego wcześniej czyszczeniu oraz do odkażania
bielizny, odzieży, pościeli i inn., a także do unieszkodliwiania odpadów medycznych; para
wodna pod normalnym ciśnieniem stosowana jest do dezynfekcji wyposażenia sanitarnego
Dezynfekcja gorącą wodą – głównie stosowana w urządzeniach myjąco-dezynfekujących
Wyparzanie wodą w temperaturze 100
o
C
Dekoktacja
to proces niszczenia drobnoustrojów poprzez działanie wrzącej wody lub pary
wodnej w normalnym ciśnieniu przez 15-20 minut.
Dezynfekcje termiczną przeprowadza się najczęściej w specjalnych urządzeniach takich jak:
dezynfektory, myjnie-dezynfektory.

14
1.2 Dezynfekcja promieniami nadfioletowymi
– promieniowanie UV o długości 256 nm redukuje
liczbę drobnoustrojów na czystych powierzchniach lub w powietrzu. Mała zdolność penetracji
ogranicza zastosowanie tego czynnika do dezynfekcji.
2. Dezynfekcja chemiczno-termiczna
– skojarzone działanie ciepła (do 60
0
C) i środków
chemicznych; stosowana do dezynfekcji sprzętu wrażliwego na działanie wysokiej temperatury.
3. Dezynfekcja chemiczna
Dezynfekcję chemiczną przeprowadza się przy użyciu związków wykazujących działanie
przeciwdrobnoustrojowe. Aktywno
ść preparatów chemicznych zależy przede wszystkim od
składu: rodzaju substancji aktywnych i wspomagających.
Środki, które znalazły zastosowanie w środowisku nieożywionym noszą nazwę
dezynfekcyjnych. Te, które stosuje się na żywe powierzchnie to antyseptyki.
Działanie środków odkażających na komórkę bakteryjną polega na uszkodzeniu struktury jej
ściany i błony komórkowej. Wniknięcie związku do wnętrza komórki zaburza podstawowe funkcje
życiowe komórki, powoduje jej lizę i śmierć. Różne drobnoustroje wykazują różną wrażliwość na
środki dezynfekcyjne i antyseptyczne. Jest to związane głównie z różną budową ściany
komórkowej, stanowiącą barierę ochronną.
Drobnoustroje potrafią wytwarzać oporność na środki odkażające na poziomie mechanizmów
genetycznych i przystosowawczych.
3.1. Główne grupy substancji, które znalazły zastosowanie w dezynfekcji chemicznej
Od czasów Listera, który pierwszy wprowadził fenol do dezynfekcji pola operacyjnego i
narzędzi, chemicy zsyntetyzowali miliony nowych związków, spośród których kilka tysięcy
wykazuje aktywność przeciwdrobnoustrojową.
Zastosowanie w dezynfekcji znalazły związki z różnych grup chemicznych: aldehydy, alkohole,
związki halogenowe, jodofory, fenole, kwasy, związki powierzchniowo czynne. Związki te są
stosowane ja
ko jednoskładnikowe preparaty lub w kombinacji. Tylko część z nich znalazła
zastosowanie w antyseptyce'. Antyseptyki bowiem, jako działające na żywą tkankę, nie mogą być
toksyczne, wywierać działania drażniącego i uczulającego. To ogranicza możliwość stosowania
niektórych związków dezynfekcyjnych w antyseptyce. Główne grupy antyseptyków to: alkohole,
związki jodu, jodofory, związki powierzchniowoczynne, barwniki.
Do najważniejszych grup związków, o działaniu przeciwdrobnoustrojowym należą:
pochodne fenolowe i dwufenolowe (fenol, o-fenylofenol, krezol, , rezorcynol,
heksylrezorcynol, tymol, heksachlorofen, triclosan)
biguanidyny (chlorheksydyna)
alkohole (etylowy, izopropylowy)
związki halogenowe
–
pochodne chloru (podchloryn sodu, chloramina);
–
związki jodu (jodyna, jodofory: Betadine , Isodine )
związki powierzchniowo-czynne
-
substancje zwilżające (emulgatory, mydła, detergenty)
-
kationowe związki (czwatrorzędowe sole amoniowe, chlorek benzalkoniowy)
-
anionowe związki (siarczan sodu)
kwasy i zasady (KOH)
aldehydy (aldehyd glutarowy, formaldehyd)
metale ciężkie i ich związki (srebro, miedź, rtęć, cynk)
nadtlenki
(nadtlenek wodoru, sól magnezowa kwasu monoperoksyftalowego
barwniki
(fiolet krystaliczny, zieleń brylantowa, akryflawina, etakrydyna)

15
oktenidyna - pochodna bipirydynowa
Aldehydy
Aldehydy otrzymywane są przez oksydację alkoholi. Są to jedne z nielicznych środków
dezynfekcyjnych o działaniu wyjaławiającym. Działają najlepiej w pH lekko alkalicznym (7,5- 8,5)
na bakterie Gram-dodatnie, Gram-
ujemne, prątki gruźlicy (średnio wrażliwe), przetrwalniki, grzyby
chorobotwórcze i wirusy.
Mechanizm ich działania polega na alkilacji grup aminowych i sulfhydrylowych białek i atomów
azotu zasad purynowych (np. guaniny). Ich działanie na wirusy polega również na denaturacji
białek i kwasów nukleinowych.
Zastosowanie aldehydów w odkażaniu ograniczone jest bardzo przez ich działanie drażniące
żywe tkanki. Z tego powodu używa się ich głównie do dezynfekcji powierzchni martwych.
Obecność w środowisku materii organicznej nieznacznie osłabia ich działanie.
Głównymi przedstawicielami tej grupy środków dezynfekcyjnych są: aldehyd glutarowy, CHO-
(CH
2
)-
CHO i aldehyd mrówkowy, H-CHO.
Aldehyd glutarowy
stosowany jest do sterylizacji i dezynfekcji wysokiego stopnia głównie
mat
eriałów medycznych z tworzyw sztucznych, które ulegają uszkodzeniu w procesie
wyjaławiania termicznego.
Aldehyd glutarowy działa bójczo na wszystkie formy drobnoustrojów. Łączy się on ze
strukturami komórkowymi powodując zahamowanie syntezy DNA, RNA i białek.
Wodne roztwory aldehydu glut arowego maja odczyn kwaśny i w tym stanie nie działają
sporobójczo. Sporobójcze właściwości wykazują wodne roztwory po aktywacji czyli dodaniu
czynnika podnoszącego pH do wartości 7,5 – 8,5.
Proces wyjaławiania prowadzi się w 2% roztworach, które przed użyciem alkalizuje się za
pomocą 0,3% węglanu sodu do pH 7,5 – 8,5 przez trzy godziny w temperaturze pokojowej. Po
wyjałowieniu konieczne jest przepłukanie sterylizowanego materiału jałową wodą destylowaną.
Aldehyd glutarow
y używany jest do sterylizacji narzędzi i drobnego sprzętu medycznego,
niewielkiej aparatury, przyborów z urządzeniami optycznymi, wzierników, zgłębników, cewników,
elementów respiratorów itp. Nie powinien być stosowany do dezynfekcji powierzchni i sprzętu
niskiego ryzyka ponieważ jest toksyczny i kosztowny.
Wykazuje on dużą toksyczność, powoduje podrażnienia skóry, błon śluzowych i oczu. Ekspozycja
na aldehyd glutarowy powinna być monitorowana. Nie koroduje metali i nie uszkadza gumy,
aparatury optycznej,
plastiku, może jednak działać korodująco na inne materiały.
Aldehyd mrówkowy -jeden z najstarszych - stosowany jest do dezynfekcji i wyjaławiania w
roztworach 3-20%.
Oprócz gazowego formaldehydu w wyjaławianiu stosuje się również wodne roztwory
formalde
hydu. Działanie sterylizujące wykazuje 8% wodny roztwór aldehydu mrówkowego w
czasie 24 godzin w temperaturze pokojowej, a
także 8% roztwór formaldehydu w 70%
alkoholu etylowym w czasie 18 godzin.
Ze względu na silne właściwości korodujące do
roztworów sterylizujących dodaje się inhibitor korozji. Po zakończonym procesie wyjaławiania
konieczne jest trzykrotne przepłukanie sterylizowanego materiału jałową wodą destylowaną.
Aldehyd mrówkowy jest używany do dezynfekcji w postaci pary w specjalnych komorach
parowo-
formalinowych , do dezynfekcji pomieszczeń oraz do przechowywania jałowych narzędzi.
W tych przypadkach warunkiem bakteriobójczego działania jest odpowiedni poziom wilgotności
powietrza (powyżej 75%). Zastosowanie znalazły również roztwory wodne formaldehydu zwane
formaliną.

16
Zastosowanie preparatu ogranicza bardzo przykry zapach, działanie korodujące metale oraz
działanie karcinogenne. Długotrwała ekspozycja na pary aldehydu lub działanie na skórę może
powodować zaburzenia oddychania, podrażnienia skóry. W przypadku stosowania aldehydu
mrówkowego obowiązkowe jest monitorowanie narażenia..
Nadtlenek wodoru
Nadtlenek wodoru wykazuje szeroki zakres przeciwdrobnoustrojowego działania;
bakteriobójcze, sporobójcze, grzybobójcze, pratkobójcze i wirusobójcze. Działa poprzez
uwalnianie wolnych rodników wodorotlenkowych, które powodują utlenienie grup sulfhydrylowych
podwójnych wiązań w białkach, lipidach i na powierzchni błony komórkowej. Uszkadza błonę
lipidową, DNA i inne organelle komórkowe.
Proces wyjaławiania prowadzi się za pomocą 6 – 8% wodnych, stabilizowanych, roztworów
nadtlenku wodoru w temperaturze pokojowej w czasie sześciu godzin.
Może on być stosowany do sterylizacji sprzętów z tworzyw sztucznych, aparatury optycznej,
aparatury dializacyjnej.
Na szeroką skale znajduje zastosowanie do sterylizacji kontenerów do
przechowywania żywności.
W dezynfekcji stosuje się 3% do 6% roztwory. Jest używany do dezynfekcji soczewek
kontaktowych, endoskopów, drobnego sprzętu, tkanin.
Kwas nadoctowy
Kwas nadoc
towy, podobnie jak nadtlenek wodoru należy do grupy związków utleniających.
Niszczy on komórki bakterii, grzybów, wirusów, wykazuje również działanie przetrwalnikobójcze.
Mechanizm jego działania nie jest do końca wyjaśniony. Przypuszcza się, że jest podobny do
mechanizmu innych związków utleniających – denaturacja białek, uszkodzenie ściany
komórkowej, utlenianie wiązań sulfhydrylowych i siarczkowych w białkach, enzymach i innych
metabolitach.
Kwas nadoctowy wykazuje aktywność przeciwdrobnoustrojową zarówno w niskich (-40
o
C), jak i
wysokich temperaturach (+85
o
C). Jako słaby kwas jest bardziej aktywny w środowisku kwaśnym,
ale w dużych stężeniach jest aktywny także w środowisku zasadowym. Jego aktywność nie
obniża się w obecności substancji organicznych. Wykazuje on synergistyczne działanie z
alkoholami: metylowym, etylowym, propylowym.
Jego pozytywną cechą jest brak reakcji ze szkłem, większością plastików, aluminium, stalą
nierdzewną, platynowanym żelazem. Podobnie jak H
2
O
2
nie daje szkodliwych produktów
ro
zpadu, rozkłada się do kwasu octowego, nadtlenku wodoru, tlenu i wody.
Może jednak reagować z winylem, a zwykła stal, galwanizowane żelazo, miedź, mosiądz i brąz
ulegają korozji w zetknięciu z kwasem nadoctowym. Innymi niekorzystnymi właściwościami kwasu
n
adoctowego są jego toksyczność i karcinogenność.
Znajduje on zastosowanie do sterylizacji na zimno sprzętu medycznego, stomatologicznego
oraz w farmacji.
Fenole i ich pochodne
Fenol, podstawowy związek z tej grupy, jest jednym z najstarszych znanych środków
przeciwbakteryjnych.
Mechanizm działania fenolu i jego pochodnych wiąże się z wpływem na przepuszczalność
błony komórkowej, a następnie z działaniem denaturacyjnym i koagulującym białko. Fenole są
truciznami protoplazmatycznymi. W niedużych stężeniach rozrywają one błonę cytoplazmatyczną,

17
powodują lizę i wyciek składników komórkowych. Pobudzają również rozkład pewnych
substratów, co prowadzi do zmian w zawartości tlenu w komórce. W większych stężeniach fenole
powodują koagulację białka komórkowego, a tym samym niszczą systemy enzymatyczne.
W zależności od stężenia mogą działać bakteriostatycznie lub bakteriobójczo, są bardziej
aktyw
ne w pH kwaśnym i podwyższonej temperaturze. Działają na bakterie Gram-dodatnie,
Gram-
ujemne, grzyby i niektóre wirusy. Przetrwalniki są zabijane w fenolach dopiero w stężeniu
5%. Mechanizm działania fenoli związany jest z obecnością grupy hydroksylowej w cząsteczce.
Znamienne jest, że małe zmiany stężeń fenoli mogą bardzo znacznie zmienić ich działanie, a
jednocześnie fenole w szerokim zakresie stężeń pozostają bakteriostatyczne, co świadczy o
względnie wysokim wykładniku stężenia lub współczynniku rozcieńczenia.
Spośród działań toksycznych należy zwrócić uwagę na fakt, że fenole mogą uszkadzać
tkankę, a także być przez nią adsorbowane, powodując zatrucie. Powodują także korozję metali.
Obecność materii organicznej osłabia działanie fenoli. Białko działa tu jako nieswoisty adsorbent.
Związki z grupy fenoli służą głównie do dezynfekcji ogólnej środowiska nieożywionego. W
antyseptyce nie znalazły zastosowania ze względu na przykry zapach i działanie drażniące, a
także właściwości adsorpcji na skórze. W pewnym zakresie służą jako środki konserwujące leki
(fenole -
preparaty do iniekcji, parabeny do leków do oczu i zewnętrznych)
Chlorheksydyna
Chemicznie należy do biguanidów. Stosowana jest w formie soli rozpuszczalnej w wodzie:
glukonianu lub octanu. Jest związkiem powierzchniowo czynnym.
Mechanizm antybakteryjnego działania chlorheksydyny polega na adsorpcji na powierzchni
komórki dzięki kationowemu charakterowi związku. W małych dawkach powoduje wypływ
składników komórki, w wyższych wykazuje zdolność wytrącania białek cytoplazmatycznych i
kwasów nukleinowych. Stopień adsorpcji zależy od wielu czynników, z których wymienia się
stężenie chlorheksydyny, wielkość inoculum bakteryjnego, rodzaj bakterii, pH środowiska.
Zwiększenie pH powoduje zwiększenie adsorpcji w związku ze wzrostem jonizacji na powierzchni
komórki, a tym samym wzmocnienie działania. Jako związek kationowy chlorheksydyna reaguje z
ujemnie naładowanymi grupami, powodując ich redukcję. W stężeniu 0,01 % następuje szybka i
bezpowrotna utrata składników cytoplazma tycznych przez błonę komórkową.
Wykazuje silne działanie bakteriostatyczne, zwłaszcza na bakterie Gram-dodatnie, w stężeniu
1-15
mg/l. Skuteczność w stosunku do bakterii Gram- -ujemnych jest dużo mniejsza i wymaga
stosowania wielokrotnie wyższych stężeń - 60-100 mg/l. Jest nieskuteczna w stosunku do
przetrwalników, grzybów i prątków gruźlicy. Stwierdzono, że dla otrzymania efektu
bakteriobójczego stężenie musi być podwyższane niejednokrotnie aż do 800 mglI (dla S. aureus,
E. coli, Proteus vulgaris i Pseudomonas aeruginosa).
Drobnoustroje wykazują znaczną zdolność wytwarzania form opornych na chlorheksydynę, co
zmniejsza wartość jej stosowania i wymaga prowadzenia badań kontrolnych.
Chlorheksydyna, jako silny bakterio statyk, znalazła zastosowanie głównie w antyseptyce.
Używana jest szeroko w stężeniach 0,5-1% w roztworach 70% etanolu do zabiegów
antyseptycznych na skórze, do odkażania rąk i pola operacyjnego. Stwierdzono, że etanol
wpływa synergicznie na zwiększenie efektu przeciwbakteryjnego i opóźnienie wytwarzania form
opornych. Nie jest zalecane stosowanie roztworów wodnych ze względu na ułatwienie możliwości
wytwarza
nia form opornych w środowisku.
Jest związkiem mało toksycznym i dobrze tolerowanym przez skórę w używanym najczęściej
stężeniu 1%. Działanie na błonę śluzową może wywołać podrażnienie nawet w o wiele
mniejszych niż l % stężeniach (0,02%).
Chlorheksydyna w praktycznym użytku bywa stosowana wraz z czwartorzędowymi zasadami

18
amoniowymi. Na połączenie to drobnoustroje zwykle dużo dłużej wykazują wrażliwość.
Chlorheksydyna znalazła także zastosowanie w konserwacji leków do oczu. Warto zaznaczyć, że
chlorheksydyna tworzy wiele niezgodności ze związkami powierzchniowoczynnymi, anionowymi,
niejonowy
rni, a także mydłami i detergentami.
Czwartorzędowe zasady amoniowe
Czwartorzędowe zasady amoniowe należą do związków powierzchniowo czynnych,
kationowych. Są związkami bipolarnymi zawierającymi w cząsteczce grupę hydrofobową i
hydrofilną. Ta cecha cząsteczki warunkuje ich właściwości powierzchniowo czynne. Z drugiej
strony pole hydrofilne warunkuje charakter kationowy związku i możliwość adsorpcji cząsteczki na
powierzch
niach. Aktywność przeciwbakteryjna zależy od liczby atomów w łańcuchach węglowych.
Zawiera się ona w granicach 8-18, a dla skuteczności związku powinno ich być więcej niż 16.
Mechanizm działania czwartorzędowych zasad amoniowych polega na adsorpcji na
powierzchni komórki. Zależnie od stężenia związku proces destrukcji obejmuje kolejno ścianę
komórkową i błonę cytoplazmatyczną, prowadząc do wypływu do środowiska składników
cytoplazmy. Szczególnie dotyczy to utraty pewnych jonów. Następuje denaturacja białek przez
depolimeryzację, inaktywacja enzymów oddechowych i glikoliza. Na poziomie błony następuje
denaturacja oksydazy cytochromowej, katalazy i fosforylazy, a na poziomie rybosomów
denaturacja kwasów nukleinowych. Związki powierzchniowo czynne działają podobnie również na
wirusy (Myxovirus),
powodując denaturację białek i kwasów nukleinowych.
Podobnie jak w przypadku chlorheksydyny, działanie czwartorzędowych zasad amoniowych
ma charakter bakteriostatyczny.
Słabe działanie bakteriobójcze jest czasem obserwowane, ale w
sytuacjach szczególnych, przy pH alkalicznym w 37°C i w odniesieniu do drobnoustrojów nie
chronionych przez obecną w środowisku materię organiczną.
Aktywność przeciwbakteryjna związków tej grupy charakteryzuje się szerokim spektrum.
Działają głównie na formy wegetatywne. Czwartorzędowe związki amoniowe są jednak bardziej
aktywne w stosunku do bakterii Gram-
dodatnich niż Gram-ujemnych. Szczególnie małą
wrażliwość przejawia Pseudomonas aeruginosa i Serratia. Zaobserwowano, że te dwa
drobnoustroje mogą nawet rozwijać się w rozcieńczonych, wodnych roztworach
czwartorzędowych zasad amoniowych. Z tych powodów w środowiskach, w których występuje
Pseudomonas aeruginosa,
nie zaleca się ich stosowania. Związki tej grupy działają bójczo w
stosunku do wirusów lipofilnych (otoczkowych), zróżnicowane działanie grzybobójcze, nie działają
na prątki i wirusy hydrofilne (nieotoczkowe).
Aktywność czwartorzędowych zasad amoniowych ulega znacznemu zmniejszeniu w obecności
materii organicznej i jonów metali. Ze względu na ich charakter chemiczny tworzą niezgodności i
są inaktywowane przez związki anionowe (mydła), niejonowe, np. polisorbaty (Tween 80) i
fosfolipidy. Z tego powodu w badaniach analitycznych do ich n
eutralizacji używa się Tweenu.
Także w obecności wody surowej zawierającej jony wapnia i magnezu obserwuje się
zmniejszenie aktywności związków tej grupy. Działają słabo w środowisku silnie kwaśnym.
Ze względu na swoje właściwości oraz zakres działania czwartorzędowe zasady amoniowe
znalazły zastosowanie głównie w dezynfekcji powierzchni niekrytycznych (podłogi, meble, sciany),
sprzętu medycznego, który ma kontakt z nieuszkodzona skórą, w antyseptyce skóry, pola
operacyjnego itp. w stężeniach wodnych 2-10%. Związki te stosuje się również do konserwacji
leków (w stężeniach 0,02-1 %) do oczu i zewnętrznych.
Czwartorzędowe związki amoniowe w roztworach nie są stabilne, a ponadto są łatwo
adsorbowane przez środowisko, zwłaszcza o charakterze porowatym (np. rękawiczki z
kauczuku). Dla wzmocnienia ich działania i przedłużenia czasu wrażliwości szczepów
bakteryjnych często łączy się je z innymi składnikami antyseptyków, np. z alkoholami i

19
chlorheksydyną.
Najczęściej stosowane czwartorzędowe związki amoniowe to chlorek i bromek bezalkoniowy oraz
bromek cetrimoniowy.
Alkohole
Chemicznie w grupie tej znajdują się monoalkohole (metylowy CH
3
0H, etylowy CH
3
CH
z
OH,
propylowy CH
3
CH
z
CH
z
OH, izopropylowy CH
3
CHOHCH
3
), dialkohole i glikole. Rozróżnia się
alkohole alifatyc
zne i aromatyczne. Z punktu widzenia mikrobiologicznego ważniejsze są alkohole
alifatyczne. Aktywność przeciwbakteryjna alkoholi wzrasta wraz z długością łańcucha węglowego
i ciężarem cząsteczki. W dezynfekcji zastosowanie mają głównie alkohol etylowy i izopropylowy.
Alkohol metylowy ma słabe działanie bakteriobójcze i jest stosowany rzadko. Stosowanie
alkoholu benzylowego jest ograniczone ze względu na jego słabą rozpuszczalność w wodzie, a
glikole są szczególnie polecane jako skuteczne w stosunku do wirusów (wodny roztwór 70- 90%).
Działanie to obserwuje się zwłaszcza w stosunku do wirusów grypy i dżumy.
Mechanizm działania alkoholi polega na denaturacji białek bakteryjnych i jest uwarunkowany
obecnością wody. Dlatego alkohol absolutny jest mniej aktywny niż rozcieńczony wodą.
Największą aktywność obserwuje się przy stężeniu 70- 80%. W stężeniach około 20% alkohole
mogą działać słabo bakteriostatycznie, odwracalnie. Mechanizm działania bakteriostatycznego
alkoholi polega na hamowaniu syntezy pewnych metab
olitów niezbędnych do podziału komórki.
Sądzi się również, że działanie na komórkę dotyczy inaktywacji enzymów odpowiedzialnych za
wytwarzanie przetrwalników, nie jest to jednak działanie sporobójcze. W pewnych warunkach
alkohole mogą powodować lizę komórki (np. u mikoplazmy).
Spektrum aktywności alkoholi jest szerokie. Działą bójczo zarówno na bakterie Gram-dodatnie,
jak i Gram-
ujemne, na mykobakterie, grzyby i wirusy ale nie działają na przetrwalniki..
Uważa się, że najbardziej skuteczne stężenie alkoholu etylowego to 70%. Dodatek wody
ułatwia penetrację alkoholu do komórki i powoduje łatwiejszą jej inaktywację. Alkohol etylowy
działa wirusobójczo wobec wirusów lipofilnych (HSV, wirus grypy) i większości wirusów
hydrofilnych (np. adenowirusy, enterowirusy, rinowirusy czy rotawirusy) ale nie na HAV czy wirusy
polio.
Choć alkohol izopropylowy w stężeniu 30- 80% wywiera silniejsze działanie niż etanol na S.
aureus i E. coli
to jednak jego działanie wobec niektórych wirusów jest słabsze niż alkoholu
etylowego.
Alkohol etylowy jest lotny i łatwo paruje z miejsc stosowania. Z tych powodów działanie jego
jest krótkotrwałe. Znalazł on zastosowanie głównie w antyseptyce skóry, jest dobrze tolerowany w
stężeniu 70%. Alkohol etylowy nie powinien być stosowany na błony śluzowe, rany i oparzenia.
Działanie toksyczne 7,5 raza większe jest obserwowane w odniesieniu do alkoholu absolutnego,
zwłaszcza w stosunku do S. aureus. Poza skutecznym działaniem na żywe powierzchnie (skóra)
zaleca się jego używanie do dezynfekcji niektórych powierzchni martwych, np. do drobnego
sprzętu medycznego (termometry, stetoskopy, telefony), zewnętrznej powierzchni aparatury
medycznej. W praktyce można go używać w połączeniu z jodem lub pochodnymi rtęci.
Alkohole nie są zalecane do sterylizacji ze względu na brak działania sporobójczego i braku
zdolności penetracji białek.
W małych stężeniach (10-20%) może służyć jako rozpuszczalnik dla niektórych antyseptyków.
Szczególnie dotyczy to chlorheksydyny, ponieważ stwierdzono synergiczne działanie
p
rzeciwbakteryjne obu tych składników.
Alkohol izopropylowy może być stosowany w tych samych sytuacjach co alkohol etylowy, w
tych samych stężeniach i również jako rozpuszczalnik dla chlorheksydyny.
Używanie innych alkoholi jest praktycznie bardzo ograniczone. Glikole jednak, a zwłaszcza

20
glikol etylenowy, mogą być stosowane w aerozolu, w atmosferze wilgoci na zanieczyszczone
powierzchnie.
Utleniacze
Do grupy utleniaczy należą związki halogenowe. Można je podzielić na 2 główne grupy:
l) zawierające chlor, brom lub fluor używane do dezynfekcji ogólnej,
2) zawierające jod, szeroko używane jako antyseptyki.
Związki halogenowe odznaczają się dużą skutecznością przeciwbakteryjną i przeciwwirusową.
Związki chloru
Aktywność związków chloru jest uzależniona od ilości chloru uwolnionego z cząsteczki w
czasie reakcji. Najszybciej działają w pH obojętnym. Obecność jonów amonowych podnosi ich
aktywność, natomiast materia organiczna bardzo osłabia działanie.
Mechanizm działania związków chloru obejmuje błonę i enzymy cytoplazmatyczne. Istota tego
mechanizmu nie jest dokładnie znana. Działanie chloru może wynikać z utleniania enzymów i
aminokwasów, wypływu zawartości komórki, zmniejszenia przyswajania składników odżywczych,
zahamowania syntezy białka i inn. Wiadomo, że związkiem czynnym jest kwas podchlorowy
niezdysocjowany (HCIO). Forma ta istnieje przede wszystkim w roztworach wodnych, a
aktywność jest największa przy pH 5. W środowisku bardziej kwaśnym chlor się ulatnia i roztwór
traci część swojej aktywności. Z tego powodu kwas podchlorowy jest używany w roztworach
obojętnych lub alkalicznych, które są bardziej trwałe.
Związki chloru używane do dezynfekcji występują w postaci soli. Najbardziej znany jest
.podchloryn sodu i wapnia (tzw. wapno chlorowane). Zawa
rtość czynnego chloru w podchlorynie
sodu wynosi 5-
14%, w podchlorynie wapna nie powinna być większa niż 16%.
Związki te maja szerokie spektrum działania, nie pozostawiają toksycznych pozostałości,
aktywność ich nie zmniejsza się w wodzie twardej, maja szybkie działanie, usuwają biofilm z
dezynfekowanej powierzchni, toksyczność ich jest niewielka. Stężone roztwory mogą jednak
powodować podrażnienie oczu, gardła, korozje metalu, wybielanie dezynfekowanych
przedmiotów
Innymi związkami uwalniającymi chlor, które znalazły zastosowanie w dezynfekcji są
chloramina i dwuchloroizocyjanomoczan sodu. Zawartość czynnego chloru w chloraminie
powinna wynosić około 20%. Do szybkiej dezynfekcji i stosuje się chloraminę aktywowaną
azotanem, siarczanem albo chlorkiem amonu. Dodanie aktywato
ra powoduje gwałtowne
wydzielanie wolnego chloru, co znacznie zwiększa aktywność roztworu. Chloraminę aktywowaną
stosuje się w stężeniu 0,1- 0,25%. Roztwory te są nietrwałe i powinny być zużyte w czasie 30
minut od chwili przygotowania.
Halogenów jako związków bardzo aktywnych nie należy mieszać z innymi produktami
organicznymi lub mineralnymi. Mogą bowiem reagować z tymi substancjami, przez co zmniejsza
się w nich zawartość aktywnego chloru, a tym samym aktywność przeciwdrobnoustrojowa.
Ponadto podchlorynu sodu nie wolno mieszać z kwasami ani kwaśnymi płynami ustrojowymi
ponieważ wytwarza się toksyczny chlor gazowy.
Zakres działania związków chloru na drobnoustroje jest bardzo szeroki. Wywierają one efekt
letalny zarówno na bakterie i ich przetrwalniki, jak i grzyby i wirusy. Działanie bakteriobójcze jest
bardzo szybkie, około 1 minuty. Jednak mykobakterie, a szczególnie Mycobacterium tuberculosis,
są bardziej oporne i zabijane są w tym samym czasie przez stężenie związków co najmniej 10-
krotnie większe. Ta mniejsza aktywność związków chloru dotyczy również ich działania na
przetrwalniki. Działanie na wirusy zazwyczaj obserwuje się po kilku minutach kontaktu.
Podwyższona temperatura zwiększa jednak wrażliwość wirusów. Najbardziej oporne na działanie

21
związków chloru są grzyby.
Związki chloru stosowane w ogólnej, tzw. grubej dezynfekcji są to, oprócz fenoli,
najdawniejsze znane środki dezynfekcyjne, używane do odkażania wody, ścieków itp.
W placówkach służby zdrowia używane sa do dezynfekcji podług, sprzętów, urządzeń
sanitarnych, powierzchni zanieczyszczonych krwią lub płynami ustrojowymi. Są również
stosowane do dezynfekcji bielizny szpitalnej i odpadów medycznych.
Stosowanie ich ogranicza w dużym stopniu działanie toksyczne i drażniące. Działanie
toksyczne zmniejsza się w miarę zwiększania się ciężaru cząsteczki halogenu. I tak fluor jest
najbardziej toksyczny i stosowanie związków fluoru jest najbardziej ograniczone. Chlor i brom są
mniej toksyczne i w pewnych warunkach mogą być tolerowane przez tkanki. Związki chloru są
drażniące w dużych stężeniach. Wrażliwe błony śluzowe, np. błona śluzowa oka, znoszą bez
uszkodzenia 0,1mg/l chloru w roztworach. Działania drażniące obserwowane są dużo szybciej w
przypadku kontaktu tych związków z powierzchniami żywymi, uszkodzonymi. Związki chloru
generalnie nie są stabilne. Ulegają one w roztworach hydrolizie z powstaniem kwasu
podchlorowego (HCIO). Kwas podchlorowy ma również tendencję do dysocjacji z uwolnieniem o
wiele mniej aktywnego jonu podchlorowego (CIO).
Stabilność związków chloru zależy od pH roztworów. Nie powinno ono być mniejsze niż 5.
Dużą rolę ponadto odgrywa temperatura. Stabilność związków chloru zmniejsza się, gdy
temperatura wzrasta. Jednak pochodne chloru są bardziej aktywne w 37°C niż 22°C. Aktywność
związków chloru zmniejsza się w obecności materii organicznej; w roztworach wody zawierającej
miedź, kobalt lub nikiel pochodne chloru mogą dysocjować do kwasu podchlorowego. Konieczna
jest również ochrona związków chloru przed światłem i promieniowaniem nadfioletowym.
Związki jodu
Drugą grupą najczęściej używanych w odkażaniu utleniaczy halogenowych są związki jodu.
Występują one jako środki zawierające jod w roztworze oraz jako jodofory. Roztwory jodu
sporządzane są w wodzie (np. l % płyn Lugola) i alkoholu (2% jodu w 70° etanolu).
Jodofory są kompleksami jodu z niejonowym detergentem jako rozpuszczalnikiem, z którego jod
uwalnia się powoli poprzez proste rozpuszczanie w wodzie. Stężenie jodu w preparatach
jodoforowych wynosi 0,5-2,0%.
Związkiem wiążącym jod w jodoforze jest zwykle
poliwinylopirolidon lub polividon.
Wolny jod zawarty w tych preparatach penetruje ścianę komórkową drobnoustrojów, zaburza
strukturę i syntezę białek i kwasów nukleinowych.
Związki halogenowe są silnie bakteriobójcze nawet w niedużych stężeniach. Stężenia
bakteriostatyczne i bakteriobójcze są bardzo zbliżone. Drobnoustroje są niszczone przez
oksydację i szybką destrukcję białek enzymatycznych i strukturalnych. Działanie bakteriobójcze
obserwuje si
ę w czasie od kilku sekund do kilku minut. Skuteczność działania jest uzależniona od
ilości wolnego jodu.
Spektrum działania związków jodu, podobnie jak chloru, jest bardzo szerokie i obejmuje
bakterie i ich przetrwalniki. Bakteriobójczość dla bakterii obserwuje się przy stężeniu jodu 0,1%,
dla przetrwalników jest ono 10 razy wyższe. Jod wykazuje również działanie przeciwwirusowe
(np. wirusy grypy, wirus polio) oraz przeciwgrzybicze.
Charakterystyczna w działaniu jodu na tkankę żywą jest zdolność jego penetracji. Obserwuje
się to zjawisko w przypadku działania na rany, oparzenia. Błona śluzowa żołądka jest
przepuszczalna dla jodu i po absorpcji można jod znaleźć w surowicy. Występuje on w postaci
wolnej lub związany z albuminą. Eliminacja jodu jest wolna i odbywa się przez nerki.
Podobnie jak chlor, związki jodu wykazują wiele działań ubocznych. Powodują drażnienie
skóry, szczególnie w roztworach alkoholowych, ale działanie to jest mniejsze niż powodowane
przez związki chloru. Podobnie toksyczne działanie jest mniej sze niż chloru, choć wyraźne jest
22
jego działanie cytotoksyczne. Preparaty jodu mogą również wywoływać uczulenie.
Roztwory wodne i alkoholowe jodu są lotne, ale wykazują wystarczającą stabilność. Jodofory
wykazują mniejszą stabilność w pH alkalicznym. Materia organiczna bardzo zmniejsza
skuteczność działania przeciwbakteryjnego wolnego jodu. W tej sytuacji część jodu ulega
adsorpcji, a część przekształca się w jod nieaktywny. Warto pamiętać o istnieniu niezgodności
jodu z rtęcią. Wodne i alkoholowe roztwory jodu oraz jodofory znalazły zastosowanie głównie w
antyseptyce. Używany jest w stężeniu 1-2% do odkażania rąk, pola operacyjnego, przed
iniekcjami, przy pobieraniu krwi itp. Jodofory stosuje się także do dezynfekcji sprzętu
medycznego, tak
iego jak sprzęt do hydroterapii, termometry, endoskopy itp.
Oktenidyna
Oktenidyna jest pochodną bipirydynową – jest zbudowana z dwóch zmodyfikowanych
pierścieni pirydynowych.
Spektrum jej działania obejmuje: bakterie, prątki gruźlicy, grzyby, wirusy oraz niektóre
pierwotniaki.
Mechanizm działania polega na elektrostatycznym łączeniu z błonami cytoplazmatycznymi
drobnoustrojów i ich rozerwaniu poprzez obniżenie napięcia powierzchniowego. Substancja ta
oddziałuje także z kwasami nukleinowymi.
Oktenidyna
jest składnikiem płynów do płukania ust, wchodzi też w skład roztworów
antyseptycznych.
Metale ciężkie
Pomimo iż wiązki rtęci (np. tlenek rtęci, aminochlorek rtęci) wykazują działanie
bakteriostatyczne, bakteriobójcze i grzybobójcze, to ze względu na dużą toksyczność nie są
obecnie stosowane.
Z pochodnych srebra zastosowanie znalazł, np. azotan srebra – związek łatwo rozpuszczalny
w wodzie i etanolu. Działa bakteriostatycznie i bakteriobójczo. Stosowany jest do dezynfekcji
skóry, błon śluzowych, a w wyższych stężeniach do przyżegań.
Preparaty zawierające srebro koloidowe (jony srebra związane są przez hydrofilowe produkty
rozpadu białek) wykazują działanie bakteriostatyczne, rzadko bakteriobójcze.
Mechanizm działania związków zawierających metale ciężkie polega na blokowaniu grup
tiolowych (-
SH) enzymów, a w konsekwencji do zahamowania wzrostu i śmierci.
W ostatnim metale, a zwłaszcza srebro stosuje się w postaci nanocząsteczek, np. jako powłoki
bakteriostatyczne
Pochodne amin i aminokwasów
Pochodne
amin i aminokwasów to związki zawierające w swojej strukturze atom azotu.
Do tej grupy zalicza się pochodna otrzymywana z kwasu L-glutaminowego oraz alkilu
kokosopropylenodiaminy znana pod nazwą Glukoproteina . Spektrum działania Glukoproteiny
obejmuje
bakterie, wirusy, grzyby oraz prątki. Stosowanie Glukoproteiny może być
problematyczne
ze
względu
na
dużą
toksyczność
oraz
działanie
drażniące
kokosopropylenodiaminy.
Mechanizm działania Glukoproteiny polega na elektrostatycznym łączeniu z błonami
cyto
plazmatycznymi drobnoustrojów oraz obniżaniu napięcia powierzchniowego.

23
3.2. Metody oceny działania środków dezynfekcyjnych i antyseptycznych
Skuteczność
środków dezynfekcyjnych ocenia się mikrobiologicznymi metodami
laboratoryjnymi in vitro. Dodatkowo
w badaniach antyseptyków stosuje się metody in vivo.
Badania in vitro
wykonywane są na wzorcowych szczepach drobnoustrojów o znanej
wrażliwości na związki przeciwdrobnoustrojowe. Są to przedstawiciele bakterii Gram-dodatnich
(np. S. aureus), Gram-ujemnych
(np. E. coli, Ps. aeruginosa), grzybów (np. Candida albicans). W
zależności od specyfiki zastosowania preparatu lista szczepów może być rozszerzona o
przedstawicieli innych gatunków (np. Mycobacterium). Poza tym określa się działanie sporobójcze
(np. prze
trwalniki B. subtilis), wirusobójcze.
Badania in vitro
mają na celu ustalenie efektywnych stężeń lub oczekiwanego stopnia
redukcji
liczby drobnoustrojów w określonym czasie kontaktu preparatu z drobnoustrojem.
W niektórych, uzasadnionych przypadkach wykonuje się również badanie łatwości wytwarzania
form opornych (czwartorzędowe związki amoniowe) oraz trwałości środków odkażających.
Ogólne zasady i metody oceny środków odkażających są regulowane zarówno przepisami w
poszczególnych krajach, jak i w instytucjach międzynarodowych np. w obrębie Unii Europejskiej.
W Polsce wprowadzane są od kilku lat normy Europejskiego Komitetu Normalizacji – CEN
(normy obowiązujące w krajach Unii Europejskiej).
Ocenę preparatów dezynfekcyjnych według norm Europejskiego Komitetu Normalizacji
przeprowadza się w kilku fazach:
faza 1 -
testy zawiesinowe dotyczące podstawowej aktywności
faza 2 etap 2
– testy zawiesinowe przeprowadzane w warunkach odpowiadających ich
praktycznemu stosowaniu np. ocena aktywności przeciwprątkowej
faza 2 etap 2
– inne testy laboratoryjne np. badanie działanie antyseptyków na drobnoustroje
sztucznie naniesione na opuszki palców
faza 3
– testy przeprowadzane w warunkach praktycznych
Wg powyższych norm preparaty dezynfekcyjne ocenia się na podstawie wielkości
wyznaczonego w badaniach współczynnika redukcji liczby komórek drobnoustrojów.
Oceniany w fazie 1 związek odkażający powinien spowodować, w warunkach
przeprowadzonego doświadczenia, redukcję inoculum bakteryjnego w 99,999%, co równa się
redukcji log 5 (np. przy inoculum 10
7
/ml liczba komórek bakteryjnych powinna obniżyć się co
najmniej do 10
2
/ml)
4. Antyseptyka skóry rąk
Zwykłe mycie rąk (socjalne) to zabieg polegający głównie na zmyciu z powierzchni skóry rąk
zanieczyszczeń organicznych i brudu oraz na częściowej eliminacji ze skóry rąk flory przejściowej
i stałej.
W celu przeprowadzenia higienicznego mycia rąk, nanosi się na dłonie odpowiednią ilość
mydła. Czas mycia powinien wynosić nie mniej niż 30 sek. Po dokładnym umyciu ręce spłukuje
się i osusza jednorazowym ręcznikiem. Przy myciu można stosować rutynową technikę mycia rąk
wg Ayliffe
Kiedy należy myć ręce?
przed rozpoczęciem dnia pracy i po dłuższych przerwach w pracy
po wyjściu z toalety
po wykonanych pracach porządkowych i czystościowych.
N
ajczęściej popełniane błędy podczas mycia rąk:
zbyt krótki czas mycia
niedokładne mycie rąk
pozostawienie na dłoniach biżuterii czy zegarka

24
używanie "wspólnego" mydła w kostce lub mydła w płynie zanieczyszczonego
mikrobiologicznie
wytarcie rąk po umyciu ręcznikiem wspólnego i wielokrotnego użycia
używanie zbyt gorącej wody, zbyt częste mycie rąk, zaraz po przeprowadzonej dezynfekcji
rąk preparatem alkoholowym (takie postępowanie obniża poziom wrażliwości skóry na
środki myjące i powoduje jej wysuszanie i uszkodzenia).
Dezynfekcja higieniczna
składa się z mycia zwykłego (etap I - brudny) i dezynfekcji (etap II -
czysty)
Dezynfekcję higieniczną przeprowadza się stosując antyseptyk na czystą, pozbawioną
zanieczyszczeń organicznych i brudu skórę rąk (aktywność alkoholowych preparatów spada
znacznie w obecności obciążenia organicznego, podobny wpływ mogą mieć niektóre kremy
pielęgnacyjne i zanieczyszczenia innego pochodzenia niż organiczne). Skóra rąk po umyciu musi
być dokładnie osuszona jednorazowym ręcznikiem (preparat antyseptyczny naniesiony na mokrą
skórę ulega rozcieńczeniu i nie wykazuje dostatecznej aktywności biobójczej). Dokładną
dezynfekcję całej powierzchni dłoni zapewnia stosowanie techniki rąk wg. Ayliffe. Przed
przystąpieniem do dezynfekcji i mycia rąk należy zdjąć biżuterię i zegarek.
W celu przeprowadzenia higienicznej dezynfekcji rąk należy nanieść 3ml alkoholowego
preparatu antyseptycznego i dokładnie wcierać go w skórę aż do momentu całkowitego
wyschnięcia, tj. 30-60 sek. Kiedy należy przeprowadzać dezynfekcje rąk ?
przed i po każdym zabiegu leczniczym, badaniu, pielęgnacji
po zdjęciu rękawic ochronnych
po każdym kontakcie z pacjentem, z zanieczyszczonymi przedmiotami, z materiałem
zakaźnym, wydalinami, wydzielinami i płynami ustrojowymi
Najczęściej popełniane błędy podczas dezynfekcji rąk to :
zbyt krótko przeprowadzany zabieg dezynfekcji
stosowanie zbyt małej objętości preparatu
niedokładne przeprowadzenie dezynfekcji
pozostawienie na rękach biżuterii i zegarka
stosowanie alkoholowych pr
eparatów dezynfekcyjnych na mokrą skórę i/lub znacznie
obciążoną tkanką organiczną i innymi zanieczyszczeniami
Celem dezynfekcja chirurgicznej
rąk jest jak najdalej idąca eliminacja drobnoustrojów flory
przejściowej i stałej.
Etap I - chirurgiczne mycie r
ąk
Przed myciem rąk należy zdjąć biżuterię i zegarek. Wstępnie umyć ręce (mycie zwykłe).
Następnie przeprowadzić mycie chirurgiczne. Do mycia należy używać bieżącej ciepłej wody i
mydeł w płynie dozowanych ze specjalnych dozowników ściennych wyposażonych w dźwignię do
dozowania mydła za pomocą łokcia lub pedału nożnego. Dokładne umycie całej powierzchni rąk
zapewnia stosowanie techniki mycia np. wg Ayliffe
W celu przeprowadzenia chirurgicznego mycia rąk nanosi się na dłonie odpowiednią ilość
mydła. Czas mycia powinien wynosić ok. 2-5 min. Bardzo dokładnemu myciu poddaje się dłonie i
przedramię. Po umyciu ręce dokładnie spłukuje się wodą i osusza jałowym ręcznikiem.
Etap II - dezynfekcja chirurgiczna
Dezynfekcję chirurgiczną przeprowadza się po uprzednim dokładnym chirurgicznym umyciu
rąk. Ręce muszą być dokładnie wytarte suchym, jałowym ręcznikiem.
Na ręce nanosi się przeważnie 5ml środka antyseptycznego i dokładnie wciera preparat w
skórę rąk i przedramienia, aż do momentu całkowitego wyschnięcia preparatu, tj. ok. 2,5 minuty.
Czynność należy powtórzyć dwukrotnie zwracając szczególną uwagę na czubki palców i obrąbek
naskórkowy paznokcia.
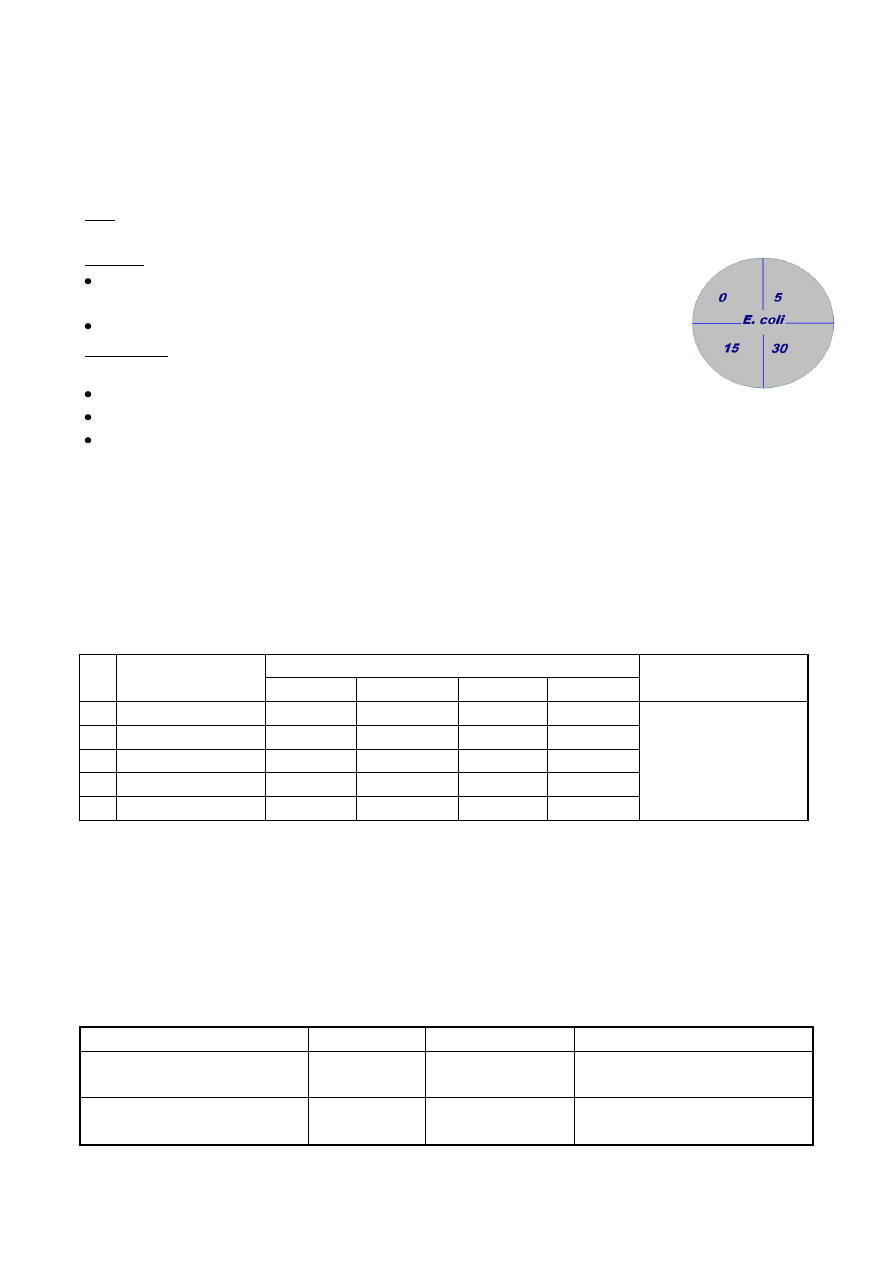
25
II. Część praktyczna
I. Wrażliwość drobnoustrojów na czynniki fizyczne - porównanie wpływu temperatury 100
o
C
i czasu ogrzewania na różne gatunki drobnoustrojów
Cel:
Określenie wrażliwości form wegetatywnych i przetrwalnych drobnoustrojów na działanie
temperatury 100
o
C w różnym czasie.
Materiał
24-godzinne hodowle bulionowe: E. coli, S. aureus, Enterococcus faecalis;
7-dniowa hodowla B. subtilis
, zawiesina zarodników Aspergillus niger
płytki Petriego z podłożem agarowym
Wykonanie
1. Opisz płytki z podłożem w następujący sposób (patrz rysunek):
na denku napisz nazwę otrzymanego drobnoustroju
podziel dermatograf
em powierzchnię płytki (denko) na 4 sektory
sektory oznacz je cyframi 0, 5, 15, 30 odpowiadającymi minutom ogrzewania
2. Otrzymany drobnoustrój posiej ezą na sektor oznaczony cyfrą 0.
3. Zanotuj czas i umieść probówkę z hodowlą we wrzącej łaźni wodnej.
4.
Po 5, 15 i 30 minutach ogrzewania wysiej ezą hodowlę (zawiesinę) na odpowiednie sektory.
5. Umieść płytkę z posiewem w cieplarce o temp. 37
o
C na 24 h.
6. Po inkubacji odczytaj wyniki i zapisz w tabelce przyjmując następujące oznaczenia:
(+++) - wzrost obfity ; (++) - pojedyncze kolonie; (+) - kilka kolonii; (-) - brak wzrostu
i wyciągnij wnioski dotyczące wpływu czasu ogrzewania i rodzaju drobnoustrojów na ich
przeżywalność w temperaturze 100
o
C.
Lp
Drobnoustrój
Czas ogrzewania w temp. 100
o
C w min
Interpretacja
0
5
15
30
wyników
1.
E. coli
2.
S. aureus
3.
E. faecalis
4.
B. subtilis
5.
A. niger
II. Wyjaławianie w gorącej nasyconej parze wodnej pod ciśnieniem – omówienie zasady
działania sterylizatorów; przeprowadzenie procesu
III. Kontrola aparatów do sterylizacji termicznej
Wpisz wyniki testów chemicznych i biologicznych kontroli sterylizacji gorącą nasyconą parą
wodną pod ciśnieniem
Test
Kontrola
Wynik testu
Interpretacja
Zintegrowany test paskowy
1
Stericon plus Bioindicator
2
1
– wpisz barwę pola wskaźnikowego
2
– (+) – wzrost drobnoustrojów; (-) – brak wzrostu drobnoustrojów
26
IV. Ocena aktywności bakteriobójczej preparatów dezynfekcyjnych metodą zawiesinową
Określanie najmniejszego stężenia bakteriobójczego (MBC)
Zasada metody:
określenie najniższego stężenia preparatu działającego bakteriobójczo w
środowisku wodnym na zawiesinę drobnoustrojów testowych
W badaniu używa się standardowe szczepy wzorcowe drobnoustrojów z kolekcji
międzynarodowych
Wykonanie badania
W kolbach miarowych przygotować wyjściowe roztwory badanego preparatu oraz preparatu
wzorcowego.
Z roztworu wyjściowego przygotować serię roztworów do badań w kolbach lub bezpośrednio w
probówkach (śred. 35 mm, wys. 100 mm). Każda probówka powinna zawierać 5 ml roztworu,
wszystkie probówki z roztworami oraz bulionową hodowlą drobnoustrojów testowych umieścić w
łaźni wodnej w temp. 20oC. Po upływie 15 min do każdego roztworu dodawać po 0,5 ml
zawiesiny drobnoustrojów, uważając, aby nie dotknąć powierzchni roztworu i nie nanieść
zawiesiny na ścianę probówki (nie dotknąć pipetą i nie rozpryskać zawiesiny). Następnie
zawartość probówek wymieszać, obracając probówkę ruchem wirowym i ponownie umieścić w
łaźni wodnej.
Zawiesinę należy dodawać do kolejnych roztworów (zaczynając od najwyższego stężenia) w
takich odstępach czasu (np. 30 sek.), aby następnie mieć możność wykonania posiewów do
podłoża płynnego z każdego rozcieńczenia dokładnie po 5, 10 i 15 min ekspozycji.
Przed każdym posiewem zawartość probówki wymieszać obracając ją ruchem wirowym. Posiewy
wykonać ezą do bulionu (lub bulionu z inaktywatowem) znajdującego się w probówkach.
Inkubować w temperaturze 37oC. Wyniki odczytać po 48 godzinach.
Wstępne badania wykonywać w szerokim zakresie stężeń, następnie przeprowadzać oznaczenia
w wąskich zakresach stężeń w granicach określonych w badaniu wstępnym.
Interpretacja wyników
Na podstawie uzyskanych wyników wyznacza się wartość stężenia, które zabija drobnoustroje po
czasie 5 minut (MBC
5
), 10 minut (MBC
10
) oraz po czasie 15 minut (MBC
15
) działania preparatu.
Odczytaj wartości MBC
5
, MBC
10
i MBC
15
dla ocenianego preparatu.
preparat badany:
Szczep testowy: E. coli NCTC 8196
Stężenia preparatu
Wzrost drobnoustroju po czasie działania: (min)
w %
5
10
15
MBC
Wpisz „+” - wzrost, „-” - brak wzrostu

27
V. Antyseptyka skóry rąk
Cel:
Ocena skuteczności mycia i dezynfekcji rąk
Materiały
mydło w płynie
preparat antyseptyczny na bazie alkoholu
płytki Petriego z podłożem agarowym
Wykonanie
Osoba I
opisz płytki z podłożem
wykonaj odcisk prawej dłoni na podłożu agarowym
umyj ręce mydłem z zachowaniem właściwej techniki mycia
wykonaj odcisk lewej dłoni na podłożu agarowym
Osoba II
opisz płytki z podłożem
wykonaj odc
isk prawej dłoni na podłożu agarowym
umyj ręce mydłem z zachowaniem właściwej techniki mycia
zdezynfekuj ręce preparatem antyseptycznym z zachowaniem właściwej techniki
dezynfekcji
wykonaj odcisk lewej dłoni na podłożu agarowym
Zlicz wyrosłe kolonie, oceń morfologię kolonii. Zapisz uzyskane wyniki.
Oceniany
parametr
Osoba I
Osoba II
Interpretacja
Przed
myciem
Po myciu
Przed
myciem
Po myciu i
dezynfekcji
Liczba
kolonii
Morfologia
kolonii

28
Wyszukiwarka
Podobne podstrony:
dezynfekcja i sterylizacja id 1 Nieznany
dezynfekcja i sterylizacja id 1 Nieznany
cwiczenie9 id 125928 Nieznany
cwiczenia23 id 124959 Nieznany
cwiczenia 4 2 id 124428 Nieznany
Fizjologia Cwiczenia 3 id 17436 Nieznany
cwiczenie 4 2 id 125411 Nieznany
cwiczenie 9 id 125104 Nieznany
Cwiczenia w szkicowaniu czesc4 Nieznany
Cwiczenia 5 id 124444 Nieznany
opis cwiczenia id 336864 Nieznany
cwiczenie 5 id 101060 Nieznany
Cwiczenie 3 id 125305 Nieznany
CWICZENIE 6 2 id 99618 Nieznany
cwiczenie 5 id 125447 Nieznany
Cwiczenie 6 id 125101 Nieznany
Pascal Cwiczenia praktyczne id Nieznany
cwiczenia2 4 id 124943 Nieznany
cwiczenie 2 id 125220 Nieznany
więcej podobnych podstron