
2011-10-04
1
PODSTAWY CHEMII
INŻYNIERIA BIOMEDYCZNA
Wykład 1
2011-10-04
Inżynieria Biomedyczna, I rok
2
PODSTAWY CHEMII
Wykładowca
Prof. dr hab. inż. Marta Radecka,
A-0, III p. 304, tel (12) (617) 25-26
e-mail:
radecka@agh.edu.pl
Strona www:
http://galaxy.uci.agh.edu.pl/~radecka/
http://www.agh.edu.pl/
Pracownicy
Strony domowe pracowników
Marta Radecka

2011-10-04
2
2011-10-04
Inżynieria Biomedyczna, I rok
3
PODSTAWY CHEMII
Do czego służą wykłady i jak się zdaje egzamin?
Program wykładów i laboratorium odpowiada dokładnie
„zawartości” egzaminu
Egzamin pisemny
żeby do niego przystąpić, trzeba zaliczyć laboratorium
każdy ma prawo zdawać egzamin trzykrotnie
Student ma prawo
do trzykrotnego przystąpienia
do egzaminu w zaplanowanych terminach, w tym
jeden
raz w terminie
podstawowym
i
dwa razy w terminie poprawkowym
.
Nieusprawiedliwiona nieobecność
na
egzaminie w danym terminie
powoduje utratę tego terminu
.
Student, który nie uzyskał zaliczenia w terminie podstawowym ma prawo po jego uzyskaniu przystąpić do
egzaminu w terminach poprawkowych.
Jeżeli student nie uzyskał zaliczenia do czasu terminów
poprawkowych egzaminu, brak zaliczenia nie usprawiedliwia nieobecności na egzaminie i skutkuje
utratą wszystkich terminów egzaminów, które odbyły się przed uzyskaniem zaliczenia
. Jeżeli z
przyczyn losowych student nie wykorzystał przysługujących mu terminów, Dziekan w porozumieniu z
prowadzącym przedmiot, wyznacza dodatkowe terminy egzaminów.
Regulamin studiów akademii Górniczo-Hutniczej Im. Stanisława Staszica (obowiązujący od 1
października 2009 r.)
Zaliczenie przedmiotu
Skala ocen
Przy zaliczeniach zajęć i egzaminach oraz
wystawianiu oceny końcowej stosuje się i wpisuje do
indeksu następujące oceny:
a) 91 – 100% bardzo dobry (5.0);
b) 81 – 90% plus dobry (4.5);
c) 71 – 80% dobry (4.0);
d) 61 – 70% plus dostateczny (3.5);
e) 50 – 60% dostateczny (3.0);
f)
poniżej 50% niedostateczny (2.0)
.
Ocena końcowa
0.6 oceny egzaminu
+
0.4 oceny laboratorium
2011-10-04
Inżynieria Biomedyczna, I rok
4

2011-10-04
3
2011-10-04
Inżynieria Biomedyczna, I rok
5
Najważniejsze podręczniki
*
A.Bielański -
Chemia ogólna i nieorganiczna
*
A.Bielański -
Podstawy chemii nieorganicznej
*
F.A.Cotton, G. Wilkinson, P.L.Gaus -
Chemia
nieorganiczna. Podstawy.
*
J.D.Lee -
Zwięzła chemia nieorganiczna
*
P.A. Cox –
Chemia nieorganiczna. Krótkie wykłady
*
dla bardziej ambitnych:
*
R.G.Wells -
Strukturalna chemia nieorganiczna
*
L. Jones, P. Atkins –
Chemia ogólna
*
Wszelkie inne podręczniki mające w nazwie - chemia
ogólna lub chemia nieorganiczna
2011-10-04
Inżynieria Biomedyczna, I rok
6
Chemia jest nauką przyrodniczą
Definicja:
chemia jest nauką, która zajmuje się składem,
strukturą i właściwościami substancji oraz reakcjami,
w których jedna substancja zmienia się w inną
Zasady nowoczesnej chemii:
poszukiwanie prawidłowości w zachowaniu się różnych
substancji
poszukiwanie modeli, które tłumaczą obserwacje
modele powinny tłumaczyć zachowanie innych
substancji i jeśli to możliwe obejmować relacje
ilościowe
modele powinno dać się weryfikować doświadczalnie

2011-10-04
4
2011-10-04
Inżynieria Biomedyczna, I rok
7
Program wykładów
Równowagi w roztworach elektrolitów
Elementy termodynamiki
Elementy elektrochemii
Trochę mechaniki kwantowej (wiązania chemiczne)
Stany materii, reguła faz
Kinetyka reakcji
Związki kompleksowe
Jak zdążymy !!!
Program laboratorium
Stężenia roztworów + stechiometria
Równowaga chemiczna, Kolokwium nr 1,
Dysocjacja elektrolityczna + pH roztworu, Kolokwium nr 2
Równowagi w roztworach związków trudnorozpuszczalnych,
Kolokwium nr 3
Roztwory buforowe, hydroliza , Kolokwium nr 4
Kolokwium nr 5, elementy analizy chemicznej, pobranie
szła i przygotowanie szła
Elementy analizy jakościowej
Elementy analizy ilościowej
2011-10-04
Inżynieria Biomedyczna, I rok
8
2011-10-04
5
HARMONOGRAM ZAJĘĆ
2011-10-04
Inżynieria Biomedyczna, I rok
9
http://galaxy.uci.agh.edu.pl/~radecka/
Zajęcia nr1-6:
11.10; 18.10; 25.10; 08.11; 15.11; 22.11. 2011
Grupy 1,2,3 godzina 8.00-9.30
Grupy 4,5,6 godzina 9.45-11.15
Grupy 7,8,9 godzina 11.30-13.00
Grupy 10,11,12 godzina 13.15-14.45
Grupa 1,2,3,7,8,9
Zajęcia nr 7-10:
29.11.; 13.12.2011; 03.01.; 17.01.2012
Grupa 1,2,3 godzina 8.00-11.00
Grupa 7,8,9 godzina 11.15-14.15
Grupa 4,5,6,10,11,12
Zajęcia nr 7-10:
06.12; 20.12 2011; 10.01.;24.01 2012
Grupa 4,5,6 godzina 8.00-11.00
Grupa 10,11,12 godzina 11.15-14.15
2011-10-04
Inżynieria Biomedyczna, I rok
10
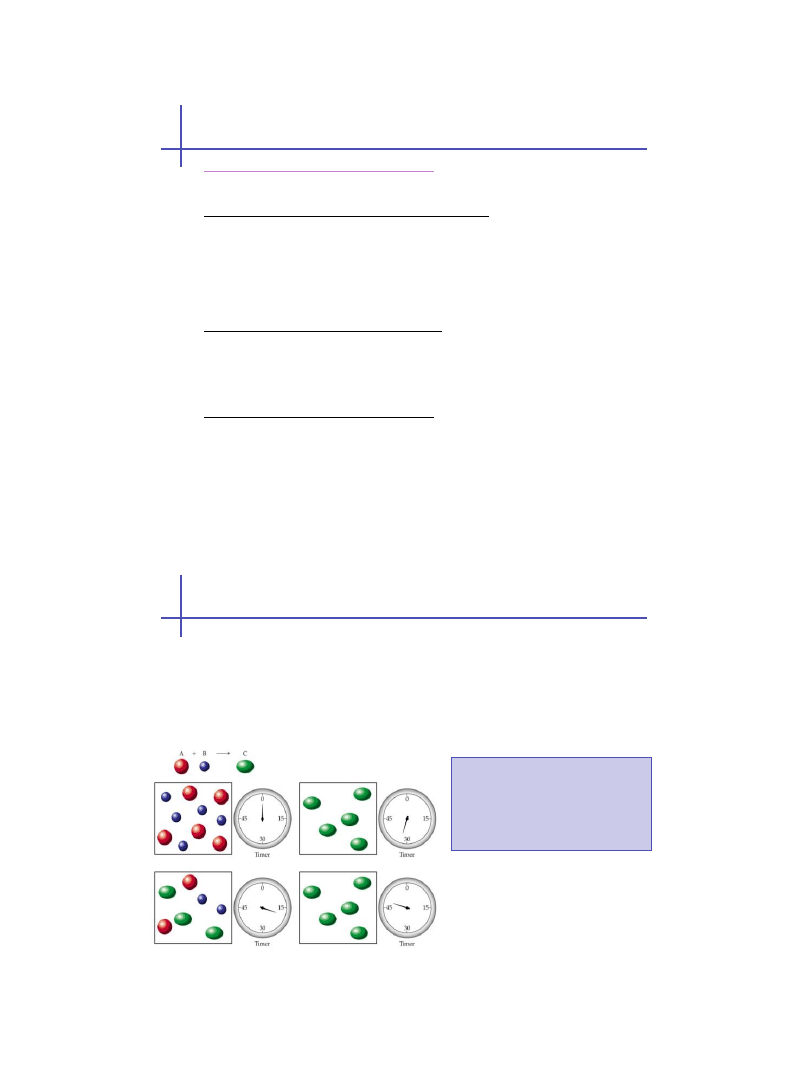
Podział reakcji
Wszystkie reakcje chemiczne można podzielić na odwracalne i
nieodwracalne:
Reakcja nieodwracalna
przebiega tylko w jednym kierunku - od
substratów do produktów (
)
Reakcja odwracalna
może przebiegać w obu kierunkach (
)
Reakcje nieodwracalne
przebiegają tak długo,
aż wyczerpie się jeden
lub kilka substratów
2011-10-04
6
2011-10-04
Inżynieria Biomedyczna, I rok
11
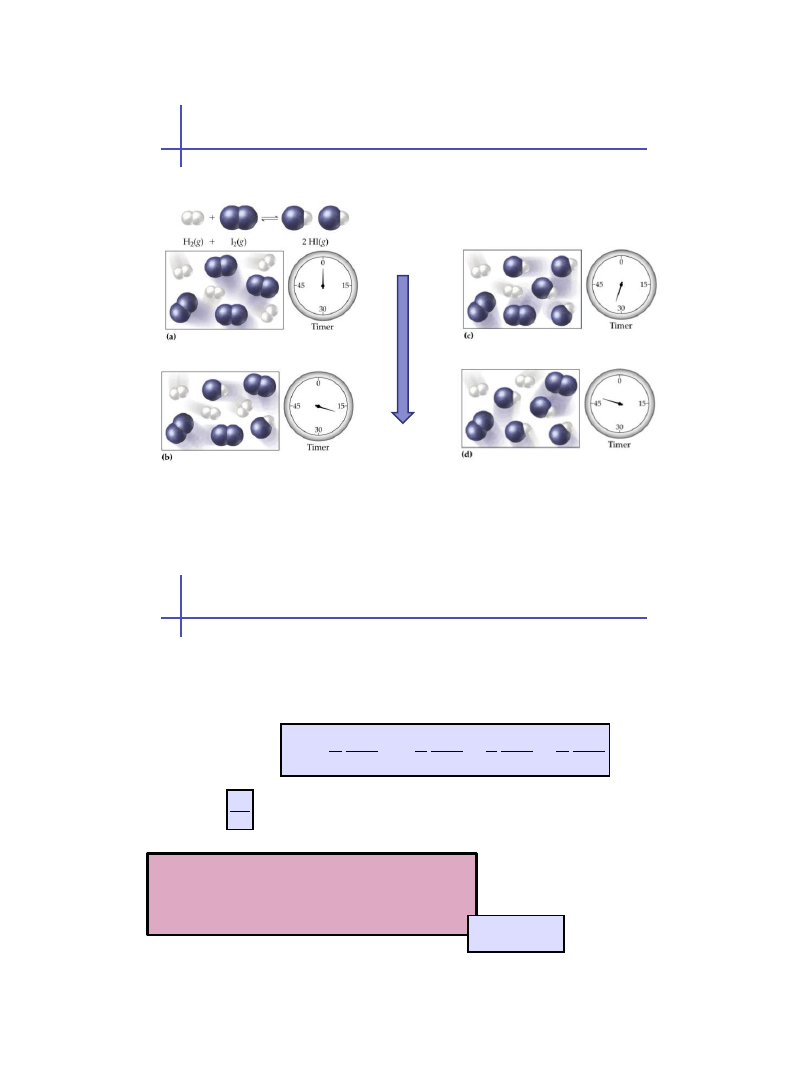
A reakcje odwracalne ?
Równowaga
Dla reakcji chemicznej opisanej równaniem:
Szybkość reakcji:
Szybkość reakcji chemicznej
2011-10-04
Inżynieria Biomedyczna, I rok
12
dD
cC
bB
aA
dt
dc
d
1
dt
dc
c
1
dt
dc
b
1
dt
dc
a
1
v
D
C
B
A
Szybkość reakcji często można
przedstawić za pomocą równania
(empirycznego) kinetycznego:
β
B
α
A
c
kc
v
dt
dc
i
k- stała reakcji,
,
- rząd reakcji
Gdzie
szybkość zmian stężenia reagenta i
2011-10-04
7
2011-10-04
Inżynieria Biomedyczna, I rok
13
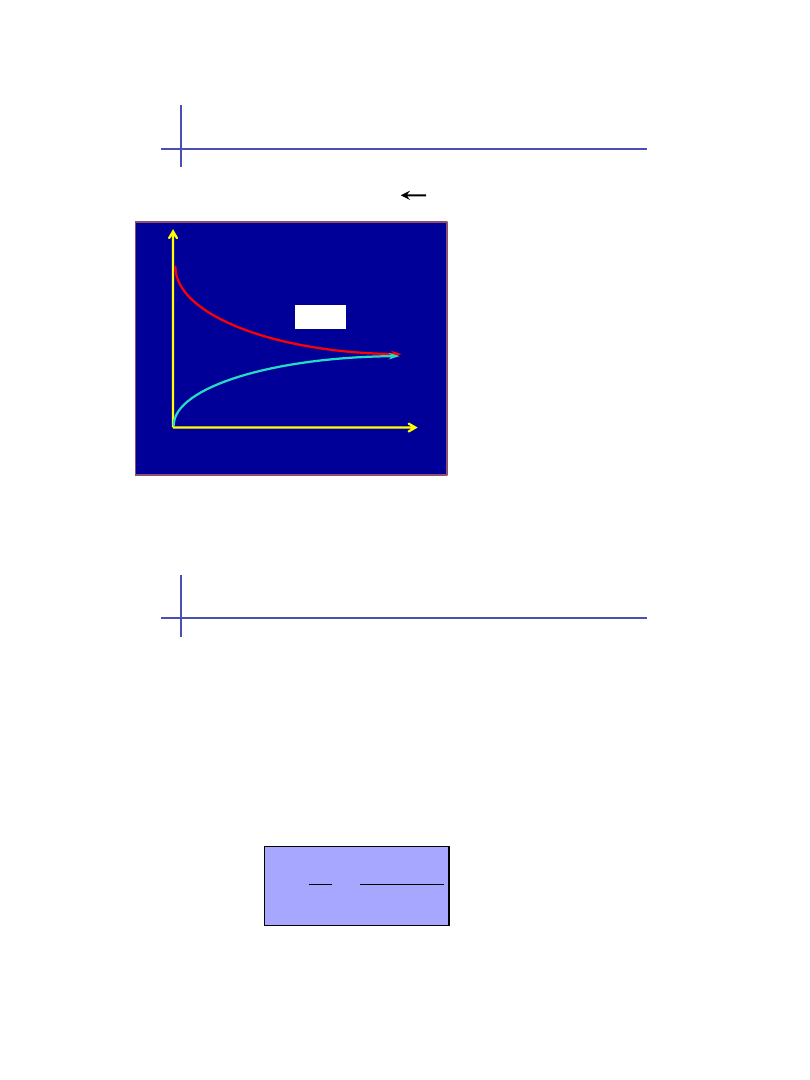
Szybkość reakcji odwracalnej
gdzie
k
1
i
k
2
- stałe
szybkości reakcji, zależne
tylko od rodzaju reakcji,
temperatury i ciśnienia
całkowitego (dla reakcji w
fazie gazowej)
dD
cC
bB
aA
2
2
β
D
α
C
2
2
c
c
k
v
1
1
β
B
α
A
1
1
c
c
k
v
CZAS
S
Z
YB
KOŚĆ
REA
KCJI
1
v
2
v
1
v
2
v
2
1
V
V
2011-10-04
Inżynieria Biomedyczna, I rok
14
Prawo równowagi
W stanie równowagi termodynamicznej ustala się stan
równowagi dynamicznej
: prędkość reakcji prostej i odwrotnej
jest taka sama
dD
cC
bB
aA
2
1
v
v
2
2
1
1
β
D(R)
α
C(R)
2
β
B(R)
α
A(R)
1
c
c
k
c
c
k
2
2
1
1
β
B(R)
α
A(R)
β
D(R)
α
C(R)
2
1
c
c
c
c
k
k
K
α
i(R)
c
Stężenie reagenta i
w stanie równowagi
2011-10-04
8
2011-10-04
Inżynieria Biomedyczna, I rok
15
Stała K, zwana stałą równowagi, zależy tylko od
temperatury
. Nie zależy od ilości (stężeń)
substratów/produktów
WAŻNE
Prawo równowagi
W stanie równowagi,
W STAŁEJ TEMPERATURZE
, dla
reakcji odwracalnej, stosunek iloczynu stężeń produktów
do
iloczynu stężeń substratów jest stały, przy czym
wszystkie stężenia są podniesione do potęg będących
współczynnikami stechiometrycznymi.
2
2
1
1
β
B(R)
α
A(R)
β
D(R)
α
B(R)
c
c
c
c
K
2011-10-04
Inżynieria Biomedyczna, I rok
16
Stała równowagi K (różny zapis)
K
a
a
a
a
b
B
a
A
d
D
c
C
dD
cC
bB
aA
p
b
B
a
A
d
D
c
C
K
p
p
p
p
to jest ogólne prawo równowagi
...(prawo działania mas, a-aktywność)
to jest prawo równowagi dla reakcji w
gazach, przy niezbyt wysokich
ciśnieniach (p
A
, p
B
, p
C
, p
D
–ciśnienia
cząstkowe poszczególnych gazów)
to jest prawo równowagi dla reakcji w
mieszaninach (roztworach), przy niezbyt
wysokich stężeniach ([A], [B], [C], [D] -
stężenia poszczególnych składników)
c
b
a
d
c
K
[B]
[A]
[D]
[C]
2011-10-04
9
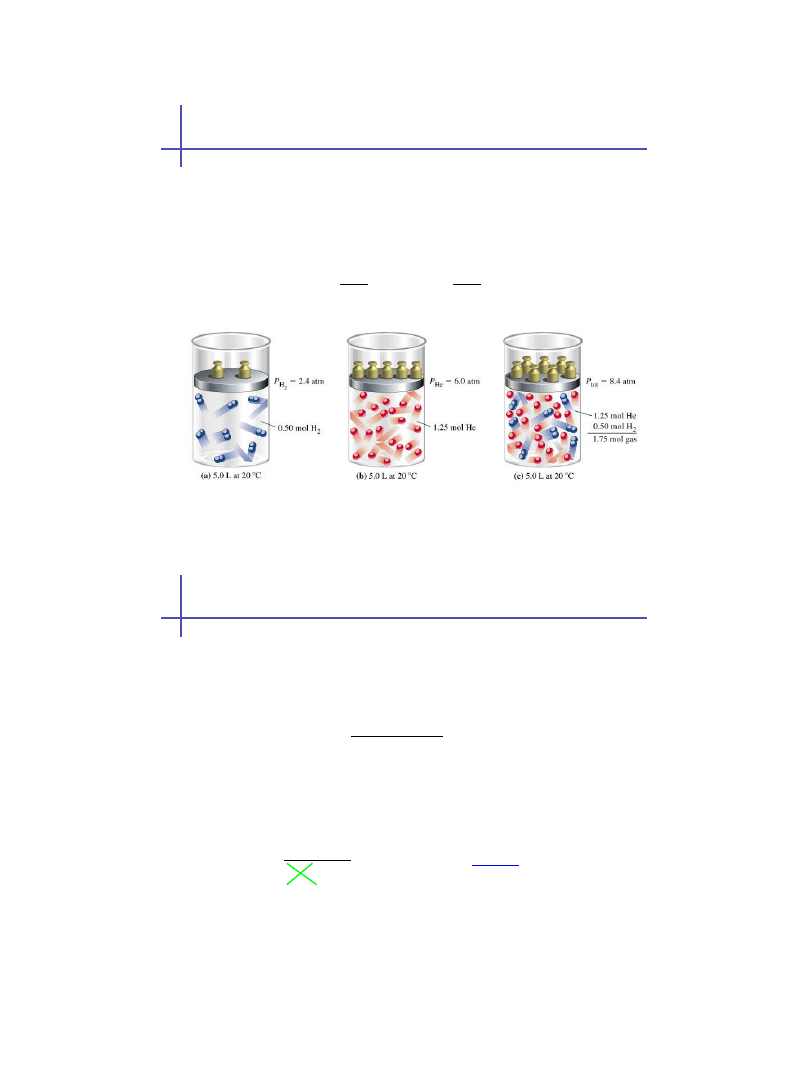
Prawo Daltona (ciśnienie cząstkowe gazu)
Dla mieszaniny gazów, ciśnienie całkowite jest sumą
ciśnień jakie wywierałby każdy gaz, gdyby znajdował
się sam w tym naczyniu:
....
p
p
p
p
4
2
1
cał
RT
V
n
p
RT,
V
n
p
cał
1
2
cał
1
1
p
1
, p
2
…
ciśnienia cząstkowe
(parcjalne)
R- stała gazowa
R=8.314 J/(mol·K)
T-temperatura
bezwzględna [K]
2011-10-04
Inżynieria Biomedyczna, I rok
18
Zapisywanie stałej równowagi K
Układ homogeniczny
(substraty i produkty reakcji występują w
tym samym stanie skupienia)
Układ heterogeniczny
(substraty i produkty reakcji występują
w różnym stanie skupienia)
(g)
2(g)
(s)
2CO
O
2C
]
[O
[C]
[CO]
K
2
2
2
]
[O
[CO]
K
2
2
Ciała stałe i ciecze nigdy nie występują w wyrażeniu na stałą
równowagi
2(g)
2(g)
(g)
2
O
4NO
O
2N
5
2
5
2
4
2
]
O
[N
]
O
[
]
[NO
K
2

2011-10-04
10
2011-10-04
Inżynieria Biomedyczna, I rok
19
Własności równowagi
Układy w równowadze są
DYNAMICZNE
(stała i taka sama prędkość
reakcji prostej i odwrotnej)
ODWRACALNE
Równowagę można osiągnąć z każdego
kierunku
2011-10-04
Inżynieria Biomedyczna, I rok
20
Jeszcze o stałej równowagi
Jednostki stężenia:
[ ] mol/dm
3
otrzymujemy
K
c
Dla składników gazowych, p=(n/V)·RT
p jest proporcjonalne do stężenia,
Jeżeli
p
wyrażone jest w
atmosferach
otrzymujemy K
p
K
c
i K
p
mają różne wartości
(chociaż ilości składników są takie same)
Jednostka stałej K zależy od współczynników stechiometrycznych reakcji
oraz sposobu wyrażenia koncentracji składników
O
2H
O
2H
2
2
2
1
3
c
2
2
2
2
2
c(1)
dm
mol
]
[K
,
]
[O
]
[H
O]
[H
K
O
H
O
2
1
H
2
2
2
1/2
3
c
1/2
2
2
2
c(2)
dm
mol
]
[K
,
]
[O
]
[H
O]
[H
K
2
c(2)
c(1)
)
(K
K
2011-10-04
11
Jaka jest relacja pomiędzy K
c
i K
p
?
2011-10-04
Inżynieria Biomedyczna, I rok
21
g
g
g
g
dD
cC
bB
aA
p
b
B
a
A
d
D
c
C
K
p
p
p
p
c
b
a
d
c
K
[B]
[A]
[D]
[C]
RT
V
n
p
RT,
V
n
p
B
B
A
A
RT
V
n
p
RT,
V
n
p
D
D
C
C
[A]
[B]
[C]
[D]
b)
a
d
(c
p
b)
a
d
(c
b
B
a
A
d
D
c
C
C
(RT)
K
(RT)
p
p
p
p
K
Δn
c
p
(RT)
K
K
gdzie ∆n=(c+d)-(a+b)
Jeżeli ∆n=0 to K
p
=K
c
2011-10-04
Inżynieria Biomedyczna, I rok
22
O równowadze raz jeszcze: wartość K (1)
Kiedy reakcja „faworyzuje” tworzenie produktów a kiedy
substratów?
W stanie równowagi koncentracja produktów jest
dużo większa niż koncentracja substratów
(g)
2
2(g)
2(g)
O
2H
O
2H
p
K
K>>1
Reakcja silnie faworyzuje tworzenie
produktów
80
10
5
.
1
2
2
2
O
2
H
2
O
H
p
p
p
T=300K

2011-10-04
12
2011-10-04
Inżynieria Biomedyczna, I rok
23
O równowadze raz jeszcze (2)
Cl
Ag
gCl
A
(s)
c
K
]
[Cl
]
[Ag
-5
10
1.8
K<<1
W stanie równowagi koncentracja produktów
jest mniejsza niż substratów
Reakcja silnie faworyzuje tworzenie substratów
…..a w przypadku reakcji odwrotnej?
(s)
AgCl
Cl
Ag
4
1
c
odw
10
5.6
K
K
Reakcja silnie faworyzuje tworzenie produktów
2011-10-04
Inżynieria Biomedyczna, I rok
24
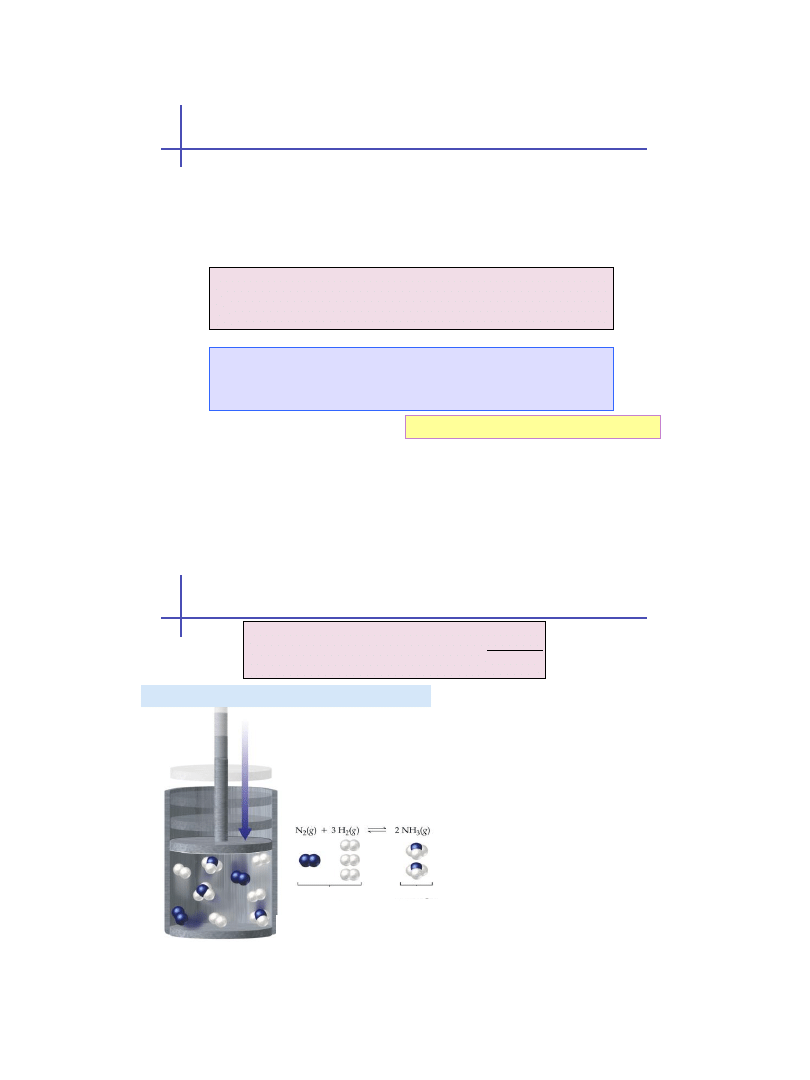
Równowaga i bodźce zewnętrzne
Stan równowagi może być przesunięty jeżeli zmienimy:
koncentrację składników
ciśnienie zewnętrzne (w przypadku reagentów
gazowych)
temperaturę
Henri Le Chatelier
1850-1936
Reguła przekory Le Chateliera
Jeśli w warunkach równowagi zmienimy jeden z
parametrów reakcji (temperaturę lub ciśnienie),
to równowaga reakcji przesunie się w taki
sposób, by zmniejszyć działanie bodźca (układ
przeciwstawi się zmianie) ...
2011-10-04
13
2011-10-04
Inżynieria Biomedyczna, I rok
25
Przesunięcie stanu równowagi:
zmiana koncentracji
Jeżeli koncentracja jednego ze składników ulegnie zmianie
koncentracja pozostałych reagentów zmienia się
tak aby wartość stałej równowagi pozostała niezmieniona (w T=const)
K jest stałe-jedynie przesunięcie położenia stanu równowagi
DODANIE PRODUKTÓW
-równowaga przesuwa się w stronę tworzenia
substratów
DODANIE SUBSTRATÓW
-równowaga przesuwa się w stronę tworzenia
produktów
USUWANIE PRODUKTÓW
- często stosowane jako siła napędowa „zakończenia reakcji”
TWORZENIE GAZU, STRĄCANIE
2011-10-04
26
4 mole gazu
2 mole gazu
przesunięcie w prawo
w stronę mniejszej ilości
moli gazów
Efekt zmiany ciśnienia (równowaga w gazach)
3
H
N
2
NH
p
3(g)
2(g)
2(g)
2
2
3
p
p
p
K
2NH
3H
N
Wzrost ciśnienia (zmniejszenie objętości)
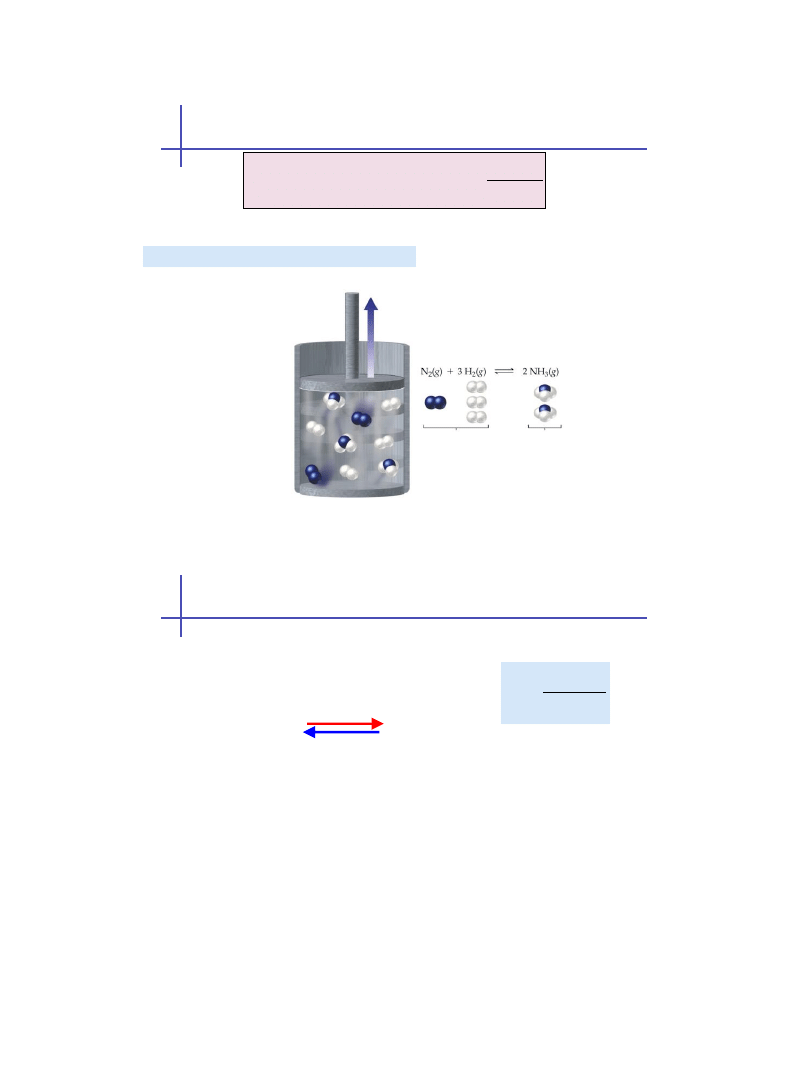
2011-10-04
14
2011-10-04
27
Efekt zmiany ciśnienia (równowaga w gazach)
3
H
N
2
NH
p
3(g)
2(g)
2(g)
2
2
3
p
p
p
K
2NH
3H
N
spadek ciśnienia (zwiększenie objętości)
4 mole gazu
przesunięcie w lewo
w stronę większej ilości moli
gazów
2 mole gazu
2011-10-04
Inżynieria Biomedyczna, I rok
28
Wpływ temperatury na równowagę chemiczną (1)
reakcje egzotermiczne (Q<0)
Zmiana temperatury
zmiana K
Zmiana T: nowe położenie stanu równowagi,
nowe K
Wzrost temperatury
stan równowagi przesuwa się
w lewo
:
K maleje jak T rośnie
Spadek temperatury
stan równowagi przesuwa się
w prawo
:
K rośnie jak T maleje
Q
CO
O
C
2(g)
2(g)
(s)
]
[O
]
[CO
K
2(g)
2(g)
c
]
[CO
,
]
[O
2(g)
2(g)
]
[CO
,
]
[O
2(g)
2(g)
Spadek T
Wzrost T

2011-10-04
15
2011-10-04
Inżynieria Biomedyczna, I rok
29
Wpływ temperatury na równowagę chemiczną (2)
reakcje endotermiczne (Q>0)
Q
2NO
O
N
2
4
2
]
O
[N
]
[NO
K
4
2
2
2
c
bezbarwny brązowy
Ze wzrostem T stan równowagi przesuwa się w stronę
tworzenia produktów ( w kierunku reakcji endotermicznej).
Ze wzrostem T dla reakcji endotermicznej następuje
wzrost stałej równowagi K
Wyszukiwarka
Podobne podstrony:
Pochodne funkcji, IB i IŚ, 2011 12
Calki, IB i IS, 2011 12 id 1073 Nieznany
IB wyk1
IB wyk2 2011
Pochodne funkcji, IB i IŚ, 2011 12
Calki, IB i IS, 2011 12 id 1073 Nieznany
TWN ED 2011 WYK1 rozklad pola
PISZ wyk1
Chemia Bionie wyk1
2011 2 KOSZE
więcej podobnych podstron