http://www.sggw.waw.pl/~stepniak/ e-mail: stepniak@alpha.sggw.waw.pl
EKSTRAKCJA jako metoda rozdzielania lub oczyszczania substancji organicznych
Jakie zjawisko fizyczne wykorzystuje się w procesie ekstrakcji?
Podział substancji między
dwie niemieszające się ciecze (np. olej - woda; eter - woda; benzyna - woda).
Dwie niemieszające się ciecze stanowią tzw. układ ekstrakcyjny. Podział substancji między dwie niemieszające się ciecze
opisuje prawo podziału Nernsta. W stałej temperaturze stosunek stężenia substancji rozpuszczonej w fazie organicznej
do stężenia substancji rozpuszczonej w fazie wodnej jest wielkością stałą charakterystyczną dla tej substancji i dla
układu ekstrakcyjnego. Stosunek stężeń substancji w fazie organicznej (c
o
) i w fazie wodnej (c
w
) nosi nazwę stałej podziału K.
T = const.,
w
o
c
c
K
=
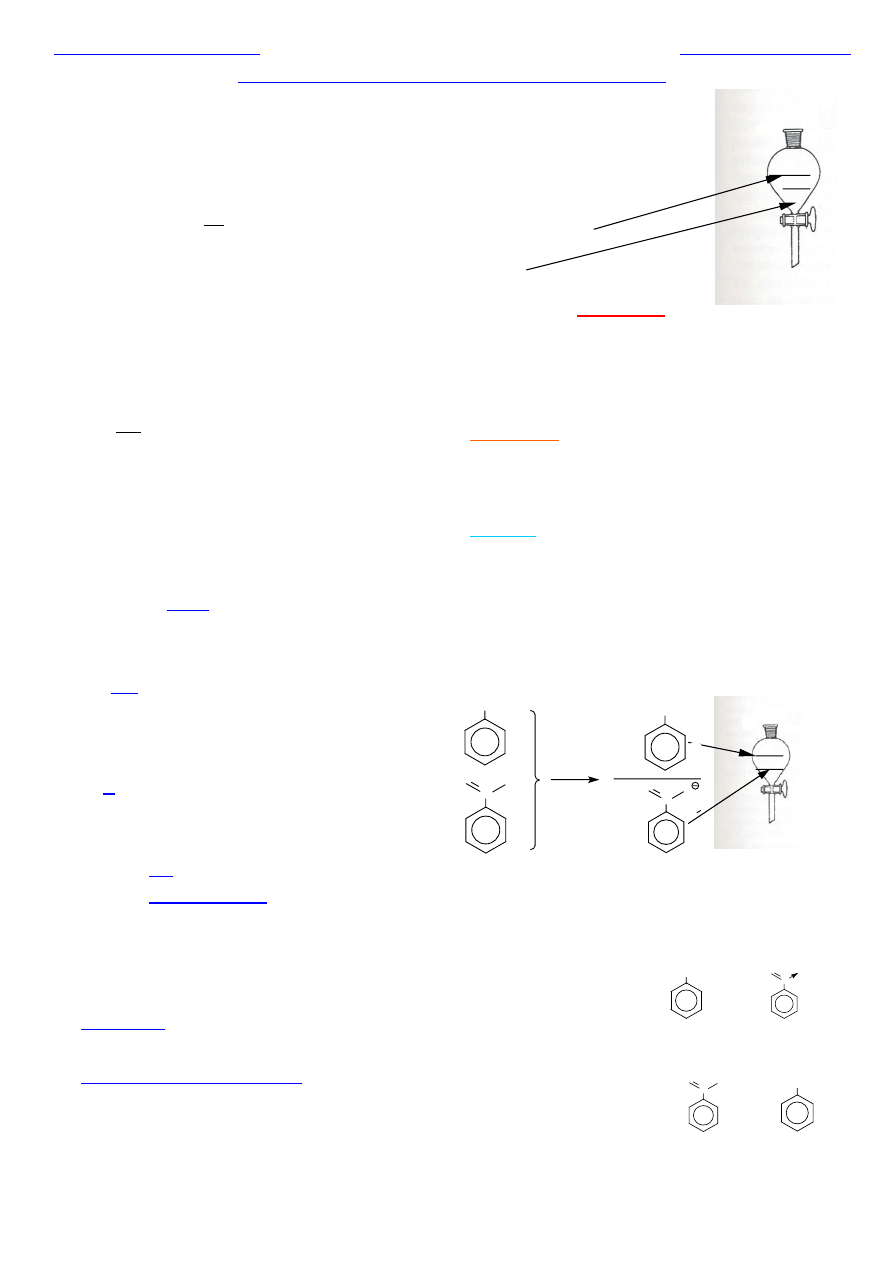
Faza organiczna
Faza wodna
Jakie warunki muszą być spełnione, aby mogło nastąpić
efektywne rozdzielenie składników mieszaniny metodą ekstrakcji?
Efektywność rozdzielenia składników mieszaniny jest tym większa,
im większa jest różnica stałych podziału tych składników (K
1
, K
2
).
Jaka jest definicja współczynnika rozdzielenia(β
i,j
)
składników mieszaniny metodą ekstrakcji?
j
i
j
i
K
K
=
,
β
,
K
i
>K
j
.
Im większa jest wartość współczynnika rozdzielenia(β
i,j
),
tym większa jest efektywność rozdzielenia metodą ekstrakcji.
Zadanie 1
Jaki procent związku A zostanie przeniesiony ze 100 cm
3
fazy wodnej do 50 cm
3
fazy eterowej w procesie jednokrotnej ekstrakcji.
Stała podziału K
A
= 4?
Odp.: %A = 2/3· 100 = 66,67 %
Zadanie 2
Obliczyć wartość stałej podziału substancji A pomiędzy eter i wodę, jeśli w wyniku jednokrotnej ekstrakcji 250 cm
3
fazy wodnej 70-cioma cm
3
eteru, do fazy o
nicznej przeszło 85% związku A.
rga-
Odp.: K
A
= 20,24
Zadanie 3
Obliczyć, jaka ilość związku A przejdzie ze 100 ml roztworu wodnego
zawierającego 10g związku A do fazy eterowej przy:
a)
1-krotnej ekstrakcji eterem o objętości 100 ml, K
A
= 4
Odp.: x = 8g
b)
2-krotnej ekstrakcji porcjami eteru po 50 ml.
x
1
= 6,67
x
2
= 2,22
x = x
1
+ x
2
Odp.: 6,67 + 2,22 = 8,89
Część praktyczna:
1) Umieścić ekstraktor w pierścieniu metalowym na statywie.
2) Wlać do ekstraktora 25 cm
3
mieszaniny toluen-kwas benzoesowy.
3) Dodać 20 cm
3
roztworu NaOH o stężeniu 2 mol/dm
3
.
4) Wytrząsać układ ekstrakcyjny przez 10 minut, odpowietrzając co 2-3 minuty..
5) Wstawić ekstraktor do metalowego pierścienia na statywie, w celu rozdzielenia faz.
6) Fazę wodną (dolną) spuścić do kolby stożkowej i mieszając dodawać ostrożnie stężony kwas solny,
aż do uzyskania odczynu kwaśnego (kontrolować odczyn papierkiem lakmusowym).
7) Po
oziębieniu wytrącony kwas benzoesowy odsączyć na lejku Bűchnera, przemyć wodą i wysuszyć.
8) Warstwę organiczną (pozostawioną w rozdzielaczu) przemyć dwukrotnie 20 cm
3
wody,
przelać do suchej kolby stożkowej i dodać bezwodny siarczan(VI) magnezu, w celu wysuszenia.
Suszyć przez 10 minut.
9)
Wysuszony toluen przesączyć przez sączek karbowany do suchej kolby destylacyjnej i przedestylować,
Etapy ekstrakcji:
1.
Przygotowanie odpowiedniego układu ekstrakcyjnego (przeprowadzenie j
go ze składników mieszaniny w formę jonową)
edne-
2. Wytrząsanie w celu osiągnięcia stanu równowagi w układzie ekstrakcyjnym
3. Pozostawienie
układu ekstrakcyjnego do momentu rozwarstwienia faz
4. Rozdzielenie
faz
5. Wyodrębnienie składnika z fazy:
A. Faza
organiczna:
1. Przemywanie fazy wodą
2. Suszenie fazy organicznej bezwodnym MgSO
4
(lub innym śr. susz.)
3. Przesączenie przez sączek karbowany
4. Destylacja prosta
B. Faza
wodna:
1. Zobojętnienie fazy wodnej
2. Odsączenie wytrąconych kryształów na lejku Bűchnera
3. Przemywanie kryształów
4. Suszenie i ważenie kryształów
Omówić etapy ekstrakcji w czasie rozdzielania mieszanin:
a)
Kwasu benzoesowego (s) i toluenu (c):
C
O
OH
CH
3
H O
2
NaOH
F.o.
F.w.
Wyodrębnianie składnika z fazy:
- F.o.: 1. Suszenie, 2. Sączenie, 3. Destylacja
- F.w.: 1. Zobojętnienie, 2. Krystalizacja
b)
Aniliny (c) i nitrobenzenu (c):
NH
2
,
N
O
O
c)
Kwasu benzoesowego (s) i fenolu (s)
C
O
OH
,
OH
O
CH
3
C
O
Rozdzielanie faz
zbierając frakcję w zakresie temperatury 108-111
o
C.
10) Obliczyć % skład mieszaniny.
Dr S.A. Stępniak
Katedra Chemii, Wydział Technologii Żywności, SGGW, pok. 1115, 1116
1
Document Outline
- Zadanie 1
- Zadanie 2
- Zadanie 3
- Odp.: x = 8g
- x1 = 6,67
- x2 = 2,22
- x = x1 + x2
- Odp.: 6,67 + 2,22 = 8,89
- Część praktyczna:
Wyszukiwarka
Podobne podstrony:
EKSTRAKCJA NADKRYTYCZNA id 1571 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron