
1
Politechnika
Białostocka
Wydział Budownictwa i Inżynierii Środowiska
Laboratorium z przedmiotu:
BIOPALIWA
KOD: EKS1A400034
Studia stacjonarne I stopnia
Ćwiczenie 3
Analiza surowców do produkcji biopaliw.
Instrukcje do ćwiczeń
3.1. Badanie
właściwości fizyko-chemicznych wybranych olejów roślinnych
3.2.
Badanie wpływu stężenia katalizatora kwasowego na wydajność hydrolizy bio-
masy lignocelulozowej
3.3.
Badanie składu i właściwości biosurowców
Opracowanie:
dr Mariola Samsonowicz

2
Politechnika
Białostocka
Wydział Budownictwa i Inżynierii Środowiska
Instrukcja do zajęć laboratoryjnych
BIOPALIWA
KOD: EKS1A400034
Studia stacjonarne I stopnia
Numer ćwiczenia: 3.1.
Temat:
Badanie właściwości fizyko-chemicznych wybranych olejów
roślinnych
Opracowanie:
dr Mariola Samsonowicz

3
1. Wprowadzenie
Biopaliwami nazywane są paliwa w formie stałej, płynnej lub gazowej otrzymywane z surowców po-
chodzenia organicznego (biomasy lub biodegradowalnych frakcji odpadów, zarówno komunalnych, jak
i odpadów z produkcji roślinnej i zwierzęcej). Energia zgromadzona w surowcach do produkcji biopaliw
jest krótkotrwale skumulowaną energią słoneczną. Zastosowanie biopaliw obejmuje głównie transport i
ciepłownictwo.
Tabela 1. Obszary zastosowań biopaliw w transporcie i energetyce (stosowane i rozważane do stoso-
wania)
Jako biopaliwa i paliwa alter-
natywne dla silników o zapło-
nie iskrowym:
W zakresie zasilania silników
o zapłonie samoczynnym,
(prace nad otrzymywaniem i
stosowaniem paliw alterna-
tywnych pochodzących głów-
nie z biomasy)
W zastosowaniach stacjonar-
nych brane są pod rozwagę:
etanol
estry kwasów tłuszczowych, mety-
lowe i etylowe, odpowiednio
FAME i FAEE, z procesów tran-
sestryfikacji olejów: rzepakowego,
słonecznikowego, sojowego itp.;
alkohole
metanol
eter dimetylowy (DME), eter die-
tylowy (DEE)
estry wyższych kwasów tłuszczo-
wych
inne alkohole (np.: tert-butylowy -
TBA, sec-butylowy-SBA, izopropy-
lowy - IPA, neopentylowy - NPA);
emulsje paliwowo-wodne (Aqua-
zole)
paliwa z procesów pirolizy;
etery (etylo-tert-amylowy-TAEE,
etylo-tert-butylowy-ETBE, metylo-
tert-amylowy- TAME, metylo-tert-
butylowy-MTBE, diizopropylowy-
DIPE);
czyste oleje roślinne
paliwa talowe (TPO-tall pitch oils)
otrzymywane w procesach estryfi-
kacji alkoholami etylowym lub
metylowym olejów talowych wy-
dzielonych z żywicy drzew igla-
stych (produktów ubocznych, pod-
czas produkcji celulozy siarczano-
wej oraz wytlewania drewna);
węglowodorowe paliwa synte-
tyczne;
węglowodorowe paliwa synte-
tyczne.
czyste oleje roślinne;
skroplony gaz naftowy;
biogaz
wodór
Surowce wykorzystywane do produkcji biopaliw mogą być zaklasyfikowane do trzech grup:
biomasy celulozowej,
surowców zawierających cukry proste, sacharozę lub skrobię
roślin zawierających oleje roślinne.
Pierwszą grupę stanowi biomasa celulozowa zbudowana głównie z celulozy, hemicelulozy oraz
ligniny. Celuloza (zaw. 40 – 60% s. m. o.) jest poddawana hydrolizie do cukrów prostych i kierowana
do fermentacji alkoholowej z wytworzeniem bioetanolu. Hemiceluloza (zaw. 20 – 40% s. m. o.) jest
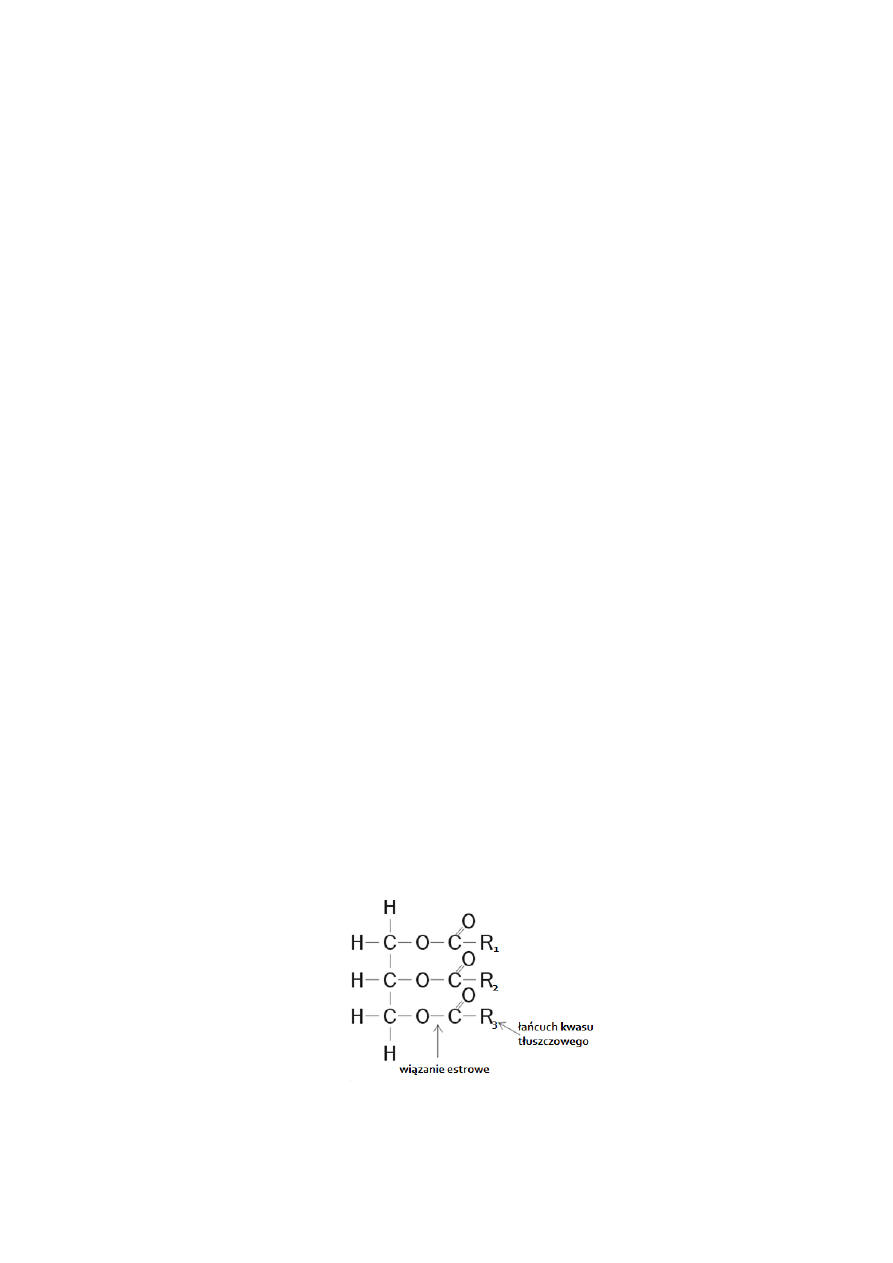
4
polisacharydem zbudowanym z cukrów zawierających 5 i 6 atomów węgla. Poddawana jest hydro-
lizie i fermentacji alkoholowej. Lignina (zaw. 10 – 14% s. m. o.) stanowi pozostałość po procesie
fermentacji. Wysoka wartość opałowa sprawia, że materiał jest wykorzystywany do wytwarzania
ciepła niezbędnego do ogrzewania reaktora fermentacji. Surowce celulozowe nie są wykorzysty-
wane do celów spożywczych. Do tej grupy zaliczane są m. in. pozostałości z produkcji rolniczej
zawierające materiał z upraw (np. ryż, włókna orzecha kokosowego, łodygi, łupiny roślin kukury-
dzy), odpady z produkcji leśnej (np. wióry i trociny z tartaków, obumarłe drzewa lub gałęzie drzew),
stałe odpady komunalne (np. wyroby z papieru), odpady z produkcji żywności oraz odpady przemy-
słowe (odpady z gorzelni, odpady z produkcji papieru), rośliny energetyczne uprawiane na cele pa-
liwowe (szybko rosnące drzewa lub trawy).
Drugą grupę stanowią surowce zawierające skrobię, sacharozę i cukry proste. Zaliczane są rośliny,
które wyprodukowaną w procesie fotosyntezy energię przechowują w postaci cukrów prostych, sa-
charozy lub skrobi. Są to m. in. trzcina cukrowa, buraki cukrowe, kukurydza, maniok i ziemniaki.
Surowce zaliczane do tej grupy są powszechnie wykorzystywane do produkcji żywności i stanowi
alternatywę dla produkcji paliw (biopaliwa 1 generacji).
Trzecią grupę stanowią surowce olejowe. Ilościowo najwięcej na świecie produkuje się oleju sojo-
wego i palmowego, natomiast trzecie i czwarte miejsce stanowią oleje rzepakowy i słonecznikowy.
Powszechne wykorzystywane są zarówno do produkcji żywności dla ludzi i zwierząt, jak i do pro-
dukcji paliw w postaci estrów metylowych wyższych kwasów tłuszczowych (paliwa 1 generacji).
Produkcja biopaliw z olejów pochodzących z niektórych gatunków roślin (np. Jatrophy) ze względu
na ich wysoką toksyczność nie stanowi konkurencji w stosunku do produkcji żywności (biopaliwa
2 generacji).
Składniki olejów roślinnych i zwierzęcych
Podstawowym składnikiem olejów roślinnych i zwierzęcych są triglicerydy czyli estry wyższych
kwasów tłuszczowych i glicerolu, oraz niewielkie ilości wolnych kwasów tłuszczowych.
Grupy acylowe (R
1
, R
2
, R
3
) zawierają proste łańcuchy kwasów tłuszczowych nasyconych lub niena-
syconych o parzystej liczbie atomów węgla i masie cząsteczkowej od 650 do 790 g/mol. W tabeli 2

5
przedstawiono udział procentowy kwasów tłuszczowych w niektórych olejach konsumpcyjnych i
niekonsumpcyjnych.
Udział reszt acylowych w składzie tłuszczów zależy od pochodzenia oleju. Najbardziej cennymi do
wytwarzania biopaliwa do silników wysokoprężnych są mononasycone kwasy o ilości węgla w czą-
steczce: C16 – C20, a przede wszystkim kwas oleinowy (C18:1). W tłuszczach zwierzęcych, które
mają stałą konsystencję, w dużym stężeniu występują reszty kwasów nasyconych charakteryzują-
cych się długimi łańcuchami węglowymi. W tłuszczach zwierzęcych o konsystencji płynnej prze-
ważają reszty kwasów nienasyconych lub reszty o krótkich łańcuchach węglowych.
Oprócz triglicerydów w olejach i tłuszczach występują wolne kwasy tłuszczowe. Ich stężenie jest
szczególnie istotne dla procesu technologicznego, ponieważ w standardowych warunkach wytwa-
rzania estrów metylowych tzn. w środowisku zasadowym, reagują z zasadą, tworząc mydła.
CH
3
(CH
2
)
14
COOH + KOH CH
3
(CH
2
)
14
COOK + H
2
O
Przykładowe wartości stężenia wolnych kwasów tłuszczowych w surowcach do produkcji biodiesla
są następujące:
Olej rafinowany < 0.5%
Olej surowy 0.3 – 0.7 %
Tłuszcze odpadowe z gastronomii 2 – 7 %
Tłuszcze zwierzęce 5 – 30 %
Tłuszcze odpadowe z łapaczy tłuszczy 40 – 100 %.
Skład chemiczny olejów i tłuszczów stosowanych do produkcji biodiesla wpływa na jakość uzyski-
wanych z nich estrów metylowych. Wraz ze wzrostem długości łańcucha grup acylowych rośnie
lepkość biodiesla, natomiast maleje wraz ze wzrostem liczby podwójnych wiązań w łańcuchu. Bio-
diesel uzyskiwany z tłuszczy zwierzęcych i odpadowych charakteryzuje się wyższą lepkością w po-
równaniu z biodieslem z olejów roślinnych, ponieważ stopień nasycenia reszt kwasów tłuszczowych
wchodzących w skład triglicerydów jest większy. Stabilność oksydacyjna jest skorelowana z ilością
i położeniem wiązań podwójnych w łańcuchu kwasów tłuszczowych. Wraz ze wzrostem stężenia
kwasów zawierających przynajmniej dwa wiązania podwójne stabilność oksydacyjna (odporność na
utlenienie) biopaliwa maleje. Aby przeciwdziałać temu zjawisku należy zapewnić odpowiednie wa-
runki magazynowania, np. ograniczyć dostęp tlenu, czy też kontakt ze światłem.
W tabeli 3 zestawiono wybrane właściwości niektórych estrów metylowych w porównaniu do oleju
napędowego.

6
Tabela 2 Udział kwasów tłuszczowych (%) w wybranych olejach konsumpcyjnych i niekonsumpcyjnych
Kwasy
tłuszczowe
Wzór kwasu
ilość wiązań
podwójnych
olej
rzepakowy
olej słonecz-
nikowy
olej
sojowy
olej
palmowy
olej
z jatrofy
olej z nasion
kauczukowca
Kwasy nasycone
mirystynowy
CH
3
(CH
2
)
12
COOH
-
-
-
-
1
-
-
palmitynowy
CH
3
(CH
2
)
14
COOH
-
3.49
6.08
10.58
42.8
14.2
10.2
stearynowy
CH
3
(CH
2
)
16
COOH
-
0.85
3.62
4.76
4.5
6.9
8.7
Kwasy nienasycone
oleinowy
CH
3
(CH
2
)
7
CH=CH(CH
2
)
7
COOH
1
64.3
16.93
22.52
40.5
43.1
24.6
linolowy
CH
3
(CH
2
)
4
CH=CHCH
2
CH=CH(CH
2
)
7
COOH
2
22.3
73.73
52.34
10.1
34.3
39.6
linolenowy
CH
3
(CH
2
)CH=CHCH
2
CH=CHCH
2
CH=CH(CH
2
)
7
COOH
3
8.23
-
8.19
0.2
-
16.3
Tabela 3. Porównanie właściwości wybranych estrów metylowych i oleju napędowego
Rodzaj paliwa
Lepkość [mm
2
/s]
w T=40
o
C
Gęstość [g/cm
3
]
w T=21
o
C
Liczba centowa
T zapłonu
[
o
C]
T mętnienia
[
o
C]
T
zablokowania
zimnego filtra [
o
C]
Olej napędowy
2 – 4.5
0.82 – 0.86
51
55
-18
-25
Estry metylowe z oleju sojowego
4.08
0.884
51
131
-0.5
-4
Estry metylowe z oleju rzepako-
wego
4.83
0.882
53
155
-4
-10,8
Estry metylowe z oleju słoneczni-
kowego
4.60
0.88
49
183
1
-7
Estry metylowe z łoju
5
0.877
59
150
12
9
Estry metylowe z tłuszczy odpado-
wych
5.16
0.873
63
-
9
12
Estry metylowe z produktów
ubocznych z produkcji oleju sojo-
wego
4.30
0.885
51
169
6
-

7
W skali światowej udział olejów w produkcji biodiesla przedstawia się następująco: olej rzepakowy
– 84%, słonecznikowy – 13%, palmowy – 1%, sojowy i pozostałe – 2%. W Polsce występują ko-
rzystne warunki dla uprawy rzepaku, który stanowi ponad 98,7% produkcji wszystkich roślin olei-
stych w Polsce.
Olej rzepakowy najczęściej zawiera (w % wag.):
- 2% kwasu stearynowego,
- 4% kwasu palmitynowego,
- 8% kwasu linolenowego,
- 13% kwasu arachidowego,
- 14% kwasu linolowego,
- 40% kwasu erukowego w postaci triglicerydów.
Bezpośrednie zastosowanie oleju rzepakowego jako paliwa silnikowego jest utrudnione głównie z
powodu zbyt dużej lepkości. Lepkość ta może dodatkowo rosnąć w wyniku reakcji polimeryzacji
składników o charakterze nienasyconym, np. lepkość oleju rzepakowego jest 10-krotnie większa niż
oleju napędowego pochodzenia naftowego. Aby oleje roślinne mogły być użyte jako paliwo silni-
kowe, należy je zmodyfikować.
Lepkość można zmniejszyć przez:
• rozcieńczenie oleju roślinnego paliwem dieslowskim pochodzenia naftowego (metoda ta jest jed-
nak tylko częściowo skuteczna);
• mikroemulgowanie z alkoholami małocząsteczkowymi, np. metanolem lub etanolem w obecności
jonowego bądź niejonowego emulgatora;
• pirolizę lub kraking i następnie wydzielenie odpowiedniej frakcji w drodze destylacji;
• transestryfikację (określaną również jako alkoholizę) małocząsteczkowymi alkoholami (metano-
lem, etanolem i butanolem) .
Najczęściej stosuje się proces transestryfikacji. Olej przeznaczony na biopaliwa musi spełniać określone
standardy. Olej rzepakowy kierowany do transestryfikacji powinien być pozbawiony wilgoci (zawartość
wody < 0.5%), gdyż jej obecność powoduje hydrolizę triacyloglicerolu w wyniku czego zwiększa się
ilość wolnych kwasów tłuszczowych (WKT), przez co zwiększa się wartość liczby kwasowej (LK).
Podwyższona liczba kwasowa oleju powoduje powstawanie podczas procesu estryfikacji znacznie więk-
szej ilości niepożądanych mydeł, a także powoduje wzrost zapotrzebowania na katalizator. Obecne w
stosunkowo dużych ilościach w oleju surowym sole żelaza i miedzi wpływają niekorzystnie na jego
odporność na utlenienie. Obecne w oleju fosfolipidy podnoszą jego odporność na utlenianie (tj. rośnie
stabilność oksydatywna), ale jednocześnie jako związki powierzchniowo czynne silnie emulgują układ
reakcyjny i utrudniają rozdział fazy estrowej od glicerynowej. Zawartość fosforu w oleju kierowanym
do transestryfikacji nie powinna przekraczać 10 ppm,
W celu określenia przydatności tłuszczów jako surowców żywnościowych lub przemysłowych określa

8
się ich właściwości fizyczne i chemiczne. Do najważniejszych oznaczeń należą:
– oznaczenie gęstości metodą piknometryczną lub areometryczną,
– oznaczanie lepkości
– oznaczenie liczby kwasowej LK (ilość mg KOH potrzebna do zobojętnienia wolnych kwasów
organicznych zawartych w 1g próbki tłuszczu)
– oznaczenie liczby zmydlania LZ (ilość mg KOH potrzebna do zmydlenia tłuszczu i do zobojęt-
nienia wolnych kwasów organicznych zawartych w 1g próbki tłuszczowej),
– oznaczenie liczby jodowej LI (jest to liczba gramów jodu potrzebna do wysycenia wiązań wie-
lokrotnych w 100-gramowej próbce tłuszczu). Im wyższa wartość liczby jodowej, tym większa
zawartość układów nienasyconych C=C w badanej próbce.
– oznaczenie liczby nadtlenkowej LOO (ilość ml roztworu Na
2
S
2
O
3
o stężeniu 0.01 M potrzebna
do zmiareczkowania jodu wydzielonego z KI przez nadtlenki zawarte w 1g tłuszczu). Zbyt wy-
soka liczba nadtlenkowa surowca uniemożliwia prawidłowy przebieg procesu transestryfikacji
(wydzielenie się poszczególnych frakcji)

9
1. Cel i zakres ćwiczenia laboratoryjnego
Celem ćwiczenia jest opisanie jakości surowca do otrzymywania biopaliwa poprzez wyznaczenie
liczby kwasowej i liczby nadtlenkowej w próbkach olejów.
Liczba kwasowa (LK) określa ilość wolnych kwasów tłuszczowych. Określa stopień hydrolizy tłusz-
czu czyli rozpadu cząsteczek oraz charakteryzuje jakość przeprowadzonego procesu rafinacji. Jej
wzrost podczas eksploatacji sygnalizuje postępujący proces starzenia się oleju. Podwyższona liczba
kwasowa oleju powoduje podczas procesu estryfikacji znacznie większej ilości niepożądanych mydeł,
a także powoduje większe zużycie katalizatora.
Jest wyrażona jako ilość miligramów wodorotlenku potasu potrzebną do zobojętnienia kwasów tłusz-
czowych zawartych w 1 g oleju.
Schemat reakcji zachodzącej podczas oznaczania LK:
RCOOH + KOH → RCOOK + H
2
O
Liczba nadtlenkowa (LOO) inaczej liczba Lea oznaczana dla tłuszczu informuje o zawartości w próbce
pierwotnych produktów utlenienia lipidów, tj. wodoronadtlenków. Liczba nadtlenkowa jest to ilość cm
3
mianowanego roztworu tiosiarczanu sodu potrzebna do zmiareczkowania jodu wydzielonego z roztworu
jodku potasu w wyniku działania nadtlenków znajdujących się w 1 kg badanego tłuszczu. Ilość nadtlen-
ków w próbce, która utlenia jodek potasu w warunkach oznaczenia, wyraża się jako miliekwiwalenty
aktywnego tlenu zawarte w kilogramie tłuszczu [mEq O/kg tłuszczu] dokładnie w chwili pomiaru. W
czasie oznaczania zachodzą następujące reakcje:
─CH─CH─ + 2KI + 2CH
3
COOH → ─CH─CH─ + I
2
+ H
2
O + 2CH
3
COOK
│ \ /
OO O
I
2
+ 2Na
2
S
2
O
3
→ 2NaI + Na
2
S
4
O
6
2. Metodyka badań
2.1. Szkło i sprzęt laboratoryjny
– kolby stożkowe
– kolby stożkowe ze szlifem i korkiem
– biureta
– pipety
– waga analityczna

10
2.2. Odczynniki i materiały
– Olej rzepakowy, sojowy, słonecznikowy i inne
– Olej posmażalniczy
– Mieszanina rozpuszczalników: etanol i eter etylowy w stosunku 1:1
– Etanolowy roztwór wodorotlenku potasu o stężeniu 0,01 mol/dm
3
– 1% etanolowy roztwór fenoloftaleiny
– mieszanina chloroformu i kwasu octowego lodowatego (2:3, v:v)
– Nasycony roztwór jodku potasu (świeżo przygotowany)
– Roztwór skrobi
– 0,01 mol/dm
3
roztwór tiosiarczanu sodu
2.3. Wykonanie ćwiczenia
1. Oznaczanie liczby kwasowej [PN – ISO 660]
Na wadze technicznej odważyć około 5 g oleju z dokładnością do ± 0,01 g i przenieść do kolby
stożkowej o pojemności 100 cm
3
. Następnie do kolby dodać 25 cm
3
mieszaniny rozpuszczalników:
eteru etylowego i 95 % alkoholu etylowego w stosunku objętościowym 1:1. Mieszaninę rozpuszczal-
ników należy zobojętnić przed użyciem etanolowym roztworem KOH o stężeniu 0,01 mol/dm
3
wobec
fenoloftaleiny do bladoróżowego zabarwienia, które nie znika w ciągu 30 s. Do analizowanej próbki
dodać 2-3 krople roztworu fenoloftaleiny, a następnie mieszając miareczkować mianowanym roz-
tworem wodorotlenku potasu o stężeniu 0,01 mol/dm
3
, aż do momentu zmiany barwy roztworu na
jasno różową, utrzymującą się przez co najmniej 15 s. Równolegle wykonać próbę ślepą z taką sama
ilością rozpuszczalnika i w takich samych warunkach, ale bez badanej próbki.
2. Oznaczanie liczby nadtlenkowej [PN – ISO 3960]
Do kolby ze szlifem o pojemności 100 cm
3
odważyć 5 g badanej próbki, z dokładnością do 0,001 g i
dodać 25 cm
3
mieszaniny chloroformu i kwasu octowego. Próbkę szybko wymieszać, po czym dodać
pipetą 2 cm
3
roztworu jodku potasu. Kolbę natychmiast zamknąć korkiem i mieszać przez 1 min, a
następnie pozostawić na 5 min w zaciemnionym miejscu w temperaturze pokojowej. Po tym czasie
dodać 30 cm
3
wody destylowanej, opłukując przy tym starannie korek (wodą destylowaną z try-
skawki). Całość wymieszać energicznie, dodać kilka kropli skrobi (roztwór zabarwia się na grana-
towo), a następnie wydzielony jod odmiareczkować roztworem tiosiarczanu sodu o stężeniu 0,01
mol/dm
3
do odbarwienia. Oznaczenie wykonać co najmniej w dwóch powtórzeniach. Równolegle
wykonać próbę ślepą bez badanej próbki.

11
3. Opracowanie wyników (sprawozdanie)
3.1. Liczba kwasowa
Liczbę kwasową (LK) wyrażoną w miligramach KOH potrzebnych do zobojętnienia kwasów tłuszczo-
wych zawartych w 1g badanego produktu, obliczyć ze wzoru dla każdego miareczkowania:
𝐿𝐾 =
𝑀
𝐾𝑂𝐻
∙ 𝐶
𝐾𝑂𝐻
∙ (𝑉
𝐾𝑂𝐻
− 𝑉
𝑠
)
𝑚
gdzie:
C
KOH
– stężenie roztworu KOH, [mmol/cm
3
]
V
KOH
- objętość 0,1 mol/dm
3
roztworu wodorotlenku potasu zużyta do zmiareczkowania próby właściwej,
[cm
3
],
V
s
- objętość 0,1 mol/dm
3
roztworu wodorotlenku potasu zużyta do zmiareczkowania próby ślepej, [cm
3
],
m - naważka próbki, [g],
M
KOH
– masa molowa wodorotlenku potasu (56,11 mg/mmol).
Następnie przeprowadzić dyskusję wyników (obliczyć
x
, S,
X
S , podać przedział ufności
]
[ jednostki
s
t
x
x
x
dla
).
05
,
0
Wzory i odpowiednie zależności są dostępne na stanowiskach,
lub w przygotowanych programach komputerowych; Excel).
3.2. Liczba nadtlenkowa
Liczbę nadtlenkową (LOO) wyrażoną w milirównoważnikach aktywnego tlenu w kilogramie próbki
obliczyć ze wzoru:
𝐿𝑂𝑂 =
𝐶
𝑁𝑎
2
𝑆
2
𝑂
3
∙ (𝑉
𝑁𝑎
2
𝑆
2
𝑂
3
− 𝑉
𝑠
)
𝑚
∙ 1000 [
𝑚𝐸𝑞 𝑂
2
𝑘𝑔
]
gdzie:
V
s
- objętość roztworu tiosiarczanu sodu o stężeniu 0,01 mol/dm
3
zużytego do miareczkowania próby ślepej,
[cm
3
],
V
Na
2
S
2
O
3
- objętość roztworu tiosiarczanu sodu o stężeniu 0,01 mol/dm
3
zużytego do miareczkowania badanej
próbki, [cm
3
],
C
Na
2
S
2
O
3
- stężenie użytego roztworu tiosiarczanu sodu, [ mol/dm
3
],
m - naważka badanej próbki, [g]
Następnie przeprowadzić dyskusję wyników (obliczyć
x
, S,
X
S , podać przedział ufności
]
[ jednostki
s
t
x
x
x
dla
).
05
,
0
Wzory i odpowiednie zależności są dostępne na stanowiskach,
lub w przygotowanych programach komputerowych; Excel).
12
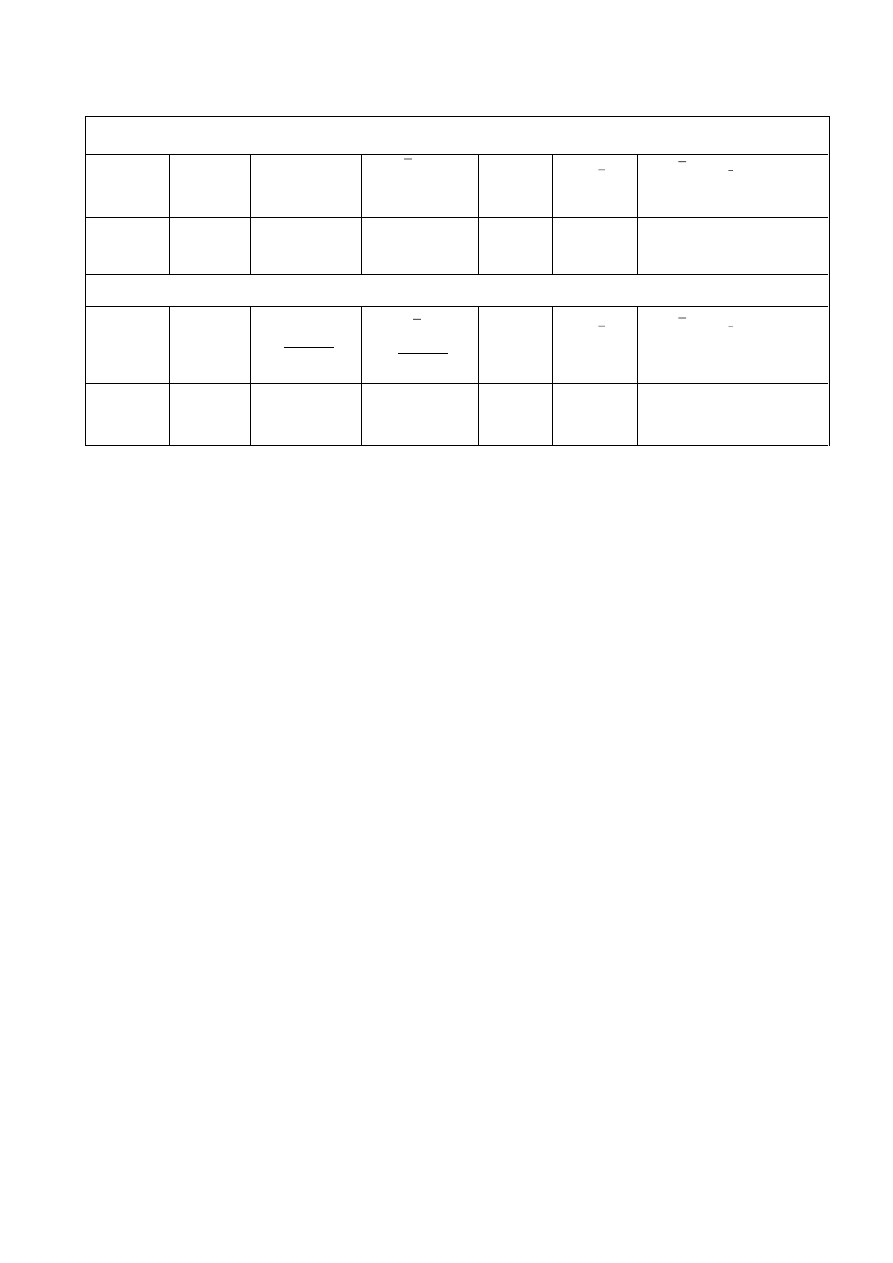
Wyniki ze wszystkich oznaczeń przedstawić w poniższej tabeli:
Oznaczanie liczby kwasowej
Masa
próbki
[g]
V
KOH
[cm
3
]
LK
[mgKOH/goleju]
x
[mgKOH/goleju]
S
X
S
]
[ jednostki
s
t
x
x
x
V
1
=
V
2
=
V
3
=
Oznaczanie liczby nadtlenkowej
Masa
próbki
[g]
V
Na
2
S
2
O
3
[cm
3
]
LOO
[
𝑚𝐸𝑞 𝑂
2
𝑘𝑔
x
[
𝑚𝐸𝑞 𝑂
2
𝑘𝑔
S
X
S
]
[ jednostki
s
t
x
x
x
m
1
m
2
m
3
V
1
=
V
2
=
V
3
=
Sprawozdanie studenckie powinno zawierać
Stronę tytułową
Cel i zakres ćwiczenia
Krótkie wprowadzenie
Opis stanowiska laboratoryjnego
Równania zachodzących reakcji
Zestawienie otrzymanych wyników
Dyskusja otrzymanych wyników
Wnioski.
4. Przykładowe pytania kontrolne
1. Omów metodę oznaczania liczby kwasowej surowców do produkcji biopaliw
2. Omów metodę oznaczania liczby nadtlenkowej
3. Przedstaw i scharakteryzuj podział surowców do produkcji biopaliw
4. Omów podstawowe parametry oceny przydatności olejów do zastosowań przemysłowych
5. Wyjaśnij, dlaczego olej rzepakowy nie nadaje się do bezpośredniego zastosowania jako
biopaliwo i w jaki sposób można go zmodyfikować
6. Jakie wymagania musi spełniać olej przeznaczony do procesu transestryfikacji
7. Omów składniki tłuszczów roślinnych i zwierzęcych
8. Omów wpływ składu olejów na jakość uzyskiwanych z nich estrów metylowych
9. Umiejętność rozwiązywania zadań związanych z procesami zachodzącymi w trakcie wy-
konywania ćwiczeń laboratoryjnych
10. Znajomość podstawowych definicji: np. transestryfikacja, biopaliwa, hemiceluloza, li-
gnina, biomasa celulozowa, liczba kwasowa, liczba jodowa,
Literatura
1. Radziemska E., Lewandowski W., Szukalska E., Tynek M., Pustelnik A., Ciunel K., Biopaliwa z
rzepaku. Przygotowanie surowca do otrzymania biodiesla w warunkach gospodarstwa rolnego oraz

13
pilotowe metanolizy, CHEMIA.DYDAKTYKA.EKOLOGIA. METROLOGIA 2009, R.14, Nr 1-2.
2. Zabaniotou A., Ioannidou O., Skoulou V., “Rapeseed residues utilization for energy and 2nd gen-
eration biofuels”, Fuel 87 (8), 1492-1502 87, 2008
3. Biernat K., „Biopaliwa – definicje i wymagania obowiązujące w Unii Europejskiej”, Czysta Energia,
nr 10/2010
4. Biernat K., Rogulska M., „Biopaliwa II generacji”, Czysta Energia, nr 1/2008,
5. Klimiuk E., Pawłowska M., Pokój T., „Biopaliwa. Technologie dla zrównoważonego rozwoju”, Wy-
dawnictwo Naukowe PWN , Warszawa 2012
5. Utylizacja odpadów
Roztwory po wykonaniu ćwiczenia wylewamy do odpowiednich pojemników, zgodnie z polece-
niem prowadzącego ćwiczenia.
6. Przepisy BHP
1.
K
ażdy student jest zobowiązany mieć własny fartuch laboratoryjny.
2. W czasie wykonywania ćwiczenia na stole może znajdować się tylko niezbędny sprzęt labora-
toryjny, instrukcja (skrypt) oraz zeszyt laboratoryjny.
3.
P
racować należy ostrożnie i uważnie, nie prowadzić głośnych, rozpraszających uwagę rozmów.
4.
N
ależy ściśle stosować się do instrukcji i zarządzeń osoby prowadzącej ćwiczenia, dotyczących
sposobu wykonywania ćwiczeń. Nie wolno wykonywać eksperymentów i prac nie wchodzących
w zakres ćwiczeń, gdyż mogą one zagrażać bezpieczeństwu.
5.
S
tarannie przestrzegać używania właściwych odczynników. Dokładne odczytanie etykiety na
słoiku lub butelce zmniejsza możliwość pomyłki.
6.
W
szystkie roztwory należy pipetować przy użyciu specjalnej nasadki (pompki do pipet).
7.
O
każdym wypadku, nawet pozornie błahym, jaki zaszedł w pracowni należy natychmiast za-
wiadomić osobę prowadzącą ćwiczenia.
8.
P
oza teren laboratorium nie wolno wynosić żadnych chemikaliów, roztworów i substancji
9.
P
rzed opuszczeniem pracowni należy umyć ręce.
Przepisy porządkowe
1.
W
pracowni mogą przebywać tylko studenci należących do grupy wykonującej ćwiczenia.
Obecność obowiązuje przez cały czas trwania ćwiczeń.
2.
W
pomieszczeniach laboratoryjnych zabronione jest spożywanie posiłków
3.
S
tudenci odrabiający ćwiczenia obowiązani są do noszenia fartucha lub płaszcza ochronnego.
4.
P
racować należy tylko na wyznaczonym miejscu, posługując się chemikaliami i sprzętem labo-
ratoryjnym do niego przydzielonym. Wszystkie braki w odczynnikach i szkle należy zgłaszać
pracownikowi inżynieryjno-technicznemu, który natychmiast je uzupełni.
5.
S
tół laboratoryjny powinien być zawsze czysty i suchy. Rozlane przypadkowo chemikalia na-
leży starannie wytrzeć.
6.
B
utelek i słoików z odczynnikami nie wolno pozostawiać otwartych. Pobranych do ćwiczeń
odczynników nie należy wlewać lub wsypywać z powrotem do butelek czy słoików.

14
7.
Z
auważone uszkodzenie przyrządu lub zestawu aparaturowego należy zgłosić do prowadzą-
cego ćwiczenia.
8. Do mycia naczyń należy używać przygotowane detergenty, wodę wodociągową, a do płukania
już czystych - małej objętości wody destylowanej. Po pobraniu wody destylowanej z butli z
tubusem konieczne jest sprawdzenie, czy ściskacz w gumowej rurce odpływowej jest dobrze
zaciśnięty.
Wyszukiwarka
Podobne podstrony:
Biopaliwo
biopaliwa
Biopaliwa płynne 4
Biopaliwa w polityce ekologicznej Unii Europejskiej
Nowoczesne technologie wytwarzania biopaliw Prof Koltuniewicz
Ogniwa Paliwowe 4, Biopaliwa, Energia, Ogniwa paliwowe
Perspektywy rozwoju polskiego rynku biopaliw wersja finalnau
NOWE TECHNOLOGIE WYTWARZANIA BIOKOMPONENTÓW I BIOPALIW
Biopaliwa unijne i polskie uwarunkowania prawne
Rozwój produkcji biopaliw w UE
biopaliwa drugiej generacji
Biopaliwa hydrogen
BIOPALIWA1
Przemysłowa i przydomowa produkcja biopaliw płynnych
Prezentacja o biopaliwach
11 Biopaliwa
BIOPALIWA II GENERACJI
Biopaliwa płynne
więcej podobnych podstron