
OZNACZANIE PRZYNALEŻNOŚCI SYSTEMATYCZNEJ DROŻDŻY
CELEM ĆWICZENIA JEST ZAPOZNANIE SIĘ Z METODYKA OZNACZANIA
PRZYNALEŻNOŚCI
SYSTEMATYCZNEJ
DROŻDŻY
NA
PODSTAWIE
WŁAŚCIWOŚCI MOROFOLOGICZNYCH, HODOWLANYCH I FIZJOLOGICZNYCH
ORAZ PRZEPROWADZENIE IDENTYFIKACJI BADANEGO SZCZEPU DO RODZAJU.
ZAKRES ĆWICZENIA
-
określenie właściwości morfologicznych badanego szczepu drożdży,
-
scharakteryzowanie sposobu rozmnażania wegetatywnego,
-
scharakteryzowanie sposobu rozmnażania płciowego,
-
określenie cech hodowlanych przy wzroście na podłożu płynnym i stałym, określenie
stałej szybkości radialnego wzrostu kolonii (k
t
),
-
oznaczenie właściwości fizjologicznych badanego szczepu drożdży w zakresie
niezbędnym do określenia rodzaju,
- wpisanie uzyskanych wyników badań do tabeli diagnostycznej i określenie
przynależności badanego szczepu do rodzaju.
INSTRUKCJA
BADANIA MIKROSKOPOWE
I.
Określenie właściwości morfologicznych
1.
Przeprowadzić obserwacje mikroskopowe komórek drożdży stosując
preparaty proste z otrzymanej hodowli. Zaobserwować kształt i sposób
ułożenia komórek.
2.
Wykonać obserwacje mikroskopowe kolonii drożdży celem określenia
zdolności do wytwarzania pseudomycelium i mycelium.
W tym celu wysterylizowane szkiełko podstawowe pokryć cienką warstwą
agaru cebulowego. Po jego zastygnięciu ezą bakteriologiczną o małej średnicy,
umieścić 3 krople zawiesiny w trzech rzędach na powierzchni podłoża.
Hodowle umieścić w jałowych płytkach Petriego, zawierających na dnie
niewielką ilość sterylnej wody. Po 5-dniowej inkubacji w temp. 28
0
C utrwalić
preparat umieszczając hodowle w termostacie o temp. 37
0
C na 1 godz.
Następnie zabarwić 0,5% roztworem błękitu bawełnianego w laktofenolu,
stosując do przemycia preparatu 70% etanol. Wykonać obserwacje
mikroskopowe.
Zaobserwować
budowę
nici
oraz
artrospor,
chlamydospor, blastospor i balistospor.
3.
Scharakteryzować sposób rozmnażania wegetatywnego (pączkowanie,
podział poprzeczny komórek). Obserwacje prowadzić w hodowlach
kropkowych. W tym celu na dno jałowej płytki Petriego nanieść kilka kropel
jałowej brzeczki. Zawiesinę drożdży przenieść ezą do pierwszej kropli, po
wymieszaniu do następnej, i w ten sposób sporządzić „rozcieńczenia” komórek
w brzeczce. Z dwóch ostatnich „rozcieńczeń” pobrać próbkę do
mikroskopowania. Jeżeli w polu widzenia widoczne są pojedyncze, nieliczne
komórki drożdży to należy następnie wykonać obserwacje w komorze

Lindnera. W tym celu na dno komory Lindnera nanieść kroplę jałowej wody,
następnie pobrać materiał z wybranego uprzednio „rozcieńczenia” na szkiełko
nakrywkowe i przykleić je przy pomocy pierścienia wazelinowego do komory.
Obserwacje mikroskopowe wykonywać co 15 min. Zaobserwować sposób
pączkowania komórek lub ich podziału poprzecznego (rozszczepiania).
4.
Scharakteryzować sposób tworzenia zarodników. W tym celu drożdże
zaszczepić na powierzchnię słupka podłoża sporulacyjnego wg Gorodkowej.
Inkubację prowadzić w temp. pokojowej przez 7 – 10 dni. Po okresie inkubacji
wykonać obserwacje mikroskopowe materiału pobranego z hodowli.
Zaobserwować ilość, kształt i ułożenie zarodników wytworzonych w
workach (askospory).
II.
Określenie właściwości hodowlanych
1.
Wzrost na podłożu płynnym. Wykonać posiew badanych szczepów na
brzeczkę słodową (8
0
Blg) w kolbach stożkowych o poj. 100 cm
3
(przy obj.
podłoża 50 cm
3
). Inkubację hodowli prowadzić w temp. 26 – 28
0
C w ciągu 7 –
14 dni. Po okresie inkubacji wykonać obserwacje wzrostu. Zaobserwować
występowanie osadu na dnie podłoża, ocenić obecność gazu, tworzenie się
kożucha, błonki lub pierścienia na powierzchni podłoża.
2.
Wzrost na podłożu stałym. Wykonać posiew badanych szczepów drożdży na
podłoże agarowe z brzeczką umieszczając kroplę zawiesiny na środku
powierzchni podłoża. Inkubację hodowli prowadzić przez 24 godz. W temp.
28
0
C a następnie w czasie dalszych 100 godz. W temp. pokojowej. W celu
zabezpieczenia hodowli przed wysychaniem podłoża zalepić boki płytki
parafilmem. Po 1 dobie oraz 1, 2, 3 i 4 tygodniach inkubacji wykonać
obserwacje makro- i mikroskopowe kolonii z uwzględnieniem kształtu,
zabarwienia, charakterystyki powierzchni, struktury oraz brzegu kolonii.
Obliczyć stałą szybkość radialnego wzrostu kolonii k
t
w mm po 100 godz.
Inkubacji w temp. pokojowej wg wzoru:
k
t
=
( r
t
– r
o
/ t - t
o
) ·100
gdzie: r
o
– średnica kolonii po 24 godz. hodowli (mm)
r
t
– srednica kolonii po 3 tygodniach hodowli (mm)
t – czas inkubacji w godz.
t
o
– 24 godz.
III.
Określenie właściwości fizjologicznych
1.
Określenie zdolności fermentacji cukrów – pozwala na odróżnienie od siebie
poszczególnych gatunków drożdży. Podłożem jest woda drożdżowa z 2%
dodatkiem badanego cukru (glukoza, galaktoza, sacharoza, maltoza i laktoza) i
rurkami Durhama. Jałowe podłoże zaszczepić 0,1 cm
3
zawiesiny drożdży,
inkubację prowadzić w 28
0
C przez 7 dni. Po okresie inkubacji wykonać
obserwacje zmian zaszłych w podłożu. Stwierdzenie zmętnienia oraz
obecności gazu w rurce Durhama świadczy o zdolności badanego szczepu
do fermentacji danego cukru.
2.
Określenie zdolności do asymilacji cukrów. Wykonać posiew 1 cm
3
zawiesiny komórek badanego szczepu drożdży na dno sterylnej płytki

Petriego. Następnie zalać oziębioną do ok. 40
0
C pożywką agarową. Delikatnie
wymieszać, pozostawić do zastygnięcia. Następnie na powierzchnię podłoża
nanieść krążki jałowej bibuły filtracyjnej nasączonej 10% jałowym roztworem
badanych cukrów. Odwrócone wieczkiem na dół płytki inkubować w temp.
28
0
C w ciągu 2-3 dni. Po okresie inkubacji wykonać obserwacje wzrostu. Za
wynik dodatni doświadczenia przyjąć obecność wzrostu drożdży wokół
krążka bibuły nasyconej roztworem badanego cukru.
3.
Określenie zdolności asymilacji związków azotowych. Zawiesinę drożdży (1
cm
3
) w jałowej płytce Petriego zalać pożywką agarową o składzie:
-
woda destylowana,
-
glukoza - 2%,
-
KH
2
PO
4
– 0,1%,
-
MgSO
4
– 0,05%.
Po delikatnym wymieszaniu i zestaleniu się pożywki nakroplić roztwory
peptonu, NaNO
3
, (NH
4
)
2
SO
4
, asparaginy i mocznika. Po hodowli, w
miejscach asymilacji danego związku widoczne są strefy wzrostu drożdży.
4.
Określenie zdolności do wytwarzania ureazy. Wykonać posiew 0,1 cm
3
zawiesiny komórek badanego szczepu drożdży na podłoże płynne z
mocznikiem i czerwienią fenolową. Hodowle inkubować w temp. 28
0
C w
ciągu 3 dni. Po okresie inkubacji wykonać obserwacje makroskopowe
hodowli. Za wynik dodatni oznaczenia (wytwarzanie ureazy) uznaje się
zmianę zabarwienia podłoża na kolor karminowoczerwony, spowodowany
zmianą odczynu pH na skutek wytwarzania amoniaku.
5.
Określenie zdolności do wytwarzania barwnika. Zdolność do wytwarzania
barwnika określić podczas hodowli badanego szczepu na podłożach stałych,
głównie na podłożu agarowym, na brzeczce. Zaobserwować i opisać
zabarwienie kolonii. Określić rodzaj wytwarzanych barwników.
Drożdże wykazują na ogół zabarwienie kolonii białe lub kremowe. Przy wytwarzaniu
barwników
karotenoidowych
zabarwienie
kolonii
może
być
jasnoczerwone,
karminowoczerwone lub ciemnoczerwone, niekiedy żółte, pomarańczowe lub różowe.
Barwniki te wytwarzane są w procesie biosyntezy adeniny. Wytwarzanie barwników żółtych
związane jest ze zdolnością syntetyzowania ryboflawiny. Czarne zabarwienie kolonii
związane jest z wytwarzaniem barwników melaninowych powstających z udziałem oksydaz
polifenolowych.
OBSERWACJE I WYIKI WYKONNYCH OZNCZEŃ UMIEŚCIC W TABELI 1.
Na podstawie uzyskanych danych określić przynależność systematyczną badanych
drożdży.
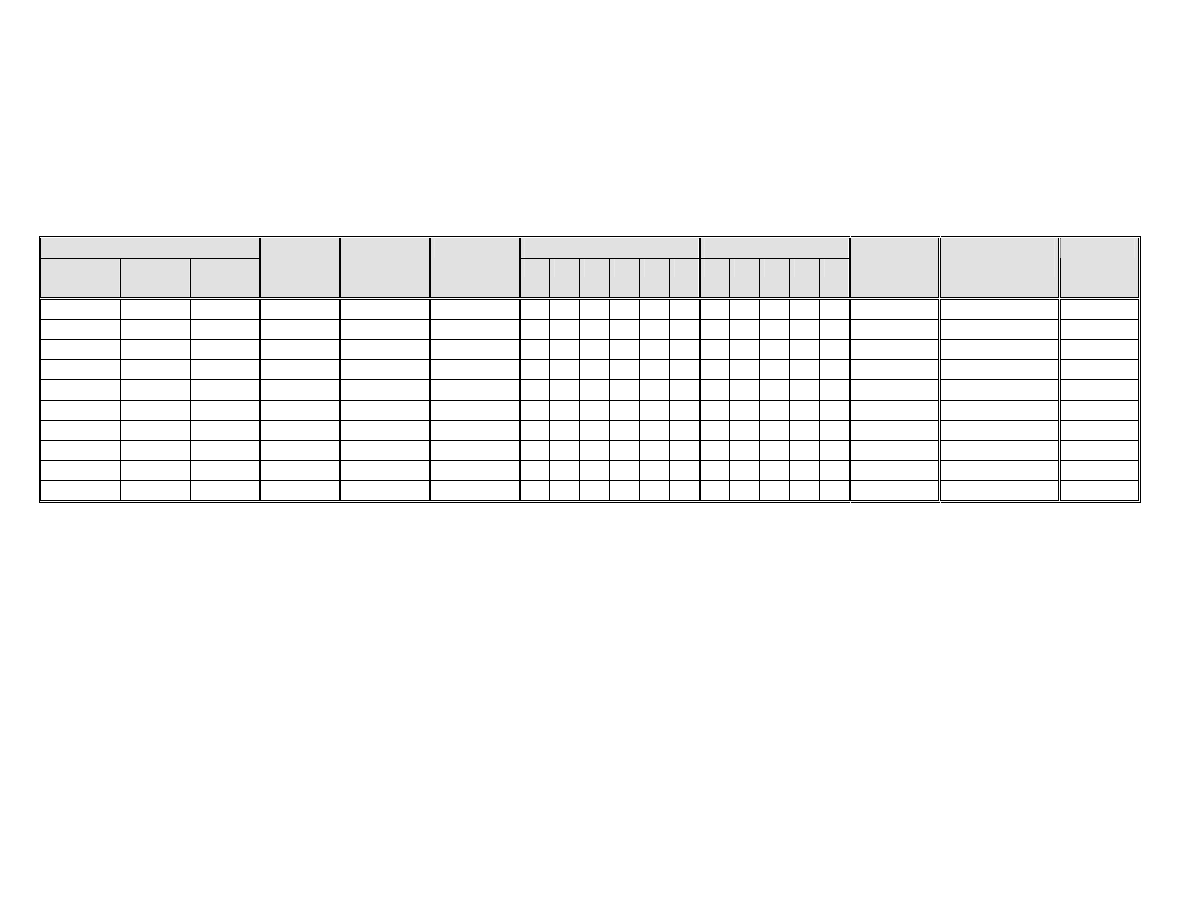
Tabela 1.
Właściwości morfologiczne, hodowlane i fizjologiczne wybranych gatunków drożdży.
Rozmnażanie wegetatywne
Fermentacja cukrów
Asymilacja cukrów
Pseudo
grzybnia
Pączko
wanie
Podział
Kształt
komórek
Kształt
i
liczba
zarodników
Kożuszek
G Ga L M S
R G Ga L M S
Asymilacja
azotanów
Gatunek
drożdży
Klasa
G – glukoza
Ga – galaktoza
L – laktoza
M – maltoza
S – sacharoza
R - rafinoza
Wyszukiwarka
Podobne podstrony:
Oznaczanie przynależności systematycznej drożdży
System oznaczeń elementów półprzewodnikowych, Elektronika, Różne
System oznaczeń układów scalonych polskiej produkcji
ekologia, Temat 8, Rolnictwo ekologiczne (biologiczne, organiczne lub biodynamiczne) oznacza system
OznaczeniaRezystor, Studia, Teoria obwodów i systemów, Ćwiczenia
system f3w+oceny+zgodno 9cci+wyrob f3w+budowlanych+oraz+sposobu+ich+oznaczania+znakowaniem+ce exseg
System oznaczeń elementów półprzewodnikowych
7. Oznaczanie pH-met.Helliga, GLEBOZNAWSTWO, SYSTEMATYKA
10. Oznaczanie CaCO3-met.Scheiblera, GLEBOZNAWSTWO, SYSTEMATYKA
4. Oznacz.składu granulometr.-met.areometryczna, GLEBOZNAWSTWO, SYSTEMATYKA
Systematyka do oznaczania makrofauny wód śródlądowych, Hydrobiologia
Oznaczenia obiektywów Canona dla systemu EOS, Foto-Informacje
8. Oznaczanie pH-met.potencjometr, GLEBOZNAWSTWO, SYSTEMATYKA
systemy oznaczania zebów, higienistka stomatologiczna
Oznaczanie zawartości substancji tłuszczowych, - dietetyka, HACCP -, systemy zarzadzania jakoscia
9. Oznaczanie CaCO3-met.polowa, GLEBOZNAWSTWO, SYSTEMATYKA
11. OZNACZ. Hh, GLEBOZNAWSTWO, SYSTEMATYKA
więcej podobnych podstron