
Ć W I C Z E N I E Nr 36
OZNACZANIE WSPÓŁCZYNNIKA PODZIAŁU ACETONU
POMIĘDZY TOLUEN I WODĘ METODĄ REFRAKTOMETRYCZNĄ
Cel ćwiczenia: wyznaczenie współczynnika podziału acetonu pomiędzy dwie
fazy, wodną i organiczną.
Rozpatrzmy ciekły układ trójskładnikowy, złożony z dwóch składników
ciekłych,
α i β, o ograniczonej rozpuszczalności wzajemnej oraz trzeciego składnika
A, którym może być ciało stałe, ciecz lub gaz, który dobrze rozpuszcza się w obu
cieczach. W stałej temperaturze i pod stałym ciśnieniem, ustala się równowaga
dwóch faz ciekłych, którymi są roztwory składnika A w ciekłej fazie
α i ciekłej fazieβ.
Warunkiem równowagi jest równość potencjałów chemicznych każdego składnika w
obu fazach. Dla składnika A można napisać następującą równość:
β
α
μ
=
μ
)
(
)
(
A
A
w której (
μ
A
)
α
oraz (
μ
A
)
β
oznaczają potencjały chemiczne tego składnika w każdej z
faz. Uzależniając potencjał chemiczny składnika od jego aktywności
termodynamicznej można napisać równanie:
β
β
⊗
α
α
⊗
+
μ
=
+
μ
)
a
ln(
RT
)
(
)
a
ln(
RT
)
(
A
A
A
A
które można przekształcić do zależności:
RT
)
(
)
(
)
a
(
)
a
(
ln
A
A
A
A
α
⊗
β
⊗
β
α
μ
−
μ
=
(a
A
)
α
i (a
A
)
β
oznaczają aktywność termodynamiczną składnika A w fazach
α oraz β.
(
μ
A
⊗
)
α
oraz (
μ
A
⊗
)
β
oznaczają standardowe potencjały chemiczne składnika A
odpowiednio w fazach
α oraz β. W stałej temperaturze i pod stałym ciśnieniem
wyrażenie po prawej stronie powyższego równania jest wielkością stałą, co pozwala
przekształcić to równanie do następującej postaci:
const
k
)
a
(
)
a
(
A
A
=
=
β
α
Jeżeli stężenia składnika A w obu są niewielkie można przyjąć, iż współczynniki
aktywności termodynamicznej składnika A w obu fazach, (
γ
A
)
α
oraz (
γ
A
)
β
są bliskie
jedności, co pozwala zastąpić aktywności termodynamiczne składnika (a
A
)
α
i (a
A
)
β
,
ułamkami molowymi tego składnika, odpowiednio (x
A
)
α
i (x
A
)
β
:
β
α
β
α
β
α
≅
γ
γ
≡
=
)
x
(
)
x
(
)
x
(
)
x
(
)
a
(
)
a
(
k
A
A
A
A
A
A
A
W roztworze rozcieńczonym liczba moli składnika A jest znacznie mniejsza od liczby
moli rozpuszczalnika:
rozp
A
rozp
A
A
A
n
n
n
n
n
x
≅
+
=
natomiast objętość roztworu rozcieńczonego jest praktycznie równa objętości
rozpuszczalnika, co pozwala napisać następującą zależność określającą stężenie
molowe składnika w roztworze:
0
rozp
rozp
A
rozp
A
rozt
A
A
V
n
n
V
n
V
n
c
≡
≅
=
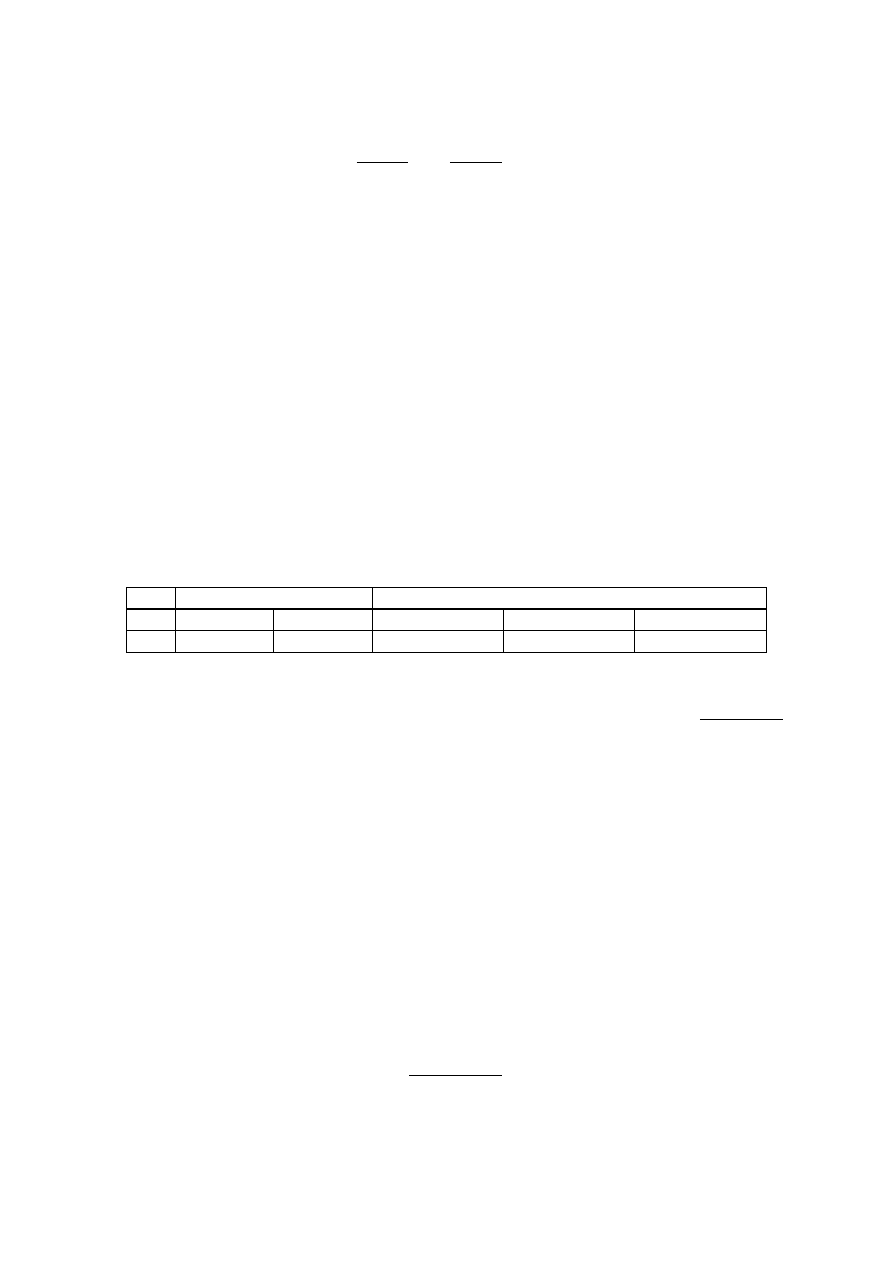
Uwzględniając powyższe zależności otrzymujemy równanie:
K
)
V
(
)
V
(
k
)
c
(
)
c
(
0
0
A
A
≡
⋅
=
α
β
β
α
z którego wynika, że w dostatecznie rozcieńczonych roztworach stosunek stężeń
składnika w dwóch współistniejących fazach ciekłych, zwany współczynnikiem
podziału, jest stały i niezależny od stężenia.
Wykonanie ćwiczenia
1. W suchych kolbkach przygotować kolejno roztwory acetonu w toluenie, około
10 ml, o stężeniach podanych przez asystenta. Uwaga! Aceton jest bardzo
lotny i dlatego nie należy pozostawiać przygotowanych roztworów w otwartych
kolbkach.
2. Odpipetować po 5 ml każdego roztworu do kolbki o pojemności 25 ml, dodać 5
ml wody, szczelnie zakorkować kolbkę, a przygotowany układ dokładnie
wytrząsnąć i pozostawić na kilkanaście minut do rozdzielenia faz.
3. Z pozostałego wyjściowego roztworu acetonu w toluenie pobrać suchą pipetką
około 1ml i oznaczyć współczynnik załamania światła (n)
pocz
.
4. Po rozwarstwieniu faz pobrać ostrożnie, suchą pipetką, około 1 ml roztworu
acetonu w toluenie, z warstwy górnej, i oznaczyć współczynnik załamania
światła (n)
rów
.
5. Wyniki pomiarów zestawić w tabelce:
Lp. Roztwór
wyjściowy Roztwory
równowagowe
n (C
0
)
T
n (C)
T
(C)
W
Opracowanie wyników
1. Stężenie acetonu w toluenie można obliczyć z zależności:
0104
0
49623
1
,
n
,
C
−
=
wyznaczonej na podstawie kalibracji, w której c jest stężeniem acetonu, w
mol/dm
3
, n jest współczynnikiem załamania światła.
2. Wykorzystując wartości współczynników załamania światła zmierzone dla
roztworu wyjściowego i w stanie równowagi, obliczyć stężenia acetonu w
toluenie: początkowe (C
0
)
T
i w stanie równowagi (C)
T
.
3. Ponieważ objętości obu faz, toluenowej i wodnej, są jednakowe,
równowagowe stężenie acetonu w fazie wodnej (C)
W
jest równe:
.
T
T
0
w
)
c
(
)
c
(
)
c
(
−
=
4. Zależność stężenia acetonu w toluenie (C)
T
od stężenia acetonu w wodzie
(C)
W
przedstawić na wykresie.
5. Obliczyć współczynnik kierunkowy prostej, przechodzącej przez początek
układu, który jest równy współczynnikowi podziału K.
6
6
.
.
Obliczenia wykonać albo za pomocą arkusza kalkulacyjnego, albo metodą
najmniejszych kwadratów:
2
W
k
1
i
W
T
k
1
i
)
C
(
C
C
K
=
=
Σ
⋅
Σ
=
Document Outline
Wyszukiwarka
Podobne podstrony:
Ćwiczenie 36, Ćwiczenie 36
Ćwiczenie 36 Patrycja, laboratorium chemia fizyczna
Wyniki ćwiczenia 36
ĆWICZENIA PORANNE MAC (36), ZESTAWY ĆWICZEŃ PORANNYCH MAC
Ćwiczenie nr 36, sprawozdania, Fizyka - Labolatoria, Ćwiczenie nr36
36 z, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr36
Plan cwiczenV r zima 2013 id 36 Nieznany
36 Zestaw zabaw ruchowych, zabawy i ćwiczenia gimnastyczne
Pytanie 5 7 30 i 36, st. Pedagogika ćwiczenia, pedagogika U P tematy do egzaminów 46 tematów
PlanPrezentacji cwiczenia id 36 Nieznany
36. Ćwiczenia kształtujące siłę mm RR, Gimnastyka1
36 cwiczenia 11
Odpowiedzi do ćwiczeń z lekcji 33 36
Ćwiczenie nr 36
3 ćwiczenia BADANIE asfaltów
więcej podobnych podstron