
Zakład Technologii Chemicznej
Wydział Chemii Uniwersytetu Warszawskiego
Ćwiczenie: Identyfikacja odpadów polimerowych
Źródło:
http://www.prb-net.qub.ac.uk/contamL/Lecture%202.ppt
Opracował: dr hab. inż. Andrzej Kaim

2
Tytuł ćwiczenia: Identyfikacja odpadów polimerowych
Cel ćwiczenia: Ponowne wykorzystanie odpadów z tworzyw sztucznych (recykling) wymaga zwykle
ich wcześniejszego rozdzielenia (sortowania). W tym celu niezbędna jest identyfikacja polimerów
składających się na te odpady. Celem ćwiczenia jest zapoznanie studentów z prostymi laboratoryjnymi
metodami identyfikacji polimerów użytych do wytworzenia badanych tworzyw sztucznych.
Wprowadzenie
Tworzywa sztuczne są dzisiaj w powszechnym zastosowaniu. Opanowały bowiem niemal wszystkie dziedziny
gospodarki i życia codziennego. Stało się to możliwe przede wszystkim dzięki takim zaletom tworzyw
sztucznych jak: mały ciężar właściwy (lekkość tworzywa), wysoka odporność na działanie czynników
chemicznych, łatwość przetwórstwa i barwienia oraz estetyczny wygląd. Produkcja przedmiotów codziennego
użytku, urządzeń, konstrukcji i opakowań z tworzyw sztucznych jest obecnie jedna z najszybciej rozwijających
się dziedzin gospodarki. Rozwój nowych technologii i nowych materiałów prowadzi do wyrobów nowej
generacji. Powoduje to szybkie „starzenie” tych wyrobów, które staja się w ten sposób uciążliwym odpadem.
Tym sposobem rocznie powstaje przykładowo w Europie Zachodniej ok. 20 mln ton odpadów z tworzyw
sztucznych. W USA w roku 2000 powstało ok. 16 mln ton tego rodzaju odpadów. W Polsce na składowiska
odpadów trafia rocznie ok. 0,8 mln ton z tworzyw sztucznych. W samej Warszawie statystyczny mieszkaniec
wytwarza dziennie ok. 1 kg odpadów komunalnych, z czego ok. 15% to odpady z tworzyw sztucznych.
Problem ten będzie narastał. Przykładowo, w branży urządzeń elektrycznych i elektronicznych prognozy
przewidują 16-28% wzrost odpadów tego typu
1
. Czas użytkowania komputerów i podobnego sprzętu wydłużył
się z 10 lot w latach 80-tych do 4,3 roku obecnie
2
. Najbardziej rozpowszechnionym sposobem usuwania
odpadów z tworzyw sztucznych, zarówno w Polsce, jaki i w krajach europejskich, jest ich składowanie (ok.
70%). Reszta jest utylizowana w procesach recyklingowych lub spalana bez odzysku energii.
3
Paradoksalnie,
zalety, jakie tworzywa posiadają w okresie swego użytkowania (duża odporność mechaniczna, chemiczna i
biologiczna), zamieniają się w bardzo poważne wady w momencie ich składowania. Tworzywa sztuczne mogą
nie ulegać rozkładowi przez wiele lat, a rozkładając się mogą stanowić źródło skażenia środowiska przez długi,
choć często trudny do ocenienia, okres. Związane jest to z faktem, że tworzywa sztuczne mogą zawierać
zarówno pierwiastki ciężkie jak i szkodliwe dla zdrowia dodatki nieorganiczne i organiczne, które w okresie
składowania uwalniane są do otocznia.
Ograniczona powierzchnia składowiska odpadów i coraz większe koszty składowania sprawiają, że, tak ze
względu technologicznych jak i ekonomicznych, muszą być rozwijane inne kierunki utylizacji odpadów z
tworzyw sztucznych. Poza oczywistym faktem, że rozwój nowych technik wytwórczych, produkcja materiałów
coraz mniej szkodliwych dla środowiska, rozwój biotechnologii pomogą zapewne w rozwiązaniu problemu
odpadów dużego znaczenia nabiera traktowanie odpadów z tworzyw sztucznych jako surowców wtórnych
ponowne ich wykorzystanie w jednym z rodzajów recyklingu: materiałowego, surowcowego lub
energetycznego. Odpady z tworzyw sztucznych, zanim zostaną ponownie zagospodarowane wg jednej z
powyższych metod, muszą być zebrane i, co najtrudniejsze, posortowane. Najważniejszymi kryteriami
przydatności metod identyfikacji materiałów polimerowych odpadach są: prosta technika badania, duża
szybkość detekcji i duża niezawodność. Wyczerpujący opis metod identyfikacji omawianych materiałów można
znaleźć w literaturze
3
. Schematy postępowania przy identyfikacji tworzyw sztucznych są zwykle dość podobne
do siebie. Pełna procedura identyfikacyjna wymaga określenia wielu cecha charakterystycznych materiału
polimerowego i obejmuje następujące rodzaje badań:
- metody analityczne (spektrometria absorpcyjna w podczerwieni niekiedy dodatkowo z detektorem
fonoakustycznym dla identyfikacji materiału, spektroskopia UV/VIS, analiza jakościowa i ilościowa zarówno
matrycy polimerowej jak i (po oddzieleniu) napełniaczy, zawartość węgla, zawartość wilgoci wg Karla Fischera,
badanie starzenia polimeru,
• testy wytrzymałości mechanicznej na różnego rodzaju odkształcenia (przykładowo: rozciąganie,
ściskanie, zginanie, odporność na uderzenia). W innych badaniach oznacza się takie cechy jak
tworzywa jak twardość określana w kilku rodzajach testów i odporność na ścieranie,
• badania własności elektrycznych (np. oznacza się stałą dielektryczna, stratność dielektryczną, ładunek
powierzchniowy),
1
Materiały Krajowej Konferencji Naukowo-Technicznej „Ekologia w elektronice”, Warszawa, 16-17.2000
2
Projekt Dyrektywy dot. Odpadów z urządzeń elektrycznych, Materiały Unii Europejskie, Bruksela 13.06.00.
3
A. Błędzki, Recykling materiałów polimerowych, WNT, Warszawa, 1997

3
• badania własności termicznych (różnicowa analiza termiczna (DSC), analiza termograwimetryczna
(TGA), analiza termomechaniczna (TMA), oznaczenie współczynnika rozszerzalności cieplnej,
temperatury topnienia, zeszklenia, temperatury Vicata, badanie palności),
• badania własności reologicznych (oznaczanie wg różnych metod lepkości stopu polimerowego),
• optycznych (pomiary kolorymetryczne, , pomiar absorpcji i transmisji promieniowania ultrafioletowego
i widzialnego, współczynnik załamania światła, współczynniki mętnienia i żółknięcia)
Zainteresowani bardziej szczegółowym opisem takiego schematu mogą zapoznać się z jego przykładem
opracowanym przez firmę
CONSULTEK (USA
)
http://www.consultekusa.com/consultekplasticidchart.pdf
Zadaniem w niniejszym ćwiczeniu jest zidentyfikowanie wskazanego przez prowadzącego ćwiczenia odpadu
polimeru stosując metody określone w ćwiczeniu. Należy przy tym zaznaczyć, że w praktyce celem badań
identyfikacyjnych jest określenie typu polimeru stanowiącego z reguły główny składnik analizowanego
tworzywa. Oprócz polimeru tworzywo zwykle zawierają bowiem jeden lub większą liczbę dodatków takich jak:
• dodatki uszlachetniające, np. barwniki, utwardzacze, inhibitory, plastyfikatory, zmiękczacze,
aktywatory, przeciwutleniacze itp.
• napełniacze, np. sadza, grafit, talk, skaleń, mika, kaolin, ziemia okrzemkowa itp.
• środki wzmacniające, np. włókna, tkaniny lub maty szklane lub z włókien sztucznych (np.
aramidowych), włókna węglowe, węglik krzemu i in.,
• środki poprawiające mieszalność tworzyw, są one często przydatne przy recyklingu odzyskanych
surowców polimerowych
Podczas identyfikacji tworzyw sztucznych prowadzonych w laboratoriach badawczych identyfikację rozpoczyna
się od niekiedy dość trudnego etapu polegającego na wydzieleniu polimeru i oczyszczenie go z możliwie
wszystkich wymienionych wyżej dodatków.
W ćwiczeniu zakładamy (z dużą dokładnością), że mamy do czynienia z czystymi próbkami polimerów.
Identyfikację odpadu polimerowego należy dokonać wykorzystując następujące metody:
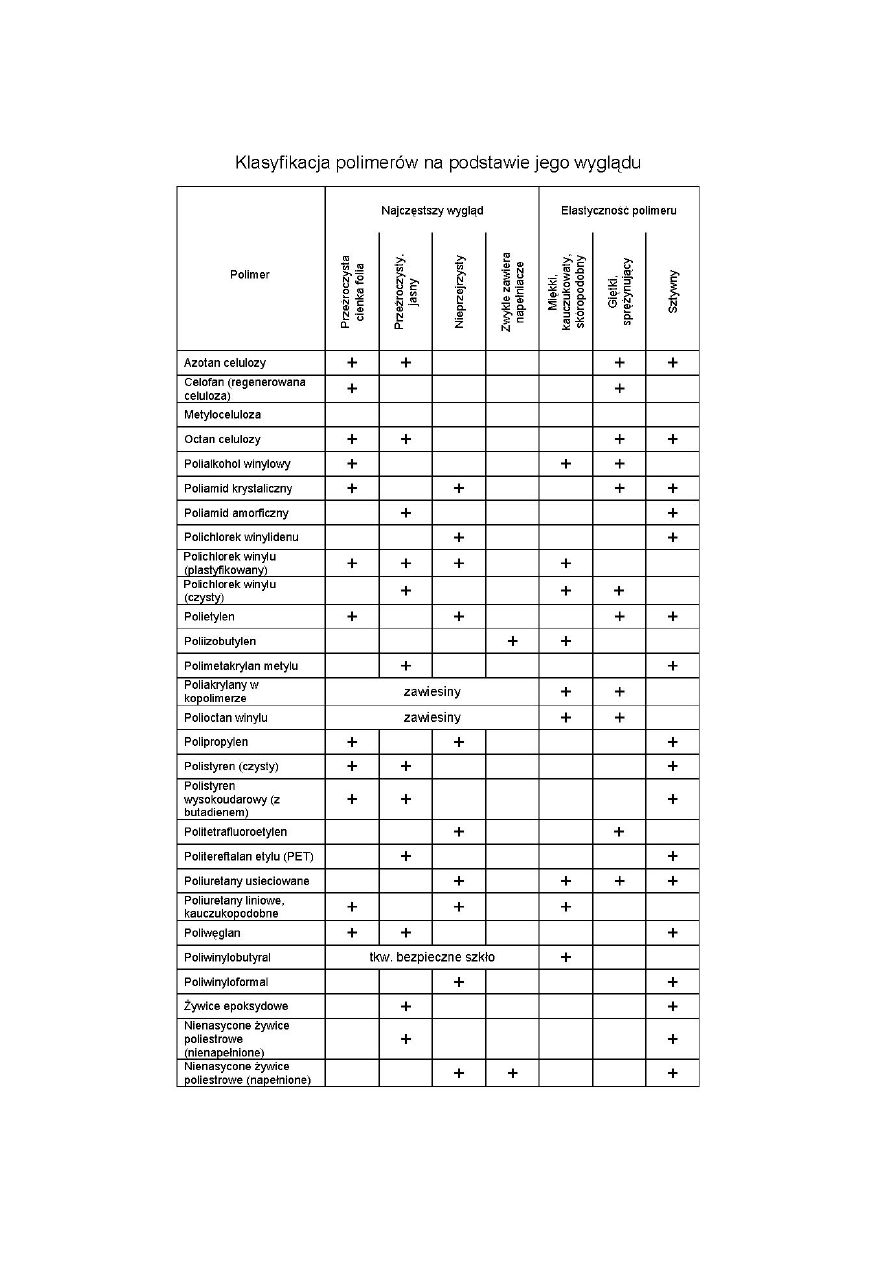
1. Ocena wizualna podstawowych własności mechanicznych i fizycznych polimeru takich jak
giętkość, twardość, rodzaj powierzchni itp.,
2. Określenie typu polimeru na podstawie jego gęstości,
3. Określenie typu polimeru na podstawie jego rozpuszczalności,
4. Ocena zachowania się próbki w płomieniu,
5. Reakcja Liebermana – Storach – Morawskiego,
6. Analiza widma absorpcyjnego w podczerwieni.
4
Ad. 1: Ocena wizualna podstawowych własności mechanicznych i fizycznych polimeru takich jak:
giętkość, twardość, wygląd rodzaj powierzchni

5
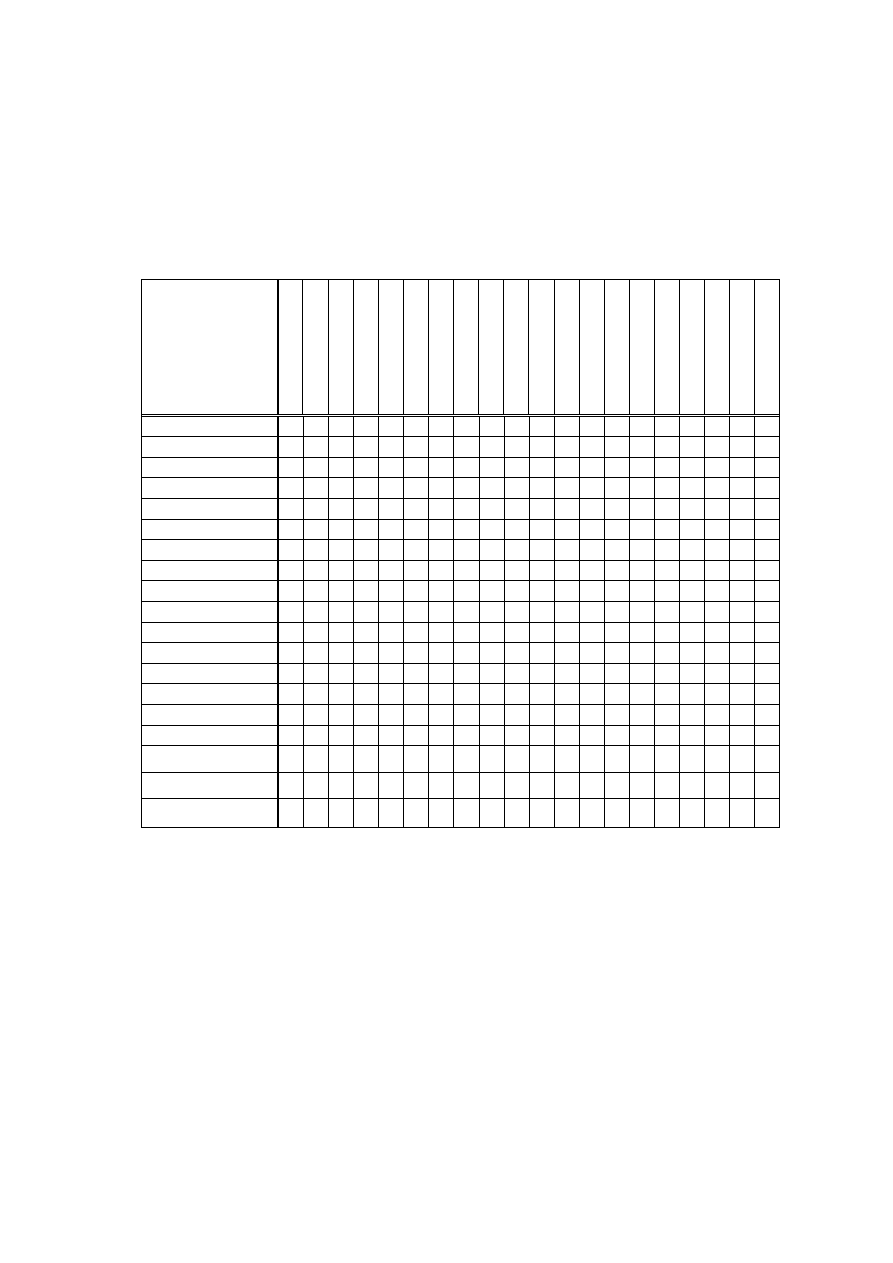
Ad. 2: Określenie typu polimeru na podstawie jego gęstości
W laboratoriach przemysłowych oznaczenie gęstości polimeru (tworzywa) wykonuje się wg odpowiednich
norm (np. ASTM D792, ISO 1183), często przy pomocy tzw. wagi Mettlera.
W naszym ćwiczeniu gęstość tworzywa (polimeru) oznaczymy obserwując zachowanie się próbki w kilku
roztworach o znanych gęstościach.
Wykonanie:
Przygotować po 100 ml roztworów o podanych poniżej gęstościach d:
Roztwory etanol/woda:
• 52% etanol (d = 0.911),
• 38% etanol (d = 0.9408),
• 24% etanol (d = 0.9549).
Roztwory CaCl
2
/woda:
• 6% CaCl
2
(d = 1.0505),
• 32% CaCl
2
(d = 1.3059),
• 40% CaCl
2
(d = 1.3982).
Roztwór ZnCl
2
/woda:
• nasycony (d = 2.01)
Mały kawałek próbki polimeru umieścić w zlewce kolejno wypełnionej przygotowanymi uprzednio
roztworami.
Proszę zaobserwować zanotować jak zachowuje się próbka polimeru w kolejnych roztworach, tj., w których
roztworach próbka pływa, a w których tonie.
Klasyfikacja polimerów na podstawie gęstości
Gęstość,
[g/cm
3
]
Nazwa polimeru
Gęstość,
[g/cm
3
]
Nazwa polimeru
< 1
Polistyren spieniony
1.17-1.20
Polioctan winylu
0.80
Kauczuk silikonowy ( w
zależności od napełnienia, np.
krzemionką do 1.25)
1.18-1.24
Propionian celulozy
0.83
Polimetylopenten
1.19-1.35
Zmiękczony (plastyfikowany) PCW (ok. 40%
plastyfikatora)
0.85-0.92
Polipropylen
1.20-1.22
Poliwęglan (z bisfenolu A)
0.89-0.93
Polietylen wysokociśnieniowy
(LD)
1.20-1.26
Usieciowane poliuretany
0.91-0.92
Polibuten-1 1.26-1.28
Żywice fenolowo-formaldehydowe (nienapełnione)
0.91-0.93
Poliizobutylen 1.21-1.31
Polialkohol winylowy
0.92-1.0
Kauczuk naturalny
1.25-1.35
Octan celulozy
0.94-0.98
Polietylen niskociśnieniowy
(HD)
1.30-1.41
Żywice fenolowo-formaldehydowe (napełnione
napełniaczami organicznymi)
1.01-1.04
Nylon 12 (poliamid 12)
1.3-1.4
Polifluorek winylu
1.03-1.05
Nylon 11 (poliamid 11)
1.34-1.40
Celuloid
1.04-1.06
Kopolimer akrylonitryl-
butadien-styren (ABS)
1.38-1.41
Poli(tereftalan etylenu)
1.04-1.08
Polistyren
1.38-1.41
Twardy PCW

6
1.05-1.07
Polioksyfenylen
1.41-1.43
Polioksymetylen (poliformaldehyd)
1.06-1.10
Kopolimer styren-akrylonitryl
1.47-1.52
Żywice mocznikowe napełniaczami melaminowo-
formaldehydowe (napełnione napełniaczami
organicznymi)
1.07-1.09
Nylon 6,10 (poliamid 6,10)
1.47-1.55
Chlorowany PCW
1.12-1,15
Nylon 6 (polikaprolaktam)
1.5-2.0
Fenoplasty i aminoplasty
napełnione napełniaczami organicznymi
1.13-1.16
Nylon 6,6 (poliamid 6,6)
1.7–1.8
Polifluorek winylidenu
1.1-1.4
Żywice epoksydowe,
nienasycone żywice
poliestrowe
1.5-2.9
Żywice poliestrowe i epoksydowe napełnione
włóknem szklanym
1.14-1.17
Poliakrylonitryl
1.86-1.88
Polichlorek winylidenu
1.15-1.25
Acetomaślan celulozy
2.1-2.2
Politrifluoromonochloroetylen
1.16-1.20
Polimetakrylan metylu
2.1-2.3
Politetrafluoroetylen
7
Ad. 3: Określenie typu polimeru na podstawie jego rozpuszczalności
Mały kawałek próbki polimeru (ok. 100 mg) umieścić w probówce napełnionej w jednej trzeciej
rozpuszczalnikiem i pozostawić do końca ćwiczeń od czasu do czasu wstrząsając. Pod koniec zajęć ocenić
wygląd próbki (bez zmian, pęcznienie, rozpuszczanie).Wynik porównać z tabelą rozpuszczalności polimerów.
Należy pamiętać, że rozpuszczalność danego polimeru w określonym rozpuszczalniku może zmieniać się w
zależności od masy cząsteczkowej, rozgałęzień i stopnia krystaliczności. Ze wzrostem masy cząsteczkowej oraz
stopnia krystaliczności zmniejsza się rozpuszczalność.
Polimer
Woda
Ac
e
ton
Oc
tan
ety
lu
D
ioks
an
B
enz
en
D
ichl
o
ro
et
yle
n
Pi
ry
dy
na
Ch
lo
ro
fo
rm
K
w
as o
ctow
y
Kwa
s mr
ó
w
ko
wy
Kwa
s so
lny
K
w
as si
ar
kow
y
n
-bu
ta
no
l
Oc
tan
me
ty
lu
Oc
tan
bu
ty
lu
Chlor
e
k met
ylu
E
ter ety
low
y
A
lkoh
o
l et
ylow
y
Cy
kl
oh
ek
sa
no
l
T
e
tra
chl
or
ek
w
ę
gla
Octan celulozy
- + + + - - + - + -
- + + - - - + -
Polialkohol winylowy
+ - - - - - - -
- -
- - - - - -
Poliakrylany
- + + +
- +
Poliamid
- - - - - - - - + + +
- - - - - -
Polichlorek winylidenu
- - - c - - g
-
- -
- -
Polichlorek winylu
- - - + - + - + - -
- -
- p - - + +
Polietylen
- - - - g - g g - - -
- -
- - - - - g
Poliizobutylen
- - - - - - -
- - -
- -
p -
Polimetakrylan metylu
- + + + + + +
+
+ c + - - + -
Polioctan winylu
- + + + + + + + +
+ + + + p + + +
Polipropylen
- - - - - -
- - -
- - -
- - - - - -
Polistyren
- p p + + + g + - - -
- + + + p - - +
Politetrafluoroetylen
- - - - - - - -
-
-
- - -
Poliuretany
- - - - - - - + + -
- - -
Poliwinylobutyral
- c +
g +
+
g c + + - +
Poliwinyloformal
- c +
+ +
+
- c c -
Ż.fenolowo-
formaldehydowa
- + - - - - + +
+
+ +
Ż.melaminowo-
formaldehydowa
- - - - g - +
- - - - -
Ż.mocznikowo-
formaldehydowa
- - - - - g - + -
- - - -
(+) - rozpuszczalny
(-) - nierozpuszczalny
(c) - częściowo rozpuszczalny
(g) - rozpuszczalny na gorąco
(p) - pęcznieje
Ad. 4: Ocena zachowania się próbki w płomieniu
Próbkę należy umieścić na łopatce i wprowadzić do części ostrej, tj. nieświecącej płomienia palnika
gazowego tak, aby próbka zanurzona była w płomieniu. Można też zastosować pęsetą i wprowadzić próbkę
wprost do płomienia. Należy obserwować zjawiska zachodzące w bezpośrednim kontakcie z płomieniem,
jak i po wyjęciu próbki.
Jeżeli próbka się pali płomień należy zdmuchnąć. W czasie analizy notuje się:
• stopień łatwopalności
• stwierdzenie, czy próbka gaśnie po wyjęciu z płomienia czy też nie

8
• rodzaj płomienia (świecący, kopcący)
• barwę płomienia i układ barw (np. barwna obwódka)
• zmiany wyglądu tworzywa pod wpływem płomienia (topienie się tworzywa, zwęglanie, tworzenie
się pęcherzy, itp.)
• zapach gazów wydzielających się podczas palenia
Uwaga:
Próbkę należy ogrzewać wolno. Jeśli płomień będzie zbyt duży rozkład odbędzie się za szybko, by
zaobserwować zachodzące zjawiska.
Wyniki obserwacji:
Polimer nie pali się:
a. żarzy się w płomieniu – kauczuk silikonowy lub poliimidy
b. żarzy się w płomieniu, pozostają resztki wypełniacza (np. włókna) – laminaty napełnione azbestem lub
innym napełniaczem nieorganicznym
c. żarzy się w płomieniu, niebiesko-zielony koniec płomienia, nie zwęgla się – politetrafluoroetylen lub
polimery pochodne zawierające chlor,
d. próbka zachowuje swój kształt, we wszystkich przypadkach czuje się zapach formaldehydu
- brak innego zapachu – żywica mocznikowo-formaldehydowa.
- silny rybi zapach – żywica melaminowo-formaldehydowa.
- zapach formaldehydu i fenolu – żywica fenolowo-formaldehydowa.
Polimer pali się w płomieniu, ale po wyjęciu z płomienia gaśnie.
1. Płomień jasny, żółtawy lub bez wyraźnego zabarwienia, kopcący tworzywo tworzy pęcherze –
poliwęglan lub, nieutwardzone żywice fenolowe lub formaldehydowe
2. Płomień ma żółto-zielone zabarwienie:
a.
zapach palonej gumy,
- zielona obwódka – chlorowany kauczuk,
- zielona obwódka otoczona żółtą – neopren,
b. nie zapala się, polimer zmienia kolor na żółtą, potem na brunatnoczerwoną, a w końcu czarną, ostry
zapach (HCl)– polichlorek winylu i jego pochodne,
c. zapach
słodki, czarny popiół – polichlorek winylidenu
d. zapach spalonego mleka – kazeina.
Polimer pali się po wyjęciu z płomienia. Obserwuje się płomień podczas pierwszych sekund palenia.
1. Palenie bardzo gwałtowne z intensywnym płomieniem.
a. zapach kamfory – azotan celulozy plastyfikowany (zmiękczony).
b. brak zapachu kamfory – azotan celulozy
c. zapach octu i palonego papieru, żółtawy, kapie – octan celulozy
2. Jasny płomień głównie niebieski z małym białym końcem,
a. bardzo słodki owocowy zapach, trzaski, kapiące krople – metakrylany,
b. trudny do zapalenia, zapach przypomina palone włosy, lub róg, płomień biały, później
niebieskawo-żółty, trzeszczy, ciągnące się (niekiedy pieniące) krople – poliamid,
c. słaby słodki zapach – poliwinyloformal,
d. zapach zjełczałego masła,
e płomień iskrzący – octanomaślan celulozy,
f brak iskier – poliwinylobutyral.
3. Płomień otoczony przez czerwoną obwódkę, iskrzy, zapach kwasu octowego – poliwinyloacetal.
4. Płomień żółty,
a. zapach kwasu masłowego – octanomaślan celulozy,
b. zapach słodki, kwiatowy (hiacyntów), płomień, niekiedy żółto-pomarańczowy, silnie kopcący,
błyskający – polistyren,
c.
słaby słodki zapach – poliwinyloformal,
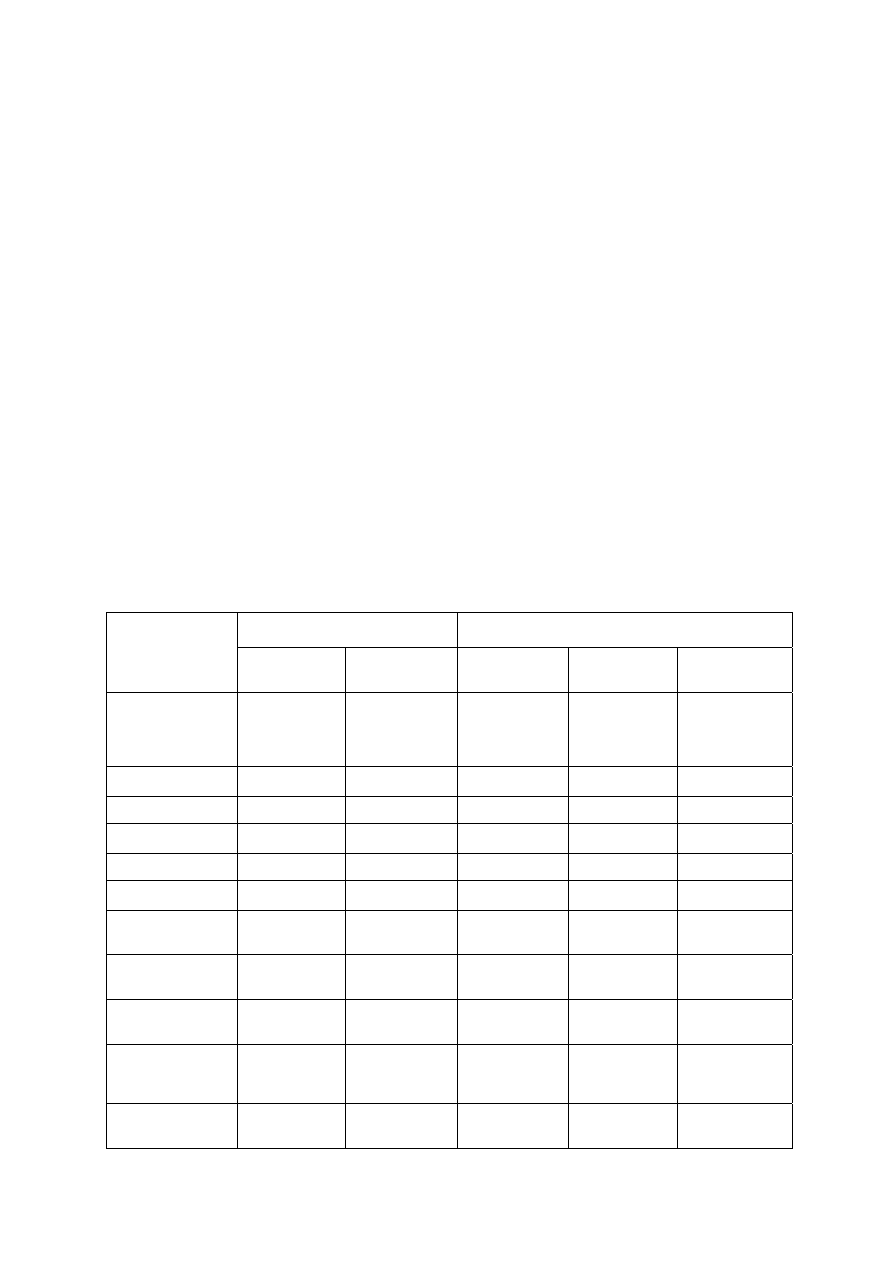
9
d. zapach palonego papieru – celuloza
e. jasny
płomień, trudny do zapalenia, nieprzyjemny zapach (izocjaniany), pieni się, krople –
poliuretany,
f. środek płomienia niebieski, zapach parafiny, – polietylen, polipropylen,
5. Płomień z żółto-zieloną obwódką,
a. pali się bardzo trudno i iskrzy, zapach kwasu octowego. Stopiony palący się materiał wkroplony
do wody tworzy ciężkie brązowo-czarne pieniące się granulki lub płatki – octan celulozy.
b. palenie zaczyna się od razu, słaby słodki zapach, stopiony polimer wkroplony do wody tworzy
płaskie dyski, które są jasnoorzechowe kiedy polimer jest niezabarwiony – etyloceluloza.
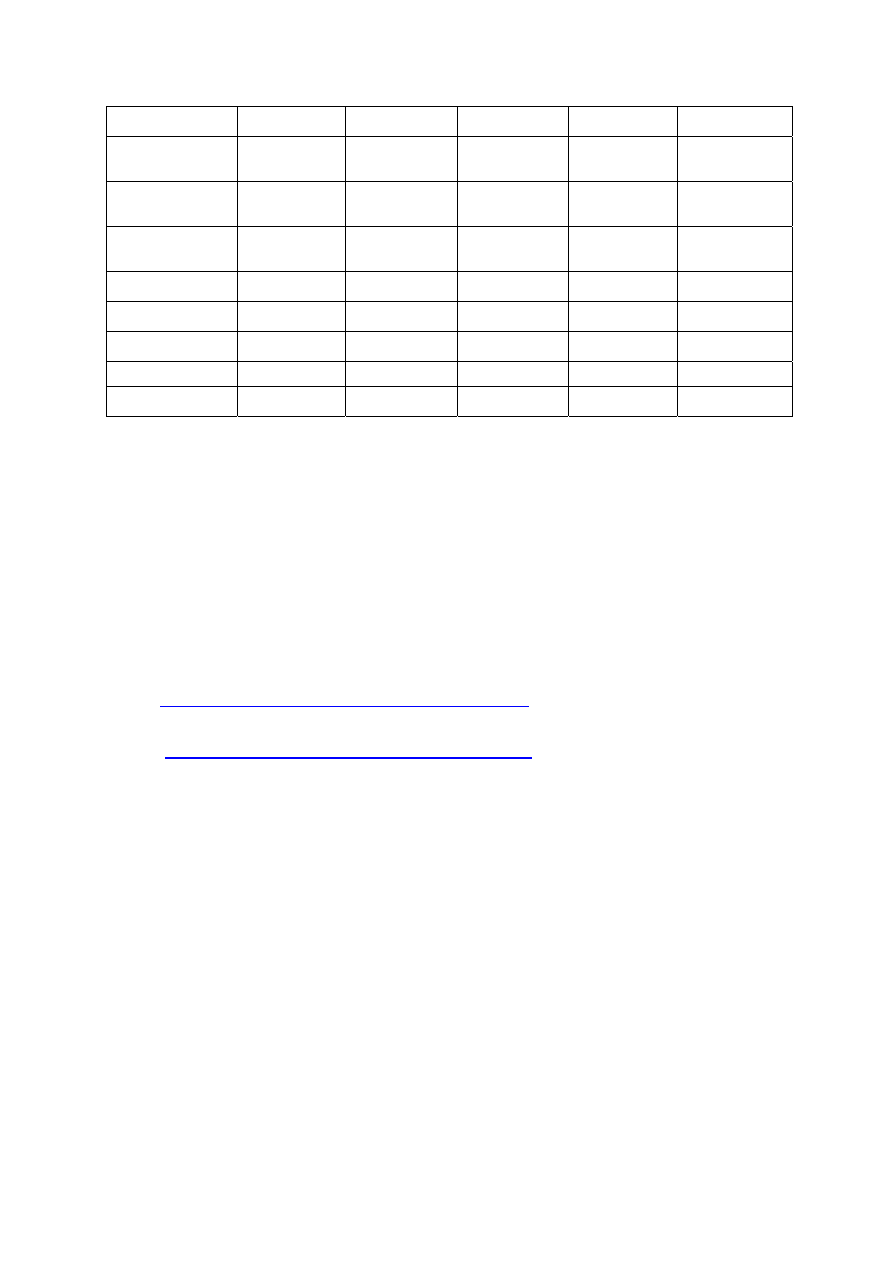
Ad. 5: Reakcja Liebermana – Storach – Morawskiego
Reakcja Liebermana – Storach – Morawskiego jest adaptacją reakcji Liebermana – Storacha stosowana do
wykrywania olejów żywicznych w olejach schnących. W przypadku obecności tych olejów w próbce
pojawia się zabarwienie czerwono-fioletowe, przechodzące w brunatne
Przepis na przeprowadzenie reakcji.
Odpowiednio małą próbkę polimeru (ok. 50 mg) należy zmieszać i wytrząsnąć z 2 cm
3
gorącego
bezwodnika octowego. Po ostudzeniu dodać 3 krople stężonego kwasu siarkowego (50%). Należy
obserwować zabarwienie pojawiające się natychmiastowo, następnie po 10 min. Następnie próbkę należy
podgrzać do 100
o
C na łaźni wodnej. Proszę porównać zaobserwowane zmiany zabarwienia próbki z tabelą.
Reakcje Liebermana – Storach – Morawskiego
Rozpuszczalność w bezwodniku
octowym
Zabarwienie
Żywica/polimer
na gorąco po
oziębieniu
po dodaniu
H
2
SO
4
Po 10 min.
po dodatk.
ogrzew. do
100
o
C
Fenolowo-
formaldehydowa
całkowita roztwór
mętnieje
Czerwono-
fioletowe
przechodzące w
różowe, a
następnie żółte
brunatne
czerwono-
brunatne
Mocznikowo-
formaldehydowa
roztwór mętny roztwór
mętny
Brak zabarwienia brak zabarwienia
żółtawo-
pomarańczowe
Polistyren roztwór
mętnieje roztwór
mętny
Brak zabarwienia brak zabarwienia
żółto-brunatne
Acetyloceluloza rozpuszcza
się
roztwór
przezroczysty
Brak zabarwienia brak zabarwienia brak zabarwienia
Etyloceluloza rozpuszcza
się roztwór
mętny
Żółto-brunatne ciemno-brunatne ciemno-brunatne
Benzyloceluloza rozpuszcza
się
roztwór
przezroczysty
Brak zabarwienia brak zabarwienia brak zabarwienia
Melaminowo-
formaldehydowa
całkowita
roztwór
przezroczysty
Brak zabarwienia brak zabarwienia
brak zabarwienia
roztwór
przezroczysty
Polialkohol winylowy
Brak
zabarwienia-do
żółtawego
brak
zabarwienia-do
żółtawego
brązowo-czarne
Poliamid całkowita
roztwór
przezroczysty
Brak zabarwienia brak zabarwienia
jasnożółte
przechodzące w
czerwone
Epoksydowa roztwór
mętny roztwór
mętny
Żółte
przechodzące w
czerwono-
brunatne
żółte
przechodzące w
czerwono-
brunatne
-
Polichlorek winylu
roztwór
przezroczysty
roztwór mętnieje Brak zabarwienia brak zabarwienia
brunatno-żółte
przechodzące w
brunatne
10
Polioctan winylu
roztwór
przezroczysty
roztwór mętnieje
Brak zabarwienia
do żółtawego
szaro-niebieskie brunatno-czarne
Eter poliwinylowy
roztwór
przezroczysty
roztwór
przezroczysty
niebieskie
przechodzące w
ziel.
brunatne -
Polibutyral winyl.
roztwór mętny roztwór
mętny
czerwone
przechodzące w
brunatne
ciemno-brunatne ciemno-brunatne
Poliuretan
jasnożólte jasnożólte
brązowe,
fluoryzuje na
zielono
Kauczuk chlorowany
żółto-brązow
żółto-brązow
czerwono-żółto-
brązowe
Polietylen
chlorosulfonowy
roztwór nie
rozpuszcza się
- - -
jasno-brunatne
Poliizobutylen
roztwór nie
rozpuszcza się
- - - -
Poliakrylan rozpuszcza
się roztwór
mętnieje -
-
-
Polimetakrylan
metylu
rozpuszcza się roztwór
mętnieje -
-
-
Ad. 6: Analiza widma absorpcyjnego w podczerwieni
Pod zakończeniu ćwiczeń studenci otrzymują widmo absorpcyjne w podczerwieni otrzymanego do analizy
polimeru. W sprawozdaniu widmo to należy zinterpretować i porównać z otrzymanymi wynikami
eksperymentalnymi.
Warunki zaliczenia ćwiczenia:
1. Zdane kolokwium wejściowe
2. Wykonanie przewidzianych w ćwiczeniu czynności badawczo-analitycznych
3. Sporządzenie sprawozdania ujmującego w skróci opis przeprowadzonych eksperymentów wraz analizą
wyników i ich interpretacją
4. Rozszyfrowanie trzech podanych przez asystenta akronimów (skrótów) polimerów i narysowanie
struktury jego łańcucha (adres dla skrótów:
http://www.tworzywa.com.pl/poradnik/poradnik.asp?ID=292
5. Wykonanie pisemnego raportu z odwiedzin w Sandretto Plastics Museum
(
http://www.sandretto.it/museonew/UKmuseo/default.htm
). W raporcie należy podać co najmniej 3
obiekty „wystawione” w tym muzeum wykonane z polimeru zidentyfikowanego podczas ćwiczenia.
Ponadto należy podać (posiłkując się innymi materiałami) krótką charakterystykę własności
fizykochemicznych polimeru ze szczególnym uwzględnieniem tych jego własności, które mają
znaczenie dla środowiska naturalnego.
Zalecana literatura:
1. D. Braun, Simple methods for identification of plastics, Carl Hanser Verlag, München Wien 1996.
2. A.K. Błędzki, Recykling materiałów polimerowych, WNT, Warszawa, 1997
3. T. Broniewski, J. Kapko, W. Płaczek, J. Thomalla, Metody i ocena własności tworzyw sztucznych,
WNT, Warszawa 2000.
Wykorzystana literatura:
1. D. Braun, Simple methods for identification of plastics, Carl Hanser Verlag, München Wien 1996.
2. A.K. Błędzki, Recykling materiałów polimerowych, WNT, Warszawa, 1997
3. T. Broniewski, J. Kapko, W. Płaczek, J. Thomalla, Metody i ocena własności tworzyw sztucznych,
WNT, Warszawa 2000.
4. J. Dworakowski, R. Hryniewicz, Tworzywa sztuczne dla stolarza, PWSZ, Kraków, 1968.
5. A. Myśliński, J. Wasiak, Z. Wielogórski, Encyklopedia domowa, tom Nr 2, Ht Edytor Sp. z o.o. 1993.
6. Materiały dydaktyczne Katedry Technologii Polimerów Politechniki Gdańskiej
7. J. Dechant, Ultrarotspektroskopische Untersuchungen an Polymeren, Akademie Verlag, Berlin 1972.
8. D. Hummel, Infrared analysis of polymers, resins and additives An atlas, New York: Wiley –
Interscience, 1969. (Dostępny: Biblioteka Główna PW, Sygn. B 014152 )

11
9. D. Hummel, Hochpolymere und Harze. Spektren und Methoden zur Identifizierung : Spektern,
Tabellen, Register. Munchen : Carl Hanser,1968 (Dostępny: Biblioteka Główna PW, Sygn. B.012043 )
10. Inne źródła wskazane w tekście.
Konieczna aparatura, szkło, odczynniki itp. do przygotowania ćwiczenia.
Konieczne jest uprzednie skompletowanie zbioru próbek polimerowych spełniających następujące warunki:
- różnej wielkości kawałki (w tym małe tak, aby mogły być umieszczone w probówkach) w ilości ok. 10 g
- rozpuszczalne (czyli nieusieciowane)
- bez lub z małą ilością dodatków uszlachetniających
Ad. Metoda 2. Określenie typu polimeru na podstawie jego gęstości
Aparatura: zlewki 50 ml x 8 (do obserwacji polimerów w roztworach), zlewki 100 ml x 3 (do przygotowywania
roztworów), trzy cylindry miarowe á (do przygotowywania roztworów), naczyńka wagowe do naważania CaCl
2
i ZnCl
2
, pinceta do wkładania i wyjmowania próbek z roztworów, lignina w arkuszach (do osuszania próbek)
Chemikalia: CaCl
2
, ZnCl
2
, H
2
O, etanol (eterowy: uwaga d=?),
Ad. Metoda 3. Określenie typu polimeru na podstawie jego rozpuszczalności
Aparatura: próbówki 20 ml x 20 (do rozpuszczania polimerów),
Chemikalia: woda, aceton, octan etylu, dioksan, dichloroetylen, pirydyna, chloroform, kwas octowy, kwas
mrówkowy, kwas solny, kwas siarkowy, n-butanol, octan metylu, octan butylu, chlorek metylu, eter etylowy,
alkohol etylowy, cykloheksanol, tetrachlorek węgla.
Ad. Metoda 4. Ocena zachowania się próbki w płomieniu
Aparatura: Butla gazowa z palnikiem, szpadelki metalowe 5 szt., probówki szklane, pojemnik (rodzaj kosza na
śmieci) na zwęglone polimery,
Chemikalia: brak
Ad. Metoda 5. Reakcja Liebermana – Storach – Morawskiego
Aparatura: łaźnia wodna (ok. 100
o
C), probówki szklane, 2 pipety szklane na 2 ml, wkraplacz kwasu siarkowego,
pojemnik na zlewki kwasu siarkowego.
Chemikalia: bezwodnik octowy (pod kontrolą asystenta!), stężony (50%) kwas siarkowy,
Ad. Metoda 6. Analiza widma absorpcyjnego w podczerwieni
Należy przygotować zbiór widm w podczerwieni, np. na podstawie (lit. 8-9), dla wszystkich posiadanych
próbek polimerów, których odbitki (oczywiście z usunięciem cech identyfikujących polimer, np. wzór, podpis)
będą rozdawane studentom do analizy po zakończeniu części praktycznej.
Uwagi BHP: Studenci powinni nosić okulary przez cały czas ćwiczenia, używać rękawiczek ochronnych.
Operacje z wolnym płomieniem wykonywać w obecności asystenta.
Wyszukiwarka
Podobne podstrony:
06 Identyfikacja polimerów
identyfikacja polimerów
02 Identyfikacja polimerów, Politechnika Wrocławska - Wydział Chemiczny, Semestr VI, Tworzywa polim
Identyfikacja polimerów 2
Recykling metody identyfikacji materialow polimerowych w odpadach
Materiały konstrukcyjne-identyfikacja tworzyw sztucznych2, ZUT-Energetyka-inżynier, I Semestr, Mater
identyfikacja tworzyw polimerowych
6. POLIMERY - IDENTYFIKACJA TWORZYW SZTUCZNYCH, Budownictwo, chemia, II semestr
Metody identyfikacji tworzyw sztucznych, Materiały studia, materiały polimerowe
Recykling metody identyfikacji materialow polimerowych w odpadach
06 Podstawy syntezy polimerówid 6357 ppt
właściwości polimerów
W10A Polimery biostabilne
więcej podobnych podstron