
1
Laboratorium
Oczyszczanie wód i ścieków
Studia niestacjonarne
Ćwiczenie
Badania aktywności
mineralnych adsorbentów formowanych

2
Badania aktywności mineralnych adsorbentów
formowanych
Zagadnienia, z którymi należy się zapoznać przed przystąpieniem do
ćwiczeń:
Co to jest adsorpcja, adsorbent, adsorbat, pojemność sorpcyjna?
Podstawowe rodzaje adsorbentów przemysłowych.
Co to są minerały ilaste? Przykłady, struktura.
Adsorbenty zeolitowe, przykłady, struktura, sposoby otrzymywania.
Co to jest efekt sitowy ?
W jakich oznaczeniach i jakimi technikami określamy jakość
adsorbentów zeolitowych?
Dlaczego formujemy adsorbenty?
Dlaczego oznaczamy właściwości mechaniczne adsorbentów
formowanych?
Celem ćwiczenia
jest określenie pojemności sorpcyjnej względem
benzenu adsorbentów zeolitowych pozyskanych z materiałów ilastych –
kaolinu i haloizytu.
3
C
ZĘŚĆ
TEORETYCZNA
1.
ADSORPCJA
Zjawisko adsorpcji jest rezultatem występowania na powierzchni każdego ciała stałego
nienasyconych i niezrównoważonych sił molekularnych. Kiedy powierzchnia ciała stałego
jest w kontakcie z cieczą lub gazem, występują wzajemne oddziaływania między polami sił
powierzchni ciała stałego i cieczy lub gazu. Powierzchnia ciała stałego dąży do wyrównania
szczątkowych sił przez przyciąganie i zatrzymywanie na niej cząsteczek, atomów lub jonów
gazów czy cieczy. Skutkiem tego jest większe stężenie gazu lub cieczy w bliskim sąsiedztwie
powierzchni ciała stałego niż w pozostałej masie.
ADSORPCJA oznacza zjawisko zwiększenia stężenia gazu lub cieczy na
powierzchni ciała stałego.
Adsorpcja obejmuje dwa typy sił: siły fizyczne (van der Waalsa), które mogą być siłami
polaryzacji lub siłami dyspersyjnymi (adsorpcja fizyczna), a także siły chemiczne, które są
siłami walencyjnymi pojawiającymi się w wyniku redystrybucji elektronów między
powierzchnią ciała stałego i adsorbowanymi atomami (adsorpcja chemiczna).
Podstawowe pojęcia związane z procesem adsorpcji to:
adsorbent – ciało stałe, na którego powierzchni zachodzi adsorpcja
adsorbat – substancja zaadsorbowana przez adsorbent
adsorptyw – substancja właśnie adsorbowana
1.1. Klasyfikacja adsorbentów
Ogólnie adsorbenty możemy podzielić na:
Adsorbenty nieporowate – ciała stałe o nieznacznie rozwiniętej powierzchni
właściwej; powierzchnię właściwą ciał nieporowatych określa się ich powierzchnią
zewnętrzną, którą można zwiększyć przez rozdrabnianie. Przykładem tego typu
sorbentów są sadze.
Adsorbenty porowate – ciała stałe o silnie rozwiniętej powierzchni właściwej
rzędu setek, a nawet powyżej 1000 m
2
/g. Tak duża powierzchnia wynika z bardzo
dużej powierzchni porów znajdujących się wewnątrz ziaren adsorbentu, natomiast
powierzchnia zewnętrzna jest tego samego rzędu co adsorbentów nieporowatych.

4
Adsorbenty porowate charakteryzują się dużą chłonnością sorpcyjną względem
określonych gazów, par i cieczy.
Adsorbenty porowate dzielimy na:
Adsorbenty mineralne - do najczęściej stosowanych w praktyce należą: zeolity,
silikażele (żele krzemionkowe), aluminożele (aktywowany tlenek glinu)
Adsorbenty węglowe – węgle aktywne, węglowe sita cząsteczkowe (molekularne),
włókna i tkaniny węglowe.
2.
ZEOLITY
2.1 Definicja
Zeolity to krystaliczne glinokrzemiany metali alkalicznych lub metali ziem
alkalicznych, wyróżniające się ściśle regularną strukturą porów. Pory te w zwykłych
warunkach temperaturowych są wypełnione cząsteczkami wody (tzw. zeolitowej), która
podczas ich ogrzewania wydziela się. Stąd nazwa „zeo-lit” czyli „wrzący kamień”.
Wśród zeolitów wyróżnia się dwie grupy: naturalne i syntetyczne. W przyrodzie
odkryto dotąd 34 minerały zeolitowe. Syntetycznie otrzymano około100 zeolitów .
Zeolity syntetyczne mają budowę analogiczną do naturalnych .
2.2.Budowa
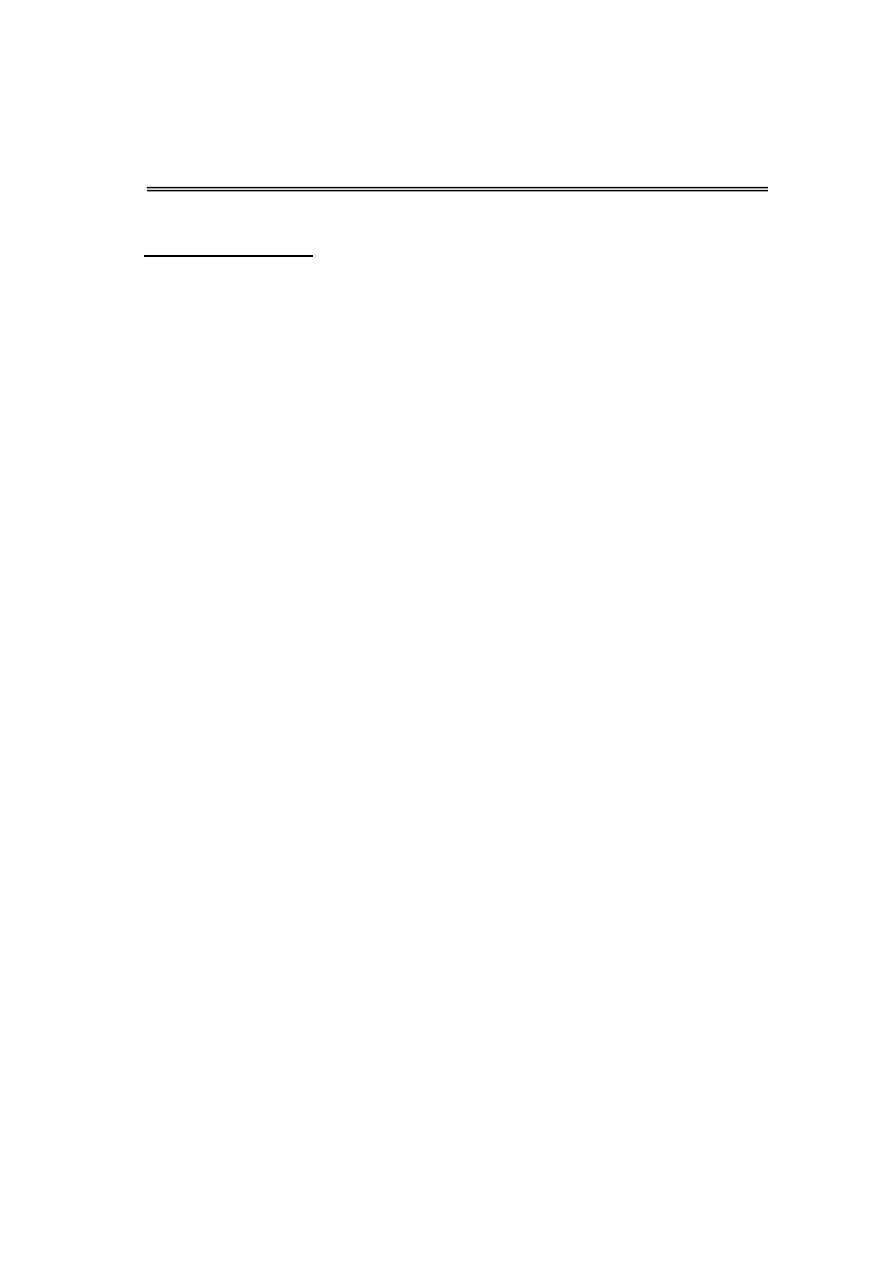
Trójwymiarowa, krystaliczna sieć zeolitów składa się z tetraedrów SiO
4
i AlO
4
-
połączonych ze sobą wierzchołkami (Rys.1), przy czym ujemny ładunek szkieletu
glinokrzemowego (pochodzący od jonów AlO
4
-
) kompensowany jest, w zależności od typu
zeolitu, kationami takimi jak Na
+
, K
+
, Mg
2+
, Ca
2+
, Sr
2+
, czy Ba
2+
.
Atomy tlenu łącząc tetraedry glinowotlenowe i krzemotlenowe tworzą pierścienie
4 -, 5 -, 6 -, 8 -, 10 – i 12 – członowe nazwane „oknami” o maksymalnych średnicach
wynoszących od 1,5 do 8,0 Å. Dzięki przestrzennie ułożonym pierścieniom tlenowym
powstają komory o objętości setek angstremów, które są połączone kanałami o średnicy kilku
angstremów. Obecność „okien” wejściowych umożliwia dostanie się cząsteczek adsorbatów o
odpowiednich rozmiarach i kształcie do przestrzeni wewnątrz komór. Tutaj m.in.
adsorbowana jest woda lub cząsteczki innych indywiduów oraz zhydratyzowane jony
kompensacji, mogące ulegać wymianie .
5

6
Skład chemiczny zeolitów (odpowiadający jego komórce elementarnej) wyrażony jest
wzorem : Me
n
O*Al
2
O
3
*xSiO
2
*yH
2
O, gdzie Me – kation metalu alkalicznego, n – jego
wartościowość, x i y – liczby całkowite .
Ważnym problemem charakteryzującym zarówno zeolity syntetyczne jak
i naturalne jest moduł molowy SiO
2
/ Al
2
O
3
determinujący strukturę zeolitu (zawiera się na
ogół w granicach od 1 do 10).
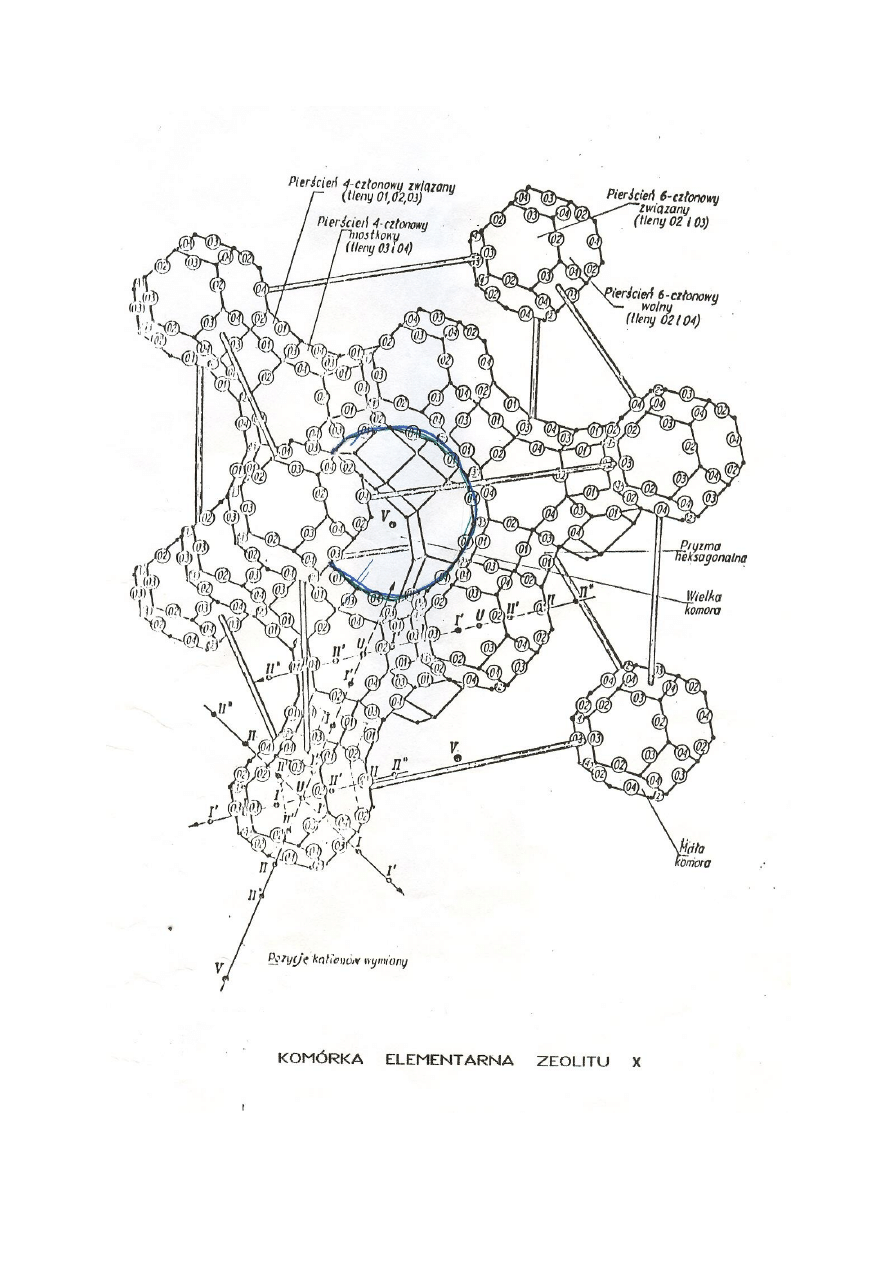
Wśród zeolitów syntetycznych wyróżnia się zeolity typów A, X, Y i inne. Niektóre z
nich posiadają odpowiedniki w przyrodzie.
W zależności od kationów kompensacji zmieniających średnicę porów rozróżnia się
następujące odmiany zeolitów typu A :
3A o średnicy okien mniejszej od 0,38 nm – odmiana sodowo – potasowa,
4A o średnicy okien mniejszej od 0,4 nm – odmiana sodowa,
5A o średnicy okien mniejszej od 0,45 nm – odmiana wapniowa .
Struktura zeolitu typu 4A
.
Zeolit 4A jest najczęściej stosowany spośród zeolitów w procesach adsorpcji i
katalizy. Nie posiada on analogów w przyrodzie. Jego komórka elementarna
(pseudokomórka) zawiera w sumie 192 tetraedry SiO
4
i AlO
4
-
. W strukturze szkieletowej
zeolitu 4A stosunek liczby tetraedrów SiO
4
do AlO
4
-
jest najniższy wśród zeolitów i wynosi 1.
Tutaj tetraedry łączą się tworząc 4 -, 6 – i 8 – członowe pierścienie tlenowe.
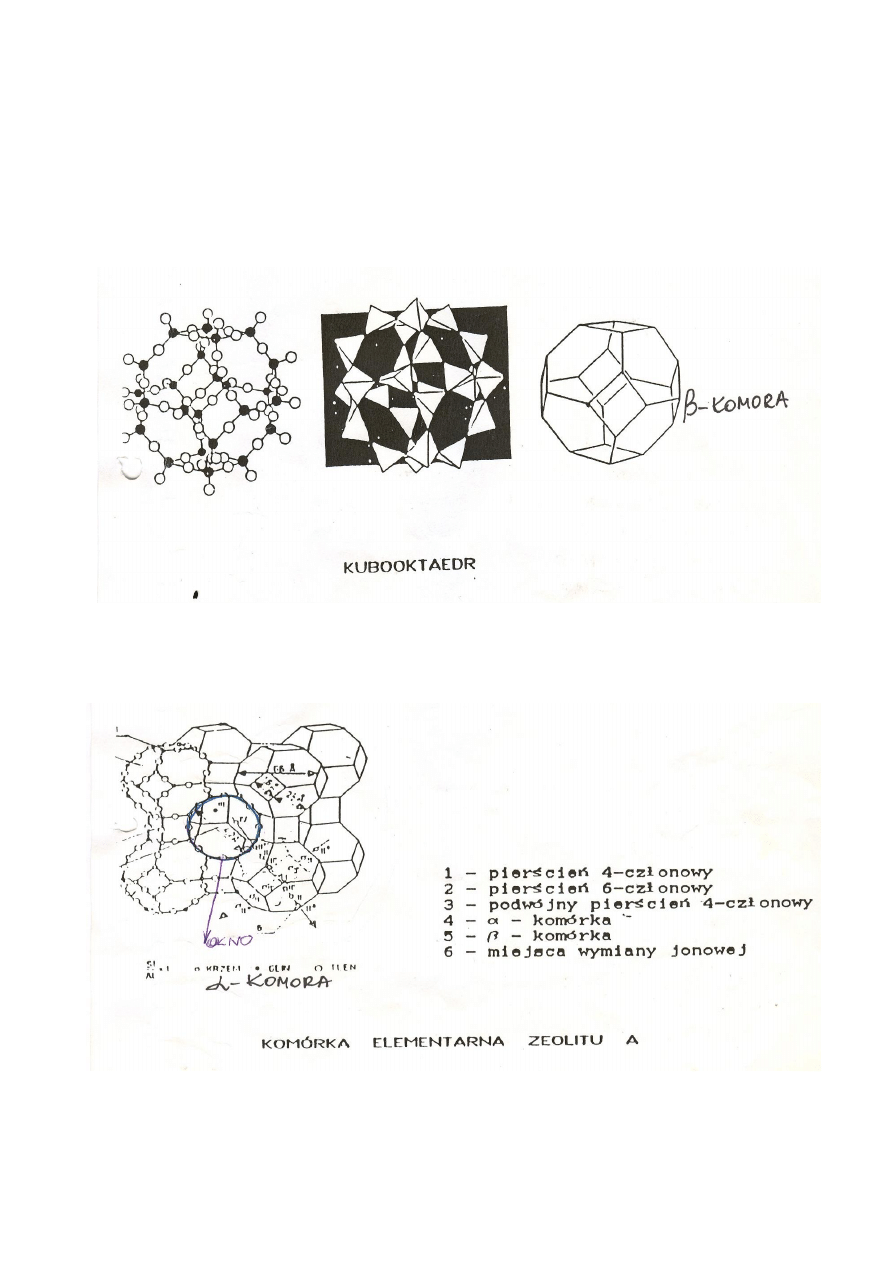
Z sześciu 4 – członowych i ośmiu 6 – członowych pierścieni powstaje kubooktaedr –
powtarzający się w strukturze element budowy (Rys.2).
Stanowi on β – komorę o swobodnej objętości 157 Å
3
i wymiarach „okien” do niej
prowadzących około 2,4 Å (osiem 6 – członowych pierścieni tlenowych).
β – komory łączą się poprzez podwójne 4 – członowe pierścienie tlenowe i tworzą w ten
sposób α – komorę o wymiarach: objętość 775 Å
3
, średnica 11,4 Å. Wymiary „okien” do niej
prowadzących (sześć 8 – członowych pierścieni tlenowych) wynoszą około 4,2 Å. Powstają
więc dwa systemy trójwymiarowych kanałów: jeden składa się z α – komór
a drugi z β – komór (Rys.3 i 4).
Co wynika z tak precyzyjnej budowy?
Większość cząsteczek adsorbatów wnika tylko do α – komór, bo ich wymiary są zbyt
duże, aby przejść przez „okna” wejściowe mniejszych β – komór.
7

8
Woda tzw. „zeolityczna” wypełnia zaś α – i β – komory. Przy pełnym uwodnieniu
zeolitu 4A do pseudokomórki wchodzi 27 cząsteczek wody. Hydratyzują one kationy
kompensacji znajdujące się obok, w wolnych przestrzeniach. Ich ilość zależy od ładunku i
promienia jonowego, stosunku Si / Al., a także od rozkładu pola elektrostatycznego w
zeolicie. Można powiedzieć, że kationy kompensacji lokalizują się w ściśle określonych
miejscach struktury. W pseudokomórce dehydratowanego zeolitu 4A znajduje się 12
kationów Na
+
z czego 4 zlokalizowane są w 8 – członowych pierścieniach prowadzących do α
– komór i przesłaniają częściowo prześwit „okna”, zmniejszając jego efektywny rozmiar o
około 0,2 Å.
Ważną sprawą jest to, że jony Na
+
łatwo można wymienić na jony K
+
lub Ca
2+
uzyskując w ten sposób zeolity 3A i 5A o średnicach „okien” odpowiednio wynoszących
około 3,3 Å i 4,4 Å.
2.3 Metody otrzymywania zeolitów i surowce
Zeolity syntetyczne otrzymuje się w procesach hydrotermalnych dwiema drogami:
poprzez długotrwałe ogrzewanie wodnych roztworów glinianów i krzemianów metali
alkalicznych albo poprzez rekrystalizację glinokrzemianów naturalnych.
Bezpośrednia synteza zeolitów (klasyczna metoda Barrera).
Zasada syntezy zeolitów, oparta na tej metodzie, polega na krystalizacji alkalicznego
hydrożelu glinokrzemianowego o odpowiednim składzie. Używa się tutaj odrębnych
składników krzemo – i glinonośnych.
Jako surowiec glinonośny najczęściej stosuje się glinian sodu, a krzemonośnymi
surowcami mogą być: krzemian sodowy, szkło wodne, amorficzna krzemionka czy zol kwasu
krzemowego .
Skład i struktura powstających kryształów zeolitów zależą od wielu czynników:
jakości surowców, sposobu otrzymywania, temperatury i czasu krystalizacji. Jednak
determinujący wpływ na rodzaj uzyskanego zeolitu wywierają stężenia reagujących
składników. Stężenia te określają stosunki molowe SiO
2
/ Al
2
O
3,
Na
2
O / SiO
2
,H
2
O / Na
2
O.
Wartości modułów molowych dla poszczególnych typów zeolitów są różne

9
(w zależności od tego jaki typ zeolitu chcemy otrzymać). Na przykład zeolit typu A będzie
krystalizował z mieszaniny charakteryzującej się modułami molowymi:
SiO
2
/ Al
2
O = 1,0
3,0 , Na
2
O / SiO
2
= 0,6
3,0 , H
2
O / Na
2
O = 30
120 , czyli procesowi
syntezy zeolitu a sprzyja niskie stężenie składnika krzemowego w stosunku do glinowego i
wysoka alkaliczność.
Rekrystalizacja glinokrzemianów naturalnych.
Ze względu na duże koszty wytwarzania surowców wykorzystywanych w
bezpośredniej syntezie zeolitów, zaczęto poszukiwać i badać nowe i tańsze surowce. Należą
do nich naturalne glinokrzemiany, z których można otrzymać określony typ zeolitu na drodze
rekrystalizacji. Stosunek molowy SiO
2
/ Al
2
O
3
w tym przypadku zależy od rodzaju użytego
glinokrzemianu.
Najczęściej stosowanymi surowcami są minerały z grupy kaolinitu (kaolinit,
haloizyt). Zalicza się je do grupy krzemianów warstwowych o budowie pakietowej. Celem
otrzymania pożądanego typu zeolitu najpierw niszczy się istniejącą sieć krystaliczną surowca
glinokrzemianowego, a następnie uzyskany amorficzny materiał poddaje się obróbce
hydrotermalnej w roztworze ługu o odpowiednio dobranym stężeniu .
Destrukcja sieci krystalograficznych minerałów kaolinitowych następuje w zakresie
temperatur od 823 do 1173 K . Im głębsze jest zniszczenie struktury pierwotnej surowca, tym
czystsze produkty otrzymuje się w procesie rekrystalizacji.
W wyniku obróbki termicznej glino krzemian przechodzi w formę amorficzną –
metakaolinit czy metahaloizyt itp.
Obróbka ługowa polega na traktowaniu bezpostaciowego minerału roztworami
wodorotlenków pierwiastków alkalicznych w celu przeprowadzenia składników glinowego i
krzemowego w postać glinianu i krzemianu. Jednocześnie podczas rozpuszczania tych
składników wytrąca się hydrożel glinokrzemowy, z którego następnie w podwyższonej
temperaturze krystalizuje pożądany zeolit. Dlatego tak ważny jest czas reakcji i temperatura
kontaktu.
Jak wspomniano wcześniej moduł molowy SiO
2
/ Al
2
O
3
kaolinitu równy 2 odpowiada
warunkom powstania struktury zeolitu A. Można oczywiście zmieniać te wartości i otrzymać
zeolity typu X i Y o wyższych modułach, z tego minerału. Dokonuje się tego przez
wprowadzenie dodatkowych ilości krzemionki jak również na drodze aktywacji
glinokrzemianu kwasami mineralnymi (np. H
2
SO
4
, HCl).

10
Znana jest metoda syntezy zeolitu przez spiekanie glinokrzemianu naturalnego
z alkaliami w temperaturze 1573 K lub w warunkach hydrotermalnych ( 873-1023 K ).
Otrzymany spiek stanowiący bezwodne gliniany i krzemiany, poddaje się procesom
krystalizacji hydrotermalnej w środowisku wodnym.
2.4 Sitowo – molekularne właściwości zeolitów
Zeolity są adsorbentami mikroporowatymi. Posiadają jednorodne pory o wymiarach
wynikających z budowy komórki elementarnej (2 – 10 Å). Oprócz doskonałej selektywności
adsorpcji charakteryzuje się zdolnością do rozdzielania substancji dzięki występowaniu różnic
w rozmiarach i kształtach cząsteczek. Dlatego też, właściwości zeolitów pod względem
rozmiarów i rozkładu objętości porów zdecydowanie odbiegają od właściwości innych
adsorbentów.
Proces adsorpcji na zeolitach nożna porównać do procesu przesiewania przez sito
o określonych wielkościach oczek . Stąd wywodzi się termin „efekt sitowy” zeolitów
polegający na selektywnej adsorpcji indywiduów chemicznych z mieszanin . Cząsteczki,
których rozmiar krytyczny jest większy od średnicy „okna” nie będą adsorbowane przez
zeolit.
Tablica 1. Przykłady średnic krytycznych niektórych cząsteczek w Å .
H
2
– 2,82
CO
2
– 3,30
H
2
O – 2,65
NH
3
– 2,80
CH
4
– 3,80
C
3
H
8
– 4,30
C
6
H
6
– 6,6
CCl
2
F
2
– 4,40
Sitowo – molekularne właściwości zeolitów można regulować trzema drogami: przez
wymianę jonową, wcześniejszą adsorpcję polarnych cząsteczek i przewężanie porów.
Wymiana jonowa powoduje zmniejszenie bądź zwiększenie wymiarów „okien”
wejściowych np. wymieniając jony Na
+
na jony Ca
2+
efektywna średnica porów zeolitu

11
4 A zwiększy się z około 4 Å do 4,4 Å. Lokalizacja kationów Ca
2+
w
- komorach
powoduje odsłonięcie 8 – członowych „okien” wejściowych. Dzięki temu do kanałów zeolitu
już 5 A mogą dyfundować cząsteczki o większych rozmiarach niż 4 Å np. węglowodory n –
parafinowe. Wymiana natomiast jonów Na
+
na K
+
w zeolicie 4 A tj. jonów o większych
promieniach jonowych spowoduje „przesłonięcie okien”, ostatecznie doprowadzi do
zmniejszenia wymiarów porów do wartości ok. 3,3 Å i adsorpcji tylko małych, polarnych
cząsteczek np. wody czy metanolu.
Wcześniejsza adsorpcja polarnych cząsteczek powoduje zmniejszenie wielkości
adsorpcji drugiej substancji. Również obróbka adsorbentu zeolitowego para wodną
wywołująca zjawisko przewężenia porów i zmniejszenie ich rozmiarów, doprowadzi do
ograniczenia adsorpcji cząsteczek o wymiarach zbliżonych do wymiarów „okien”.
Adsorpcja na zeolitach
Poza selektywnością związaną z wielkością cząsteczek, zeolity wykazują też
selektywność zależną od polarności cząsteczek. Wszystkie zeolity selektywnie adsorbują
wodę i inne polarne cząsteczki, a z dwóch substancji łatwiej ulegnie adsorpcji związek
bardziej polarny. Zeolity syntetyczne są typowymi adsorbentami heteropolarnymi. Oznacza
to, że charakter rozkładu gęstości elektronowej w wiązaniach cząsteczek adsorbatu decyduje
w dużej mierze o wielkości adsorpcji i energii oddziaływań adsorpcyjnych . Z jonową
strukturą zeolitów bardzo silnie oddziaływują cząsteczki
o stałym momencie dipolowym (H
2
O, NH
3
) lub kwadrupolowym (N
2
, CO
2
) czy też
cząsteczki zawierające wiązania π (węglowodory aromatyczne). Selektywność adsorpcji tych
cząsteczek jest związana ze wzmocnieniem sił adsorpcyjnych. Wynika to z obecności
dwojakiego rodzaju oddziaływania: niespecyficznego dyspersyjnego i specyficznego wolnych
par elektronowych czy wiązań π cząsteczek z jonowa siatką zeolitów.
Ważną cechą sorbentów cząsteczkowych jest ich odporność na działanie wysokich
temperatur. Nawet w temperaturach od 723 do 873 nie zmieniają właściwości sorpcyjnych.
Ocena jakości syntetycznych adsorbentów cząsteczkowych zgodnie z Polską Normą
BN–85/6069–11 obejmuje takie oznaczenia jak wytrzymałość mechaniczna, wodoodporność,
dynamiczna sorpcja pary wodnej czy sorpcja etanolu, n – heptanu czy benzenu z mieszanin
ciekłych.

12
2.5 Modyfikacja struktury porowatej zeolitu
Zeolity syntetyczne krystalizowane są zazwyczaj w postaci proszkowej. Aby mogły
być stosowane w procesach przemysłowych poddaje się je formowaniu.
Ze względu na silne właściwości tiksotropowe możliwe jest to przy użyciu lepiszczy
wiążących, najczęściej minerałów ilastych, o bardzo dobrych właściwościach pęczniejących
np. bentonitów. Wtedy jednak pogarsza się ich właściwości sorpcyjne, gdyż rozcieńcza się
aktywną fazę zeolitów.
Synteza zeolitów z naturalnych glinokrzemianów (kaolinit, haloizyt) uformowanych w
kształtki przed procesem krystalizacji, eliminuje problem „płynięcia” proszku zeolitowego
podczas formowania. Jednocześnie uzyskuje się produkt o doskonałych właściwościach
mechanicznych .
Aby zapobiec nadmiernemu zbiciu i ściśnięciu masy minerału ilastego (szczególnie w
procesie tłoczenia) do układu wprowadza się substancje – modyfikatory tekstury, za pomocą
których uzyskuje się odpowiednią strukturę porowatą . Należą do nich takie substancje jak
celuloza, skrobia, melasa, węgiel aktywny, tlenek glinu, krzemionka czy węgiel kamienny i
brunatny.
Zastosowanie tego typu modyfikatorów do procesu formowania surowca mineralnego
wywiera korzystny wpływ na jakość formowanych adsorbentów: zwiększa wydajność reakcji
krystalizacji formy zeolitowej, zwiększa pojemność sorpcyjną adsorbentów i wzbogaca
mikroporowatą strukturę adsorbentu zeolitowego o pory transportowe.
2.6 Zastosowanie zeolitów
Zeolity znalazły szerokie zastosowanie w wielu dziedzinach chemii i w procesach
przemysłowych. Liczba ich zastosowań ciągle rośnie. Wciąż prowadzone są intensywne
badania nad ich syntezą i właściwościami.
Jak wiadomo, zeolity (głównie typu A) ze względu na dużą zdolność odwadniania
gazów i to w zakresie niewielkich prężności pary wodnej, są adsorbentami stosowanymi
przede wszystkim w suszarnictwie. Temperatura punktu rosy odwadnianego gazu może
sięgać - 80
C, dlatego użycie adsorbentu zeolitowego zapewnia najwyższy stopień osuszenia .
Osusza się nimi także ciecze organiczne np. produkty rafineryjne.

13
Zeolity znalazły zastosowanie do wydzielania składników niepożądanych lub
toksycznych (np. tlenków siarki, azotu, węgla, siarkowodoru, amoniaku, pary rtęci, wodoru
czy węglowodorów).
Niezastąpione okazały się katalizatory zeolitowe, szczególnie w przemyśle przeróbki
ropy naftowej czy w procesach utleniania związków siarkowych – oczyszczanie gazów
kominowych. Za pomocą zeolitów można wydzielić izotopy promieniotwórcze ze zużytych
roztworów. Są także dostosowane do regeneracji powietrza w pojazdach kosmicznych.
Rekrystalizacja glinokrzemianów naturalnych do struktur zeolitowych stała się realną
szansą na tanie, krajowe sita cząsteczkowe do masowego zastosowania . Szczególną uwagę
poświęcono zeolitowym wymieniaczom jonowym w chemii gospodarczej jako komponentom
środków piorących w miejsce ekologicznie niebezpiecznego trójpolifosforanu sodu .
Usuwanie jonów metali ciężkich (Pb, Cn, Zn, Cr, Cd, V i inne) z wód i ścieków jest
bardzo efektywne przy użyciu zeolitów.
Adsorbenty zeolitowe z minerałów ilastych charakteryzują się wysoką aktywnością
względem n – parafin (węglowodorów o najniższych liczbach oktanowych). Dlatego też
wykorzystanie zeolitów przy podwyższaniu LO paliw jest alternatywą dla częściowego
odparafinowania w procesach adsorpcyjnych .
14
C
ZĘŚĆ
DOŚWIADCZALNA
Wykonanie ćwiczenia
Przebieg ćwiczenia przedstawiono na schemacie 1. Dokładną procedurę podano poniżej.
1. Odważyć 20 g benzenu i 80 g n-heptanu, a następnie zmieszać oba składniki.
Oznaczyć współczynnik załamania światła (n
20
d
) tak przygotowanej mieszaniny
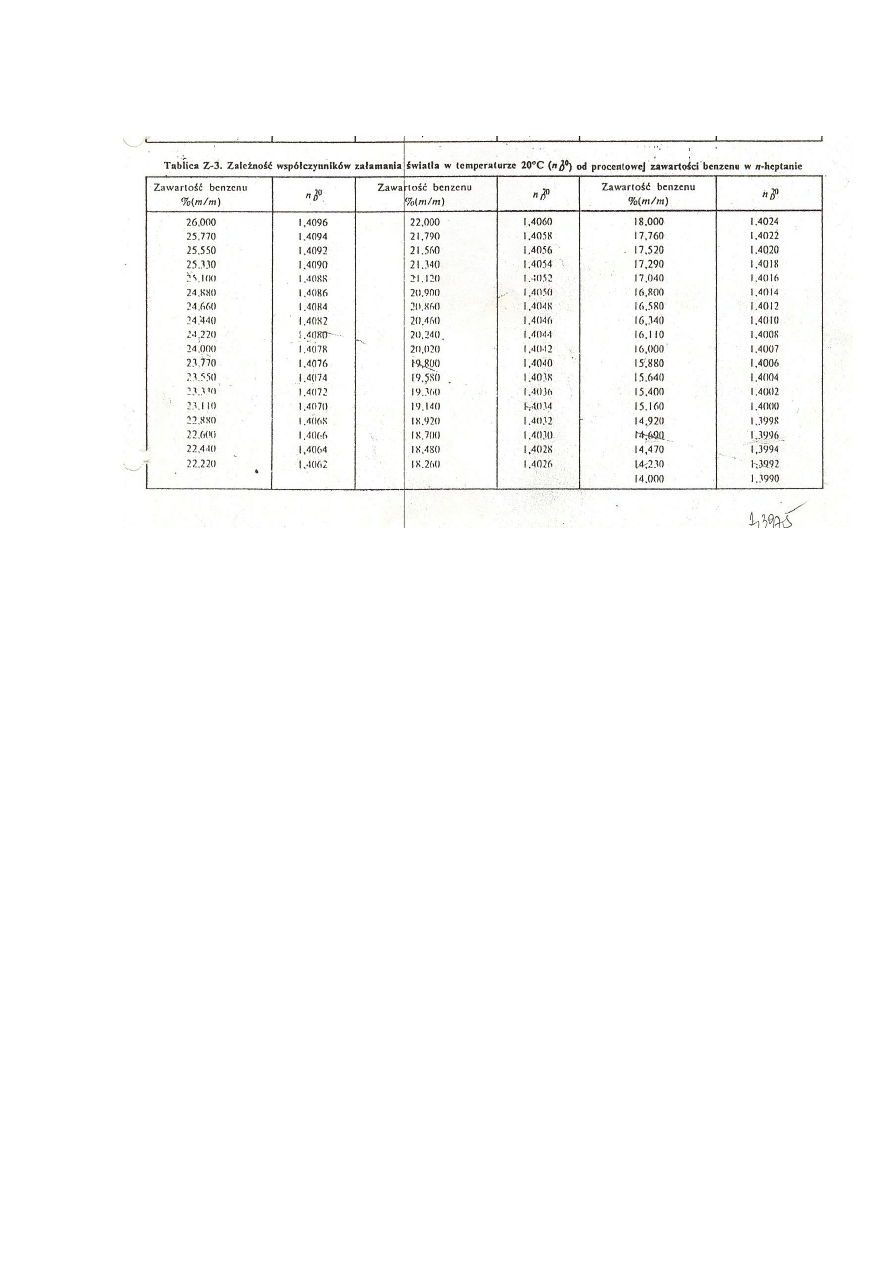
i z tablicy Z-3 odczytać jej skład w % (m/m).
2. Zważyć fiolki do badań wraz z korkami.
3. Do fiolek wsypać warstwę 1 cm zeolitów 4A i 13X, zamknąć korkami i zważyć.
4. Do fiolek z sorbentami wprowadzić odpowiednią ilość mieszaniny cieczy – 1 cm
ponad warstwę zeolitu, zamknąć korkami i ponownie zważyć.
5. Fiolki z sorbentem i mieszaniną wytrząsać ręcznie przez 20 minut.
6. Mieszaninę cieczy we fiolkach odwirować w ciągu 3 minut przy prędkości
obrotowej 3000 obr/min.
7. Pobrać probówką klarowną ciecz znad osadu i oznaczyć współczynnik załamania
światła (n
20
d
) oraz odczytać skład mieszaniny w % (m/m) z tablicy Z-3.
8. Sorpcję benzenu (X
b
) obliczyć w gramach na jeden gram sorbentu wg wzoru:
X
b
= m
1
/m
(w
o
-w)/(100-w)
gdzie:
m
1
– masa mieszaniny cieczy wprowadzonej do fiolki, g
m – masa sorbentu we fiolce, g
w
o
– ułamek masowy składnika adsorbowanego (benzenu) w mieszaninie przed
sorpcją, % (m/m)
w - ułamek masowy składnika adsorbowanego (benzenu) w mieszaninie po
sorpcji, % (m/m)
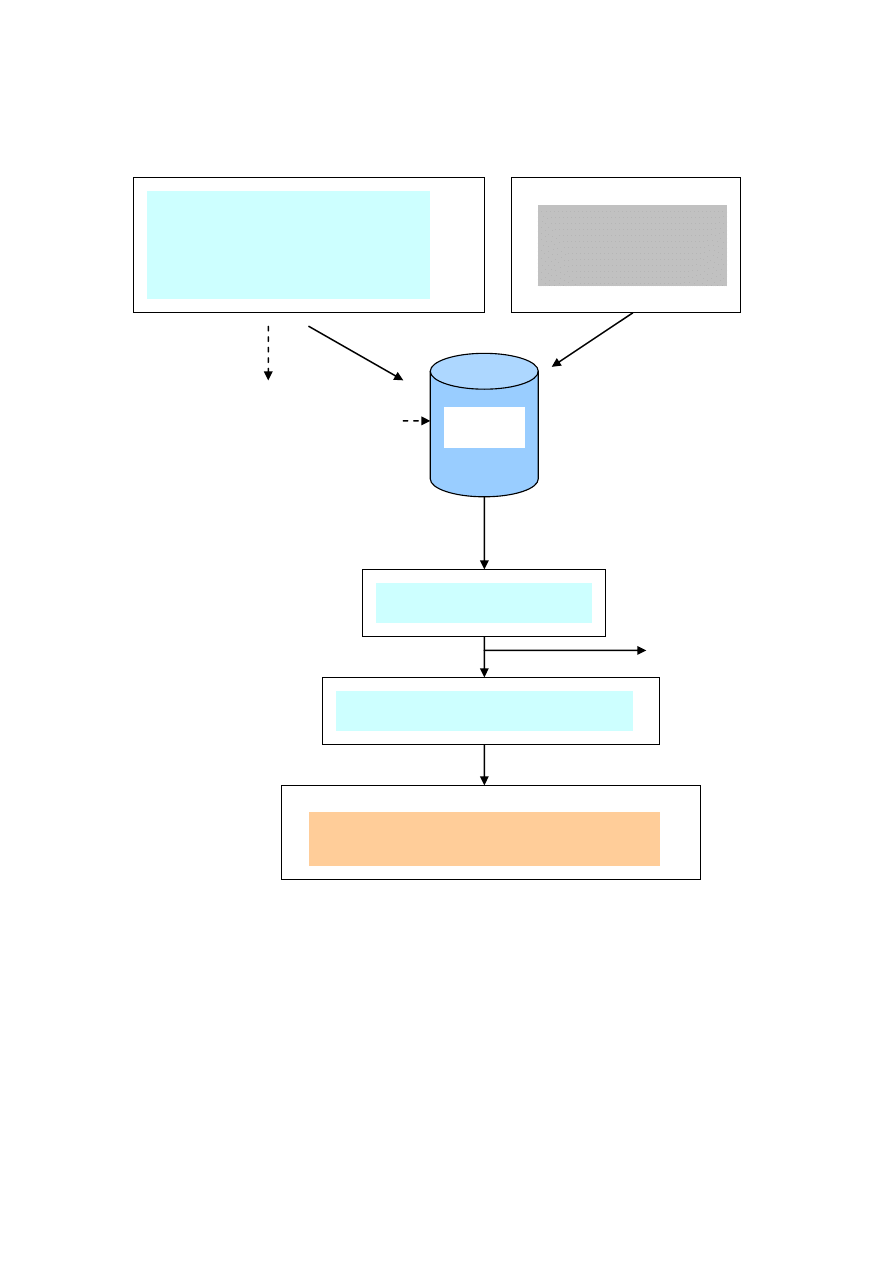
15
Rys. 1. Schemat przebiegu ćwiczenia.
Ściek 2
(20 g benzenu + 80 g n-heptanu)
Zeolit 4A i 13X
warstwa 1 cm
wytrząsanie – 20 minut
Wirowanie – 3000 rpm
Przesącz
osad
Oznaczenie współczynnika załamania
światła
Fiolka
1 cm ponad warstwę zeolitu
16
Wyszukiwarka
Podobne podstrony:
1 Badanie filtrow RC Nieznany (2)
Montowanie i badanie sieci tele Nieznany
Badanie aktywności dehydrogenaz mikroorganizmów osadu czynnego metodą spektrofotometryczną z TTC
Badanie właściwości minerałów i skał
Badanie stalych materialowych s Nieznany (2)
BADANIE STATYSTYCZNEGO CHARAKTE Nieznany
Badanie lamp metalohalogenkowyc Nieznany
Badanie parametrow charakteryzu Nieznany (2)
2 Badanie ukladow dopasowania i Nieznany
Badanie wzmacniaczy operacyjnyc Nieznany (2)
Badanie i diagnozowanie pacjent Nieznany
1 Badanie charakterystyk staty Nieznany (2)
OII05 Badanie przemian energii Nieznany
2 Ustalanie wzorow mineralow i Nieznany (2)
badania makroskopowe instrukcja Nieznany (2)
BADANIE WSPOLPRADOWEGO I PRZECI Nieznany (2)
więcej podobnych podstron