
1
Oddziaływania
międzycząsteczkowe
2
Oddziaływania międzycząsteczkowe są siłami elektro-
statycznego przyciągania między cząsteczkami lub atoma-
mi. Oddziaływania te nie są wiązaniami chemicznymi.
Do oddziaływań międzycząsteczkowych zaliczamy:
1. Wiązania wodorowe
2. Oddziaływania jon – jon
3. Siły van der Waalsa
Siła oddziaływań międzycząsteczkowych:
Siły van der Waalsa < wiąz. wodorowe < oddz. jon – jon

3
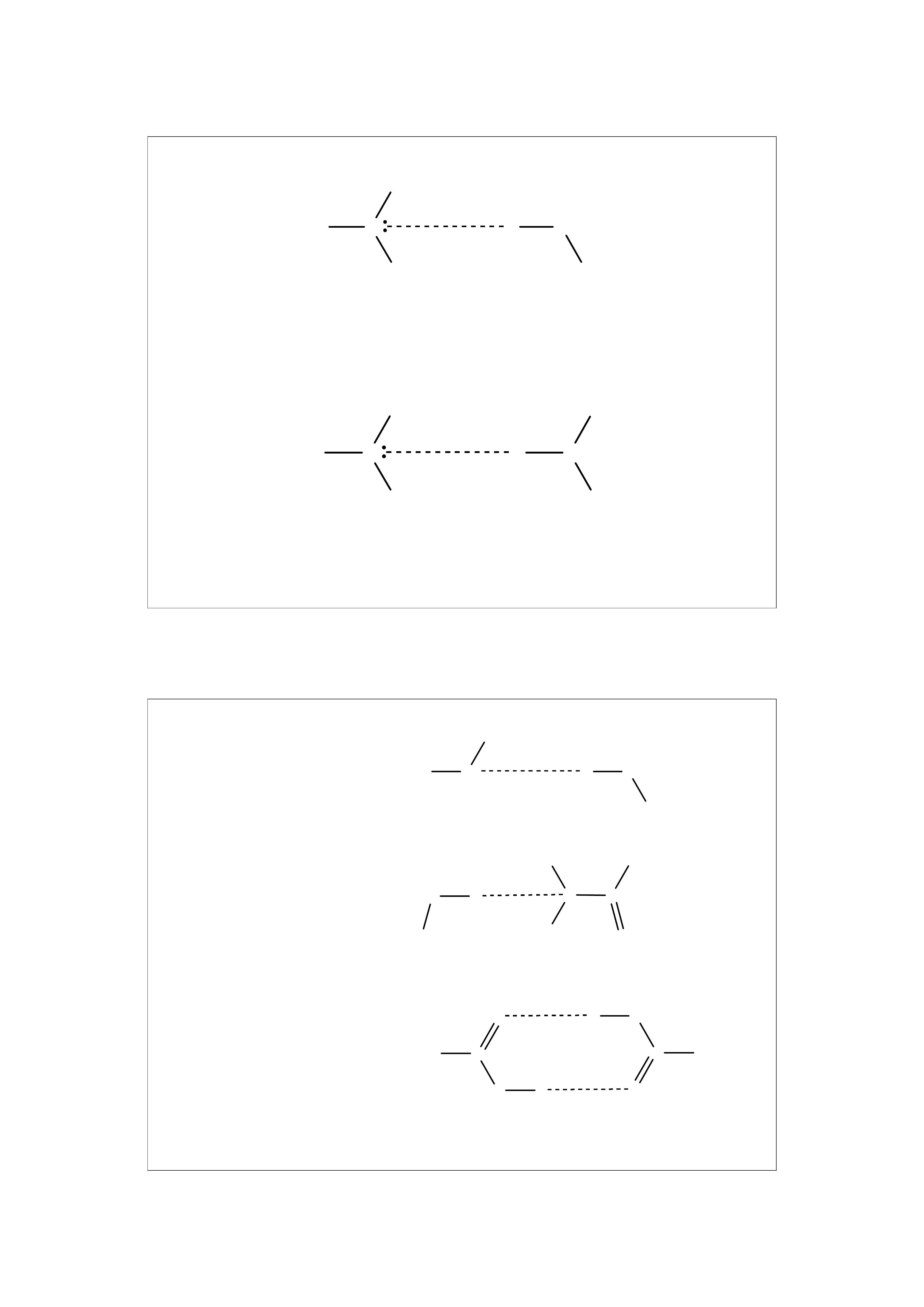
Wiązania wodorowe powstają między cząsteczkami, które
spełniają następujące warunki:
1. W obu cząsteczkach występują atomy silnie
elektroujemnych pierwiastków (F, O, N).
2. Przynajmniej w jednej cząsteczce musi się znajdować
atom wodoru związany kowalencyjnie z atomem silnie
elektroujemnym.
3. Cząsteczki muszą się zbliżyć do siebie w taki sposób,
aby atom wodoru związany kowalencyjnie z atomem
elektroujemnym jednej cząsteczki, spotkał się z atomem
elektroujemnym drugiej cząsteczki.
4
4. Wiązanie wodorowe jest najsilniejsze gdy atomy
elektroujemne i atom wodoru między nimi leżą w jednej
linii.
Wiązania wodorowe są 10 – 30 razy słabsze od
wiązań chemicznych (kowalencyjnych, jonowych).
W układach bilogicznych komórkach wiązania
wodorowe występują pomiędzy parami atomów:
O i O, N i N, O i N.
5
R
N
H
H
H
O
H
δ+
δ−
R
N
H
H
H
N
H
R
1
amina - woda
amina - amina
6
R
O
H
H
O
R
alkohol-alkohol
R
C
O
N
H
H
O
H
H
woda-amid
R
C
O
O
H
R
C
O
O
H
2 kwasy karboksylowe
7
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
8
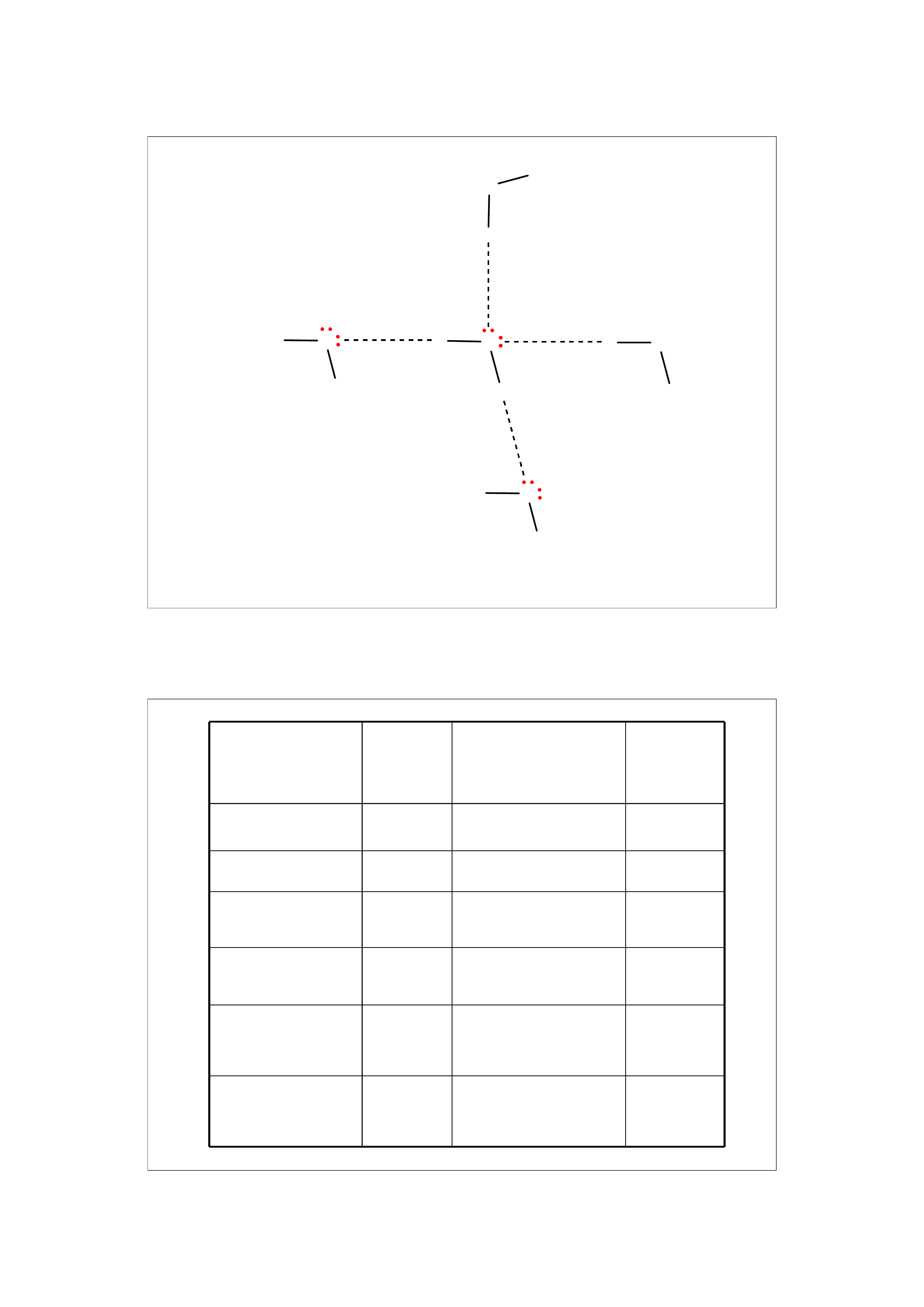
Nazwa
Masa
molowa
Maks. liczba
wiązań
wodorowych
Temp.
wrzenia
Propan
44
0
- 42ºC
Woda
18
4
100ºC
Metanol
32
3
65ºC
Etanol
46
3
78ºC
Eter
dimetylowy
46
0
- 42ºC
Eter
dietylowy
70
0
35ºC
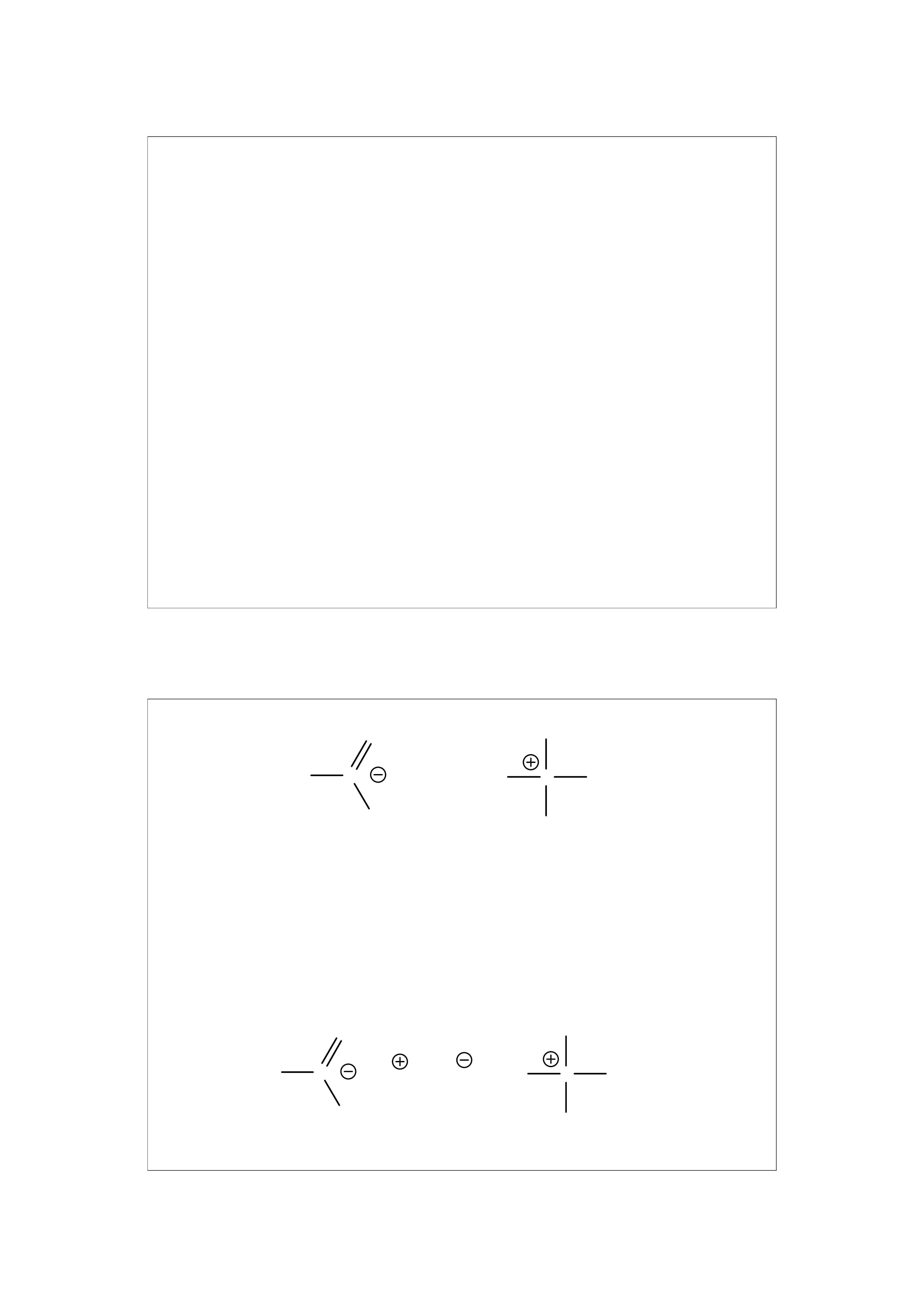
9
Oddziaływania jon – jon
Są to siły przyciągania między cząsteczkami posiadającymi
różnoimienne ładunki elektryczne.
Różnią się od wiązań jonowych tym, że ładunki elektryczne
są rozmyte (zdelokalizowane) na kilka atomów, a odleg-
łości między ładunkami są znacznie większe w porównaniu
z odległościami między jonami w sieci krystalicznej.
Podlegają prawu Coulomba czyli siła oddziaływań jest
proporcjonalna do 1/r
2
, gdzie r jest odległością między
ładunkami.
10
R
C
O
O
N
R
1
H
H
H
Oddziaływanie jon – jon jest często spotykanym wiązaniem
stabilizującym III-rzędową strukturę białek.
Oddziaływania tego typu są silnie osłabiane przez jony soli
obecne w roztworze, które powodują efekt „ekranowania”.
R
C
O
O
N
R
1
H
H
H
Na
Cl
11
Siły van der Waalsa (oddziaływania Londona,
oddziaływania dyspersyjne)
Najsłabsze oddziaływania międzycząsteczkowe.
Występują pomiędzy wszystkimi rodzajami cząsteczek.
Istnieją trzy rodzaje takich oddziaływań:
Dipol trwały – dipol trwały (efekt orientacyjny)
Dipol trwały – dipol indukowany (efekt indukcyjny)
lub jon – dipol indukowany
Dipol chwilowy – dipol chwilowy (efekt dyspersyjny)
12
Efekt orientacyjny
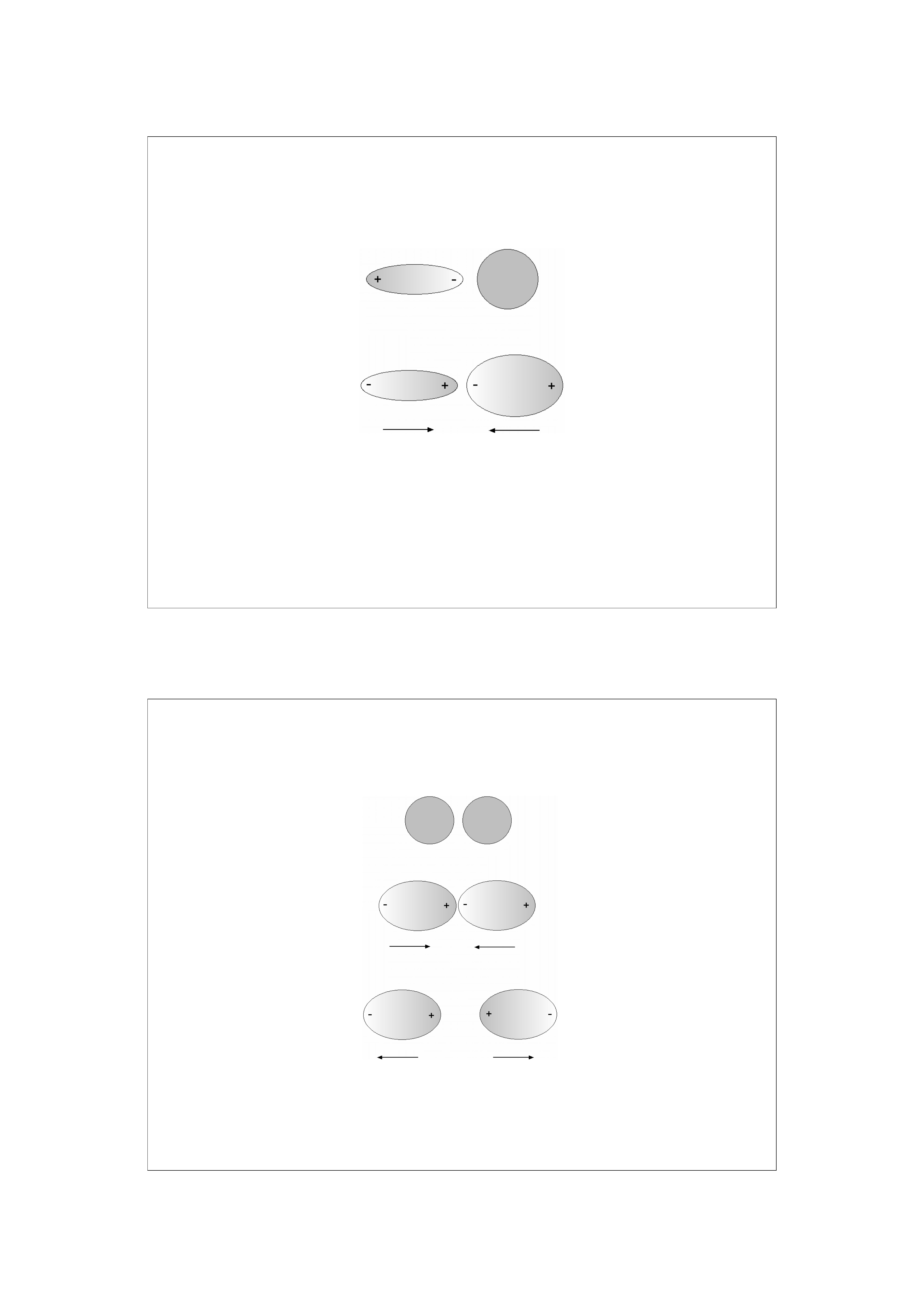
13
Efekt indukcyjny
Siła oddziaływań proporcjonalna do 1/r
4
14
Efekt dyspersyjny
Siła oddziaływań proporcjonalna do 1/r
6

15
Roztwory
Roztworem nazywamy jednorodną mieszaninę substancji
stanowiącą jedną fazę.
Roztwory mogą się znajdować w stanie gazowym, ciekłym
lub stałym.
Substancję, która występuje w nadmiarze nazywamy
rozpuszczalnikiem.
Roztwory właściwe składają się z rozpuszczalnika i sub-
stancji rozpuszczonej, której wymiary wynoszą poniżej 10
-7
cm (1 nm). Roztwory właściwe nie dają efektu Tyndalla.
Roztwory koloidalne zawierają cząstki substancji
rozpuszczonej o wymiarach 1 – 200 nm, dają efekt
Tyndalla.
16
Mechanizmy tworzenia roztworów
1. Solwatacja (hydratacja)
2. Dyspersja
3. Reakcja chemiczna
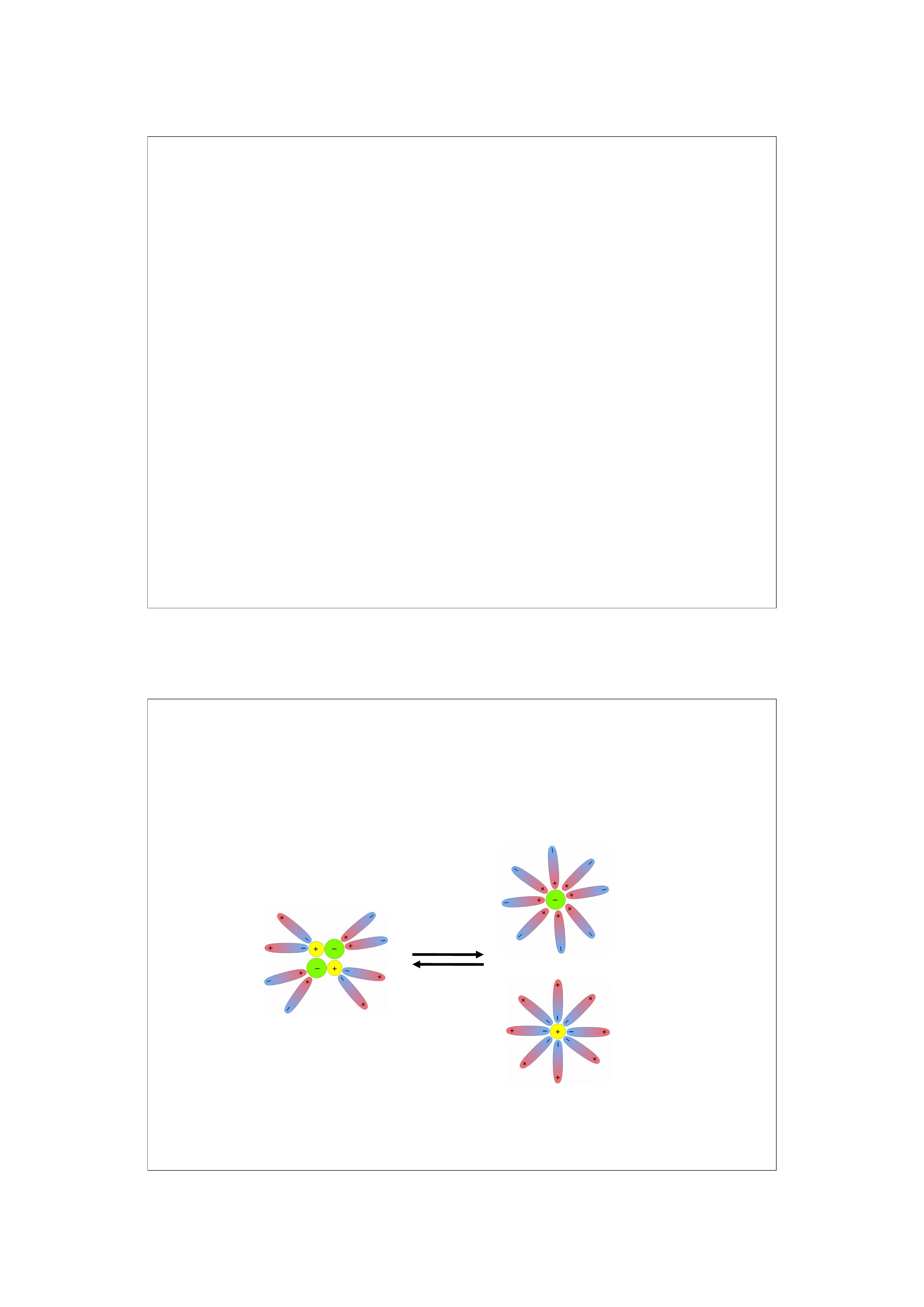
17
1. Solwatacja
Proces otaczania cząsteczek substancji rozpuszczonej
przez cząsteczki rozpuszczalnika stabilizowany przez
oddziaływania międzycząsteczkowe. Powstają tzw.
solwaty.
Zachodzi wówczas, gdy obie substancje mają charakter
polarny i mogą się przyciągać lub mogą tworzyć wiązania
wodorowe.
Mechanizm solwatacji zachodzi podczas rozpuszczania w
wodzie soli i wodorotlenków lub związków z grupami silnie
polarnymi np. wodorotlenowymi lub aminowymi.
18
Solwatacja (hydratacja) w wyniku oddziaływań dipol - jon
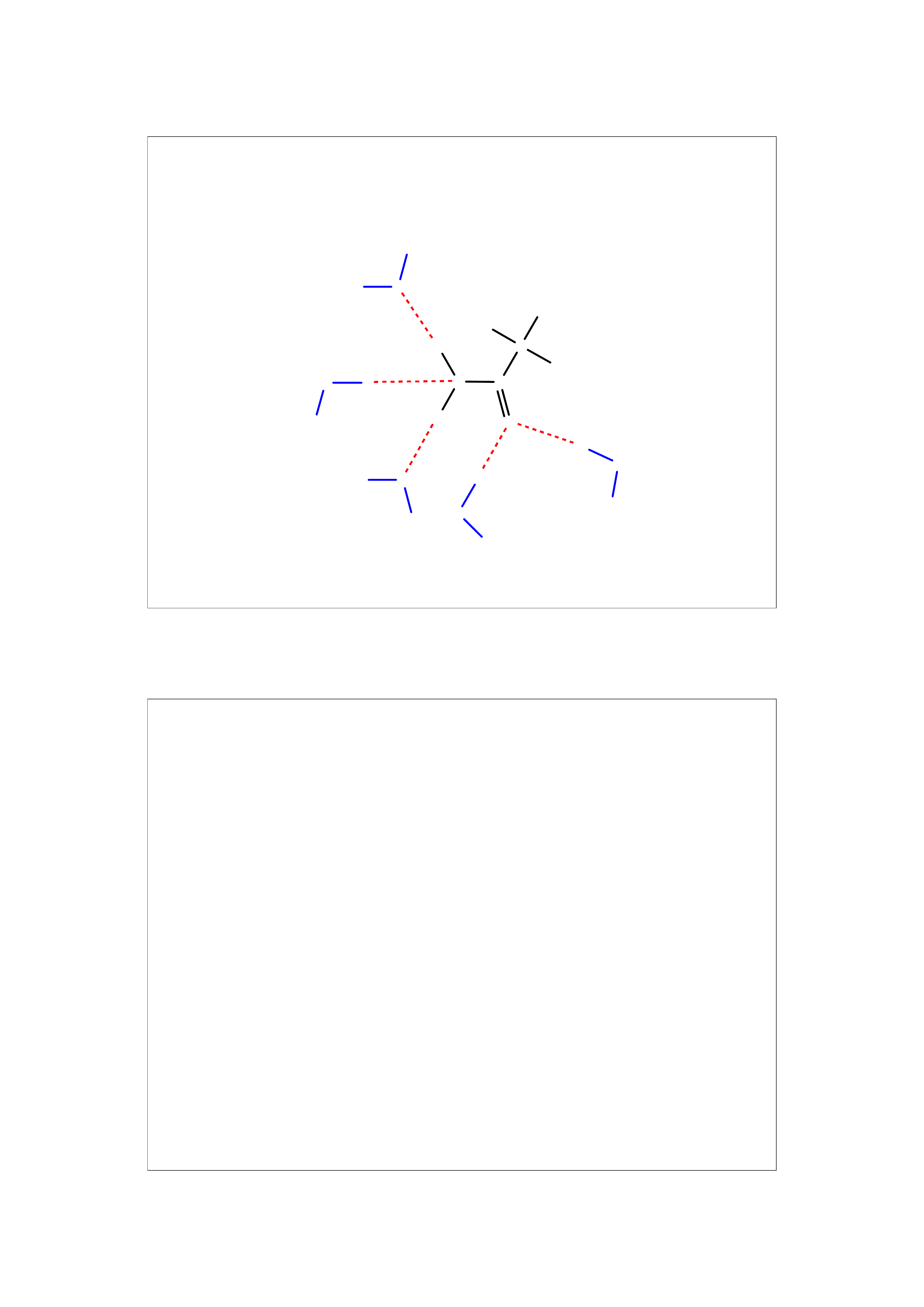
19
C
C
H
H
H
O
N
H
H
O
H
H
O
H
H
O
H
H
O
H
H
O
H
H
Hydratacja w wyniku tworzenia wiązań wodorowych
20
2. Dyspersja
Zachodzi wówczas, gdy obie substancje mają charakter
apolarny. Nie dochodzi wtedy do solwatacji lecz w wyniku
procesów dyfuzji następuje ujednorodnienie układu
dwufazowego do jednofazowego.
Powodem dyfuzji są w tym przypadku oddziaływania
międzycząsteczkowe typu dipol chwilowy – dipol chwilowy,
czyli siły van der Waalsa (efekt dyspersyjny).
Przykładem może być np. rozpuszczanie toluenu w
benzenie.

21
Tworzenie roztworu w wyniku dyspersji zachodzi także w
trakcie rozpuszczania substancji apolarnej w rozpuszczal-
niku polarnym (np. tlen w wodzie) lub odwrotnie (np. woda
w benzenie).
Do dyspersji dochodzi w wyniku oddziaływań typu dipol
trwały – dipol indukowany, czyli sił van der Waalsa (efekt
indukcyjny).
W układach tego rodzaju roztwory mają bardzo niskie
stężenia.
22
3. Reakcja chemiczna pomiędzy rozpuszczalnikiem i
cząsteczkami substancji rozpuszczanej. Powstają nowe
związki chemiczne.
2Na + 2H
2
O 2Na + 2OH + H
2
HCl + H
2
O H
3
O + Cl
RCOOH + H
2
O H
3
O + RCOO
NH
3
+ H
2
O NH
4
+ OH

23
Rozpuszczalność (definicje)
Definicja potoczna
Zdolność substancji do rozpuszczania się.
Definicja chemiczna 1
Masa substancji wyrażona w gramach, która tworzy w
określonych warunkach (temp. i ciśnienia) roztwór
nasycony w 100 g danego rozpuszczalnika.
Stosowana jest w katalogach i kalendarzach chemicznych
w celu charakterystyki właściwości danego związku.
Definicja chemiczna 2
Rozpuszczalność (S) jest to stężenie molowe nasyconego
roztworu danej substancji w określonych warunkach (temp.
i ciśnienia).
Stosowana do obliczeń.
24
Nie ma prostego związku między budową cząsteczek roz-
puszczalnika, a budową cząsteczek substancji rozpusz-
czonej.
Istnieje ogólna tendencja, że substancje jonowe i polarne
rozpuszczają się lepiej w rozpuszczalnikach polarnych, a
substancje apolarne w rozpuszczalnikach apolarnych.
Istnieje jednak bardzo wiele przykładów, że substancje
jonowe (sole i wodorotlenki) rozpuszczają się w wodzie
bardzo słabo (AgCl, PbS, BaSO
4
, Ca(OH)
2
).
Związki kowalencyjne z grupami polarnymi zwykle dobrze
rozpuszczają się w wodzie, ale rozpuszczalność spada dla
związków makrocząsteczkowych (np. skrobia, białka),
które tworzą roztwory koloidalne.

25
metanol etanol propanol
Rozpuszczają się w wodzie bez ograniczeń
n
-butanol
S = 9 g/100g
n
-pentanol
S = 2,7 g/100g
26
W miarę wzrostu części apolarnej cząsteczki obniża się
stała dielektryczna związku i jego rozpuszczalność w wo-
dzie maleje.
Stała dielektryczna
ε, wskazuje ile razy oddziaływanie
między ładunkami elektrycznymi jest słabsze w obecnoś-
ci danego rozpuszczalnika w porównaniu z próżnią.
ε
ε
próżnia
1
aceton
21,4
woda 80
eter
4,3
metanol
33 benzen
2,4
etanol
24
CCl
4
2,2
n
-propanol
20
heksan
2
n
-butanol
18
n
-pentanol
16

27
Niektóre związki wykazują powinowactwo zarówno do
związków polarnych, jak również apolarnych.
Cząsteczki z wyraźną biegunowością polarności nazy-
wamy amfilowymi lub amfipatycznymi.
Jon stearynianowy jest amfipatyczny
(ładunek ujemny zaznaczony kolorem czerwonym)
28
Właściwości roztworów
• Ciśnienie osmotyczne
• pH
• Efekt ebulioskopowy
• Efekt krioskopowy
• Przewodnictwo elektryczne
• Lepkość
Wszystkie te właściwości są proporcjonalne do stężenia
molowego roztworu.

29
Stężenia
1. Ułamek molowy jest stosunkiem liczby moli danego
składnika roztworu do sumy liczby moli wszystkich
składników.
Ułamek molowy jest rzadko stosowany w biochemii i
chemii organicznej. Stosowany jest w chemii fizycznej
do niektórych obliczeń.
2. Stężenie molowe (c) jest stosunkiem liczby moli sub-
stancji rozpuszczonej do objętości roztworu wyrażonej w
dm
3
.
Stężenie molowe zwane też molowością oznaczane jako c
lub M jest najczęściej stosowanym rodzajem stężenia.
30
c
n
V
=
Gdzie n jest liczbą moli, a V objętością w dm
3
.
Molowość można też obliczyć stosując jako n liczbę mmoli
i wyrażając objętość w cm
3
.
3. Stężenie procentowe (c%) jest stosunkiem masy
substancji rozpuszczonej do masy roztworu wyrażonym
w procentach.
c%
m
M
=
100%
x
jednostką c jest mol/dm
3

31
Zależnie od potrzeb stosowane są różne odmiany stęże-
nia procentowego:
% wagowo – wagowy (stosunek mas, g/g), gdy gęstość
roztworu znacząco różni się od 1 g/cm
3
.
% wagowo – objętościowy (stosunek masy do objętości,
g/v), gdy gęstość roztworu w przybliżeniu wynosi 1
g/cm
3
.
% objętościowo – objętościowy (stosunek objętości, v/v),
gdy substancja rozpuszczona i rozpuszczalnik są
roztworami.
32
Aktywność molowa
Zauważono, że właściwości stężonych roztworów niek-
tórych substancji (szczególnie mocnych elektrolitów) nie
Są wprost proporcjonalne do stężenia molowego.
W ramach tzw. teorii elektrolitów mocnych zapropono-
wano pojęcie aktywności molowej , nazywaną także
aktywnością roztworu, które w wielu równaniach powin-
no zastępować stężenie molowe.
Jednostką aktywności (a) jest mol/dm
3
.
Aktywność molowa jest efektywnym termodynamicznie
(pozornym) stężeniem roztworu przejawiającym się w
konkretnych właściwościach fizykochemicznych roztworu.
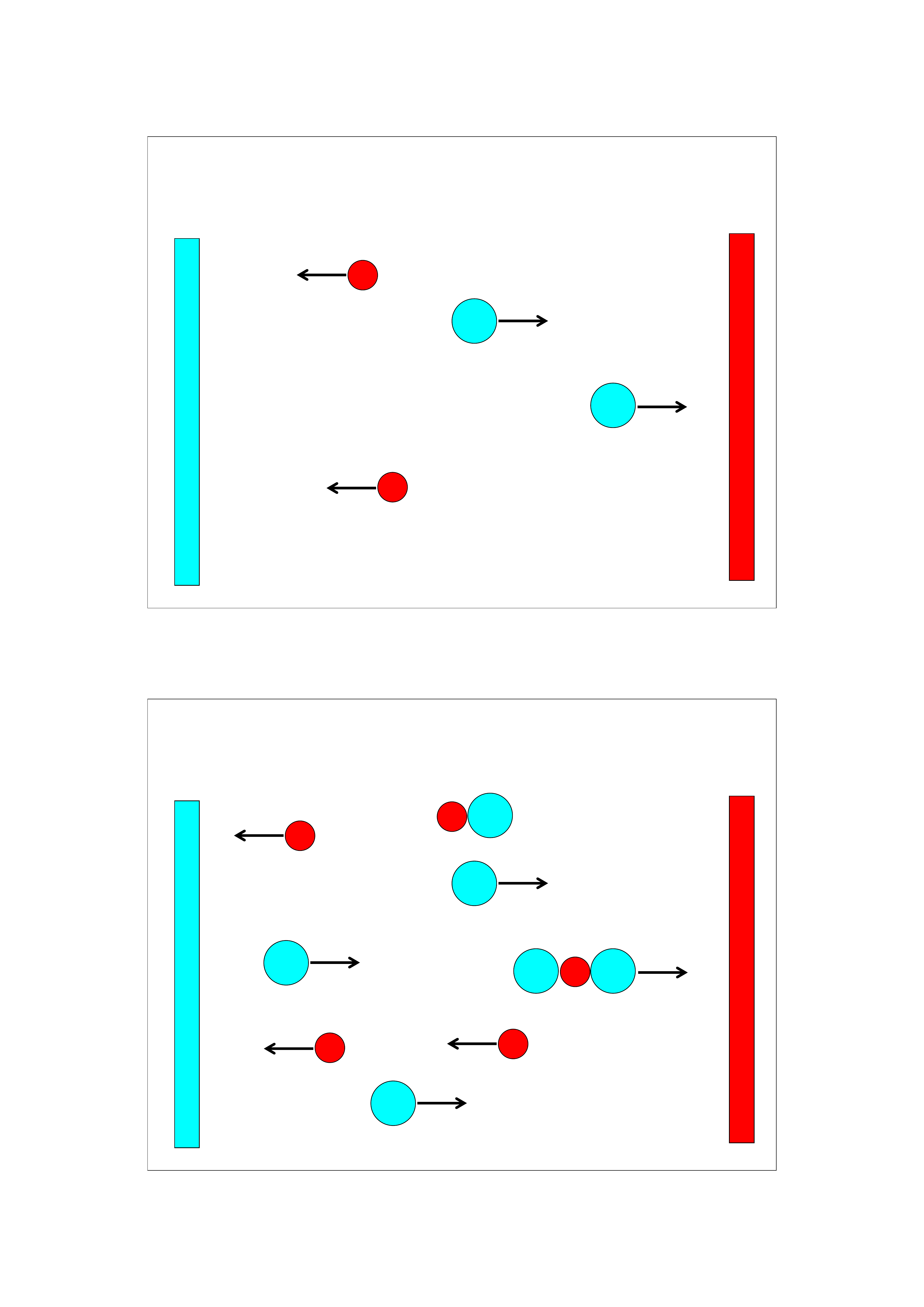
33
+
_
+
_
_
+
Pomiar przewodnictwa (niskie stężenie jonów)
34
+
_
+
_
+
Pomiar przewodnictwa (wysokie stężenie jonów)
_
_
+
+
_
_
+
_
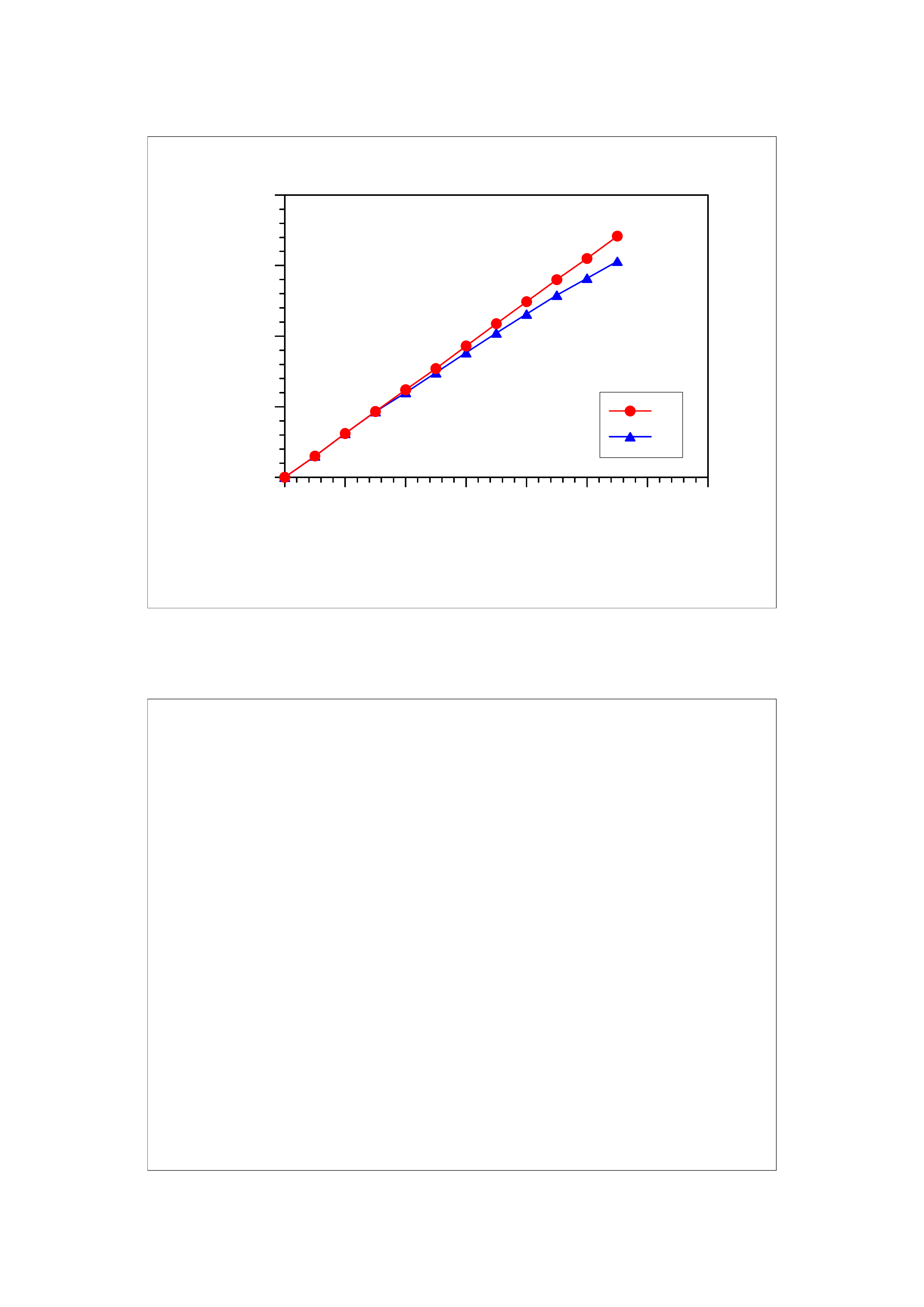
35
0,00
0,05
0,10
0,15
0,20
M
o
lar conce
ntra
tio
n and act
ivi
ty
0,0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
Concentration (g/100g)
C
a
36
Aktywność zależy od stężenia molowego roztworu, lecz
nie jest do niego wprost proporcjonalna
a ~ c
a = f · c
gdzie f jest współczynnikiem aktywności zależnym od
siły oddziaływań między cząsteczkami substancji
rozpuszczonej.
0 ≤ f ≤ 1 czyli 0 ≤ a ≤ c
Aktywność jest równa molowości tylko w roztworach
nieskończenie rozcieńczonych (w praktyce o bardzo
niskim stężeniu), w których f = 1.

37
Wartość f zależy od oddziaływań między jonami. Im są
silniejsze, tym f jest niższy. Wzrost stężenia jonów
obniża współczynnik aktywności.
Absolutna wielkość ładunku jonów również ma wpływ
na f.
Np. jony Ca
2+
wpływają na wartość f w większym
stopniu niż jony Na
+
o tym samym stężeniu.
Wyszukiwarka
Podobne podstrony:
Chemia ogolna wyklady 5 6 2012 Nieznany
Chemia ogólna wykład 4 2012
Chemia ogólna wykład 7 2012
Chemia ogólna wykład 4-2012
Chemia ogolna wyklad 3 2012 id Nieznany
Chemia ogólna wykład 1 2012
Chemia ogolna wyklady 5 6 2012 Nieznany
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
Chemia ogólna program 2012 2013
Slownik ChemLab, Studia, Chemia ogólna wykład
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
Elektrody, CHEMIA, semestr 1, chemia ogólna, wykłady
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
więcej podobnych podstron