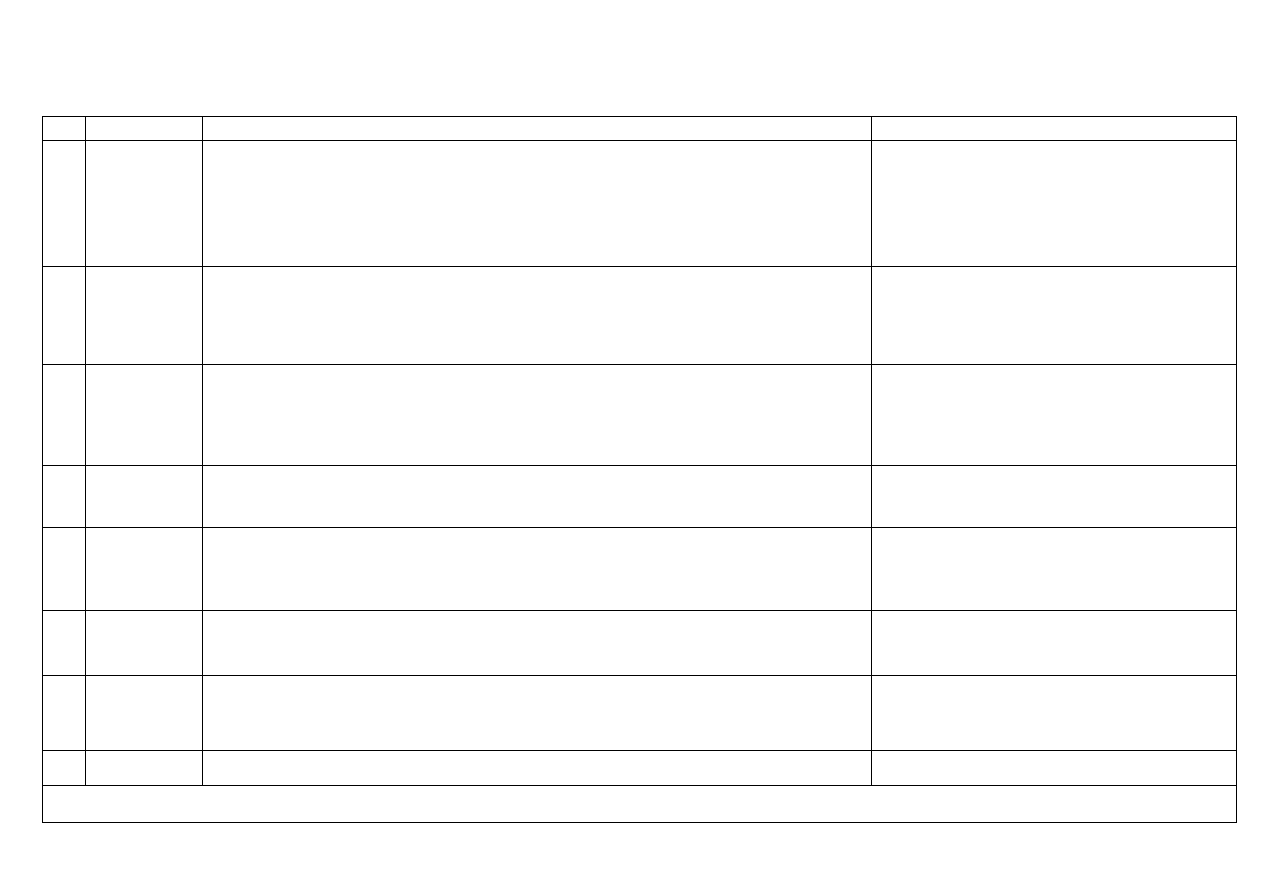
PROGRAM ZAJĘĆ Z CHEMII OGÓLNEJ DLA STUDENTÓW I ROKU BIOTECHNOLOGII MEDYCZNEJ W ROKU 20012/2013
Nr
Data zajęć
Część teoretyczna
Część laboratoryjna
1
8 –12
października
Budowa atomu. Rozmieszczenie elektronów w atomie (pierwszych 18 pierwiastków układu okresowego),
Orbitale atomowe s i p, Orbitale cząsteczkowe wiążące i antywiążące na przykładzie cząsteczki H
2
i O
2
.
Hybrydyzacja orbitali. Pojęcie elektroujemności. Wiązania chemiczne: kowalencyjne apolarne i
spolaryzowane, jonowe, koordynacyjne. Wiązania pojedyncze (
σ
) i wielokrotne (
π
). Wpływ rodzaju wiązań
w cząsteczce na właściwości związków. Polarność cząsteczek, moment dipolowy. Utlenianie i redukcja:
stopień utlenienia – definicja i obliczanie dla związków węgla. Reaktywne formy tlenu (budowa i potencjały
red-oks): anionorodnik ponadtlenkowy, H
2
O
2
, rodnik hydroksylowy. (2 godz.)
Analiza kationów: Ag
+
, Pb
2+
, Hg
2
2+
, Cu
2+
, Hg
2+
, Mn
2+
,
Fe
3+
, Zn
2+
, Ca
2+
, Ba
2+
, Mg
2+
, Na
+
, K
+
, NH
4
+
.
Podział na
grupy analityczne, odczynniki grupowe, reakcje
charakterystyczne (równania). (4 godz.)
2
15 – 19
października
Oddziaływania międzycząsteczkowe: wiązanie wodorowe – sposób powstawania i wpływ na właściwości
związków chemicznych. Siły van der Waalsa, efekt orientacyjny, indukcyjny i dyspersyjny, przykłady.
Roztwory rzeczywiste i koloidalne. Mechanizmy rozpuszczania się związków chemicznych. Ułamek
molowy, stężenie molowe, stężenie procentowe. Obliczanie i przeliczanie stężeń. Aktywność molowa
(roztworu, jonów), współczynnik aktywności. (2 godz.)
Analiza anionów: J
-
, Br
-
, Cl
-
, SCN
-
, CH
3
COO
-
, CO
3
2-
,
C
2
O
4
2-
, S
2
O
3
2-
, HPO
4
2-
, NO
3
-
, SO
4
2-
. Podział na grupy
analityczne, reakcje charakterystyczne (równania).
(4 godz.)
3
22 – 26
października
Energetyka reakcji chemicznych. Funkcje stanu: energia wewnętrzna (U), entalpia (H), energia swobodna
(F), entalpia swobodna (G). kierunek reakcji, reakcje samorzutne. Reakcje egzo- i endoergiczne. Kinetyka i
kataliza. Szybkość reakcji chemicznej i czynniki wpływające na jej wartość. Energia reakcji i energia
aktywacji. Rzędowość i cząsteczkowość reakcji. Przykłady reakcji I- i II-rzędu. Teoria zderzeń efektywnych i
kompleksu aktywnego. Kataliza homo- i heterogenna. (2 godz.)
Analiza soli. Powtórzenia metod identyfikacji kationów i
anionów. (4 godz.)
4
5 – 9 listopada
Równowaga reakcji: Reakcje odwracalne i „nieodwracalne”. Stała równowagi i czynniki wpływające na jej
wielkość. Równowaga metastabilna. Wydajność reakcji, reguła przekory – czynniki wpływające na zmianę
stanu równowagi i wydajności reakcji. (2 godz.)
Alkacymetria 1:
Oznaczanie ilościowe CH
3
COOH i NaOH. (4 godz.)
5
12 – 16 listopada
Właściwości roztworów wodnych cz. 1. Dysocjacja eletrolityczna - mechanizm. Stopień i stała dysocjacji.
Prawo rozcieńczeń Ostwalda. Elektrolity mocne - aktywność roztworu, współczynnik aktywności. Teoria
kwasów i zasad Brönsteda-Lowry'ego. Iloczyn rozpuszczalności i jego związek z rozpuszczalnością.
Czynniki wpływające na rozpuszczalność soli. Ciśnienie osmotyczne. (2 godz.)
Alkacymetria 2: Oznaczanie NaOH + Na
2
CO
3
,
Argentometria: Oznaczanie NaCl. (4 godz.)
6
19 – 23 listopada
Właściwości roztworów wodnych cz. 2. Definicja pH, zakres wartości w oparciu o iloczyn jonowy wody.
Krzywe miareczkowania mocnych i słabych kwasów i zasad. Charakterystyczne cechy krzywych: punkt
równoważnikowy, punkt pK
a,
skok miareczkowania, (2 godz.)
Redoksymetria. Oznaczanie ilościowe: K
2
Cr
2
O
7
,
(NH
4
)
2
C
2
O
4
, (4 godz.)
7
26 – 30 listopada
Roztwory buforowe mechanizm działania (równania), zakres buforowy. Pojemność buforowa. Zależność pH
buforu i pojemności buforowej od składu roztworu. Bufory fizjologiczne: węglanowy, fosforanowy.
Obliczenia chemiczne: stężenia, iloczyn rozpuszczalności i ciśnienie osmotyczne, pH, bufory (6 godz.).
Bez części laboratoryjnej
8
3 – 7 grudnia
Sprawdzian z zadań i repetytorium (3 godz.)
Bez części laboratoryjnej
Wykłady w czwartki godz. 8
00
– 9
45
Wyszukiwarka
Podobne podstrony:
Chemia ogolna wyklady 5 6 2012 Nieznany
PEDAGOGIKA OGÓLNA program 2012, Pedagogika, Pedagogika ogólna
Chemia ogólna wykład 2 2012
Chemia ogólna wykład 4 2012
Chemia ogólna wykład 7 2012
Chemia Ogólna - PROGRAM WPC1002w (Walkowiak), Biotechnologia PWR, Semestr 1, Chemia ogólna, Chemia o
Chemia ogólna wykład 4-2012
Chemia poprawa, Dietetyka 2012,2013, Chemia żywności
Chemia ogolna wyklad 3 2012 id Nieznany
Chemia ogólna wykład 1 2012
Chemia Ogólna - PROGRAM CHC011001w (Drozdzewski), Biotechnologia PWR, Semestr 1, Chemia ogólna, Chem
Chemia ogolna wyklady 5 6 2012 Nieznany
PEDAGOGIKA OGÓLNA program 2012, Pedagogika, Pedagogika ogólna
więcej podobnych podstron