
Chemia ogólna, nieorganiczna i analityczna.
str. 1
CHEMIA – WSTĘP
Chemia jest nauką o substancjach, ich strukturze, właściwościach reakcji, w których zachodzi przemiana
jednych substancji w drugie.
Badanie przemian chemicznych nie ogranicza się jednak tylko do klasyfikowania substancji i produktów
przemian, ale obejmuje także mechanizmy reakcji i sposoby kontrolowania szybkości reakcji oraz
wydajności tworzenia produktów. Podstawą ilościowych rozważań dotyczących reakcji chemicznych
są elementarne pojęcia prawa.
Nomenklatura (nazewnictwo związków)
O nazewnictwie związków chemicznych decyduje:
Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC)
Polskie Towarzystwo Chemiczne (PTchem)
Nomenklatura chemii nieorganicznej:
1) Związki binarne – składają się z dwóch części, zapisujemy je jako:
A
m
B
n
, gdzie
A – składnik bardziej elektrododatni
B- składnik bardziej elektroujemny
np. NaCl – chlorek sodu
OF
2
– di fluorek tlenu
XeF
2
- di fluorek ksenonu, fluorek ksenonu (II)
Cl
2
O
6
– heksatlenek difluoru, sześciotlenek dwuchloru.
2) Przedrostki – afiksy zwielokrotniające:
I.
mono
II.
di
III.
tri
IV.
tetra
V.
penta
VI.
heksa
VII.
hepta
VIII.
okta
IX.
nona
X.
deka
XI.
undeka
XII.
dodeka
Ogólnie
- niedużo, kilka – oligo
- dużo, wielo – poli
Cząsteczki pierwiastków
H – wodór atomowy (monowodór)
H
2
- diwodór (cząsteczka)
O
2
– ditlen (cząsteczka)
O
3
- tritlen (ozon)
F
4
- tetrafosfor
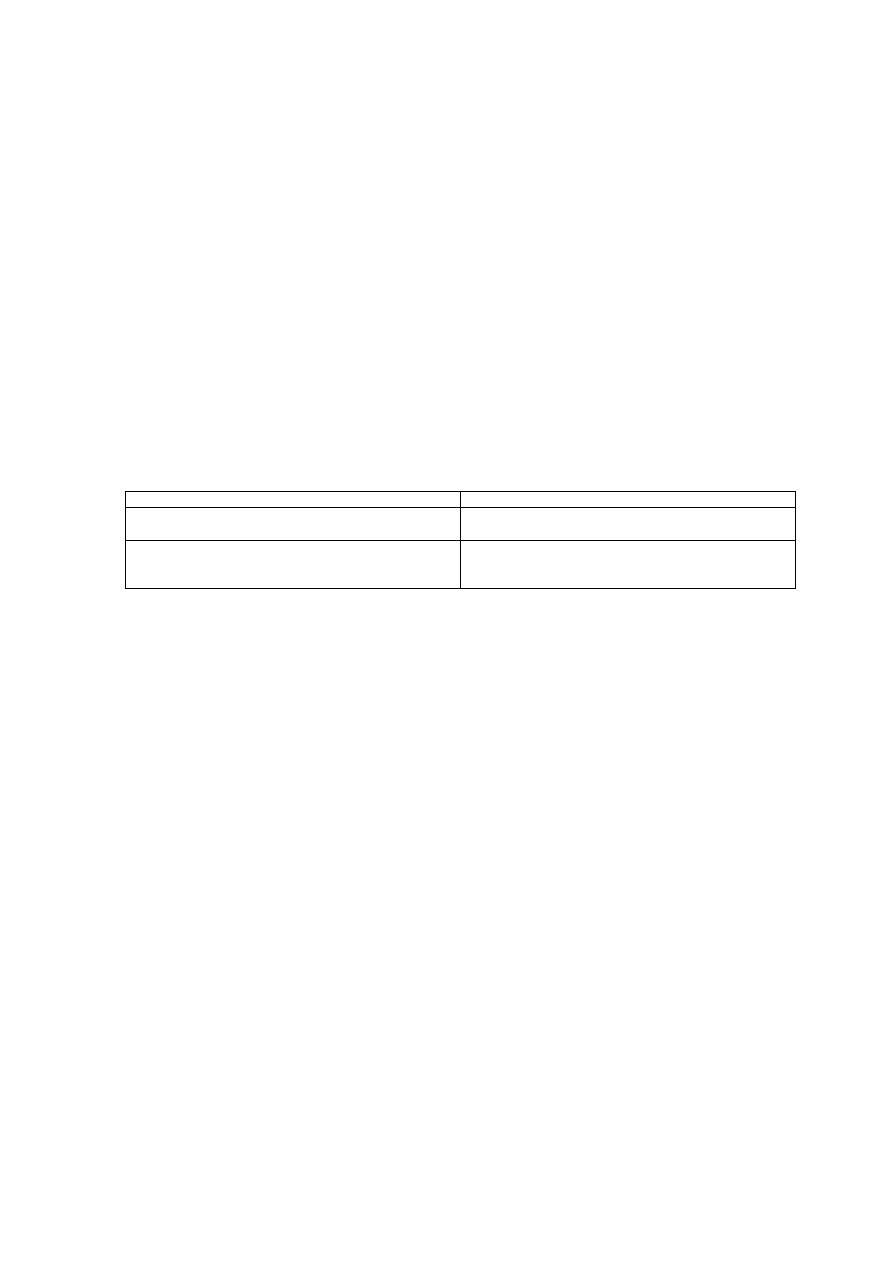
Chemia ogólna, nieorganiczna i analityczna.
str. 2
S
8
- oktasiarka
Cl
2
- dichlor (cząsteczka)
Uwagi:
- Należy unikać przedrostka –mono, z wyjątkiem, gdy jego brak spowoduje niejasność
- Jeżeli któryś z atomów związku ma stały powszechnie znany stopień utlenienia, to nazwy można
uprościć, pomijając zbędny przedrostek liczbowy.
Np. Al
2
O
3
– tritlenek diglinu = trójtlenek dwuglinu = tlenek glinu (III) = tlenek glinu
3) Określenia stechiometrii związków
a) system Stocka
Stopień utlenienia pierwiastka wyrażony cyfrą rzymską, np.
FeCl
3
– chlorek żelaza (III)
b) system Evensa – Bassetta
Stopień utlenienia pierwiastka wyrażony cyfrą arabską z uwzględnieniem znaku plus lub minus,
np. FeCl
3
– chlorek żelaza (3+)
4) Ogólne zasady tworzenia części elektroujemnej związku.
Końcówka -ek
Końcówka – an
Gdy część elektroujemna składa się z jednego
pierwiastka, np. KF – fluorek potasu
Gdy część elektroujemna składa się z dwóch lub więcej
pierwiastków, np. KClO
4
- chloran (VII) potasu
Wyjątki:
KCN – cyjanek potasu
NaOH – wodorotlenek sodu
Wyjątki:
PH
3
- fosforan
B
2
H
6
– boran
5) Cząsteczki bardziej złożone
a) cząsteczki typu ABC, gdzie BC – bardziej elektroujemne (grupy V, VI, VII w układzie okresowym)
Np. XeO
2
F
2
- difluorek ditlenek ksenonu (VI)
XeOF
4
– tetrafluorek tlenek ksenonu (VI) lub tetrafluorek tlenek ksenonu lub czterofluorek ksenonu
b) związki kompleksowe
Na[XeF
7
] lub NaXeF
7
– heptafluoroksenian (VI) sodu
Na
2
[XeF
8
] lub Na
2
XeF
8
- oktafluoroksenonian (VI) disodu
HClO
3
– kwas trioksochlorowy (V) = kwas chlorowy (V)
c) Pięć różnych kwasów nadjodowych
HIO
4
- kwas tetraoksojodowy (VII)
H
3
IO
5
- kwas pentaoksojodowy (VII)
H
5
IO
6
- kwas heksaoksojodowy (VII)
H
4
I
2
O
9
- kwas nanookodijodowy (VII)
H
7
I
3
O
14
- kwas tetradekaoksotrijodowy (VII)
UWAGA: Okso – tlen połączony z innym pierwiastkiem; z wyjątkiem tlenków
6) Oznaczenie liczby atomowej, masowej i ilości atomów w cząsteczce.
A – liczba masowa -> wskaźnik lewy górny
Z- liczba atomowa -> wskaźnik lewy dolny
ilość atomów danego pierwiastka w cząsteczce – wskaźnik prawy dolny

Chemia ogólna, nieorganiczna i analityczna.
str. 3
Nazewnictwo wodorków.
Nazwy wodorków lotnych tworzy się dodając do nazwy pierwiastka „-an”.
KH – wodorek potasu
HCl – chlorek wodoru
PH
3
- fosforan
NH
3
- amoniak = azan = hydrazyna
AsH
3
- arsan = ersyna
H
2
O – woda = oksydan
SiH
4
- silan
H
2
S – siarkowodór = sulfan
H
2
Se – selenowodór = selan
H
2
Te – teluowodór = tellan
wodorki binarne – od bardziej elektroujemnej – ek.
wodorki inne- końcówka –an z wyjątkiem połączeń z fluorem i tlenem.
Nazewnictwo wodorotlenków.
Nazwy wodorotlenków prostych tworzy się łącząc słowo „wodorotlenek” z nazwą pierwiastka
w dopełniaczu.
KOH – wodorotlenek potasu
Cu(OH)
2
- wodorotlenek miedzi (II)
Nazewnictwo kwasów.
-beztlenowe
Nazwy anionów kwasów beztlenowych mają końcówkę „-kowy”.
HF – fluorek wodoru – kwas fluorowodorowy - fluorek (anion fluorkowy)
HBr – bromek wodoru – kwas bromowodorowy – bromek
HI – jodek wodoru – kwas jodowodorowy – jodek
Kwas tiocyjanowy (rodanowodorowy) HSCN
Sól: Triacyjanki (rodanki)
MASA ATOMOWA I CZĄSTECZKOWA
Bezwzględne masy atomów uczestniczących w reakcjach chemicznych wyrażone bardzo małymi liczbami
nie są rozpatrywane ze względów praktycznych. W to miejsce stosuje się wielkości będące względnymi
masami atomowymi, odniesionymi do jednostki masy atomowej "u", stanowiącej 1/12 masy atomu
izotopu węgla
12
C.
1u = 1,66057 * 10
-27
kg
Zatem względną masę atomową pierwiastka definiuje się jako liczbę określającą ile razy masa
przeciętnego atomu danego pierwiastka jest większa od jednostki masy atomowej "u", stanowiącej 1/12
części masy atomu izotopu
12
C.
Przykład obliczenia względnej masy atomowej dla atomu magnezu
24
Mg
A(
24
Mg) = 4 * 10
-26
kg : 1,66057 * 10
-27
kg = 24
Dla związku chemicznego, a także dla wieloatomowych cząsteczek pierwiastków masa cząsteczkowa
stanowi sumę mas atomowych pierwiastków wchodzących w skład jednej cząsteczki, uwzględniającą
oczywiście krotność występujących w niej atomów.

Chemia ogólna, nieorganiczna i analityczna.
str. 4
MOL
Miarą liczebności materii jest mol, czyli ilość substancji, która zawiera taką liczbę atomów, cząsteczek,
jonów bądź innych cząsteczek materialnych, ile atomów znajduje się w 12 g węgla
12
C. Ilość ta wynosi:
1 mol = 6,023 * 10
23
jednostek
Nosi ona nazwę liczby Avogadra i jest oznaczana literą N
a
.
MASA MOLOWA
Masą jednego mola atomów, cząsteczek, jonów bądź innych cząstek materialnych wyrażoną w gramach
nazywa się masą molową danej substancji. Jest ona oznaczana dużą literą M.
Jednostka : kg * mol
-1
lub g * mol
-1
Ponieważ liczba atomów, cząsteczek, jonów bądź innych cząstek materialnych zawarta w jednym molu
dowolnej substancji jest równa liczbie Avogadra /N
a
/
N
a
= 6,023 * 10
23
Istnieje zależność:
M = N
a
* m
Gdzie: M - oznacza masę molową, a m bezwzględną masę atomu, cząsteczki, jonu bądź innej cząstki
materialnej.
PRAWO AVOGADRO
Prawo Avogadra określa że, jednakowe objętości gazów zawierają w tej samej temperaturze i pod
tym samym ciśnieniem jednakową liczbę cząsteczek.
A to oznacza, że w warunkach normalnych 22,4 dm
3
tlenu, dwutlenku węgla, helu i wielu innych gazów
będzie zawierało 6,02 * 10
23
cząsteczek lub atomów.
PRAWO ZACHOWANIA MASY
Pomiędzy masą a energią, stanowiącymi dwie formy materii, istnieje zależność określona przez Einsteina
wzorem
E = mc
2
Gdzie: E - energia, m - masa , c - prędkość światła.
Z zależności tej wynika, że w miejsce rozpatrywanych niegdyś odrębnie dwóch praw, a to:
Prawa zachowania energii określającego, że w danym układzie zamkniętym suma energii
pozostaje stała, bez względu na przemiany, jakim ulegają wzajemnie jej poszczególne rodzaje.
Prawa zachowania masy wyrażającego, iż łączna suma mas substratów równa się łącznej masie
produktów reakcji chemicznej
należy obecnie w świetle równoważności masy i energii, mówić o prawie zachowania materii.
Uogólnione prawo zachowania materii można wyrazić równaniem:
/E
j
+ m
j
c
2
/ = const
gdzie: E
j
- energia zawarta wewnątrz układu w różnych postaciach, m
j
- masy składające się na układ
substancji.

Chemia ogólna, nieorganiczna i analityczna.
str. 5
PRAWO STOSUNKÓW STAŁYCH
Reakcje chemiczne przebiegają jedynie przy zachowaniu ściśle określonej proporcji substratów.
Stałe stosunki wagowe pierwiastków w związkach
Lp.
Związek chemiczny
Wzór cząsteczkowy
Stosunek wagowy
pierwiastków
1. Woda
H
2
O
H : O = 1 : 8
2. Amoniak
NH
3
H : N = 1 : 4,66
3. Metan
CH
4
H : C = 0,333 : 1
4. Acetylen
C
2
H
2
H : C = 0,084 : 1
Sformułowane przez Prousta /1799/ prawo stosunków stałych wyraża, że każdy związek chemiczny ma
stały i charakterystyczny skład ilościowy.
PRAWO STOSUNKÓW WIELOKROTNYCH
Jeżeli dwa pierwiastki mogą tworzyć kilka związków chemicznych, bo obowiązuje dalsza zależność ich
składów ilościowych wyrażona prawem DALTONA w 1804r.
Jeżeli dwa pierwiastki zdolne są tworzyć z sobą więcej niż jeden związek chemiczny, to w związkach tych
ilości wagowe jednego pierwiastka przypadające na stałą ilość wagową drugiego pierwiastka pozostają
do siebie w stosunku niewielkich liczb całkowitych.
Na przykład wodór i tlen tworzą dwa związki: H
2
O i H
2
O
2
. Z taką samą ilością wagową wodoru, wynoszącą
2,016 g w jednym z tych związków związane jest 16 g tlenu, a w drugim 32 g tlenu. Wzajemny stosunek
wagowy ilości tlenu związanego w związkach z taką samą ilością wagową wodoru wyraża się liczbami
1 : 2.
Azot i tlen tworzą z sobą pięć różnych tlenków N
2
O, NO, N
2
O
3
, NO
2
, N
2
O
5
W poszczególnych tlenkach azotu na 14 g azotu przypada odpowiednio: 8, 16, 24, 32, 40 g tlenu.
Wzajemny stosunek ilości wagowych tlenu związanego z jednakową ilością wagową azotu wyraża się
prostymi liczbami całkowitymi 1 : 2 : 3 : 4 : 5
PRAWO STOSUNKÓW OBJĘTOŚCIOWYCH
Jeżeli reagujące ze sobą substancje znajdują się w stanie gazowym, to objętości poszczególnych gazów
zarówno substratów jak i gazowych produktów reakcji, pozostają do siebie w stosunku niewielkich liczb
całkowitych.
Prawo to, zwane prawem prostych stosunków objętościowych, zostało sformułowane przez Gay-Lussaca
/1808/. Jest ono prostą konsekwencją prawa Avogadra, według którego jednakowe objętości wszystkich
gazów, mierzone w tych samych warunkach fizycznych, zawierają jednakową liczbę cząsteczek.
Jeżeli na przykład w dwóch jednakowych objętościach znajduje się po 6,023 x 10
23
cząsteczek wodoru H
2
i chloru Cl
2
, to w reakcji między nimi
1 objętość wodoru H
2
+ 1 objętość chloru Cl
2
----> 2 objętości chlorowodoru 2HCl
tworzy się chlorowodór w ilości 2 x 6,023 x10
23
cząsteczek, gdyż z każdej cząsteczki H
2
oraz Cl
2
powstają
dwie cząsteczki chlorowodoru.
Z prawa Avogadra wynika jeszcze jeden istotny wniosek:
ilości molowe jakichkolwiek substancji w stanie gazowym zajmują w tych samych warunkach fizycznych

Chemia ogólna, nieorganiczna i analityczna.
str. 6
jednakowe objętości. Obliczono, że jeden mol jakiegokolwiek gazu zajmuje w warunkach normalnych / temp.
0
o
C, ciśnienie 1013 hPa/ objętość 22,4 dm
3
. Objętość ta nazywa się objętością molową.
WARTOŚCIOWOŚĆ PIERWIASTKA
Wartościowość pierwiastka określa liczbę atomów wodoru przypadających w cząsteczce na jeden atom
danego pierwiastka.
Wartościowość oznacza się cyfrą rzymską w nawiasie po symbolu pierwiastka np. Cl(I), Fe(III), C(IV).
Pierwiastki w stanie wolnym wykazują wartościowość zerową.
Od czego zależy wartościowość pierwiastka w związkach?
Wartościowość zależy głównie od konfiguracji elektronowej atomów pierwiastka a szczególnie ilości
elektronów walencyjnych. Ilość elektronów walencyjnych określa maksymalną wartościowość
pierwiastka w związkach chemicznych.
Na przykład:
siarka (konfiguracja (2, 8, 6) - sześć elektronów walencyjnych) jest dwuwartościowa w związku
z wodorem, cztero- lub sześciowartościowa w związkach chemicznych z tlenem
chlor (konfiguracja (2, 8, 7) - siedem elektronów walencyjnych) jest jednowartościowy w związku
chemicznym z wodorem (HCl), ale z tlenem siedmiowartościowy
węgiel (konfiguracja (2, 4) - cztery elektrony walencyjne) bywa czterowartościowy w związkach
z tlenem i wodorem (CO
2
, CH
4
) i dwuwartościowy z tlenem (CO)
Zastosowania:
w nazewnictwie związków chemicznych (tlenek siarki(IV), tlenek siarki(VI))
rysowaniu kreskowych wzorów chemicznych
RODZAJE WZORÓW CHEMICZNYCH
Wzór chemiczny jest to przedstawienie za pomocą symboli pierwiastków, symbolu chemicznego związku
chemicznego albo części związku chemicznego.
Mamy następujące rodzaje wzorów chemicznych;
wzór elementarny (empiryczny)
wzór rzeczywisty (sumaryczny)
wzór strukturalny
uproszczony wzór strukturalny
kreskowy wzór wartościowości (elektronowy)
Wzór elementarny (empiryczny)
To rodzaj wzoru informujący o rodzaju pierwiastków z jakich zbudowana jest cząsteczka oraz
o wzajemnym ilościowym stosunku liczby atomów albo jonów w związku chemicznym.
Przykład: H
2
SO
4
. Z tego wzoru możemy odczytać, że jedna cząsteczka kwasu siarkowego(VI) składa się
z dwóch atomów wodoru, jednego atomu siarki i czterech atomów tlenu.
Wzór rzeczywisty (sumaryczny)
Informuje o rzeczywistym składzie związku chemicznego wraz z liczbą atomów uczestniczących
w budowie cząsteczki albo jonu.
Przykładem jest tlenek fosforu(V), dla którego wzór rzeczywisty piszemy jako P
4
O
10
. Wzór elementarny
dla tego tlenku piszemy jako P
2
O
5
.
W większości wzory rzeczywiste odpowiadają wzorom elementarnym.
Wzór strukturalny
Wzór strukturalny podaje sposób wzajemnego powiązania atomów w cząsteczce związku chemicznego.

Chemia ogólna, nieorganiczna i analityczna.
str. 7
Uproszczony wzór strukturalny (półstrukturalny)
Jest wzór strukturalny, w którym określone grupy atomów wchodzących w skład cząsteczki zgrupowane
są bez ukazywania zawartych w nich wiązań.
Kreskowy wzór wartościowości (wzór elektronowy, wzory Lewisa)
Jest to wzór strukturalny związku chemicznego, w którym przedstawione są elektrony powłoki
zewnętrznej, nie uczestniczące w wiązaniach chemicznych.
Pierwszy koncepcję przedstawiania wiązań chemicznych z wykorzystaniem elektronów walencyjnych
przedstawił chemik amerykański G. N. Lewis. Podstawowym założeniem tej teorii jest twierdzenie,
że powstawanie wiązania między atomami polega na uwspólnieniu elektronów. I tak wg Lewisa, wiązanie
kowalencyjne między dwoma atomami jest wynikiem uwspólnienia przez te atomy pary elektronów.
Przyjmuje się, że taka para wiążących elektronów jest zlokalizowana miedzy dwoma atomami, a wiązanie
przedstawia się jako kreskę łączącą atomy. Elektrony nie uwspólnione są zlokalizowane jako wolne pary
elektronowe na jednym lub drugim atomie (atomach) w cząsteczce. Strukturę elektronową całej
cząsteczki przedstawia sie jako sumę wszystkich wiążących i wolnych par elektronowych. Opierając się
na tym, można przedstawić strukturę elektronową cząsteczki w postaci tzw. wzoru Lewisa.
BUDOWA ATOMU
Jądro atomu – materia ma budowę ziarnistą, nieciągłą, gdyż dowolnie mała przestrzeń pomyślana
w jej wnętrzu nie jest nią całkowicie wypełniona.
Na przykład proces dyfuzji, czyli zjawisko samorzutnego mieszania się różnych substancji we wszystkich
stanach skupienia zachodzi dzięki temu, że pomiędzy skupieniami (cząsteczkami) jednej substancji
istnieją wolne przestrzenie, przez które mogą przenikać cząsteczki innej substancji.
Atom- jest najmniejszą jednostką budowy pierwiastka chemicznego, ale już - bez naruszenia zasadniczych
właściwości pierwiastka - niepodzielną. Zbudowany jest z jądra, ale także cała masa (protony i neutrony
decydują o masie) oraz elektronów znajdujących się w stosunkowo dużej przestrzeni otaczającej jądro.

Chemia ogólna, nieorganiczna i analityczna.
str. 8
Rutherford badając procesy rozpraszania cząstek przechodzących przez
cienką folię metalową doszedł do przekonania, że prawie cała masa atomu
skupiona jest w bardzo małym dodatnio naładowanym jądrze atomowym a
elektrony krążą w odległej chmurze. Otaczające to jądro elektrony
wyznaczały całkowity rozmiar atomu. Obraz atomu, który ustalono na
podstawie tego doświadczenia, jest niezwykły.
Promień atomu i jego części składowych
Lp.
Nazwa
Promień (m)
Masa
1.
Atom
ok. 10
-10
różna w zależności od
pierwiastka
2.
Jądro
ok. 10
-15
ok. 99,9% masy atomu
3.
Elektron
tworzą chmurę o promieniu
równym promieniowi atomu
ok. 0,1% masy atomu
Wnioski:
* badania procesów promieniotwórczych pozwoliły stwierdzić, że jądra atomowe są również tworami
złożonymi. Ustalono, że elementami składowymi jądra są neutrony i protony.
* protonom i neutronom nadaje się często wspólną nazwę nukleony.
CZĘŚCI SKŁADOWE ATOMU
Elektron – cząstka, która posiada ujemny ładunek elementarny o wartości – 1,602 ∙ 10
-19
C. Dla wygody
przyjęto, że ma ładunek -1.
Proton- cząstka o ładunku dodatnim +1.
Neutron – cząstka elektrycznie obojętna.
Ponieważ atom posiada jednakową ilość elektronów i protonów, dlatego jest elektrycznie obojętny.
Elektrony są przyciągane siłami elektrostatycznymi przez protony znajdujące się w jądrze. Siła ta
decyduje o właściwościach atomów (pierwiastków). Odgrywają dużą rolę w reakcjach chemicznych.
Współczesny model budowy atomu, zakłada, że elektrony rozmieszczone są na powłokach i tworzą wokół
jądra rozproszony w przestrzeni ładunek ujemny.
Wyrażając w jednostkach masy atomowej masy składników atomu otrzymamy:
Masy składników atomu
Nazwa
Wartość w unitach (u) Wartość w gramach (g)
Proton
1.00727 u
1,673*10
-24
Neutron
1.00866 u
1,675*10
-24
Elektron
0,00055 u
9,109*10
-28
WNIOSKI:
-masy protonu i neutronu są prawie identyczne
-w jądrze (protony plus neutrony) skupiona jest prawie cała masa atomu
-elektrony które równoważą dodatni ładunek protonów mają masę równą tylko 0.05% całej ich masy
Rozmiary atomów są bardzo małe. Odpowiednio promienie jąder atomowych są rzędu 10
-14
do 10
-15
m,
a promienie atomów są równe 0,6*10
-10
– 2,6*10
-10
m.

Chemia ogólna, nieorganiczna i analityczna.
str. 9
Do wyrażenia rozmiarów atomów możemy wykorzystywać inną jednostkę długości – angstrem.
(Å) = 1*10
-10
m.
Atomy mają średnicę w zakresie 1-5 angstremów.
OZNACZENIA I SYMBOLE
Jądro składa się z Z protonów i N neutronów. Proton i neutron n=1, więc względna masa atomowa równa
jest M=Z+N.
Z - liczba ładunkowa jądra, albo liczba porządkowa atomu.
N – różnica N= M-Z.
Np. Atomy węgla mają 6 protonów i 6 elektronów. Liczbę protonów zapisujemy jako wskaźnik dolny
z lewej strony.
liczba atomowa ->
6
C
- Liczba masowa – jest zapisana z lewej strony jako górny wskaźnik. Jest ona sumą ilości protonów
i neutronów i jest różna dla różnych izotopów.
NUKLIDY, IZOTOPY, IZOBARY
Nuklid - zbiór atomów o tej samej wartości liczby atomowej i masowej.
Izotopy – różne jądra tego samego pierwiastka mogą się różnić liczbą neutronów, a zatem liczbą M.
Pierwiastki czyste: Be, F, Na, Al. Oznacza zawsze jądra, które należą do tego samego pierwiastka, czyli
mają taką samą liczbę atomową, a różnią się liczbą masową.
Izobary - jądra o tej samej liczbie masowej, np. jądro H-3 i He-3.
Modele i trwałość jądra atomowego (kroplowy, powłokowy, kolektywny)
1. Model kroplowy – porównuje jądro do kropli cieczy i rozpatruje jako zbiór gęsto ze sobą związanych
sztywnych, kulistych nukleonów.
2. Model powłokowy – przyjmuje się, że nukleony w jądrze poruszają się po stacjonarnych orbitach,
którym odpowiadają określone energie. Jądra o małych liczbach masowych z mniej więcej jednakową
liczbą neutronów i protonów są najbardziej trwałe.
TRWAŁE UKŁADY występują, gdy liczba protonów albo neutronów jest równa 2, 8, 20, 28, 50, 82, 126
i są to liczby magiczne.
42
He,
168
O,
20882
Pb
3. Model kolektywny – uwzględnia powstanie zespołów stanów wszystkich nukleonów w jądrze.
Wyjaśnia częściowo przebieg reakcji jądrowych.
DEFEKT MASY
Według Einsteina, każdej masie m odpowiada energia określona wzorem:
m – masa
c – prędkość światła
Energia wyzwolona w czasie łączenia się nukleonów jest równa masy rzędu 1%. Masa jądra jest równa
sumie mas zawartych w jądrze nukleonów. W rzeczywistości jest ona mniejsza i ten defekt masy energii
wiązania:
Defekt masy przypadający na 1 nukleon
i przeliczony na jednostkę energii E=mc
2
nosi nazwę energii
wiązania.
Im wartość jest wyższa, tym jądro jest trwalsze. Najwyższe energie wiązań mają jądra w liczbach
atomowych od 40 do 60.

Chemia ogólna, nieorganiczna i analityczna.
str. 10
CZĄSTKI ELEMENTARNE
Są to cząstki najmniejsze, których na chwilę obecną nie da się bardziej rozbić. Cząstki, które postały pod
wpływem oddziaływania protonów i elektronów. Np. proton, elektron, foton, neutrino są trwałe.
Pozostałe cząstki istnieją bardzo krótko. Dzielimy je na: fotony, fermiony lekkie (leptony), mezony,
fermiony ciężkie (bariony).
Kwark – cząstka elementarna zwana fermionem (podlega oddziaływaniom silnym). Można je podzielić
na dwie grupy: kwarków i leptonów.
NATURALNE I SZTUCZNE PRZEMIANY JĄDROWE
Studentka Becquerela, Maria Skłodowska-Curie (1867 - 1934), fizyczka i chemiczka polska, laureatka
nagrody Nobla, odkryła, że naturalne rudy uranowe są silniej promieniotwórcze niż to wynikałoby
z zawartości w nich uranu i wysunęła przypuszczenie, że w rudzie znajduje się nieznany jeszcze silnie
promieniotwórczy pierwiastek. Razem ze swym mężem Pierrem Curie (1859 - 1906), po długiej
i mozolnej pracy odkryła, dwa dalsze promieniotwórcze pierwiastki; polon, nazwany tak od imienia
ojczyzny, oraz rad.
Emitowane przez pierwiastki promieniowanie zawiera różnego rodzaju składniki. Samorzutnemu
rozpadowi jąder pierwiastków towarzyszy emisja różnego rodzaju promieniowanie, a mianowicie;
cząstek
42
α lub po prostu a (są to jądra helu
42
He
+2
)
cząstek β (są to elektrony o dużej prędkości
0-1
e
-
, znak -1 oznacza ładunek elektronu a 0 wartość
liczby masowej)
promieni γ (fale elektromagnetyczne o długości mniejszej niż 0,1 mm).
Np.
1. Podczas emisji cząstki a: Uran
23892
U rozpadając się emituje cząstkę a i przechodzi w tor.
23892
U ->
23490
Th +
42
He
2. Podczas rozpadu b: tor
23490
Th rozpadając się emituje elektron i przechodzi w protaktyn
23490
Th ->
23491
Pa +
0-1
e
W przemianie tej neutron przechodzi w proton oraz emitowany jest elektron i neutrino.
10
n ->
11
p +
0-1
e + n
Zarówno rozpad α i rozpad β pierwiastków promieniotwórczych podlega prawu Fajansa i Sodd'ego:
- każdej przemianie a towarzyszy zmniejszenie liczby masowej o cztery jednostki i zmniejszenie liczby
atomowej o 2,
-każda przemiana b powoduje podwyższenie liczby atomowej o jeden, przy nie zmienionej liczbie
masowej izotopu.
Niektóre jądra mogą dokonać wychwytu elektronu z najbliższej mu wewnętrznej powłoki elektronowej K.
Zachodzi wtedy przemiana protonu w neutron i neutrino.
11
p +
0-1
e ->
10
n + n
Zazwyczaj opuszczane miejsce w powłoce K jest zajmowane przez elektron wyższego poziomu
energetycznego i przemianie towarzyszy jednocześnie emisja promieni γ (gamma).
Dla każdego pierwiastka promieniotwórczego szybkość rozpadu radioaktywnego jest proporcjonalna
do liczby N obecnych jąder. Jest ona określona:

Chemia ogólna, nieorganiczna i analityczna.
str. 11
gdzie:
N
0
- liczba obecnych jąder w czasie t=0 i odpowiednio N po czasie t.
OKRES PÓŁTRWANIA (połowicznego rozpadu)
Dla każdego pierwiastka promieniotwórczego charakterystyczny jest ten okres
, czyli przedział czasu,
w którym pierwotna liczba jąder N
0
maleje do połowy, gdy
.
Równanie:
Dla naturalnych pierwiastków okres półtrwania zawarty jest od 10
-11
s do 1,3*10
10
lat.
SZTUCZNE PRZEMIANY JĄDROWE
Jądra izotopów niepromieniotwórczych mogą ulegać przemianom pod działaniem bombardujących
je cząstek o dostatecznie dużej energii. Do takich celów stosowane bywają protony
11
H, deuterony
21
H,
cząsteczki a, neutrony, a także promienie g, których strumieniowi nadaje się odpowiednią energię
w cyklotronie.
Jeżeli cząstka bombardująca trafia w atakowane jądro, to wywołuje reakcję jądrową. Produktem takiej
reakcji może być jądro zdolne następnie do samorzutnego rozpadu, tj. jądro izotopu promieniotwórczego.
Na przykład bombardowanie jąder niepromieniotwórczego izotopu fosforu
3115
P deuteronami
21
H
wywołuje reakcję
3115
P +
21
H ->
3215
P +
11
H
Produktem tej przemiany jądrowej jest promieniotwórczy izotop fosforu
3215
P o okresie półtrwania 14,3
dni oraz proton
11
H.
147
N +
10
n ->
146
C +
11
H
5927
Co +
10
n ->
6027
Co + γ
KWANTOWA TEORIA ATOMÓW
Nasza wiedza o elektronowej budowie atomów powstała głownie dzięki budowie światła wysyłanego
przez atomy; światło pobudzone działaniem wysokiej temperatury, łuku elektrycznego lub iskry.
W obszarze łuku elektrycznego gaz jest zjonizowany – stanowi plazmę. Temperatura plazmy zależy
od natężenia prądu, rodzaju elektrod, rodzaju i ciśnienia gazu. Pod ciśnieniem atmosferycznym i przy
przepływie 1A wynosi ona 5000 – 6000 K (T= 273+t). Światło emitowane przez atomy składa się z linii
o określonych częstotliwościach drgań, określa się je jako widmo liniowe atomu.
KWANTOWA TEORIA BUDOWY ATOMU
Bohr jako pierwszy zastosował do interpretacji widm atomu wodoru teorię kwantów i położył w ten
sposób podwaliny pod niezwykły postęp z zrozumieniu istoty materii, dokonany w ciągu ubiegłych lat.
Gdy atom przechodzi od stanu wyższej energii do niższej, traci energię emitowaną, jako foton. Im większa
utracona energia tym większa jest częstość (mniejsza długość fal) emitowanego promieniowania.
Przejście A wytwarza światło o większej częstotliwości V i mniejszej długości fali λ niż przejście B.
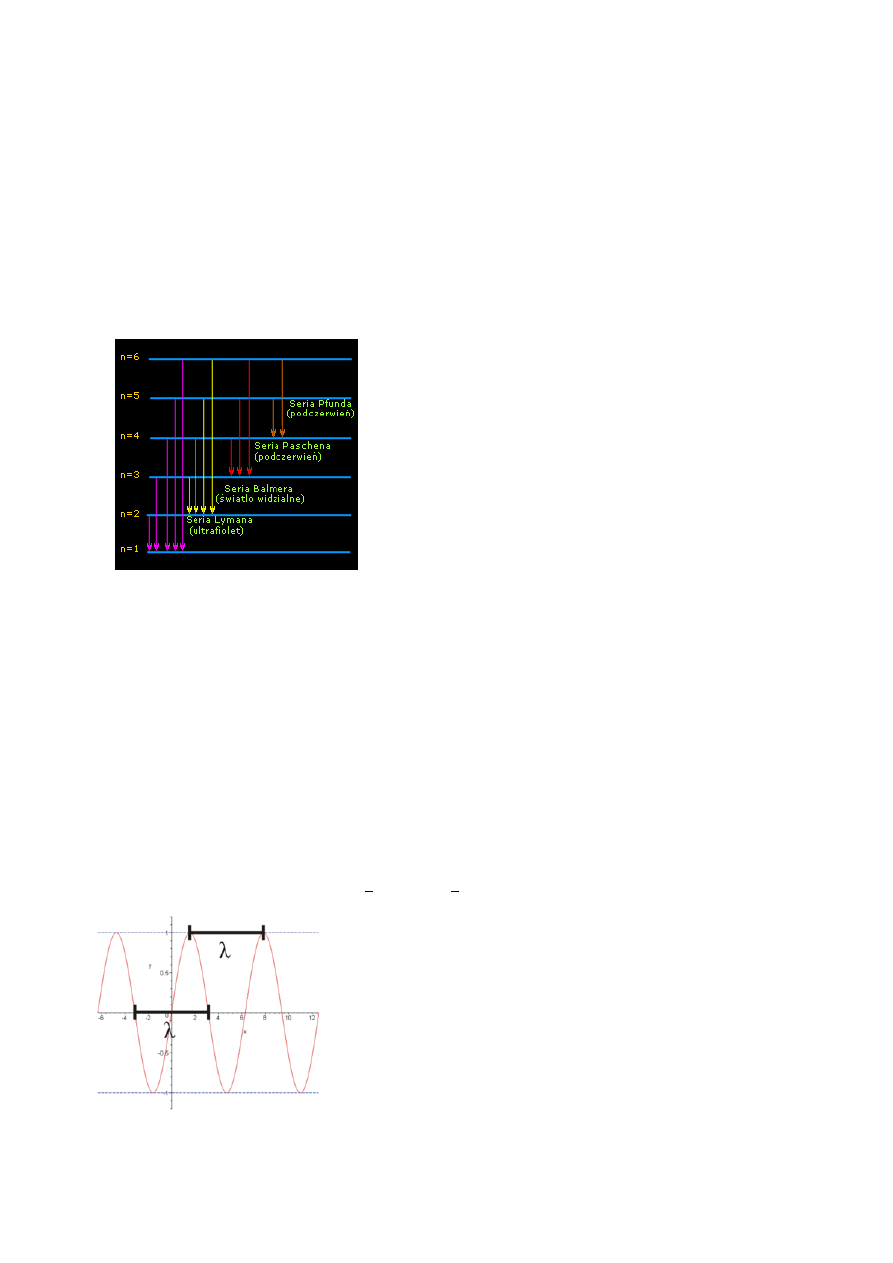
Widmo atomu wodoru składa się z linii:
Seria Balmera linii widma wodoru atomowego. Linia o największej długości fali (na lewo) jest linią, która
odpowiada przejściu od stanu n=3 do stanu n=2.
Planck i Einstein założyli, że światło o określonej częstotliwości nie jest emitowane ani absorbowane
Chemia ogólna, nieorganiczna i analityczna.
str. 12
przez materię w dowolnie małych ilościach, lecz tylko w postaci kwantów energii h * V, gdzie h – stała
Planka, V – częstotliwość promieniowania.
Kiedy elektron promieniuje energię elektromagnetyczną?
Gdy przechodzi z jednej dozwolonej powłoki energetycznej na drugą. Ilość wypromieniowanej energii
jest opinana wzorem:
Potwierdzeniem były serie widma emisyjnego wodoru.
Schemat powstawania serii widma emisyjnego wodoru.
Zastosowanie przyjętych założęń dla pierwiastków
posiadających więcej niż jeden elektron nie pozwoliło uzyskać
ilościowo poprawnych wyników. Okazało się, że jest ona
sprzeczna z nieznanymi jeszcze wówczas postulatami Broglie’a i
Heisenberga. Dlatego teoria Borha została zarzucona i
zastąpiona nową, w której wykorzystano postulat „de Broglie’a”
według którego cząstki wykazują właściwości falowe.
NOWOCZESNA TEORIA KWANTÓW
Erwin Schrödinger odpowiedział na pytanie: co stanie się z tą falą, gdy zadziała na nią siła? Odpowiedź
zawarta jest w słynnym równaniu:
Równanie Schrödingera przypisuje falę de Broglie’a elektronowi, dowolnej cząsteczce i wreszcie
dowolnemu kwantowemu układowi cząsteczek.
Jeżeli dana jest masa cząstki i siły, które na nią działają (grawitacyjne, elektromagnetyczne i inne), gdzie
równanie Schrödingera wykazuje możliwe fale związane z tą cząstką, fale jako funkcje położenia i czasu
są opisywane funkcją falową:
FUNKCJA FALOWA
Oznacza, że dla każdej cząstki, czy dla fotonu, czy dla elektronu istnieje stowarzyszone z nią fale fal
materii, którego amplituda opisana jest funkcją . Częstość (V) i długość fali (λ) związanej
z falą materii liczymy:
Odległość między pikami (skrajnymi, największymi wartościami) jest
długość fali promieniowania.
Jaki jest sens fizyczny funkcji falowej?
Okazuje się, że funkcja falowa jest w równym stopniu wielkością
fizyczną jak pole elektryczne czy pole magnetyczne. Funkcja falowa
musi coś mówić o położeniu cząstki w czasoprzestrzeni, ponieważ
cząstka znajduje się najprawdodopodobniej w tych miejscach, gdzie
natężenie fali jest duże. Fizyk niemiecki Max Born nadał następujący
sens funkcji falowej.
Chemia ogólna, nieorganiczna i analityczna.
str. 13
Prawdopodobieństwo znalezienia elektronu w danym punkcie jest proporcjonalne do kwadratu funkcji
falowej (ψ)
2
. Gęstość prawdopodobieństwa w węźle wynosi 0. Węzeł jest punktem.
W mechanice kwantowej cząstka stanowi falę i jej położenia nie można dokładnie przewidzieć. Tam, gdzie
funkcja falowa ma dużą amplitudę istnieje duże prawdopodobieństwo znalezienia cząstki. Tam, gdzie
funkcja falowa ma małą amplitudę – małe prawdopodobieństwo.
DUALIZM FALOWO-KORPUSKULARNY
- Elektrony wykazują właściwości cząstek (korpuskularne) i właściwości falowe. Te ostatnie właściwości
muszą być uwzględnione w opisie struktury atomów.
- ZASADA NIEOZNACZANOŚCI HEISENBERGA – stwierdza, że nie możemy określić jednocześnie położenia
i prędkości cząstki.
RÓWNANIE SCHRÖDNIGERA DLA UKŁADU JEDNOELEKTRONOWEGO
Równanie można rozwiązać:
- w sposób ścisły dla atomów jednoelektronowych
- przybliżony w pozostałych przypadkach, ale takie rozwiązanie może być bardzo dokładne
(przekraczające dokładnością pomiary doświadczalne).
Najprostszą strukturą atomową w przyrodzie jest atom wodoru i jest on doskonałym obiektem,
do którego zastosowanie teorii Schrödingera pozwoliło na zbadanie szczegółów jego widma i stanowiło
jedno z pierwszych wielkich osiągnięć mechaniki kwantowej, które pozwoliło zbadać i porównać
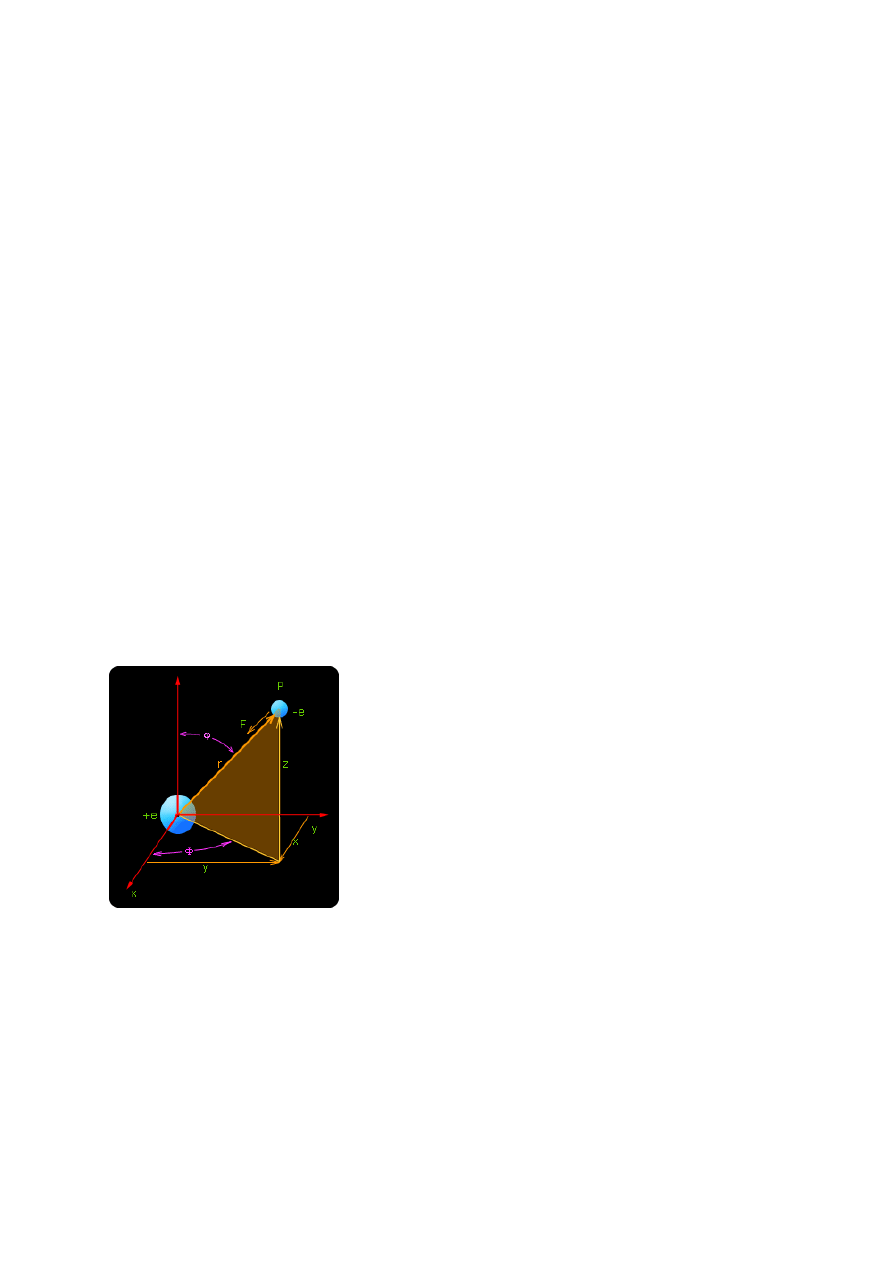
założenia teoretyczne z otrzymanymi wynikami badań. Dla tak przedstawionego schematu
i uwzględnieniu, że:
x = r sin
cos
y = r sin
sin
z = r cos
Schematyczne przedstawienie atomu
wodoru. Siła F wywołana jest kulombowskim przyciąganiem.
Funkcja falowa zależy od .
Rozwiązanie tego równania dla stanu stacjonarnego prowadzi do otrzymania niezależnych równań
falowych, z których każde będzie zawierało funkcję tylko jednej współrzędnej sferycznego układu
współrzędnych. Tymi funkcjami są;
funkcja radialna – R
nl
(r)
funkcja kątowa - Y
lm
(φ,ϕ)
Dla tych funkcji otrzymano trzy stałe kwantowania, oznaczone literami n, l, m.
Chemia ogólna, nieorganiczna i analityczna.
str. 14
Liczby kwantowe
n=1,2,3,…
l=0,1,2,…, n-1
m=l,l-1,l-2,…,-l-1,-l-2,-l.
MODEL BUDOWY ATOMU BOHRA I SCHRÖDINGERA
LICZBY KWANTOWE
Główna liczba kwantowa - główną liczbę kwantową oznacza się za pomocą litery n; może ona
przyjmować wartości całkowitych liczb dodatnich, n = 1, 2, 3, … . Liczba kwantowa n określa nam
jednocześnie numer powłoki elektronową do której należy elektron. Powłoki często oprócz oznaczeń
liczbowych, oznacza się również za pomocą kolejnych dużych liter wziętych z badań widm emisyjnych lub
absorpcyjnych promieniowania rentgenowskiego.
Wartość n
1
2
3
4
5
6
Symbol literowy
K
L
M
N
O
P
Główna liczba kwantowa „n” określa energię powłoki elektronowej.
Poboczna /dodatkowa, orbitalna, azymutalna / liczba kwantowa (l) -
może przyjmować n wartości:
n = od 0, 1, 2, .......do (n-1). Jest to liczba kwantowa opisująca niewielkie różnice energii elektronów danego
poziomu elektrycznego związane z różnicami ich orbitalnego momentu pędu. Charakteryzuje ona
podpowłokę elektronową do której należy elektron, a para liczb kwantowych (l, m) charakteryzuje
składową kątową funkcji falowej.
W przypadku atomów zawierających więcej niż jeden elektron, trzeba znać równocześnie liczbę n oraz l,
by określić poziom energetyczny. Ponadto poboczna liczba kwantowa l uściśla wartość energii elektronu
oraz charakteryzuje kształt orbitali atomowych.
Przykład obliczenia wartości kwantowej liczby pobocznej (l)
Dla pierwszej powłoki gdzie n = 1 liczba poboczna l przyjmie wartość l = n - 1 = 1 -1 = 0
Dla drugiej powłoki gdzie n = 2 liczba poboczna l będzie miała wartości 0 oraz n - 1 = 2 - 1 =1, czyli
otrzymany dwie wartości liczby pobocznej l = 0, 1.
Odpowiednio dla n = 3 wartości liczby pobocznej wyniosą l = 0, 1, 2
Chemia ogólna, nieorganiczna i analityczna.
str. 15
Oprócz wartości liczbowych, kwantowe liczby poboczne „l” oznacza się małymi literami zgodnie z tabelą.
Poboczna liczba kwantowa l
0
1
2
3
4
5
Oznaczenie orbitalu
s
p
d
f
g
h
Stan s, dla którego l=0, jest stanem, któremu odpowiada moment pędu równy 0. Spośród trzech funkcji
falowych atomu wodoru jedynie funkcja radialna pozostaje w tym wypadku różna od 0, a więc układ nie
jest zależny od φ ani od ϕ. Jest ona więc sferycznie symetryczna. Gdy l przyjmuje wartości różne od zera,
całkowita funkcja falowa odbiega od symetrii sferycznej i w układzie pojawia się moment pędu.
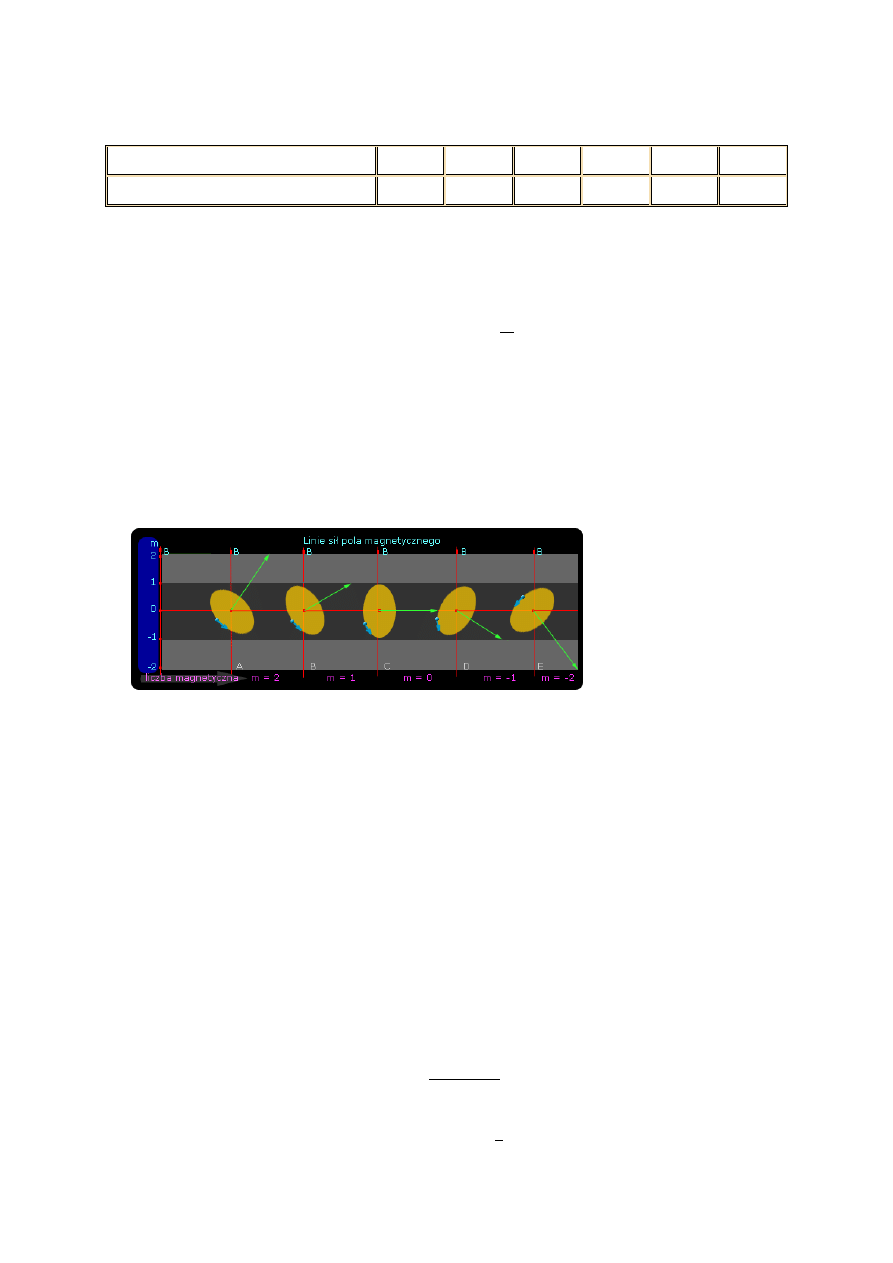
Magnetyczna liczba kwantowa (m) – po pomnożeniu przez
reprezentuje składową momentu pędu
w kierunku dowolnej osi współrzędnych, np. w kierunku osi Z. Oznacza to, że wektor orbitalnego
momentu pędu nie może ustawić się pod dowolnym kątem do linii sił przyłożonego pola magnetycznego,
a tylko w dozwolonych wybranych kierunkach.
Wektor orbitalnego momentu L jest skierowany w przestrzeni. Względem danego kierunku dozwolone
są jedynie pewne ustawienia wektora L. Gdy l=2 kwantyzacja przestrzenna wektora orbitalnego momentu
pędu daje składowe L
z.
Rozszczepienie w polu
magnetycznym
pięciokrotnie
zdegenerowanego
poziomu d.
W znaczeniu fizycznym liczba (m) oznacza niewielkie różnice energetyczne pomiędzy elektronami o tej
samej liczbie kwantowej n i l oraz wzajemnie ustawienie się orbitali w przestrzeni pod względem
zewnętrznego pola magnetycznego. Przy braku zewnętrznego pola magnetycznego orbitale nie mają
określonego kierunku w przestrzeni i ni różnią się energią, są zatem zdegradowane.
Stany p są trzykrotnie, stany d – pięciokrotnie, a stany f – siedmiokrotnie zdegenerowane. (p
3
,d
5
,f
7
)
Liczba m może przyjmować (2l+1) wartości. m = (2l+1) czyli:
m= -l,-(l-1),…,-1,0,+1,…,+(l-1)+l.
Np. dla l=2 m wynosi 5 (-2,-(2-1),0,+(2-1),+2).
ZJAWISKO ZEEMANA
W nieobecności zewnętrznego pola magnetycznego w wyniku przejścia ze stanu d do p powstaje tylko
jedna linia widmowa. W obecności pola magnetycznego możliwych jest sześć przejść zwanych efektem
Zeemana.
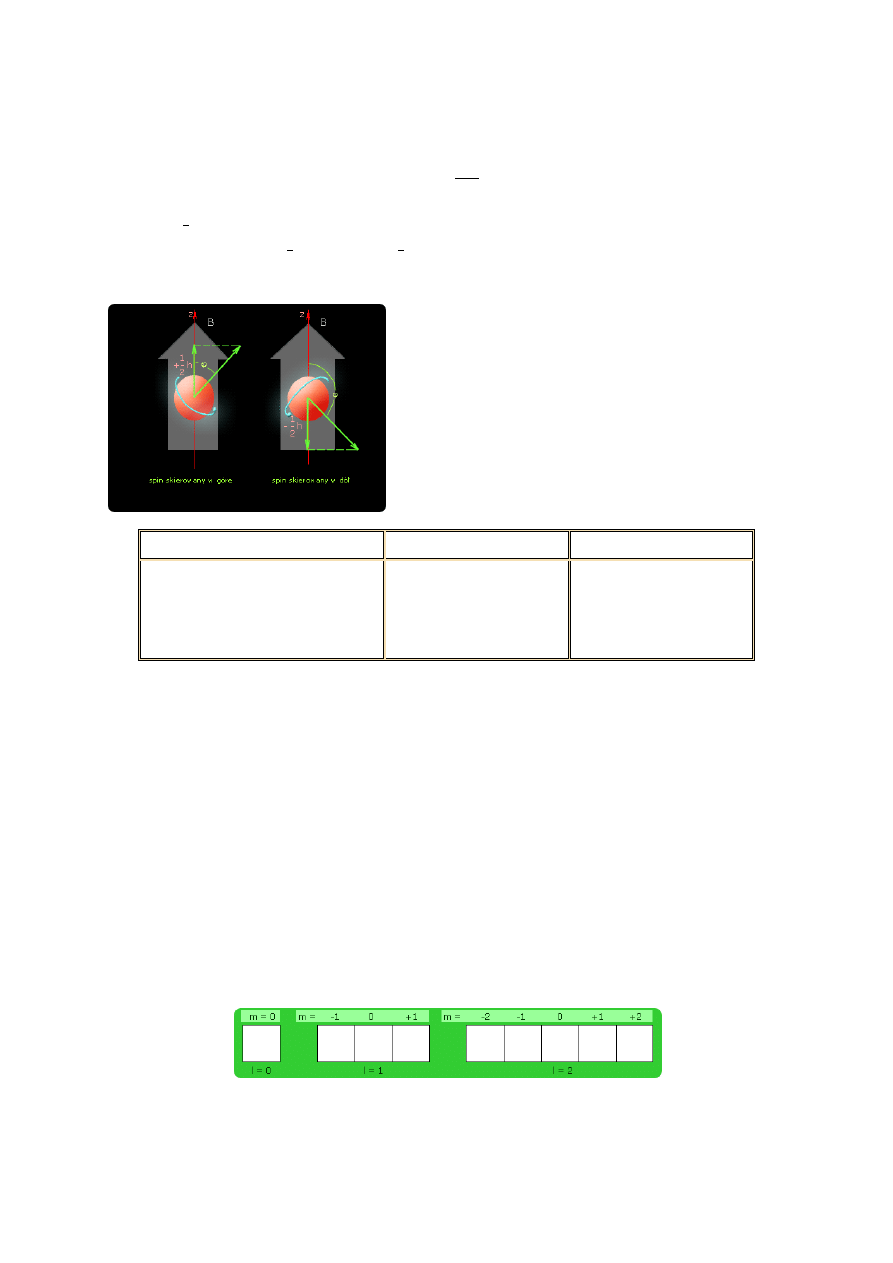
Spinowa liczba kwantowa – niekiedy następuje rozdwojenie linii, co wskazuje na rozdwojenie
poziomów energetycznych. Wiąże się to z faktem, że elektron posiada spinowy moment pędu zwany
spinem. Jest on wynikiem ruchu obrotowego elektronów wokół własnej osi.
Chemia ogólna, nieorganiczna i analityczna.
str. 16
Gdy przyłożymy zewnętrzne pole magnetyczne o natężeniu B, składowa L
s
, w kierunku osi Z jest
skwantowana i opisana wzorem:
,
gdzie m
s
= ∓
nosi nazwę magnetycznej spinowej liczby kwantowej. Liczbie tej odpowiada spin
skierowany w górę, kiedy
i w dół, kiedy
.
Spinowy moment pędu elektronu przestrzennie
skwantowany
(względem pola magnetycznego B ma tylko dwa dozwolone
ustawienia.)
Liczby kwantowe
Wartości
Liczba możliwych wartości
Główna, n
Orbitalna, l
Magnetyczna, m
Spinowa, s
Magnetyczna spinowa, m
s
1, 2, 3, ....
0, 1, 2,...,(n - 1)
0, +/-1, +/-2,...,+/-l
1/2
+/-1/2
dowolna
n
2l + 1
1
2s + 1 = 2
Ponieważ s jest zawsze równe 1/2 stan układu może być całkowicie opisany za pomocą liczb kwantowych
n, l, m, m
s
. Zauważmy, że dla każdego l istnieje 2l + 1 wartości m, a dla każdego s mamy 2s + 1 = 2
możliwych wartości m
s
.
Dla opisu jednego elektronu w atomie ma zastosowanie tylko jedna funkcja falowa, która nazywana jest
orbitalem. Jest to najmniejszy obszar przestrzeni wokół jądra, w którym prawdopodobieństwo znalezienia
elektronu, o określonym zasobie energii wynosi 90%. Każdemu elektronowi można przyporządkować
maksymalnie dwa elektrony. Orbital jest określany za pomocą trzech liczb kwantowych n, l, m.
SYMBOLICZNE PRZEDSTAWIENIE ORBITALI ATOMOWYCH
Pojedynczy orbital przedstawia się symbolicznie w postaci małego kwadratu wewnątrz którego rysujemy
strzałki, które przedstawiają elektrony. Aby przedstawić elektron odpowiadający danemu orbitalowi,
wewnątrz klatki rysuje się strzałkę, której ostrze zwrócone jest do góry, jeżeli spin wynosi + 1/2 albo
do dołu, jeśli s = - 1/2.
Dla celów praktycznych często łączymy wszystkie kwadraty należące do tej samej podpowłoki.
Jeżeli l = 0, m = 0 i występuje tylko jeden orbital. Jeżeli l = 1 to m przyjmuje wartości -1, 0, +1. Przy trzech
wartościach m występują trzy orbitale. Jeżeli l = 2, to orbitali jest 5, gdyż m przyjmuje pięć różnych
wartości itd.
Chemia ogólna, nieorganiczna i analityczna.
str. 17
Zauważmy, że liczba orbitali zależy wyłącznie od wartości l. Jest ona niezależna od n, lecz l powinno
spełniać warunek 0 < l < n.
Zapis kwantowy – otrzymuje się go pisząc dla każdej podpowłoki grupę trzech symboli:
1. Pierwszy jest liczbą, która podaje wartości głównej liczby kwantowej,
2. Drugi jest liczbą s, p, d, f – charakteryzuje podpowłokę elektronową,
3. Trzeci umieszczony jako wykładnik u góry na prawo wskazuje liczbę elektronów obecnych w danej
podpowłoce.
Symbole te można grupować według powłok.
Przedstawione opisy orbitali mają zastosowanie praktyczne do opisowego i graficznego przedstawiania
budowy powłok elektronowych atomu.
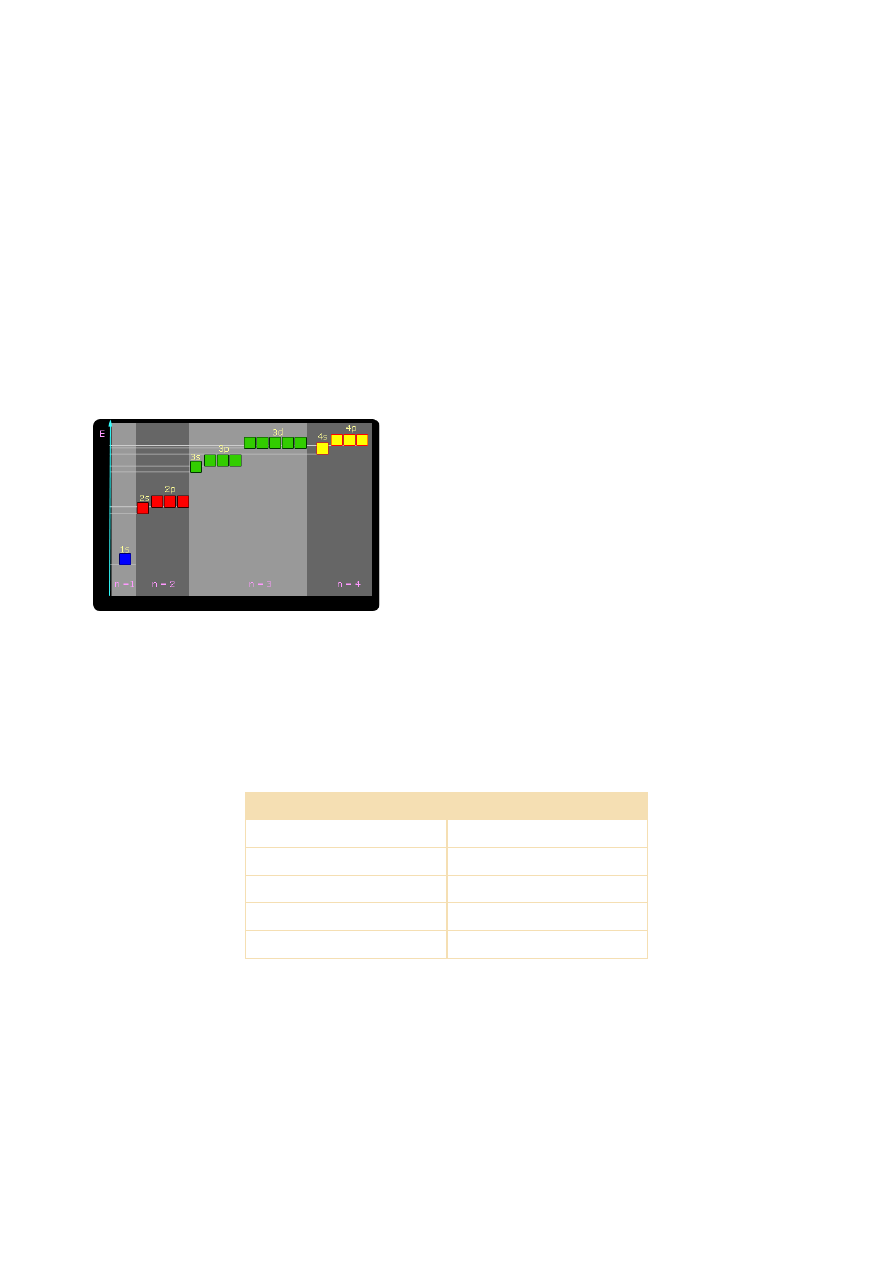
ZASADY OBSADZANIA ORBITALI
1. Zasada rozbudowy
Zasada ta mówi, że kolejne orbitale są zajmowane w porządku wzrastającej energii.
Względne energie powłok, podpowłok i orbitali w
atomie wieloelektronowym.
2. Zakaz Pauliego
Dwa elektrony mogą zajmować ten sam orbital tylko wówczas, gdy ich spiny są przeciwne tj.
zorientowane w przeciwnych kierunkach. Oznacza to, że nie mogą istnieć dwa elektrony w identycznym
stanie kwantowym, tzn. mające identyczne wartości czterech liczb kwantowych (n, l, m, s, m
s
).
Na podstawie zakazu Pauliego łatwo można wyliczyć maksymalną liczbę elektronów jaka może pomieścić
się na poszczególnych powłokach i podpowłokach atomu.
Maksymalna pojemność powłok wynosi:
Nr powłoki
Maksymalna ilość elektronów
1
2
2
8
3
18
4
32
5
50
Maksymalna liczba elektronów dla podpowłok wynosi: s - 2, p - 6, d - 10, f - 14.
3. Reguła Hunda
Elektrony obsadzają orbitale w taki sposób, aby liczba niesparowanych elektronów w danej podpowłoce
była możliwie największa. Oznacza to, że przy zapełnianiu kolejnych orbitali elektronami wszystkie
orbitale odpowiadające (orbitale o tych samych liczbach kwantowych n i l) zostaną zapełnione najpierw
po jednym elektronie o spinie równoległym, a dopiero potem drugim elektronem o spinie
przeciwstawnym.
Przykładem jest atom tlenu o konfiguracji elektronowej 1s
2
2s
2
2p
4
, co odpowiada schematowi:
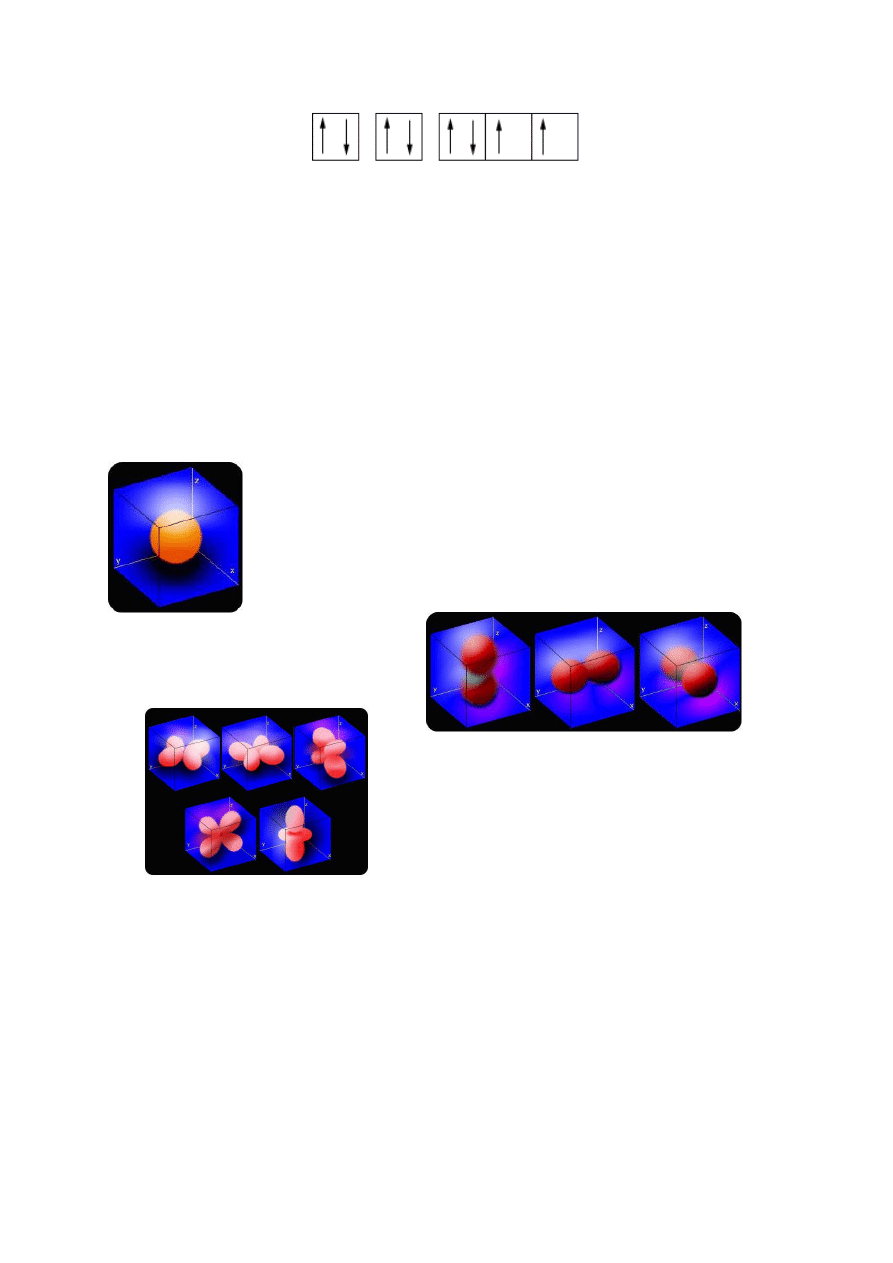
Chemia ogólna, nieorganiczna i analityczna.
str. 18
KSZTAŁT ORBITALI
Kwadrat funkcji falowej ψ
2
jest miarą gęstości elektronowej w różnych obszarach wokół jądra.
Trójwymiarowy wykres wynosi ψ
2
, którego środek znajduje się w jądrze, wskazuje te obszary wokół
jądra, w którym gęstość rozmieszczenia elektronu zachowującego się zgodnie z funkcją falową ψ jest
największa.
Gdy traktujemy elektron, jako funkcję falową, wówczas można powiedzieć, że jest on rozmieszczony w
orbitalu, który ma rozmiary określone przez funkcję R (r) i kształt określony przez funkcję φ(φ), ϕ(ϕ).
Orbitale s, p, d, f różnią się między sobą kształtem, jak i orientacją w przestrzeni.
Pod określeniem „kształt orbitali” należy rozumieć powierzchnię graniczną obejmującą większą część
gęstości prawdopodobieństwa.
Powłoka o głównej liczbie kwantowej n=1 składa się z 1 orbitalu 1s, tworzącego kulistą powłokę K. Orbital
1s ma zatem charakter bezkierunkowy.
Podobnie i wyższe orbitale 2s, 3s itd. tworzą powłoki kuliste.
Powierzchnia graniczna orbitali s.
Powierzchnia graniczna orbitali p.
Powierzchnia graniczna orbitali d.
Elektrony w powłoce n=2 mogą mieć n=2 wartości liczby pobocznej l=0 i 1, tzn. oprócz orbitalu s
pojawiają się orbitale p. Trzy zdegenerowane / tzn. o jednakowej energii/ orbitale p mają w przybliżeniu
kształt figur powstałych przez obrót ósemki dookoła podłużnej osi i są ustawione względem siebie
w przestrzeni pod kątem prostym. Prawdopodobieństwo znalezienia się elektronu w środkowej części
jest równe zeru. Poziom n = 3 obejmuje podpoziomy s, p, d. Pięć równoważnych / zdegenerowanych/
orbitali typu d.
Chemia ogólna, nieorganiczna i analityczna.
str. 19
ROZMIESZCZENIE ELEKTRONÓW W POZIOMACH KWANTOWYCH
Kolejność rozmieszczenia elektronów na powłokach kwantowych i podpowłokach w atomie,
z tego wynika wniosek, że w pierwszej kolejności będą obsadzone poziomy o najniższych energiach.
W przypadku kolejności wprowadzenie elektronów przedstawia się następująco:
- pierwszy i drugi elektron wprowadza się na orbitale 1s
- dwa następne na orbitale 2s
- sześć następnych na trzy orbitale 2p, itd.
W wyniku rozmieszczenia elektronów atom uzyskuje określoną konfigurację elektronową.
Konfiguracja elektronowa atomu podaje, które stany są w nim obsadzone zgodnie z zakazem Pauliego.
Ten katalog elektronowy stanowi podstawę współczesnego układu okresowego.
Obsadzenie poziomów d i f następuje nieregularnie z obsadzeniem poziomów s należących do tych
samych grup. Z tego obsadzenia możemy wnioskować, że podpoziom 4s jest energetycznie korzystniejszy
tzn. leży niżej od poziomu 3d, dlatego jest wcześniej zapełniony. To samo odnosi się do poziomu 5s
wcześniej zapełnionego od 4f itd.
Z tego można wnioskować, że wartości elektronów zachodzą na siebie.
NAZWA POWŁOKI
Nazwa powłoki
Symbol konfiguracji elektronowej w pełnej powłoce z ukazaniem podpowłok
Powłoka helowa
Powłoka neonowa
Powłoka argonowa
Powłoka kryptonowa
Powłoka ksenonowa
Powłoka radonowa
Powłoka eko-radonowa
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
6
4d
10
5s
2
5p
6
4f
14
5d
10
6s
2
6p
6
5f
14
6d
10
7s
2
7p
6
UZASADNIENIE BUDOWY UKŁADU OKRESOWEGO NA KWANTOWEJ BUDOWY ATOMU
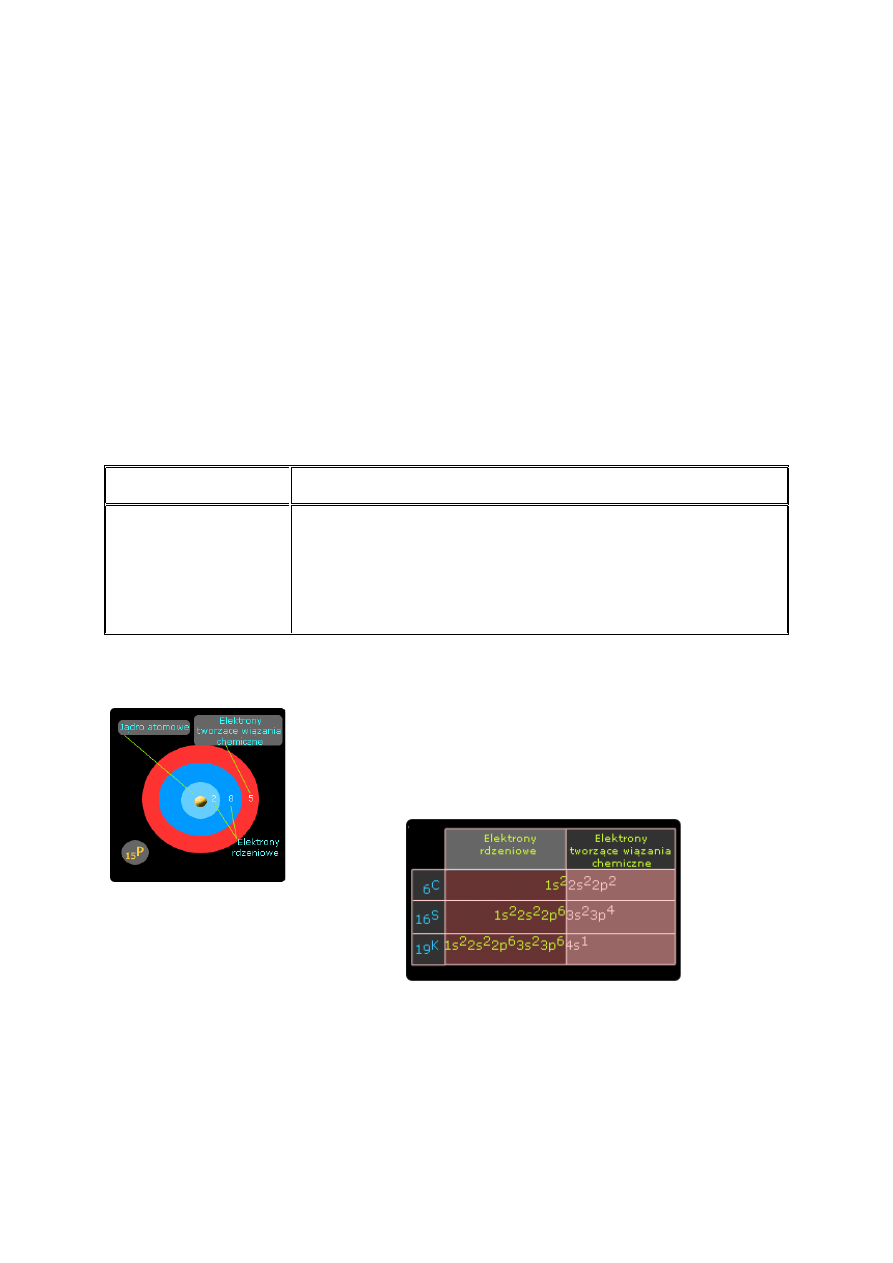
Rdzeń atomowy i elektronowy – uczestniczące w tworzeniu wiązań chemicznych.
W atomie wyróżnia się rdzeń atomowy i powłoki walencyjne zawierające
elektrony uczestniczące w tworzeniu wiązań chemicznych. Są to elektrony
najwyższego poziomu energetycznego, które w znacznej mierze określają
właściwości chemiczne pierwiastków. Elektrony tego poziomu noszą nazwę
elektronów walencyjnych.
Z przedstawionego zapisu wynika, że elektronami uczestniczącymi w tworzeniu wiązań mogą być
elektrony umieszczone w różnych powłokach, jak i podpowłokach.
W podanych przykładach elektronami walencyjnymi są:
- w przypadku węgla
6
C elektrony drugiej powłoki rozmieszczone w podpowłokach s i p,
- w przypadku siarki
16
S elektrony trzeciej powłoki rozmieszczone w podpowłokach s i p
- w przypadku potasu
19
K elektron czwartej powłoki rozmieszczony w podpowłoce s.

Chemia ogólna, nieorganiczna i analityczna.
str. 20
W atomach o wysokich liczbach atomowych (Z), kiedy występuje nakładanie się poziomów
energetycznych, elektronami uczestniczącymi w tworzeniu wiązań chemicznych mogą być elektrony
z podpowłok, które nie należą do zewnętrznych powłok elektronowych. Przykładem jest
31
Ga,
35
Br i
38
Sr.
W podanych przykładach konfiguracja elektronowa jest następująca;
31
Ga - 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
1
i odpowiednio elektronami walencyjnymi są 4s
2
4p
1
35
Br - 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
5
i odpowiednio elektronami walencyjnymi są 4s
2
4p
5
38
Sr - 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
i odpowiednio elektronami walencyjnymi są 5s
2
W każdym podanym przypadku są to elektrony o najwyższych wartościach energii i najsłabiej
przyciągane przez jądro. Słabe przyciąganie elektronów walencyjnych przez jądro pozwala im na
łatwiejsze przemieszczanie się, co umożliwia ich udział w reakcjach chemicznych.
OKRESOWOWŚĆ CECH CEMICZNYCH I FIZYCZNYCH PIERWIASTKÓW
Jeżeli będziemy umieszczać obok siebie pierwiastki chemiczne szeregując je według rosnących liczb
atomowych, to dostrzeżemy, że co 8-my, co 18-ty lub co 32-gi pierwiastek wykazuje podobne cechy
chemiczne. Układ zawiera 118 pierwiastków, podzielonych na siedem poziomów okresowych.
Dla tych samych powodów duże prawdopodobieństwo wykazują pierwiastki przejściowe, w których
zewnętrzna powłoka kolejnych pierwiastków nie zmienia się, a zabudowie ulega w miarę wzrostu Z,
druga od zewnątrz podpowłoka d.
Osiem grup (pionowych) układu okresowego tworzy odpowiednio osiem rodzin głównych o nazwach
wprowadzonych od nazwy pierwszego przedstawiciela danej rodziny głównej:
grupa I.
litowce
grupa II.
berylowce
grupa III. borowce
grupa IV. węglowce
grupa V.
azotanowce
grupa VI. tlenowce
grupa VII. fluorowce
grupa VIII. helowce
Pierwiastki rozbudowujące podpowłoki d tworzą osiem rodzin pobocznych umieszczonych w ośmiu
podgrupach układu okresowego. Są to:
grupa I.
miedziowce
grupa II.
cynkowce
grupa III. skandowce
grupa IV. tytanowce
grupa V.
wanadowce
grupa VI. chromowce
grupa VII. manganowce
grupa VIII. żelazowce
Grupa VIII Żelazowców dzieli się na trzy triady.
I triada – żelazowce Fe, Co, Ni
II triada – platynowce lekkie Ru, Rh, Pd
III triada – platynowce ciężkie Os, Ir, Pt
Pierwiastki zapełniające podpowłoki 4f i 5f tworzą odpowiednio dwie rodziny poddodatkowe:
lantanowce i aktynowce.

Chemia ogólna, nieorganiczna i analityczna.
str. 21
Znaczenie liczby atomowej. Reguła Hunda.
Liczba atomowa mówi nam o ilości elektronów znajdujących się w atomie oraz o budowie powłok
elektronowej i poziomów energetycznych.
WNIOSEK: O właściwościach pierwiastka decydują głównie powłoki zewnętrzna, a w szczególności ich
kształt i ilość znajdujących się elektronów.
SYMETRIA ROZKŁADU
Dużą trwałością oznaczają się atomy o zapełnionych podpoziomach s i p powłoki zewnętrznej.
Przykładem jest wysoka trwałość i mała aktywność chemiczna helowców oraz nietrwałość i duża
aktywność pierwiastków pierwszej grupy – litowców na skutek łatwego oderwania elektronu
walencyjnego, oraz trwałość i aktywność pierwiastków siódmej grupy fluorowców na skutek łatwego
uzupełniania zewnętrznej powłoki do ośmiu elektronów.
Wskazuje to na wyjątkową trwałość układu oktetowego w zewnętrznej, walencyjnej powłoce.
Wpływ na trwałość posiada symetria rozkładu orbitali w przestrzeni dookoła jądra.
Im symetria jest większa, tym i trwałość atomu jest większa.
Potwierdzeniem tego jest także reguła Hunda według której najkorzystniejsze energetycznie jest takie
zapewnienie orbitali elektronami przy którym liczba elektronów ze spinami swobodnymi tj. liczba
elektronów niesprawnych w obrębie danej wartości pobocznej liczny kwantowej l, jest jak największa.
ROZMIARY ATOMÓW I JONÓW
pm -> pikometr 10
-12
Promień atomowy pierwiastka definiuje się jako połowę odległości między środkami sąsiednich atomów.
Promie jonowy pierwiastka jest to układ pierwiastka w odległości między sąsiednimi jonami w jonowej
substancji stałej.
Wielkość atomu lub jonu określa promień najbardziej zewnętrznej powłoki elektronowej.
W obrębie okresu promienie atomów zmniejszają się malejąc w danym okresie od strony lewej do prawej.
Wiąże się to ze wzrostem liczny protonów w jądrze tzn. z silniejszym przyciąganiem elektronów przez
jądro. Tak więc w poszczególnych okresach litowce maja największe promienie atomowe, a fluorowce
najmniejsze.
W obrębie grup promienie atomów wzrastają wraz ze wzrostem liczb atomowych.
Wiąże się to ze wzrostem liczby powłok elektronowych, których wpływ wzrostu ładunku jądra
decydującego o zmniejszeniu średnicy atomu.
Na ogół promienie jonowe wzrastają ku dołowi grupy i maleją w okresie od strony prawej ku lewej.
Kationy są mniejsze, a aniony większe od swoich macierzystych atomów.
Atomy i jony mające jednakową liczbę elektronów noszą nazwę izoelektronowych.
Na przykład: Jony Na
+
, F
-
, Mg
2+
wszystkie trzy jony mają jednakową liczbę elektronów i jednakową
konfiguracje elektronową [He] 2s
2
2p
2
lecz ich promienie są różne ze względu na różne ładunki jądra.

Chemia ogólna, nieorganiczna i analityczna.
str. 22
Energia jonizacji – to energia potrzebna do oderwania elektronu od atomu pierwiastka w fazie gazowej.
Ponieważ z każdego atomu można oderwać jeden, dwa lub więcej elektronów, a oderwanie każdego
elektronu wymaga innej energii,
pierwszej,
drugiej,
trzeciej,
itd. energii jonizacji.
Pierwszą energię jonizacji nazywamy energią potrzebną do przemiany: M->M
+
drugą do przemiany M
+
->M
2+
, trzecią do przemiany M
2+
->M
3+
a) Aby usunąć elektrony z obojętnego atomu konieczne jest dostarczenie energii w celu pokonania
przyciągania częściowo ekranowego jądra.
b) Znacznie więcej energii potrzeba do odciągnięcia drugiego elektronu od kationu, gdyż w tym przypadku
jądro jest słabiej ekranowane i silniej przyciąga elektron.
Metale występują w lewej dolnej części układu okresowego gdyż położone tam mają niską energie
jonizacji.
Pierwsze energie jonizacji są największe dla pierwiastków położonych blisko helu, a najmniejsze dla
pierwiastków położonych blisko cezu.
Zaproponuj przyczynę zmniejszenia się energii jonizacji przy przejściu od azotu (1400kJ/mol) do tlenu
(1310kJ/mol).
Strategia: W przypadku atomów wieloelektronowych rolę odgrywają efekty wzajemnego odpychania się
elektronów.
Rozwiązanie: Trzy zewnętrzne elektrony w atomie N zajmują trzy różne orbitale 2p, lecz jeden z orbitali 2p
w atomie O jest zapełniony.
Z tego względu energia jonizacji jest mniejsza dla tlenu niż azotu.
POWINOWACTWO ELEKTRONOWE
Powinowactwo elektronowe E
pe
pierwiastka jest to energia wydzielana podczas przyłączenia elektronu do
atomu pierwiastka w stanie gazowym.
Cl (g) + e
-
-> Cl
-
(g)
E
pe
= (energia Cl+e
-
)-(energia Cl
-
)
Dodatnie powinowactwo elektronowe oznacza, że energia anionu jest mniejsza od łącznej energii
obojętnego atomu i swobodnego elektronu.
E
pe
= (energia Cl+e
-
)-(energia Cl
-
)
Ujemne powinowactwo elektronowe oznacza, że energia anionu jest większa od energii obojętnego atomu
i przyłączenie elektronu do atomu wymaga dostarczenia energii.
Gazy szlachetne mają ujemne powinowactwa elektronowe, gdyż przyłączany do nich elektron musi zająć
orbital znajdujący się poza zamkniętą powłoką daleko od jądra.
Największe powinowactwo elektronowe mają pierwiastki położone blisko tlenu, fluoru, chloru.
Atomy grupy 17 mogą przyłączyć jeden elektron z uwolnieniem energii, a atomy grupy 16 mogą
przyłączyć dwa elektrony po dostarczeniu osiągalnej chemicznie energii.
Fluorowce tworzą więc z reguły jony X
-
, a tlenowce jony X
2-
.

Chemia ogólna, nieorganiczna i analityczna.
str. 23
Przykład.
Wytłumacz dlaczego beryl ma znacznie mniejsze powinowactwo elektronowe niż lit.
Dodatni elektron obsadza orbital 2s w licie, lecz orbital 2p w berylu, a elektron 2s ma mniejsza energię niż
elektron 2p.
WŁAŚCIWOŚCI PIERWIASTKÓW
Półmetale tworzą w układzie okresowym pasmo diagonalne między metalami i niemetalami. Położenie
półmetali stanowi odzwierciedlenie diagonalnych powiązań między pierwiastkami.
Właściwości metali i niemetali.
Metale
Niemetale
tworzenie połyskliwej, gładkiej powierzchni w stanie
stałym (bardziej reaktywne metale tworzą na
powierzchni warstwę tlenków),
szybkie wypromieniowywanie ciepła,
bardzo dobre przewodnictwo elektryczne (za
przewodnictwo odpowiedzialne są ujemnie
naładowane cząstki, czyli elektrony , które poruszają
się w sieci krystalicznej między jonami dodatnimi.
Jest to typ wiązania metalicznego),
skłonność do tworzenia związków chemicznych o
właściwościach raczej zasadowych i nukleofilowych,
stały stan skupienia w temperaturze pokojowej
(wyjątkiem jest rtęć) i z reguły dość wysoka
temperatura topnienia,
bezwonność.
izolatory - słabe przewodnictwo elektryczne i
przewodność cieplna w porównaniu z metalami
tlenki niemetali wykazują raczej własności kwasowe
niż zasadowe
formują one kryształy, które nie posiadają połysku i
nie mają gładkiej powierzchni
mają zwykle niższe temperatury topnienia i wrzenia
niż metale o zbliżonych masach atomowych - dzięki
czemu wiele z nich jest w temperaturze pokojowej
cieczami lub gazami
Wszystkie pierwiastki bloku s są reaktywnymi metalami. Pierwiastki bloku p wykazują tendencję do
przyłączenia elektronów w celu osiągnięcia zamkniętych powłok; charakter tych pierwiastków zmienia
się od metalicznego, poprzez półmetaliczny do niemetalicznego.
Dwa powiązane diagonalnie pierwiastki często wykazują podobne właściwości chemiczne wszystkich
pierwiastków bloku d, są metalami o właściwościach pośrednich między właściwościami pierwiastków
bloku s i p. Wiele pierwiastków bloku d tworzy kationy na różnych stopniach utlenienia.
TEORIE TWORZENIA WIĄZAŃ CHEMICZNYCH
Cząsteczki powstają w wyniku połączenia się dwóch lub więcej atomów.
Atomy łączą się ze sobą tylko wtedy, gdy energia cząsteczek produktów jest
mniejsza od sumy energii atomowej i cząsteczkowej substratów.
Wszystkie atomy podczas reakcji chemicznych dążą do uzyskania
konfiguracji elektronowej najbliższego gazu szlachetnego, czyli posiadania
ośmiu elektronów – oktetu elektronowego – w zewnętrznej powłoce, lub
posiadania dwóch elektronów – dubletu elektronowego.
Podstawy nowoczesnej interpretacji wiązań chemicznych opracował G.N.
Lewis, chemik amerykański, który opisał mechanizmy tworzenia wiązań chemicznych, opierając się na
zmianach położenia elektronów walencyjnych.

Chemia ogólna, nieorganiczna i analityczna.
str. 24
Elektrony walencyjne przedstawiane są przy pomocy symboli:
We wzorach Lewisa dla cząsteczek rysuje się wszystkie elektrony walencyjne takie jak elektrony tworzące
wiązania chemiczne i tzw. wolne pary elektronowe.
Wzory Lewisa zapisuje się w formie uproszczonej zastępując parę elektronów kreską.
Opracowana przez G. N. Lewisa teoria tworzenia wiązań chemicznych nosi nazwę Elektronowej Teorii
Wiązania Chemicznego.
Nowa teoria wyjaśnia mechanizm tworzenia wiązań chemicznych o nazwie kwantowej teorii wiązań
chemicznych.
TYPY WIĄZAŃ CHEMICZNYCH
1. jonowe – eletrowalencyjne
2. atomowe – kowalencyjne
3. wiązanie metaliczne
4. siły międzycząsteczkowe
Do wiązań atomowych zalicza się również:
- wiązanie pośrednie czyli atomowe spolaryzowane (kowalencyjne- spolaryzowane)
-wiązanie donorowo – akceptorowe (koordynacyjne)
Pozostałe wiązanie siły międzycząsteczkowe to:
-wiązania wodorowe
-wiązania międzycząsteczkowe czyli wiązania siłami van der Waalsa
ELEKTRONOWA TEORIA WIĄZAŃ CHEMICZNYCH
1. Wiązania jonowe (eletrowalencyjne), sieci jonowe.
Wiązania jonowe występują w układach złożonych z atomów o skrajnie różniących się
elektroujemnościach.
Atom pierwiastka elektrododatniego oddaje, a atom pierwiastka elektroujemnego przyłącza elektrony.
Tworzą się dwa jony o różnoimiennych ładunkach przyciągające się dzięki działaniu sił
elektrostatycznych, które w stanie stałym tworzą siec jonową.

Chemia ogólna, nieorganiczna i analityczna.
str. 25
Na przykład:
Atom sodu (Na) oddaje elektron i staje się kationem (Na
+
).
Atom chloru (Cl) przyjmuje elektron i staje się anionem (Cl
-
).
Siły elektrostatycznego przyciągania utrzymują w trwałości cząsteczkę.
Jeżeli nie wystąpi oddziaływanie czynników zewnętrznych i jony nie mogą się przemieszczać to tworzą
sieć krystaliczną. W takiej sieci krystalicznej nie ma cząsteczek, a są rozmieszczone w przestrzeni jony.
Struktura chlorku sodowego w którym każdy jon sodu jest otoczony sześcioma jonami chlorkowymi, a z
kolei każdy jon chlorkowy sześcioma jonami sodowymi i nie można rozróżnić, który z jonów sodu do
którego z jonów chloru należy i na odwrót.
Cały kryształ można tu traktować jako jedną makrocząsteczkę.
Podobny przebieg ma reakcje tworzenie cząsteczki MgO.
2Mg + O
2
-> 2MgO
Typowymi związkami jonowymi są halogenki, tlenki oraz siarczki litowców i berylowców.
Z wiązaniami jonowymi spotykamy się również w cząsteczkach soli kwasów tlenowych, które występuje
między kationem metalu, a anionem reszty kwasowej.
Charakterystyczne dla związków chemicznych o budowie jonowej jest przewodzenie prądu elektrycznego
po stopieniu lub rozpuszczeniu w wodzie.

Chemia ogólna, nieorganiczna i analityczna.
str. 26
2. Wiązania atomowe (kowalencyjne).
Wiązania te powstają, gdy łączą się ze sobą atomy pierwiastków elektroujemnych o takich samych
wartościach elektroujemności.
Wiążące się atomy dążą do osiągnięcia struktury oktetowej najbliższego gazu szlachetnego. Wiązania tego
typu występują w cząsteczkach H
2
, Cl
2
, O
2
,N
2
, itp.
Wiązanie kowalencyjne niespolaryzowane (atomowe)
Pamiętaj, jeśli różnica elektroujemności atomów tworzących wiązanie jest równa zero, a więc są to te
same pierwiastki, to powstanie wiązanie atomowe (kowalencyjne niespolaryzowane). Polega ono na
uwspólnieniu elektronów walencyjnych obu atomów i elektrony te znajdują się dokładnie w środku
pomiędzy tymi atomami.
a) Mechanizm powstawania wiązania kowalencyjnego w cząsteczce chloru.
-powstaje w wyniku uwspólnieniu elektronów.
Pary elektronów walencyjnych nie biorących udziału w wiązaniu noszą nazwę wolnych elektronów. Jeżeli
utworzenie jednej wiążącej pary elektronowej nie wystarcza do utworzenia oktetu, atom może
wykorzystać dwa lub trzy elektrony tworząc wiązanie podwójne lub potrójne.
b) Mechanizm powstawania wiązania kowalencyjnego w cząsteczce azotu
Atom może utworzyć tyle wiązań ile ma niesparowanych elektronów. W wiązaniu jonowym para
elektronowa całkowicie jest przesunięta do atomu bardziej elektroujemnego. W wiązaniu atomowym
wiążąca para elektronowa znajduje się w jednakowej odległości od jąder atomów tworzących wiązanie.
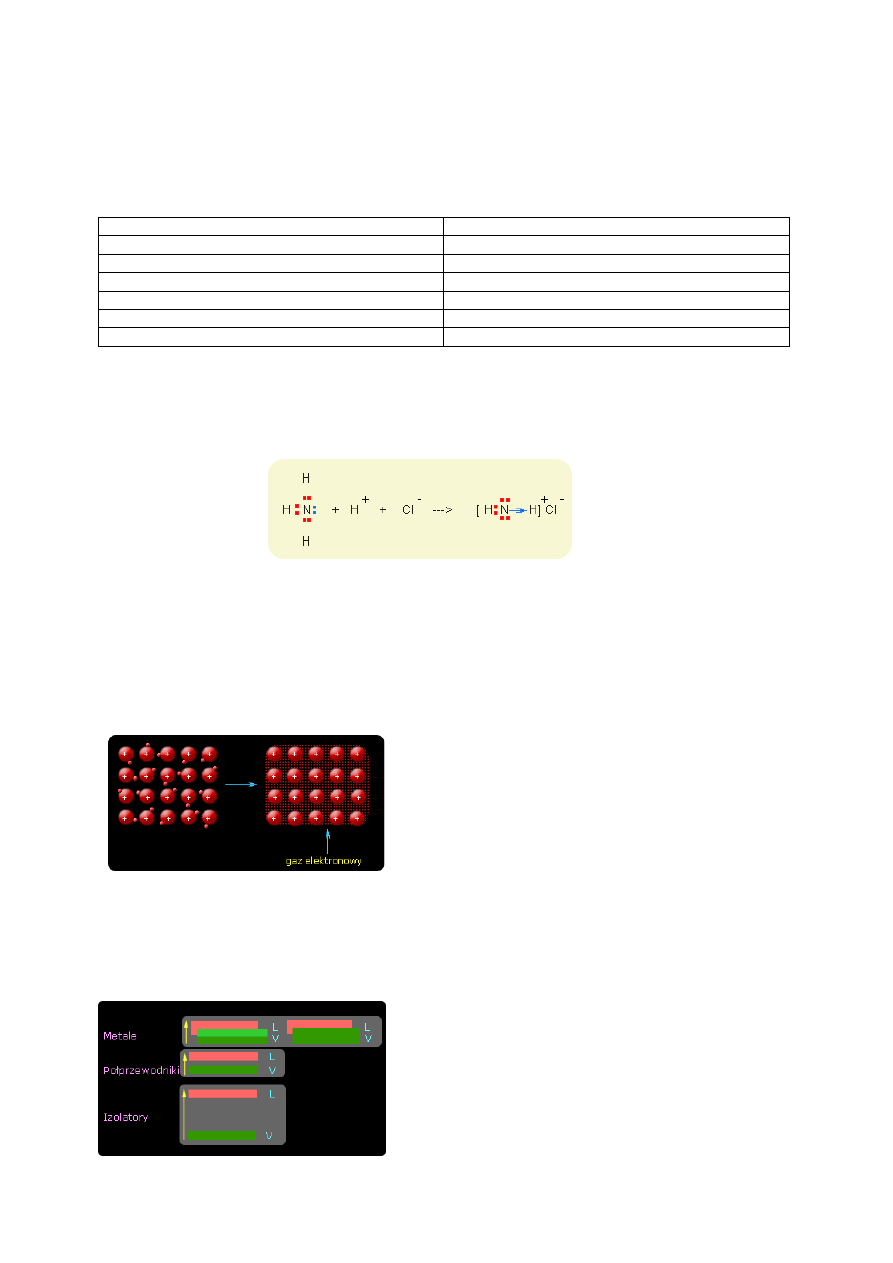
Wiązanie atomowe (kowalencyjne – spolaryzowane)
Wiązanie atomowe spolaryzowane jest wiązaniem pośrednim między jonowym, a atomowym; łączą się ze
sobą atomy pierwiastków różniących się elektroujemnością, lecz nie tak znaczną.
Jednym z przykładów tego wiązania może być połączenie chloru z wodorem w cząsteczce chlorowodoru.
c) Mechanizm powstawania wiązania kowalencyjnego – spolaryzowanego w cząsteczce
chlorowodoru
Chemia ogólna, nieorganiczna i analityczna.
str. 27
Cząsteczki z wiązania kowalencyjnego spolaryzowanego z powodu nierównomiernego, niesymetrycznego
rozmieszczenia ładunków w stosunku do środka cząsteczki wykazują biegunowość. Cząsteczki o budowie
polarnej nazywamy dipolami tak zwanymi cząsteczkami dwubiegunowymi.
Cząsteczki dwubiegunowe mają tzw. moment dipolowy. (µ)
Substancja
Moment dipolowy µ (10
-30
C∙m)
C
6
H
6
0
CCl
4
0
NH
3
4,908
CO
0,366
CO
2
0
H
2
O
6,186
Wiązanie donorowo – akceptorowe (koordynacyjne)
Jest to wiązanie atomowe, w którym wszystkie elektrony wiązania pochodzą od jednego atomu (tzw.
donor); drugi atom (tzw. akceptor) uzupełnia własną powłokę walencyjną elektronami donora.
Najprostszym przykładem powstawania wiązania donorowo-akceptorowego jest tworzenie się jonu
amonowego. Azot w cząsteczce amoniaku mający wolną parę elektronową przyłącza (dokoordynowuje)
do niej jon wodorowy. Sposób powstawania tego wiązania jest inny niż powstawanie trzech pozostałych
wiązań między atomami wodoru z azotem, w których każdy atom wodoru oddaje do wiązania jeden
własny elektron. Po utworzeniu jednak wiązania donorowo-akceptorowego wszystkie cztery atomy
wodoru w jonie amonowym stają się równocenne.
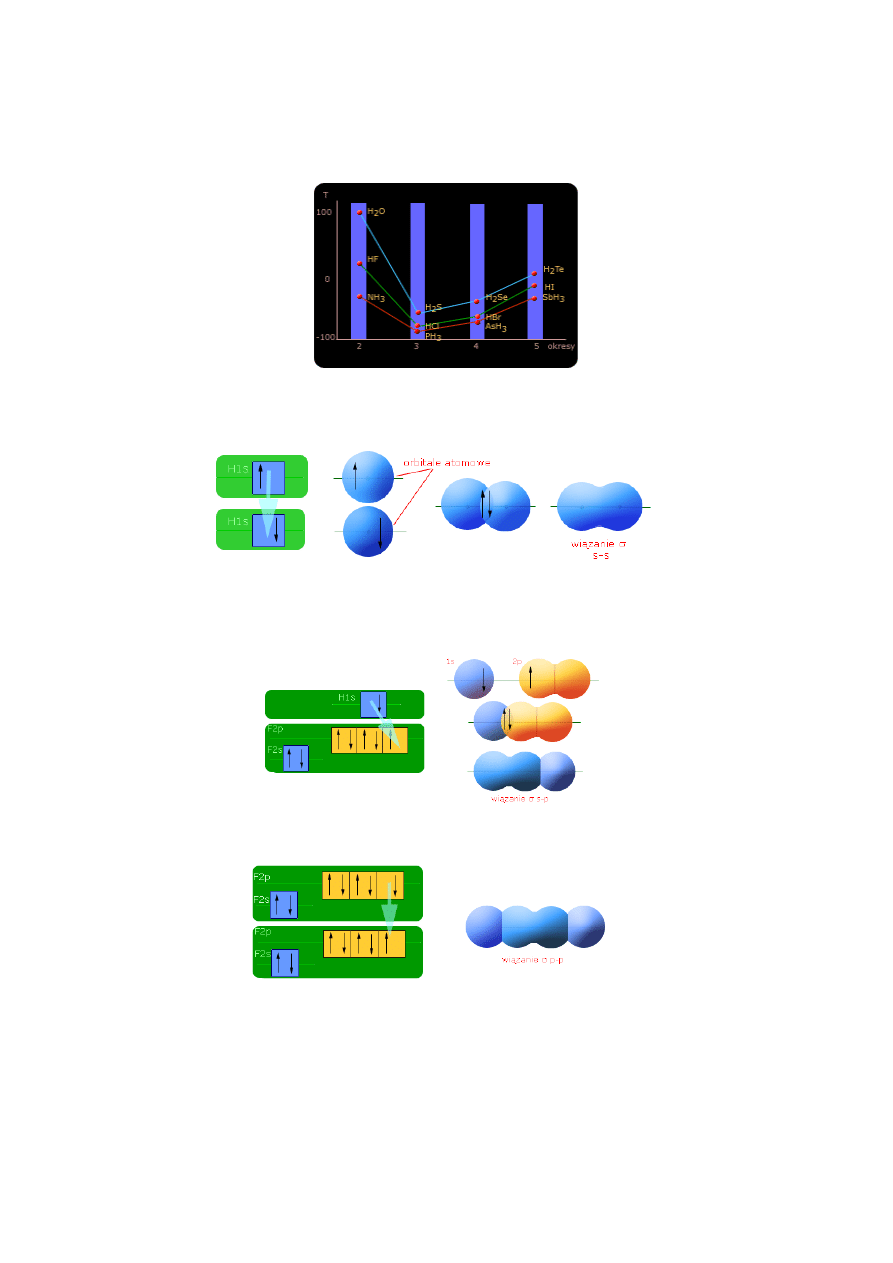
3. Wiązanie metaliczne
Tworzy się ono pod wpływem elektrycznego przyciągania
między jądrami atomowymi i swobodnie poruszającymi się
elektronami pochodzącymi z zewnętrznych powłok
elektronowych atomów.
Tak więc metal (sód) składa się z sieci dodatnich jonów,
zanurzonych w gazie swobodnie poruszających się
elektronów walencyjnych, które straciły bezpośredni
związek z atomami macierzystymi i stanowią niejako wspólną własność wszystkich jonów równocześnie.
Opierając się na prawach mechaniki kwantowej zakłada się istnienie w krysztale poziomów
elektronowych i odpowiadających im pasm stanów energetycznych.
Najwyższe zapełnione pasmo energetyczne nosi nazwę
pasma walencyjnego V, następne, położone wyżej (nie
zapełnione), pasma przewodnictwa L.
Jeżeli pasmo walencyjne i pasmo przewodnictwa mają
zbliżone energie (nakładają się), wtedy substancja może
przewodzić prąd elektryczny. Przykładem są różnego
rodzaju metale.
W przypadku znacznej różnicy energii pomiędzy pasmem

Chemia ogólna, nieorganiczna i analityczna.
str. 28
walencyjnym i pasmem przewodnictwa, elektrony nie są w stanie przejść do pasma przewodnictwa.
Obserwujemy wtedy brak przewodnictwa elektrycznego a sama substancja jest izolatorem. Stanem
pośrednim jest stan półprzewodnictwa.
Łączenie się między sobą obojętnych cząsteczek i helowców tłumaczy się występowaniem sił przyciągania
i odpychania, które noszą nazwę oddziaływań międzycząsteczkowych.
Istnieją trzy główne typy oddziaływań międzycząsteczkowych:
1. wodorowe
2. siły van der Waalsa
3. oddziaływanie jon – jon
Wiązanie van der Waalsa (międzycząsteczkowe).
Siły te są wynikiem wzajemnego oddziaływania elektronów i jąder w cząsteczkach. Powstają
szybkozmienne dipole, które wzajemnie przyciągają się, zwiększając w miarę zbliżania się wzajemną
polaryzację elektronową.
Wzrost sił van der Waalsa powoduje wzrost temperatury wrzenia pierwiastków.
I tak atom wodoru F
2
ma tylko 9 elektronów, fluktuacje (szybkie zmiany położenia w przestrzeni)
w tej chmurze elektronowej są małe i oddziaływania międzycząsteczkowe są tak słabe, że gazowy fluor
wrze w temperaturze -188
o
C. W atomie takim jak brom Br
2
mamy 35 elektronów, fluktuacje są
zdecydowanie większe a efektem tego jest zmiana temperatury wrzenia, która dla bromu wynosi 59
o
C.
Siły van der Waalsa są siłami typu uniwersalnego. Odnoszą się do wszystkich cząsteczek niezależnie od
ich kształtu i wielkości.
Wiązanie wodorowe
Wiązanie wodorowe tworzy się pomiędzy atomem wodoru związanym z atomem o dużej
elektroujemności, a atomem z wolnymi parami elektronowymi.
Wiązanie wodorowe oznacza się kropkami, by odróżnić je od prawdziwego wiązania kowalencyjnego, np.
we wzorze;
O istnieniu tego rodzaju wiązania świadczą wyjątkowo wysokie temperatury wrzenia wody, amoniaku i
fluorowodoru. Jest ono utworzone przez atom wodoru położony między dwoma małymi, silnie
elektroujemnymi atomami zawierającymi wolne pary elektronowe.
Donorami wolnych par elektronowych w szczególności atomy N, O i F.
Aby zrozumieć powstawanie wiązania wodorowego, posłużymy się cząsteczką wody w której mamy
silnie spolaryzowane wiązanie O-H. Elektroujemny atom O silnie
przyciąga elektrony wiązania, co powoduje, że atom H uzyskuje
duży cząstkowy ładunek dodatni. Dodatnio naładowany atom
wodoru jest silnie przyciągany przez jedną z wolnych par
elektronowych atomu O sąsiedniej cząsteczki wody. W wyniku
silnego oddziaływania wolnej pary elektronowej o ładunku
ujemnym i cząstkowego ładunku dodatniego powstaje wiązanie.
Wiązania wodorowe mogą tworzyć się pomiędzy różnymi
cząsteczkami. Takie wiązanie nosi nazwę międzycząsteczkowego
wiązania wodorowego. Przykładem mogą być wiązania tworzące
Chemia ogólna, nieorganiczna i analityczna.
str. 29
się pomiędzy już opisanymi cząsteczkami wody.
Ten typ wiązania wpływa, między innymi na wartość temperatury wrzenia, temperatury topnienia oraz
rozpuszczalności.
WIĄZANIA KOWALENCYJNE W UJĘCIU KWANTOWYM
Powstaje w wyniku nakładania się (zlewania się) orbitali atomowych.
Sigma - powstający charakterystyczny rozkład elektronów między dwoma atomami. W podobny sposób
powstaje wiązanie sigma w połączeniach wodoru z fluorowcami.
Wiązanie sigma powstaje również w wyniku nakładania się elektronów orbitali p. Przykładem jest F
2
.
Przyjęcie tego założenia wyjaśnia nam istotę wiązań w cząsteczkach wieloatomowych. Np. w cząsteczkach
fluorku sodu. Bor ma pusty orbital 2p, podobnie, jak węgiel. Można zwiększyć liczbę orbitali w obu
atomach przez dostarczenie energii wystarczającej do przeniesienia elektronu, czyli wzbudzenia go do
orbitalu o wyższej energii. Wzbudzenie elektronu do orbitalu do wyższej energii nosi nazwę promocji.
Dla wyjaśnienia budowy cząsteczek kwantowa teoria wprowadziła pojęcie:
Chemia ogólna, nieorganiczna i analityczna.
str. 30
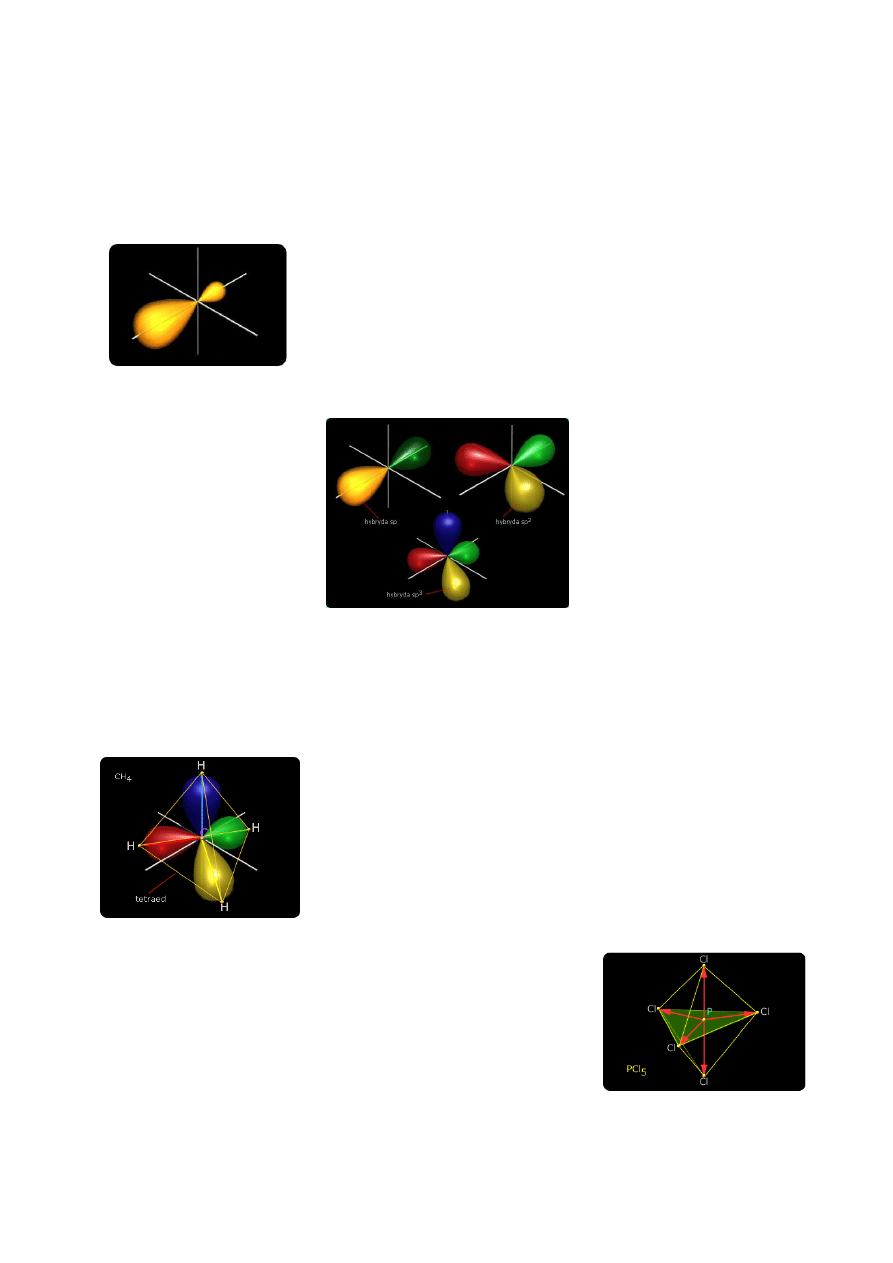
HYBRYDYZACJI – wzajemne wymieszanie się orbitali. W wyniku wymieszania powstają orbitale
zhybrydyzowane (hybrydy).
W przypadku atomu węgla wchodzącego w skład cząsteczki CH
4
, wymieszaniu podlega orbital s z trzema
orbitalami p. Po wymieszaniu powstają cztery równocenne orbitale zhybrydyzowane określane jako
hybrydy sp
3
. Zmieszane ze sobą orbitale s i p kształtem przypominają orbitale p.
W oznaczeniach orbitali zhybrydyzowanych wskaźnik górny nie oznacza
liczby elektronów, lecz liczbę orbitali danego typu, które biorą udział w
procesie hybrydyzacji. Z tego wynika, że istnieją;
dwa orbitale zhybrydyzowane (hybrydy) typu sp
trzy orbitale zhybrydyzowane (hybrydy) typu sp
2
cztery orbitale zhybrydyzowane (hybrydy) typu sp
3
Schematy hybrydyzacji.
HYBRYDYZACJA I GEOMETRIA CZĄSTECZEK
Obecnie możemy wyjaśnić powstawanie wiązania i budowę cząsteczki metanu. Niesparowany elektron
zajmuje każdy ze zhybrydyzowanych orbitali sp
3
węgla. Każdy z tych czterech elektronów może sparować
się z elektronem z orbitalu 1s wodoru. W wyniku nakładania sie orbitali
tych elektronów powstają wiązania s. Ponieważ cztery orbitale
zhybrydyzowane są skierowane ku narożom tetraedru, taki sam jest
kierunek wiązań s. Wszystkie cztery wiązania są identyczne, powstają
bowiem z tej samej mieszaniny orbitali atomowych.
Przez analogię pierwiastki grup głównych trzeciego i dalszych okresów
wykorzystują do hybrydyzacji wolne orbitale d o tej samej głównej liczbie
kwantowej co orbitale s i p tworząc hybrydy. W wyniku wykorzystania
orbitali d powstają warunki do pomieszczenia więcej niż czterech par
elektronowych. Na przykład w wyniku wymieszania jednego orbitalu s,
trzech orbitali p i jednego orbitalu d, powstają zhybrydyzowane orbitale
dsp
3
. Tworzą one konfigurację bipiramidy trygonalnej. I faktycznie taką
budowę ma cząsteczka PCl
5
, w której kierunek wiązań P-Cl jest
wyznaczony konfiguracją bipiramidy trygonalnej.
Orbital typu sp.

Chemia ogólna, nieorganiczna i analityczna.
str. 31
Z udziałem orbitali d, mogą powstać następujące ważne zespoły orbitali:
hybrydyzacja oktaedryczna d
2
sp
3
, gdzie powstaje sześć równoważnych zhybrydyzowanych
orbitali skierowanych ku narożom ośmiościanu (oktaedru)
hybrydyzacja kwadratowa dsp
2
, gdzie powstaje cztery równoważne orbitale zhybrydyzowane
skierowane ku wierzchołkom kwadratu w płaszczyźnie xy
hybrydyzacja tetraedryczna sd
3
, gdzie orbital s i trzy orbitale d tworzą cztery równoważne
orbitale skierowane tetraedrycznie
hybrydyzacja bipiramidalna dsp
3
, gdzie powstaje pięć nierównoważnych orbitali
zhybrydyzowanych skierowanych ku narożom bipiramidy trygonalnej.
Najważniejsze rodzaje hybrydyzacji skierowanej ku narożom bipiramidy trygonalnej orbitali:
Liczba zewnętrznych orbitali
Ukształtowanie przestrzenne
Rodzaj hybrydyzacji
2
liniowe
sp
3
trygonalno płaskie
sp
2
4
tetraedryczne
sp
3
5
bipiramidalne
sp
3
d
6
oktaedryczne
sp
3
d
2
4
kwadratowo płaskie
sp
2
d
W oparciu o zjawisko hybrydyzacji można wyjaśnić zjawisko wiązania podwójnego, np. ozonu, benzenu (o
konstrukcji pierścieniowej). Nakładające się zhybrydyzowane orbitale sp
3
tworzą symetryczny
sześciokątny pierścień złożony z wiązań sigma. Sześć skierowanych prostopadle do płaszczyzny
pierścienia orbitali typu p, obsadzonych pojedynczymi elektronami tworzy orbital zhybrydyzowany π.
TEORIA ORBITALI MOLEKULARNYCH (metoda MO)
Jest to metoda stosowana w chemii kwantowej pozwalająca na przybliżony opis wiązań chemicznych.
Teoria ta zakłada, że podczas powstawania wiązania chemicznego chmury elektronowe orbitali
(zawierających niesparowany elektron) każdego z wiążących się atomów przenikają się lub nakładają
nawzajem i powstają w ten sposób tzw. orbitale molekularne. Przy kombinacji dwu orbitali atomowych
tworzą się dwa energetycznie różne orbitale cząsteczkowe, jeden (nisko energetyczny) wiążący i jeden
(wysoko energetyczny) antywiążący.
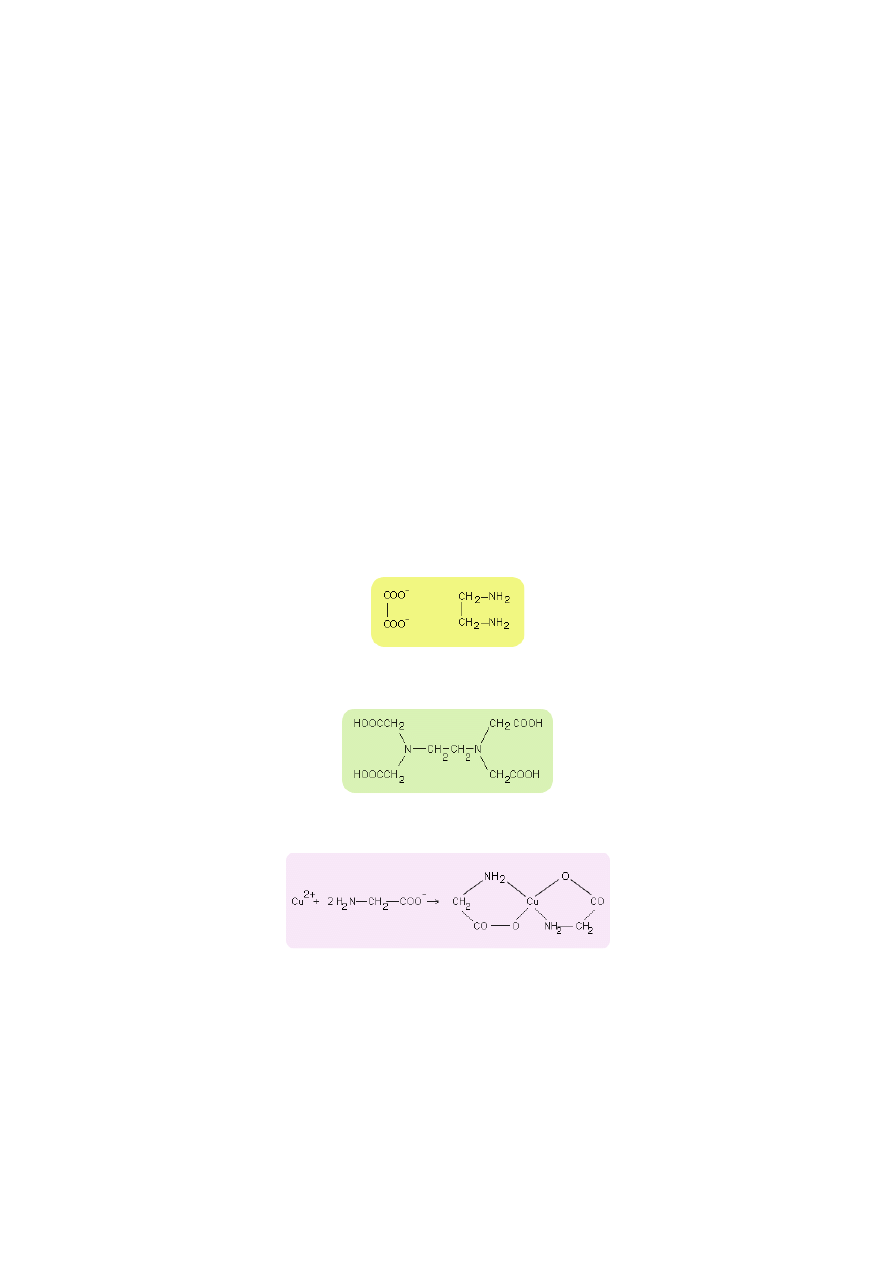
Chemia ogólna, nieorganiczna i analityczna.
str. 32
ISTOTA ZWIAZKÓW KOMPLEKSOWYCH
1. Związek nieorganiczny, którego cząsteczka zawiera kilka atomów otaczających jeden lub więcej
atomów metalu, nosi nazwę związku kompleksowego lub związku koordynacyjnego.
[Cd(NH
3
)
4
]
2+
, [Fe(CN)
6
]
4-
Zgodnie ze współczesną teorią w związku kompleksowym wyróżnia się atom centralny i cząsteczki
koordynowane zwane ligandami.
Atomy centralne to najczęściej kationy pierwiastków przejściowych, np. Ag
+
, Cu
2+
, Al
3+
, Zn
2+
itp.
Typy ligandów
aniony proste i złożone OH
-
, F
-
, Cl
-
, CN
-
cząsteczki zawierające wolne pary elektronowe: NH
3
, H
2
O, aminy, kwasy organiczne,
aminokwasy.
Ligandy oddające jedną parę elektronową noszą nazwę ligandów jednokleszczowych lub
jednofunkcyjnych. Przykładem jest cząsteczka amoniaku NH
3
.
Ligandy zawierające dwa lub więcej atomów, z których każdy może jednocześnie utworzyć
dwuelektronowe wiązanie donorowe z tym samym atomem metalu, noszą nazwę ligandów
wielokleszczowych (wielofunkcyjnych) lub chylatowych.
Ligandy dwukoordynacyjne, np.
Ligandy trój, cztero, a nawet sześciokoordynacyjne, przykład - kwas etylenodwuaminoczterooctowy
Związek kompleksowy chelatowy (chelat)
Liczba ligandów otaczających bezpośrednio jon centralny nazywa się liczbą koordynacyjną i
zwykle wynosi 2, 4, 6, 8.
Ponieważ jednym z ligandów może być cząsteczka wody, więc kationy metali przejściowych w roztworze
wodnym są w rzeczywistości akwakompleksami, dlatego w roztworach wodnych wewnętrzna strefa
koordynacyjna utworzona jest z cząsteczek wody, które mogą być zastąpione silniej wiążącym ligandem.
Zastąpienie cząsteczek wody przez inne ligandy nie musi być całkowite. Na przykład kation Cr
3+
, w
zależności od warunków, tworzy jony kompleksowe [Cr(H
2
O)
6
]
3+
, [CrCl(H
2
O)
5
]
3+
oraz [CrCl
2
(H
2
O)
4
]
3+

Chemia ogólna, nieorganiczna i analityczna.
str. 33
2. Struktura elektronowa metali
W pierwiastkach od potasu do kryptonu elektrony zewnętrzne mogą zajmować pięć orbitali 3d, orbital 4s
oraz trzy orbitale 4p. W następnych szeregach metali przejściowych dostępne orbitale są podobne, lecz
główna liczba kwantowa wzrasta o 1 lub 2.
Orbitale d metali przejściowych zdolne są do hybrydyzacji z orbitalami s oraz trzema orbitalami p powłoki
walencyjnej.
W zależności od rodzaju hybryd biorących udział w tworzeniu kompleksu uzyskujemy różne rodzaje
struktur cząsteczek.
sp - liniowa
sp
2
- trygonalna
sp
3
- tetraedryczna
dsp
2
- kwadratowa płaska
d
2
sp
3
– oktaedryczna
Geometria oktaedryczna. Przykładem jest kompleks [Fe(CN)
6
]
3-
. Tworzenie sie takiego kompleksu
możemy przedstawić następująco:
Żelazo (z = 26) ma konfiguracje elektronową 1s
2
2s
2
p
6
3s
2
p
6
d
6
4s
2
. Aby utworzył sie jon Fe
3+
, należy
pozbyć się dwóch elektronów 4s i jednego z elektronów 3d. Uwalnia to pięć elektronów w pięciu
orbitalach 3d. Aby związać jon CN
-
, będziemy potrzebować dwóch orbitali d, jednego 4s i trzech orbitali
3p. Uzyskamy to poprzez wtłoczenie wszystkich elektronów 3d
5
do trzech orbitali. Mamy wtedy sześć
wolnych orbitali gotowych do przyłączenia CN
-
. Każdy jon CN
-
lokuje parę elektronów w dostępny orbital
żelaza i w ten sposób powstaje wiązanie kowalencyjne. Cały kompleks zespala się razem, ponieważ
następuje podział elektronów między orbital zhybrydyzowany d
2
sp
3
i niektóre orbitale cyjanku.
Urok powyższego zobrazowania polega na tym, że pokazuje ono iż w kompleksie [Fe(CN)
6
]
3-
powinien być
jeden elektron niesparowany. Rzeczywiście pokrywa sie to z obserwacją paramagnetyzmu kompleksu.
Chociaż Fe
3+
ma pięć niesparowanych elektronów, Fe(CN)
63-
ma tylko jeden. Pierwszy zwany jest
elektronem wysokospinowym, a ostatni - niskospinowym.
Geometria tetraedryczna Przykładem może być jon cynku Zn
2+
(1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
), który ma
dziesięć elektronów na zewnątrz powłoki elektronowej argonu. Mogą one zajmować parami pięć orbitali
3d (konfiguracja d
10
), pozostawiając orbital 4s oraz trzy orbitale 4p zdolne do hybrydyzacji z
utworzeniem czterech orbitali wiążących o symetrii tetraedrycznej. Stwierdzono doświadczalnie, ze
dwudodatni jon cynku ma rzeczywiście liczbę koordynacyjną cztery i tworzy kompleksy, w ktorych cztery
atomy lub grupy atomów z nim związane rozmieszczone są w narożach czworościanu.
Do jonów kompleksowych tego typu należą; [Zn(OH)
4
]
2-
, [Zn(NH
3
)
4
]
2+
i [Zn(CN)
4
]
2-
.
Geometria płaskokwadratowa Przykładem jest [Ni(CN)
4
]
2-
, kompleks pochodzący od Ni
2+
(1s
2
2s
2
p
6
3s
2
p
6
d
8
4s
2
) w którym wszystkie osiem elektronów d jest wciśnietych w cztery orbitale d, zwalniając
jeden orbital d dla utworzenia hybryd dsp
2
.
Kompleksy płaskokwadratowe są najbardziej rozpowszechnione dla atomów metalu o konfiguracji d
8
.
Takim metalem jest Ni.
Struktury związków kompleksowych
Istnieje określony związek między geometrią cząsteczki a liczbą koordynacyjną. Poniżej przedstawione
będą najczęściej występujące liczby koordynacyjne i odpowiadające im typowe struktury cząsteczek.
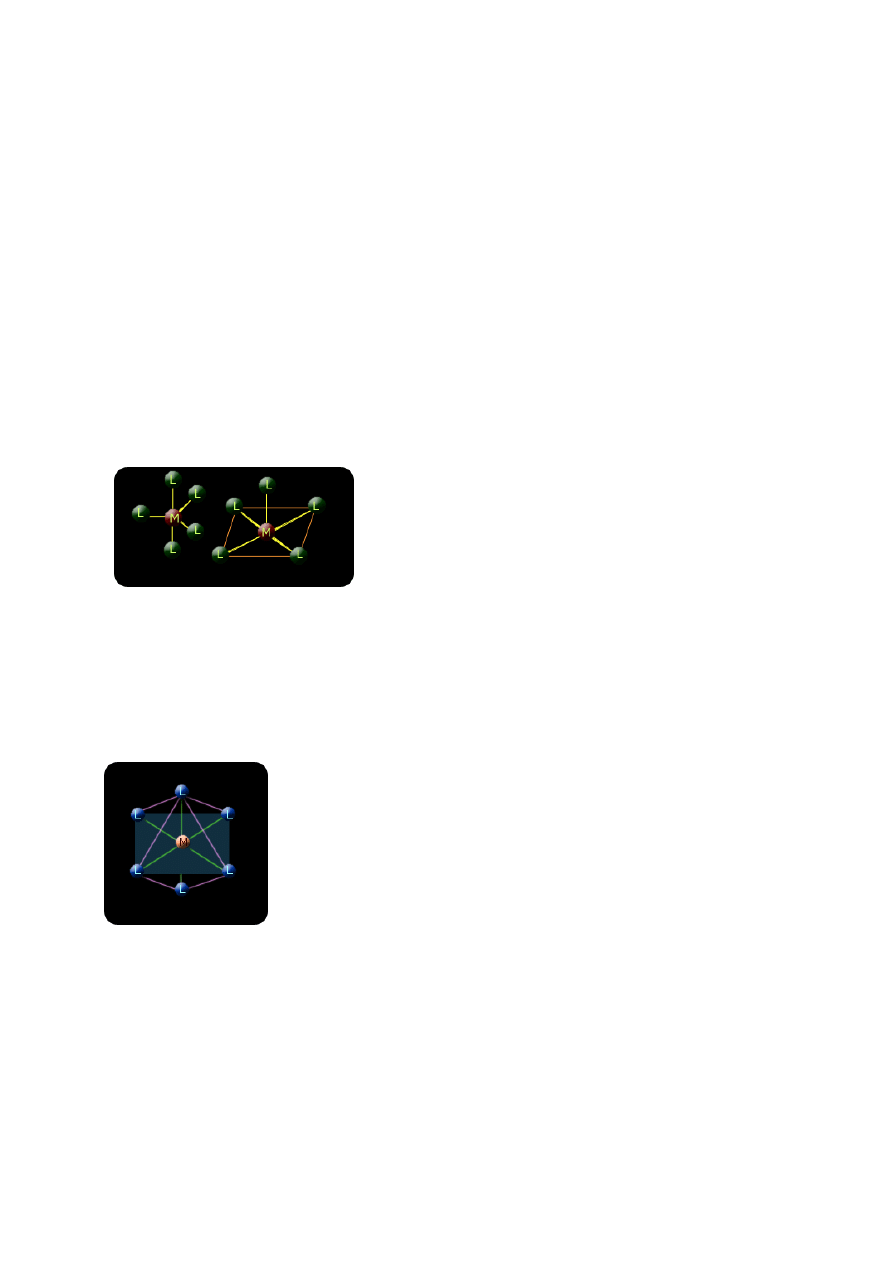
Chemia ogólna, nieorganiczna i analityczna.
str. 34
Liczba koordynacyjna 3
W przypadku kompleksów o liczbie koordynacyjnej 3 najważniejsza jest struktura trójkątna płaska i
struktura piramidy trygonalnej. Przykłady to płaskie kompleksy HgI
3-
i [Cu(CN)
3
]
2-
oraz piramidalny
kompleks SnCl
3-
.
Liczba koordynacyjna 4
Jest to jedna z najważniejszych liczb koordynacyjnych, której odpowiadają struktury: tetraedryczna lub
kwadratowa płaska. Dominują kompleksy tetraedryczne, tworzone prawie wyłącznie przez metale
nieprzejściowe i metale przejściowe nie znajdujące sie w pobliżu prawej strony bloku d.
Jako przykłady struktur tetraedrycznych można wymienić; Li(H
2
O)
4+
, BeF
42-
, BH
4-
, AlCl
4-
i Ni(CO)
4
.
Struktura tetraedryczna występuje najczęściej dla konfiguracji elektronów walencyjnych d
0
lub d
10
.
Kwadratowa konfiguracja płaska jest charakterystyczna dla konfiguracji elektronowej d
8
. Występuje to
zwykle dla kompleksów jonów Ni
2+
, Pd
2+
, Pt
2+
, Rh
+
, Ir
+
i Au
3+
, a także dla kompleksów jonu d
9
, Cu
2+
.
Liczba koordynacyjna 5
Ta liczba koordynacyjna występuje rzadziej niż liczby 4 i 6, ma jednak istotne znaczenie. Dwie najbardziej
symetryczne odpowiadające jej struktury to bipiramida
trygonalna i piramida tetragonalna.
Te dwie struktury zwykle nieznacznie różnią się energią; każda z
nich może przekształcić się w pozostałą w wyniku zmian kątów
między wiązaniami. Ze względu na to struktury wielu
kompleksów o liczbie koordynacyjnej 5 nie pokrywają się
dokładnie z jedną z wymienionych struktur, lecz kompleksy te
mają pewną strukturę pośrednią.
Interesującym przykładem występowania dwóch struktur o liczbie koordynacyjnej 5 jest jon [Ni(CN)
5
]
3-
,
tworzący sól krystaliczną, w której wykryto obydwie struktury.
Liczba koordynacyjna 6
Jest to liczba niezwykle ważna, gdyż prawie wszystkie kationy tworzą kompleksy o liczbie koordynacyjnej
6. Praktycznie wszystkie te kompleksy mają identyczny kształt ośmiościanu (struktura oktaedryczna).
Praktycznie z uwagi na różnorodność ligandów nie może być zachowana
idealna symetria ośmiościanu. Obserwuje się wtedy odkształcenia na osi
wiązań ligand-atom centralny, co polega na wydłużaniu lub skracaniu wiązań.
Skrócenie lub wydłużenie jednej osi L-M-L w stosunku do dwóch pozostałych
nosi nazwę odkształcenia tetragonalnego, natomiast całkowite zniszczenie
równości osi to odkształcenie rombowe.
Wyższe liczby koordynacyjne
Liczby koordynacyjne 7, 8 i 9 występują nierzadko w przypadku niektórych większych kationów.
Każdemu z takich przypadków odpowiada kilka możliwych struktur, nie różniących sie na ogół znacznie
trwałością. Kompleksy o dużych liczbach koordynacyjnych nie są wiec z reguły sztywne stereochemicznie.
Liczbie koordynacyjnej 7 odpowiadają trzy różne regularne struktury:
bipiramida pentagonalna
konfiguracja wyprowadzona z ośmiościanu przez zwiększenie jednej ściany dla pomieszczenia
siódmego ligandu
Chemia ogólna, nieorganiczna i analityczna.
str. 35
konfiguracja wyprowadzona w podobny sposób ze słupa trygonalnego
Liczbie koordynacyjnej 8 odpowiadają także trzy ważne struktury:
sześcianu - występuje rzadko
antypryzmatu kwadratowego - powstaje w wyniku zniekształcenia sześcianu
dwunastościanu - powstaje w wyniku zniekształcenia sześcianu
IZOMERIA ZWIĄZKÓW KOMPLEKSOWYCH
Izomeria w związkach kompleksowych podobnie jak i wielu innych związków chemicznych, istnienie w
wyniku istnienia przyczyn jej powstawania. Na fakt istnienia izomerii składają się;
różne położenie ligandów w strukturze związku
istnienie różnych sposobów połączeń ligand - atom centralny.
Wśród związków kompleksowych znane są następujące rodzaje izomerii:
izomeria geometryczna
izomeria optyczna
izomeria jonowa
izomeria wiązaniowa
izomeria koordynacyjna
Izomeria geometryczna
Przykładem istnienia izomerii geometrycznej jest fakt istnienia izomerii cis i trans dla struktur
kwadratowych i oktaedrycznych.
Przykład - kompleks [Pt(NH
3
)
2
Cl
2
]
Jest to jeden z najprostszych przykładów izomerii związków
kompleksowych.
Przykładami innych ważnych rodzajów izomerii optycznej dla
struktur oktaedrycznych są podobnie jak dla struktur
kwadratowych izomeria cis i trans dla związku ML
4
X
2
oraz izomeria
facjalna i meridionalna dla związku ML
3
X
3
.
Izomeria optyczna
Zgodnie z definicją izomerami optycznymi są cząsteczki, które mają
się do siebie tak, jak obraz i jego zwierciadlane odbicie. Takie

Chemia ogólna, nieorganiczna i analityczna.
str. 36
cząsteczki nazywane są enacjomerami. Enacjomery różnią się pod wzgledem skręcalności optycznej.
Taką właściwość posiadają pewne typy kompleksów oktaedrycznych. Do najważniejszych enancjomerów
oktaedrycznych należą kompleksy zawierające dwa lub trzy ligandy kleszczowe, tj. typu M(L-L)
2
X
2
oraz
kompleksy typu M(L-L)
3
. Przykłady na rysunkach poniżej.
Izomeria jonowa
Istnieją przypadki, gdy związki kompleksowe mają jednakowy wzór empiryczny, lecz różnią się
położeniem anionów, które mogą występować jako ligandy w kompleksowym kationie lub stanowić
przeciwjony w sieci krystalicznej. Izomery takie tworzą w roztworze różne jony, zgodnie równaniami.
[Co(NH
3
)
4
Cl
2
]NO
2
---> [Co(NH
3
)
4
Cl
2
]
+
+ NO
2-
[Co(NH
3
)
4
Cl(NO
2
)]Cl ---> [Co(NH
3
)
4
Cl(NO
2
)]
+
+ Cl
-
Kolejnym przykładem występowania izomerii jonowej jest substancja o składzie CrCl
3
*6H
2
. Izomerami w
tym przypadku są;
[Cr(H
2
O)
6
]Cl
3
, koloru fioletowego
[Cr(H
2
O)
5
Cl]Cl
2
*H
2
O, koloru zielonego
[Cr(H
2
O)
4
Cl
2
]Cl*2H
2
O, koloru zielonego
Izomeria wiązaniowa
Niektóre ligandy mogą łączyć się z atomem centralnym w więcej niż jeden sposób i często można
wyodrębnić izomeryczne kompleksy różniące się kolejnością powiązania atomów. Przykładem takiego
ligandu jest SCN
-
, w którym atomem donorowym może być S lub N oraz sulfotlenek R
2
S=O; w tym
przypadku donorem może być s lub O. Ligand zdolny do wiązania się w dwojaki sposób można nazywać
ligandem ambichelatowym.
Izomeria koordynacyjna
w związkach zawierających kompleksowy kation i kompleksowy anion rozmieszczenie ligandów może
być różne, występują więc izomery. Przykładem są;
[Co(NH
3
)
6
][Cr(CN)
6
] i [Cr(NH
3
)
6
][Co(CN)
6
]
[Cr(NH
3
)
6
][Cr(SCN)
6
] i [Cr(NH
3
)
4
(SCN)
2
][Cr(NH
3
)
2
(SCN)
4
]
Wyszukiwarka
Podobne podstrony:
pytania-chemia, POLITECHNIKA ŁÓDZKA, Technologia żywności i żywienia człowieka, Sem I i II, Chemia o
Chemia ogólna, nieorganiczna i analityczna
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
tlenowce ci ga, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
Węglowce (2), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
wodór, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
aaa. opracowania 24-48, Analityka Medyczna 2014-19 Uniwersytet Medyczny Wrocław, Chemia ogólna i nie
Węglowce (1), 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
tlenowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
Zakres materiału obowiązujący na II kolokwium wykładowe, Chemia ogólna i nieorganiczna, giełdy
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
28, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Egzamin chemia
Chemia ogolna i nieorg 13 2010
Opracowanie - chemia ogólna i nieorganiczna, Nanotechnologia, sem I, chemia
więcej podobnych podstron