
Acta Haematologica Polonica 2008, 39, Nr 3, str. 417–428
PRACA POGLĄDOWA – Review Article
KAROLINA CAŁKA, EWA BALCERCZAK, ALEKSANDRA SAŁAGACKA,
MAREK MIROWSKI
Białka oporności wielolekowej w szpiczaku mnogim
Multidrug resistant proteins in multiple myeloma
Uniwersytet Medyczny, Wydział Farmaceutyczny, Zakład Biochemii Farmaceutycznej, Pracow-
nia Biologii Molekularnej i Farmakogenomiki w Łodzi
Kierownik Zakładu: Prof. dr hab. n farm. Marek Mirowski
STRESZCZENIE
Oporność wielolekowa (ang. multidrug resistance, MDR) jest jedną z najważniejszych przyczyn
niepowodzeń chemioterapii przeciwnowotworowej. Podstawowym mechanizmem wywołującym
zjawisko oporności jest nadekspresja transporterów błonowych, z których większość należy do
nadrodziny transporterów ABC. Jest ona jedną z najliczniejszych klas białek, występujących za-
równo u organizmów pro- jak i eukariotycznych. Należą do niej m.in. P-gp, MRP1, BCRP, któ-
rych nadekspresja w komórkach nowotworowych może być czynnikiem związanym z niesku-
tecznością chemioterapii. Ze zjawiskiem oporności wielolekowej wiąże się również białko opor-
ności raka płuc (LRP), które jest białkiem transportowym, nie należącym do nadrodziny ABC.
W pracy została omówiona struktura, funkcja i znaczenie w lekooporności szpiczaka mnogiego
białek: Pgp, MRP1, BCRP oraz LRP.
SŁOWA KLUCZOWE: Szpiczak mnogi – Oporność wielolekowa – Transportery ABC – Glikopro-
teina P
SUMMARY
Multidrug resistance (MDR) is one of major causes of the anti-cancer treatment failure. The prin-
cipal mechanism causing MDR is high expression of membrane transporters, which in majority
belong to ATP-binding cassette transporter family (ABC). These transporters superfamily is one
of the largest classes of proteins found in pro- and eucariotic organisms. The ABC superfamily
includes among others P-gp, MRP1, BCRP, which are highly expressed in neoplastic cells, and
may be associated with anti-cancer treatment inefficacy. The lung resistance protein (LRP),
which is non-ABC protein transporter, is also connected with multidrug resistance. In this paper
we review available data on the Pgp, MRP1, BCRP and LRP structure, function and role in drug
resistance in multiple myeloma.
KEY WORDS: Multiple myelana – Multidrug resistance – ABC transporters – glycoprotein P
Szpiczak mnogi
Szpiczak mnogi (ang. multiple myeloma, MM) jest chorobą nowotworową, w któ-
rej komórki plazmatyczne w szpiku kostnym ulegają rozrostowi monoklonalnemu (1,
2). Schorzenie to jest drugim pod względem częstości występowania hematologicznym

K. CAŁKA i wsp.
418
nowotworem złośliwym. W całej Europie wskaźnik zapadalności na szpiczaka mno-
giego wynosi 5,72/100 tys., w tym w Polsce około 4/100 tys. mieszkańców. Nie znana
jest etiopatogeneza MM. Jedna z hipotez zakłada, że patologiczny rozrost plazmocy-
tów inicjowany może być przez zmiany genetyczne. Udowodniono, że karcynogeny
środowiskowe, np. długotrwała ekspozycja na pestycydy, mogą również odgrywać rolę
w etiologii tej choroby. Mimo postępu w terapii szpiczak mnogi pozostaje nadal cho-
robą nieuleczalną. Odsetek 5-letnich przeżyć chorych leczonych konwencjonalną che-
mioterapią wynosi 29% i nie zmienia się istotnie od 40 lat. Śmiertelność w przypadku
chorych na MM jest znaczna. W krajach Unii Europejskiej w 1999 r. na szpiczaka
mnogiego zmarło 15200 osób, co stanowi ok. 2% wszystkich zgonów spowodowanych
nowotworami, natomiast w Polsce w 2000 r. zmarło 875 chorych [3]. Najważniejsze
niekorzystne czynniki rokownicze wg Barlogiego to: wiek chorych >60 lat, stężenie
beta2 mikroglobuliny >3 mg/dL, stężenie albuminy <3,5 g/dL, liczba płytek krwi <13
000/mm
3
, aktywność LDH w surowicy >190U/L oraz postać IgA szpiczaka mnogiego.
Jak wykazano, złe rokowanie związane jest również z opornością na zastosowaną
chemioterapię (1). Główną rolę w terapii szpiczaka mnogiego odgrywa chemioterapia,
w tym u pacjentów młodszych (zwykle poniżej 65 r.ż.) po leczeniu indukującym sto-
suje się standardowo chemioterapię wysokodozowaną polączona z autologicznym
przeszczepieniem komórek macierzystych. Schematy chemioterapii w szpiczaku mno-
gim zwykle oparte są na różnych połączeniach glikokortykosteroidów, leków alkilują-
cych i pochodnych antybiotyków antracyklinowych, w których ostatnio coraz szerzej
stosuje się również leki immunomodulujące (talidomid, lenalidomid) oraz inhibitory
proteasomu (bortezomib). Do jednych z częściej stosowanych kombinacji wieloleko-
wych należy schemat VAD winkrystyna/doksorubicyna(adriamycyna)/deksametazon
(VAD). Schemat ten pozwala na uzyskanie remisji u wielu pacjentów, jednak obarczo-
ny jest znaczną toksycznością (1, 2).
Oporność wielolekowa
Oporność wielolekowa (ang. multidrug resistance, MDR) oznacza zmniejszoną
wrażliwość na szereg strukturalnie i funkcjonalnie odmiennych leków, po ekspozycji
komórek nowotworowych na jeden lek cytostatyczny. MDR jest jedną z najpoważniej-
szych przyczyn niepowodzeń zastosowanej chemioterapii. Podstawowym mechani-
zmem wywołującym zjawisko oporności jest nadekspresja transporterów błonowych,
czego efektem jest nadmierne usuwanie leku z wnętrza komórki. Do powstania opor-
ności wielolekowej może prowadzić także:
•
utrudnienie wewnątrzkomórkowego transportu leku
•
zmiana ilości receptorów oraz ich powinowactwa
•
indukcja lub inaktywacja enzymów
•
zakłócenia lub zablokowanie procesu apoptozy
•
zmiany zaburzające cykl komórkowy
•
zmiany w mechanizmach naprawczych DNA (4–8).
Białka oporności wielolekowej w szpiczaku mnogim
419
Transportery błonowe – nadrodzina białek ABC
Nadrodzina transporterów ABC jest
jedną z najliczniejszych klas białek, wy-
stępujących zarówno u organizmów pro-
jak i eukariotycznych. Dotąd do nadro-
dziny ABC zaklasyfikowano 49 białek,
które podzielono na 7 podrodzin (Tabela
1) (4, 9, 10). Białka te zawierają charak-
terystyczne elementy strukturalne tj. re-
gion przezbłonowy (ang. transmembrane
domain, TMD) – prawdopodobnie bez-
pośrednio zaangażowany w przenikanie
substratu przez błonę lipidową – oraz
domenę wiążącą ATP (ang. nucleotide
binding domain, NBD) – odpowiedzialną
za wiązanie i hydrolizę ATP. W skład
NBD wchodzi motyw Walkera A i B
oraz region podpisu, czyli motyw C, a
sekwencja tej domeny jest podstawą kla-
syfikacji białek ABC. Wśród nadrodziny
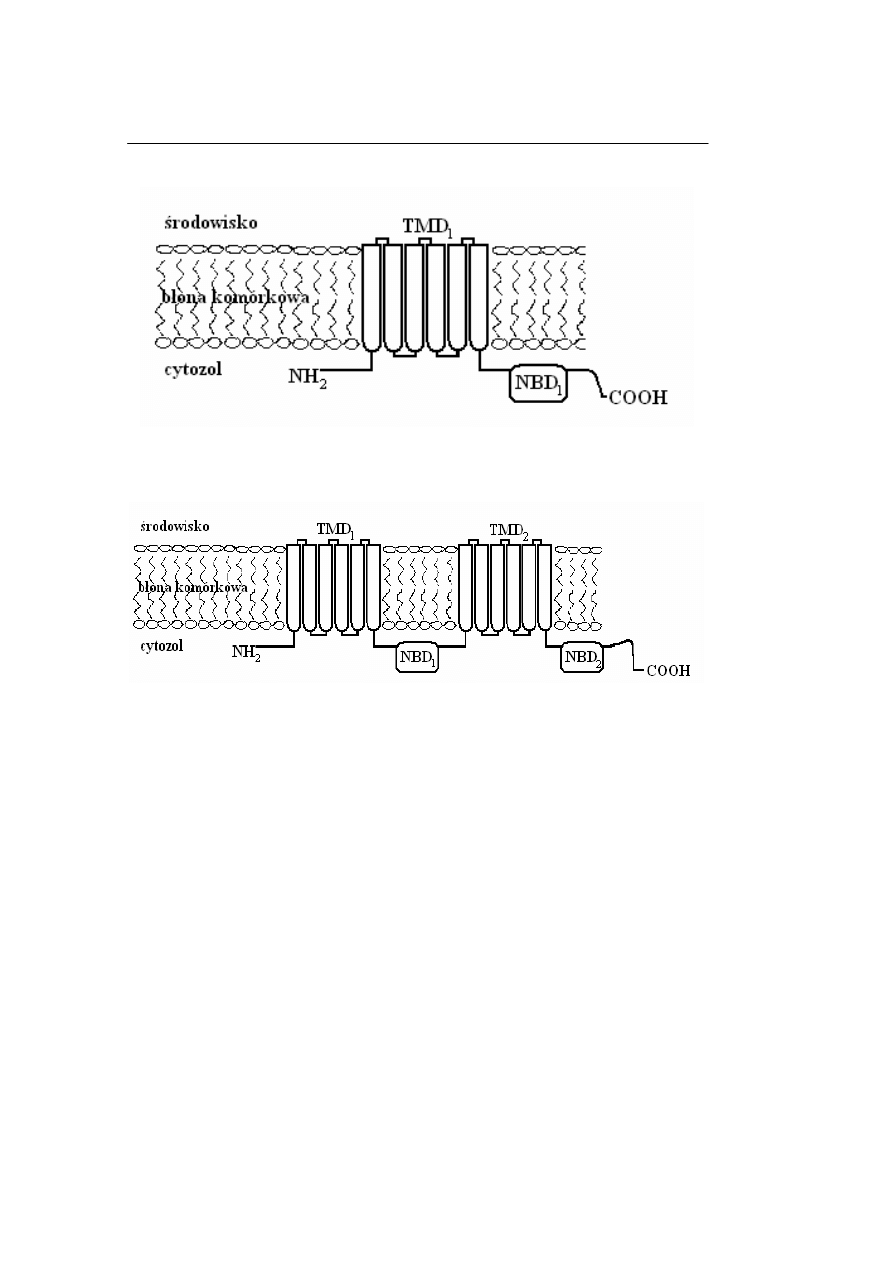
białek ABC opisano półtransportery
(hemitransportery) – zawierające jedną
domenę TMD i jedną domenę NBD (np.
białko BCRP, Rycina 1) – oraz pełne
transportery – składające się z dwóch
domen TMD i dwóch domen NBD (np.
glikoproteina P, Ryc. 2). Znane są także
transportery rozbudowane, które mogą
posiadać dodatkową domenę przez-
błonową (np. MRP1) (9–12).
Tabela 1. Charakterystyka nadrodzin białek trans-
portowych ABC
Table 1. Characteristics of ABC transporter pro-
teins superfamilies
Pod-
rodzina
Symbol
Nazwa genu /białka
ABCA
ABCA1
ABCA2
ABCA3
ABCA4
ABC1
ABC2
ABC3, ABCC
ABCR
ABCA5
ABCA6
ABCA7
ABCA8
ABCA9
ABCA10
ABCA11
ABCA12
ABCB
ABCB1
ABCB2
ABCB3
ABCB4
ABCB5
ABCB6
ABCB7
ABCB8
ABCB9
ABCB10
ABCB11
MDR1, PGP
TAP1
TAP2
PGP3, MDR3
MTABC3
ABC7
MABC1
MTABC2
SPGP, BSEP
ABCC
ABCC1
ABCC2
ABCC3
ABCC4
ABCC5
ABCC6
ABCC7
ABCC8
ABCC9
ABCC10
ABCC11
ABCC12
MRP1
MRP2, c MOAT
MRP3, c MOAT-2
MRP4, MOAT-B
MRP5, MOAT-C
MRP6
CFTR
SUR
SUR2
MRP7
MRP8
MRP9
ABCD
ABCD1
ABCD2
ABCD3
ABCD4
ALD
ALD1, ALDR
PMP70, PXMP1
PMP69, P70R
ABCE
ABCE1
OABP
ABCF
ABCF1
ABCF2
ABCF3
ABC50
ABCG
ABCG1
ABCG2
ABCG4
ABCG5
ABCG8
ABC8, Human white
ABCP, MXR, BCRP
White2
Sterolin1
Sterolin2
K. CAŁKA i wsp.
420
Ryc. 1. Struktura hemitransportera (półtransportera) z nadrodziny transporterów ABC
Fig. 1. Structure of a hemitransporter from ABC transporters superfamily
Ryc. 2. Struktura pełnego transportera z nadrodziny transporterów ABC
Fig. 2. Structure of a full transporter from ABC transporters superfamily
Transportery ABC pełnią funkcje związane z przenoszeniem różnych substancji
hydrofobowych przez błony zewnątrz i wewnątrzkomórkowe. U Prokaryota transpor-
tery ABC są w głównej mierze zaangażowane w pobieranie ze środowiska zewnętrz-
nego niezbędnych dla życia związków, które nie mogą być uzyskane poprzez dyfuzję
(np. węglowodanów, witamin, jonów metali). W komórkach Eukaryota większość
pomp ABC przemieszcza szereg ksenobiotyków z cytoplazmy poza komórkę lub do
wewnątrzkomórkowych kompartmentów. Do tego typu transporterów należą m.in.
P-gp oraz MRP. Część transporterów ABC funkcjonuje jako kanały jonowe lub regu-
latory kanałów np.: białko mukowiscydozy (CFTR), nabłonkowy regulator przenikania
chlorków (EBCR). Natomiast funkcje niektórych transporterów ABC nadal oczekują
na wyjaśnienie (9, 11).
Białka oporności wielolekowej w szpiczaku mnogim
421
Glikoproteina P – struktura, lokalizacja oraz mechanizm działania
Glikoproteina P (P-gp, ABCB1) jest pierwszym zidentyfikowanym i scharaktery-
zowanym transporterem ABC u człowieka. Należy do podrodziny B nadrodziny trans-
porterów ABC. Jest ATP-zależną pompą błonową o masie 170 000 daltonów (170 kD),
zbudowaną z 1280 aminokwasów, kodowaną przez gen MDR1 (4, 10). W swej struktu-
rze posiada dwie domeny transbłonowe (TMD), z których każda składa się z sześciu
segmentów, oraz dwie domeny wiążące ATP (NBD), ulokowane w pętlach znajdują-
cych się po cytoplazmatycznej stronie błony. W NBD występują także specyficzne dla
nadrodziny ABC sekwencje: „region podpisu”, motyw Walkera A i motyw Walkera B.
Natomiast w obrębie TMD zlokalizowane są co najmniej dwa miejsca odpowiedzialne
za wiązanie przenoszonych substancji (9–12).
W komórce P-gp występuje w błonach plazmatycznych komórek, rzadziej w bło-
nach struktur wewnątrzkomórkowych. P-gp opisano po raz pierwszy w 1976 roku
w komórkach nowotworowych (13). Później stwierdzono, że występuje ona także
w komórkach prawidłowych. Wysokie stężenie P-gp stwierdzono na powierzchni ko-
mórek pełniących funkcje wydzielnicze (m.in. kanalików żółciowych, nabłonka prok-
symalnych cewek nerkowych, jelita cienkiego i okrężnicy). Niższą jej zawartość wy-
kazują komórki śródbłonka naczyń włosowatych mózgu, jąder, jajników, nabłonka
pęcherza moczowego oraz komórki układu limfatycznego. Uważa się, że P-gp bierze
udział w sekrecji i eliminacji z ustroju metabolitów, toksyn i leków. Wskazuje na to
wysoki poziom ekspresji P-gp w komórkach gruczołów wydzielania wewnętrznego.
Tabela 2. Substraty glikoproteiny P
Table 2. Glycoprotein P substrates
Grupy leków
Nazwa leku
Leki stosowane w chorobie
nowotworowej
•
Antybiotyki cytostatyczne
•
Alkaloidy różanecznika
•
Taksoidy
miotomycyna C, doksorubicyna, daunorubicyna, mitamincyna,
idarubicyna
winblastyna, winkrystyna
paklitaksel
Leki immunosupresyjne
•
Glikokortykosteroidy
•
Peptydy
kortyzol, deksametazon, kortykosteron, hydrokortyzon
cyklosporyna
Leki stosowane w chorobach
inwazyjnych i zakażeniach
•
Alkaloidy wymiotnicy
•
Inhibitory proteazy
emetyna
vitonawir, indinawir, nelfinawir
Leki nasercowe
•
Glikozydy nasercowe
•
Alkaloidy (działające
p/arytmicznie)
digoksyna, digitoksyna, metylodigoksyna, acetylodigoksyna,
chinidyna
Leki p/histaminowe
•
Leki blokujące receptory H1
terfenadyna

K. CAŁKA i wsp.
422
Natomiast przez udział w tworzeniu barier przepuszczalności krew-mózg, krew-mocz
oraz obecność w łożysku odgrywa istotna rolę ochronną, utrudniając przechodzenie z
krwi do tkanek ww. substancji. P-gp prawdopodobnie odgrywa również istotną rolę w
regulacji odpowiedzi immunologicznej. Sugeruje się, że P-gp obecna w limfocytach
CD8+ i komórkach NK może mieć znaczenie dla ich aktywności cytotoksycznej. Wy-
kazano, że P-gp w limfocytach T pośredniczy w przezbłonowym transporcie cytokin
(m.in. IL-2, IL-4, IFN-γ) (4, 9–11). Glikoproteina P posiada szerokie spektrum substra-
towe, ukierunkowane na substancje hydrofobowe i wnikające do komórki na drodze
biernej dyfuzji. Do substratów P-gp należą leki stosowane w leczeniu wielu chorób, w
tym leki przeciwnowotworowe (Tabela 2).
Sposób przemieszczania substratów przez P-gp nie został dotychczas w pełni wyja-
śniony. Udowodniono, że zjawisko to wymaga współdziałania obu TMD oraz równo-
czesnej hydrolizy ATP. Miejsce, do którego wiąże się ATP, znajduje się na domenach
NBD. Istnieje kilka hipotez dotyczących działania P-gp: model tzw. „odkurzacza mo-
lekularnego”, flipaza, klasyczna pompa jonowa, poprzez aktywację kanału chlorkowe-
go i podwyższenie pH. Wśród nich najbardziej prawdopodobny wydaję się model „od-
kurzacza molekularnego”, który zaklada, że P-gp usuwa poza obręb komórki cząstecz-
ki substratów znajdujące się pomiędzy warstwami lipidowymi wewnętrzną i ze-
wnętrzną. Energia potrzebna do tego procesu pochodzi z hydrolizy dwóch czasteczek
ATP (9–12).
Głównym mechanizmem lekooporności, za który odpowiada P-gp, jest aktywny
transport leków przeciwnowotworowych na zewnątrz komórek zmienionych nowotwo-
rowo, który uniemożliwia osiągnięcie stężenia terapeutycznego leku.
Istnieją także dowody na antyapoptotyczne działanie P-gp, co dodatkowo przyczy-
nia się do oporności na leczenie komórek z nadekspresja P-gp. Glikoproteina ta chroni
komórki przed apoptozą poprzez zmniejszenie ilości sfingomieliny, a co za tym idzie
spadek produkcji ceramidów. Ceramidy, które powstają ze sfingomieliny po indukcji
komórek m.in. chemioterapeutykami (np. daunorubicyną, ligandami receptora Fas),
odpowiadają za aktywacje apoptozy. Potwierdza to fakt, że komórki z ekspresją P-gp
wykazują oporność krzyżową na ligandy receptora Fas, nie będące substratami dla P-
gp (14, 15).
P-gp a oporność wielolekowa
Nadekspresja P-gp w komórkach nowotworowych jest przyczyną nieskuteczności
chemioterapii. Oporność wielolekową, za którą odpowiada P-gp, podzielić można na
pierwotną i wtórną. Za pierwotnie oporne uważa się nowotwory wywodzące się z tka-
nek o fizjologicznie wysokiej ekspresji P-gp (m.in. wątroby, nerek, trzustki, jelit,
i kory nadnerczy). Wtórną opornością charakteryzują się natomiast nowotwory wywo-
dzące się z tkanek, posiadających niskie stężenia P-gp, a w których podczas chemiote-
rapii obserwuje się stymulację ekspresji tej glikoproteiny, utrzymującą się również po
jej zakończeniu. Wytworzenie wtórnej lekooporności może wynikać ze zjawiska klo-
nalnej selekcji – ekspozycja na transportowany przez P-gp lek przeciwnowotworowy

Białka oporności wielolekowej w szpiczaku mnogim
423
prowadzi do selekcji komórek o wyższej ekspresji P-gp kosztem bardziej wrażliwych
subpopulacji (8).
Istnieją także inne mechanizmy odpowiedzialne za wzrost stężenia P-gp w komór-
kach nowotworowych. Na poziomie molekularnym za wzrost stężenia P-gp odpowiada
zwiększona ekspresja genu MDR1, kodującego P-gp. Za wzrost ekspresji genu MDR1
odpowiada m.in. translokacja czynnika transkrypcyjnego YB-1 (Y-box-1) do jądra
komórkowego, rearanżacja promotora MDR1 oraz hipometylacja miejsc CpG w obrę-
bie promotora MDR1 (16–19). Szczególne zainteresowanie budzi czynnościowy poli-
morfizm genu MDR1. Dotychczas zidentyfikowano ponad 50 mutacji punktowych
(ang. single nucleotide polymorphism, SNP) genu MDR1. Pierwszą opisaną przez
Mickley i wsp. (20) SNP genu MDR1 był polimorfizm G2677A/T, który prowadzi do
zmiany sekwencji aminokwasowej z alaniny na serynę lub treoninę. W 2000 roku
Hoffmeyer i wsp. (21) opisali „cichy” polimorfizm w eksonie 26 w pozycji 3435, za-
obserwowali oni także czynnościowy efekt substytucji cytozyny na tyminę w miejscu
polimorficznym. W badaniu immunohistochemicznym stwierdzono, że osoby z geno-
typem 3435CC miały dwukrotnie wyższą ekspresję P-gp w nabłonku dwunastnicy w
porównaniu z alternatywnymi homozygotami 3435TT. Ponadto, biodostępność digok-
syny, substratu P-gp, była niższa u homozygot 3435CC, co wskazuje na wyższą ak-
tywność transportową P-gp skojarzoną z tym genotypem. U heterozygot 3435CT wy-
stępowały pośrednie w stosunku do obu homozygot wartości ekspresji i aktywności P-
gp (21). Wpływ „cichego” polimorfizmu C3435T na aktywność P-gp może być tłuma-
czona istnieniem niezrównoważonego sprzężenia między tym polimorfizmem z innym
„cichym” polimorfizmem C1236T oraz polimorfizmem zmiany sensu G2677T/A. Pra-
dopodobnie te trzy polimorfizmy są współdziedziczone w ramach jednego haplotypu.
Zmutowany w pozycji 3435 gen MDR1 może także odpowiadać za zmienioną ekspre-
sję P-gp poprzez wpływ na stabilność mRNA. Kimchi-Sarfaty i wsp. postulują, że
cichy polimorfizm 3435 chociaż nie powoduje zmiany aminokwasowej w kodowanym
białku, to skutkuje zmianą kodonów, co może wpływać na proces składania mRNA
i folding białka, a przez to na aktywności P-gp (22).
Istotną rolę w procesie regulacji ekspresji genu MDR1 odgrywa gen P53. Jego
forma niezmutowana odpowiedzialna jest za supresję nowotworu i hamowanie ekspre-
sji MDR1. Mutacje genu P53 powodują natomiast indukuję ekspresji MDR1, co pro-
wadzi do wzrostu lekooporności komórek (23, 24). Hamowanie ekspresji genu MDR1
przez niezmutowany gen P53, może odbywać się nie tylko na poziomie transkrypcji.
Zhan i wsp. donoszą, że niezmutowany gen P53, hamuję ekspresję kinazy proteinowej
C, która odpowiada za fosforylację P-gp (potrzebna do jej aktywności), przez co obni-
ża aktywność P-gp (25).
Szpiczak mnogi jest przykładem nowotworu charakteryzującego się wtórną leko-
opornością. Nie odnotowano nadekspresji P-gp w komórkach szpiczaka mnogiego nie
eksponowanych na chemioterapię. Jednak ekspresja P-gp wzrasta u pacjentów podda-
nych leczeniu winkrystyną, doksorubicyną i deksametazomem. Marie i wsp. stwier-
dzili, że przed rozpoczęciem leczenia u 6% chorych wystapiła ekspresja P-gp, nato-
miast po zastosowaniu chemioterapii schematem VAD aż 85% chorych opornych na

K. CAŁKA i wsp.
424
leczenie ujawniło ekspresję P-gp (26). Prawdopodobieństwo ekspresji P-gp koreluje ze
skumulowaną dawką doksorubicyny i winkrystyny jaką otrzymują pacjenci. Grogan
i wsp. wykazali, że podawanie chorym na szpiczaka mnogiego, kombinacji wysokich
dawek winkrystyny (20 mg) i doksorubicyny (340 mg) spowodowało wzrost ekspresji
P-gp. Potwierdzili również, że zastosowanie chemouczulaczy P-gp (werapamil, cyklo-
sporyna) wraz z terapią VAD powoduje lepszą odpowiedź na leczenie chorych na szpi-
czaka mnogiego (27). W przeciwieństwie do leków wchodzących w skład schematu
VAD melfalan, lek stosowany także w leczeniu MM, nie jest substratem P-gp. U pa-
cjentów leczonych melfalanem nie zaobserwowano wzrostu ekspresji P-gp (28).
Jedynie nieliczne prace opisują polimorfizmy genu MDR1 w szpiczaku mnogim.
Istnieją doniesienia o roli haplotypów tego genu w genetycznych predyspozycjach
zachorowań na szpiczaka mnogiego. U pacjentów z rozpoznanym MM częściej wystę-
puje haplotyp zawierające allele zmutowane 1236T – 2677T – 3435T, natomiast
u osób zdrowych częściej stwierdzano haplotyp 1236C – 2677T/A – 3435T (29). Buda
i wsp. zaobserwowali wpływ polimorfizmu C3435T na przeżycie pacjentów ze szpi-
czakiem mnogim: chorzy z co najmniej jednym allelem T mieli dłuższy całkowity czas
przeżycia w porównaniu z chorymi posiadającymi genotyp CC (30).
Inne białka z nadrodziny ABC
Poza glikoproteiną P ze zjawiskiem oporności wielolekowej wiązane są również
inne białka należące do nadrodziny ABC, jak np. białko oporności wielolekowej
MRP1 (ABCC1) czy białko oporności raka piersi BCRP (ABCG2).
MRP1 należy do podrodziny MRP, drugiej co do liczności podrodziny w obrębie
transporterów ABC u człowieka. MRP1 jest białkiem o masie 190 kDa zbudowany
z 1531 aminokwasów o charakterystycznej asymetrycznej budowie, wynikającej
z obecności dodatkowej domeny przezbłonowej. MRP1 transportuje szeroką gamę
substratów, głównie związki organiczne, chemicznie obojętne i obdarzone ładunkiem
ujemnym, w tym substancje sprzężone z glutationem, glukuronianem lub siarczanem.
Białko to jest przyczyną oporność na metotreksat oraz arsenin. MRP1 występuje
w błonach plazmatycznych i w błonach struktur wewnątrzkomórkowych komórek
budujących wiele narządów (mięśnie, płuca, śledziona, pęcherz moczowy, pęcherzyk
żółciowy, kora nadnerczy). Fizjologiczną funkcją tego białka jest transport leukotrie-
nów. Komórki oporne wielolekowo charakteryzują się często nadekspresją MRP1
(4, 10).
BCRP należy do podrodziny G transporterów ABC. Jest półtransporterem o masie
72,6 kDa. Do leków będących substratami BCRP należą: mitoksantron, doksorubicyna,
daunorubicyna, etopozyd, epirubicyna, metotreksat. BCRP występuje w wielu prawi-
dłowych tkankach (w komórkach łożyska, mózgu, kanalików żółciowych, jelit), gdzie
pełni ważną funkcję ochrony organizmu przed działaniem toksycznych substancji.
Nadekspresja BCRP wiąże się ze słabą skutecznością chemioterapii różnych nowotwo-
rów m.in.: ostrych białaczek mielo- i limfoblastycznych oraz nowotworów litych –
raka płuc i piersi (4, 10).

Białka oporności wielolekowej w szpiczaku mnogim
425
Białka nie należące do nadrodziny ABC
Ze zjawiskiem oporności wielolekowej wiąże się również białko oporności raka
płuc (LRP), które jest białkiem transportowym, ale nie należy do nadrodziny ABC.
LRP jest tzw. białkiem MVP (większym białkiem krypt), o masie 110 kDa, zlokalizo-
wanym w obrębie błony jądrowej, gdzie przypuszczalnie pełni rolę usuwania cytosta-
tyków z jadra do cytozolu. Ekspresja LRP zachodzi w wielu zdrowych tkankach, m.in.
nabłonku oskrzeli, przewodu pokarmowego, bliższych odcinkach kanalików nerko-
wych, keratynocytach, korze nadnerczy. Ekspresję LRP wykazano też w różnych ty-
pach nowotworów, co powodowało ich słabą odpowiedź na zastosowaną chemiotera-
pię. Białko to powoduje oporność na takie cytostatyki jak: melfelan, cisplatyna, karbo-
platyna, winkrystyna, doksorubicyna, daunorubicyna, prednizon (31, 32).
Znaczenie innych białek transportowych w budowaniu lekooporności
Mimo że najlepiej poznanym mechanizmem powstawania lekooporności w szpi-
czaku mnogim jest usuwanie leków z komórek przez P-gp, również inne białka trans-
portowe mogą być związane z tym zjawiskiem.
Białko MRP1, podobnie jak P-gp, jest transporterem antracyklin i alkaloidów Vin-
ca, które są wykorzystywane w leczeniu szpiczaka mnogiego, mimo to rola MRP1 jako
czynnika warunkującego lekooporność szpiczaka mnogiego jest ciągle dyskutowana.
Brak jest danych opisujących pomiar czynności MRP. Takie badania wydają się istotne
w kontekście oceny wpływu MRP1 na powstawanie lekooporności komórek. Z drugiej
strony dostępne są dane na temat badań ekspresji tego białka u chorych na szpiczaka
mnogiego. Nie wykazały one jednak nadekspresji MRP1 (28), a nawet jej obniżenie
(33). Mohammad i wsp. porównali poziom ekspresji MRP1 w komórkach pobranych
ze szpiku kostnego chorych na szpiczaka mnogiego z poziomem ekspresji tego białka
w zdrowych komórkach krwi – w obu przypadkach był on taki sam (34). Natomiast
często obserwuje się koekspresje MRP i P-gp, co może potęgować oporność na lecze-
nie szpiczaka mnogiego. Schwarzenbach
i wsp. badając ekspresję P-gp, MRP1 i LRP u
chorych na szpiczaka mnogiego stwierdzili, że na 96 zbadanych przypadków w 46%
obecna była ekspresja P-gp (odnotowano wzrost ekspresji P-gp w komórkach po le-
czeniu doksorubicyną i/lub winkrystyną), na 88 zbadanych przypadków w 20,5% od-
notowano ekspresję MRP1, a na 72 przypadki ekspresję LRP stwierdzono u 12,5%.
Ekspresja białka MRP nie zmieniła się zarówno przed, jak i po chemioterapii (35).
LRP może odpowiadać za wytworzenie się oporności szpiczaka mnogiego na le-
czenie melfalanem, substratem dla tego transportera. Filipits i wsp. (32) porównali
ekspresje LRP w komórkach plazmatycznych szpiku kostnego z parametrami klinicz-
nymi oraz odpowiedzią na leczenie i przeżyciem wcześniej nie leczonych chorych na
szpiczaka mnogiego. Ekspresję LRP stwierdzono w 61% przebadanych przypadków.
Ekspresja tego białka była częstsza u chorych ze stwierdzoną delecją p53. Nie stwier-
dzono korelacji pomiędzy ekspresją LRP a parametrami klinicznymi, m.in. płcią, wie-
kiem, poziomami β-2-mikroglobuliny, LDH, białka C-reaktywnego. 87% chorych bez

K. CAŁKA i wsp.
426
ekspresji LRP i tylko 54% z ekspresją tego białka odpowiedziało na leczenie. Chorzy
z ekspresja LRP charakteryzowali się również krótszym całkowitym czasem przeżycia.
Badania te mogą wskazywać, że ekspresja LRP prawdopodobnie odpowiada za leko-
oporność szpiczaka mnogiego i może stać się niekorzystnym czynnikiem prognostycz-
nym w tej chorobie (32). Podobne wyniki badań przedstawili Raajmakers i wsp., (36)
którzy stwierdzili wysoką ekspresję LRP (47%) w próbach szpiku kostnego pobranych
od chorych na szpiczaka mnogiego. Nie wykazali korelacji pomiędzy ekspresją LRP
a klinicznymi parametrami: wiekiem, poziomem β-2-mikroglobuliny. Także chorzy
leczeni schematem MP, u których stwierdzono ekspresję LRP, byli oporni na leczenie
i mieli krótszy czas przeżycia. Ponadto stwierdzono, że zintensyfikowanie dawki mel-
falanu pomaga znieść oporność na ten wynikającą z obecności ekspresji LRP (36).
Istnieją nieliczne prace opisujące znaczenie ekspresji BCRP w lekooporności szpi-
czaka mnogiego. Badania opublikowane przez Turnera i wsp. potwierdzają ekspresję
BCRP w plazmatycznych komórkach izolowanych ze szpiku kostnego chorych na
szpiczaka mnogiego, a także, że ekspresja ta wzrasta po leczeniu topotekanem i dokso-
rubicyną. Badacze ci sugerują, że ekspresja BCRP może mieć znaczenie w lekoopor-
ności szpiczaka mnogiego, jednak potrzebne są dalsze badania, by potwierdzić tę tezę
(37).
PODSUMOWANIE
Nadekspresja P-gp w komórkach nowotworowych jest przyczyną nieskuteczności
terapii chorych na szpiczaka mnogiego leczonych schematem VAD. Zjawisko oporno-
ści na leczenie szpiczaka mnogiego może być związane z podwyższoną ekspresją także
innych transporterów białkowych należących do nadrodziny ABC (MRP1, BCRP), jak
również nie należącego do tej nadrodziny białka LRP. Poszukiwanie związku miedzy
ekspresją omawianych transporterów białkowych a metabolizmem leków może mieć
znaczenie przy wyborze skutecznej terapii szpiczaka mnogiego.
Praca przygotowana w ramach projektów badawczych Ministerstwa Nauki
i Szkolnictwa Wyższego (N405340533 i 2P05B14528) oraz funduszy statutowych
UM w Łodzi 503-3015-2
PIŚMIENNICTWO
1. Skotnicki A B, Wolska-Smoleń T, Juszczyn A. Szpiczak mnogi - nowe perspektywy terapeutyczne.
Przegląd lekarski 1999; 56: 67-72.
2. Durie B.G.M. Concise Review of the Disease and Treatment Options, International Myeloma
Foundation, 2003 Polish Edition (tłum. Jurczyszyn A.)
[http://www.myeloma.org/pdfs/Polish_CR2003.pdf].
3. Krzemieniecki K. Bortezomib – w świetle Nagrody Nobla 2004. Nowe perspektywy leczenia szpi-
czaka mnogiego. Współ. Onkol. 2005; 9: 54–60.
4. Jakoniuk D. Rola transportu błonowego w zjawisku oporności wielolekowej. Post. Biol. Kom.
2004; 31: 703-715.

Białka oporności wielolekowej w szpiczaku mnogim
427
5. Szenajch J., Cieślak A. Molekularne mechanizmy chemooporności w raku nerki. Współ. Onkol.
2005; 9: 123-128.
6. Liscovitch M, Lavie Y. Cancer multidrug resistance: A review of recent drug discovery research.
I
Drugs 2002; 5: 1369-7056.
7. Sonneveld P. Multidrug resistance in haematological malignancies. J. Int. Med. 2000; 247: 521-
534.
8. Lenart K, Szyda A, Kiełbasiński M, Duś D, Podolak-Dawidziak M. Kliniczne skutki oporności
wielolekowej w nowotworach. Onkologia w Praktyce Klinicznej 2005; 1: 18–26.
9. Bartosz G. Transportery ABC w komórkach człowieka. Post. Biochem. 1998; 44: 136-150.
10. Jamroziak K, Młynarski W, Robak T. Znaczenie białek transportowych nadrodziny ABC w opor-
ności na leczenie ostrej białaczki szpikowej. Acta Haematol. Pol. 2001; 32: 131-141.
11. Panczyk M, Sałagacka A, Mirowski M. Gen MDR1(ABCB1) kodujący glikoproteinę P (P-gp) z
rodziny transporterów błonowych ABC: znaczenie dla terapii i rozwoju nowotworu. Post. Biochem. 2007;
53: 361-373.
12. Michalak K, Hendrich AB. Rola lipidów błony komórkowej w zjawisku oporności wielolekowej i
jego modulacji. Post. Biochem. 2002; 48: 208-218.
13. Juliano RL, Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster
ovary cell mutants. Biochim Biophys Acta 1976; 455: 152-162.
14. Liu YY, Han TY, Giuliano AE, Cabot MC. Ceramide glycosylation potentiates cellular multidrug
resistance. FASEB J. 2001; 15: 719-730.
15. Watts GS, Futscher BW, Isett R, Gleason-Guzman M, Kunkel MW, Salmon SE. cDNA microar-
ray analysis of multidrug resistance: doxorubicin selection produces multiple defects in apoptosis signal-
ing pathways. J Pharmacol Exp Ther. 2001; 299: 434-41.
16. van den Heuvel-Eibrink MM, Wiemer EA, de Boevere MJ, et al. MDR1 gene-related clonal selec-
tion and P-glycoprotein function and expression in relapsed or refractory acute myeloid leukemia. Blood
2001; 97: 3605-3611.
17. Nakayama M, Wada M, Harada T, et al. Hypomethylation status of CpG sites at the promoter re-
gion and overexpression of the human MDR1 gene in acute myeloid leukemias. Blood 1998; 92: 4296-
4307.
18. Geick A, Eichelbaum M, Burk O. Nuclear receptor response elements mediate induction of intes-
tinal MDR1 by rifampin. J Biol Chem 2001; 276: 14581-14587.
19. Mahadevan D, List AF. Targeting the multidrug resistance-1 transporter in AML: molecular regu-
lation and therapeutic strategies. Blood 2004; 104: 1940-1951.
20. Mickley LA, Lee JS, Weng Z, et al. Genetic polymorfizm in MDR1: a tool for examining allelic
expresion in normal cells, unselected and drug-selected cell lines, and human tumors. Blood 1998; 91:
1749-1756.
21. Hoffmeyer S, Burk O, von Richter O, et al. Functional polymorphisms of the human multidrug-
resistance gene:multiple sequence variations and correlation of one allele with P-glycoprotein expression
and activity in vivo. Proc Natl Acad Sci 2000; 97: 3473-3478.
22. Kimchi-Sarfaty C, Oh JM, Kim IW, et al. A “silent” polymorphism in the MDR1 gene changes
substrate specificity. Science 2007; 315: 525-528.
23. Bush JA, Gang Li Cancer Chemoresistance: the relationship between P53 and multi drug trans-
porters. Int J Cancer 2002; 98: 323–330.
24. Johnson RA, Shepard EM, Scotto K. W Differential Regulation of MDR1 transcription by the p53
Family Members. J Biol Chem. 2005; 280: 13213–13219.
25. Zhan M, Yu D, Liu J, Hannay J, Pollock RE. Transcriptional repression of protein kinase C alfa
via Sp1 by wild type p53 is involved in inhibition of multidrug resistance 1 P-glycoprotein phosphoryla-
tion. J Biol Chem. 2005; 280: 4825–4833.
26. Marie JP, Zhou DC, Gurbuxani S, Legrand O, Zittoun R. MDR1/P-glycoprotein in haematologi-
cal neoplasms. Eur J Cancer 1996; 32:1034-8.

K. CAŁKA i wsp.
428
27. Grogan TM, Spier CM, Salmon SE, et al. P-Glycoprotein expression in human plasma cell mye-
loma: correlation with prior chemotherapy. Blood 1993; 81: 490-495.
28. Yang HH, Ma MH, Vescio RA, James R. Overcoming drug resistance in multiple myeloma: The
emergence of therapeutic approaches to induce apoptosis. J. Clin. Oncol. 2003; 21: 4239-4247.
29. Jamroziak K, Balcerczak E, Całka K. ABCB1 (MDR1) gene haplotypes and susceptibility to mul-
tiple myeloma. 10th European Hematology Congress 2005.
30. Buda G, Maggini V, Galimberti S, et al. MDR1 polymorphism influences the outcome of multiple
myeloma patients. British Journal of Haematology 2007; 137: 454–456.
31. Jamroziak K, Balcerczak E, Robak T. Znaczenie białka związanego z opornością w płucach
(LRP) w nowotworach układu krwiotwórczego. Acta Haematol. Pol. 2002; 33: 41-51.
32. Filipits M, Drach J, Pohl G, et al. Expression of the Lung Resistance Protein Predicts Poor Out-
come in Patients with Multiple Myeloma. Clin. Cancer Res. 1999; 5: 2426–2430.
33. Nooter K, Burger H, Stoter G. Multidrug resistance-associated protein (MRP) in haematological
malignancies. Leuk. Lymph. 1996; 20: 381-387.
34. Mohammad R, Abbaszadegan MR, Futscher BW, Klimecki TW, List A, Dalton WS. Analysis of
multidrug resistance-associated protein (MRP) messenger RNA in normal and malignant hematopoietic
cells. Cancer Res. 1994; 54: 4676-4679.
35. Schwarzenbach H. Expression of MDR1/P-glycoprotein, the multidrug resistance protein MRP,
and the lung-resistance protein LRP in multiple myeloma. Med. Oncol. 2002; 19: 87-104.
36. Raaijmakers HGP, Izquierdo MAI, Lokhorst HM, et al. Lung-resistance–related protein expres-
sion is a negative predictive factor for response to conventional low but not to intensified dose alkylating
chemotherapy in multiple myeloma. Blood 1998; 91: 1029-1036.
37. Turner JG, Gump JL, Zhang C, et al. ABCG2 expression, function, and promoter methylation in
human multiple myeloma. Leuk. Res. 2005; 29: 1455-1458.
Praca wpłynęła do Redakcji 24.04.2008 r. i została zakwalifikowana do druku 12.08.2008 r.
Adres Autora:
Uniwersytet Medyczny, Wydział Farmaceutyczny, Zakład Biochemii Farmaceutycznej,
Pracownia Biologii Molekularnej i Farmakogenomiki
ul. Muszyńskiego 1
90-151 Łódź
tel/fax.: +48 42 677-91-26
e-mail: mmirowski@pharm.am.lodz.pl
Wyszukiwarka
Podobne podstrony:
Oporność wielolekowa i kliniczne znaczenie polimorfizmów
Oporność wielolekowa
Oporność wielolekowa drobnoustrojow
Oporność wielolekowa
Białka wiążące wapń
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
BM1 Białka
04) Kod genetyczny i białka (wykład 4)
Szpiczak mnogi
Wyklad 03 Białka3
BIOSYNTEZA BIAŁKA
Wykład 7 Wieloletni Plan Finansowy
2 Objawy kliniczne w szpiczaku plazmocytowym – patomechanizm objawów 2id 19582 ppt
Białka 08 06 05
Białka
Białka
więcej podobnych podstron