
Mgr Wioleta Zalewska
Diagnostyka laboratoryjna
I Wydział lekarski
IV rok
2010/2011

Białka osocza
Niejednorodna mieszanina wielu białek
funkcjonalnych o różnej budowie i
właściwościach,
Oznaczanie białka całkowitego – metody
kolorymetryczne
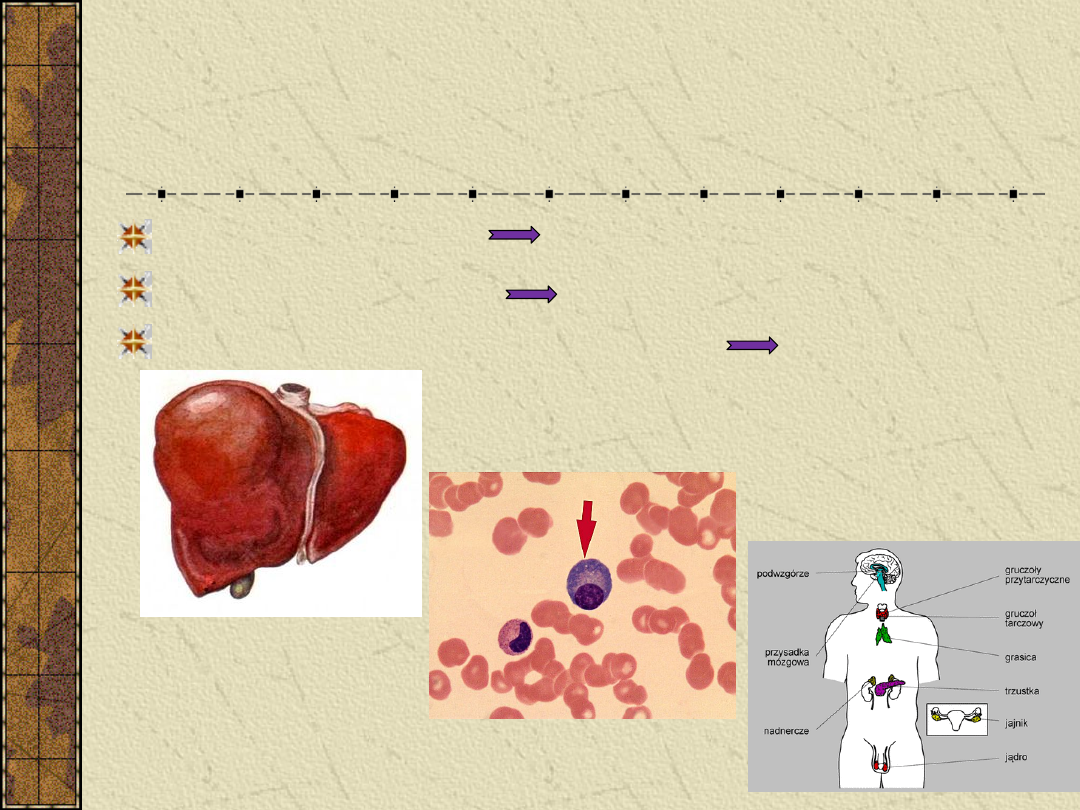
Synteza białek osocza
Wątroba – 75% białek albumina
Komórki plazmatyczne immunoglobuliny
Konkretne gruczoły dokrewne i tkanki
hormony i enzymy
www.doctormed.pl/.../300px-
Watroba_zdrowaUT.jpg
www.hematologica.pl/Atlas3/Polska/Interne
tInfo.htm
http://portalwiedzy.onet.pl/6443,1,,,gruczoly_dokrewn
e,haslo.html

Rola białek osocza
Kontrola dystrybucji płynów przestrzeni pozakomórkowej –
albumina – właściwe ciśnienie roztworów koloidowych,
Hemostaza i krzepnięcie krwi – czynniki krzepnięcia,
Funkcje transportowe: albumina (witaminy, bilirubina,
hormony, Ca2+, Mg2+, pierwiastki śladowe, kwasy
tłuszczowe, leki), haptoglobina (hemoglobina), transferyna
(Fe), transkobalamina (wit. B12),
Enzymy i regulatory enzymów,
Składniki układu buforowego – utrzymują stałe pH (białczany),
Białka układu odpornościowego,
Materiał odżywczy – albumina,
Hormony, receptory.

Całkowite stężenie białka w
surowicy
Białko całkowite
65–80 g/l
(6,5-8,0 g/dl)
Albumina
35-52 g/l
(3,5-5,2 g/dl)
Krytyczny poziom białka całkowitego –
45 g/l
,
albuminy <
20 g/l
Euproteinemia
–
zawartość białka całkowitego w
surowicy/osoczu w zakresie normy fizjologicznej, z
prawidłowymi proporcjami frakcji.
Hipoproteinemia
–
obniżenie ogólnej zawartości białek w
surowicy/osoczu < 65 g/l,
hipoalbuminemia.
Obniżenie stosunku stężeń albumina/globuliny (A/G): marskość wątroby
i zespół nerczycowy, przewlekłe stany zapalne, szpiczak mnogi.
Hiperproteinemia
–
zwiększenie ogólnej zawartości białek w
surowicy/osoczu > 80 g/l,
hiperglobulinemia.
Hipoproteinemia < 65 g/l
Nadmierna utrata białek:
•
zespoły nerkowe: kłębkowe zapalenie nerek, cukrzyca,
toczeń rumieniowaty trzewny, zakrzepica żył
nerkowych, skrobiawica
•
zespoły jelitowo-żałądkowe: stany zapalne, nowotwory
złośliwe, zwężenia, uchyłki
•
przez skórę: rozległe oparzenia, dermatozy
(pęcherzyca, łuszczyca)
•
przesięki i wysięki: obrzęki, zapalenia płuc
•
krwawienia, krwotoki
•
„stany ciężkie’: sepsa, urazy, choroba nowotworowa

Hipoproteinemia cd.
Zmniejszona synteza białek w wątrobie
•
uszkodzenie miąższu wątroby: toksyczne, marskość, zanik
miąższu, pierwotny lub wtórny nowotwór
•
zaburzenia wchłaniania: zespoły poresekcyjne, biegunki
bakteryjne i inne zakażenia, mukowiscydoza
•
niedobory białka w diecie: kwashiorkor, niedożywienie
Niedobory immunoglobulin
(proces nowotworowy w
obrębie szpiku, toksyczne uszkodzenie szpiku)
Zmiany objętości przestrzeni pozakomórkowej:
przewodnienia, spadek ciśnienia, stany zapalne, artefakty
Hiperproteinemia > 80 g/l
Hipergammaglobulinemie:
•
monoklonalne: szpiczak mnogi, makroglobulinemia Waldemströma,
choroba ciężkich łańcuchów, inne nowotwory układu chłonnego
•
poliklonalne: przewlekłe stany zapalne, autoimmunizacja (choroba
reumatyczna, toczeń rumieniowaty układowy i inne)
•
przewlekle choroby wątroby: marskość, wirusowe zapalenie,
sarkoidoza
Odwodnienia
•
dysproporcja między podażą a utratą wody (prawidłowy stosunek
A/G)
Artefakty
(błędy w pobieraniu krwi – zbyt długo trzymana staza)
Zwiększeniu stęż. immunoglobulin towarzyszy obniżenie względnego i
bezwzględnego stęż. albuminy, gdyż ciśnienie onkotyczne krwi jest
sygnałem dla wątroby do ich syntezy.
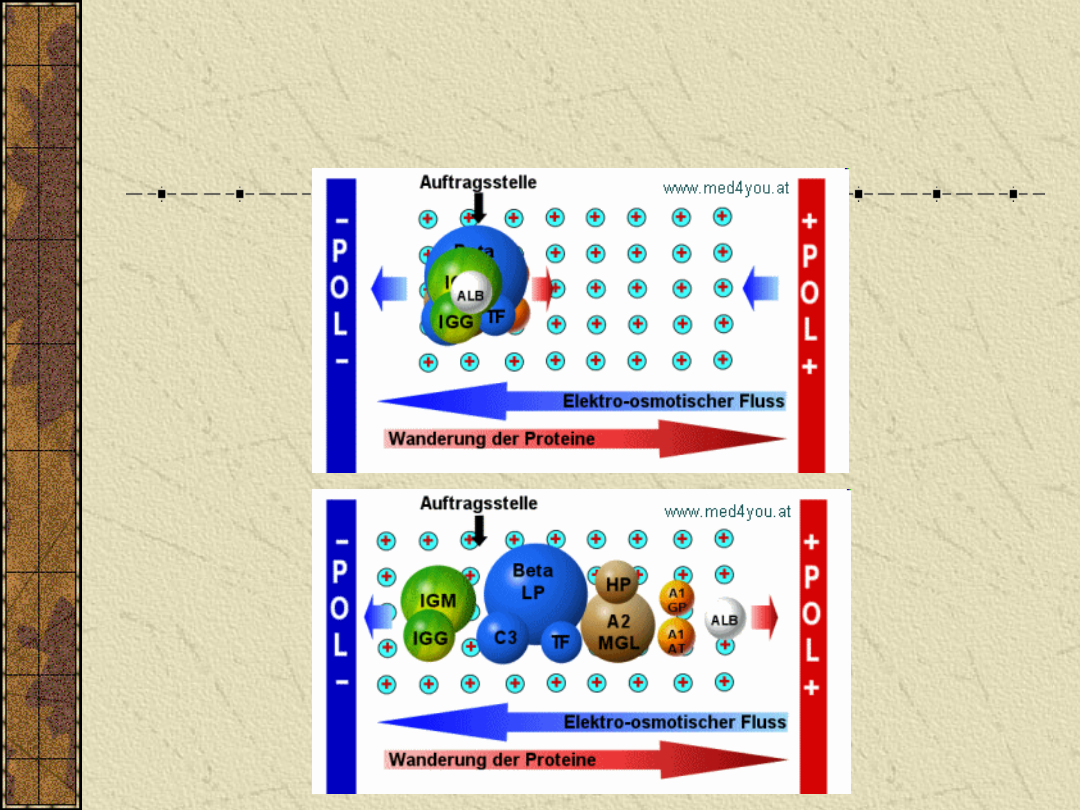
Elektroforeza białek surowicy krwi
Ruch cząsteczek białek, które są obdarzone ładunkiem
elektrycznym, na odpowiednich nośnikach (żel agarozowy)
znajdujących się w roztworach po przyłożeniu zewnętrznego pola
elektrycznego.
Szybkość wędrówki zależy od:
wielkości ładunku cząsteczki białka,
wielkości cząsteczki białka,
siły pola elektrycznego,
siły jonowej roztworu (buforu) i jego lepkości,
pH roztworu (buforu).
Białka naładowane dodatnio – kationy wędrują do elektrody ujemnej
– katody,
a białka naładowane ujemnie – aniony do elektrody dodatniej –
anody.
Podstawowa metoda wykrywania zaburzeń składu białkowego osocza –
elektroforeza białek surowicy.

Rozdział elektroforetyczny białek
przeprowadza się zwykle:
w buforach zasadowych o pH=8,6,
w tych warunkach większość białek jest anionami (-) i wędruje do anody (+), większe z
nich, takie jak immunoglobuliny (głównie klasy IgG) pozostają w miejscu nałożenia lub
wędruje do katody,
z użyciem agarozy jako nośnika, gdyż:
dobra jakość rozdziałów,
przezroczyste podłoże umożliwiające uwidocznienie nawet słabych prążków),
płytki do elektroforezy zawierają niskie stężenia agarozy (0,5 – 1%), tworzy to żel o
odpowiednio dużych porach umożliwiający migrację nawet dużych cząsteczek białkowych,
czas rozdziału wynosi zwykle 15 – 30 min.,
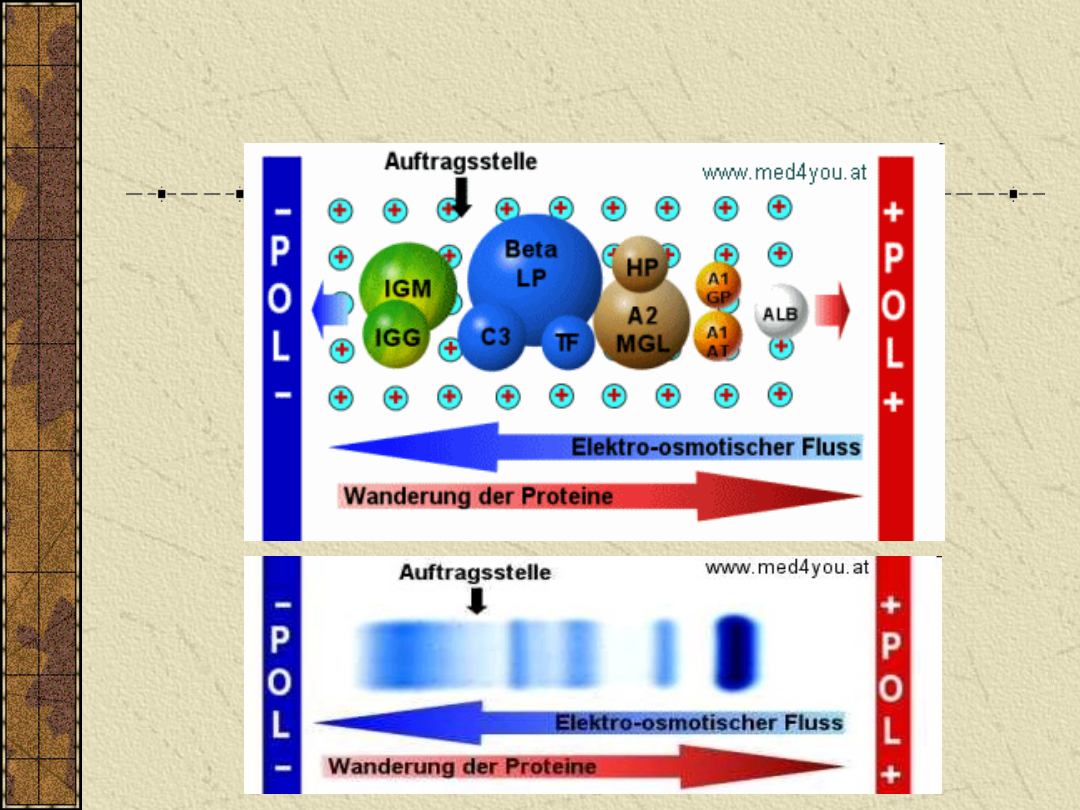
po rozdziale elektroforetycznym frakcje są wybarwiane za pomocą czerni amidowej,
czerwieni pąsowej lub błękitu Coomasie, powstaje charakterystyczny obraz prążków
(pasm),
każde pasmo odzwierciedla obecność konkretnego białka, a jego szerokość jest
przybliżonym wskaźnikiem jego ilości.
odczytu dokonuje się za pomocą densytometrii – umożliwia to:
wyliczenie procentowej zawartości poszczególnych frakcji lub
wartości poszczególnych frakcji białkowych są przedstawiane w postaci stężeń.,
prążki zostają zapisane w postaci wykresu, na którym są widoczne szczyty (piki),
proporcjonalne do ilości białka, następuje wyliczenie procentowej zawartości
poszczególnych frakcji
.
Zmiany występujące w obrazie densytometrycznym mogą być spowodowane tylko bardzo
istotnymi zmianami stężeń białek, np. uwidocznienie białka C-reaktywnego na pograniczu
frakcji beta i gamma uwarunkowane jest bardzo znacznym wzrostem jego stężenia w
surowicy.
Elektroforeza białek surowicy
krwi
katod
a
anoda
Elektroforeza białek surowicy krwi
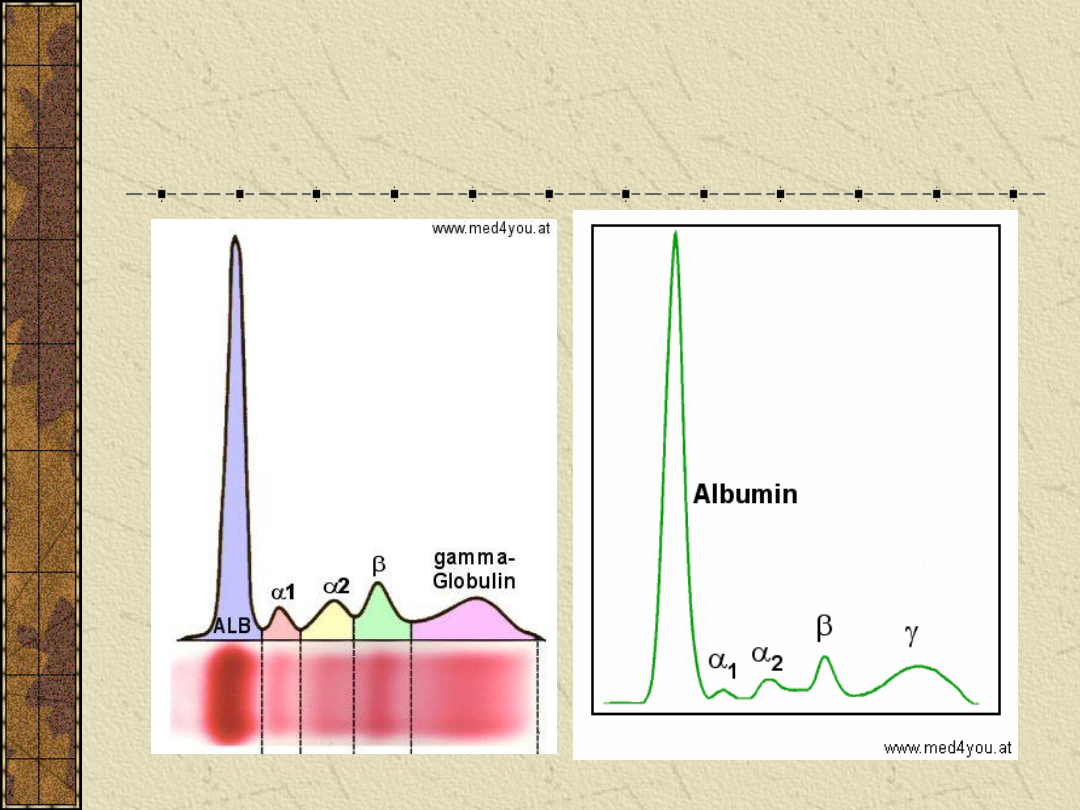
Wynik elektroforegramu

Przy pomocy elektroforezy, białka w
surowicy są rozdzielane na pięć lub sześć
głównych frakcji.
Frakcja
białkowa
%*
Charakterystyczne białka
albuminy
53-68 Albumina
α1-globuliny
1-4
α1-antytrypsyna (70%)
α1-kwaśna glikoproteina
(orozomukoid)
α-lipoproteiny (HDL)
białko wiążące tyroksynę
α2-globuliny
3-14
haptoglobina (30%)
α2-makroglobulina
ceruloplazmina
liczne enzymy
β-globuliny
8-17
transferyna
hemopeksyna
β-lipoproteiny (LDL)
białko układu dopełniacza
fibrynogen (tylko w osoczu)
śladowe ilości IgA, IgM
γ-globuliny
9-22
immunoglobuliny: IgA, IgG, IgM, (IgD i
IgE – identyfikacja metodami
immunochemicznymi)
CRP
*Wartości prawidłowe frakcji elektroforetycznych surowicy wg S.
Angielskiego.

Albumina
frakcja jednorodna,
Bisalbuminemia
– występowanie 2 rodzajów
albuminy (występuje rzadko i jest dziedziczna
autosomalnie recesywnie lub na skutek
modyfikacji albuminy w osoczu)
Analbuminemia
– brak fakcji albuminowej
(bardzo rzadko, objawy: niskie ciśnienie
tętnicze i umiarkowane obrzęki).

Hipoalbuminemia:
wrodzone defekty syntezy albumin
stany głodzenia, niedożywienia, nieprawidłowego
żywienia
zaburzenia wchłaniania i trawienia – stany zapalne jelit
utrata przez : nerki – zespół nerczycowy, skórę – stany
zapalne skóry i oparzenia
przewlekłe krwawienia
uszkodzenie wątroby (niedostateczna biosynteza białek)
hiperkatabolizm białek – choroby nowotworowe,
nadczynność tarczycy, posocznica.
Hiperalbuminemia:
bez znaczenia patologicznego
odwodnienie organizmu
często u pacjentów hospitalizowanych
rzadko obserwowana

α1-globuliny
Spadek frakcji:
niewydolność wątroby (wirusowe zapalenie wątroby i
marskość wątroby)
wrodzony niedobór α1-antytrypsyny
zespół nerczycowy
niedoczynność tarczycy
Wzrost frakcji:
ostre stany zapalne
choroba Crohna (↑ α1-kwaśna glikoproteina )
w czasie ciąży (objaw prawidłowy)
niektóre nowotwory
α2-globuliny
Spadek frakcji:
niewydolność wątroby (wirusowe zapalenie wątroby)
zespoły utraty białek
hemoliza wewnątrznaczyniowa
Wzrost frakcji:
ostre stany zapalne
zespół nerczycowy
urazy
procesy martwicze
druga połowa ciąży (objaw prawidłowy)
cukrzyca
zapalenie nerek
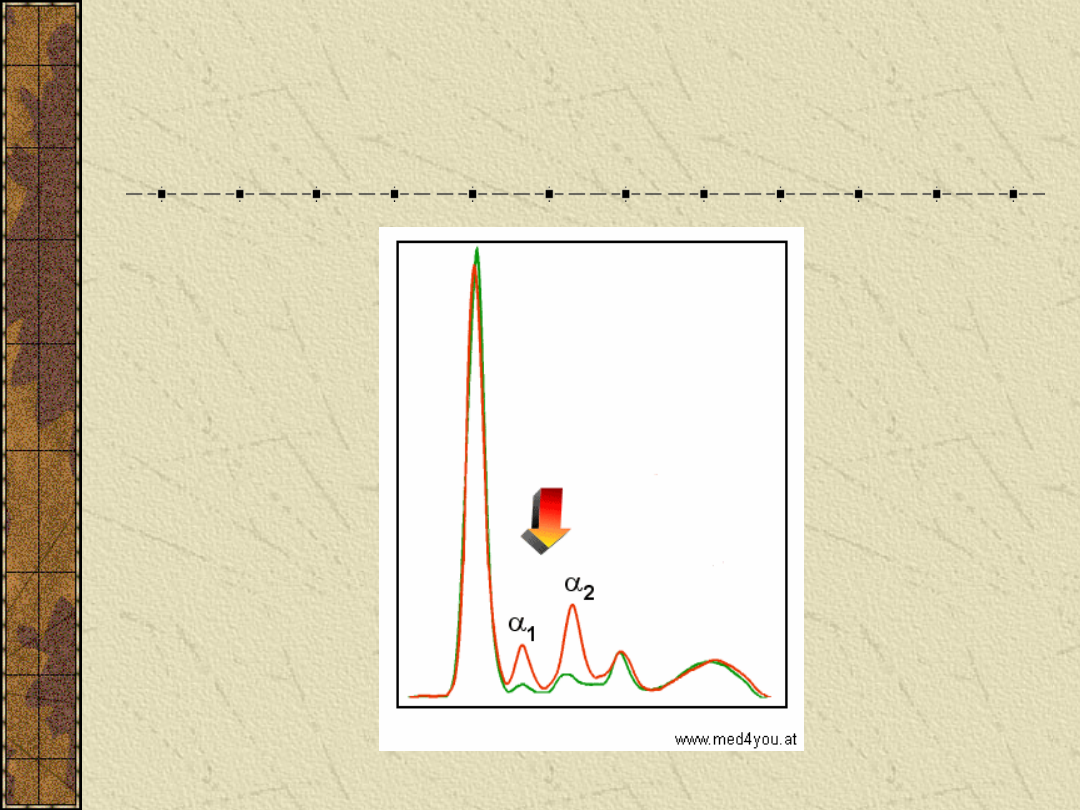
β-globuliny
Spadek frakcji:
niewydolność wątroby
zespoły utraty białek
hemoliza wewnątrznaczyniowa
Wzrost frakcji:
stany zapalne
zespół nerczycowy
urazy, procesy martwicze
niedokrwistość z niedoboru Fe
szpiczak mnogi, choroba Waldenströma i inne choroby
nowotworowe
u kobiet w cięży
marskość wątroby (mostek β-γ)
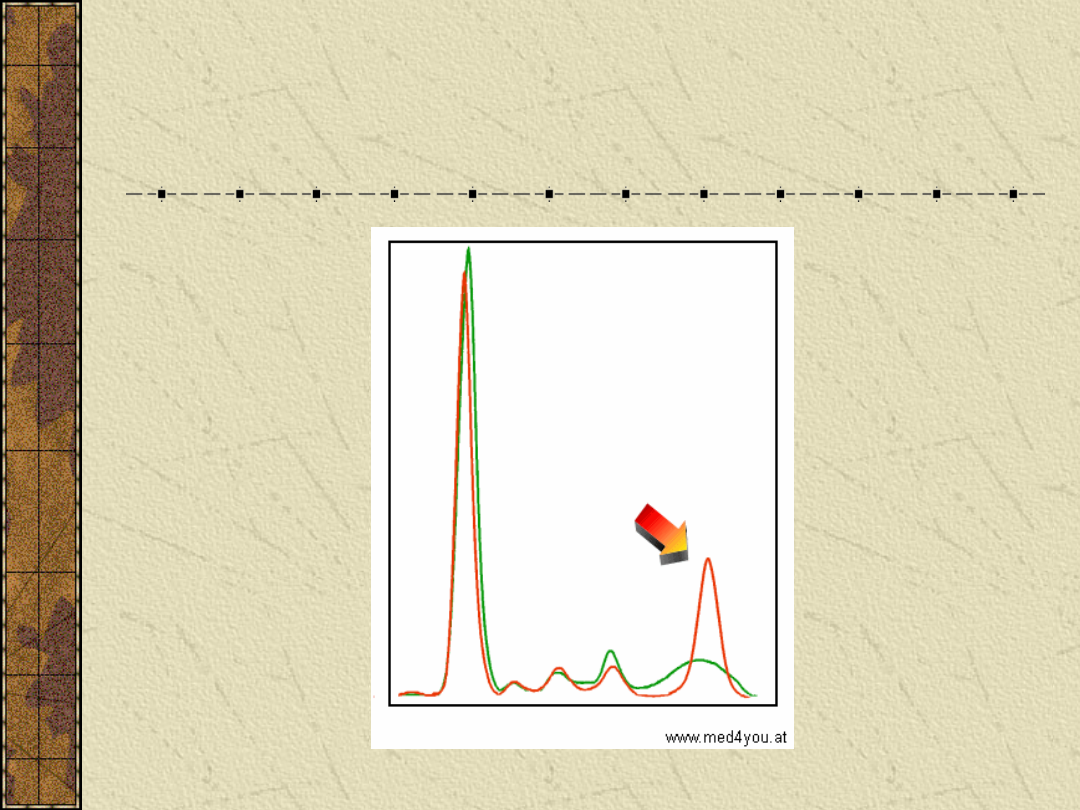
γ-globuliny
Spadek frakcji:
wrodzone zaburzenia syntezy tych białek
choroby nowotworowe, rozległe przerzuty nowotworowe do kości
stosowanie leków immunosupresyjnych, np.
glikokortykosteroidów, cyklofosfamidu
zespół nerczycowy
Wzrost frakcji:
przewlekłe stany zapalne pochodzenia bakteryjnego (gruźlica,
zapalenie szpiku kostnego) i pasożytniczego (malaria,
bilharcjoza)
choroby autoimmunologiczne (np. kolagenozy, reumatoidalne
zapalenie stawów)
marskość wątroby, przewlekłe zapalenie wątroby
szpiczak mnogi, choroba Waldenströma
sarkoidoza
rozstrzenie oskrzeli

Najczęstsze zmiany w
proteinogramach
Hipoproteinemia nieselektywna – równomierne obniżenie wszystkich frakcji
białkowych (odsetki poszczególnych frakcji często niezmienione):
długo trwające niedożywienie,
masywna utrata krwi.
Brak frakcji α-1-globulin – wrodzony niedobór α-1-antytrypsyny
Wzrost stężenia β-globulin – hiperlipoproteinemia z hipercholesterolemią
– niedokrwistość z niedoboru Fe
Wzrost γ-globulin – przewlekły proces zapalny, choroby
autoimmunologiczne (poliklonalny)
Obniżenie lub zanik γ-globulin – niedobory immunoglobulin
Wzrost stężenia α-2-globulin (α-2-makroglobulina) i β-globulin i
zmniejszenie γ-globulin i albumin – zespół nerczycowy
Ostry stan zapalny
Białko monoklonalne we frakcji γ-
globulin
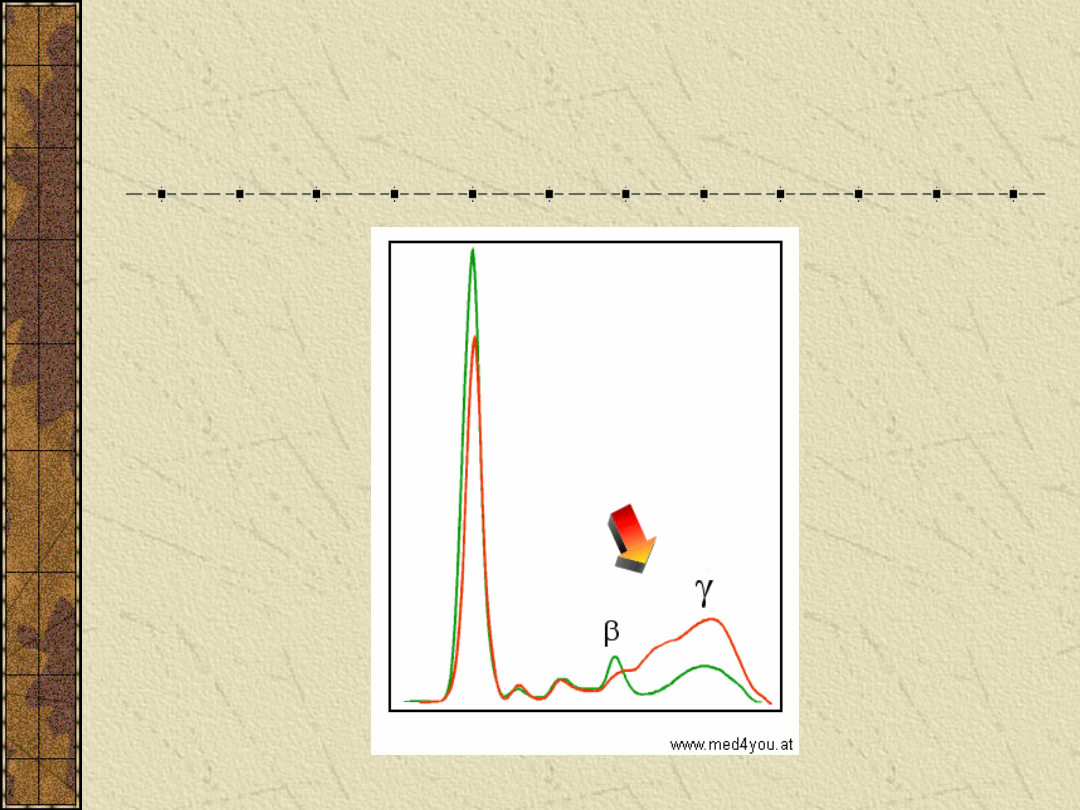
Mostek β-γ – marskość wątroby
Obniżenie
zawartości:
• albumin
• α-1-globulin
• α-2-globulin
Znaczny wzrost:
•γ-globulin

Swoiste metody identyfikacji białek:
metody immunochemiczne z zastosowaniem odpowiednich przeciwciał;
immunofiksacja,
immunoelektroforeza,
elektroforeza „rakietowa” (metoda ilościowa służąca do oznaczenia stężenia
białka),
immunodyfuzja,
elektroforeza przeciwbieżna.
Immunofiksacja
jest dwuetapową metodą identyfikacji białek:
I etap – elektroforeza w żelu agarozowym,
II etap – immunodyfuzja – nanosi się poszczególne rodzaje przeciwciał
w określone miejsca na płytce – powstają prążki pozwalające na różnicowanie
immunoglobuliny monoklonalnej i poliklonalnej,
zabarwienie powstałych kompleksów i odczyt,
wykonywana w surowicy i w moczu,
zastosowanie: identyfikacja białka monoklonalnego w szpiczaku mnogim, chorobie
Waldenströma oraz w chorobie lekkiego łańcucha.
Białka ostrej fazy
– podział w zależności od
stężenia białek:
Dodatnie
alfa-1 antytrypsyna,
haptoglobina,
fibrynogen,
CRP,
ferrytyna,
Ujemne
albumina,
transferyna,
prealbumina,
białko wiążące retinol
(RBP).
Białka ostrej fazy
– podział w zależności od stopnia syntezy w
pierwszych 2 dobach:
białka spektakularne
↑ 20 – 60 razy,
CRP,
białko amyloidowe A
(SAA),
białka silne ostrej fazy
↑ 2 – 6 razy,
orozomukoid = α1-kwaśna
glikoproteina (AAG),
fibrynogen,
haptoglobina,
α1- antytrypsyna,
słabe białka ostrej fazy
↑ 0,2 – 0,6 razy.
ceruloplazmina,
białka obojętne dla ostrej
fazy
,
alfa-2 makroblobulina,
białko amyloidowe P,
Ig.
białka ujemne ostrej fazy
↓ 0,2 – 0,6 razy,
albumina,
prealbumina,
transferyna,
RBP.
Białka ostrej fazy
– podział w zależności od pełnionej
funkcji:
Aktywatory:
np. CRP – aktywuje układ dopełniacza prowadząc do lizy
bakterii.
Inhibitory proteaz:
alfa-1 antytrypsyna – inhibitor elastazy w
granulocytach obojętnochłonnych,
alfa-1 antychymotrypsyna,
Białka transportujące:
haptoglobina,
ceruloplazmina,
transferyna.
Większość białek to inhibitory proteaz i białka wiążące żelazo,
ponieważ ich rola polega na hamowaniu proteolitycznego
uszkodzenia tkanek w miejscach zmian zapalnych.
Białko CRP
wartości prawidłowe – 0,8 – 10 mg/L.
metody oznaczania CRP:
immunoturbidymetryczne,
immunonefelometryczne,
testy oparte na technice immunonefelometrycznej ze
wzmocnieniem lateksowym,
testy turbidymetryczne ze wzmocnieniem lateksowym
tzw. hs-CRP (high sensitive CRP).
Testy te umożliwiają oznaczanie nawet bardzo niskich
stężeń tego białka w surowicy rzędu 0,05 – 0,1 mg/L.

Białko CRP
czuły pojedynczy wskaźnik rozwijającego się stanu zapalnego w wyniku:
infekcji bakteryjnej
martwicy spowodowanej niedotlenieniem, oparzeniem lub działaniem toksyn
zapalenia trzustki i otrzewnej.
wzrost CRP może nastąpić w ciągu 6 – 8 godzin od wystąpienia urazu lub
infekcji.
↑ stężenia CRP > 10 mg/l – lokalny stan zapalny,
> 100 mg/l w 80 – 85% - infekcje bakteryjne i/lub rozległy proces zapalny,
>300-500 mg/l (najwyższe stężenia) – ostre martwicze zapalenie trzustki,
uszkodzenia wielonarządowe, rozległe oparzenia i zmiany martwicze.
stężenie CRP szybko spada – około 1 doba, jeżeli proces uszkadzania tkanek
ustaje i odczyn zapalny nie ulega rozszerzeniu,
↑ CRP – u osób z przewlekłymi stanami zapalnymi, bez podłoża infekcyjnego
(astma, SLE, zawał serca, zapalenie martwicze trzustki, guzy nowotworowe).
↑ CRP – bez współistniejącego stanu zapalnego obserwuje się również w
niektórych nowotworach złośliwych (np. szpiczak mnogi, chłoniak ziarniczy)
→ stężenie CRP koreluje z rokowaniem i rozwojem nowotworu.

Wskazania do oznaczania CRP:
(Dobry wskaźnik infekcji pooperacyjnych, ostrych zakażeń u
noworodków i małych dzieci i wczesny wskaźnik odrzucania
przeszczepu)
badanie w kierunku stanów zapalnych,
rozpoznanie uogólnionych infekcji u noworodków,
różnicowanie infekcji bakteryjnych i wirusowych,
wybór odpowiedniego leczenia stanów zapalnych i jego monitorowanie,
w celu szybkiego wykluczenia bakteryjnych stanów zapalnych po
zabiegach chirurgicznych,
w celu wykrycia infekcji u pacjentów z obniżoną odpornością (chorzy z
białaczką, czy pacjenci zakażeni wirusem HIV),
w celu oceny ryzyka zmian w układzie sercowo-naczyniowym (CRP o
wysokiej czułości),
wykrycie współistniejącej infekcji w przebiegu tocznia rumieniowatego,
wrzodziejącego zapalenia jelita grubego, białaczki lub po przeszczepie
szpiku kostnego,
rozpoznanie zakażenia w przypadku przedwczesnego odejścia wód
płodowych lub przedwczesnego porodu,
różnicowanie choroby Crohna i wrzodziejącego zapalenia jelita grubego.

Surowicze amyloidowe białko A
(SSA)
silnie reagujące białko ostrej fazy (obok CRP),
wzrasta wolniej niż CRP, bo od 8 godz. od wystąpienia
infekcji,
związane w kompleksach z lipoproteinami o wysokiej
gęstości (HDL),
uczestniczy w transferze cholesterolu z HDL do
komórek wątroby,
stężenie SAA silnie wzrasta w infekcjach wirusowych w
odróżnieniu od CRP,
podwyższone SAA występuje w chorobie Crohna oraz
uczestniczy w rozwoju choroby reumatycznej.

α1-kwaśna glikoproteina
(orozomukoid, AAG)
jej stężenie wzrasta powoli (do 5 dnia stanu zapalnego),
2-3-krotnie powyżej wartości referencyjnej,
spadek w ciężkim upośledzeniu funkcji wątroby,
podczas wyniszczenia organizmu (niedożywieniu), w
zespole nerczycowym, zespołach utraty treści
pokarmowej,
transporter progesteronu, tworzy kompleksy z
niektórymi białkami układu krzepnięcia, ma zdolność
wiązania leków i ksenobiotyków o charakterze
zasadowym.
α1-antytrypsyna (AAT)
jeden z najsilniejszych, nieswoistych inhibitorów proteaz
serynowych (inaktywuje enzymy proteolityczne uwalniane
podczas fagocytozy przez granulocyty wielojądrzaste:
trypsyna, chymotrypsyna, kolagenaza, plazmina, trombina),
wzrost 4-5-krotnie w stanach zapalnych między 2-4 dniem.
spadek stężenia:
• wrodzony niedobór α1-antytrypsyny – defekt wydzielania
tego białka z komórek wątroby → gromadzenie złogów
białka w hepatocytach prowadząca do marskości żółciowej
• zespoły utraty białek
• zespół niewydolności oddechowej noworodków (wiązanie z
błonami hialinowymi).

Haptoglobina (HAP)
wiąże i transportuje hemoglobinę pozakrwinkową po
hemolizie erytrocytów w naczyniach krwionośnych,
(kompleks Hb+haptoglobina jest szybko fagocytowany
przez komórki układu siateczkowo-śródbłonkowego – w
ten sposób organizm zabezpiecza nerki przed
szkodliwym działaniem Hb i zatrzymuje Fe w ustroju),
w ostrych stanach zapalnych wzrasta 5-6-krotnie już w
pierwszej dobie, po 10 dniach powrót do normy,
wzrost u osób z niektórymi chorobami na podłożu
autoagresji i z zaawansowaną choroba nowotworową,

Ceruloplazmina (CER)
jedna cząsteczka CER wiąże 6-7 atomów miedzi,
katalizuje utlenianie Fe2+ do Fe3+, by mogło zostać
połączone z transferyną,
silny antyoksydant w osoczu (ok. 80% aktywności
osocza),
niedobór CER
→
choroba Wilsona (wzrost wolnej
miedzi w krążeniu i odkładanie się jej w nerkach,
wątrobie, mózgu – uszkodzenie narządów),
wzrost stężenia CER 2-3-krotnie występuje późno:
• ciąża,
• doustne środki antykoncepcyjne,
• procesy zapalne,
• martwica tkanki.

Fibrynogen
białko układu krzepnięcia,
wzrost w ostrych stanach zapalnych ok. 3-krotnie
powyżej wartości podstawowej i utrzymuje się długo po
ustąpieniu odczynu zapalnego,
wzrasta również w martwicy tkanek, urazach, chorobach
nowotworowych, zespole nerczycowym,
syntetyzowane w wątrobie.
niespecyficzny inhibitor proteaz (np. trypsyna,
chymotrypsyna, trombina, plazmina), podobnie jak AAT,
duże białko, które nie przechodzi przez łożysko naczyń –
wzrost w zespole nerczycowy.
α2-makroglobulina (AMG)
Transferyna (TRF)
białko transportujące Fe,
ujemne białko ostrej fazy – spadek stężenia w stanach zapalnych
wzrost TRF:
• niedokrwistość z niedoboru Fe,
• ciąża,
• terapia estrogenami.
spadek TRF:
• zespół nerczycowy,
• upośledzenie funkcji wątroby,
• niedożywieniu.

Niedobory immunoglobulin –
hipogammaglobulinemie
Pierwotne:
• uwarunkowane genetycznie,
• rzadko występują,
• mogą dotyczyć jednej lub wszystkich klas
immunoglobulin, najczęściej dotyczą IgA.
Wrodzone niedobory immunoglobulin:
o Agammaglobulinemia związana z płcią (niedobór
wszystkich klas Ig u chłopców),
o Izolowane niedobory IgA lub IgM,
o Zespół niedoboru deaminazy adenozyny – ADA
(limfopenia, niedobór IgG)

Nabyte niedobory immunoglobulin:
nowotwory układu chłonnego i siateczkowo-
śródbłonkowego (białaczki, szpiczaki, ziarniniaki,
makroglobulinemie) (ubytek limfocytów B) (Poziom
wybranej monoklonalnej immunoglobuliny jest wysoki, ale
ilość Ig syntetyzowanych przez prawidłowe plazmocyty jest
niska),
leczenie cytostatykami, naświetlania promieniowaniem
jonizującym,
fizjologicznie u noworodków (najniższe stężenia w 3
miesiącu życia),
jelitowe i nerkowe zespoły utraty białka,
usunięcie śledziony,
hemoglobinopatie, anemia złośliwa.
Hipergammaglobulinemie
poliklonalne
prawidłowa odpowiedź organizmu na infekcję bakteryjną
lub wirusową,
bardzo wysoki poziom Ig poliklonalnych w chorobach o
podłożu autoimmunologicznym,
przewlekłe choroby wątroby.
Wzrost
immunoglobuliny
Jednostka chorobowa
IgM
Ostre stany zapalne, pasożyty
Ostre WZW
Marskość wątroby
IgG
Przewlekłe stany zapalne
Przewlekle wzw, marskość
wątroby
Choroby z autoagresji
AIDS, sarkoidoza
IgA
Przewlekłe infekcje dróg
oddechowych i przewodu
pokarmowego
Wczesny okres chorób z
autoagresji
Marskość wątroby
Laktacja

Hipergammaglobulinemie
monoklonalne
Najczęstsze przyczyny:
Szpiczaki mnogie (IgG>IgA>>IgE,IgD):
Rozrost zróżnicowanych limfocytów B – plazmocytów, które
syntetyzują identyczne cząsteczki Ig określonej klasy – w
rozdziale elektroforetycznym białek surowicy wyraźna
strefa białka monoklonalnego,
Plazmocyty syntetyzują większą liczbę łańcuchów lekkich
niż ciężkich, które jako małe białka przedostają się do
moczu – białko Bence-Jonesa (obecność w moczu łańcuchów
lekkich w ilościach przekraczających wartości prawidłowe),
Choroba łańcuchów lekkich (synteza tylko łańcuchów
lekkich κ lub λ,
Choroba łańcuchów ciężkich (tylko łańcuchy ciężkie Ig).
Hipergammaglobulinemie
monoklonalne cd.
Makroglobulinemia Waldenströma
Rozrost plazmocytów w szpiku kostnym, węzłach
chłonnych i śledzinie produkujących IgM o dużej masie
cząsteczkowej,
IgM gromadzi się we krwi w dużych ilościach
zwiększając lepkość krwi i nasilając skłonność do
zatorowości.
Chłoniaki,
Łagodne gammapatie monoklonalne.

Piśmiennictwo:
Angielski S., Jakubowski Z.,. Dominiczak M.H., Biochemia
Kliniczna, 1996, Wydawnictwo Perseusz.
Dembińska – Kieć A., Naskalski J.W., Diagnostyka
Laboratoryjna z Elementami Biochemii Klinicznej, 1998,
Volumed Wrocław.
Nastalski J. W., Białka ostrej fazy - znaczenie diagnostyczne,
Badanie i diagnoza, 1996, 25-30.

Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
Białka wiążące wapń
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
BM1 Białka
04) Kod genetyczny i białka (wykład 4)
Wyklad 03 Białka3
BIOSYNTEZA BIAŁKA
Białka 08 06 05
Białka
bialkaII
Białka1
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Regulacja białka supresorowego nowotworów p53. Biologia molekularna. Seminarium 1, biologia- studia
Oczyszczanie ludzkiego białka P2 na drodze chromatografii powinowactwa
mater białka instrukcja wykonania doświadczenia
Referat białka
Sprawozdanie białka
więcej podobnych podstron