
Opis cząsteczki
Wygląd cząsteczki
Liczba
aminokwasów
Peptydy
od 2
Oligopeptydy
kilka-kilkanaście
Polipeptydy
poniżej 100
Białka
powyżej 100
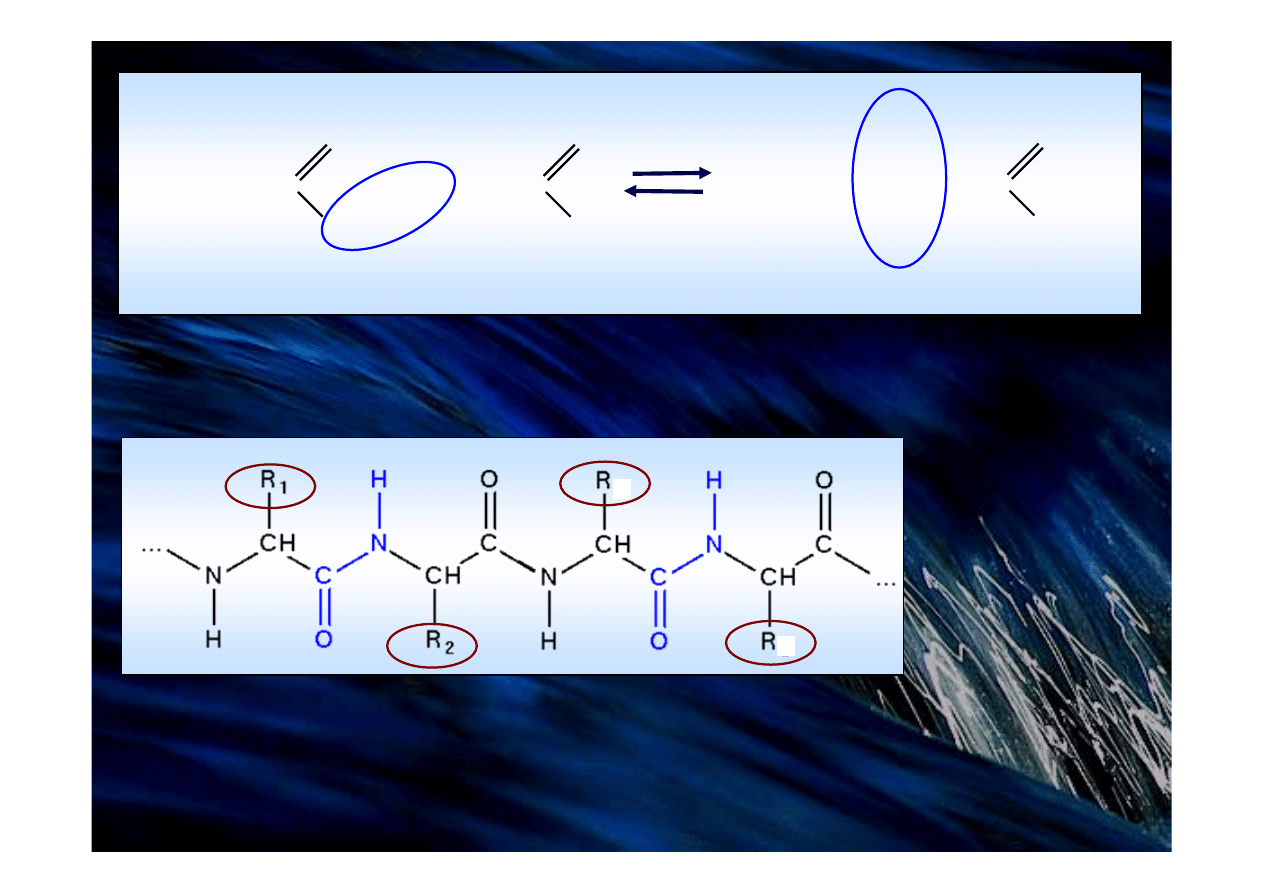
Łańcuch polipeptydowy tworzą:
regularnie powtarzający się układ wiązań szkieletu
i charakterystyczne łańcuchy boczne (R1, R2, R3, R4)
3
4
Łańcuchy polipeptydowe są utworzone z aminokwasów
połączonych wiązaniami peptydowymi
R
1
I
+
H
3
N-C-C
I
H
O
O
-
R
2
I
+
H
3
N-C-C
I
H
O
O
-
R
1
O R
2
I II I
+
H
3
N-C- C - N -C-C
I I I
H H H
O
O
-
Wiązanie peptydowe
+
+ H
2
O
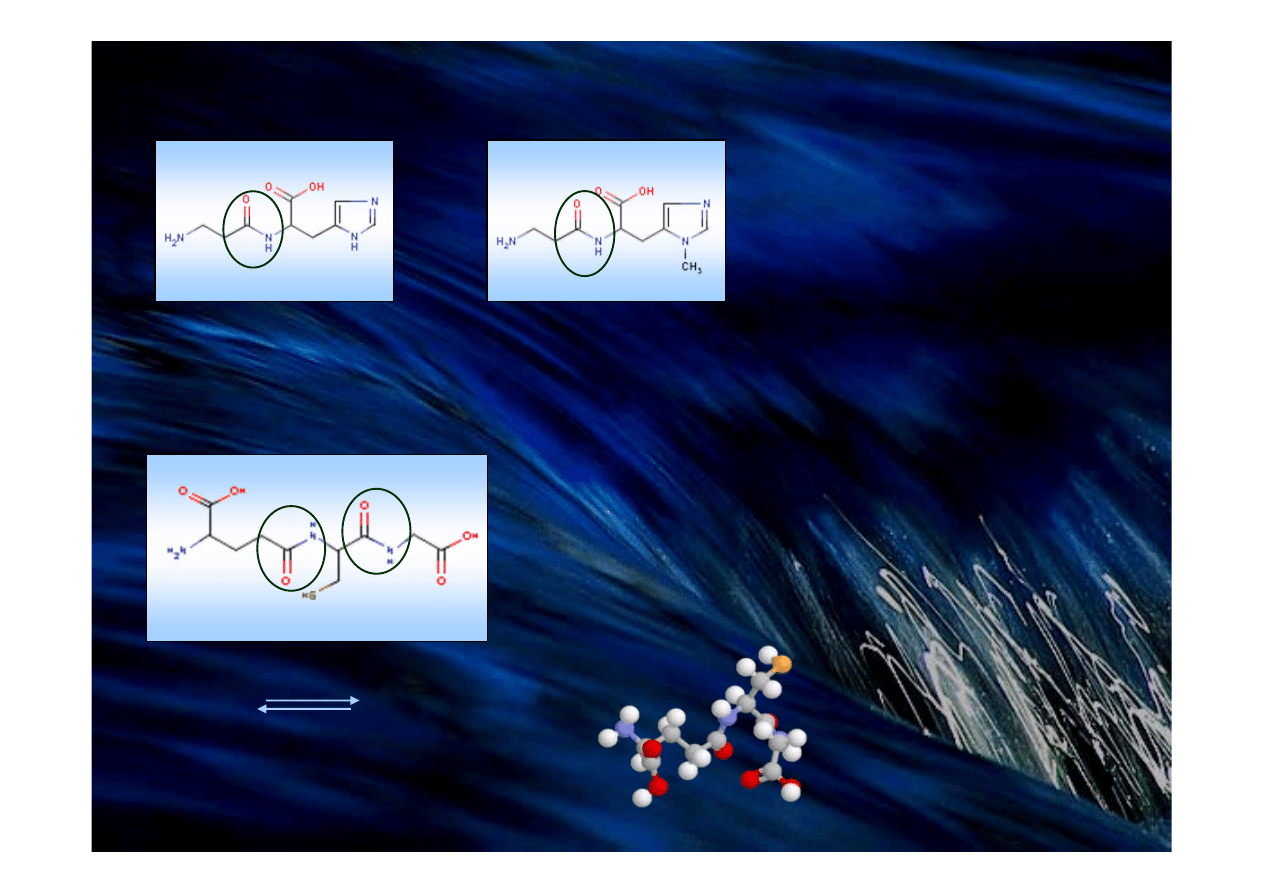
Dipeptydy
Trójpeptydy
Karnozyna (β-Ala-His)
Anseryna (β-Ala-N-Met-His)
Występują w mięśniach
Funkcja buforująca (kwas mlekowy)
Glutation (γ-Glu-Cys-Gly)
Działanie antyutleniające w komórkach
Reaguje z H
2
O
2
i nadtlenkami organicznymi
2GSH 2GSSG
-2H
+2H
γ
-glutaminian
cysteina
glicyna

Oligopeptydy i polipeptydy są często hormonami
Oksytocyna
Wazopresyna
Insulina
Glukagon
Kalcytonina
Gastryna
Sekretyna
Hormon
Miejsce biosyntezy
Struktura
Angiotensyna
Bradykinina
Działanie
podwzgórze
podwzgórze
trzustka
(komórki
β)
trzustka
(komórki
α)
tarczyca
błona śluzowa
żołądka
błona śluzowa
jelit
plazma krwi
plazma krwi
Skurcz macicy (początek porodu),
wydzielanie mleka
Wzrost ciśnienia krwi, efekt
antydiuretyczny
Obniża poziom cukru we krwi
Obniża poziom wapnia we krwi
Pobudza wydzielanie soków
żołądkowych i pepsyny
Pobudza trzustkę do syntezy
i wydzielania soków trawiennych
Podnosi ciśnienie krwi; pobudza produkcję
aldosteronu w nadnerczach
Obniża ciśnienie krwi; zwiększa
przepuszczalność naczyń; powoduje skurcz
mięśni gładkich
peptyd cykliczny;
9 reszt
peptyd cykliczny;
9 reszt
peptyd cykliczny;
51 reszt
peptyd liniowy;
29 reszt
peptyd cykliczny;
32 reszty
peptyd liniowy;
17 reszt
peptyd liniowy;
27 reszt
peptyd liniowy;
8 reszt
peptyd liniowy;
9 reszt
Podwyższa poziom cukru we krwi

Białka przyjmują ściśle określoną konformację przestrzenną zdeterminowaną sekwencją aminokwasową
Struktura
pierwszorzędowa:
kolejność (sekwencja) aminokwasów w łańcuchu polipeptydowym
Struktura
drugorzędowa:
układ głównego łańcucha polipeptydowego bez uwzględniania
konformacji łańcuchów bocznych cząsteczki białka
Struktura
trzeciorzędowa:
przestrzenny układ wszystkich atomów w cząsteczce (podjednostce)
Struktura
czwartorzędowa:
układ przestrzenny podjednostek w cząsteczce białka
struktura
pierwszorzędowa
struktura
drugorzędowa
struktura
trzeciorzędowa
struktura
czwartorzędowa
RZĘDOWOŚĆ STRUKTURY BIAŁEK
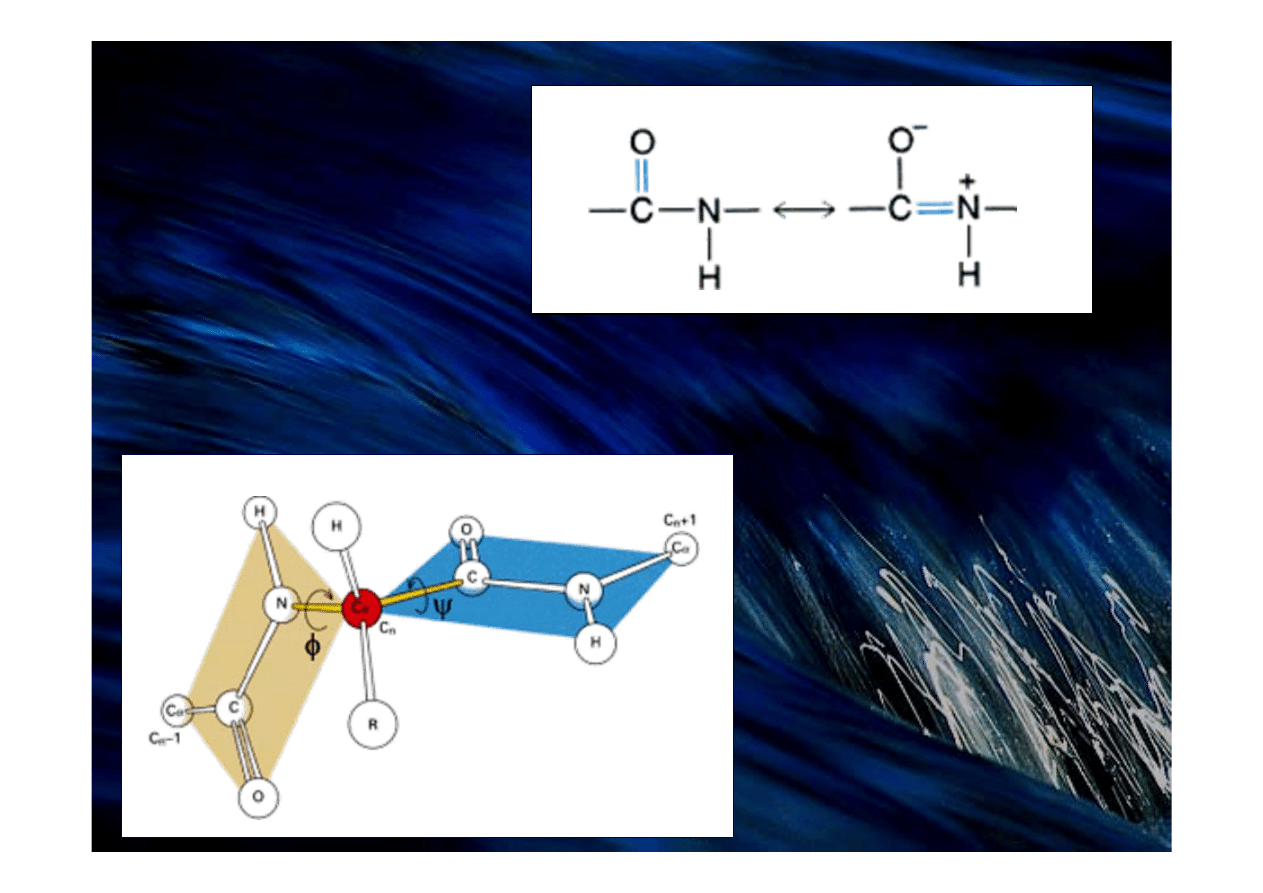
Grupa peptydowa
jest sztywnym i płaskim
elementem strukturalnym
Grupa peptydowa jest płaska,
ponieważ wiązanie między atomami azotu i węgla ma częściowo charakter wiązania podwójnego
Struktura
wiązania peptydowego
forma ketonowa
forma enolowa
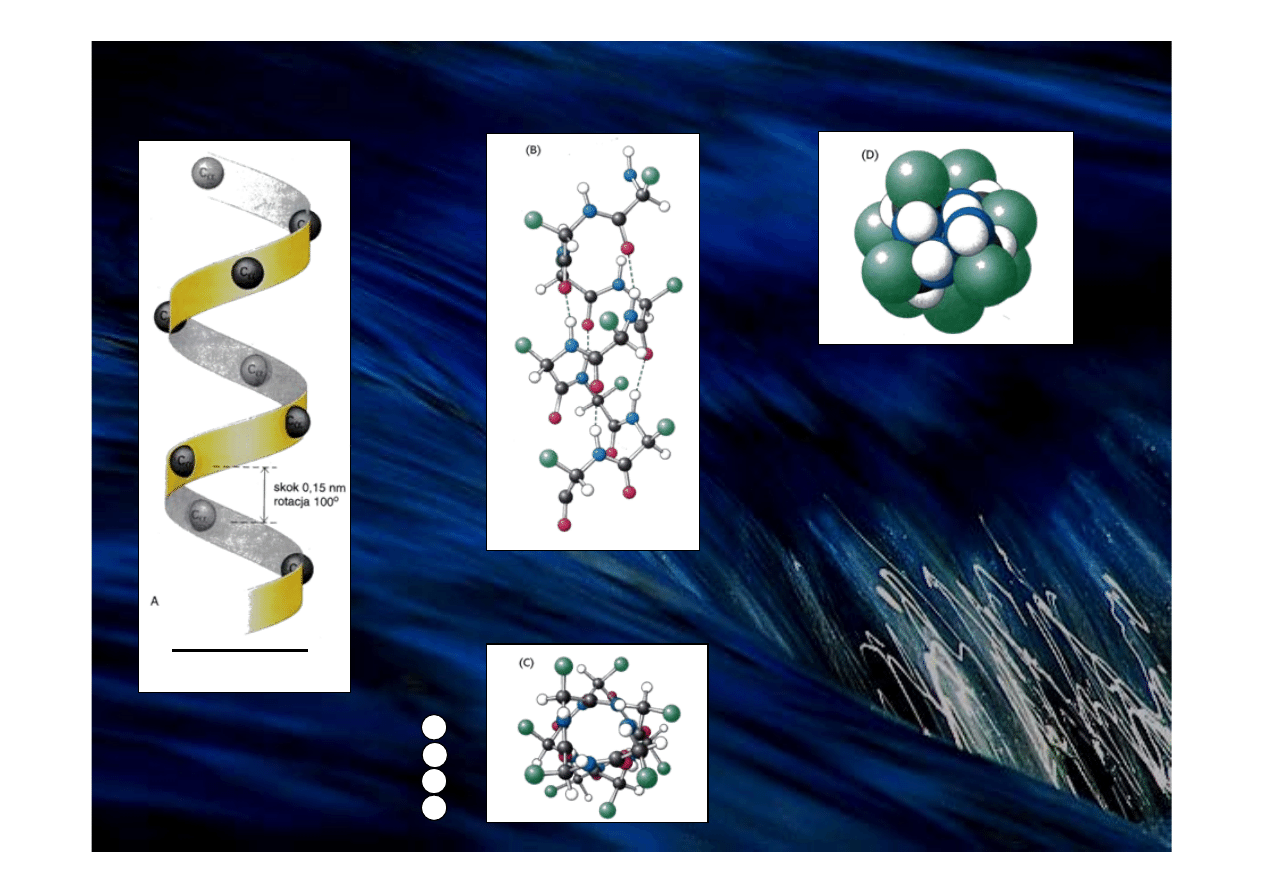
Struktury drugorzędowe białek – α helisa
3.6 aminokwasu
na skręt
Model
prawoskrętnej helisy α
Widok z boku w modelu kulkowym
przedstawiający wiązania wodorowe (linie przerywane)
między grupami NH i CO
Widok z góry
Model czaszowy rysunku (C)
przedstawiający
ściśle upakowany wewnętrzny rdzeń helisy
0.5 nm
N
O
H
R
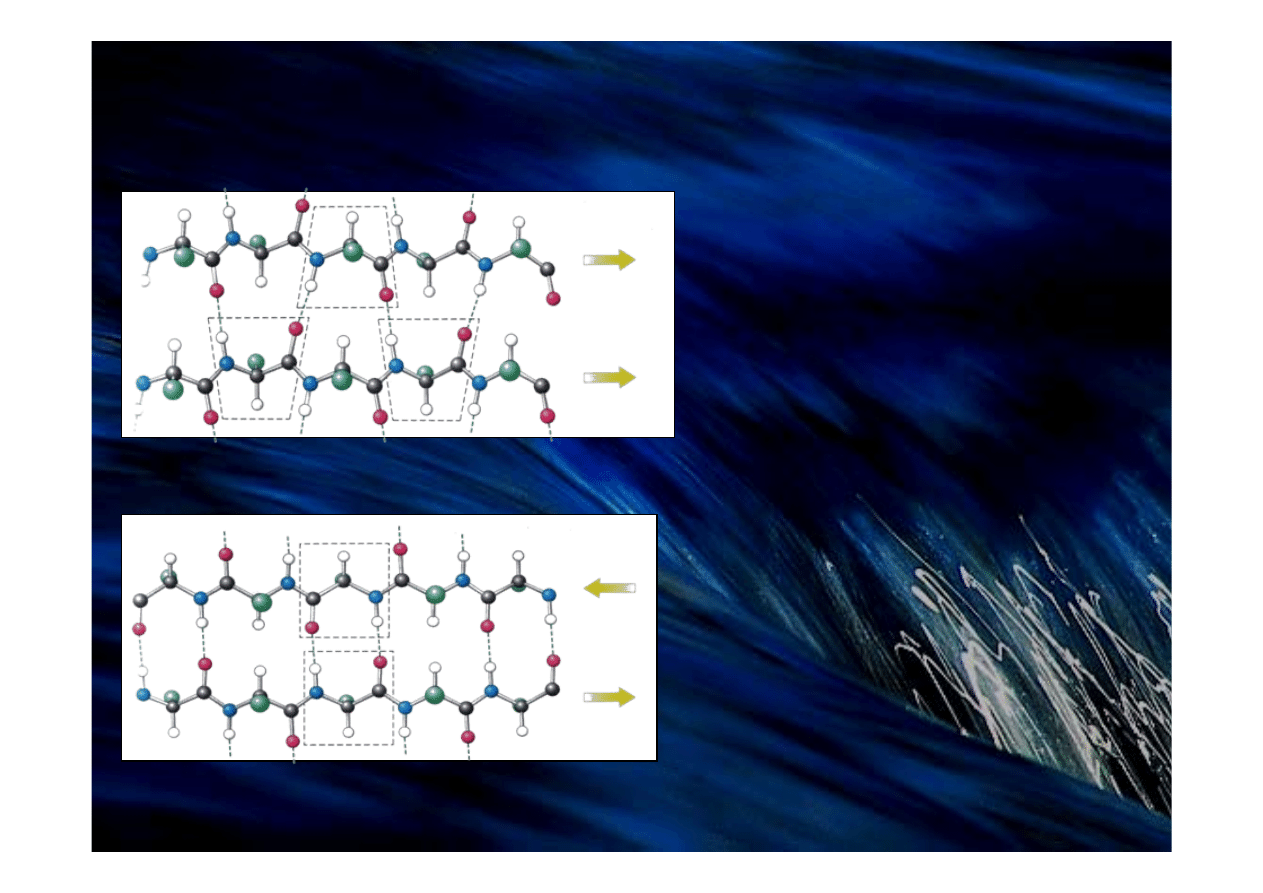
Struktura β (β sheet)
Antyr
Antyr
ó
ó
wnoleg
wnoleg
ł
ł
a
a
harmonijka
harmonijka
β
β
.
.
Sąsiadujące nici β są ułożone w przeciwnych
kierunkach.
Strukturę stabilizują wiązania wodorowe
między grupami NH i CO.
Równoległa harmonijka β.
Sąsiednie nici β są ułożone
w tym samym kierunku.
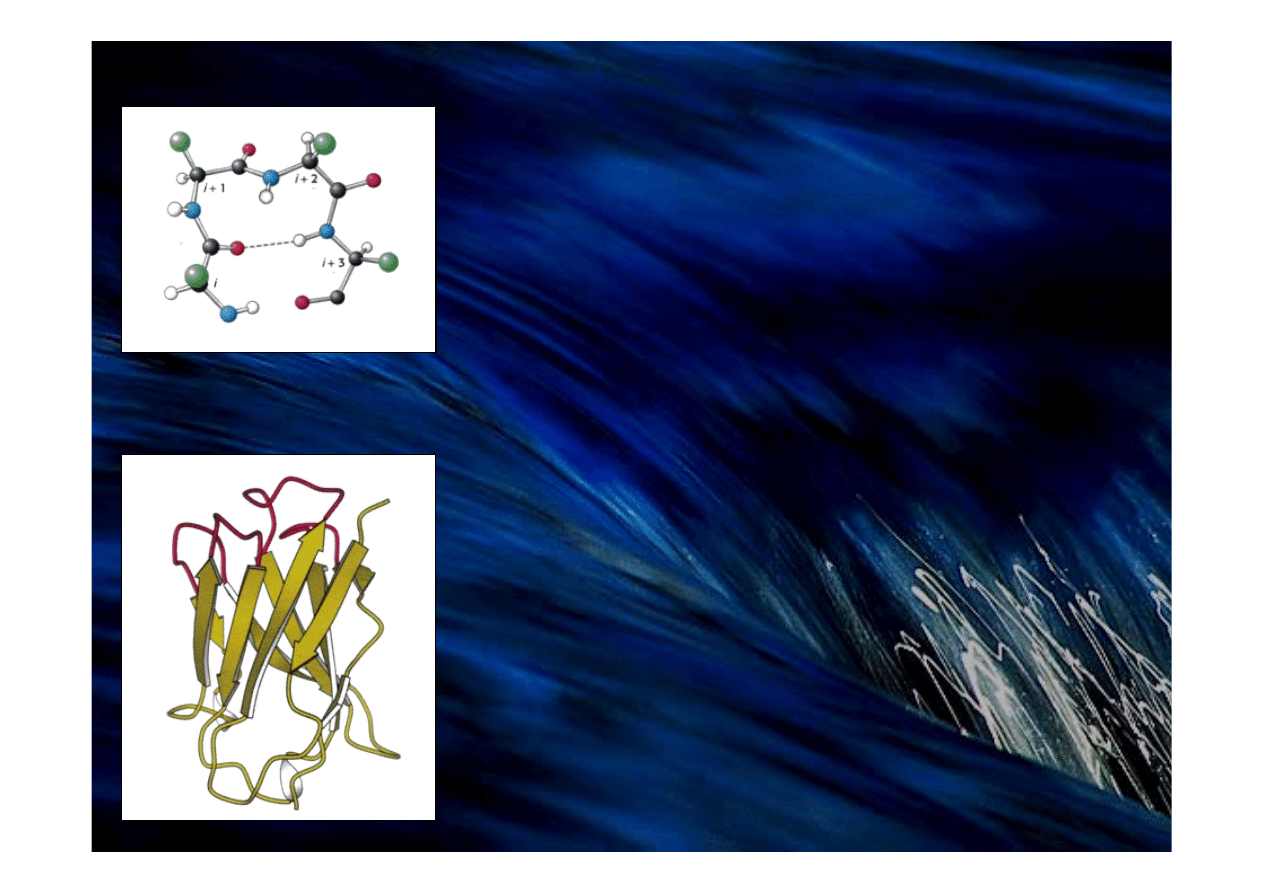
Struktura wstęga-zwrot-wstęga.
W łańcuchu polipeptydowym grupa CO reszty
i
jest
związana wiązaniem wodorowym z grupą NH reszty
i+3
,
stabilizując strukturę zwrotu
Pętle na powierzchni białka.
Część cząsteczki zawiera pętle powierzchniowe
(zaznaczone kolorem czerwonym), które pośredniczą
często w oddziaływaniach z innymi cząsteczkami.
Pętle
Struktury typu wstęga-zwrot-wstęga
(spinki do włosów lub zwrotu β)
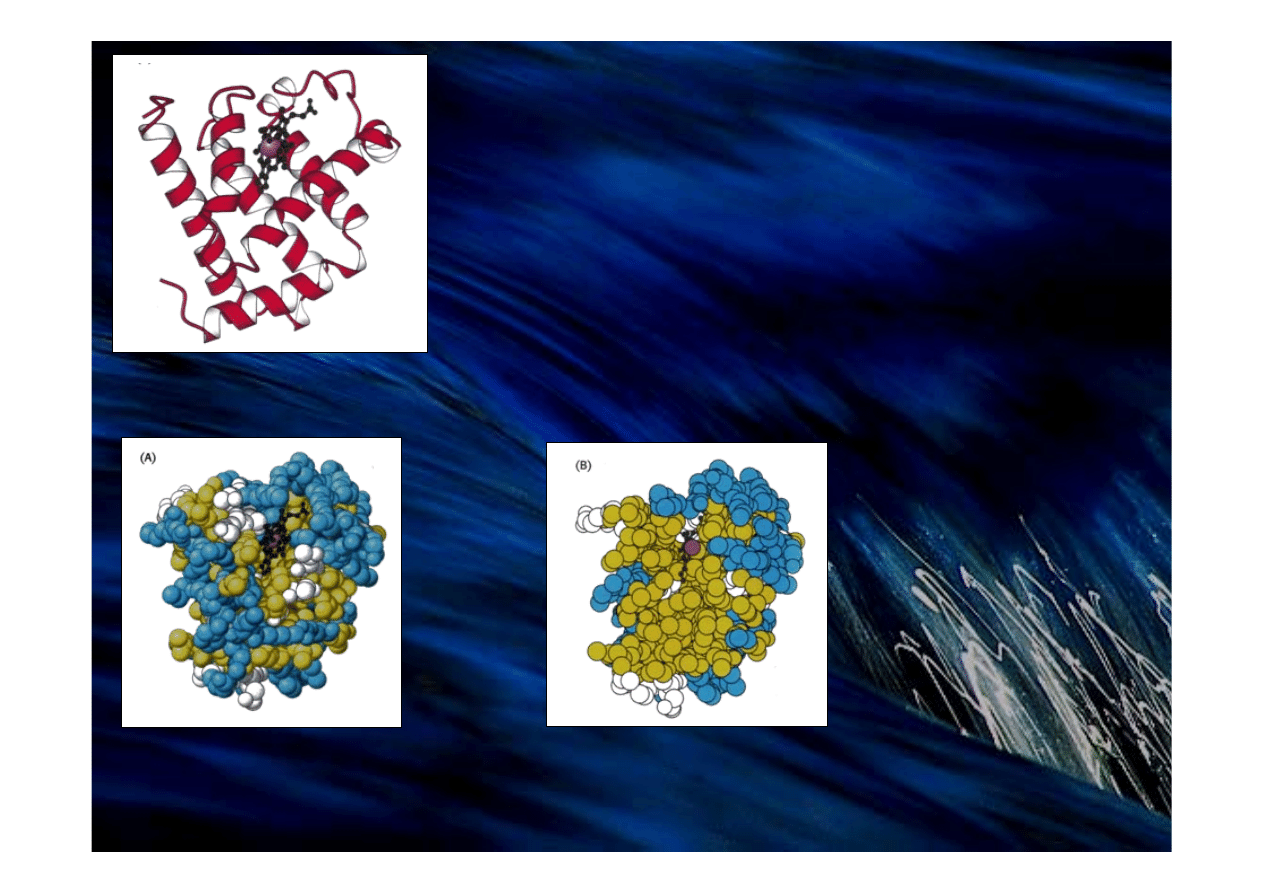
Mioglobina
Była pierwszym białkiem, którego 3-D strukturę
określono na podstawie badań rentgenowskich (1960);
sekwencja – 1965r.
Model (B) pokazuje gęste
upakowanie struktury
Struktura przestrzenna mioglobiny,
białka przenoszącego tlen w mięśniach.
Rozkład aminokwasów
w mioglobinie
Model czaszowy mioglobiny
z aminokwasami hydrofobowymi (kolor żółty),
naładowanymi (kolor niebieski) i pozostałymi
(kolor biały)
Przekrój poprzeczny – większość aminokwasów
hydrofobowych znajduje się wewnątrz struktury,
natomiast aminokwasy naładowane występują na
powierzchni białka
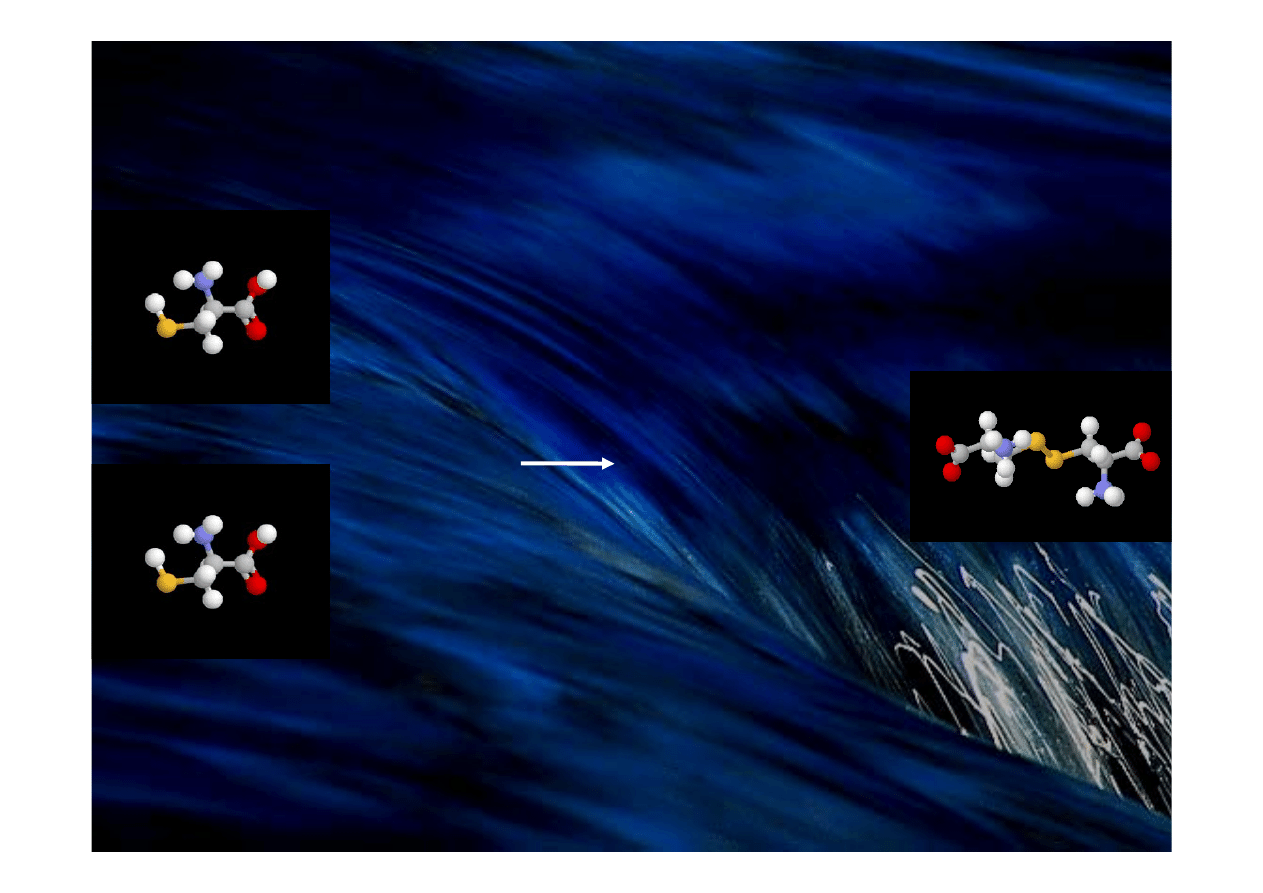
Mostek dwusiarczkowy (-S-S-) powstaje z grup tiolowych
dwu reszt cysteiny (-SH). Produktem reakcji jest reszta cystyny.
H H O
I I II
-N- C - C -
I
CH
2
I
SH
H H O
I I II
-N- C - C -
I
CH
2
I
S
I
SH
I
CH
2
I
-N- C - C -
I I II
H H O
S
I
CH
2
I
-N- C - C -
I I II
H H O
cysteina
cystyna
-2H
Obecność mostków dwusiarczkowych w białkach
wpływa w istotny sposób na ich konformację przestrzenną
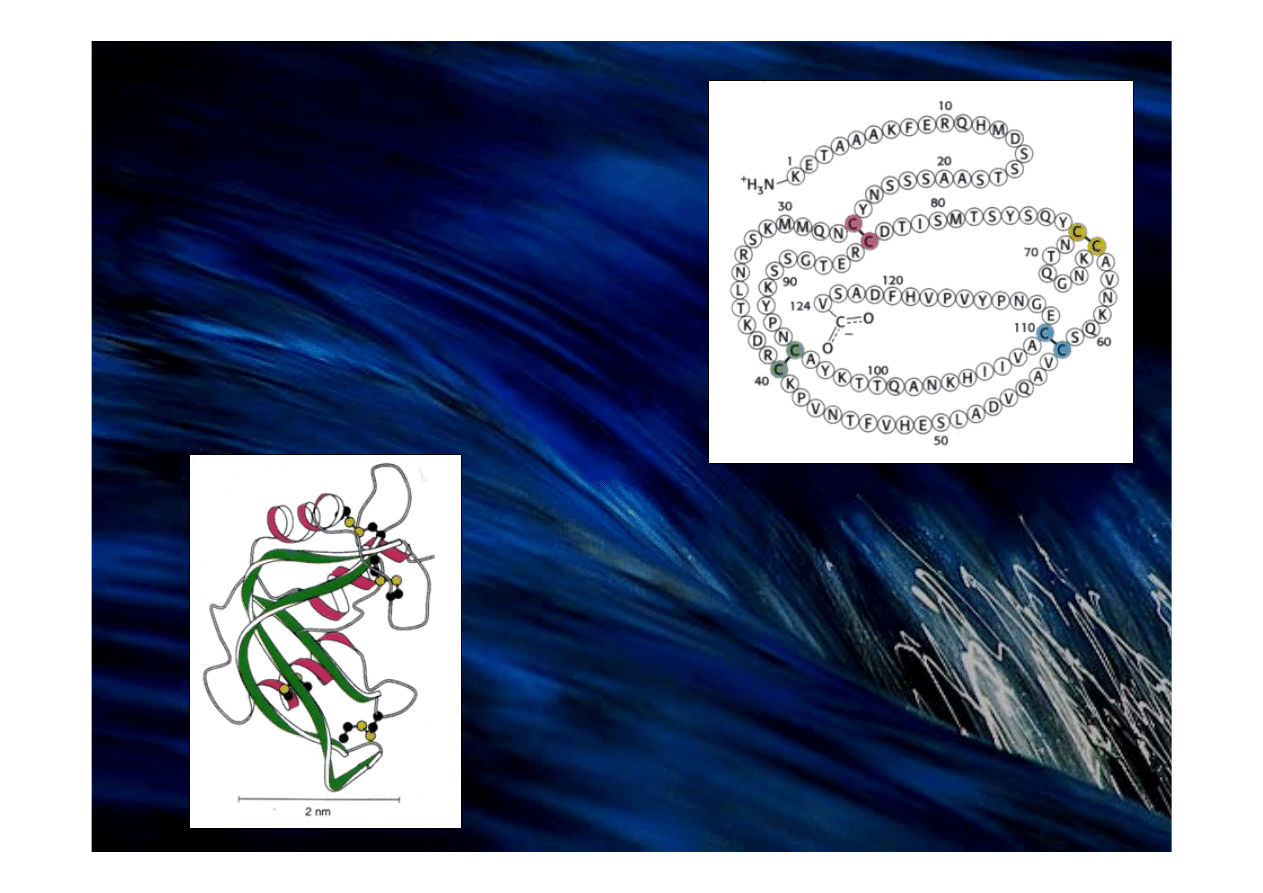
Sekwencja aminokwasów
rybonukleazy bydła domowego.
Cztery mostki dwusiarczkowe
zaznaczono kolorami.
Rybonukleaza A, enzym trawienny, ma złożoną
strukturę przestrzenną. Na tym schematycznym
rysunku helisy α mają kolor czerwony, a nici β –
zielony. Narysowano również cztery mostki
dwusiarczkowe: atomy siarki zaznaczono kolorem
żółtym.
Rybonukleaza

Czwartorzędowa struktura hemoglobiny.
Dwie identyczne podjednostki α- kolor żółty i pomarańczowy,
a podjednostki β, również identyczne – niebieski i zielony.
Grupy hemowe – czerwony, dwie z nich są widoczne.
α
2
β
2
Struktura czwartorzędowa (podjednostkowa)

Struktura czwartorzędowa białek
RUBISCO – karboksylaza/oksygenaza 1,5-rybulozobisfosforanu (RuBP)
Budowa:
• 16 podjednostek
• 8 dużych, katalityczne, 55 kDa, kodowane w
genomie chloroplastowym
• 8 małych (S), 15 kDa, kodowane w jądrze
• u roślin wyższych struktura – L8S8
• dwa miejsca katalityczne występują na styku 2
podjednostek L
• kluczowy enzym w fazie ciemnej fotosyntezy
• asymilacja CO
2
• najpowszechniej występujące białko w biosferze (ok.. 40 X 10
6
ton !)
struktura krystaliczna Rubisco L8S8
widok z boku: RuBP (niebieski) jest
związany do miejsc aktywnych między
parą dimeru L2
widok góry
Liczba zdeponowanych
struktur przestrzennych białek:
• do końca 20001 – 14 781
• do 31 01 2006 – 31903
• obecnie rocznie ~ 5000
(tyle ile było znane do 1997 r.)
Spinach ferredoxin reductase at 1.7 A resolution

Klasyfikacja białek na podstawie
ich funkcji biologicznej
TYP
Enzymy
Białka zapasowe
Białka transportowe
Białka kurczliwe
Białka ochronne
we krwi kręgowców
Toksyny
Hormony
Białka strukturalne
PRZYKŁADY
rybonukleaza, lizozym, trypsyna
owoalbumina, kazeina, ferrytyna (Fe), gliadyna, zeina
hemoglobina, hemocjanina, mioglobina (tlen), albumina surowicy (kwasy
tłuszczowe), ceruloplazmina (Cu)
miozyna, aktyna, dyneina
przeciwciała, fibrynogen, trombina
toksyna jadu kiełbasianego (
Clostriclium botulinum
),
toksyna błonicy i cholery, jad węża, rycyna (roślinna)
insulina, hormon wzrostowy (somatotropina), relaksyna
białka osłonki wirusów, glikoproteid, białka strukturalne błon,
keratyna (włosy), sklerotyna, fibroina jedwabiu,
kolagen (tkanka łączna, skóra, chrząstka), elastyna (naczynia krwionośne),
mukoproteidy, białka cytoszkieletu: mikrotubule (tubuliny),
mikrofilamenty (aktyna, tropomiozyna), filamenty pośrednie (fibronektyna)

Wartości punktu izoelektrycznego
niektórych białek
Rodzaj białka
Izoelektryczna
wartość pH
Pepsyna
< 1.0
Albumina jaj
4.6
Albumina surowicy
4.9
Ureaza
5.0
β
-laktoglobilina
5.2
γ
1 globulina
6.6
Hemoglobina
6.8
Mioglobina
7.0
Chymotrypsynogen
9.5
Cytochrom c
10.65
Lizozym
11.0

Białka proste
Nierozp. białka
strukturalne, typowo
zwierzęce
Rozp. w kwasach i zasadach,
w H
2
O i r-rach soli; duża
zawartość Glu (do 45%)
Rozp. w 50-90% etanolu,
30-45 Glu, ok. 15% Pro
Rozp. w r-rach soli
Dobrze rozp. w H
2
O; (20-
25% Asp, Glu)
pI = 10-11, duża zawartość
Arg,Lys, rozp. W H
2
O i
kwasach, w jądrach poł. z
DNA u
Eucariota
, M.cz. 10-
20kDa
W jądrach, poł. z DNA; pI =
10-12, rozp. w H
2
O i
kwasach, 80-85% Arg,
M.cz. 4000-4500
kolagen, keratyna, fibroina, elastyna
skleroproteiny
oryzeina ryżu, glutenina (pszenica)
Glutenina i gliadyna składają się
na lepkie białko (gluten) mąki pszennej i żytniej
gluteliny
gliadyna (pszenica i żyto),
hordenina (jęczmień),
zeina (kukurydza)
prolaminy
edestyna (nasiona konopii), glicynina (ziarna soi),
a-laktoglobulina mleka, immunoglubuliny
globuliny
leukozyna żyta, legumelina roślin strączkowych, rycyna,
albumina surowicy, α-laktoalbumina (mleko)
albuminy
histony
salmina (łosoś), klupeina (śledź)
protaminy

Białka złożone
Kazeina mleka (ok. 80% białek), witellina i fosfowityna żółtka jaja
(58 % reszt fosfowityny stanowi P-Ser)
* reszta kwasu fosforowego dołączona do grup –OH Ser, Thr
Fosfoproteidy
hemocjanina, plastocjanina, oksydaza fenolowa, oksydaza askorbinianowa
(Cu), , dehydrogenaza alkoholowa (Zn), nitrogenaza (Mo)
Metaloproteidy
hemoglonbina, mioglobina, cytochromy, katalaza, peroksydaza
Chromoproteidy
β
-lipoproteina osocza
Lipoproteidy
owomukoid jaja, γ-globulina krwi
• przyłączanie oligosacharydów przez wiązanie O-glikozydowe (do Ser,
Thr), N-glikozydowe (do N-końcowych grup NH
2
np. Lys, Asn),
• połączenia estrowe z Glu, Asp
Glikoproteidy
kompleksy kwasów nukleinowych (DNA) z białkami (histony, protaminy,
białka niehistonowe chromosomów), białka wirusowe
Nukleoproteidy
Document Outline
- Łańcuch polipeptydowy tworzą: regularnie powtarzający się układ wiązań szkieletu i charakterystyczne łańcuchy boczne (R1, R2,
- Oligopeptydy i polipeptydy są często hormonami
- Grupa peptydowa jest sztywnym i płaskim elementem strukturalnym
- Mostek dwusiarczkowy (-S-S-) powstaje z grup tiolowych dwu reszt cysteiny (-SH). Produktem reakcji jest reszta cystyny.
- Klasyfikacja białek na podstawie ich funkcji biologicznej
- Wartości punktu izoelektrycznego niektórych białek
- Białka proste
- Białka złożone
Wyszukiwarka
Podobne podstrony:
Białka wiążące wapń
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
BM1 Białka
04) Kod genetyczny i białka (wykład 4)
Wyklad 03 Białka3
BIOSYNTEZA BIAŁKA
Białka 08 06 05
Białka
Białka
bialkaII
BIAŁKA DO 10, Studia, 1-stopień, inżynierka, Ochrona Środowiska, Od Agaty
Regulacja białka supresorowego nowotworów p53. Biologia molekularna. Seminarium 1, biologia- studia
Oczyszczanie ludzkiego białka P2 na drodze chromatografii powinowactwa
mater białka instrukcja wykonania doświadczenia
Referat białka
Sprawozdanie białka
więcej podobnych podstron