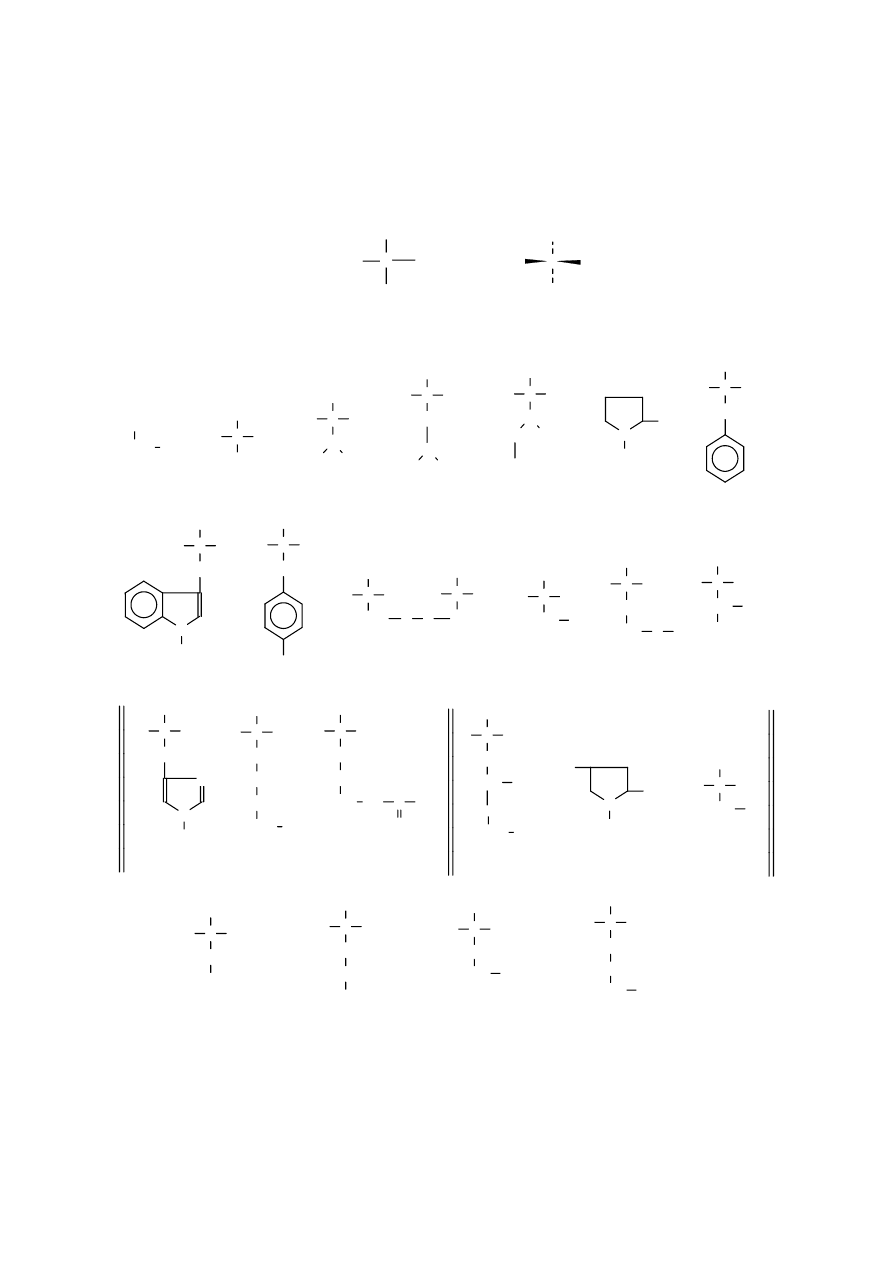
11
3. Aminokwasy, peptydy i białka
3.1. Aminokwasy
Wszystkie aminokwasy wchodzące w skład białek mają konfigurację
L
i należą do grupy
aminokwasów, to znaczy mają grupę aminową przy węglu sąsiadującym z grupą karboksylową.
Ogólny ich wzór jest następujący:
W organizmach żywych występują również aminokwasy nie będącymi składnikami białek.
Poniżej podano wzory najwazniejszych aminokwasów spotykanych w przyrodzie ożywionej.
Aminokwasy spotykane w białkach
C
COO
-
R
+
H
3
N
H
C
H
R
COO
-
+
H
3
N
lub
hydroksylizyna
C NH
2
COOH
CH
3
H
C NH
2
COOH
CH
H
H
3
C
CH
3
C NH
2
COOH
CH
H
CH
3
OH
CH
2
COOH
NH
2
glicyna
C NH
2
COOH
CH
2
H
CH
H
3
C
CH
3
C NH
2
COOH
CH
H
CH
3
H
2
C
H
3
C
alanina
walina
leucyna
izoleucyna
N
H
COOH
prolina
C NH
2
COOH
CH
2
H
OH
C NH
2
COOH
CH
2
H
S S
C NH
2
COOH
CH
2
H
cystyna
C NH
2
COOH
CH
2
H
CH
2
CH
2
CH
2
NH
2
C NH
2
COOH
CH
2
H
OH
seryna
treonina
tyrozyna
N
H
COOH
HO
hydroksyprolina
C NH
2
COOH
CH
2
H
SH
cysteina
C NH
2
COOH
CH
2
H
CH
2
CH
2
NH C NH
2
NH
lizyna
arginina
C NH
2
COOH
CH
2
H
N
N
H
histydyna
CH
2
CH
2
NH
2
C NH
2
COOH
CH
2
H
CH OH
C NH
2
COOH
CH
2
H
fenyloalanina
C NH
2
COOH
CH
2
H
N
H
tryptofan
C NH
2
COOH
CH
2
H
CH
2
S CH
3
metionina
C NH
2
COOH
CH
2
H
COOH
kwas
asparaginowy
C NH
2
COOH
CH
2
H
CH
2
COOH
kwas
glutaminowy
C NH
2
COOH
CH
2
H
CO NH
2
asparagina
C NH
2
COOH
CH
2
H
CH
2
CO NH
2
glutamina
12
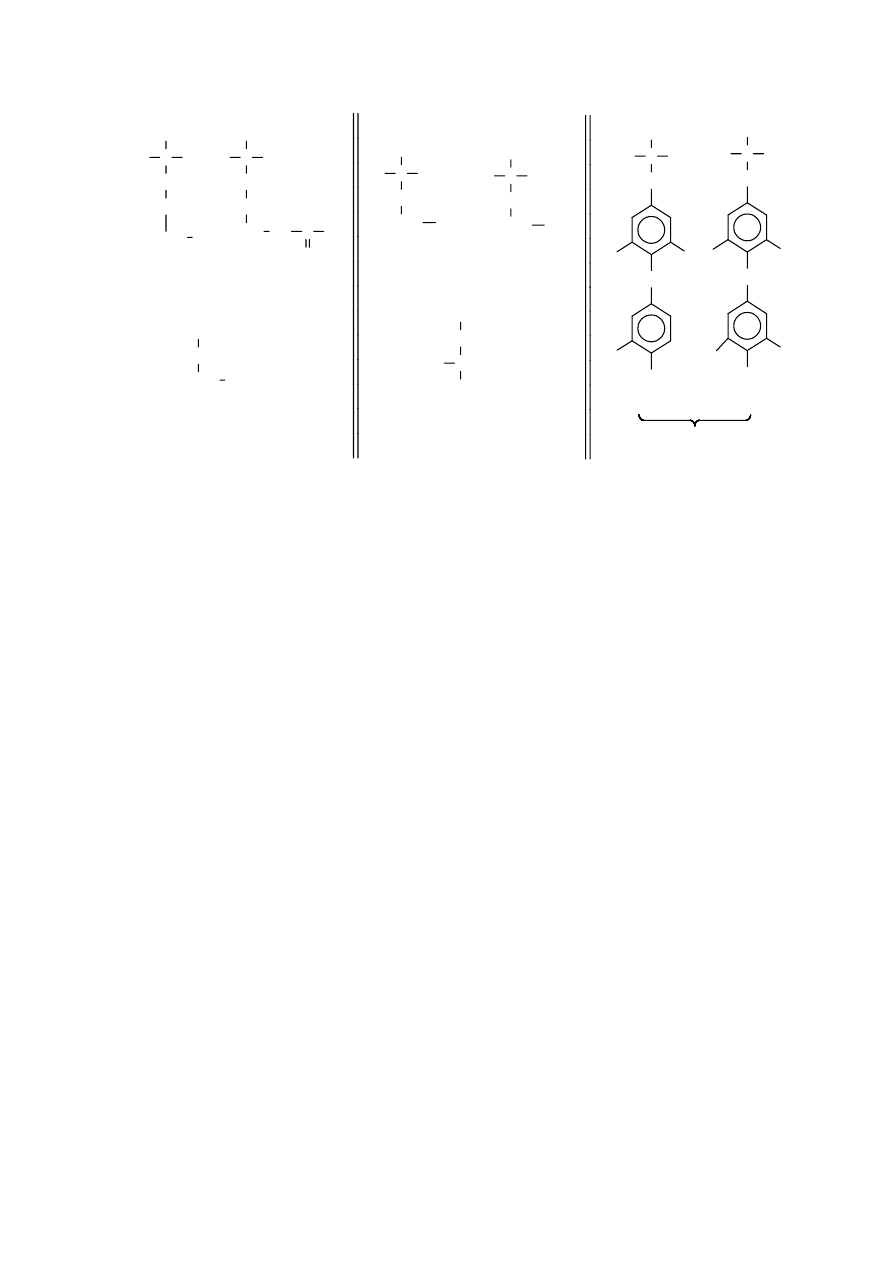
Aminokwasy niebiałkowe
Tyroksyna i trijodotyronina pochodne nie występującej w przyrodzie tyroniny, występują jedynie
w tyreoglobulinie, hormonalnym białku tarczycy. β-alanina, karnityna oraz N-metylohistydyna są
aminokwasami biologicznie czynnymi lub też są składnikami biologicznie czynnych substancji
niskocząsteczkowych. Homocysteina i homoseryna są metabolitami pośrednimi przemian metioniny i
cysteiny. Kwas β-aminomasłowy jest produktem końcowym rozkładu nukleotydów pirymidynowych.
Z kolei ornityna i cytrulina biorą udział w syntezie mocznika.
Aminokwasy o konfiguracji D występują w przyrodzie rzadko i to wyłącznie w związkach
względnie prostych, nie będącymi białkami (np. w niektórych antybiotykach pochodzenia
bakteryjnego o budowie peptydowej).
W laboratoriach sztucznie otrzymuje się całą gamę aminokwasów nie spotykanych w przyrodzie
ożywionej. Z ich wykorzystaniem np. do produkcji leków wiąże się duże nadzieje.
Podział α-aminokwasów
Poszczególne α-aminokwasy różnią się strukturą rodnika. Stosuje się różne kryteria ich podziału
Rozróżnia się aminokwasy alifatyczne i aromatyczne, a w zależności od ilości grup aminowych i
karboksylowych aminokwasy mono- lub di- aminowe lub karboksylowe. Rodniki aminokwasów
cysteiny i metioniny w swojej budowie zawierają atom siarki (są to aminokwasy siarkowe). Rodniki
waliny, leucyny i izoleucyny posiadają rozgałęziony łańcuch alifatyczny (aminokwasy rozgałęzione).
Prolina jest z kolei iminokwasem (kwasem pirolidyno-karboksylowym).
Często aminokwasy dzieli się biorąc pod uwagę hydrofobowość lub hydrofilowość łańcucha
bocznego. Aminokwasy z niepolarnymi rodnikami węglowodorowymi (glicyna, alanina, walina,
leucyna i izoleucyna) lub zawierające grupę funkcyjną o znikomej polarności (prolina, fenyloalanina,
tryptofan, metionina i cystyna) zalicza się do aminokwasów hydrofobowych.
Z punktu widzenia wartości pokarmowych (dietetycznych) aminokwasy dzieli się na egzogenne
(niezbędne) i endogenne (nie niezbędne). Aminokwasy egzogenne muszą być dostarczone
organizmowi zwierzęcemu z zewnątrz (np. z pokarmem), z uwagi na zanik zdolności do ich
syntetyzowania. Dla człowieka niezbędnymi aminokwasami są w al i n a , l e ucyn a , i zol eu c yn a ,
f e n yl o al an i n a, t r yp t of a n, t r e o ni na , me t i oni na i l i zyn a .
C NH
2
COOH
CH
2
H
CH
2
CH
2
NH C NH
2
O
C NH
2
COOH
CH
2
H
CH
2
CH
2
NH
2
ornityna
cytrulina
CH
2
NH
2
CH
2
COOH
-alanina
C NH
2
COOH
CH
2
H
O
OH
J
J
J
C NH
2
COOH
CH
2
H
O
OH
J
J
J
J
trijodotyronina
tyroksyna
tyreoglobulina
C NH
2
COOH
CH
2
H
CH
2
SH
C NH
2
COOH
CH
2
H
CH
2
OH
homocysteina
homoseryna
CH
2
COOH
CH
CH
3
H
2
N
*
kwas
-aminomaslowy
13
3.2. Peptydy
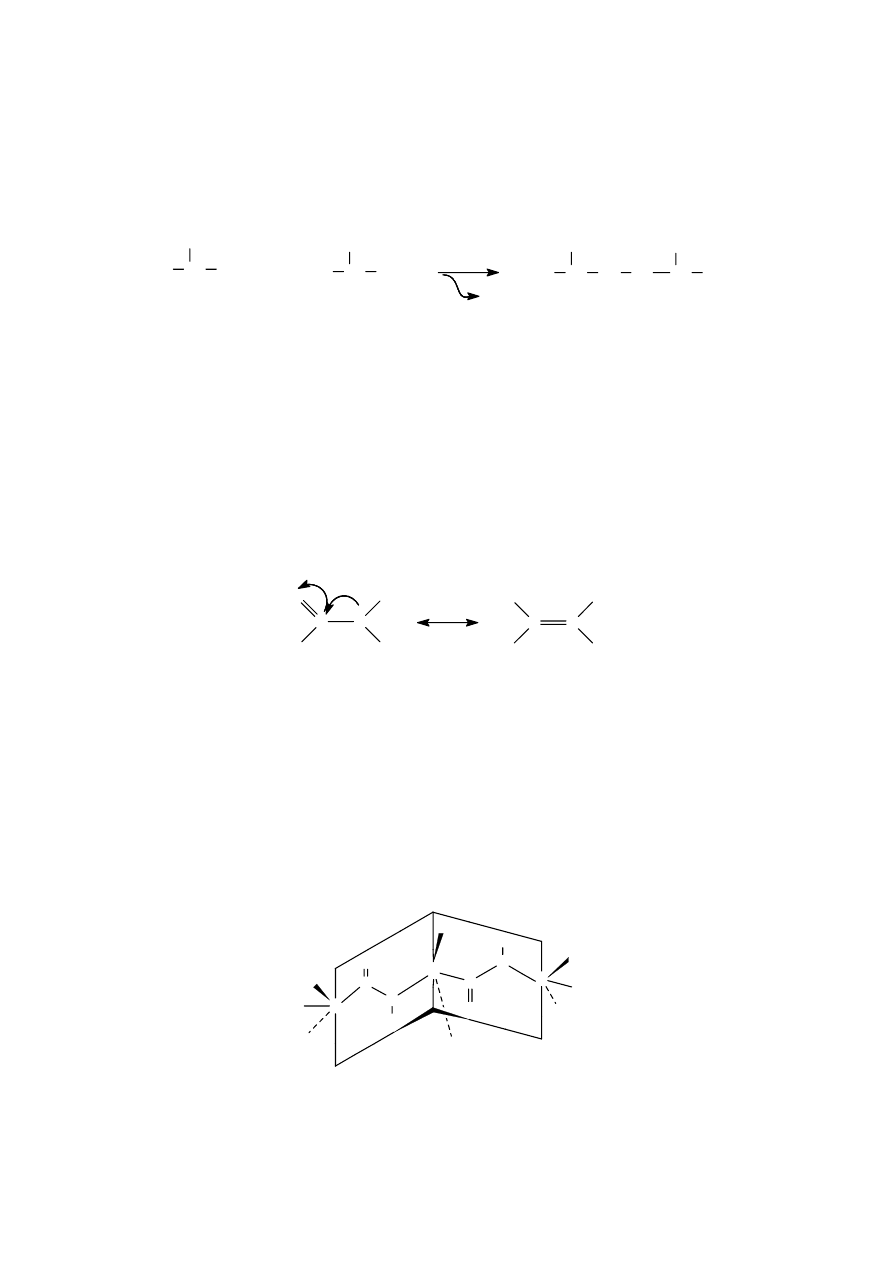
Grupa aminowa jednego α-aminokwasu może reagować z grupą karboksylową innego
α-aminokwasu tworząc w i ą za n i e p ep t yd o we
–CO–NH–
, które z chemicznego punktu widzenia
jest szczególnym przypadkiem wiązania amidowego (co ma pewne znaczenie, z uwagi na
specyficzność działania niektórych enzymów). Związki powstałe z takiego połączenia nazwano
p e pt yd a mi .
Podane wyżej równanie przedstawia jedynie schemat syntezy peptydu i jego uproszczony wzór, nie
uwzględniający budowy przestrzennej.
3.2.1. Budowa peptydów - wiązanie peptydowe
Badania krystalograficzne wykazały, że wiązanie C–N w wiązaniu peptydowym jest znacznie
krótsze niż zwyczajne pojedyncze wiązanie tego typu. Jest to spowodowane, mezomerycznym
charakterem wiązania peptydowego (hybrydyzazja typu sp
2
). Wynikiem tej mezomerii jest brak
swobodnego obrotu wokół wiązania C – N i stąd istnienie tylko dwóch stabilnych konformacji cis i
trans. Ogólnie w natywnych peptydach i białkach występuje głównie forma trans.
Zgodnie z tym właściwsze jest przedstawianie wiązania peptydowego za pomocą dwu wzorów
granicznych lub wzorem, na którym symbolicznie zaznaczono delokalizację elektronów.
Z badań rentgenograficznych wynika, że konfiguracja wiązania peptydowego nie zależy od rodzaju
i właściwości łańcuchów bocznych aminokwasów tworzących wiązanie. Wyjątek pod tym względem
stanowi prolina i hydroksyprolina, których grupy iminowe związane są z łańcuchami bocznymi.
Delokalizacja elektronów w wiązaniu peptydowym sprawia, że wszystkie cztery jego atomy:
CONH a również i oba atomy C
α
łańcuchów bocznych, leżą w jednej płaszczyźnie (mówi się o
planarności wiązania peptydowego). W konsekwencji wiązanie łączące atom węgla i azotu wykazuje
znaczną sztywność właściwą wiązaniu podwójnemu, a swobodny obrót wokół niego wymaga
przezwyciężenia oporu około 88 kJ/mol. Na poniższym rysunku przedstawiono perspektywicznie
strukturę wiązania peptydowego w hipotetycznym dipeptydzie.
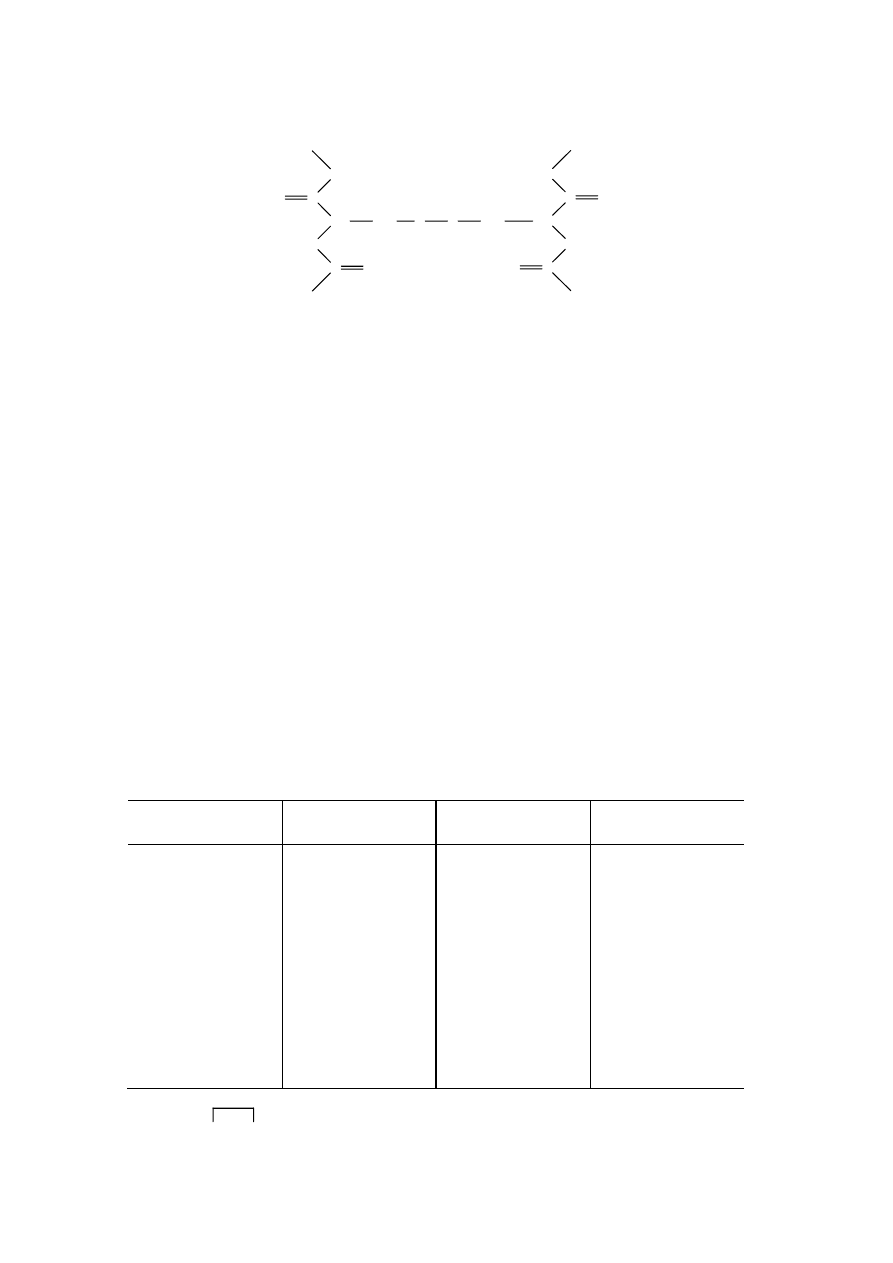
Drugim ważnym wiązaniem kowalencyjnym, spotykanym w cząsteczkach peptydów, jest wiązanie
disulfidowe (disiarczkowe), tworzone przez sąsiadujące ze sobą grupy tiolowe – SH pochodzące z reszt
cysteiny. Rozróżnia się wewnątrzłańcuchowe wiązania disulfidowe, które występują w tym samym
CH
H
2
N
R
1
COOH +
CH
H
2
N
COOH
R
2
H
2
O
CH
H
2
N
R
1
CO NH
CH COOH
R
2
aminokwas 1
aminokwas 2
dipeptyd
C
N
O
C
H
C
C
N
C
H
C
O
+
-
..
-
+
delokalizacja elektronow w wiazaniu peptydowym
H
H
H
R
2
H
N
O
C
C
H
N
O
C
C
C
H
2
N
R
1
COOH
R
2
14
łańcuchu peptydowym, oraz międzyłańcuchowe wiązania disulfidowe występujące między dwoma
różnymi łańcuchami peptydowymi:
Wewnątrzcząsteczkowe wiązania S – S występują np. w oksytocynie, wazopresynie, w łańcuchu A
insuliny i w rybonukleazie. Wiązania te mogą spowodować, że części cząsteczki o zupełnie różnych
sekwencjach znajdują się w bezpośrednim zbliżeniu, jak np. w rybonukleazie. W utlenionej formie
glutationu dwa identyczne łańcuchy peptydowe połączone są przez kowalencyjne wiązanie disulfidowe.
W insulinie w ten sam sposób połączone są dwa różne łańcuchy.
Sąsiadujące ze sobą wiązania peptydowe, np. w dwu równoległych peptydach, mogą tworzyć
wiązania wodorowe >CO...HN<, w których odległość atomu tlenu od atomu azotu wynosi nieco mniej
niż 0,3 nm.
Oprócz tych wiązań, czynnikami mającymi wpływ na przyjęcie przez cząsteczkę peptydu
określonej konformacji są oddziaływania kwasowych, zasadowych, aromatycznych i alifatycznych
łańcuchów bocznych różnych aminokwasów ze sobą lub z łańcuchem głównym peptydu. Te
oddziaływania, zwykle stabilizujące, staja się w pełni efektywne dopiero w białkach, niemniej mają one
także znaczenie dla utrzymania odpowiednich efektywnych konformacji wielu polipeptydów
biologicznie aktywnych.
3.2.2. Nazwy i wzory peptydów
Nazwy peptydów są tworzone w zależności od liczby rodników aminoacylowych tworzących
cząsteczkę peptydu. Peptyd zbudowany z dwu aminokwasów nazywa się dipeptydem, z trzech —
tripeptydem, z dziesięciu — dekapeptydem, itp. Peptydy zawierające w cząsteczce do 10 rodników
aminoacylowych nazywa się o l i go pe pt yd a mi , zawierające zaś większą liczbę —
p o l i pe pt yd a mi . Te ostatnie stanowią przejście do białek (zaliczanych do makropeptydów), których
cząsteczki są zbudowane ze 100 i więcej rodników aminoacylowych.
Tabela 1.2. Nazwy i symbole najpospolitszych
-aminokwasów
Rodnik
aminoacylowy
Symbol
Rodnik
aminoacylowy
Symbol
Alanyl
Arginyl
Aspargil
Asparginyl
Cysteil
Cysteinyl
Fenyloalanyl
Glicyl
Glutamil
Glutaminyl
Histydyl
Hydroksylizyl
Ala
Arg
Asp
Asn lub Asp(NH
2
)
Cys
Cys
Cys
1
Fen (Phe)
Gli (Gly)
Glu
Gln lub Glu(NH
2
)
His
Hyl lub Liz(OH)
Hydroksyprolil
Izoleucyl
Leucyl
Lizyl
Metionyl
Ornityl
Prolina
Seryl
Treonyl
Tryptofanyl
Tyrozyl
Walil
Hyp lub Pro(OH)
Ileu (Ile)
Leu
Liz (Lys)
Met
Orn
Pro
Ser
Tre (Thr)
Try (Trp)
Tyr
Wal (Val)
W nawiasach podano symbole zalecane przez Unię Biochemiczną.
1
również Cys Cys
C
HN
CH
C
O
O
NH
CH
2
S
S
H
2
C
C
HN
O
HC
NH
C
O
mostek disiarczkowy
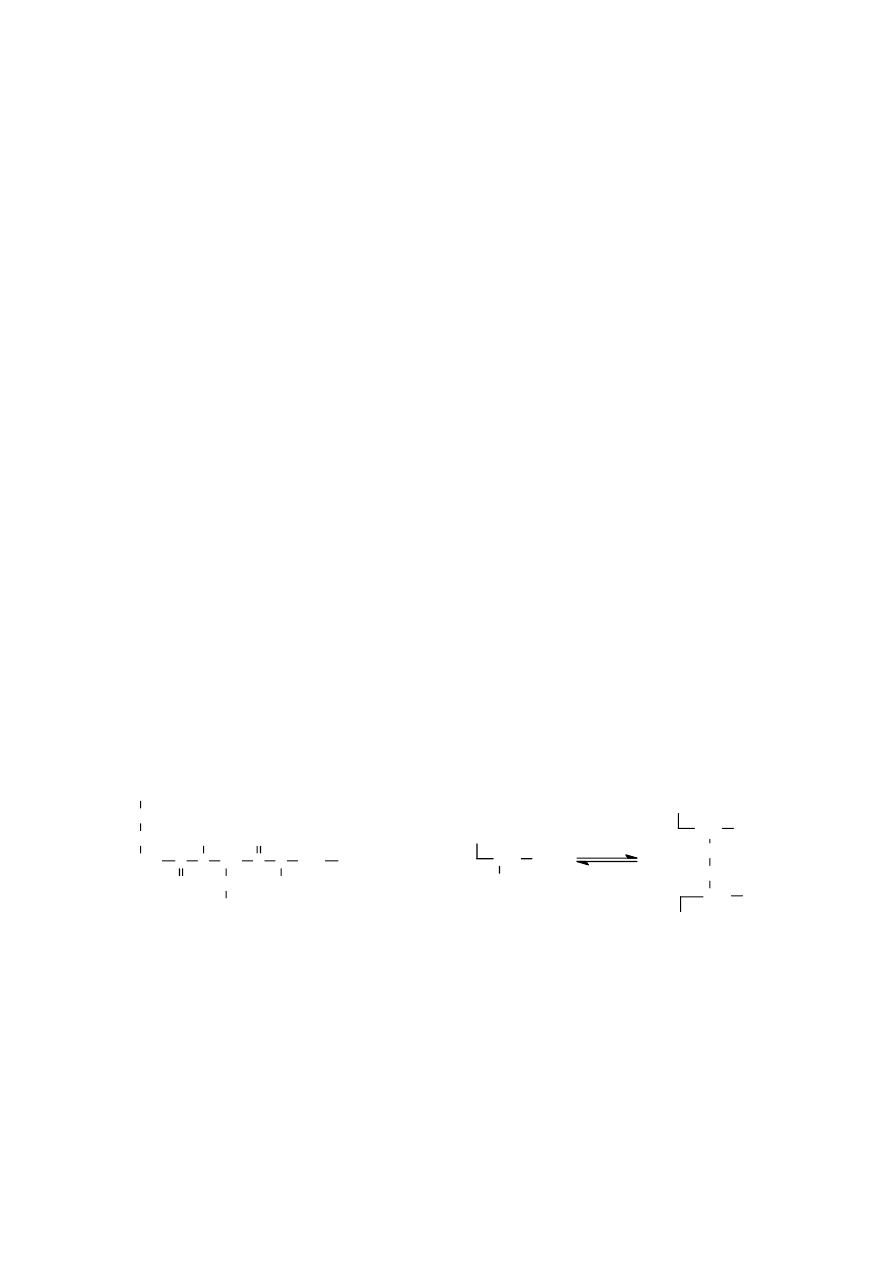
15
Szczegółowe nazwy peptydów są albo zwyczajowe, albo mają charakter systematycznych nazw
chemicznych określających je jako aminoacyloaminokwasy. Na przykład tripeptyd zbudowany z
glicyny, alaniny i cysteiny nosi nazwę glicyloalanylocysteiny. Nazwa ta podaje skład aminokwasowy
peptydu i jednocześnie kolejność łączenia się aminokwasów. I tak tripeptyd wspomniany wyżej jest
zupełnie różnym od alanyloglicylocysteiny, peptydu zbudowanego z identycznych aminokwasów, ale
połączonych w innej kolejności.
W celu uproszczenia zapisywania wzorów peptydów i uniknięcia długich nazw, ustalono, by
rodniki aminoacylowe oznaczać pierwszymi trzema literami nazwy aminokwasu. W tabeli 1.2 podano
nazwy i symbole rodników najpospolitszych
-aminokwasów.
Przy pisaniu wzorów peptydów symbole łączy się krótką kreską, przy czym lewa strona symbolu
odpowiada grupie aminowej, a jego prawa strona - grupie karboksylowej. Wzory przytoczonych wyżej
tripeptydów można więc zapisać symbolicznie: Gli-Ala-Cys oraz Ala-Gli-Cys. Jeżeli zachodzi
specjalna potrzeba wyraźnego wskazania kierunku, w jakim połączone są ze sobą cząsteczki
aminokwasów w peptydzie (np. przy przedstawianiu struktury peptydów pierścieniowych) wówczas
zaznacza się strzałką
kierunek powstawania wiązań od grupy karboksylowej do aminowej:
Gli
AlaCys. Jeżeli kolejność łączenia się aminokwasów nie jest znana dla jakiegoś fragmentu
łańcucha polipeptydowego, to fragment ten ujmuje się w nawiasy, wewnątrz których symbole oddziela
się przecinkami, np. Gli-Ala-Cys-(Arg, Tyr, Leu)-Pro-Ala-Fen. Końcowy aminokwas z wolną grupą
aminową, tzw. N-terminalny aminokwas, symbolizuje się dopisaniem litery H- lub H
2
N-, zaś końcowy
aminokwas z wolną grupą karboksylową, czyli C-terminalny aminokwas, dodaniem liter -OH lub -
COOH: H-Gli-Ala-Cys-OH lub H
2
N-Gli-Ala-Cys-COOH.
3.2.3. Ważniejsze peptydy naturalne
W ciągu ostatnich 20 lat liczba peptydów znalezionych w materiale zwierzęcym, roślinnym i
bakteryjnym ogromnie wzrosła. Większość znajdowanych w przyrodzie peptydów składa się
wyłącznie z aminokwasów, które zwykle spotykamy w białkach. Jednak w naturalnych peptydach
często występują inne proste aminokwasy, takie jak β-alanina i kwas γ-aminomasłowy.
Najprostszym i jednocześnie najwcześniej poznanym dipeptydem wyodrębnionym z tkanek była
ka r n o zyn a , czyli
-alanylohistydyna. Obok niej w mięśniach kręgowców spotyka się także
anserynę:
-alanylo–N-metylohistydynę. Rola obydwu dipeptydów jest do dzisiaj nie poznana.
Glutation (GSH) jest tripeptydem, który szeroko rozpowszechniony jest w zarówno w tkankach
zwierzęcych jak i roślinnych. Zawiera on kwas glutaminowy, cysteinę i glicynę. Był pierwszym
znanym peptydem zawierającym wiązanie inne niż α-peptydowe.
Związek ten łatwo ulega odwracalnym przemianom oksydacyjno-redukcyjnym. Reakcja
utlenienia jest katalizowana solami Cu i Fe. Redukcja disulfidu i przekształcenie do GSH
katalizowane jest przez reduktazę glutationową.
Funkcje biochemiczne glutationu są bardzo różne. Jest to koenzym hydrolazy
hydroksyacyloglutationowej, dehydrogenazy formaldehydowej, tautomerazy indolilopirogronianowej,
izomerazy maleiloacetooctanowej i innych enzymów. Stanowi on również grupę prostetyczną
dehydrogenazy fosfogliceroaldehydowej oraz odgrywa pewną rolę w działaniu dehydrochlorynazy
DDT, którą odkryto w odpornych na DDT muchach domowych. Glutation jest także bardzo ważnym
związkiem w wielu biologicznych reakcjach redox, ponieważ może stabilizować wolne grupy – SH.
COOH
CH-NH
2
CH
2
CH
2
C N
O
H
CH
CH
2
SH
C
O
N
H
CH
2
COOH
glutation
Glu
Cys
SH
Gli
2
-2H
+
Glu
Cys Gli
S
S
Cys Gli
Glu
utlenianie i redukcja glutationu

16
Biosynteza glutationu zachodzi następująco:
Glu + Cys +ATP → Glu(Cys) + ADP + H
3
PO
4
I
Gly + Glu(Cys) + ATP → Glu(Cys-Gly) + ADP + H
3
PO
4
II
Reakcja I jest katalizowana przez syntetazę γ-glutamylocysteinową, a reakcja II przez syntetazę
glutationową.
Hormony peptydowe
H o r mo n y są substancjami chemicznymi, produkowanymi w specjalnych organach lub tkankach
i przynoszonymi do miejsca działania poprzez układ krwionośny. Ta chemicznie zróżnicowana grupa
substancji – regulatorów, między innymi, obejmuje pewną liczbę peptydów i białek. Znaczna liczba
hormonów peptydowych i białkowych produkowana jest w gruczołach wydzielania wewnętrznego
(podwzgórze, przysadka, tarczyca, przytarczyce, komórki Langerhansa w trzustce, itp.). Pozostała
część jest produkowana w specjalnych tkankach. Na tej podstawie rozróżniamy hormony gruczołowe i
tkankowe.
Wiele ze znanych hormonów peptydowych ma prekursory białkowe, z których w skutek
działania enzymów następuje uwalnianie aktywnych związków. Typowymi przykładami są
angiotensyna, bradykinina, kalidyna i insulina. Przypuszcza się, że podobne metaboliczne prekursory
istnieją dla wazopresyny, gastryny, glukagonu, hormonu paratyreotropowego i ACTH. Najpierw, na
rybosomach zachodzi synteza biologicznie nieaktywnych prekursorów o dużej masie cząsteczkowej.
Następnie jeden lub więcej enzymów uwalnia hormony lub prohormony. Okres półtrwania wolnych
hormonów nie przekracza zwykle 30 min. Są one dezaktywowane przez różne egzo i endopeptydazy.
A n gi o t e ns yn a I I zaliczana do oligopeptydów jest oktopeptydem wytwarzanym w nerkach o
wzorze: H-Asp-Arg-Wal-Tyr-Ileu-His-Pro-Fen-OH. Hormon ten powoduje wzrost ciśnienia krwi i
pobudza wytwarzanie hormonów kory nadnercza. Jest to jeden z najefektywniejszych regulatorów
ciśnienia krwi. Związek ten wywołuje silny skurcz naczyń krwionośnych, przez co automatycznie
zwiększa się ciśnienie krwi.
Peptydy regulacyjne
Od czasów odkrycia pierwszych hormonów rośnie stale liczba „chemicznych posłańców”, czyli
związków niosących określoną informację biologiczną od komórek wydzielniczych do komórek
docelowych. Ostatnie 20 lat przyniosło wiele doniesień na temat nieznanych dotąd peptydów o
aktywności: hormonalnej, neuromodulacyjnej, immunoregulacyjnej i mitogennej. Wszystkie te
peptydy określane są często wspólną nazwą p ep t yd ów r e gul ac yj n yc h .
Przyjmuje się obecnie trzy podstawowe sposoby przekazywania informacji międzykomórkowej z
udziałem peptydów regulacyjnych: endokrynny, parakrynny i autokrynny.
(1)
Transport endokrynny, w którym peptyd syntetyzowany przez wyspecjalizowane
komórki wydzielany jest do krwioobiegu i przenoszony z krwią do komórek docelowych. Ten
sposób transportu jest typowy dla hormonów dokrewnych.
(2)
Hipoteza transportu parakrynnego zakłada, że peptydy regulacyjne przenoszone są w
drodze dyfuzji międzykomórkowej. Przypuszczalnie wiele peptydów działa lokalnie tą drogą.
Podobny sposób transportu (neuroparakrynny) przyjmuje się w przypadku przenoszenia sygnału
przez synapsy chemiczne w obrębie układu nerwowego.
(3)
Hipoteza regulacji autokrynnej przyjmuje, że komórkami docelowymi są te same
komórki, które syntetyzują peptyd regulacyjny. Regulacja autokrynna ma przypuszczalnie istotne
znaczenie w kontroli wzrostu komórek neoplastycznych, aczkolwiek autoregulacja jest zjawiskiem
stwierdzonym wielokrotnie w hodowlach komórek nietransformowanych.
Antybiotyki o budowie peptydowej peptydowe
Liczne antybiotyki wytwarzana przez mikroorganizmy mają budowę peptydową. Niektóre z nich
produkowane są na skalę przemysłowa w oparciu o wgłębną hodowlę bakterii Bacillus. Jako przykład
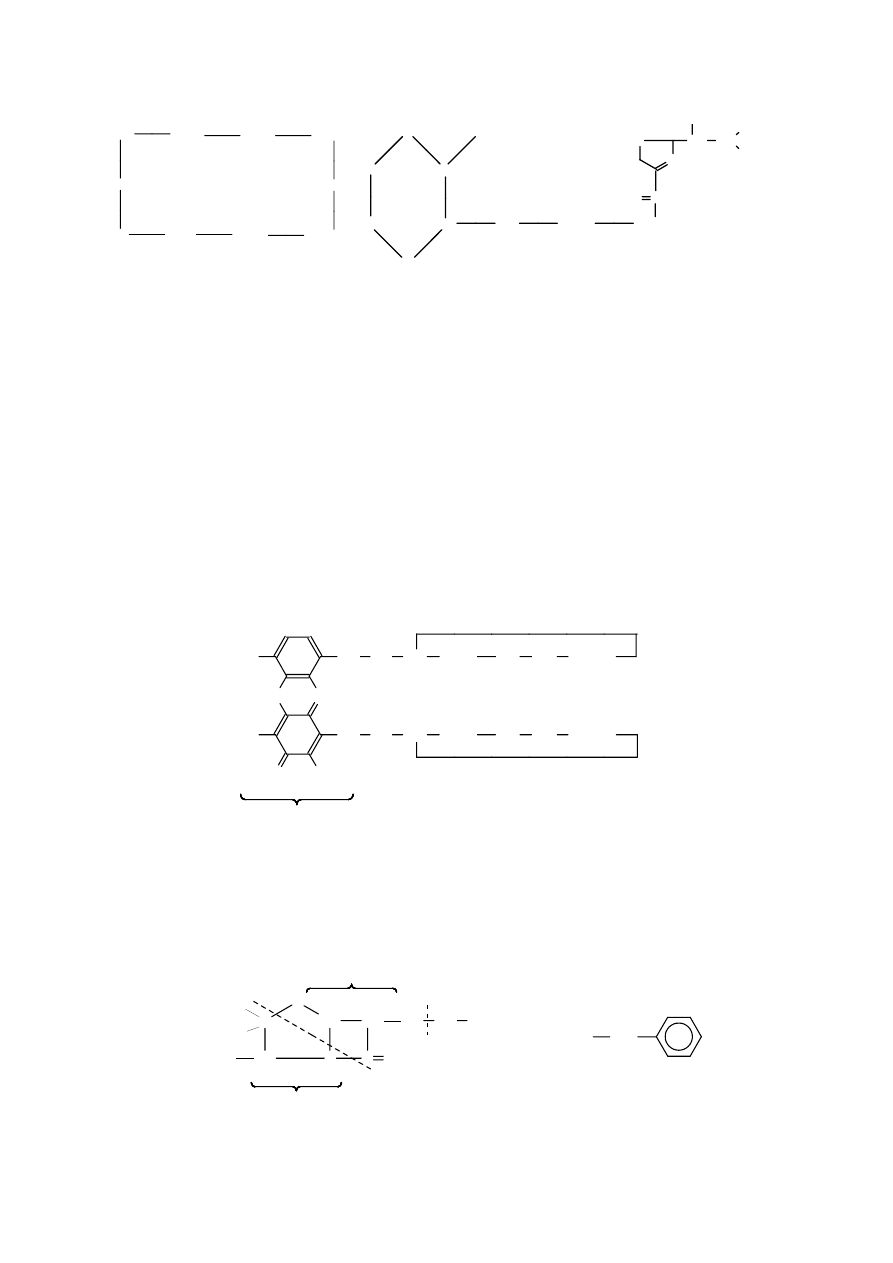
można wymienić gr a mi c yd yn ę S, pierścieniowy dziesięciopeptyd wytwarzany przez Bacillus
brevis. Gramicydynę S stosuje się jako składnik maści i roztworów używanych zewnętrznie do
leczenia owrzodzeń oraz zainfekowanych ran i oparzeń.
17
Bakterie Bacillus brevis wytwarzają jeszcze inne antybiotyki, m.in. t yr o c yd yn y A, B i C,
będące również cyklicznymi oligopeptydami, zawierającymi
-
D
-fenyloalaninę, podobnie jak
gramicydyna S. Znanych jest obecnie ponad 25 antybiotyków wytwarzanych przez różne szczepy tych
bakterii.
Innym przykładem antybiotyku o budowie peptydowej jest b ac yt r a c yn a , wytwarzana na skalę
przemysłową (m.in. w PZF „POLFA” w Pabianicach) w oparciu o hodowlę bakterii Bacillus subtilis.
Poszczególne szczepy bakterii Bacillus subtilis produkują ponad 65 antybiotyków o budowie
polipeptydowej. Z kolei Bacillus polymyxa wytwarza p o l i my ks yn y. Wszystkie te antybiotyki
działają na bakterie gramujemne, gramdodatnie i grzyby. Ich działanie jest różne. Niektóre blokują
syntezę ściany komórkowej lub zakłócają funkcje błon biologicznych, inne, mniej liczne, zakłócają
replikację, transkrypcję lub translację.
A kt yn o m yc yn y (nazywane chromopeptydami gdyż zawierają chromofor) są bardzo
toksycznymi antybiotykami produkowanymi przez różne gatunki Streptomyces. Wydzielono i
wykrystalizowano więcej niż 20 różnych związków należących do tej grupy. Różnią się one jedynie
sekwencja aminokwasową układu cyklicznego zbudowanego z dwóch pierścieni laktonowych
przyłączonych do aktynocyny wiązaniami amidowymi. W tej grupie antybiotyków, a kt yn o myc yn a
C
1
wykazuje najsilniejsze działanie przeciwbakteryjne.
P e ni c yl i na jest najstarszym i najlepiej poznanym antybiotykiem - mówi się o niej, że jest
prototypem antybiotyków. Jej budowa ma jednak mało wspólnego z peptydami, tym niemniej
rozpatruje się ją przy okazji omawiania antybiotyków o budowie peptydowej. W niektórych
publikacjach mówi się o pseudopeptydowej budowie penicyliny:
D-Fen
L-Wal
L-Orn
L-Pro
L-Leu
L-Leu
L-Wal
L-Orn
D-Fen
L-Pro
gramicydyna S
aktynocyna
Aktynomycyna C1
O
N
CO
CO
H
3
C
H
3
C
NH
2
O
NH
NH
Thr
Thr
Sar
Pro
Me-Val
D-Val
D-Val
Me-Val
Pro Sar
Sar = sarkozyna (N-metyloglicyna)
Me-Val = metylowalina
cysteina
C
HC
N
CH
S
C
CH
O
H
3
C
H
3
C
HOOC
NH CO R
walina
R =
CH
2
benzylopenicylina
penicylina
N
S
CH
NH
2
CH
CH
2
-CH
3
CH
3
C
O
D-Glu
L-Leu
L-His
D-Fen
L-Asp
L-Ile
D-Orn
D-Asn
L-Liz
L-Ile
bac ytracy na
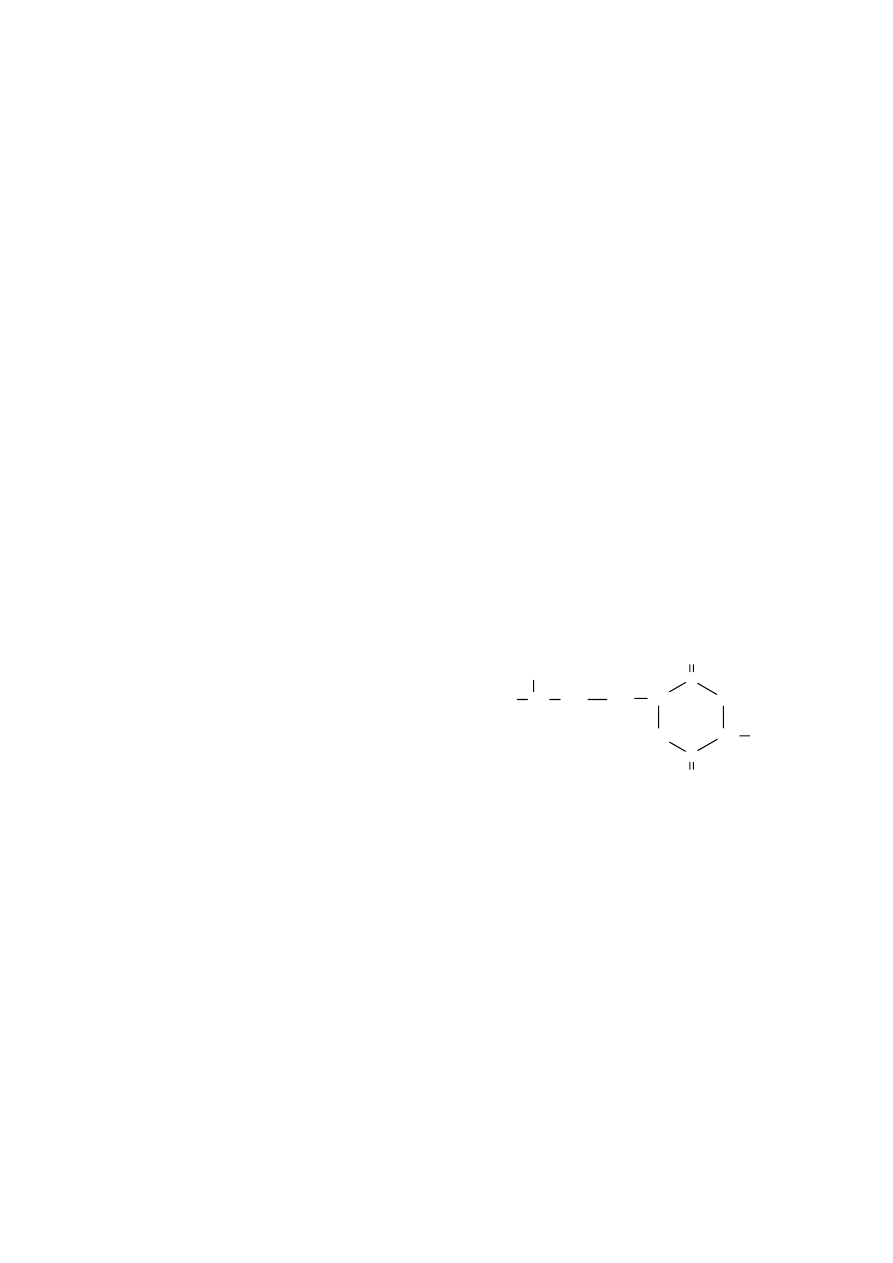
18
Wytwarzana jest przez pleśń Penicillium notatum. Biogeneza jej wynika z połączenia waliny
oraz cysteiny. W jej cząsteczce występuje silnie napięty czteroczłonowy pierścień
-laktamowy oraz
drugi pierścień zawierający siarkę. Grupa aminowa cysteiny jest N-acylowana, przy czy rodnik R
kwasu acylującego może mieć różną naturę. Np. benzylopenicylina zawiera rodnik benzylowy.
Depsipeptydy
Nazwa d e p s i p ept yd , jest kombinacją terminów depsyd (ester hydroksykwasu) i peptyd.
Nazwę tę zaproponował Szemiakin w 1953 roku w celu określenia związków, które zawierają
zarówno wiązania estrowe jak i peptydowe.
R
1
R
2
R
1
R
2
R
1
│ │ │ │ │
- NH – CH – CO – O – CH – NH – CH - CO – O – CH – CO – NH – CH – CO –
R
1
- reszty aminokwasu
R
2
– reszta hydroksykwasu
Związki cykliczne tego rodzaju wykryto w dużych ilościach w mieszaninie produktów
metabolizmu bakterii. Wykazują one zadziwiająco duża aktywność antybiotyczną. Szersze
zastosowanie tych związków w medycynie jest ograniczone ze względu na to, że wiązania estrowe
bardzo łatwo ulęgają rozszczepieniu w warunkach sprzyjających hydrolizie.
Do depsipeptydów, zawierających wyłącznie aminokwasy (często także ich pochodne
N-metylowe i D–aminokwasy) i hydroksyaminokwasy, zaliczamy: eniatyny, amidomycynę,
walinomycynę, sporydesmolidy, serratomolid i esperynę.
W innych depsipeptydach mogą istnieć wiązania estrowe utworzone z udziałem grup
hydroksylowych hydroksyaminokwasów, takich jak seryna i treonina. Depsipeptydy mogą także
zawierać skomplikowane jednostki strukturalne, których nigdy nie wykryto w białkach. Do tej grupy
należą:
pektynomycyny,
etamycyna
i
echinomycyna. Depsipeptydy w zależności od ich
struktury dzieli się na O–peptydy, peptolidy i
laktony peptydowe.
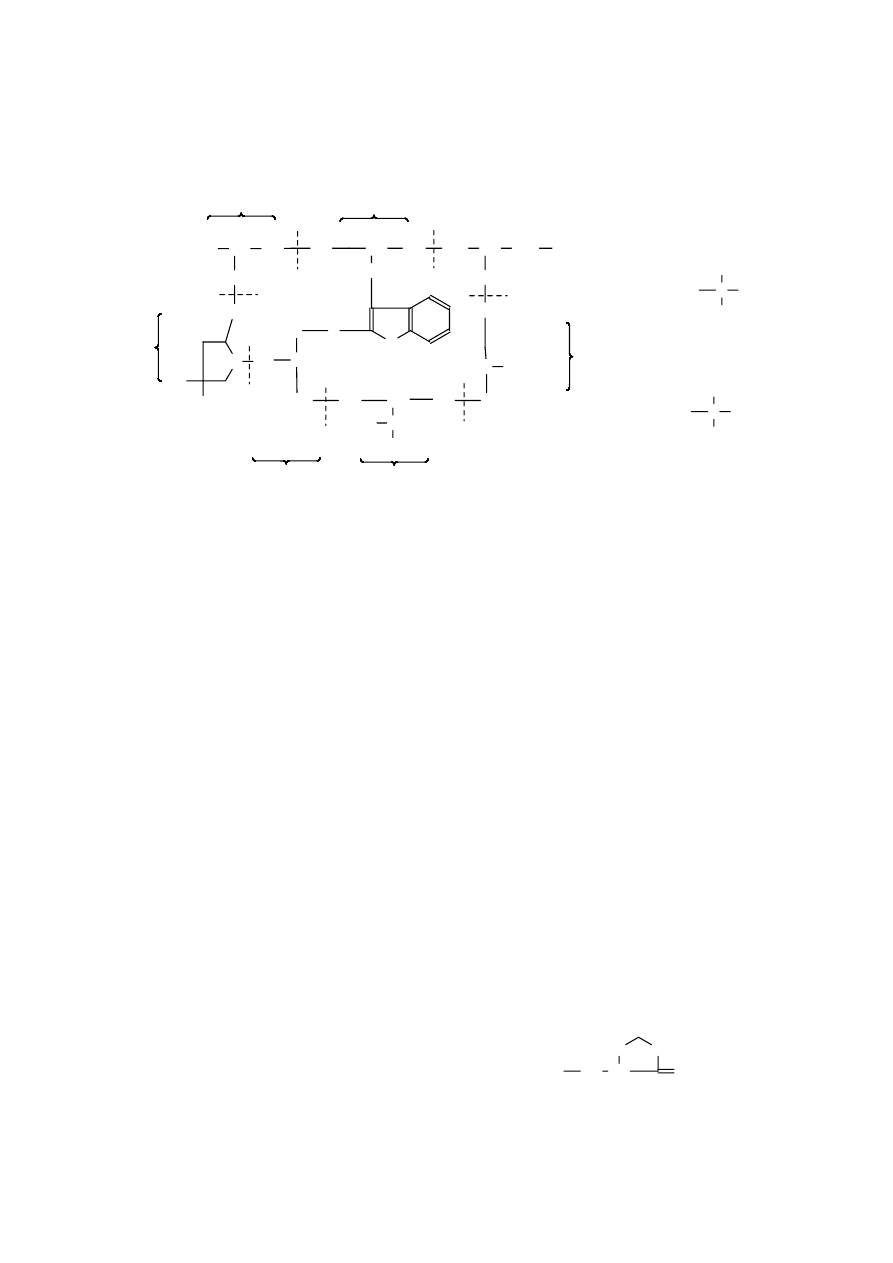
Najprostszym, występującym w przyrodzie
depsipeptydem jest fitopatogenetyczna toksyna z
Pseudomonas tabaci. Cząsteczka tego związku
składa się z cząsteczek kwasu mlekowego i
2,5-diaminoadypinowego, związanych ze sobą w
taki
sposób,
że
powstaje
pierścień
dioksomorfolinowy:
Struktura innego depsipeptydu, a mi d o myc yn y jest do tej pory nie wyjaśniona. Wiadomo
tylko, że depsipeptyd ten składa się z kwasu
D
–hydrosywalerianowego i
D
–waliny. Jego działanie
antybiotyczne polega na hamowaniu wzrostu niektórych mikroorganizmów wywołujących choroby
roślin oraz niektórych typów drożdży.
W al i n o myc yn a , nazywana tak ze względu na dużą zawartość waliny, jest cyklicznym
dwunastopeptydem. Działa ona na M.tuberculosis
Se r r at o mo l i d , cykliczny tetradepsipeptyd, oraz e s p e r yna zawierają β–hydroksykwasy. W
wyniku całkowitej hydrolizy serratomolidu stwierdzono, że zawiera on
L
–serynę i kwas
D-
β-hydroksydekanowy.
Protaminy
Do peptydów zalicza się również p r ot a mi n y , polipeptydy o masie cząsteczkowej rzędu 1
6 kDa
wyizolowane z jąder plemników ryb. Zawierają one znaczne ilości argininy, przekraczające połowę
wszystkich aminokwasów w cząsteczce, stąd wybitnie zasadowe właściwości.
CH
HN
C
CH
O
C
CH
3
O
O
CH
2
CH
2
CH
NH
2
HOOC
depsipeptyd z Pseudomonas tabaci
19
Toksyny peptydowe
Śmiercionośne toksyny zawarte w kapeluszu muchomora Amanita phalloides dzieli się na
fallatoksyny (falloidyna, falloina i fallacydyna) i amatoksyny (α-, β-, γ– amanidyny), które są bardziej
toksyczne, ale działają wolniej. Związki te są cyklicznymi siedmiopeptydami.
Fallacydyna zamiast jednostki Ala–
D-
Thr, wchodzącej w skład falloidyny, zawiera kwas
Val-
D-
erytro–β-hydroksyasparaginianowy.
Amatoksyny, które składają się wyłącznie z
L
–aminokwasów są także siedmiopeptydami
cyklicznymi. Zamiast grupy tioeterowej występuje grupa sulfotlenkowa. O toksyczności stanowi
obecność grupy γ – hydroksylowej w łańcuchu bocznym izoleucyny. Amanulina nie zawiera tej grupy
hydroksylowej i mimo to, że pod względem struktury jest bardzo podobna do γ–amatyliny, jest
nietoksyczna.
Można się całkowicie zabezpieczyć przed działaniem tych toksyn jedynie wtedy, gdy w tym
samym czasie, co toksynę spożyje się odpowiednią dawkę antamanidyny. Zabezpieczające działanie
antamanidyny i niektórych jej analogów związane jest z ich działaniem na błony. Związki te tworzą
kompleksy z jonami K
+
i Na
+
, analogicznie do tworzenia eniatyny i walinomycyny.
Peptydy strepogeninowe
S t r e po ge n i n y pobudzają wzrost bakterii, głównie bakterii kwasu mlekowego. Ich obecność
stwierdzono np. w ekstraktach z wątroby, soku pomidorowym i częściowych hydrolizatach
enzymatycznych, uzyskanych z insuliny, kazeiny, rybonukleazy, itp.
Wzorcową jednostka aktywności strepogeninowej jest przyrost tempa wzrostu Lactobacillus
casei, spowodowany przez działanie 1 mg wzorcowego ekstraktu z wątroby. Aktywność
strepogeninowa produktów syntetycznych związana jest z obecnością cysteiny. Najwyższą aktywność
stwierdzono w przypadku, gdy cysteina jest albo powiązana z N–końcową leucyną, albo umieszczona
między dwoma resztami leucynowymi.
Peptydy endorfinowe
E n d or f i n y to peptydy będące ligandami receptorów opiatowych, tzn. działających podobnie
jak morfina. Najważniejsze z nich – e n kef al i n y –są pentapeptydami. Obok naturalnie
znajdowanych enkefalin (np. Tyr-Gly-Gly-Phe-Leu), w ostatnim czasie wytwarzane są syntetyczne ich
analogi:
syntetyczny analog enkefaliny
Tyr - D-Ala - Gly - Phe - Hse-lakton
Hse-lakton =
C
CH
O
NH
O
H
2
lakton homoseryny
N
CH
2
S
CH CO
NH
H
2
C
CH
NH
CO
HO
CH
3
CH
CH
H
OH
N CO
CO
H
3
C
NH
CH CO
H
NH CH CH
2
CO
R
NH
NH
CO
CH
3
HC
Ala
Trp
Ala
D-Thr
Cys
Hyp
falloidyna: R=
C
CH
2
OH
CH
3
OH
C
CH
3
CH
3
OH
falloina: R=
fallotoksyny
Wyszukiwarka
Podobne podstrony:
# Skrypt Biochemia czesc4 id 30 Nieznany
# Skrypt Biochemia
# Skrypt Biochemia czesc1
# Skrypt Biochemia czesc3(1)
# Skrypt Biochemia spis tresci
# Skrypt Biochemia spis tresci
# Skrypt Biochemia czesc1
Biochemia skrypt AGH
BIOCHEMIA SKRYPT
BIOCHEMIA skrypt 2010 id 86508 Nieznany
chemia zywności wykłady, Zachomikowane, Naukowe, Medycyna, Biochemia, Skrypty
Biochemia zwierząt skrypt UR
biochemia skrypt aminokwasy i bia id 86612
Skrypt - Rozdzial 2 Izolowanie i amplifikacja kwasów nukleinowych CALOSC, materiały medycyna SUM, bi
Kwasy nukleinowe nowy skrypt, Studia, UR OŚ, semestr III, biochemia
więcej podobnych podstron