
ALERGIA 3/14
2002
I M M U N O L O G I A K L I N I C Z N A
Dr n. med.
Bartosz
Foroncewicz
Dr n. med.
Krzysztof Mucha
Dr n. med.
Bożena
Czarkowska
Pączek
Klinika Immunologii,
Transplantologii i
Chorób
Wewnętrznych
Instytut
Transplantologii
Akademii Medycznej
w Warszawie
Kierownik:
Prof. dr hab. n. med.
Leszek Pączek
Limfocyty pomocnicze:
Th1, Th2 i Th3 w odpowiedzi immunologicznej
Jeszcze do niedawna sądzono, że istnieją dwie subpopulacje limfocytów pomocniczych
Th, różniące się pod względem czynnościowym, produkujące różne rodzaje cytokin i
określane jako Th1 i Th2. Komórki Th1 miały brać pomocniczy udział w odpowiedzi
typu komórkowego i aktywacji makrofagów, podczas gdy Th2 ? w odpowiedzi
humoralnej oraz produkcji eozynofili i mastocytów. Badania ostatnich lat udowodniły
jednak istnienie trzeciej subpopulacji limfocytów Th3 o nie do końca poznanym
znaczeniu. Przedstawiamy udział poszczególnych typów odpowiedzi Th1, Th2 i Th3 w
wybranych jednostkach chorobowych, który obrazuje, jak wiele prowadzi się obecnie
badań eksperymentalnych i klinicznych nad patogenezą odpowiedzi immunologicznej.
Wstęp
Limfocyty T pomocnicze (Th T helper) wspomagają odpowiedź
immunologiczną typu komórkowego i humoralnego. Zarówno bezpośrednio,
jak i poprzez szereg cytokin komórki Th ułatwiają aktywację, proliferację
i różnicowanie limfocytów B, prekursorów cytotoksycznych limfocytów T,
a także pobudzają makrofagi. Do niedawna uważano, że istnieją dwie
subpopulacje limfocytów Th, określane jako Th1 i Th2. Komórki Th1 miały
brać pomocniczy udział w odpowiedzi typu komórkowego i aktywacji
makrofagów, podczas gdy Th2 w odpowiedzi humoralnej oraz produkcji
eozynofili i mastocytów. Badania ostatnich lat udowodniły jednak istnienie
trzeciej subpopulacji limfocytów Th3 o nie do końca poznanym znaczeniu.
Wykazano, że każdy z rodzajów odpowiedzi ma zdolność hamowania innych,
np. interferon gamma (IFN) produkowany przez komórki Th1 hamuje
proliferację limfocytów Th2. Z kolei syntetyzowana przez Th2 interleukina 10
(IL10) zmniejsza sekrecję cytokin przez komórki Th1, a komórki Th3
wspomagają produkcję IgA i wykazują hamujące działanie wobec limfocytów
Th1 i Th2. "Specjalizację" limfocytów Th po raz pierwszy zaobserwowano
u myszy, jednak u ludzi również następuje różnicowanie limfocytów do
poszczególnych subpopulacji Th. Proces różnicowania limfocytów składa się
z kilku etapów. Najpierw dochodzi do prezentacji antygenu, następnie pod
wpływem antygenu ma miejsce aktywacja limfocytów Th, ekspansja klonalna
i różnicowanie (1).

Monomery tworzą dimer poprzez mostek dwusiarczkowy pomiędzy
trzecim miejscem cysteinowym a Ckońcem monomerów białkowych
(strzałka).
Udział limfocytów Th1, Th2 i Th3 w procesie chorobowym
Podejmowane są próby klasyfikacji jednostek chorobowych według rodzaju
odpowiedzi immunologicznej i z uwzględnieniem typu komórek Th, jednak
podziały te nie są jednoznaczne. Ilość wzajemnych interakcji między
komórkami układu immunologicznego jest bowiem ogromna i w każdej
patologii może brać udział więcej niż jeden typ komórek Th. Klasycznie
uważa się, że limfocyty Th1 biorą udział przede wszystkim w patogenezie
chorób autoimmunologicznych (2) (np. w kłębuszkowych zapaleniach nerek)
(3), ale limfocyty Th1 obserwuje się również w płynie mózgowordzeniowym
chorych na stwardnienie rozsiane. Z kolei limfocyty Th2 i produkowane przez
nie cytokiny są charakterystyczne dla stanu atopii. Jedną z najintensywniej
badanych chorób, w której patogenezie rozważa się przesunięcia odpowiedzi
typu Th1 do typu Th2, jest astma oskrzelowa (4,5,6). Wykazano, że zarówno
u pacjentów z ostrym napadem astmy, jak też w stabilnym okresie choroby
stwierdza się istotny wzrost wskaźnika Th2/Th1 w porównaniu z populacją
ludzi zdrowych (7). Zaobserwowano również, że komórki Th2 u dzieci

wykazują znacznie większą produkuję IL4 i IL5, a także IL9 i IL13
w odpowiedzi na alergen niż komórki dzieci bez nadwrażliwości (8). Właśnie
IL4, IL5 i IL13 wykazują silne właściwości aktywujące proliferację komórek
nabłonkowych dróg oddechowych, czym próbuje się tłumaczyć ich udział
w patogenezie astmy (9). W popłuczynach oskrzelowych (BAL Broncho
Alveolar Lavage) pacjentów z astmą po stymulacji alergenem
zaobserwowano istotnie podwyższony poziom TARC, ligandu dla receptora
chemokiny CCR4, którego ekspresja ma miejsce właśnie na komórkach Th2.
Stanowi to kolejny dowód na istotne znaczenie tej subpopulacji limfocytów
w patogenezie alergicznej astmy oskrzelowej (10). Istnieje również wiele
badań sugerujących, że IFN produkowany przez komórki Th1 może hamować
czynność efektorowych limfocytów Th2, dając w ten sposób podstawy
nowych strategii leczenia (11).
Poza astmą także w patogenezie alergicznego zapalenia błony śluzowej
nosa i atopowego zapalenia skóry limfocyty Th2 wydają się spełniać istotną
funkcję (12). Klony komórek Th2 wyizolowano również z powiek pacjentów
z alergicznym stanem zapalnym spojówek.
Liczne badania wykazały udział poszczególnych typów odpowiedzi w wielu
patologiach wątroby, co stwarza nadzieję na ich immunologiczne
modyfikowanie, a nawet leczenie. Analiza ekspresji IL4, IFN i TGF
w komórkach T pomocniczych wyizolowanych z krwi obwodowej pacjentów
z przewlekłą infekcją wywołaną HBV wskazuje, że cytokiny Th1 korelują
z aktywną fazą zapalenia wątroby. Zwiększony odsetek komórek Th2
wskazuje na przetrwanie infekcji, podczas gdy komórki Th3 razem
z komórkami Th2 wywierają efekt immunosupresyjny i mogą przez to mieć
wpływ na stan przewlekłego nosicielstwa wirusa HBV, a także na
wytworzenie tolerancji immunologicznej (13).
W badaniu pacjentów z przewlekłą infekcją wywołaną wirusem HCV
wzmożoną produkcję IFN przez komórki Th1 częściej obserwowano
u chorych z hipertransaminazemią i większymi histopatologicznymi cechami
uszkodzenia wątroby niż u pacjentów z prawidłowymi wartościami
transaminaz. Wyniki te sugerują udział Th1 w progresji zapalenia wątroby
(14). Inni badacze stwierdzali indukowane wirusem komórki Th2 we
wczesnym okresie przewlekłego HCV (15).
W transplantologii wątroby również znajdujemy przykłady znaczenia
odpowiedzi z udziałem poszczególnych typów limfocytów Th. Wykazano, że
u pacjentów po przeszczepieniu wątroby równowaga Th1/Th2 we wczesnym
okresie potransplantacyjnym ma istotne znaczenie dla powodzenia
przeszczepienia (16). U osób, u których stwierdza się dominację cytokin typu
Th2 (IL4, IL6 i IL10), w ciągu pierwszych 2448 godzin częstość ostrego
odrzucania jest znacznie mniejsza niż u pacjentów z przewagą odpowiedzi
typu Th1 i nadprodukcją IFN. Supresja odpowiedzi typu Th3 ze zmniejszoną
produkcją TGFczęściej towarzyszyła odrzucaniu przeszczepionej wątroby.
Podobny efekt limfocytów Th1 zaobserwowano, badając 23 biorców wątroby
od dawców żywych, których przeszczep przeżył bez immunosupresji 2 lata (3
69 miesięcy). U pacjentów tych wykazano zmniejszoną produkcję IFN przez
limfocyty Th1, stąd postuluje się, że właśnie osłabienie odpowiedzi Th1 może
być kluczem do indukcji tolerancji po przeszczepieniu wątroby (17).
W jednym z badań wykazano protekcyjne działanie cytokin produkowanych
przez Th2 i w mniejszym stopniu Th3 na ludzkie wyspy trzustkowe. Już
wcześniejsze obserwacje na modelach zwierzęcych sugerowały, że cytokiny
stymulowane przez komórki Th2 i Th3 mogą redukować uszkodzenie wysp
trzustkowych wywołanych cytokinami prozapalnymi (głównie IL1 i TNF)
indukowanymi przez Th1. Badania na izolowanych wyspach ludzkich
potwierdziły powyższe obserwacje, przy czym efekt Th3 wydaje się mniej
istotny niż Th2 (18).
Cytokiny mają duże znaczenie dla zachowania homeostazy układu
immunologicznego jelit, zwłaszcza interakcji z antygenami pokarmowymi.
Odgrywają one także istotną rolę w uszkodzeniu jelit w procesie przewlekłego
zapalenia (IBD Inflammatory Bowel Disease). W modelach
eksperymentalnych i u ludzi stwierdza się nadmierną aktywację komórek Th1
i wzmożoną lokalną produkcję IFN i TNF. W następstwie ten stan prowadzi
do uszkodzenia tkanki jelita. Wciąż nie znamy odpowiedzi na pytanie, czy
nadmierna odpowiedź Th1 wynika z przesterowania odpowiedzi typu Th2 lub
Th3, czy też jest stale obecna w obrębie jelit, utrzymywana w formie
"niepatogennej" przez komórki regulatorowe. Nie wiemy też, gdzie taka
regulacja ma miejsce, w kępkach Peyera czy w błonie właściwej (19).
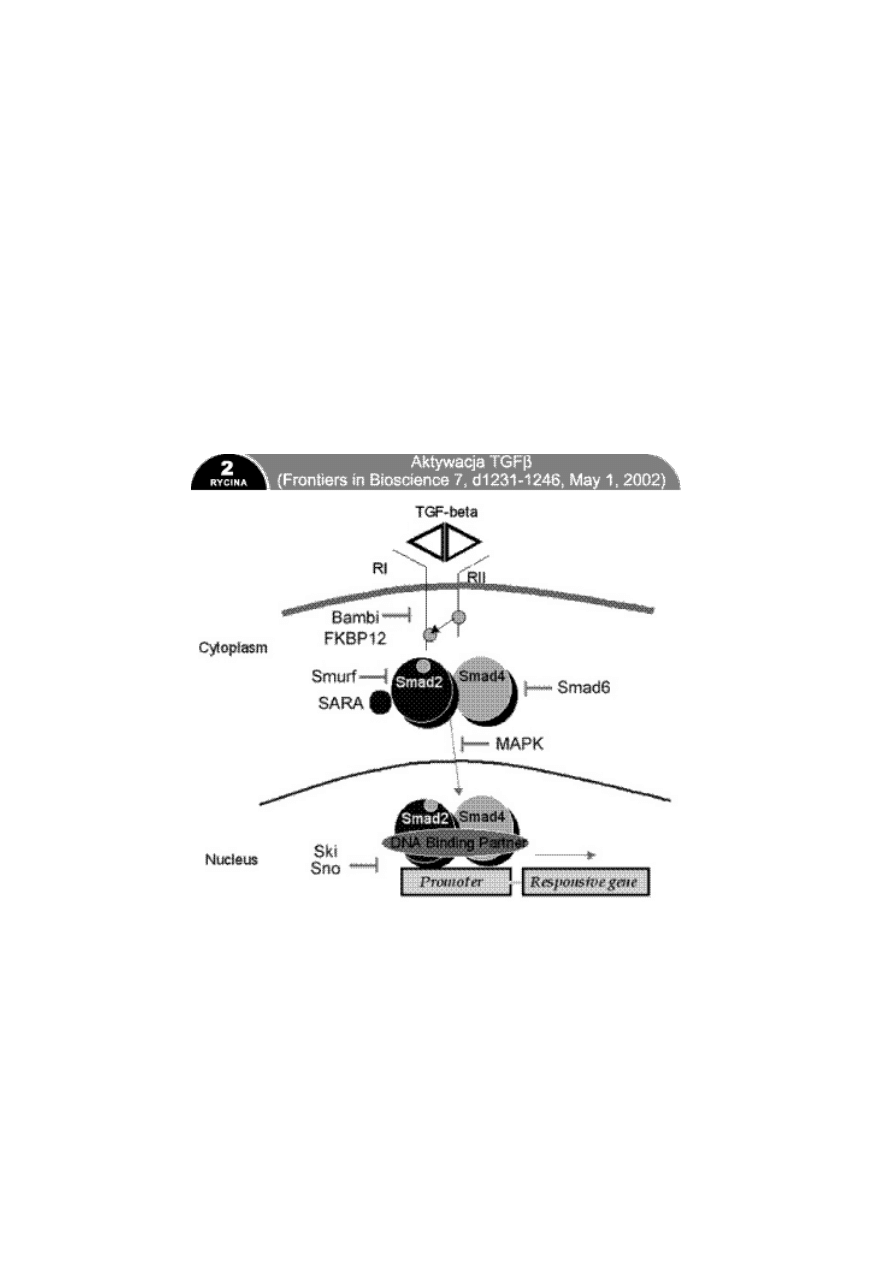
TGF działa na trzy typy receptorów o wysokim powinowactwie:
RI, RII i RIII, występujących na wszystkich rodzajach komórek.
TGF z przestrzeni zewnątrzkomórkowej może się połączyć z RIII,
który prezentuje go dla RII, lub bezpośrednio z RII. Dopiero
połączenie z RII prowadzi do utworzenia kompleksu
z receptorem RI i jego fosforylacji, która jest warunkiem
przekazania informacji do jądra komórkowego. RI i RII mają
w swojej domenie wewnątrzkomórkowej serynowotreoninowe
kinazy białkowe, inicjujące przekazanie informacji do jądra
poprzez fosforylację szeregu czynników transkrypcyjnych
określanych jako Smad (nazwa pochodzi od Sma i MAD
homologów genowych Caenorhabditis elegans i Drosophila
melanogaster). Do dziś opisano dziesięć białek Smad (110).
Smad2 i Smad3 ulegają fosforylacji przez aktywowany TGFbRI
i wówczas mogą tworzyć kompleks ze Smad4. Kompleks

wędruje do jądra komórkowego, wchodzi w interakcje
z czynnikami transkrypcyjnymi (innymi dla różnych rodzajów
tkanek) i wywołuje odpowiedni efekt. Smad6 i Smad7 są
inhibitorami fosforylacji Smad2 i Smad3. Poza drogą
przekaźnikową zależną od Smad TGFb oddziałuje również
poprzez kinazę białkową aktywowaną przez mitogeny (MAPK)
lub przez stres. Pozostałe symbole: FKBP12 FK506 binding
protein 12kDa (białko wiążące FK506), BAMBI Bone
Morphogenetic Protein (BMP) and Activin MembraneBound
Inhibitor (inhibitor błonowy białka morfogenetycznego kości
i aktywiny), Ski Sloan Kettering Institute protooncogen
(protoonkogen instytutu Sloan Kettering), Sno Skirelated
novel gene (nowy gen związany ze Ski), Smurf SMAD
Ubiquitylation Regulatory Factor (czynnik regulujący
ubikwitylację Smad), SARA Smad Anchor for Receptor
Activation (czynnik kotwiczący Smad dla aktywacji receptora),
DNA binding partner partner wiążący DNA, Cytoplasm
cytoplazma, Nucleus jądro komórkowe, Promoter promotor
genu, Responsive gene odpowiadający gen.
W chorobach nerek, poza rodzajem odpowiedzi Th1 biorącym udział
w nadwrażliwości typu późnego, również komórki Th2 odgrywają istotną rolę.
Uważa się, że nadmierna produkcja IgA stwierdzana u pacjentów z nefropatią
IgA wynika ze wzmożonej stymulacji limfocytów Th2. Dochodzi do indukcji IL
4, IL5 i IL6, które biorą udział w syntezie przeciwciał, zwłaszcza IgA.
Ponadto u pacjentów z kłębuszkowym zapaleniem nerek typu nefropatii IgA
stwierdzono podwyższone stężenie IL4 w surowicy. IL4 stymuluje produkcję
IgA, ale dodatkowo ma dodatni wpływ na limfocyty Th2 (20). Również na
zwierzęcych modelach nefropatii toczniowej wykazano wzmożony udział
odpowiedzi Th2. Rozwój i przebieg choroby zależy od poliklonalnej aktywacji
limfocytów B, występującej pod wpływem stymulacji cytokinami zależnymi od
Th2 (21).
Liczne badania eksperymentalne, a także prace kliniczne dowodzą istnienia
związku pomiędzy odpowiedzią typu Th2 a prawidłowym przebiegiem ciąży.
Dodatkowo wiele danych sugeruje udział odpowiedzi Th1 w poronieniach
(22). U kobiet z podwyższoną produkcją TNF i TGF2 zaobserwowano niższy
odsetek poronień niż u matek, które przedwcześnie produkowały TNF i nie
wykazywały zdolności syntezy TGF2 i 3 w późniejszym okresie ciąży, co
sugeruje udział odpowiedzi Th2/Th3 w prawidłowym przebiegu ciąży (23).
Nawracające samoistne poronienia w modelu mysim CBA/J wiążą się
z produkcją cytokin Th1 (TNF i IFN) przez komórki NK (natural killer)
i limfocyty T V+ naciekające macicę. Być może zatem przesunięcie
odpowiedzi z Th1 do Th2 i Th3 będzie w przyszłości metodą zapobiegania
poronieniom (24).
W ostatnim okresie zwiększono również intensywność badań nad udziałem
komórek Th3 i produkowanego przez nie TGF w procesie embriogenezy.
Badany jest też ich wpływ na przebieg chorób autoimmunologicznych.
Wiadomo bowiem, że TGF wykazuje właściwości immunomodulujące. TGF
można dziś uznać za składową część układu renina angiotensyna
aldosteron (25). Odwrotnie niż tenże układ TGF określano jako czynnik auto
lub parakrynny, badania zaś ostatnich lat przyniosły przekonujące dowody
ogólnoustrojowych efektów działania tego peptydu (26). TGF został
wyizolowany z płytek krwi i opisany ponad dziesięć lat temu (ryc. 1).

Właściwie każda komórka ludzkiego organizmu produkuje TGF i posiada na
swojej powierzchni jego receptory (ryc. 2). Do tej pory zidentyfikowano pięć
izoform TGF, spośród których trzy określane jako TGF1, TGF2 i TGF3,
występują u wszystkich ssaków.
Zarówno nadmierna ekspresja TGF, jak też jego niedobór mogą prowadzić do
rozwoju licznych chorób, m.in. nerek (np. zwiększone stężenie TGF
i nadmierną ekspresję mRNA dla TGF obserwuje się u ludzi w przebiegu
nefropatii IgA, ogniskowoszkliwiejącego, mezangialnorozplemowego
kłębuszkowego zapalenia nerek, nefropatii toczniowej, cukrzycowej
i związanej z HIV [2729]), a także w przebiegu miażdżycy, osteoporozy,
nadciś nienia tętniczego, włóknienia płuc czy wątroby. Podwyższone wartości
TGF stwierdza się w cukrzycy in vitro, w modelach zwierzęcych (30,31), jak
też u pacjentów z nefropatią cukrzycową (32,33). Mutacje genowe TGF, jego
receptorów lub cząstek przekaźnikowych obserwuje się w chorobach
nowotworowych, zjawiskach przerzutów nowotworowych, młodzieńczej
polipowatości jelita grubego, a także w niektórych chorobach wrodzonych, np.
we wrodzonej teleangiektazji krwotocznej (34).
TGF, produkowany m.in. przez omawianą subpopulację limfocytów Th3,
wywołuje również efekt immunomodulacyjny. Już od ponad dziesięciu lat
wiadomo, że TGF indukuje migrację limfocytów CD4+ i CD8+ in vitro (35). Już
wówczas badacze uważali, że nadprodukcja TGF może działać
immunosupresyjnie poprzez hamowanie proliferacji limfocytów T i B oraz
komórek NK, a także produkcji immunoglobulin przez limfocyty B (36,37).
Korzystny wpływ TGF1 w chorobach autoimmunologicznych tłumaczy się
aktywną supresją autoregulacyjnych limfocytów T (38). Trudno jest ocenić
dokładny mechanizm działania TGF na limfocyty, gdyż wywiera on również
pośredni wpływ m.in. na komórki prezentujące antygen (39). O ile
wcześniejsze badania sugerowały głównie efekt supresyjny, ostatnie lata
przynoszą liczne dowody kostymulacyjnego i antyapoptotycznego działania
TGF na limfocyty T (39,40,41). Funkcja regulacyjna komórek CD25 (+) i CD4
(+) również wydaje się zależna od TGF (42). Możliwe, że przeciwstawne
efekty działania TGF na układ odpornościowy zależą od czynników
dodatkowych, np. IL2 (39), jednak niezależnie od rodzaju efektu faktem jest,
że TGF jest silnym czynnikiem immunomodulacyjnym.
Podsumowanie
Populacje limfocytów Th1, Th2 i Th3 są zaangażowane
w patogenezę wielu jednostek chorobowych, a także w procesy
odpowiedzi immunologicznej biorców przeszczepów. Uzupełniają
się nawzajem lub efekty ich działania są przeciwstawne. Coraz
więcej wiadomo na temat ich aktywacji oraz produkowanych przez
nie cytokin, co stwarza coraz większe możliwości terapeutyczne.
Nadal jednak jest to wiedza pochodząca głównie z badań
eksperymentalnych, stąd konieczność ich kontynuacji
i podejmowania kolejnych prób zastosowania w praktyce
klinicznej. •
Piśmiennictwo
1. Roitt I., Brostoff J., Male D.: Immunology. Fourth Edition, Mosby, 1998. 2. Romagnani S.: The Th1/Th2/Th3
paradigm. Immunol Today 1997, 18: 263266. 3. Huang XR., Holdsworth SR., Tipping PG.: Evidence for delayed
type hypersensitivity in glomerular crescent formation. Kidney Int 1994, 46: 6978. 4. Cohn L., Ray A.: Thelper type
2 celldirected therapy for asthma. Pharmacol Ther 2000 Nov; 88 (2): 18796. 5. Stirling R. G., Chung K. F.: New
immunological approaches and cytokine targets in asthma and allergy. Eur Respir J 2000 Dec; 16 (6): 115874. 6.
Robinson D. S.: Th2 cytokines in allergic disease. Br Med Bull 2000; 56 (4): 95668. 7. Wong C. K., Ho C. Y., Ko F.

W. et al.: Proinflammatory cytokines (IL17, IL6, IL18 and IL12) and Th cytokines (IFNgamma, IL4, IL10 and IL
13) in patients with allergic asthma. Clin Exp Immunol 2001 Aug; 125 (2): 17783. 8. Jenmalm M. C., Van Snick J.,
Cormont F. et al.: Allergeninduced Th1 and Th2 cytokine secretion in relation to specific allergen sensitization and
atopic symptoms in children. Clin Exp Allergy 2001 Oct; 31 (10): 152835. 9. Relova A. J., Kampf C., Roomans G.
M.: Effects of Th2 type cytokines on human airway epithelial cells: interleukins4, 5, and 13. Cell Biol Int 2001; 25
(6): 5636. 10. Berin M. C., Eckmann L., Broide D. H. et al.: Regulated production of the T helper 2type Tcell
chemoattractant TARC by human bronchial epithelial cells in vitro and in human lung xenografts. Am J Respir Cell
Mol Biol 2001 Apr; 24 (4): 3829. 11. Ray A., Cohn L.: Altering the Th1/Th2 balance as a therapeutic strategy in
asthmatic diseases. Curr Opin Investig Drugs 2000 Dec; 1 (4): 4428. 12. Stirling R. G., Chung K. F.: Future
treatments of allergic diseases and asthma. Br Med Bull 2000; 56 (4): 103753. 13. Jiang R., Lu Q., Hou J.:
Polarized populations of T helper cells in patients with chronic hepatitis B virus infection. Zhonghua Yi Xue Za Zhi
2000 Oct; 80 (10): 741 4. 14. Rico M. A., Quiroga J. A., Subira D. et al.: Features of the CD4 (+) Tcell response in
liver and peripheral blood of hepatitis C virusinfected patients with persistently normal and abnormal alanine
aminotransferase levels. J Hepatol 2002 Mar; 36 (3): 40816. 15. Spanakis N. E., Garinis G. A., Alexopoulos E. C. et
al.: Cytokine serum levels in patients with chronic HCV infection. World J Gastroenterol 2001 Aug; 7 (4): 532536.
16. Minguela A., Torio A., Marin L., et al.: Implication of Th1, Th2, and Th3 cytokines in liver graft acceptance.
Transplant Proc 1999; 31: 519520. 17. Takatsuki M., Uemoto S., Inomata Y. et al.: Analysis of alloreactivity and
intragraft cytokine profiles in living donor liver transplant recipients with graft acceptance. Transpl Immunol 2001 Feb;
8 (4): 27986. 18. Marselli L., Dotta F., Piro S., et al.: Th2 cytokines have a partial, direct protective effect on the
function and survival of isolated human islets exposed to combined proinflammatory and Th1 cytokines. J Clin
Endocrinol Metab 2001 Oct; 86 (10): 49748. 19. MacDonald TT.: Effector and regulatory lymphoid cells and
cytokines in mucosal sites. Curr Top Microbiol Immunol 1999; 236: 11335. 20. Nagasawa R., Maruyama N.,
Imasawa T. et al.: Role of T cell in murine IgA nephropathy. Nephrol Dial Transplant 1999, 14 (suppl. 1): 1213. 21.
De Heer E., Aaldering L., Florquin S.: T cell subsets in experimental lupus nephritis: modulation by bacterial
superantigen. Nephrol Dial Transplant 1999, 14 (suppl. 1): 1416. 22. Raghupathy R.: Pregnancy: success and
failure within the Th1/Th2/Th3 paradigm. Semin Immunol 2001 Aug; 13 (4): 21927. 23. Clark D. A., Arck P. C.,
Chaouat G.: Why did your moher reject you? Immunogenetic determinants of the response to environmental
selective pressure expressed at the uterine level. Am J Reprod Immunol 1999, 41: 522. 24. Clark D. A., Croitoru K.:
Th1/Th2,3 imbalance due to cytokineproducing NK, gammadelta T and NKgammadelta T cells in murine
pregnancy decidua in success or failure of pregnancy. Am J Reprod Immunol 2001 May; 45 (5): 25765. 25. Border
W. A., Noble N. A.: Interactions of TGFb and angiotensin II in renal fibrosis. Hypertens 1998; 31 (part 2): 181188.
26. Sporn MB.: The importance of context in cytokine action. Kidney Int 19. 27. Iwano M., Akai Y., Fujii Y. et al:
Intragglomerular expression of TGFb1 mRNA in patients with glomerulonephritis. Quantitative analysis by
competitive PCR. Clin Exp Immunol 1994; 97: 309314. 28. Kanai H., Mitushashi N., Ono [imię? E. Cz. ]. et al:
Increased excrtion of urinary TGFb in patients with focal glomerular sclerosis. Nephron 1994; 66: 391395. 29.
Yamamoto T., Noble N. A., Miller D. E. et al: Sustained expression of TGFb1 underlies development of progressive
kidney fibrosis. Kidney Int 1994; 45: 916927. 30. Park I. S., Kyomoto H., Abboud S. et al: Expression of TGFb and
type IV collagen in early streptozocininduced diabetes. Diabetes 1997; 46: 473480. 31. Shankland S. J., Scholey J.
W.: Expression of TGFb in diabetic renal hypertrophy. Kidney Int 1994; 46: 430442. 32. Sharma K., Ziyadeh F. N.,
Alzahabi B. et al: Increased renal production of TGFb1 in patients with type II diabetes. Diabetes 1997; 46: 854859.
33. Yamamoto T., Nakamura T., Noble N. A. et al: Expression of TGFb is elevated in human and experimental
diabetic nephropathy. Proc Natl Acad Sci USA 1993; 90: 18141818. 34. Blobe G. C., Schiemann W. P., Lodish H.
F.: Role of transforming growth factor TGFb in human disease. The New Engl J Med 2000; 342 (18): 13501358.
35. Adams D. H., Hathaway M., Shaw J. et al: Transforming growth factorß induces human T lymphocyte migration
in vitro. J Immunol 1991 Jul 15; 147 (2): 60912. 36. Fox F. E., Ford H. C., Douglas R. et al: Evidence that TGFß
can inhibit human Tlymphocyte proliferation throľgh paracrine and autocrine mechanisms. Cell Immunol 1993, Aug;
150 (1): 4558. 37. Kehrl J. H.: Transforming growth factorß: an important mediator of immunoregulation. Int J Cell
Cloning 1991 Sep; 9 (5): 43850. 38. Prud
homme G. J., Piccirillo C. A.: The inhibitory effects of transforming growth
factor beta1 (TGFb1) in autoimmune diseases. J Autoimmun 2000, 14 (1): 2342. 39. Cerwenka A., Swain S. L.:
TGFß1: immunosuppressant and viability factor for T lymphocytes. Microbes Infect 1999 Dec; 1 (15): 12916. 40.
Brown T. L., Patil S., Howe P. H.: Analysis of TGFßinducible apoptosis. Methods Mol Biol 2000; 142: 14967. 41.
Schiott A., Sjogren H. O., Lindvall M.: The three isoforms of transforming growth factorß costimulate rat T cells and
inhibit lymphocyte apoptosis. Scand J Immunol 1998 Oct; 48 (4): 3718. 42. Weiner H. L.: Oral tolerance: immune
mechanisms and the generation of Th3type TGFßsecreting regulatory cells. Microbes Infect 2001 Sep; 3 (11):
94754.
Lymphocytes T helpers: Th1, Th2 and Th3 in immune response
Lymphocytes T helpers were thought to differentiate into two subpopulations: Th1 and Th2, which
produced different cytokines. Th1 cells were considered to stimulate the cellular type of immune
response and to activate macrophages, whereas Th2 cells were involved rather in the humoral
response and eosinophils and mast cells production. Recent years brought evidence for
existence of another lymphocytes subpopulation Th3. Its role needs to be elucidated; however it
was observed that they have a potential to produce TGFß. We present selected diseases
involving different types of Th cells in order to demonstrate how wide is the range of research on
pathogenesis of immune response.
Wyszukiwarka
Podobne podstrony:
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
więcej podobnych podstron