
Insulina, glukagon, cukrzyca
Dariusz Nowak
Katedra Fizjologii Doświadczalnej i
Klinicznej UM w Lodzi

Trzustka
• Funkcja trawienna
• Funkcja dokrewna ;insulina, glukagon – istotne dla
regulacji glukozy, lipidów, białek
• Amylin, somatostatin, pancreatic polypeptide – ich
funkcja jeszcze nie jest w pełni zbadana
• Budowa trzustki – acini – sok trawienny do
dwunastnicy
• Wysepki Langerhansa – insulina , glukagon do krwi
• Wysepki 1 do 2 milionów, Φ jednej wyspy – 0.3 mm,
zlokalizowane wokół małych kapilar

Trzustka
• Komórki β (60% wszystkich komórek wysp)- w
środkowej części wyspy, sekrecja insuliny i
amyliny (często amylina jest razem wydzielana z
insuliną)
• Komórki α (25% liczby) sekr. Glukagon
• Komórki Δ (10%) – somatostatyna
• Komórki PP – pancreatic peptide
• Te komórki są blisko siebie – cell-to-cell
communication: insulina hamuje wydzielanie
glukagonu, amylin hamuje insulinę, somatostatyna
hamuje oba insulinę i glukagon
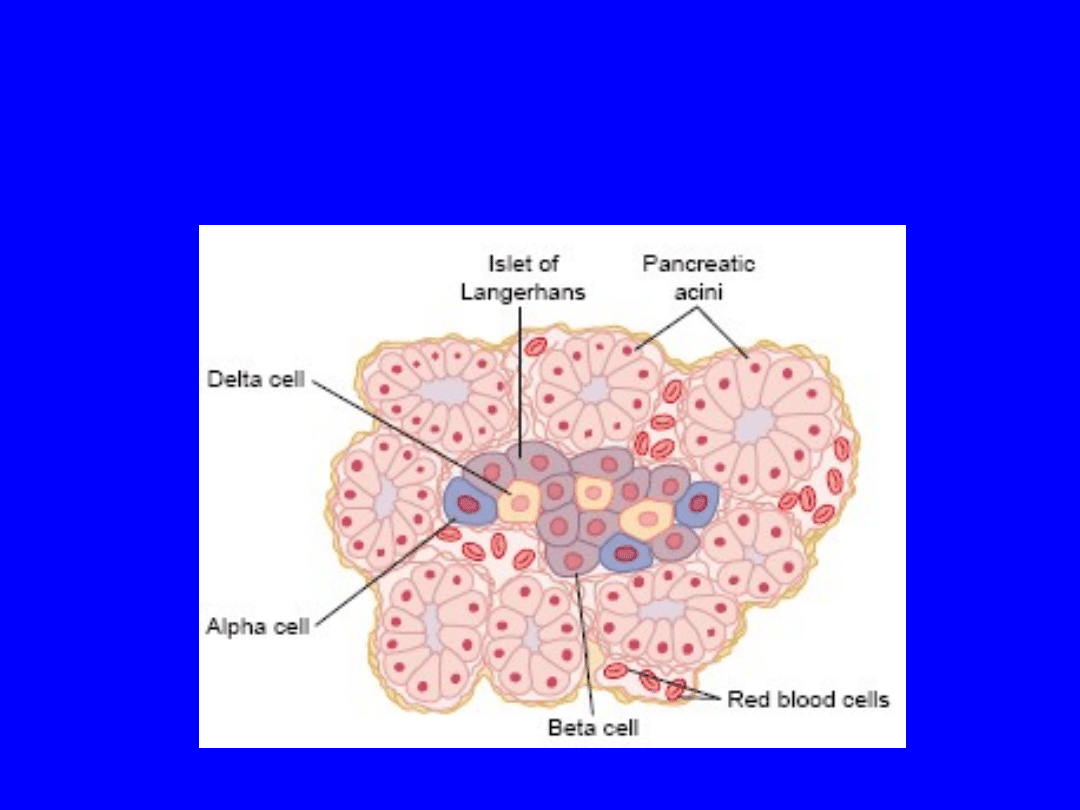
Physiologic anatomy of an islet of
Langerhans in the pancreas.

Insulina i jej działanie na
metabolizm
• 1922 Banting i Best – wyizolowali z trzustki
insulinę – podali choremu i dramatyczna
poprawa
• Z czym kojarzyła się insulina ?
• „Cukier we krwi”, kwasica, miażdżyca
(zaburzenia metabolizmu lipidów), obniżona
synteza białek w długotrwałej cukrzycy.

Insulina
•
Insulina – hormon związany z obfitością
energii, obfitością pożywienia bogatego w
energię, szczególnie z obfitością
węglowodanów
•
Przechowywanie nadmiaru energii ,
węglowodany → glikogen w wątrobie i
mięśniach. Część węglowodanów która nie
może być przechowana jako glikogen
konwertowana jest w tłuszcz i magazynowana w
tkance tłuszczowej.
•
Aminokwasy – ↑ wychwyt i synteza białek w
komórce, hamuje degradacje białek które są
już w komórce, zwiększa ich T1/2

Chemia insuliny i synteza
• Małe białko , ludzka insulina m.w. = 5808
• Dwa łańcuchy aminokwasowe połączone ze sobą
-S-S- , ich pęknięcie – utrata aktywności
• Synteza w komórkach β – typowy mechanizm
syntezy jak dla białek
• Najpierw jest insulin preprohormon m.w ~
11.500
• Cięcie w retikulum endoplazmatycznym –
proinsulina (m.w.~ 9000) – dalsze cięcie w
aparacie Golgi’ego – insulina + fragmenty
peptydowe – pakowanie do ziarnistości
sekrecyjnych

Chemia insuliny i synteza
•
! 1/6 końcowego produktu który jest
wydzielany jest wciąż w formie proinsuliny (bez
aktywności insuliny)
•
Wydzielana do krwi krąży w formie
niezwiązanej
•
T1/2 ~ 6 min., oczyszczana z krążenia w ciągu
10-15 min, to co nie zwiąże się z receptorem na
docelowych komórkach rozkładane jest przez
enzym insulinazę w wątrobie ( też w nerkach i
mięśniach i innych tkankach)
•
Szybko pojawia się i szybko znika z krwi
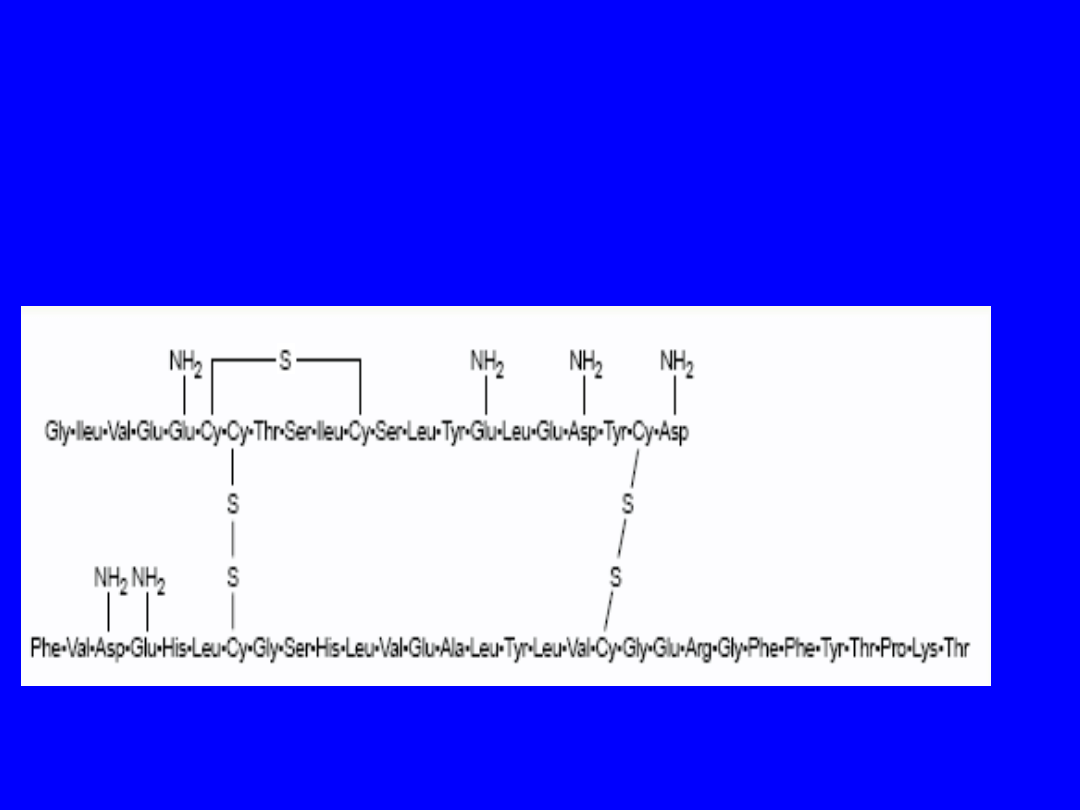
Human insulin molecule.

Receptor dla insuliny
• 2 podjednostki α i 2 podjednostki β
• Całość m.w ~ 300 000
• Autofosforylacja podjednostek β (enzyme-
linked receptor) → aktywacja lokalnej
kinazy tyrozynowej
• Fosforyluje wiele różnych substratów –
insulin receptor substrates (IRS), IRS-1,
IRS-2, IRS-3 (zależnie od tkanki), efekt
netto – jedne hamuje inne aktywuje

Wiązanie insuliny z receptorem
• Schematic of the insulin receptor.
• Insulin binds to the a-subunit of its receptor,
which causes autophosphorylation of the b-
subunit receptor, which in turn induces
tyrosine kinase activity.
• The receptor tyrosine kinase activity begins a
cascade of cell phosphorylation that increases
or decreases the activity of enzymes,
including insulin receptor substrates, that
mediate the effects on glucose, fat, and
protein metabolism.
• For example, glucose transporters are moved
to the cell membrane to facilitate glucose
entry into the cell.
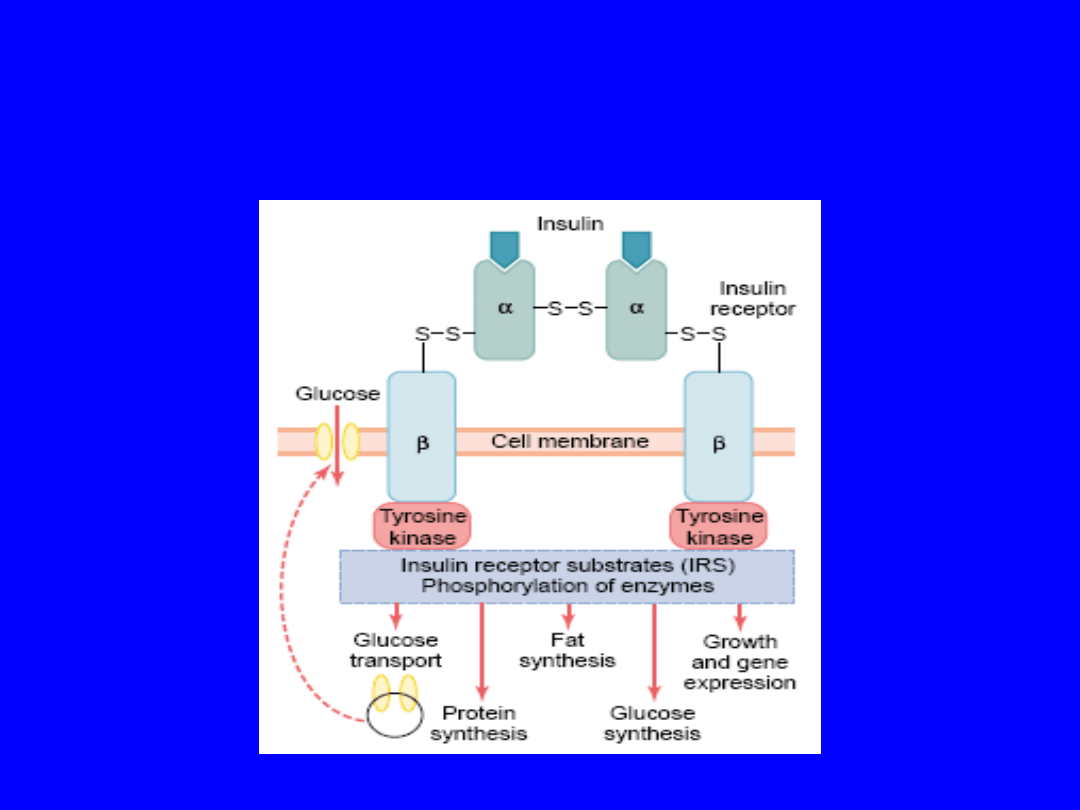
Wiązanie insuliny z receptorem

Efekty działania insuliny
• 1 wciągu sekund po związaniu z receptorem-
wyraźne zwiększenie wychwytu glukozy
(dotyczy to 80% naszego ciała) w komórkach
mięśni, tkanki tłuszczowej (ale nie neuronów
mózgu !!)
• Realizowane jest to poprzez
wewnątrzkomórkowe pęcherzyki – łącza się z
błoną komórkowa i wnoszą do niej białka
transportujące glukozę, gdy brakuje insuliny
to pęcherzyki oddzielają się od błony
komórkowej w ciągu 3-5 min i cofają się z
powrotem do wnętrza komórki – by później gdy
pojawi się insulina być użyte ponownie

Efekty działania insuliny
• 2. wzrost przepuszczalności błony
komórkowej dla aminokwasów, K
+
,
fosforanów , - wzrost ich transportu do
komórki
• 3. wolniejsze działanie w ciągu 10-15 min
– zmiana aktywności licznych enzymów
wewnątrzkomórkowych- poprzez
mechanizm fosforylacji
• 4. jeszcze wolniejsze działanie – godziny-
dni : translacja, mRNA – synteza enzymów

Wpływ insuliny na metabolizm
węglowodanów
• Zaraz po pożywieniu bogatym w węglowodany
→ glukoza ↑ we krwi → szybkie uwalnianie
insuliny → szybki wychwyt, magazynowanie i
zużycie glukozy przez prawie wszystkie tkanki
ciała (zwłaszcza mięśnie, tkanka tłuszczowa,
wątroba).
• Przez większość dnia energetyka mięśni
(zwłaszcza w spoczynku) zależy od kwasów
tłuszczowych a nie od glukozy, (dlaczego ?) bo
w prawidłowym mięśniu w spoczynku błona jest
minimalnie przepuszczalna dla glukozy

Wpływ insuliny na metabolizm
węglowodanów
• Pomiędzy posiłkami wydzielanie insuliny za małe
by zwiększyć istotnie przepuszczalność błony dla
glukozy
• W dwóch przypadkach mięśnie zużywają dużo
glukozy:
• 1. – umiarkowany-ciężki wysiłek → i tu rośnie
przepuszczalność dla glukozy niezależnie od
obecności insuliny, z powodu samego skurczu
• 2. w ciągu godzin (1-3 ?) po posiłku – bo wysoka
glukoza i wysoka insulina i wtedy dominuje zużycie
glukozy nad kwasami tłuszczowymi w mięśniu

Zapas glikogenu w mięśniu
• Mięsień nie pracuje → dużo glukozy (nadmiar)
(i jest insulina) jest transportowany do mięśni
→ zapasy glikogenu 2-3% masy mięśnia –
zabezpiecza możliwość ekstremalnego wysiłku
przy względnych niedoborach tlenu
• Insulina zwiększa 15 razy szybkość transportu
glukozy do komórki mięśniowej
• Wątroba – jest glukoza i insulina – powstaje
glikogen w wątrobie. Brak insuliny pomiędzy
posiłkami, spada glukoza – to rozkład
glikogenu by zapobiec spadkowi glukozy
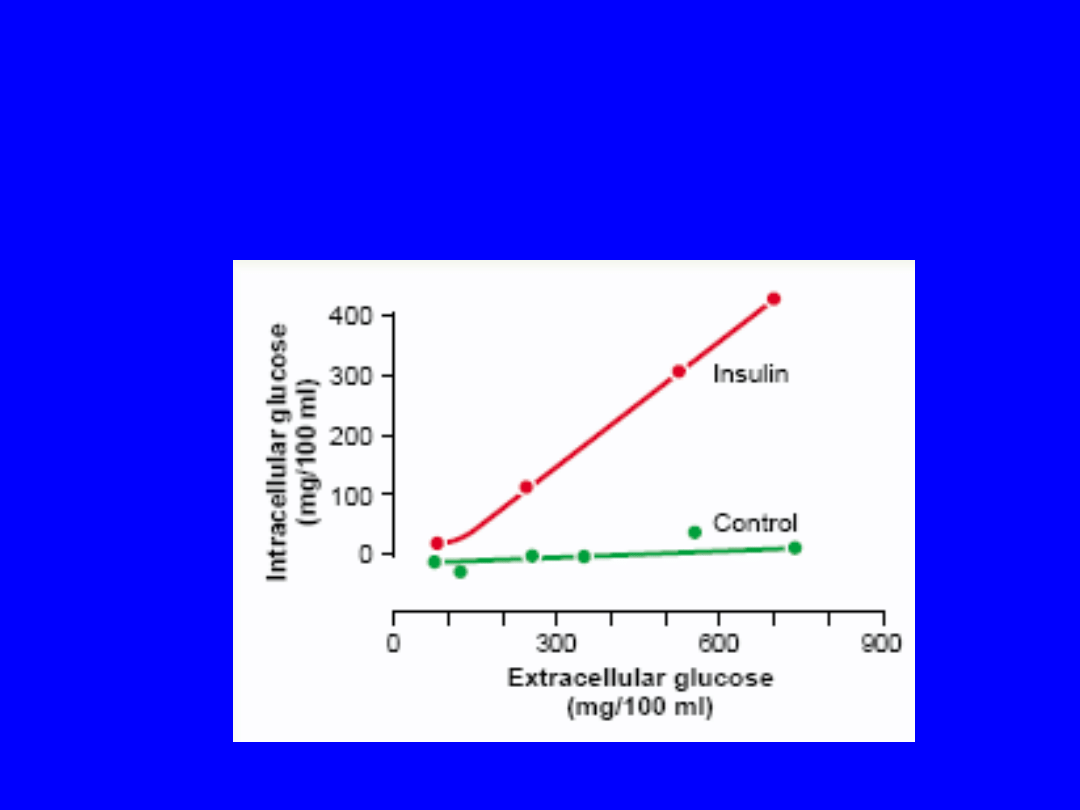
Effect of insulin in enhancing the concentration of glucose
inside
muscle cells. Note that in the absence of insulin (control),
the
intracellular glucose concentration remains near zero,
despite
high extracellular glucose concentrations.

Insulina - wątroba
• Insulina:
• 1.inaktywuje fosforylazę wątrobową
• 2. zwiększa wychwyt glukozy, zwiększa
aktywność glukokinazy – fosforyluje glukozę i
„usidla” w komórce (nie dyfunduje przez
błonę)
• 3. aktywuje syntazę glikogenu – zawartość
glikogenu rośnie do 5-6% masy wątroby ( ~
100 g w całej wątrobie)

Uwalnianie glukozy z wątroby
pomiędzy posiłkami
• ↓ glukozy – następują zdarzenia by z powrotem
ją ↑
• 1. spada wydzielanie insuliny z trzustki
• 2.odwrócenie wszystkich efektów o których
mówiliśmy wcześniej przy magazynowaniu
glikogenu w wątrobie: aktywacja fosforylazy →
powstaje fosforan glukozy; aktywacja fosfatazy
glukozy → wolna glukoza – wychodzi z komórki
do krwi
• Około 60% glukozy z posiłku jest magazynowane
w wątrobie a potem uwalniane

Insulina stymuluje konwersję nadmiaru
glukozy do kwasów tłuszczowych i hamuje
glukoneogenezę w wątrobie
• Glukoza gdy nie może być zmagazynowana jako
glikogen lub zużyta do metabolizmu
hepatocytów jest konwertowana do kw.
tłuszczowych → pakowane jako triglicerydy do
VLDL ( very-low-density-lipoproteins) → z krwią
do tkanki tłuszczowej i deponowane jako tłuszcz.
• Hamowanie enzymów glukoneogenezy w
wątrobie i ograniczenie dostępności
prekursorów dla glukoneogenezy

Insulina – glukoza- mózg
• Mózg zużywa glukozę bez pomocy insuliny !!! Jedynym
źródłem energii jest glukoza , nie zużywa wkt. !!!
• Dlatego gdy glukoza ↓ < 20-50 mg/dl może być
wstrząs hipoglikemiczny ; pobudzenie nerwowe,
napady drgawek, porażenie kończyn (dziwaczne !) ,
śpiączka
• Inne tkanki są zależne od insuliny np. Mięśnie
• W tkance tłuszczowej , glukoza jest też źródłem dla
szkieletu glicerolu do tworzenia tłuszczów.
• Długotrwały brak insuliny → ↑ atherosclerosis – zawał
m. sercowego, udar mózgu i inne zmiany naczyniowe

Szybki efekt insuliny na metabolizm
tłuszczu
• Magazynowanie tłuszczu w tk. Tłuszczowej
• Nasilenie transportu glukozy do komórek –
oszczędzanie tłuszczu (zastępowanie go przez
glukozę) do produkcji energii
• Nasila syntezę tłuszczu i dzieje się to prawie
wyłącznie w wątrobie → lipoproteiny krwi →
do tk. tłuszczowej → magazynowanie tłuszczu.
• Jak to się dzieje – insulina – synteza tłuszczu ?

Szybki efekt insuliny na metabolizm
tłuszczu
• 1. nasilenie transportu glukozy do hepatocytów –
glikogen, gdy powstanie go 5-6% masy wątroby to sam
hamuje swoja syntezę i dalej produkowany jest tłuszcz;
• Glukoza → pirogronian → acetyl coenzym A (acetyl-CoA)
• 2. cytrynian i iso-cytrynian (w cyklu kwasu
cytrynowego) → aktywacja acetyl-CoA carboksylazy +
acetyl CoA → malonyl CoA (I etap syntezy kwasu
tłuszczowego)
• 3. Po tym synteza kwasów tłuszczowych w wątrobie,
później triglicerydów (z hepatocytów do krwi) , we krwi
jako lipoproteiny, (insulina aktywuje lipazę
lipoproteinowa w ścianie kapilar)

Szybki efekt insuliny na metabolizm
tłuszczu
• Powstają kwasy tłuszczowe – przechodzą do
adipocytów
• Tam ponownie synteza triglicerydów i magazynowanie.
• Insulina promuje magazynowanie tłuszczu w tkance
tłuszczowej bo
• 1. zwiększa napływ glukozy i z tego powstaje α-glicerol
phosphate - potrzebny do syntezy triglicerydow
• Gdy brak jest insuliny nie można zmagazynować
tłuszczu w tkance tłuszczowej, niedobór insuliny
zwiększa użycie tłuszczu do produkcji energii

Efekt insuliny na metabolizm
tłuszczu
• Tak jest między posiłkami gdy mało jest insuliny i
jest to ekstremalnie nasilone w cukrzycy
• Brak insuliny – lipoliza zmagazynowanego tłuszczu
i uwalnianie wolnych kwasów tłuszczowych (WKT)
• Są źródłem energii dla wszystkich tkanek z
wyjątkiem mózgu !!!
• Brak insuliny – wzrost stężenie cholesterolu i
fosfolipidow w osoczu; nadmiar WKT i glicerolu –
synteza w wątrobie cholesterolu i fosfolipidów i
triglicerydów – wydzielane (usuwane z wątroby)
jako lipoproteiny – rozwój miażdżycy w cukrzycy
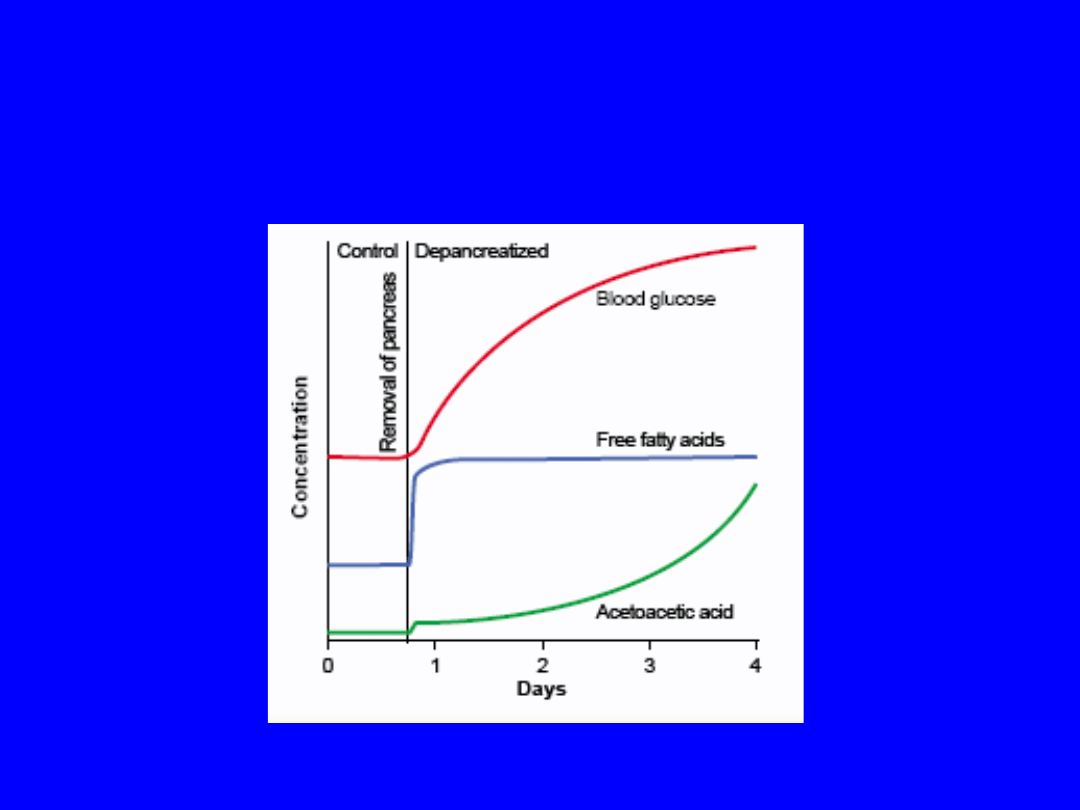
Effect of removing the pancreas on the
approximate concentrations of blood
glucose, plasma free fatty acids, and
acetoacetic acid

Nadmierne zużycie tłuszczów w
czasie braku insuliny powoduje
ketozę i kwasicę
• W wątrobie tworzy się nadmiar kwasu
acetooctowego : bo dużo WKT i brak insuliny
→aktywacja zależnego od karnityny transportu
WKT do mitochondriów → mitochondria
intensywna β-oksydacja → dużo acetyl-CoA,
nadmiar kondensowany do kwasu acetooctowego
→ uwalniany do krwi → normalnie powinien być
zużyty w tkankach obwodowych ale brak insuliny
to upośledza → kwas acetooctowy rośnie we krwi
i powstaje kwasica !!!

Ketoza
• Część kwasu acetooctowego przekształcana
do acetonu i β-betahydroxybutyric acid
• Są to ciała ketonowe a nagromadzenie się ich
we krwi nazywa się KETOZA
• Ciężka kwasica , śpiączka , śmierć

Insulina a metabolizm białek i
wzrost
• ↑ rośnie synteza białek i magazynowanie po posiłku gdy
jest insulina. Mechanizm nie do końca poznany ale coś
wiemy :
1. Stymuluje transport aminokwasów do komórek ; valina,
izoleucyna, tyrozyna, fenyloalanina
2. Zwiększa powstawanie mRNA (translacja) włącza
(aktywuje) rybosomy
3. Zwiększa szybkość transkrypcji wybranych sekwencji DNA
(enzymy dla przechowywania tłuszczu, glukozy, białek).
4. Hamuje katabolizm białek, hamuje degradację białek przez
lizosomy
5. W wątrobie hamuje glukoneogenezę, co oszczędza
aminokwasy bo sa one do tego substratami

Insulina a metabolizm białek i
wzrost
• Odwrotnie brak insuliny powoduje brak,
zubożenie komórek w białka i wzrost
aminokwasów w osoczu
• Aminokwasy są wykorzystane do glukoneogenezy
i bezpośrednio jako źródło energii → więcej
mocznika i większe jego wydalanie z moczem
(„ujemny bilans azotowy”)
• W ciężkiej cukrzycy to osłabia i upośledza funkcje
wielu narządów
• Jest synergizm insuliny i hormonu wzrostu w
indukcji wzrostu
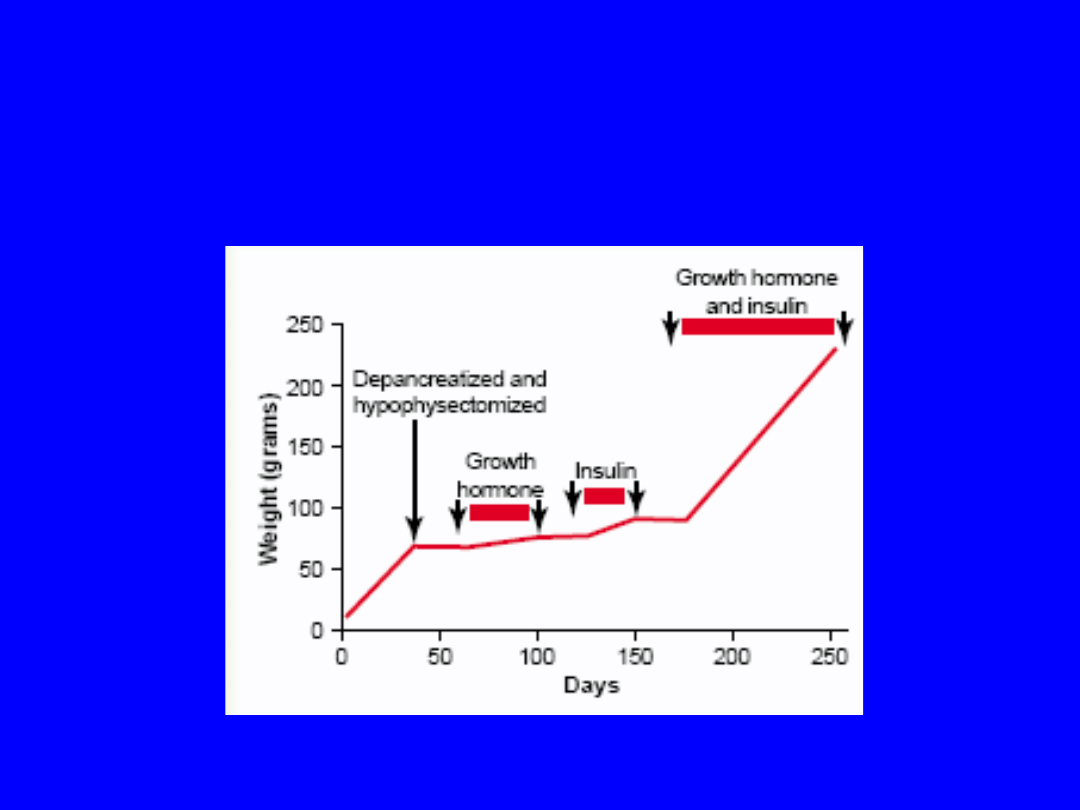
Effect of growth hormone, insulin, and
growth hormone plus insulin on growth in a
depancreatized and hypophysectomized rat.

Mechanizm wydzielania insuliny
• Komórki-β → mają dużo transportera glukozy
(GLUT-2), napływ glukozy do komórki
proporcjonalny do jej stężenia w osoczu →
(glukokinaza) glukozo-6-fosforan – z niej powstaje
ATP → on hamuje ATP-sensitive K+ channel w
błonie komórkowej (zamknięcie kanału) →
depolaryzacja→ aktywacja voltage-gated calcium
channel → napływ Ca2+ do komórki → fuzja
zaktywowanych pęcherzyków z insuliną z błoną
komórkową i egzocytoza insuliny
• Pewne aminokwasy działają tak jak glukoza na
wydzielnie insuliny
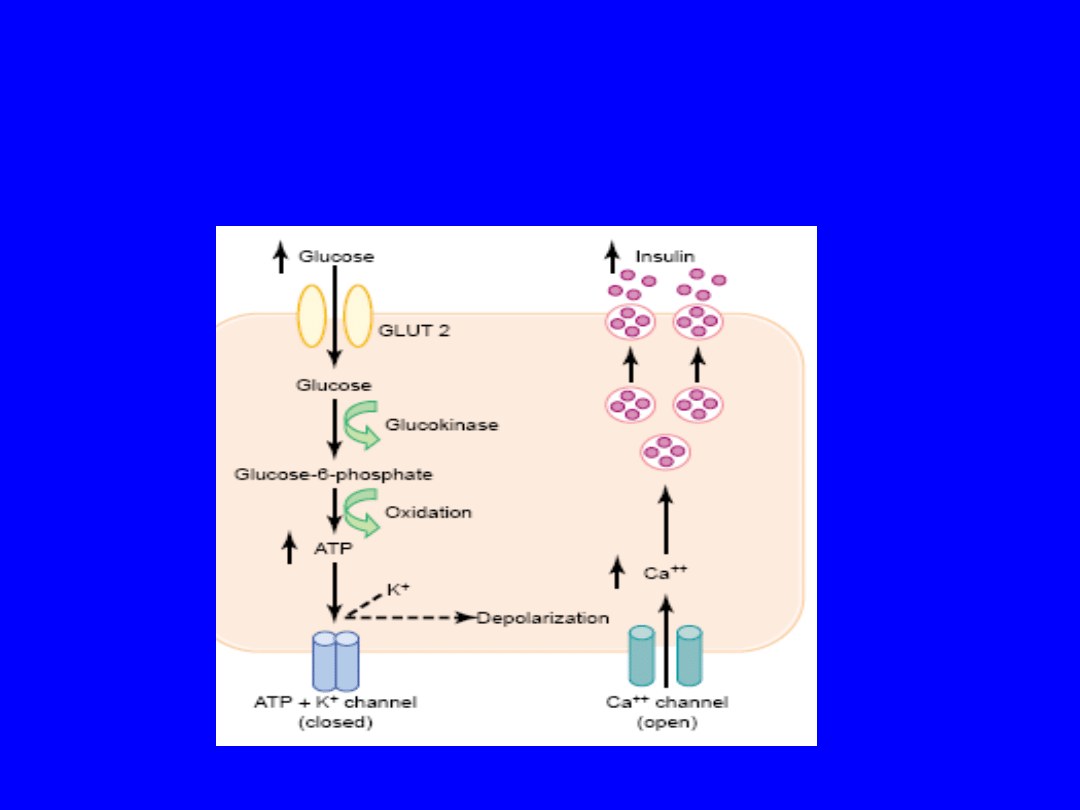
Basic mechanisms of glucose stimulation of
insulin secretion by beta cells of the pancreas.
GLUT, glucose transporter

Wydzielanie insuliny
• [Glukagon, GIP (gastric inhibitory peptide),
acetylocholina] → ↑ Ca2+ i nasilają efekt glukozy
• Somatostatyna, norepinefryna (przez α-receptory) –
hamują egzocytozę insuliny
• Sylfonylomocznik (lek cukrzyca typ II) , nasila
sekrecja insuliny- wiąże się z ATP- sensitive K+
channel i blokuje go (reszta podobnie jak fizjologia)
• Dawniej uważano że glukoza w osoczu jest jedynym
regulatorem wydzielania insuliny, obecnie wiemy,
ze inne czynniki tez wpływają na sekrecję insuliny
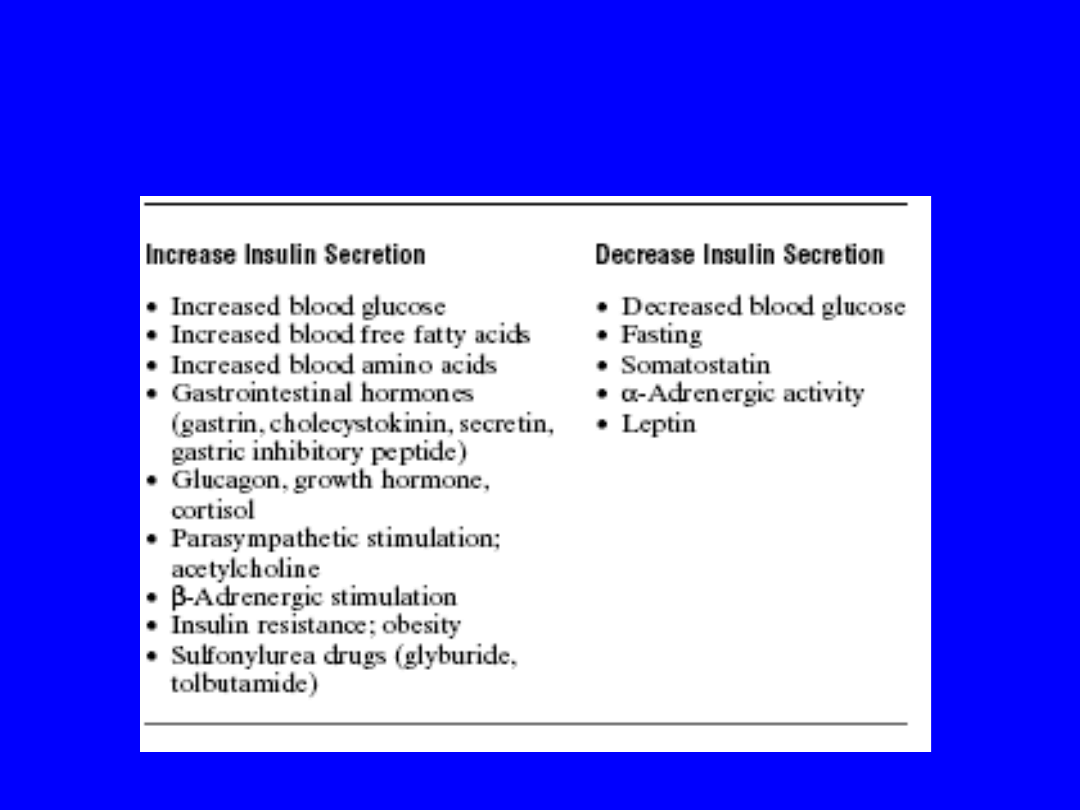
Factors and Conditions That Increase or
Decrease
Insulin Secretion

Wydzielanie insuliny
• ↑ glukozy stymuluje wydzielanie insuliny
• Poziom glukozy na czczo 80-90 mg/100 ml →
wydzielanie insuliny minimalne 25 ng/min/kg masy
ciała daje to minimalną fizjologiczna aktywność .
• 2-3 krotny ↑ stężenia glukozy i utrzymuje się przez
pewien czas (kilka h) to wydzielanie insuliny
bardzo rośnie – proces dwufazowy
• 1 faza- insulina w osoczu ↑ około 10 razy w ciągu
3-5 min po ostrym wzroście glukozy – z powodu
natychmiastowego wydzielania gotowej
(preformowanej) insuliny , ale spada o 50% w ciągu
następnych 5-10 min

Wydzielanie insuliny
• Faza 2. po około 15 min – znowu rośnie
wydzielanie insuliny i utrzymuje się przez 2-3
h nawet na wyższym poziomie niż na początku
. Wynika to z uwalniania preformowanej i
nowosyntezowanej insuliny
• Gdy glukoza > 100mg/dl to sekrecja insuliny
szybko rośnie. Max. gdy stężenie glukozy
wynosi 400-600 mg/dl (wzrost nawet o 10-25
razy)
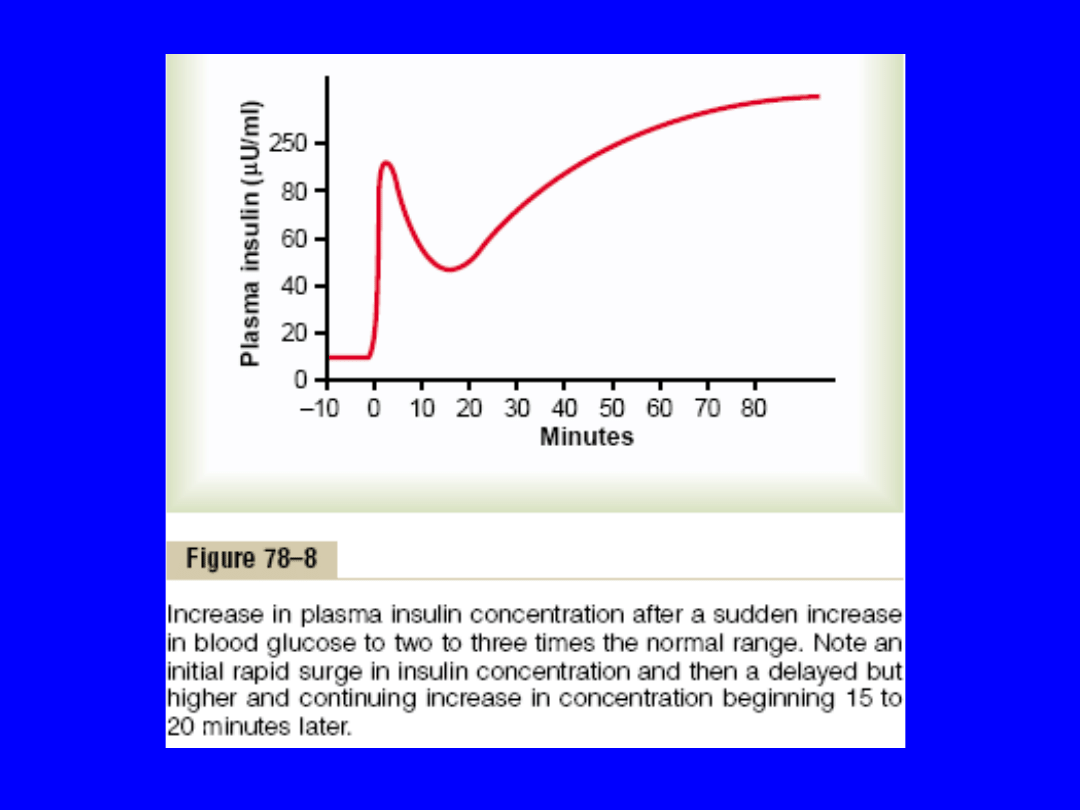
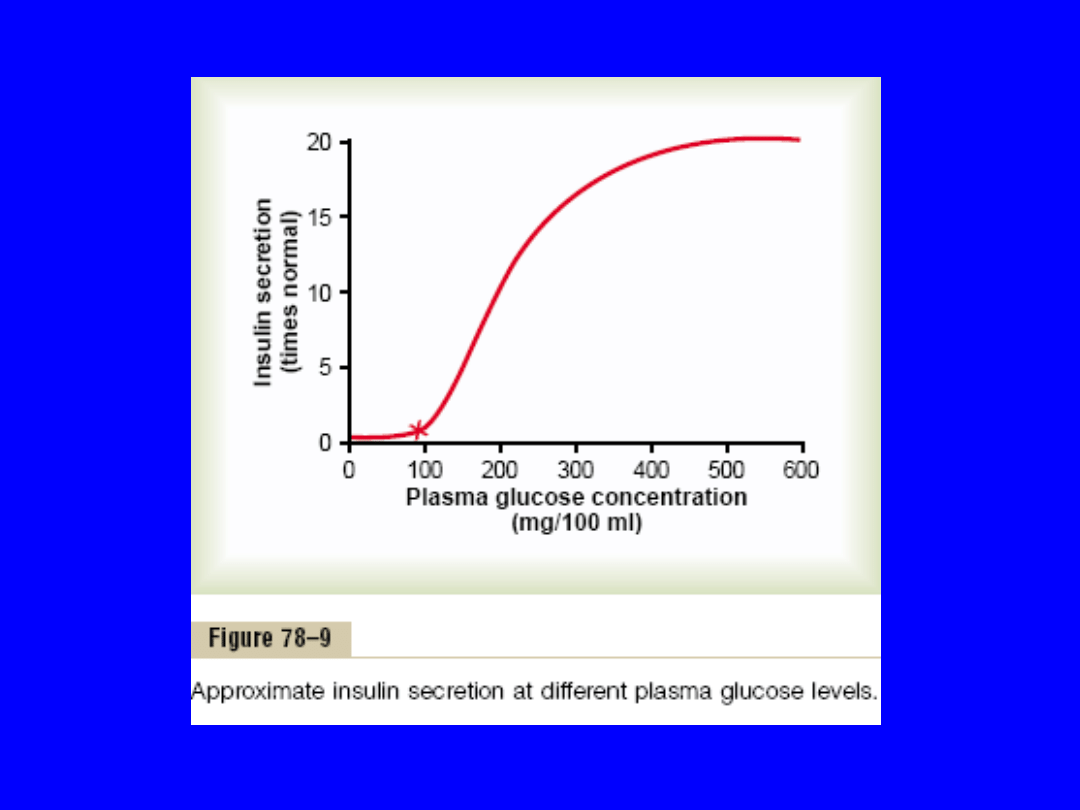

Wydzielanie insuliny
• Wyłączenie wydzielania insuliny jest tak samo
szybkie jak włączenie
• Glukoza spada do poziomu na czczo –
wydzielanie insuliny zatrzymuje się po 3-5min
• Ujemne sprzężenie zwrotne między glukoza a
insuliną
• Inne stymulatory wydzielania insuliny :
• Aminokwasy – najsilniejsza arginina i lizyna ,
same podane słabo nasilają wydzielanie insuliny,
podane z glukoza nasilają działanie glukozy

Wydzielanie insuliny
• Aminokwasy nasilają stymulujące działanie
glukozy na wydzielanie insuliny (nawet 2-
krotne wzmocnienie)
• Hormony żołądkowo-jelitowe – mieszanina
:gastryna, sekretyna, cholecystokinina, GIP →
umiarkowane nasilenie wydzielania insuliny
(nasilają odpowiedz na glukozę tez około 2
razy) ,
• Wcześniej przygotowują wzrost insuliny na
wchłonięte w jelitach glukozę i aminokwasy

Wydzielanie insuliny
• Glukagon, hormon wzrostu, kortyzol, i w
mniejszym stopniu progesteron, estrogen
• Bezpośrednio stymulują wydzielanie insuliny lub
zwiększają odpowiedz na glukozę
• Ważne !!! – długotrwała stymulacja może
powodować wyczerpanie komórek β wysp
Langerhansa i zwiększać ryzyko rozwoju cukrzycy
• Gdy jest konieczne podawanie tych hormonów
przewlekle w wysokich dawkach – może rozwinąć
się cukrzyca
• Gigantyzm, akromegalia – często wtórnie cukrzyca

Wydzielanie insuliny
• Długotrwale glikokortykoidy (lub guz
nadnerczy) – cukrzyca
• Pobudzenie nerwów przywspółczulnych
dochodzących do trzustki może zwiększyć
wydzielanie insuliny – ale czy to ma znaczenie
fizjologiczne ? Nie wiadomo

Insulina i inne hormony jako przełączniki
między metabolizmem lipidów a
węglowodanów
• Insulina: promuje węglowodany jako źródło
energii i zmniejsza zużycie tłuszczów (do tego)
• Odwrotnie brak insuliny: tłuszcze źródło
energii a nie glukoza (z wyjątkiem mózgu)
• Stężenie glukozy we krwi jest przełącznikiem
dla tych dwóch mechanizmów
• Niska glukoza to niska insulina
• Wysoka glukoza to wysoka insulina

Insulina i inne hormony jako przełączniki
między metabolizmem lipidów a
węglowodanów
• Przynajmniej 4 inne hormony biorą w tym udział:
• GH (hormon wzrostu), kortyzol, epinefryna i
glukagon.
• Hipoglikemia stymuluje wydzielanie GH i
kortyzolu i oba zmniejszają komórkowe zużycie
glukozy , jednocześnie promując zużycie tłuszczu.
Efekt działania pojawia się stosunkowo wolno , po
kilku-kilkunastu h.
• Epinefryna - ↑ stężenie glukozy we krwi w czasie
stresu i stymulacji współczulnej ale jednocześnie
zwiększa stężenie WKT w osoczu !!!

Insulina i inne hormony jako przełączniki
między metabolizmem lipidów a
węglowodanów
•
Dlaczego tak działa epinefryna ?
•
Bo:
a) Indukuje glikogenolizę w wątrobie
b) Lipoliza w adipocytach (aktywuje
hormonozależna lipazę)
Ilościowo B >A i w sytuacjach stresu, wysiłku,
lęku, wstrząsu krwotocznego nasila zużycie
tłuszczu (WKT)

Glukagon
• Wydzielany z komórek α gdy glukoza ↓
• Funkcje całkowicie przeciwstawne do insuliny
– najważniejsza podnieść stężenie glukozy we
krwi
• M.cz. – 3485 daltonów , łańcuch 29
aminokwasów
• Doświadczenia na zwierzętach – glukagon iv
1µg/kg masy ciała – podnosi stężenie glukozy
o ~ 20 mg/dl (25% wzrost) w ciągu 20 min
• Hyperglycemic hormone

Glukagon działanie na metabolizm
glukozy
• 1. glikogenoliza (wątroba)
• 2. wzrost glukoneogenezy (wątroba)
• To zwiększa dostępność glukozy dla innych
organów ciała
• Glikogenoliza w wątrobie – bo glukagon aktywuje
cyklazę adenylanową i ↑ cAMP ---- aktywacja
kinazy białkowej ----- konwersja fosforylazy b do
fosforylazy a → degradacja glikogenu do glukozo-
1-fosforanu – defosforylacja i uwalnianie glukozy z
hepatocytów

Glukagon działanie na metabolizm
glukozy
• Sekwencja zdarzeń (etapów), po każdym etapie
przybywa aktywnego produktu (amplifikacja
przewodzenia sygnału) – wzmocnienie nawet milion
razy !!! , dlatego mikrogramy glukagonu – podwajają
(lub więcej) stężenie glukozy we krwi w ciągu kilku
minut
• Wlew i.v. glukagonu przez 4 h – tak silna
glikogenoliza że zapasy glikogenu w wątrobie stają
się puste
• Ale po dalszych 4 h wlewu rośnie nadal glukoza we
krwi – dlaczego ? Bo nasila glukoneogenezę – rośnie
wychwyt aminokwasów przez hepatocyty i z nich jest
synteza glukozy

Inne działania glukagonu
• Występują gdy jego stężenie rośnie powyżej
maksimum jakie normalnie występuje we krwi :
aktywacja adipose cell lipase, hamowanie
przechowywanie triglicerydów w wątrobie →
dostarczanie energii dla innych tkanek.
• W bardzo dużych stężeniach (fizjologicznie bez
znaczenia):
1 zwiększa siłę skurczu serca
2 zwiększa przepływ krwi przez nerki
3 nasila wydzielanie żółci
4 hamuje wydzielanie soku żołądkowego
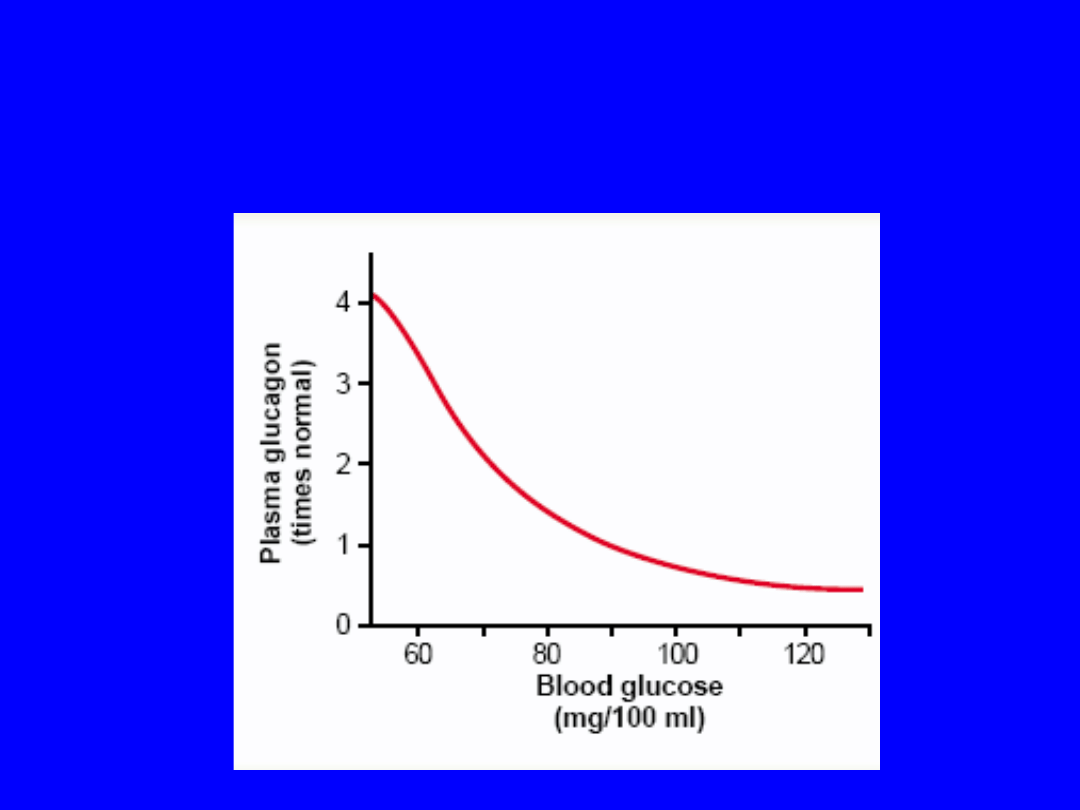
Approximate plasma glucagon
concentration at different blood glucose
levels.

Glukagon
• ↑ stężenia aminokwasów we krwi nasila wydzielanie
glukagonu, np. po jedzeniu – alanina, arginina , to
też stymuluje wydzielanie insuliny ( w tym przypadku
odpowiedzi glukagonu i insuliny nie są
przeciwstawne
• Wysiłek fizyczny stymuluje wydzielanie glukagonu –
wyczerpujący wysiłek stężenie glukagonu rośnie 4-5
razy- ma to zapobiec spadkowi glukozy
• Dlaczego tak działa wysiłek nie do końca wiadomo –
bo glukoza nie spada ( może przez wzrost
aminokwasów, β-adrenergiczna stymulację wysp
Langerhans’a)

Somatostatyna
• Hamuje wydzielanie glukagonu i insuliny
• Komórki Δ – somatostatyna, 14 aminokwasów,
b. krótki T1/2 ~ 3 min we krwi krążącej
• Prawie wszystkie czynniki związane z
jedzeniem stymulują wydzielanie
somatostatyny : ↑ glukozy, aminokwasów,
kwasów tłuszczowych, ↑ hormonów jelitowo-
żołądkowych ( z górnej części przew. pok.)

Somatostatyna
• Hamujące działanie somatostatyny :
1. na wyspy L. – hamuje wydzielanie insuliny i glukagonu
2. zmniejsza ruchliwość żołądka, dwunastnicy, pęcherzyka
żółciowego
3. Zmniejsza wydzielanie i wchłanianie w przewodzie
pokarmowym
Po co ? – by zwiększyć czas w jakim jest wchłaniane
pożywienie do krwi, zwiększa krążenie tych substancji
we krwi
Somatostatyna= growth hormone inhibitory hormone –
wydzielana z podwzgórza i hamuje wydzielanie GH z
przysadki

Podsumowanie regulacji stężenia glukozy
we krwi
• 80-90 mg/dl – rano na czczo lub w dzień bez jedzenia
• To stężenie rośnie do 120-140 mg/dl po jedzeniu ( w
ciągu 1 h) ale spada w ciągu 2 h do wartości
wyjściowych po ostatnim wchłonięciu węglowodanów
• Gdy głoduje to glukoneogeneza w wątrobie zapewnia
utrzymanie stężenia 80-90 mg/dl
• Wątroba układ buforowy dla glukozy we krwi - ~ 2/3
glukozy wchłanianej z przewodu pokarmowego jest
przechowane w wątrobie a później uwalniane gdy
stężenie glukozy i insuliny spada

Podsumowanie regulacji stężenia
glukozy we krwi
•
Wątroba „spłaszcza” fluktuacje w stężeniu glukozy
(o ~ 30%) , u pacjentów z ciężkim uszkodzeniem
wątroby duże wahania stężenia glukozy)
•
Glukagon i insulina – zwrotna kontrola utrzymująca
prawidłowe stężenie glukozy we krwi:
•
↑ glukozy to ↑ insuliny ; ↓ glukozy to ↑ glukagonu
•
W większości przypadków ważniejsza jest insulina
ale w czasie długiego ekstremalnego wysiłku lub
głodowania ważny jest glukagon (także w
sytuacjach stresowych)

Podsumowanie regulacji stężenia
glukozy we krwi
• Gdy jest głęboka hipoglikemia → stymulacja
podwzgórza (detektory) – pobudzenie układu
współczulnego → epinefryna → dalsze uwalnianie
glukozy z wątroby
• Godziny, dni – hormon wzrostu, kortyzol –
uwalniane w wyniku długotrwałej hipoglikemii.
Zmniejszają zużycie glukozy przez komórki na
korzyść tłuszczu
• Znaczenie regulacji glukozy – Po co regulować
bo jak spadnie glukoza to komórki będą zużywać
tłuszcz jako źródło energii ???

Podsumowanie regulacji stężenia
glukozy we krwi
• Trzeba regulować bo glukoza jest jedynym źródłem
energii dla mózgu, siatkówki oka, i germinal epithelium
w gonadach
• Po co nie dopuszczać do wysokich stężeń glukozy ???
• Bo ma efekt osmolarny i spowoduje odwodnienie
komórek
• Utrata glukozy z moczem
• Diureza osmotyczna – utrata wody i elektrolitów
• Gdy długo wysokie stężenie to uszkodzenie naczyń
krwionośnych – zawał m. sercowego, udar,
niewydolność nerek, retinopatia, niedokrwienie i
martwica kończyn

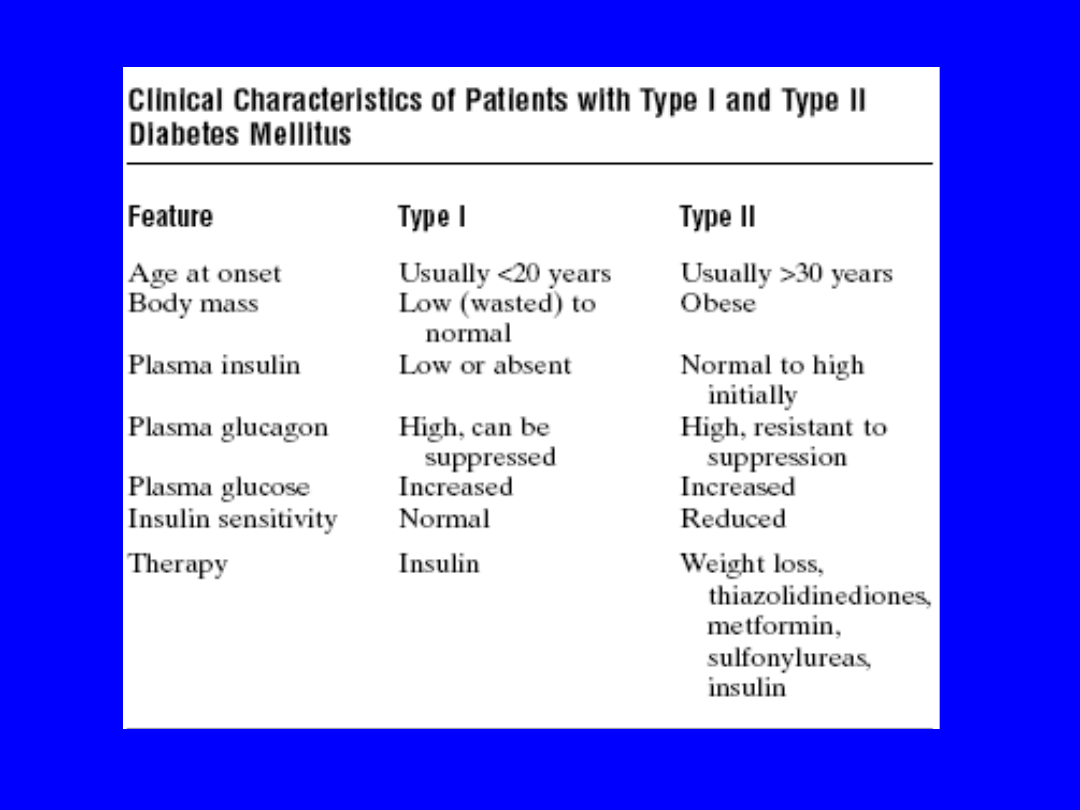
Cukrzyca
• Zespól spowodowany upośledzonym metabolizmem
węglowodanów , tłuszczów i białek w wyniku braku
insuliny lub/i zmniejszonej wrażliwości tkanek na insulinę
• 2 typy cukrzycy
• Typ I- insulinozależna (IDDM) – brak wydzielania insuliny
• Typ II non-insulin-dependent- diabetes mellitus (NIDDM)
zmniejszona wrazliwość docelowych tkanek na efekt
metaboliczny insuliny (opornośc na insulinę)
• W obu typach: ↑ stężenie glukozy, ↓ utylizacja glukozy (z
wyjątkiem mózgu) , ↑ utylizacja tłuszczów i białek

Cukrzyca typ I
• Uszkodzenie komórek β: infekcja wirusowa,
choroby z autoagresji, czynniki genetyczne
(wrodzona)- przyspieszające degenerację
komórek β
• Początek w wieku ok.. 14 lat (USA), rozwija
się szybko (kilka dni- tygodni)
• 3 podstawowe zmiany:
• ↑ glukoza we krwi, ↑ zużycie tłuszczów dla
energii i ↑ tworzenie cholesterolu w wątrobie,
utrata białek organizmu

Cukrzyca typ I
• Glukoza rośnie do 300-1200 mg/dl (próg
nerkowy 180 mg/dl)
• Glukoza 300-500 mg/dl → 100 g i więcej
glukozy jest tracone z moczem
• Odwodnienie, odwodnienie komórek (jak ?)
diureza osmotyczna, poliuria,
• Zewnątrz- i wewnątrz-komórkowe
odwodnienie, zwiększone pragnienie
• Przewlekły wzrost glukozy→ uszkodzenie
tkanek : obwodowa neuropatia, dysfunkcja
układu autonomicznego:

Cukrzyca typ I
• Uszkodzone odruch naczyniowo-sercowe,
upośledzona kontrola funkcji pęcherza
moczowego, zaburzenia czucia w kończynach
• Nadciśnienie i miażdżyca – często współistnieją
lub rozwijają się w związku z DM.
• ↑ zużycia tłuszczów i kwasica metaboliczna –
bo wzrost ketokwasów i odwodnienie, ciężka
kwasica → śpiączka →śmierć
• Kompensacja kwasicy – oddechowa i nerkowa
• pH < 7.0 – śpiączka kwasicza (bez leczenia
dużymi dawkami insuliny śmierć)
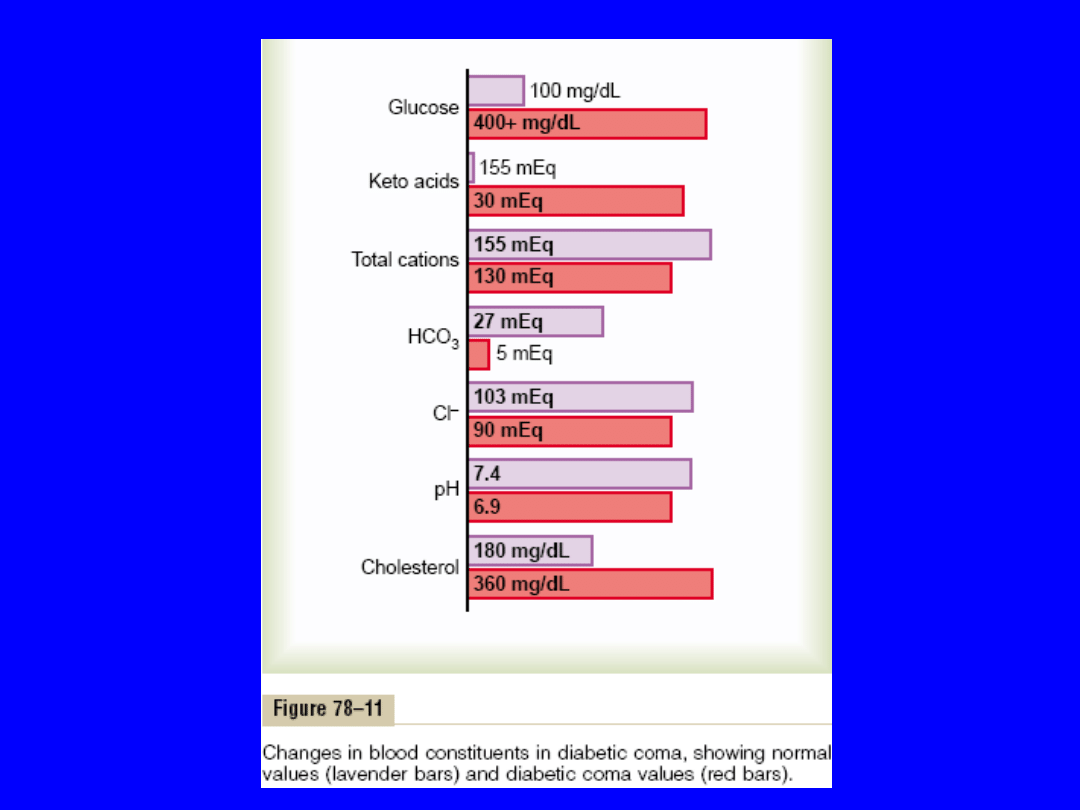

Cukrzyca typ I
• ↑ zużycie białek i ich zmniejszenie
w komórkach
• Utrata masy ciała (asthenia)
• Dużo je (polyphagia)
• Bez leczenia śmierć w ciągu kilku
tygodni

Cukrzyca typ II
• 90 % wszystkich przypadków cukrzycy w USA
• Najczęściej początek w wieku 50-60 lat, rozwija
się stopniowo
• Ale pojawia się już u młodszych bo rozwój otyłości
(nawet u dzieci)
• Jest związana ze zwiększonym stężeniem insuliny
w osoczu (hyperinsulinemia) bo kompensacja
oporności na insulinę
• W przypadku otyłości – mniej receptorów dla
insuliny (?), uposledzenie przekazywania sygnału
(?)

Cukrzyca typ II
•
Zespól Metaboliczny
1 Otyłość (szczególnie typ brzuszny – visceral fat)
2 oporność na insulinę
3. hiperglikemia na czczo
4. Zaburzenia lipidowe - ↑ triglicerydów, ↓ HDL
5. Nadciśnienie tętnicze
Duże ryzyko cardiovascular-diseases

Cukrzyca typ II
• Inne czynniki które powodują oporność na insulinę
• Policystic ovary syndrome (~6% kobiet)
• Zwiększona synteza androgenów w jajnikach i
rozwój oporności na insulinę (80% z nich ma
cukrzyce typu II
• Nadmierna produkcja glikokortykoidów (zespól
Cushing’a) lub hormonu wzrostu (akromegalia)
Gdy oporność trwa i rozwija się to zwiększone ilości
insuliny nie wystarczają i rozwija się
hiperglikemia.we wczesnych stadiach cukrzycy
typu II

Cukrzyca typ II
Później wyczerpanie komórek β i nie mogą
produkować insuliny by zapobiec zwiększonemu
stężeniu glukozy zwłaszcza po posiłkach bogatych w
węglowodany
Są tacy u których β komórki nie wyczerpują się i
nigdy nie rozwinie się u nich klinicznie jawna
cukrzyca (typ-II). Zależy to od czynników
genetycznych
W wielu przypadkach efektywne leczenie obejmuje
(zwłaszcza w początkowych stadiach choroby):
zwiększenie wysiłku, ograniczenie wchłaniania kalorii
i redukcja masy ciała i nie trzeba podawać insuliny


Cukrzyca typ II
• Leki zwiększające wrażliwość na
insulinę: metformina, thiazolidinediones
• Zwiększające wydzielanie insuliny –
pochodne suflonylomocznka
• W późnych fazach cukrzycy typu II
trzeba podawać insulinę

Fizjologiczne podstawy diagnozy
cukrzycy
• Glukoza w moczu. Zdrowy człowiek traci
niewykrywalne ilości glukozy w moczu.
• Osoba chora na cukrzycę jest glukoza w moczu
• Glukoza na czczo (wczesny ranek) 80-90 mg/dl ,
110 mg/dl górna granica normy, powyżej -
cukrzyca lub istotna oporność na insulinę
• Typ I – insulina w osoczu b. niska lub
niewykrywalna (na czczo lub po jedzeniu)
• Typ II – insulina kilka razy podwyższona i
bardzo rośnie po obciążeniu

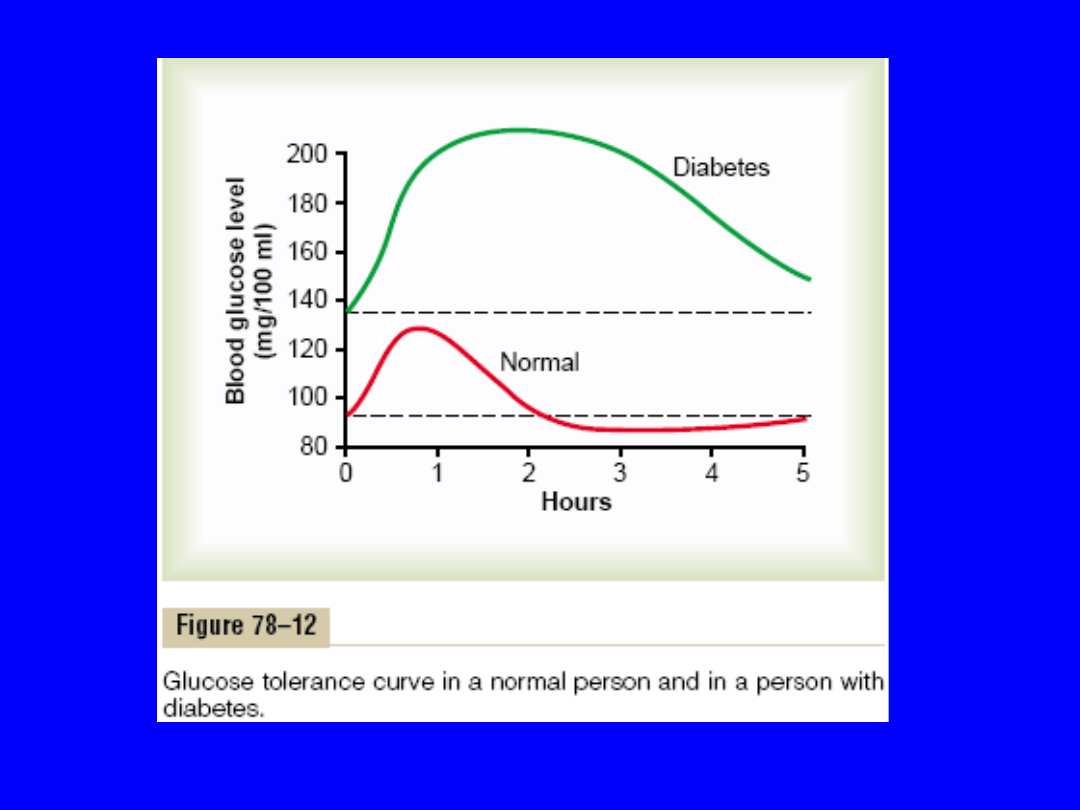
Test tolerancji (obciążenia)
glukozy
• Obciążenie 1 g glukozy na 1 kg masy ciała
• U zdrowego ↑ nie przekracza 140 mg/dl po 2 h
spada do wartości niższych niż na początku
• U chorego wyjściowe stężenia wysokie , ↑ dużo
większy , spadek do wartości wyjściowych później
i nie obniża się poniżej wartości wyjściowych
• Pomiar insuliny pozwala rozróżnić czy to jest typ I
czy II
• Aceton w powietrzu wydechowym , ketokwasy w
moczu – w zaawansowanej DM typu II też są
wykrywalne

Hiperinsulinizm,
insulinoma
• Gruczolak wysp Langerhans’a (dużo rzadziej
niż cukrzyca), 10-15% gruczolaków jest
złośliwych – przerzuty rozprzestrzeniają się w
organizmie - olbrzynia produkcja insuliny
• Takim pacjentom trzeba było podawać we
wlewie nawet > 1000 g glukozy na dobę by
zapobiec hipoglikemii !!!
• Wstrząs insulinowy (insulinoma, pacjent chory
na cukrzyce podał sobie za dużo insuliny)

Wstrząs insulinowy
• Glukoza 50-70 mg/dl – pobudzenie,
halucynacje, nerwowość, drżenie, poty
• Glukoza 20-50 mg/dl – napady drgawek
klonicznych, utrata przytomności
• Jeszcze niżej – nie ma drgawek jest tylko
śpiączka
• iv glukoza – dramatyczna poprawa nawet w
ciągu kilku minut
• Jeśli leczenie nie będzie szybko wdrożone
może być trwałe uszkodzenie OUN
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
Wyszukiwarka
Podobne podstrony:
Głowne metaboliczne efekty działania insuliny, farmacja, cukrzyca
1 Cukrzycat3poprid 9121 ppt
09 cukrzycaid 7919 ppt
insuliny, farmacja, cukrzyca
1p dr B G powiklania cukrzycyid 19107 ppt
18 opinie takie tamid 17793 ppt
18 www prezentacje orgid 17852 ppt
1 PRZECH urz pomiarowe 18 02 2009 KOMPLETid 9649 ppt
18 Multipleksery i bramki trójstanoweid 17792 ppt
Głowne metaboliczne efekty działania insuliny, farmacja, cukrzyca
1 Cukrzycat3poprid 9121 ppt
09 cukrzycaid 7919 ppt
INSULINA & GLUKAGON – HORMONY ANTAGONISTYCZNE
18 Badanie słuchu fonemowego z uzyciem testu sylab nagłosowychid 17648 ppt
więcej podobnych podstron