1
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
Pierwsza zasada
termodynamiki
Waldemar Ufnalski
Wprowadzenie do termodynamiki
chemicznej
Wykład 3
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
A"
C"
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
A"
C"

2
3.1. Pojęcie pracy w
termodynamice
Wykład 3
3
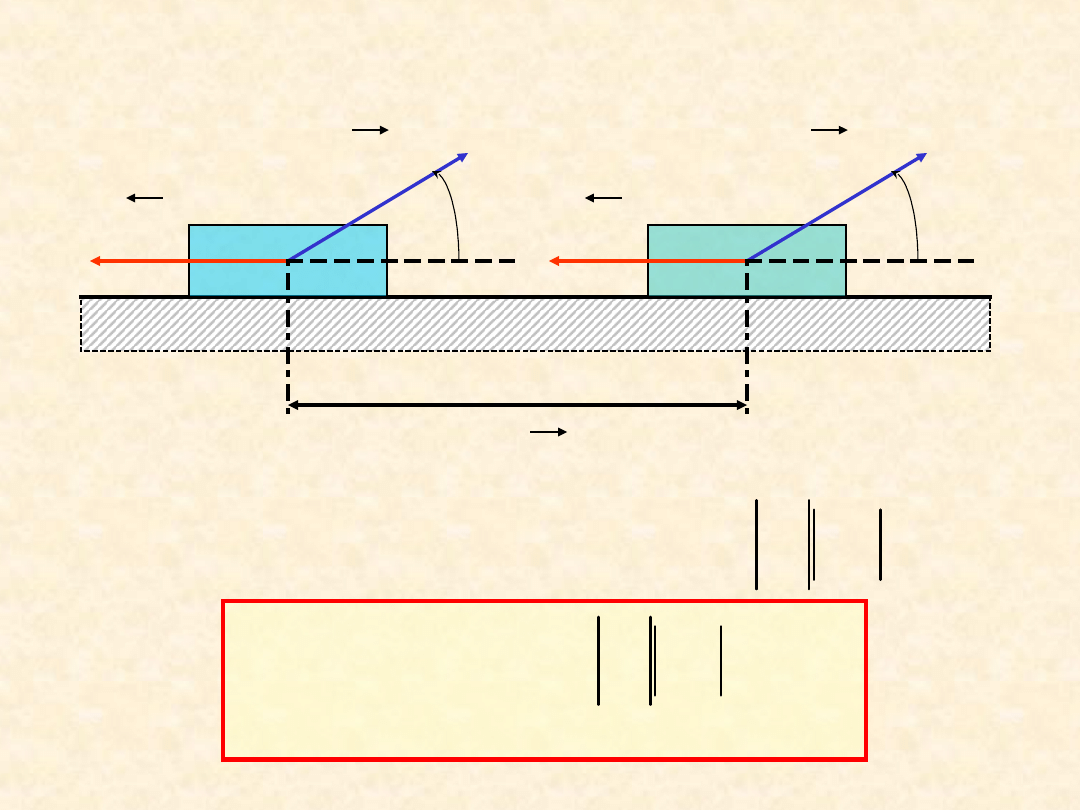
Praca mechaniczna przeciwko
sile tarcia
F
t
F
F
t
F
d s
s
d
F
dW
t
cos
s
d
F
s
d
F
dW
droga
droga
s
d
F
s
d
F
W
cos
4
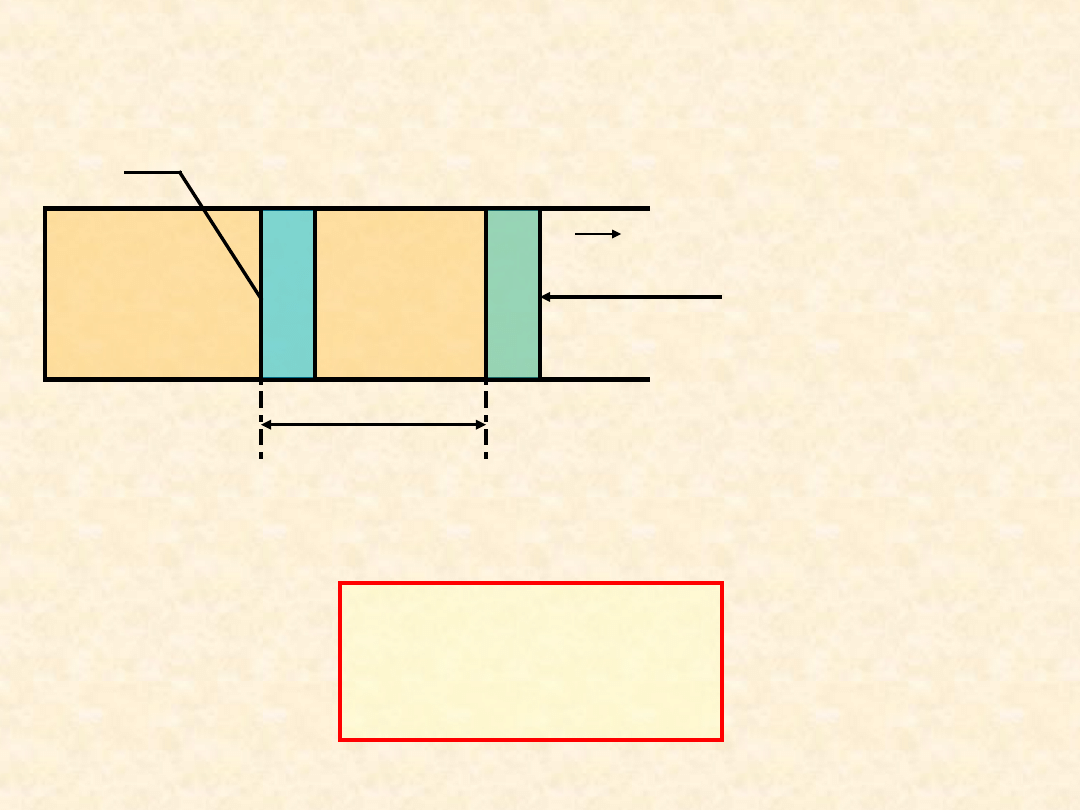
Praca objętościowa przeciwko
ciśnieniu zewnętrznemu
dl
A
F
z
= P
z
·A
dV
P
dl
F
dW
z
z
obj
dV=A
dl
droga
z
obj
dV
P
W
5
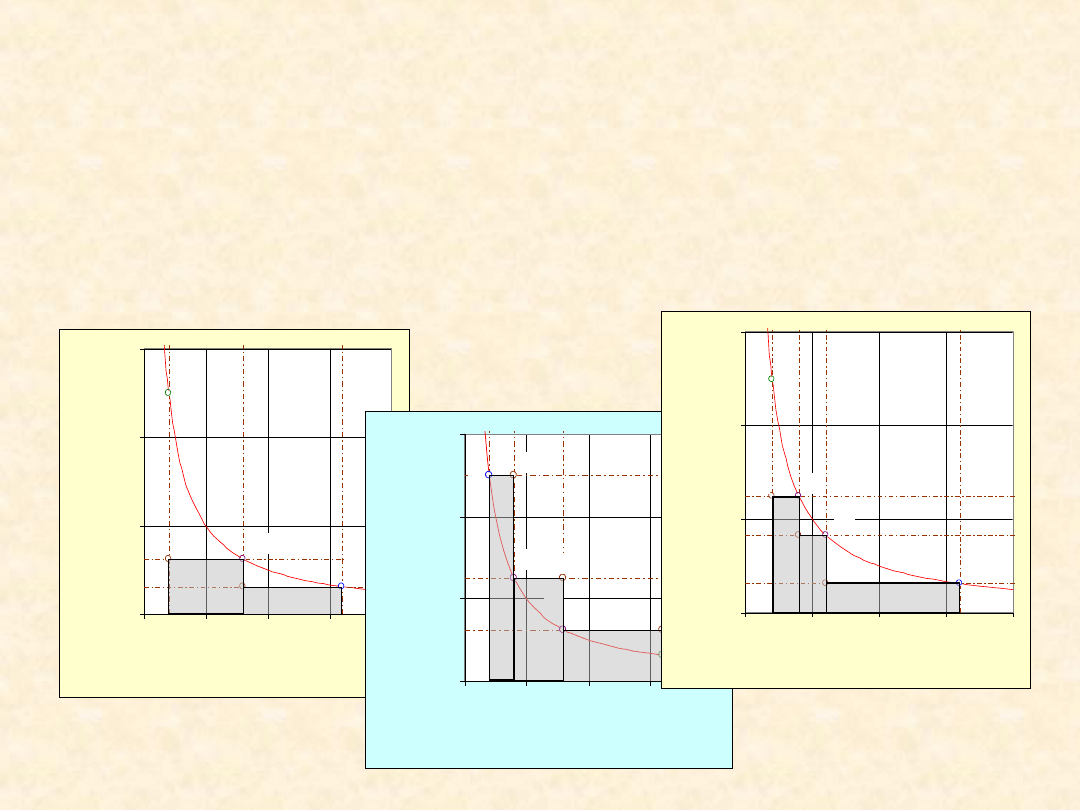
Wieloetapowe rozprężanie gazu
i
z
P
V
P
V
k
V
2
V
1
i
z
P
i
z
P
i
z
P
....
i
i
z
i
V
P
W
n
i
i
i
z
n
obj
V
P
W
1
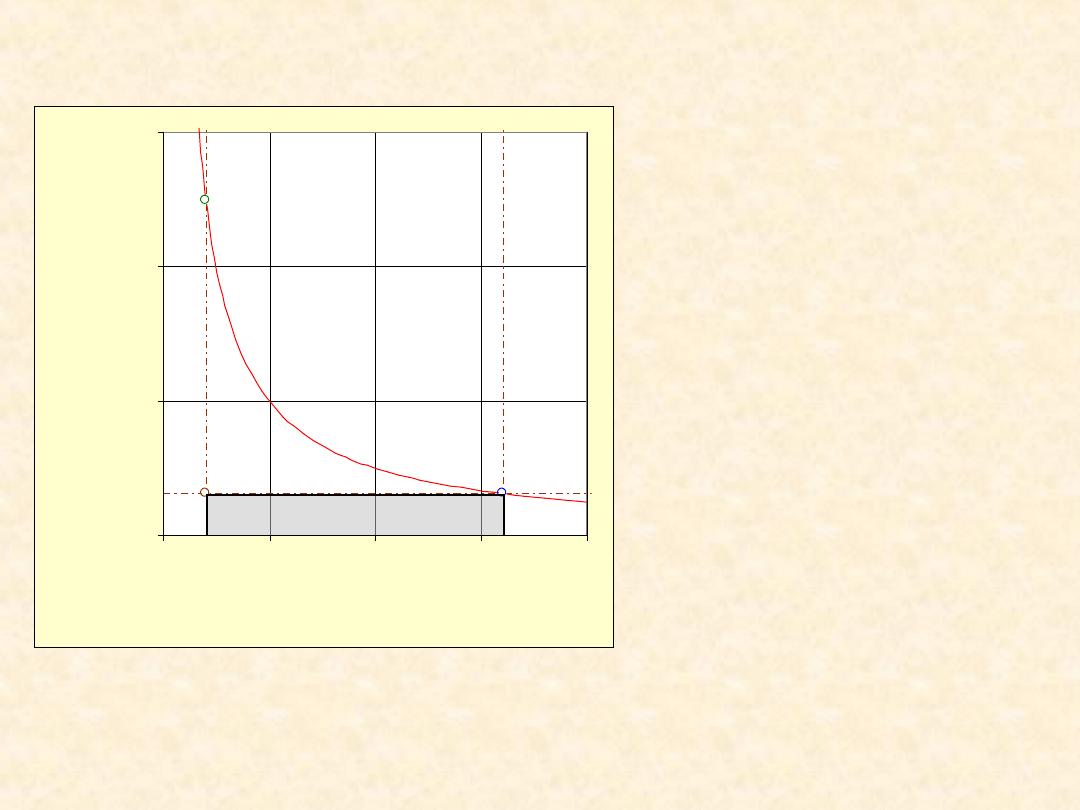
6
Praca rozprężania gazu
doskonałego ...
Warunki:
• T = 300,0 K
• n = 1,00 mol
• V
pocz
= 0,0100 m
3
• P
pocz
= 2,495e05
Pa
• V
końc
= 0,0800 m
3
• P
końc
= 3,118e4
Pa
• W = -2183 J
• W
odwr
= -5187 J
• W/W
odwr
= 42,1 %
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
Proces
jednoetapowy
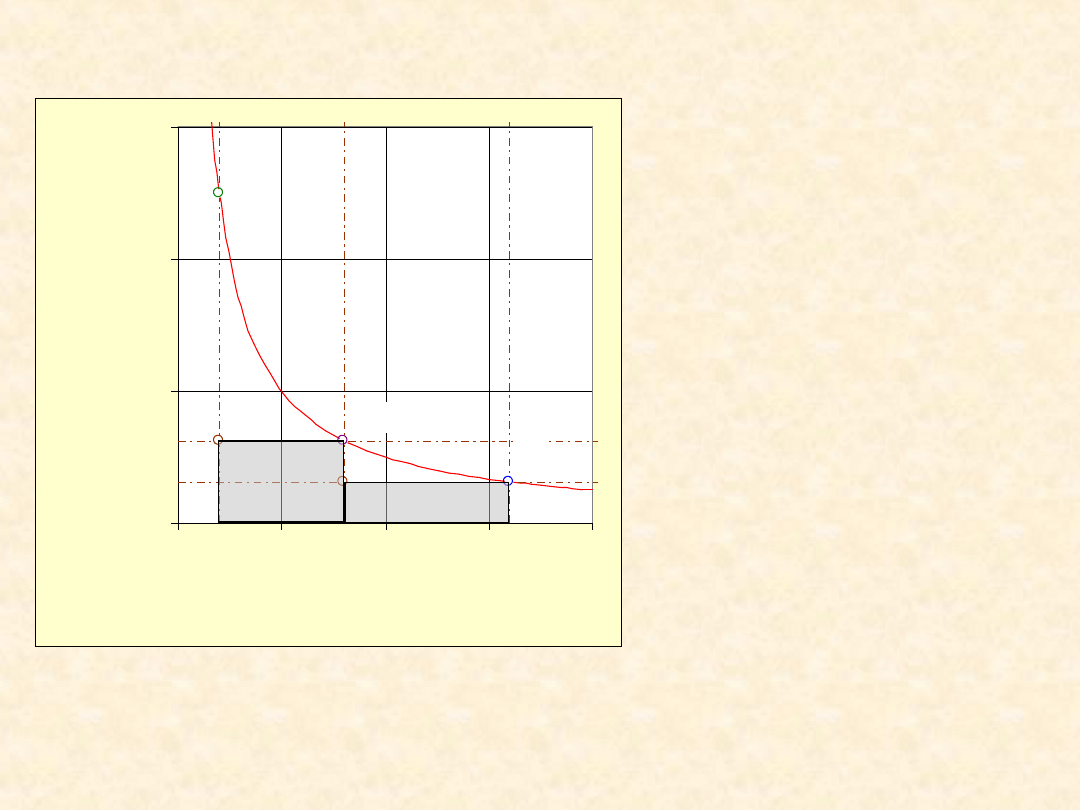
7
Praca rozprężania gazu
doskonałego ...
Warunki:
•
T = 300,0 K
•
n = 1,00 mol
•
V
pocz
= 0,0100 m
3
•
P
pocz
= 2,495e05
Pa
•
V
końc
= 0,0800 m
3
•
P
końc
= 3,118e4 Pa
•
V
pośr
= 0,0400 m
3
•
P
pośr
= 6,236e4 Pa
•
W = -1871 +(-
1247)
= - 3118 J
•
W
odwr
= -5187 J
•
W/W
odwr
= 60,1 %
Proces
dwuetapowy
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
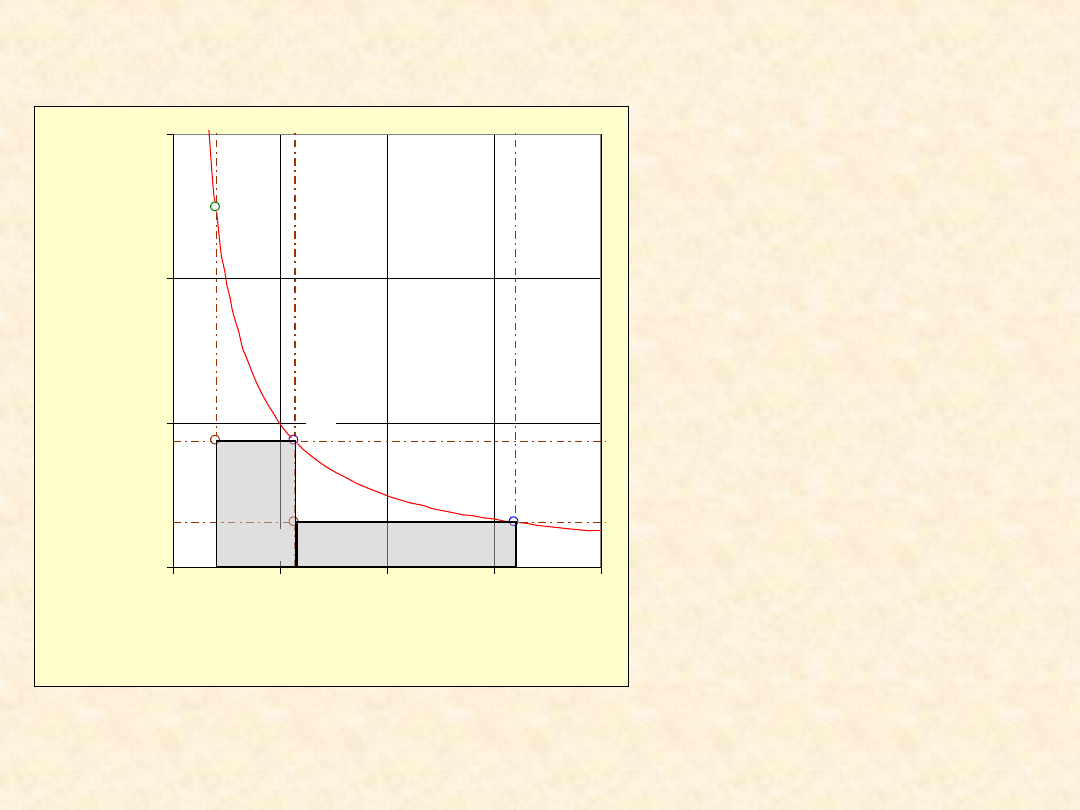
8
Praca rozprężania gazu
doskonałego ...
Warunki:
•
T = 300,0 K
•
n = 1,00 mol
•
V
pocz
= 0,0100 m
3
•
P
pocz
= 2,495e05
Pa
•
V
końc
= 0,0800 m
3
•
P
końc
= 3,118e4 Pa
•
V
pośr
= 0,0282 m
3
•
P
pośr
= 8,819e4 Pa
•
W = -1612 +(-
1612)
= - 3225 J
•
W
odwr
= -5187 J
•
W/W
odwr
= 62,2 %
Proces
dwuetapowy
optymalny
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
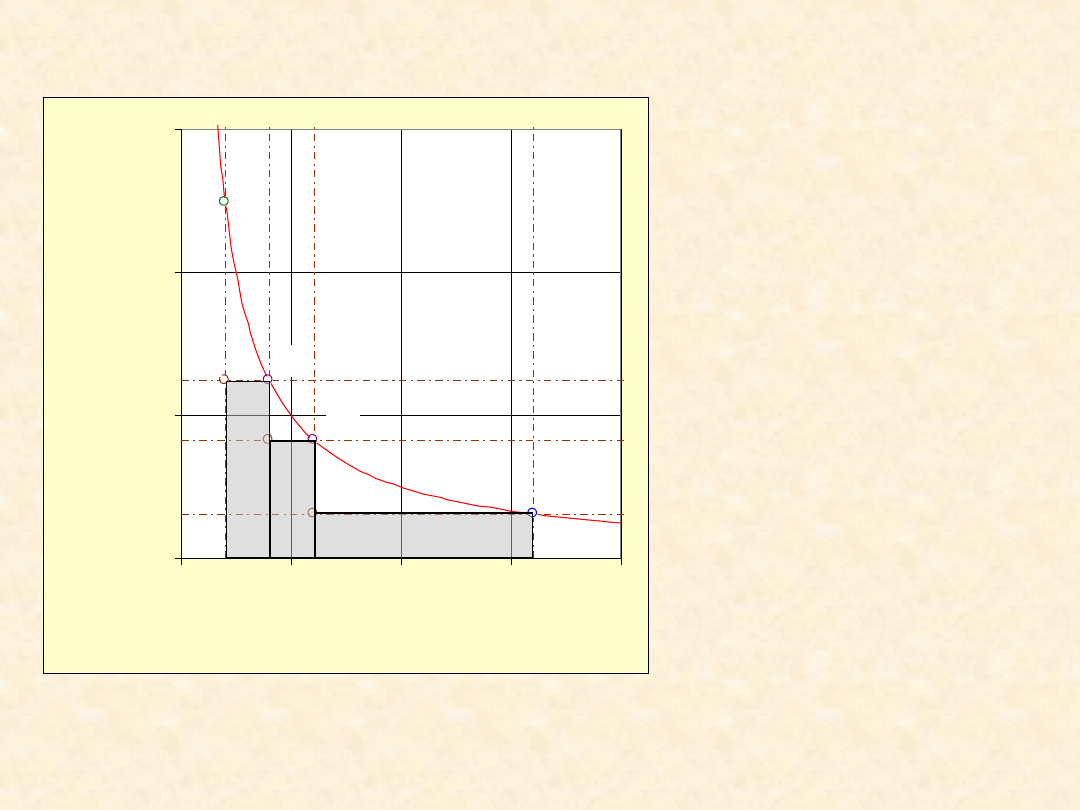
9
Praca rozprężania gazu
doskonałego ...
Warunki:
•
T = 300,0 K
•
n = 1,00 mol
•
V
pocz
= 0,0100 m
3
•
P
pocz
= 2,495e05
Pa
•
V
końc
= 0,0800 m
3
•
P
końc
= 3,118e4 Pa
•
V
pośr I
= 0,0200 m
3
•
V
pośr II
= 0,0300 m
3
•
W = -1247 +(-
812) + (-1559)= -
3225 J
•
W
odwr
= -5187 J
•
W/W
odwr
= 70,1 %
Proces
trzyetapowy
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
A"
C"
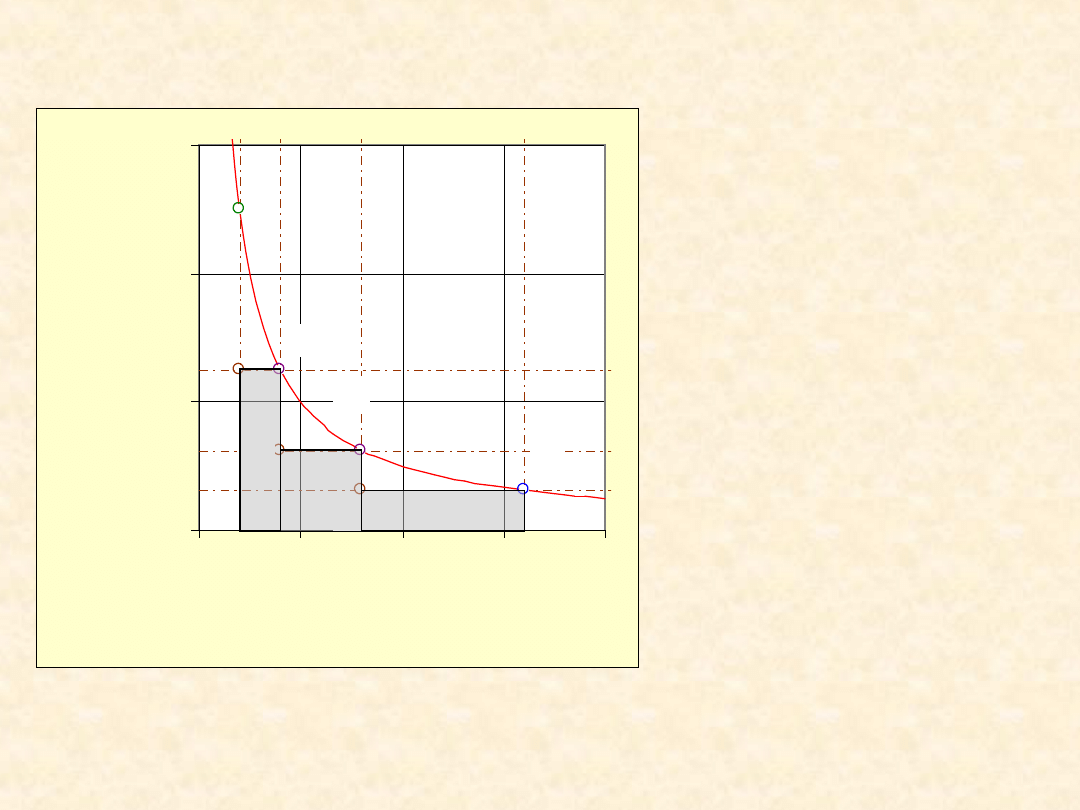
10
Praca rozprężania gazu
doskonałego
Warunki:
•
T = 300,0 K
•
n = 1,00 mol
•
V
pocz
= 0,0100 m
3
•
P
pocz
= 2,495e05
Pa
•
V
końc
= 0,0800 m
3
•
P
końc
= 3,118e4 Pa
•
V
pośr I
= 0,0200 m
3
•
V
pośr II
= 0,0400 m
3
•
W = -1247 +(-
1247) + (-1247)=
- 3742 J
•
W
odwr
= -5187 J
•
W/W
odwr
= 72,1 %
Proces
trzyetapowy
optymalny
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
A"
C"

11
Odwracalne rozprężanie gazu
n
i
i
i
z
n
obj
V
P
W
1
P
P
n
i
z
lim
dV
V
P
W
W
k
P
V
V
odwr
obj
n
obj
n
lim
p
k
V
V
odwr
obj
V
V
nRT
dV
V
nRT
W
k
P
ln
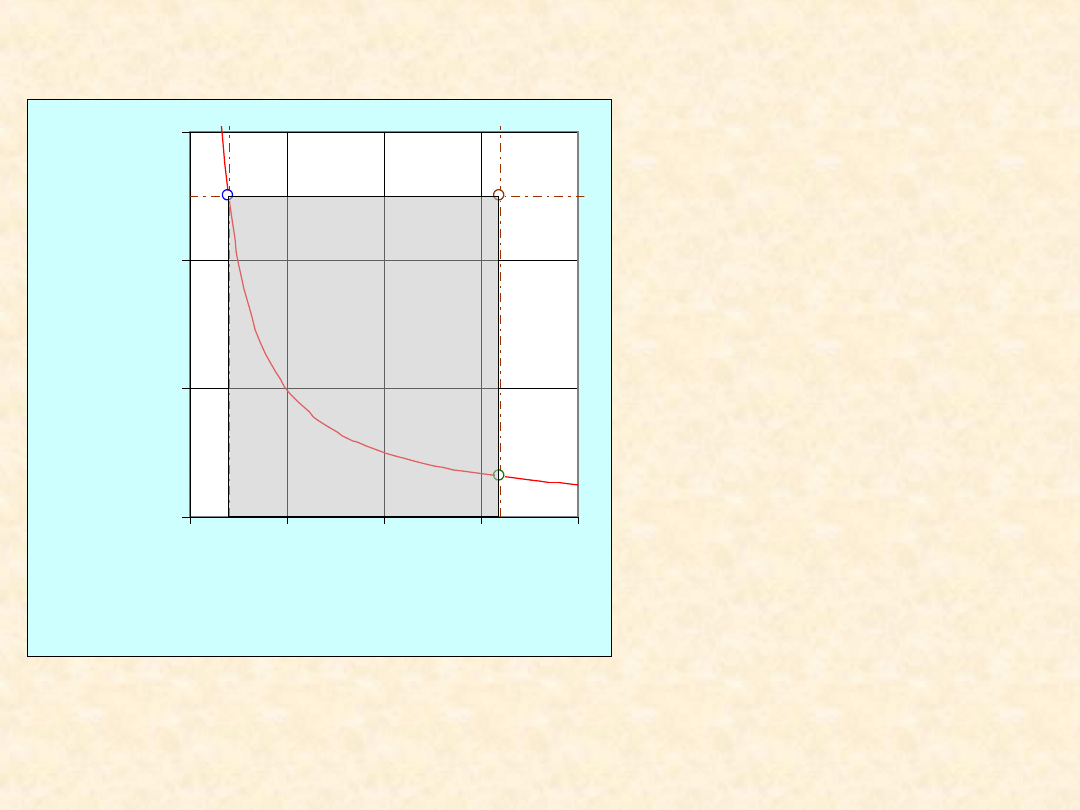
Gaz doskonały; rozprężanie
izotermiczne
12
Wieloetapowe sprężanie gazu
i
z
P
V
P
V
2
V
1
V
k
i
z
P
i
z
P
i
z
P
....
i
i
z
i
V
P
W
n
i
i
i
z
V
P
W
1
13
Praca sprężania gazu
doskonałego ...
Warunki:
• T = 300,0 K
• n = 1,00 mol
• V
pocz
= 0,0800 m
3
• P
pocz
= 3,118e04
Pa
• V
końc
= 0,0100 m
3
• P
końc
= 2,495e05
Pa
• W = 17460 J
• W
odwr
= 5187 J
• W/W
odwr
= 336,6 %
Proces
jednoetapowy
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C

14
Praca sprężania gazu
doskonałego ...
Warunki:
• T = 300,0 K
• n = 1,00 mol
• V
pocz
= 0,0800 m
3
• P
pocz
= 3,118e4 Pa
• V
końc
= 0,0100 m
3
• P
końc
= 2,494e05 Pa
• V
pośr
= 0,0400 m
3
• P
pośr
= 6,236e4 Pa
• W = 2494 + 7483
= 9977 J
• W
odwr
= 5187 J
• W/W
odwr
= 192,4 %
Proces
dwuetapowy
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
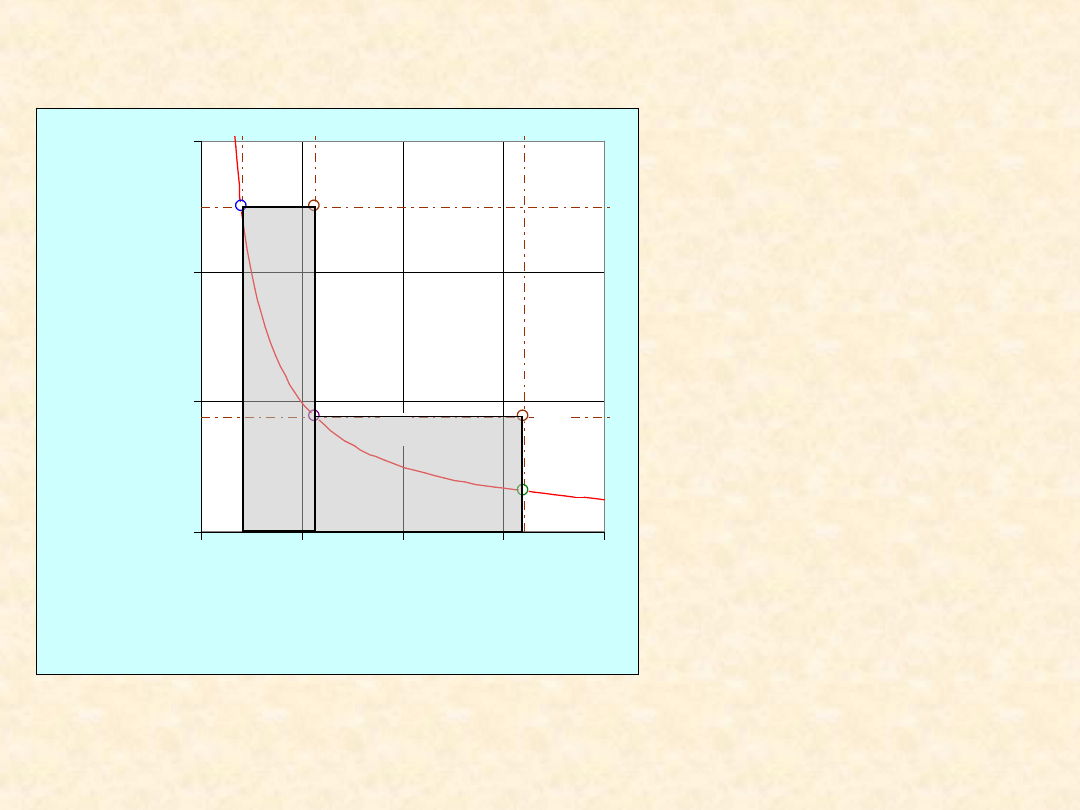
15
Praca sprężania gazu
doskonałego ...
Warunki:
• T = 300,0 K
• n = 1,00 mol
• V
pocz
= 0,0800 m
3
• P
pocz
= 3,118e4 Pa
• V
końc
= 0,0100 m
3
• P
końc
= 2,494e05 Pa
• V
pośr
= 0,0282 m
3
• P
pośr
= 8,819e4 Pa
• W = 4561 + 4561
= 9121 J
• W
odwr
= 5187 J
• W/W
odwr
= 175,9 %
Proces
dwuetapowy
optymalny
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
16
Praca sprężania gazu
doskonałego ...
Warunki:
• T = 300,0 K
• n = 1,00 mol
• V
pocz
= 0,0800 m
3
• P
pocz
= 3,118e4 Pa
• V
końc
= 0,0100 m
3
• P
końc
= 2,494e05Pa
• V
pośr I
= 0,0300 m
3
• V
pośr II
= 0,0200 m
3
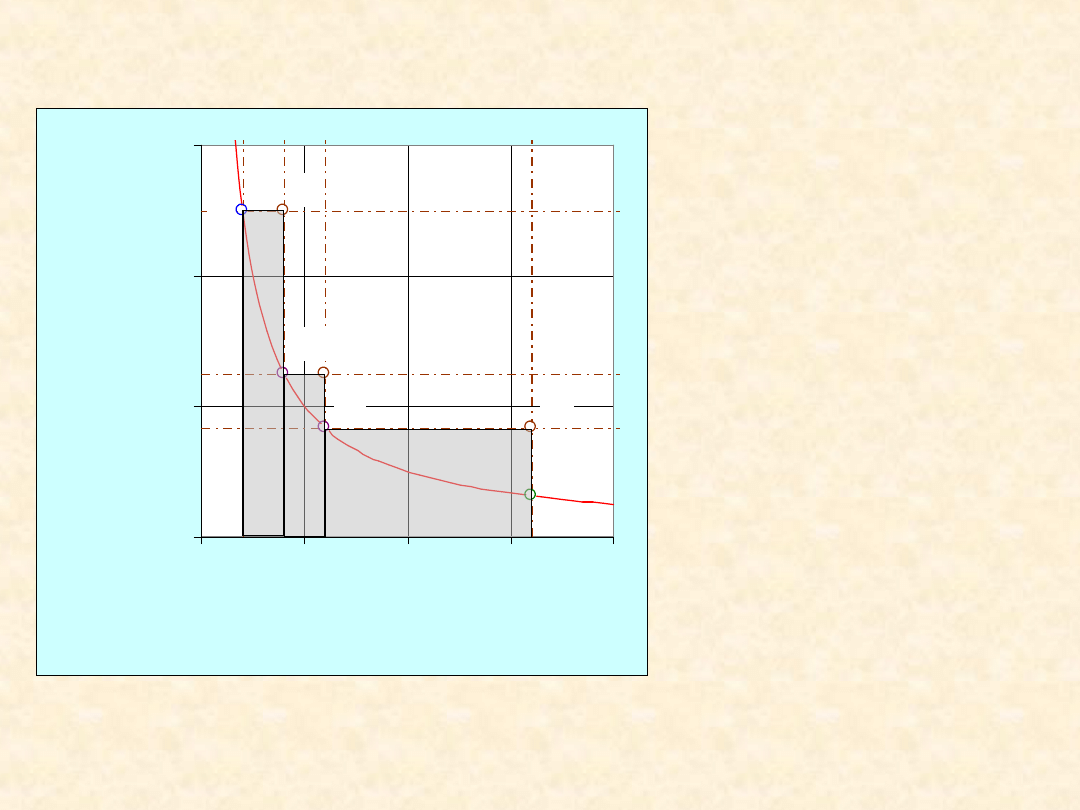
• W = 4157 + 1247
+ 2494 = 7899 J
• W
odwr
= 5187 J
• W/W
odwr
= 152,3 %
Proces
trzyetapowy
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
A"
C"
17
Praca sprężania gazu doskonałego
Warunki:
• T = 300,0 K
• n = 1,00 mol
• V
pocz
= 0,0800 m
3
• P
pocz
= 3,118e4 Pa
• V
końc
= 0,0100 m
3
• P
końc
= 2,494e05
Pa
• V
pośr I
= 0,0400 m
3
• V
pośr II
= 0,0200 m
3
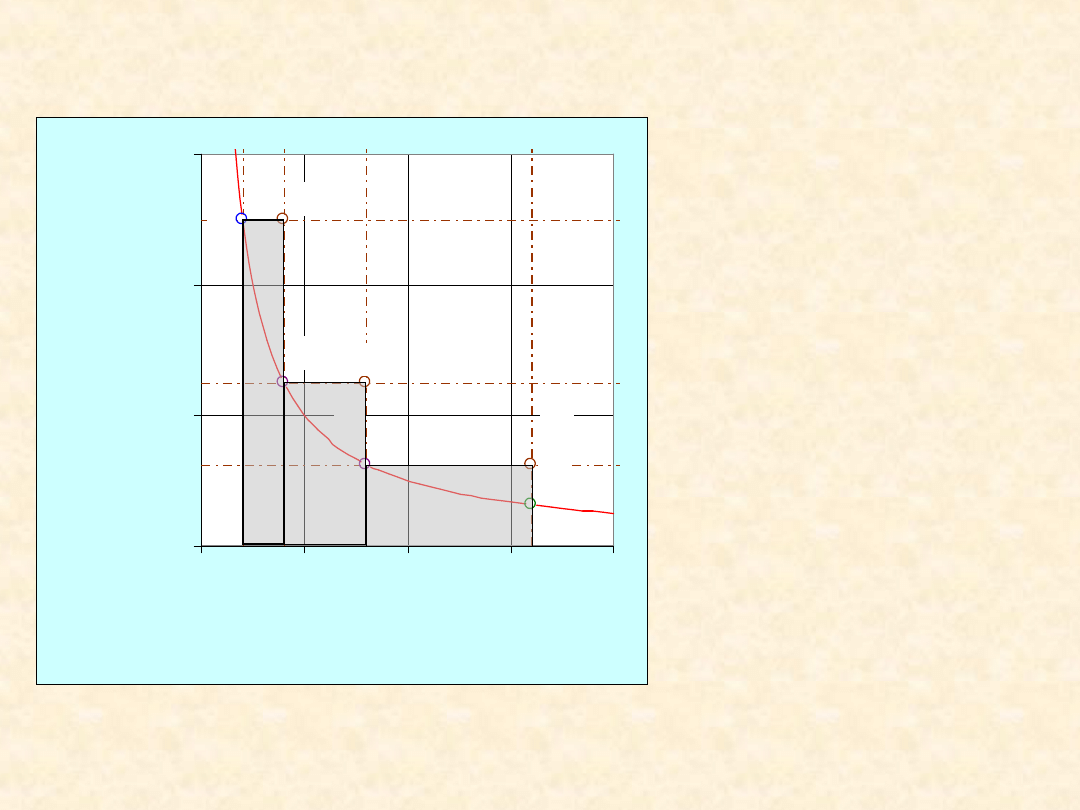
• W = 2494 + 2494
+ 2494 = 7483 J
• W
odwr
= 5187 J
• W/W
odwr
= 144,3 %
Proces
trzyetapowy
optymalny
0,0E+00
1,0E+05
2,0E+05
3,0E+05
0
,0
0
0
0
,0
2
5
0
,0
5
0
0
,0
7
5
0
,1
0
0
V/m
3
P
/P
a
A
B
C
A'
C'
A"
C"

18
Odwracalne sprężanie gazu
n
i
i
i
z
n
obj
V
P
W
1
P
P
n
i
z
lim
dV
V
P
W
W
k
P
V
V
odwr
obj
n
obj
n
lim
p
k
V
V
odwr
obj
V
V
nRT
dV
V
nRT
W
k
P
ln
Gaz doskonały; sprężanie
izotermiczne
19
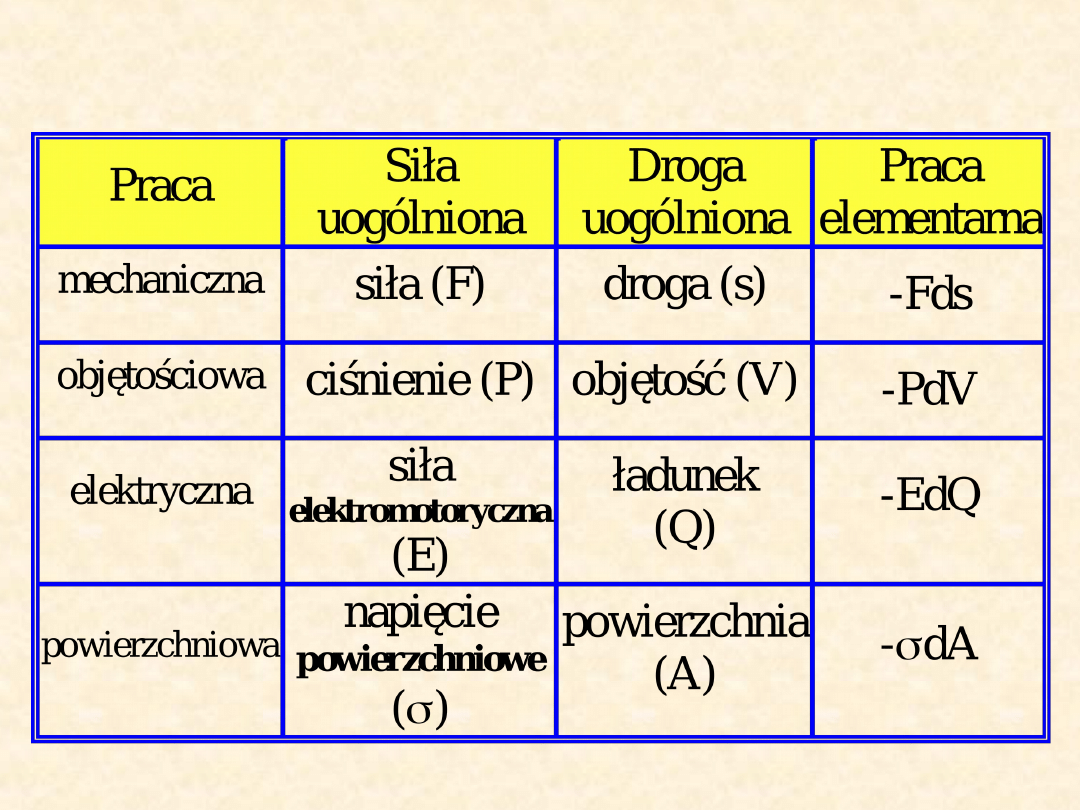
Rodzaje pracy

20
3.2. Sformułowanie
pierwszej zasady
termodynamiki
Wykład 3
21
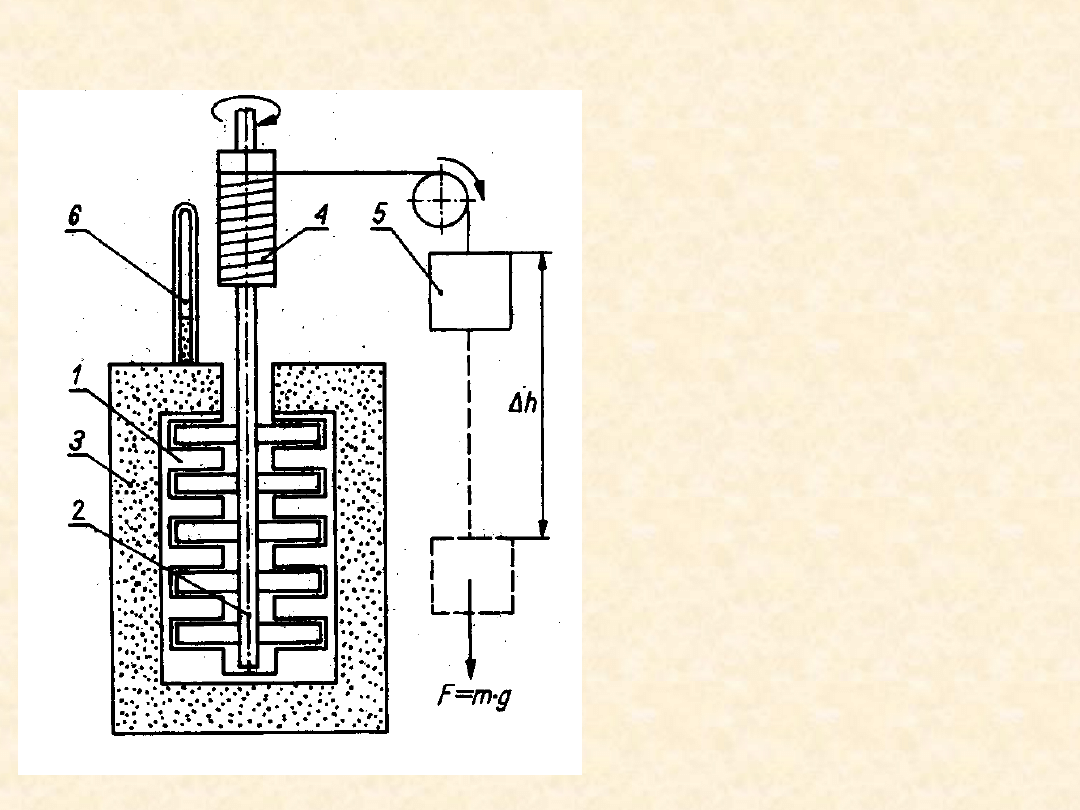
Doświadczenia J.P.Joule’a (1841
- 1850)
• 1- naczynie
kalorymetryczne,
• 2 – mieszadło,
• 3 – izolacja cieplna,
• 4 układ
napędzający
mieszadło,
• 5 – ciężar
wykonują- cy pracę
w polu gra-
witacyjnym,
• 6 - termometr

22
Wnioski sformułowane na
podstawie doświadczeń Joule’a
• Określona praca wykonana na
układzie adiabatycznym powoduje
identyczny wzrost jego temperatury
niezależnie od sposobu jej wykonania
• Ponieważ taki sam efekt można
osiągnąć dostarczając do układu
diatermicznego energię na sposób
ciepła, to oba sposoby wymiany
energii są sobie równoważne.

23
Historycznie najstarsze
sformułowanie
I zasady termodynamiki
Sumaryczna energia Wszechświata jest
stała - nie można jej tworzyć lub
niszczyć
a jedynie przekazywać między układami
(H. Helmholtz, 1847)

24
Składowe energii układów
•Energia kinetyczna
•Energia potencjalna (wynikająca
z istnienia zewnętrznych pól sił)
•Energia wewnętrzna:
> translacja drobin
> rotacja drobin
> oscylacja wiązań
> energia elektronowa....
> oddziaływania między
drobinami

25
I zasada termodynamiki
Energia wewnętrzna każdej fazy wewnętrznie
zrównoważonej jest ekstensywną funkcją
niezależnych parametrów stanu (x
1
, x
2
, ... x
k
)
k
j
j
x
,
,x
x
U
U
2
1
i
i
U
U
Energia wewnętrzna układu jest sumą
energii wewnętrznych faz
Zmiana energii wewnętrznej układu
izolowanego adiabatycznie jest równa energii
wymienionej na sposób pracy
adiab
A
B
W
U
U
U
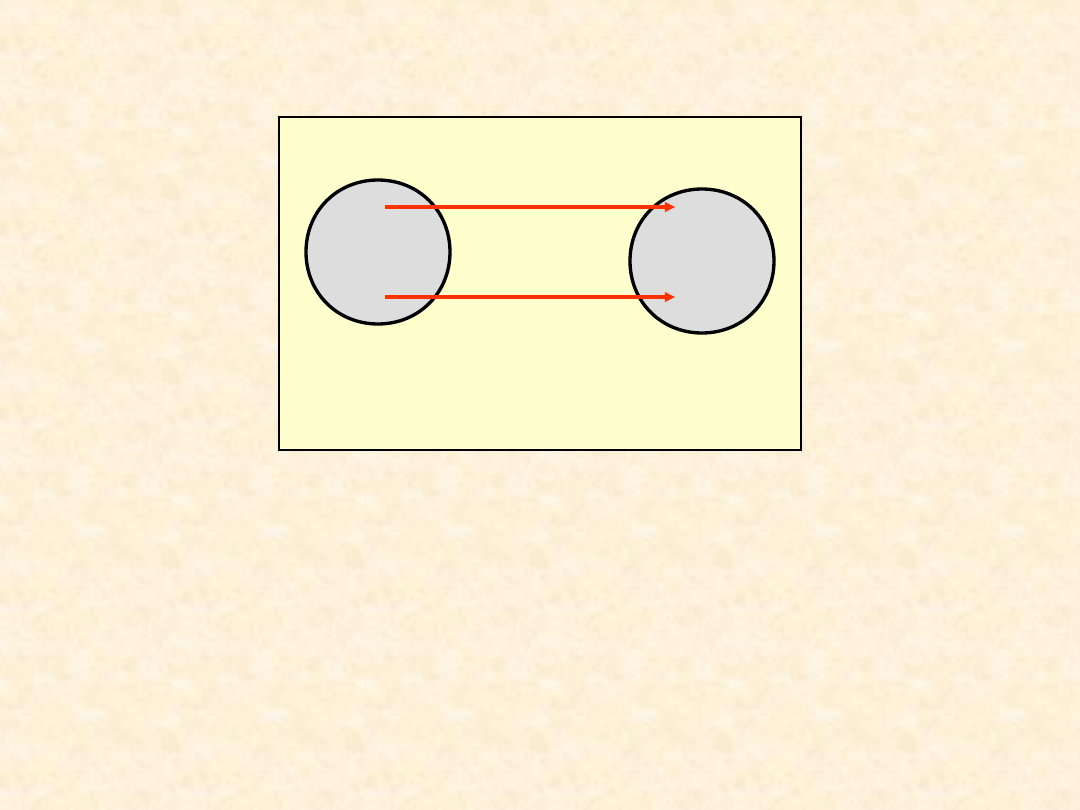
26
Konsekwencje I zasady
termodynamiki...
A
B
U”
AB
U’
A
B
U’
AB
=
U”
AB
Zmiana energii wewnętrznej układu
nie zależy od „drogi przemiany”, a
jedynie od wartości parametrów w
stanie A (początkowym) oraz B
(końcowym)
- jest to ogólna
właściwość funkcji.
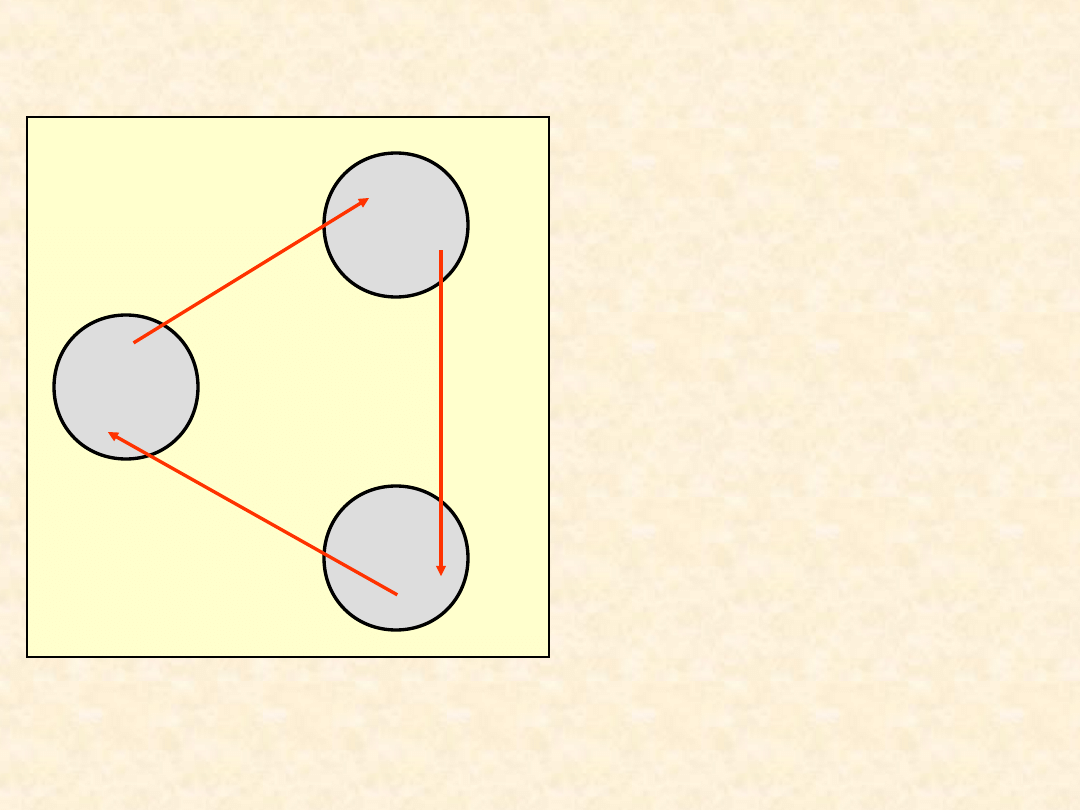
27
Konsekwencje I zasady
termodynamiki...
A
B
C
U
BC
U
CA
U
AB
U
cykl
=
0
Jeżeli w wyniku
przemiany
cyklicznej układ
powróci do stanu
początkowego to
sumaryczna zmiana
jego energii
wewnętrznej będzie
równa zeru
- jest to
również ogólna
właściwość funkcji.

28
Konsekwencje I zasady
termodynamiki...
Zmiana energii wewnętrznej układu w
wyniku przemiany elementarnej
k
i
i
i
dx
x
U
dU
i
j
x
1
Zmiana energii wewnętrznej układu w
wyniku przemiany skończonej A B
k
i
B
A
i
i
A
B
dx
x
U
U
U
U
i
j
x
1

29
Konsekwencje I zasady
termodynamiki...
Postulat Helmholtza: w wyniku
dowolnej przemiany suma zmian energii
wewnętrznych układu i otoczenia jest
równa zeru.
0
otoczenie
uklad
total
U
U
U
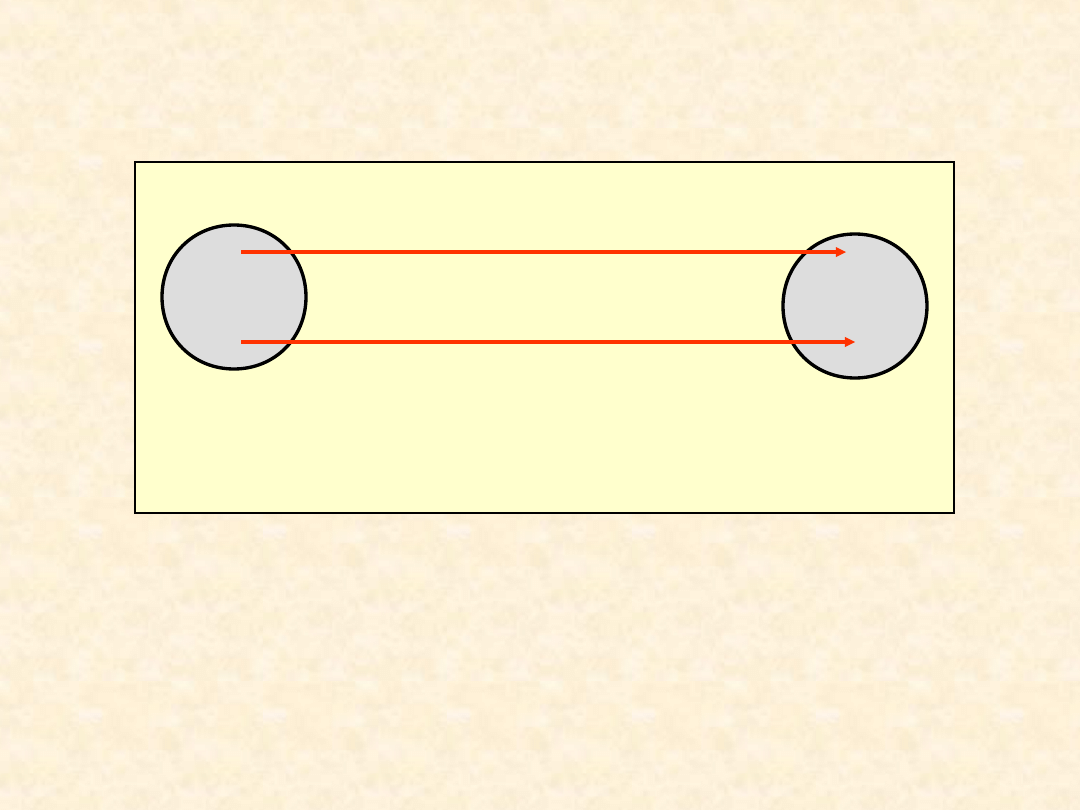
30
Konsekwencje I zasady
termodynamiki - pojęcie ciepła ...
A
B
U”
AB
= Q”
AB
+W”
AB
U’
AB
= W
adiab
; Q’
AB
= 0
U’
AB
=
U”
AB
Q”
AB
0
W”
AB
W
adiab
Różny od pracy sposób wymiany
energii nazywa się wymianą energii
na sposób ciepła.
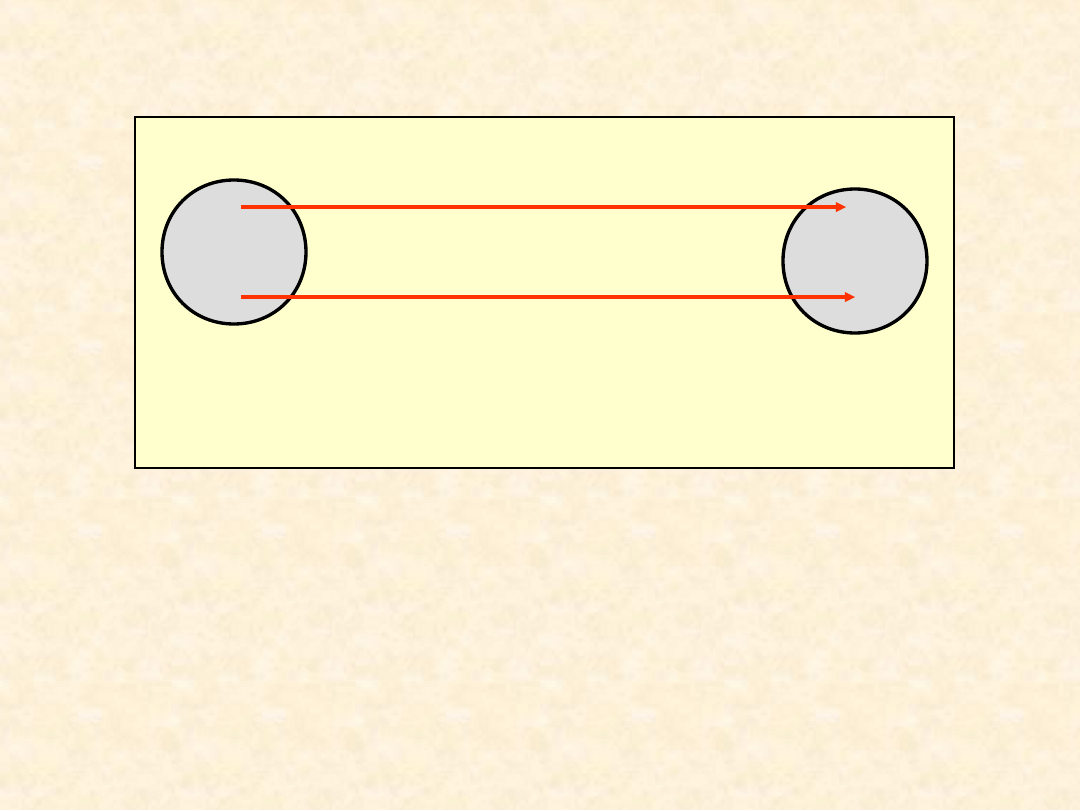
31
Konsekwencje I zasady
termodynamiki ...
A
B
U”
AB
= Q”
AB
+W”
AB
U’
AB
= Q’
AB
+W’
AB
U’
AB
=
U”
AB
Q’
AB
Q”
AB
W’
AB
W”
AB
W przypadku ogólnym ciepło i praca
wymienione między układem i
otoczeniem zależą od „drogi przemiany”
- są one funkcjonałami drogi przemiany.
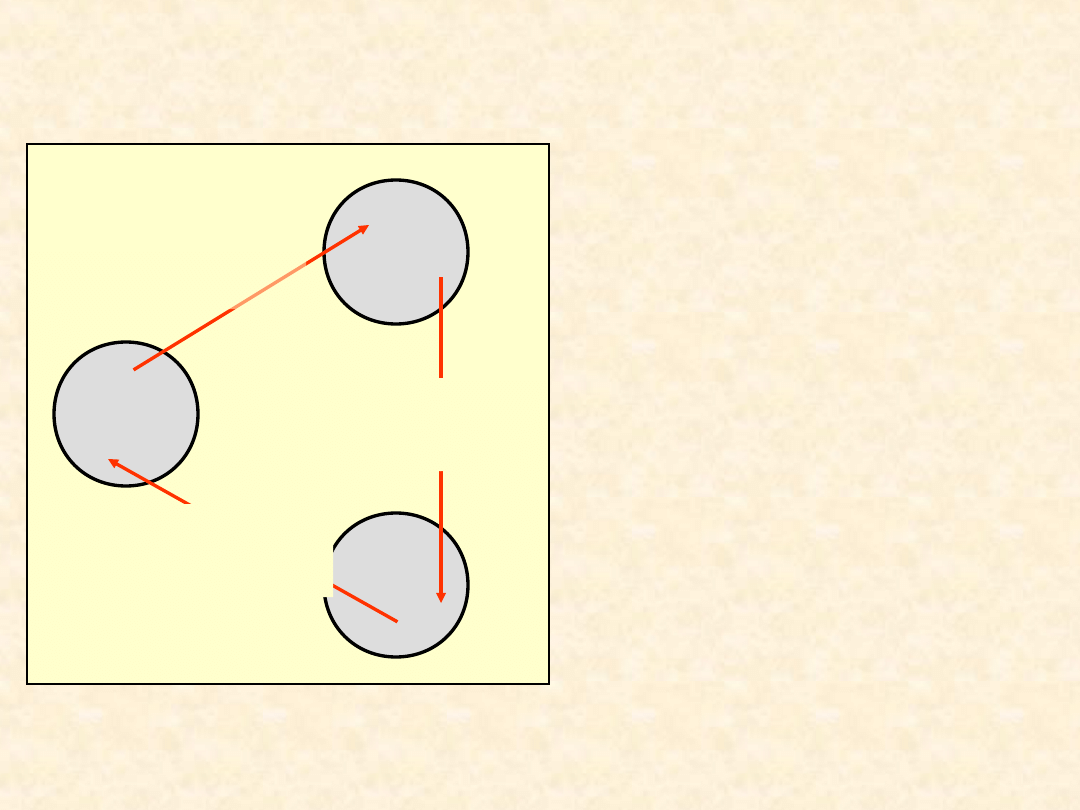
32
Konsekwencje I zasady
termodynamiki - bilans
energetyczny procesu cyklicznego
A
B
C
U
BC
= Q
BC
+
W
BC
U
CA
= Q
CA
+
W
CA
U
AB
= Q
AB
+
W
AB
0
cykl
i
cykl
i
cykl
W
Q
U
0
cykl
i
Q
0
cykl
i
W
silnik
-
0
cykl
i
W
ciepla
pompa
-
0
cykl
i
W
Konwersja
energii:

33
3.3. Przemiany
izochoryczne lub
izobaryczne układów
nie elektrochemicznych
- pojemność cieplna
Wykład 3
Obiekt: układ nie elektrochemiczny
wymieniający z otoczeniem energię
na sposób ciepła i ewentualnie
pracy wyłącznie objętościowej

34
Warunki prowadzenia
przemiany:
izochoryczne (V = const.)...
PdV
dQ
dW
dQ
dU
obj
(1
)
V
V
obj
const
dQ
dU
dW
V
0
(2
)
B
A
B
A
V
U
Q
(3
)
35
Warunki prowadzenia
przemiany:
izochoryczne (V = const.)
Przypadek szczególny:
Efekt cieplny
przemiany izochorycznej układu nie
elektrochemicznego jest równy zmianie
energii wewnętrznej (funkcji stanu)
czyli niezależny od drogi przemiany.
A
B
Q
V
=
U
AB
V
const
W
obj
= 0

36
Pojemność cieplna układu w stałej
objętości
(4
)
(5
)
n
C
C
m
V
m
V
,
,
V
V
V
T
V
T
U
C
T
Q
C
0
lim
Dla 1 mola substancji (fazy
czystej):
B
A
B
A
T
T
m
V
T
T
V
A
B
V
B
A
dT
C
n
dT
T
U
n
U
U
T
T
Q
,
Efekt cieplny ogrzania /
oziębienia fazy czystej:
(6
)
)
(
,
T
f
C
m
V
- wyznaczana
doświadczalnie

37
Warunki prowadzenia
przemiany:
izochoryczne (P = const.)...
(7
)
(8
)
(9
)
Kombinując energię wewnętrzną
(funkcję) i parametry stanu (PV) definiuje
się funkcję stanu:
PV
U
H
ENTALPIA
:
VdP
PdV
dU
dH
VdP
dQ
dH
P
P
const
dQ
dH
dP
P
0
B
A
B
A
P
H
Q
(1
0)
(11
)
38
Warunki prowadzenia
przemiany:
izochoryczne (P = const.)
Przypadek szczególny:
Efekt cieplny
przemiany izobarycznej układu nie
elektrochemicznego jest równy zmianie
entalpii (funkcji stanu) czyli niezależny
od drogi przemiany.
A
B
Q
P
=
H
AB
P
const
W
obj
=
-PV
AB

39
Pojemność cieplna układu pod
stałym ciśnieniem
(1
2)
(1
3)
n
C
C
m
P
m
P
,
,
P
P
P
T
P
T
H
C
T
Q
C
0
lim
Dla 1 mola substancji (fazy
czystej):
B
A
B
A
T
T
m
P
T
T
P
A
B
P
B
A
dT
C
n
dT
T
H
n
H
H
T
T
Q
,
Efekt cieplny ogrzania /
oziębienia fazy czystej:
(1
4)
)
(
,
T
f
C
m
P
- wyznaczana
doświadczalnie

40
J. P.
Joule
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
03 Sejsmika04 plytkieid 4624 ppt
03 Odświeżanie pamięci DRAMid 4244 ppt
podrecznik 2 18 03 05
od Elwiry, prawo gospodarcze 03
Probl inter i kard 06'03
TT Sem III 14 03
03 skąd Państwo ma pieniądze podatki zus nfzid 4477 ppt
03 PODSTAWY GENETYKI
Wyklad 2 TM 07 03 09
03 RYTMY BIOLOGICZNE CZŁOWIEKAid 4197 ppt
Rada Ministrow oficjalna 97 03 (2)
Sys Inf 03 Manning w 06
KOMPLEKSY POLAKOW wykl 29 03 2012
03 piątek
więcej podobnych podstron