
W –10: Równowaga
chemiczna -Podstawy
• W stanie równowagi reakcja „do przodu” i
reakcja „do tyłu” przebiegają z jednakową
szybkością – inaczej z lewej strony na prawa
stronę i z prawej strony na lewą (patrząc na
równanie reakcji)
• stężenia reagentów nie zmieniają się w
czasie pomimo, że obie reakcje zachodzą
• Równowagę symbolicznie zaznaczamy za
pomocą podwójnych strzałek lub znaku
równości

Równowaga chemiczna
• Z reakcją zawsze są związane:
•
termodynamiczne bodźce
• termodynamiczne przepływy (inaczej
mówiąc szybkość reakcji chemicznej)
• Bodźcem termodynamicznym
wywołującym przepływ reakcji
chemicznej jest
powinowactwo
chemiczne
.

Równowaga chemiczna
• Reakcje chemiczne zdążają i
dochodzą do stanu równowagi
chemicznej
statyka chemiczna
• Przebieg reakcji w czasie
kinetyka chemiczna

Równowaga chemiczna
• Każda reakcja zachodzi według
pewnego równania
stechiometrycznego.
• Równania stechiometryczne wyrażają:
– Stosunki stechiometryczne
– Kierunek reakcji
– Wyrażają prawo zachowania masy
)
(
HI
2
)
(
I
)
(
H
2
2
g
g
g

Równowaga chemiczna
• Uważamy za przychód produkty
reakcji
• Uważamy za rozchód substratu
reakcji
• Kierunek z lewa na prawo dodatni
• Kierunek z prawa na lewo ujemny

Równowaga chemiczna
• Dla reakcji syntezy amoniaku:
• -3 i –1 dla substratów oraz +2 dla
produktów
• Wymnażając współczynniki
stechiometryczne prze masy
cząsteczkowe i sumując
otrzymujemy wartość zero.

Znaczenie równowagi
chemicznej
• Równowaga w roztworach kwasów, zasad, soli.
• Gdzie wymiana protonu zachodzi tak szybko,
że zawsze zachowany jest stan równowagi.
• Równowagi wymiany protonu utrzymywane w
komórkach organizmów zapewniają
zachowanie przez białka zdolności życia.
• Nawet niewielkie przesunięcie
równowagowego stężenia jonów wodorowych
może spowodować uszkodzenie komórki,
chorobę lub śmierć.
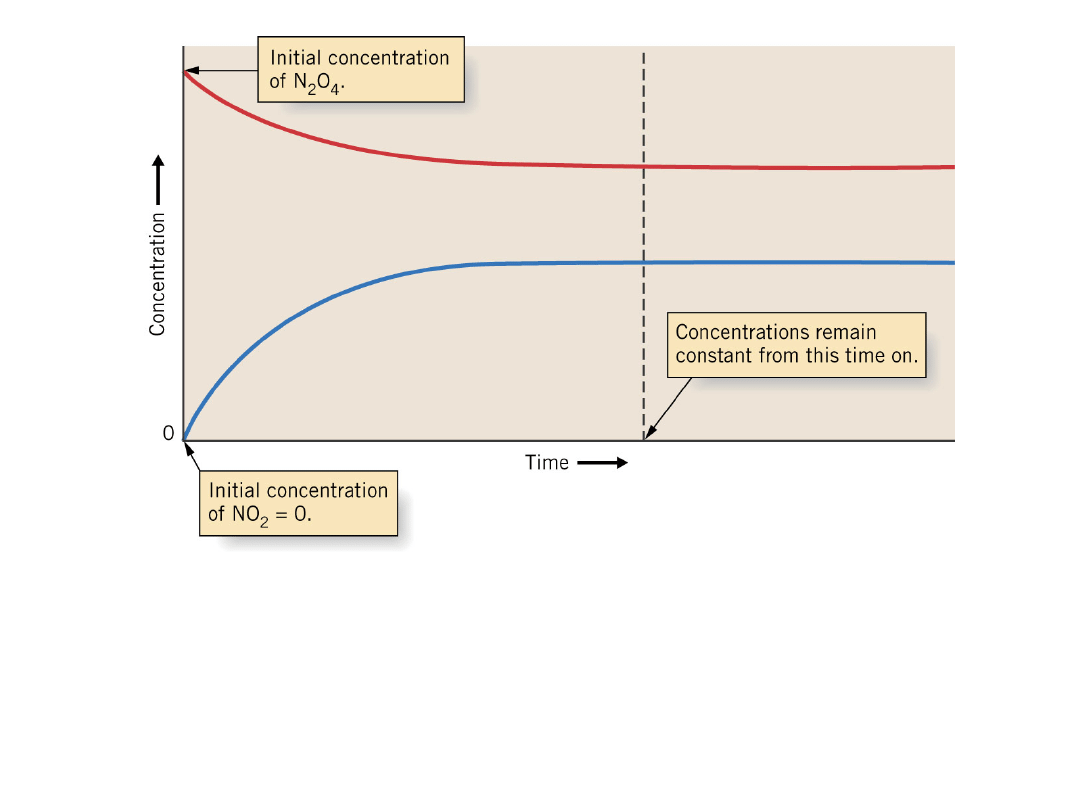
Rozkład cztero tlenku azotu do dwutlenku azotu.
Zmiana stężenia następuje względnie szybko w
początkowym okresie, natomiast zostaje
zahamowana w momencie dojścia do stanu
równowagi.
• Skład mieszaniny w stanie równowagi
nie zależy czy reakcję rozpoczynamy
od substratów czy od produktów.
Równowaga
pomiędzy N
2
O
4
i
NO
2
.
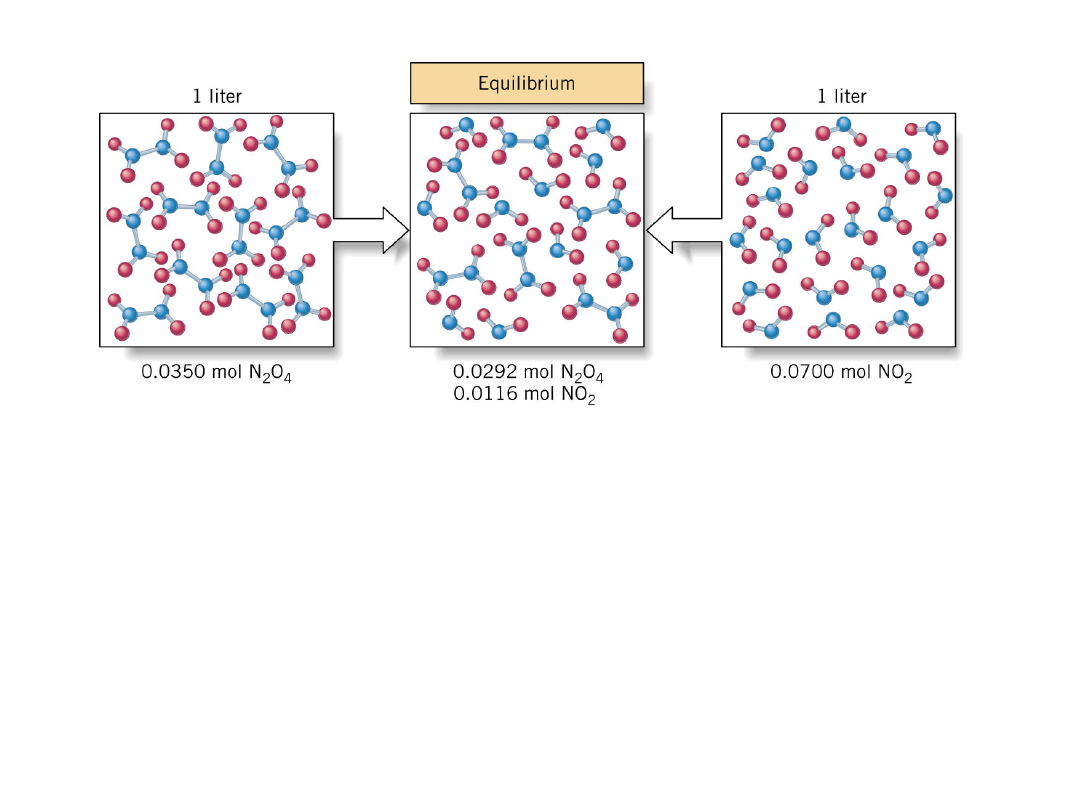
Skład mieszaniny odpowiadający stanowi
równowagi osiągany jest niezależnie od
mieszaniny wyjściowej pod warunkiem że
stężenie wyjściowe substratów jest takie same jak
stężenie produktów (wynikające ze
stechiometrii)w stanie równowagi. Czysty NO
2
jest koloru brązowego natomiast czysty N
2
O
4
jest
bezbarwny. Kolor bursztynowy świadczy o
obecności obu składników.

• Istnieje prosta zależność pomiędzy
stężeniem substratów a stężeniem
produktów wyrażona prawem
działania mas.
• Wyrażenie nosi nazwę ilorazu
reakcji i wyprowadza się je na
drodze termodynamicznej.
• Rozpatrzmy równowagę:
)
(
HI
2
)
(
I
)
(
H
2
2
g
g
g
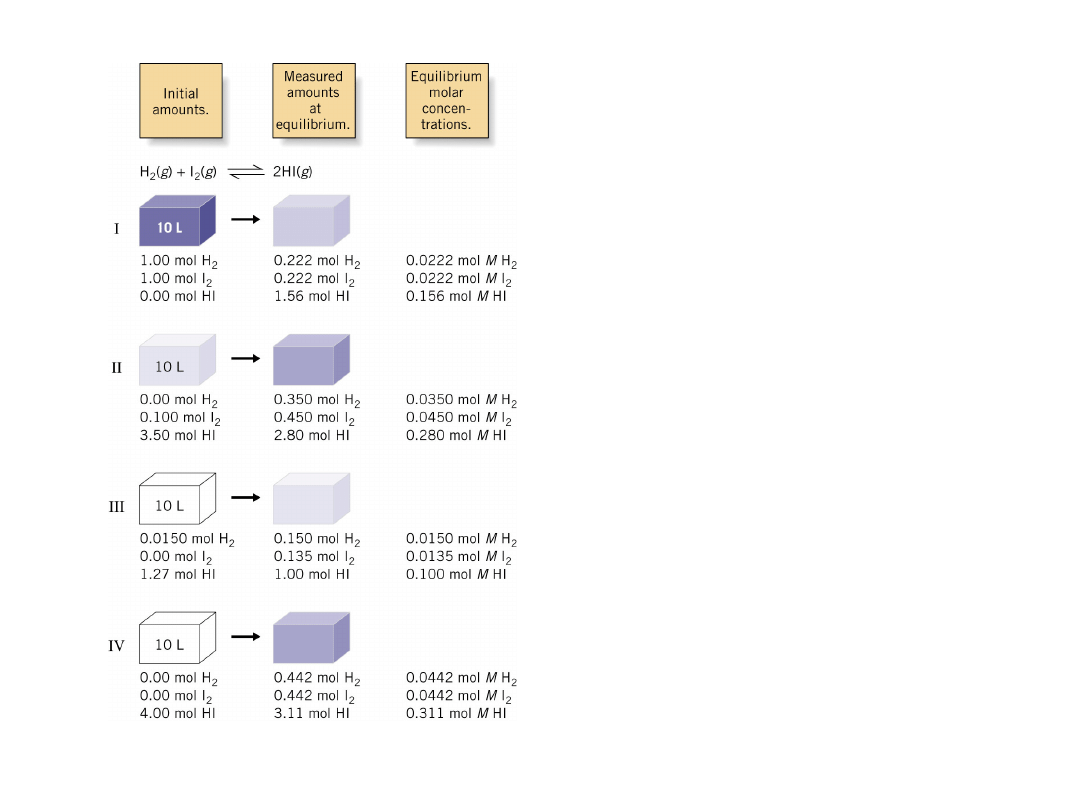
Wykonano cztery
eksperymenty
Różne ilości
substratów i
produktów
wprowadzono do
zbiornika
reakcyjnego o
objętości 10 L w
temp. 440C.W
momencie
osiągnięcia stanu
równowagi w
zbiorniku
znajdowały się
różne ilości
reagentów.

• Wartość liczbową wyrażenia
ilustrującego prawo działania mas
nazywamy ilorazem reakcji Q.
49.5
Average
49.5
0.311
0.0442
0.0442
IV
49.4
0.100
0.0135
0.0150
III
49.8
0.280
0.0450
0.0350
II
49.4
0.156
0.0222
0.0222
I
]
][I
[H
[HI]
]
[HI
]
[I
]
[H
Expt.
2
2
2
2
2
Średnia

• przebieg reakcji może być
oceniony w dowolnym momencie
• W stanie równowagi (440 C) iloraz
reakcji wynosi 49.5.
]
I
][
H
[
[HI]
2
2
2
Q

• Wartość 49,5 nosi nazwę stałej
równowagi i jest wielkością
charakterystyczną dla układu:
• Równowaga jest osiągana wtedy,
kiedy wartość Q będzie równa
wartości stałej K
c
• Rozpatrzmy równanie:
C)
440
(
5
.
49
]
I
][
H
[
[HI]
o
2
2
2
c
K
gG
fF
eE
dD
• Wykładniki w wyrażeniu na stałą
równowagi są identyczne z
współczynnikami
stechiometrycznymi
• W stanie równowagi:
• Zapisujemy zawsze produkty w
liczniku i substraty w mianowniku.
c
]
[
]
[
]
[
]
[
K
E
D
G
F
e
d
g
f
• Różne operacje matematyczne
mogą być wykonane na wyrażeniu
– Zmiana kierunku reakcji
c
c
K
PCl
Cl
PCl
K
Cl
PCl
PCl
Cl
PCl
PCl
K
PCl
Cl
PCl
c
1
]
[
]
][
[
]
][
[
]
[
5
2
3
'
2
3
5
2
3
5
5
2
3

– Mnożenie równania reakcji
2
2
5
2
2
2
3
"
2
3
5
2
3
5
5
2
3
]
[
]
[
]
[
2
2
2
]
][
[
]
[
c
c
K
PCl
Cl
PCl
K
Cl
PCl
PCl
Cl
PCl
PCl
K
PCl
Cl
PCl
c

– Kiedy równania są dodawane
stronami – stałe równowagi są
mnożone
2
1
4
2
2
2
4
2
3
2
2
2
3
2
2
2
4
2
2
2
2
2
2
2
2
2
2
1
2
2
2
]
[
]
[
]
[
4
4
2
:
y
otrzymujem
stronami
dodaniu
po
]
[
]
[
]
[
4
3
2
]
[
]
[
]
[
2
2
c
c
c
c
c
K
K
O
N
NO
K
NO
O
N
O
O
N
NO
K
NO
O
O
N
O
N
O
N
K
O
N
O
N

• równanie gazu doskonałego może
być wykorzystane do
przedstawienia ciśnień cząstkowych
• Stałą równowagi obliczoną na
podstawie ciśnień cząstkowych
oznaczamy symbolem K
p
RT
C
RT
V
n
P
nRT
PV

• Wielkość stałej równowagi jest miarą
przebiegu reakcji.
• Możemy stwierdzić ogólnie że: (albo K
c
lub K
P
)
• Należy pamiętać o aktywności. Tylko
przy stężeniach <10
-3
mol l
-1
można
posługiwać się stężeniami.
i
]
][
[
]
[
)
(
2
)
(
3
)
(
3
2
3
2
2
2
3
3
2
2
2
2
3
H
N
NH
P
c
P
P
P
K
H
N
NH
K
g
NH
g
H
g
N
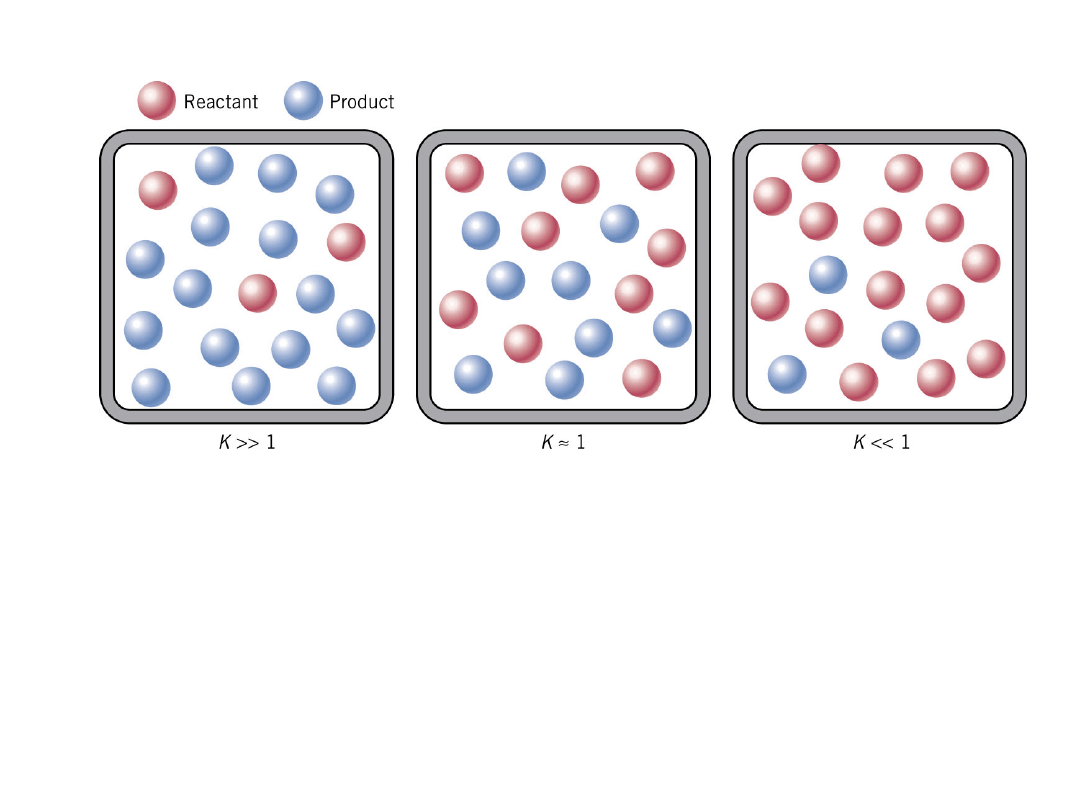
Wielkość K i stan równowagi. Duża ilość produktu
i mała substratu w stanie równowagi daje dużą
wartość K>>1.
Kiedy ilości produktu i substratu są podobne
wtedy K=1.
Kiedy K<<1, większość stanowi substrat i bardzo
mało jest produktu.
1
K

• Pomiędzy stałymi istnieje
zależność:
g
n
gdzie
)
(
zatem
)
(
g
n
c
P
m
RT
K
K
RT
C
RT
V
n
P
nRT
PV

• W reakcjach homogenicznych substraty
i produkty są w tej samej fazie
• W reakcjach heterogenicznych istnieją
minimum dwie fazy
• Rozkład węglanu sodu
• W reakcjach heterogenicznych
osiąganie stanu równowagi zachodzi w
ten sam sposób jak w reakcji
homogenicznej.
)
(
)
(
)
(
)
(
2
2
2
3
2
3
g
CO
g
O
H
s
CO
Na
s
NaHCO
heat

• Jeżeli umieścimy NaHCO
3
w zamkniętym
naczyniu, można osiągnąć równowagę
homogeniczną:
• Równowagę w układach zawierających
czyste ciecze i tylko ciała stałe można
uprościć.
K
NaHCO
O
H
CO
CO
Na
g
O
H
g
CO
s
CO
Na
s
NaHCO
2
3
2
2
3
2
2
2
3
2
3
]
[
]
][
][
[
równowagi
stałt
)
(
)
(
)
(
)
(
2
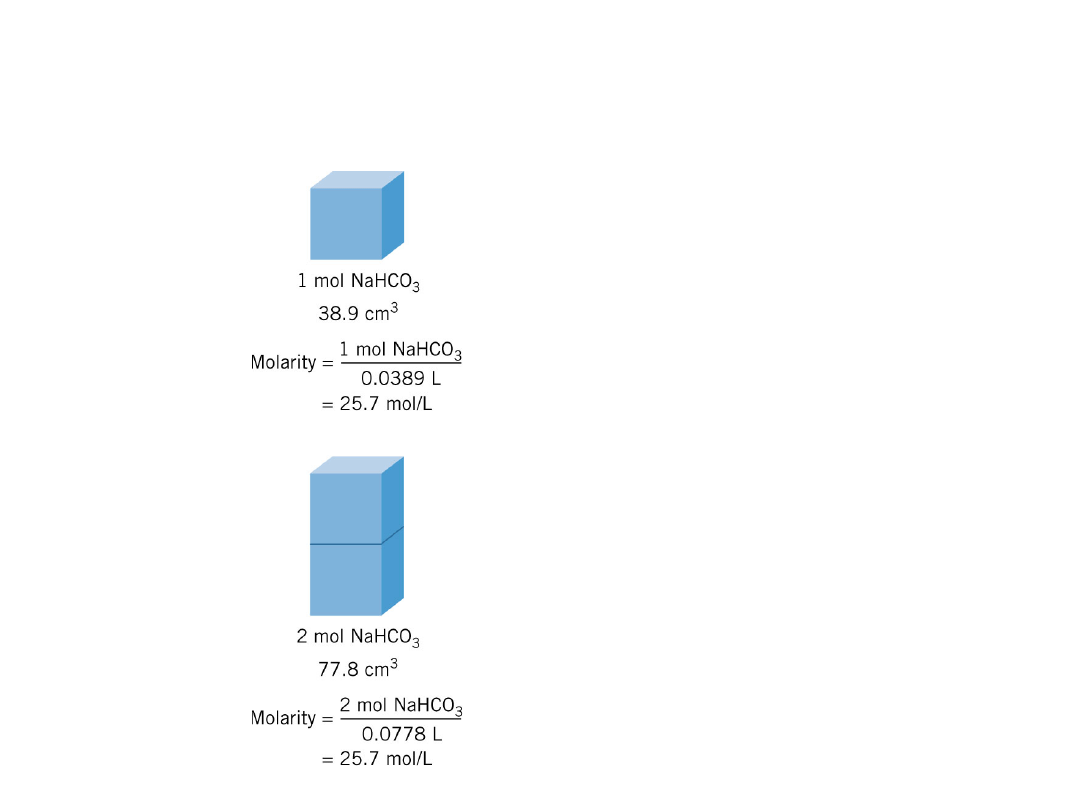
– W czystych cieczach i c. stałych
stosunek ilości substancji do
objętości pozostaje stały.
Stężenie substancji w
c. stałym jest stałe.
Podwojenie liczby
moli podwaja
objętość, lecz
stosunek
moli do
objętości pozostaje
ten sam.

• Prawo działania mas w odniesieniu
do reakcji heterogenicznych
zapisywane jest bez stężenia
czystego c. stałego lub czystej
cieczy.
• Stałe równowagi w tablicach
reprezentują kombinację stałych.
]
[
]
[
]
][
[
3
2
2
3
2
2
CO
Na
NaHCO
K
O
H
CO
K
c

• Zgodnie z regułą Le Châtelier:
Jeżeli zewnętrzne czynniki zakłócą równowagę,
układ zareaguje zmianą, która przeciwdziała
zewnętrznemu czynnikowi, i jeżeli możliwe układ
powróci do stanu równowagi
• Kilka typowych czynników
(powodujących stres)
• Dodanie lub usunięcie substratu lub
produktu
• Równowaga przesunie się w sposób powodujący
usunięcie substrat lub produkt który został
dodany.
• Równowaga przesuwa się tak żeby zastąpić
substrat lub produkt.

–
Zmiana objętości
• redukcja objętości reakcji gazowej powoduje,
że reakcja powoduje zmniejszenie liczby moli
gazu
• niewielkie zmiany ciśnienia mają niewielki
wpływ na reakcje zawierające tylko ciecze lub
ciała stałe.
–
Zmiana temperatury
• wzrost temperatury powoduje przesunięcie
reakcji w kierunku endotermicznym
(pochłaniającym ciepło)
• zmniejszenie temperatury przesuwa reakcję w
kierunku, który produkuje egzotermiczną
zmianę

– Katalizatory nie wpływają na stan
równowagi
• katalizator powoduje szybsze osiąganie
stanu równowagi, lecz nie zmienia rozkładu
stężeń substratów i produktów
– dodanie gazu obojętnego przy
zachowaniu stałej objętości
• jeżeli dodany gaz nie może reagować ani z
substratami ani z produktami, uważany jest
za obojętny względem substancji
• wtedy nie ma zmiany stężenia tak że, Q
równe jest K nie przesunięcia w stanie
równowagi

• Obliczenia dotyczące stanu
równowagi mogą być podzielone
na dwie kategorie:
1)
Obliczenie stałej równowagi na
podstawie znanych stężeń lub
ciśnień
2)
Obliczenie jednego lub więcej
stężeń równowagowych lub
cząstkowych ciśnień na podstawie
znajomości K
c
or K
P
• Rozpatrzmy rozkład N
2
O
4
• Obliczenie stałej równowagi jest
bardzo łatwe
3
2
4
2
2
2
c
2
4
2
o
4
2
2
4
2
10
61
.
4
(0.0292)
)
0116
.
0
(
]
[
]
[
i
mol/L,
0116
.
0
]
[
mol/L
0292
.
0
]
[
równowagi
stanie
w
to
C,
25
w
butelce
L
1
w
mol
0.0350
jeżeże
)
(
2
)
(
O
N
NO
K
NO
O
N
O
N
g
NO
g
O
N

• Częściej mamy sytuację gdzie
podane są warunki początkowe i
stała równowagi:
• Jeżeli podana jest K
P
, to równowaga
będzie wyrażona w postaci ciśnień
cząstkowych
• Jeżeli K
c
opisuje układ, to równowaga
będzie opisana w postaci stężenia (mol/L)

– Przykład: octan etylu, CH
3
CO
2
C
2
H
5
,
produkowany jest z kwasu octowego i
etanolu w reakcji:
W 25
o
C, K
c
=4.10 dla tej reakcji.
Zakładamy, że 0.100 mola octanu etylu i
0.150 mola wody sa wprowadzone do
naczynia reakcyjnego o objętości 1,00
L. Jakie są stężenia w stanie
równowagi?
Strategia rozwiązania: posłużymy się
następującym schematem.
)
(
)
(
)
(
)
(
2
5
2
2
3
5
2
2
3
l
O
H
l
H
C
CO
CH
l
OH
H
C
l
H
CO
CH

Substraty i produkty (ICE)
• 1. Stężenia początkowe reagentów
• 2. Zmiany stężeń konieczne, by
układ osiągnął stan równowagi
• 3. Stężenia w stanie równowagi
x
x
0.250x
-
0.0150
x
x)
-
x)(0.150
-
(0.100
4.10
x
-
0.150
x
-
0.100
x
x
)
(
E
x
-
x
-
x
x
)
(
C
0.150
0.100
0
0
)
(
I
wtedy
ala,
przereagow
ktora
ilosc
Niech
cieklym.
stanie
w
sa
reagenty
Wszyskie
2
2
2
c
2
5
2
2
3
5
2
2
2
K
M
M
M
O
H
H
C
CO
CH
OH
H
C
H
CO
CH
x

• Uzyskujemy równanie
kwadratowe.
:
zatem
2
4
,
0
2
2
a
ac
b
b
x
c
bx
ax
0401
.
0
x
and
121
.
0
x
i
0
0.0150
-
x
0.250
x
3.10
lub
4.10
x
x
0.250x
-
0.0150
-
2
2
2
c
K

• Ponieważ ujemne stężenia nie mają
sensu:
• Podobną procedurę można zastosować
kiedy ciśnienia są wyrażone jako
ciśnienia cząstkowe i podana jest wartość
K
P
M
x
O
H
M
x
H
C
CO
CH
M
x
OH
H
C
M
x
H
CO
CH
x
011
.
0
150
.
0
]
[
060
.
0
100
.
0
]
[
0401
.
0
]
[
0401
.
0
]
[
m
equilibriu
at
and
0401
.
0
2
5
2
2
3
5
2
2
3

• Często można dokonać uproszczeń
Przykład: reakcja azotu i tlenu
prowadząca do tlenku azotu:
gdzie K
c
=4.8x10
-31
.
W powietrzu w 25
o
C i przy p = 1 atm,
stężenie N
2
i O
2
początkowo wynoszą
0.033 M i 0.00810 M. Oblicz stężenie w
stanie równowagi?
Strategia rozwiązania: stała równowagi
jest bardzo mała zatem niewiele
reagentów przekształci się w produkty.
)
(
2
)
(
)
(
2
2
g
NO
g
O
g
N

18
-
2
2
31
c
2
2
10
8.01
or x
00810)
(0.033)(0.
4x
,
x)
-
x)(0.00810
-
(0.033
(2x)
10
8
.
4
2x
x
-
0.00810
x
-
0.033
)
E(
x
x
x
)
C(
0
0.00810
0.033
)
(
I
2
K
M
M
M
NO
O
N

Kwasy i zasady
• Równowaga w roztworach K i Z jest
jedną z ważniejszych równowag
chemicznych.
• Związana jest z przeniesieniem protonu
• Przeniesienie zachodzi łatwo
• Roztwory K i Z można traktować jako w
stanie równowagi i obliczać stężenia
korzystając z wartości stałej równowagi.

Kwasy i zasady
• Cel: obliczyć stężenie jonów
wodorowych
• Znaczenie stężenia jonów wodorowych
• Procesy życiowe
• Procesy geochemiczne
• Syntezy przemysłowe
• Reakcje biochemiczne

Definicja pH
• pH=-log a(H
+
)
• Np.. [H
+
]=2,0 10
-3
mol l
-1
• pH= - log(2,0 ·10
-3
) = 2,70
• pH jest tym wyższe, im mniejsze jest
stężenie jonów wodorowych w roztworze
• Zastąpienie aktywności stężeniem
molowym jest ryzykowne i słuszne jedynie
w przypadku roztworów bardzo
rozcieńczonych

Kwasy i zasady
• Zmiana pH osocza krwi o więcej niż
0,4 w stosunku do normalnej
wartości 7,4 stanowi śmiertelne
zagrożenie dla ludzkiego organizmu.
Określ graniczne wartości stężenia
jonów wodorowych, w obrębie
których możliwe jest utrzymanie
funkcji życiowych.

Rozwiązanie
• Granice zmiany pH
• pH = 7,4 + 0,4 = 7,8
• pH = 7,4 – 0,4 = 7,0
• [H
+
] = 10^-pH=10^-7,0 = 100
nmol/L
• [H
+
] = 10^-pH=10^-7,8 = 15,8
nmol/L

Teoria Bronsteda i
Lowry’ego
• Kwasem Bronsteda, HA, jest donor
protonu:
• HA H
+
+ A
-
• Zasadą Bronsteda, B, jest akceptor
protonu:
• B + H
+
BH
+

Teoria Bronsteda i
Lowry’ego
• Określ, które z wymienionych
związków są kwasami, a które
zasadami: H
2
SO
4
, HSO
-4
, SO
-24
• Kwas, bowiem: H
2
SO
4
HSO
-4
+ H
+
• Kwas, bowiem: HSO
-4
SO
-24
+ H
+
• Zasada, bowiem: SO
-24
+ H
+
HSO
-4

Kwas sprzężony
• W roztworze wodnym kwas (solny lub
octowy) uczestniczy w następującej reakcji
wymiany protonu:
• HA(aq) + H
2
O© H
3
O
+
(aq) + A
-
(aq)
• Woda przyłącza proton kwasu i działa jak
zasada
• Jon H
3
O
+
oksoniowy (hydroniowy) też jest
kwasem a A
-
zasadą
• Jon H
3
O
+
kwasem sprzężonym z zasadą A
-
• A
-
zasada sprzężona z kwasem HA

Sprzężone kwasy i zasady
• Kwas
1
+zasada
2
kwas
2
+zasada
1
• Co jest zasadą sprzężoną z
amoniakiem, gdy ten pełni rolę
kwasu?
• NH
3
+ H
2
O NH
-2
+H
3
O
+

Równowaga
autoprotolityczna
• H
2
O + H
2
O H
3
O
+
(aq)+OH
-
(aq)
• Pomimo tego, że zachodzi bez przerwy
wymiana, całkowite stężenie jonów
oksoniowych i wodorotlenowych w czystej
wodzie jest stałe.
• W temp. 25 ° C stężenie jonów oksoniowych
i wodorotlenowych powstałych w wyniku
autoprotolizy wynoszą 1,0 · 10
-7
mol l
-1
• Jedna na 550
milionów cząsteczek H
2
O
oddaje proton innej cząsteczce wody

Czysta woda
• pH czystej wody w temp. 25 ° C wynosi:
• pH-log (1,0 · 10
-7)
= 7,0emperatury
• W przypadku wody można aktywność
zastąpić stężeniem
• Autoproliza – proces endotermiczny
• Zwiększenie temperatury sprzyja
zwiększeniu stężenia jonów oksoniowych
• pH wynosi 6,82 dla temp. 37 · ° C

Stałe kwasowe
• Równowagę wymiany protonu między Kw
Bronsteda a wodą można ilościowo opisać
za pomocą stałej równowagi:
• HA(aq) + H
2
O H
3
O
+
(aq) + A
-
(aq)
• K=a(H
3
O
+
) a(A
-
)/a(HA) a(H
2
O)
• Wodę uczestniczącą w reakcji można
potraktować jako czystą fazę ciekłą, zatem
a=1

Stałe kwasowe
• K
a
=a(H
3
O
+
) a(A
-
)/a(HA)
• Stałą równowagi nazywamy stałą
kwasową kwasu HA.
• Dla przykładu:
• HF(aq) + H
2
O(c) H
3
O
+
(aq) + F
-
(aq)
• K
a
= a(H
3
O
+
) a(F
-
)/a(HF)= 3,5 · 10
-4

Stała kwasowa
• Wartość stałej kwasowej określa, jak
dalece zachodzi wymiana protonu: im
mniejsza jest wartość K
a
, tym słabsze
są właściwości protonodonorowe
• W teorii B – L, jonizacja oznacza
przeniesienie protonu. Zatem kwas
HF jest w roztworze jedynie
nieznacznie zjonizowany.

Wykładnik stałej
kwasowej
• Małe wartości wygodniej posłużyć się
logarytmem
• pK
a
= - log K
a
• Im większa wartość pK
a
, tym słabsze są
protodonorowe właściwości kwasu
• Cząsteczka HCN jest znacznie słabszym
donorem protonu (względem H
2
O) niż
cząsteczka HF
• Cząsteczka CH
4
nie wykazuje żadnych
dostrzegalnych tendencji do oddania protonu
cząsteczce wody.

Słabe kwasy
• pK
a
= 4,19 dla kwasu
benzoesowego
• Oblicz pH i ułamek zjonizowanych
cząstek w roztworze o stężeniu
molowym A molL
-1
.
• Użyjmy schematu ICE;

Słabe kwasy i mocne
kwasy
• Reagenty kwas proton reszta
• Stężenie pocz. A
0
0
• Zmiana stężenia –x +x +x
• Stężenie równowag.A-x x x

Słabe kwasy i mocne
kwasy
• Wartość x znajdujemy:
• K
a
=a(H
3
O
+
) a(A
-
)/a(HA)x· x/(A-x)
• Przekształcając otrzymamy:
• X
2
+ K
a
x – A K
a
= 0
• Rozwiązaniem będzie:
• X=[-K
a
± (K
a2
+4AK
a
)
0,5
]/2

Słabe i mocne kwasy
• Ponieważ x oznacza stężenie jonów
oksoniowych, musi mieć wartość dodatnią,
należy zatem przyjąć rozwiązanie ze
znakiem + w liczniku.
• Jeżeli A = 0,01 wówczas {H
+3
O} = 4,2 10
-4
i
pH 3,38
• Ponieważ zaniedbujemy efekt oddziaływań
międzyjonowych, dokładność takich obliczeń
rzadko kiedy przekracza 0,1 jednostki pH
zatem wynik zapisujemy pH = 3,4.

Stopień jonizacji
• Ze znajomości stałej można ocenić stopień
jonizacji.
• Stopień jonizacji = stężenie sprzężonej
zasady/ początkowe stężenie molowe kwasu
• Np.. Stopień jonizacji x/A 4,2 10
-4
/0,010
= 4,2 10
-2
• Jedynie 4,2 % cząsteczek kwasu oddało
proton
• Kwas mlekowy 25% zjonizowany

Stopień jonizacji
• Rzadko obliczamy pH roztworu, pewna
metodą jest jego pomiar
• Ważne jest umiejętność
przewidywania czy pH będzie < od 7
czy >7 przy określonym nominalnym
stężeniu
• Uproszczenie w obliczeniach:
• K
a
x
2
/A pH = 0,5 pK
a
– 0,5 log A
• Przybliżenie słuszne dla stopnia < 5%

Obliczanie pH roztworu
kwasu
• Jeżeli kwas jest mocny, przyjmujemy
całkowitą jego jonizację w
roztworze i obliczamy pH według
wartości stężenia kwasu, kładąc
• {H
3
O
+
} = [HA] dodany początkowo
• Jeżeli kwas jest słaby, sprawdzamy
wg równania stopień jonizacji =
(K
a
/A)
0,5
czy jest <
5%

Obliczanie pH roztworu
kwasu
• Jeżeli stopień > od 5% to
rozwiązujemy równanie w sposób
dokładny
• Jeżeli stopień jonizacji mniejszy od
5% to korzystamy ze wzoru
przybliżonego

Zadanie
• Do czystej wody dodano 1.5 x 10
-3
mola kwasu solnego celem
podniesienia stężenia jonów
wodorowych do wartości 1.5 x 10
-3
mola/L. Jakie jest stężenie jonów
hydroksylowych?
• [OH
-
]=1 x 10
-14
/ 1.5 x 10
-3
= 6.7 x
10
-12
mol/L

Związek pomiędzy K
a
i K
b
• HB+ H
2
O H
3
O
+
+ B
-
• BH + H
2
OBH
+
+ OH
-
• K
a
K
b
= {H
3
O
+
x B
-
/ HB x H
2
O}x
• {BH
+
x OH
-
/ BH x H
2
O =
• [H
3
O
+
] x [OH
-
] = K
w

Zadanie
• Stała dysocjacji zasadowa dla NH
3
wynosi: K
b
= 1,74 x 10
-5
w 25 °C.
Oblicz K
a
sprzężonego kwasu
NH
4+
.
• K
a
=K
w
/K
b
=1.00 x 10
-14
/1.74 x 10
-5
= 5.75 x 10
-10

Obliczenie pH
• Średni współczynnik `aktywności w 0,05
molowym roztworze HCl wynosi 0,83. Jakie
jest pH roztworu?
• pH = - log [5 x 10
-2
] = -log 5 +2 =-0,7 +2=
1,3
• pH = -log [0,83 x 5 x 10
-2
] = 1,38
• Jeżeli dodano do roztworu NaCl w ilości
takiej, że siła jonowa wyniosła 0,5; to wsp.
Aktywności wtedy wynosi 0,77; i pH = 1,41.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
Wyszukiwarka
Podobne podstrony:
7 równowaga chemiczna sprawozdanie
Lista 4 Równowagi chemiczne
Równowaga chemiczna
Równowagi chemiczne
Wykład 2, Równowagi chemiczne, woda
Chemia IX Rownowagi Chemiczne id 112320
06 Równowaga Chemiczna
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
08 Równowagi chemiczneid 7495
8-STAN RÓWNOWAGI CHEMICZNEJ, STAN RÓWNOWAGI CHEMICZNEJ
Rownowaznik chemiczny, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Laboratorium 5 Kinetyka i równowaga chemiczna
7 równowaga chemiczna instrukcja
Wyklad 10. Rownowaga chemiczna, chomikowe, WYKŁADY z Chemii
7.Prawo działania mas - równowaga chemiczna, Chemia ogólna ćwiczenia
Definicje równoważnik chemiczny, Materiały - Biotechnologia
Rownowaga Chemiczna Zadania, Nauka, Szkoła, Matura, Chemia - notatki, Notatki CHEMIA
więcej podobnych podstron