
WPŁYW HORMONÓW
NA RÓŻNICOWANIE
SIĘ ORGANÓW

Organogenez
a
Proces tworzenia się organów w wyniku
różnicowania się komórek i tkanek
Organogen
eza
Pośred
nia
Bezpośred
nia
Powstanie korzeni i pędów Korzenie i pędy
powstają
Poprzedza powstanie kallusa bezpośrednio bez
wytworzenia kallusa
Procesy niezbędne do zajścia organogenezy in vitro to
dedyferencjacja oraz redyferencjacja.

Totipotencja komórek
roślinnych
Totipotencjalne komórki mają nieograniczoną zdolność
do podziałów i odtwarzania poszczególnych organów czy
całego organizmu.
Każda komórka roślinna zawiera taki sam zestaw
informacji genetycznej. Podczas różnicowania się
komórek nie dochodzi do utraty materiału genetycznego
a jedynie do zablokowania ekspresji poszczególnych
genów.

Kalu
s
Kalus tytoniu
szlachetnego
Tkanka przyranna,
powstaje in vivo
wskutek uszkodzenia
mechanicznego lub
przez mikroorganizmy i
owady żerujące na
roślinie. In vitro w
tworzeniu kalusa mogą
brać udział wszystkie
tkanki będące na
powierzchni cięcia
eksplantatu lub tylko
niektóre z nich
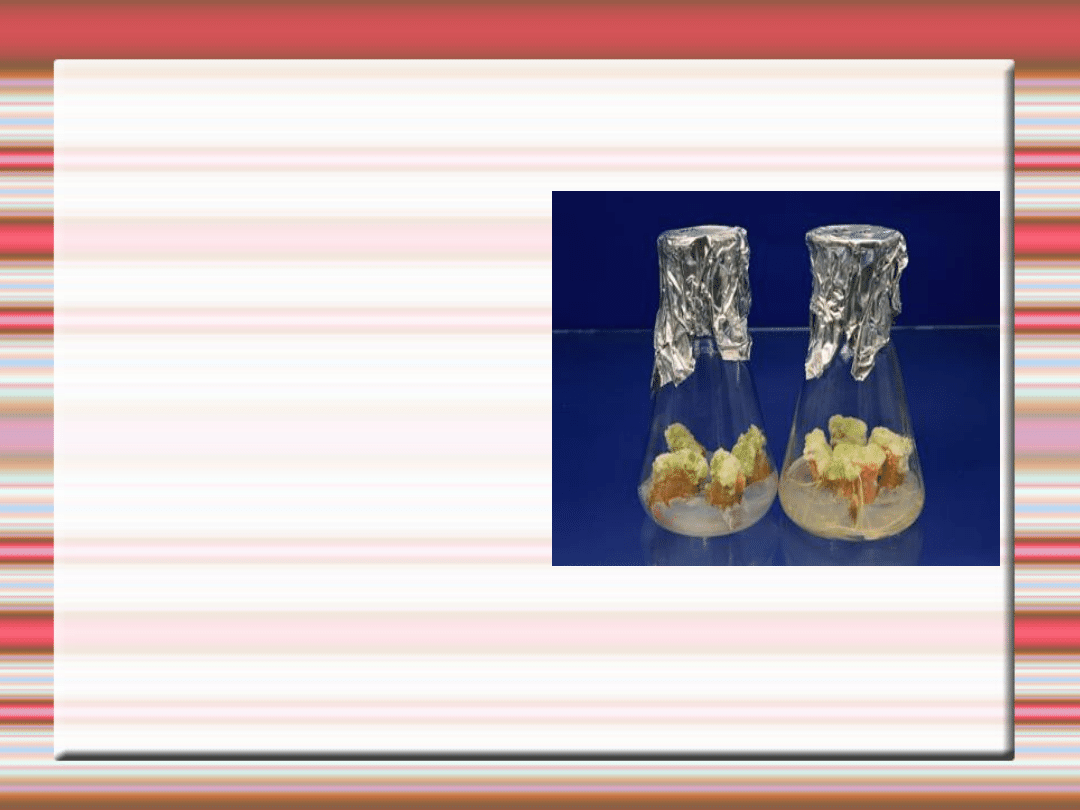
Początkowo
niezróżnicowana
tkanka kalus
zbudowana jest z
komórek
parenchymatyczny
ch. Po pewnym
czasie trwania
kultury powstają
formacje tkanek
przewodzących
oraz centra
merystematyczne
Kalus powstający na korzeniu
marchwi

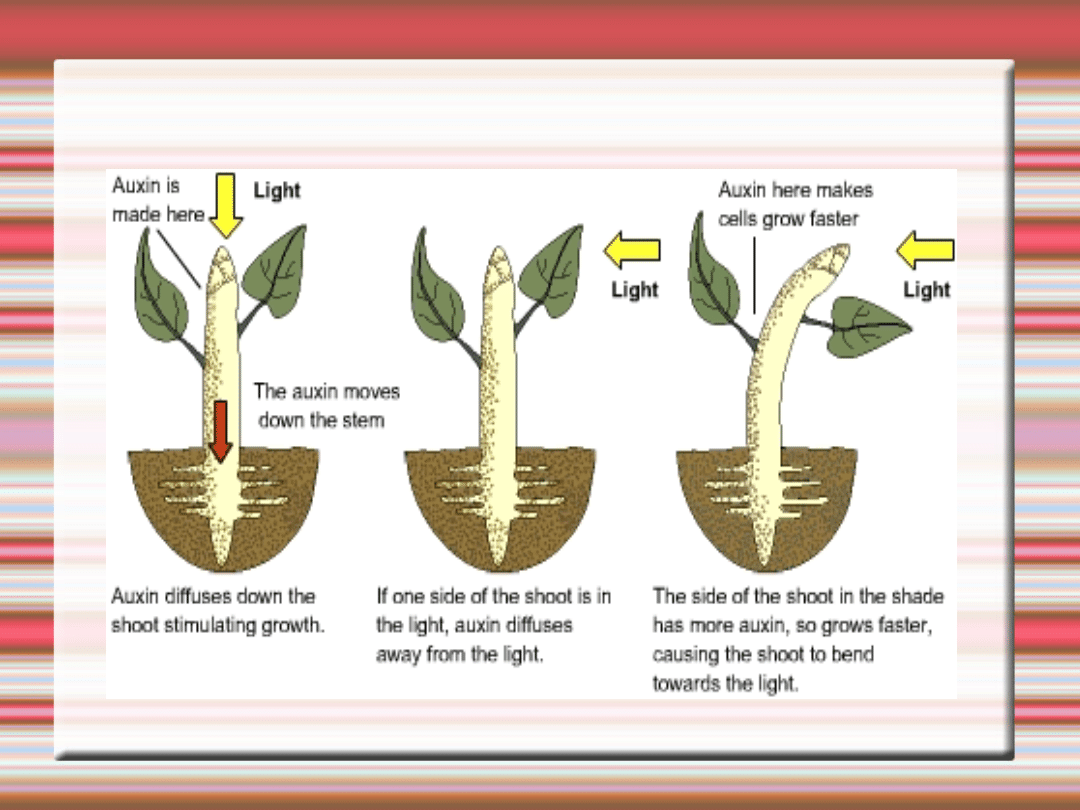
Auksyny i
cytokininy
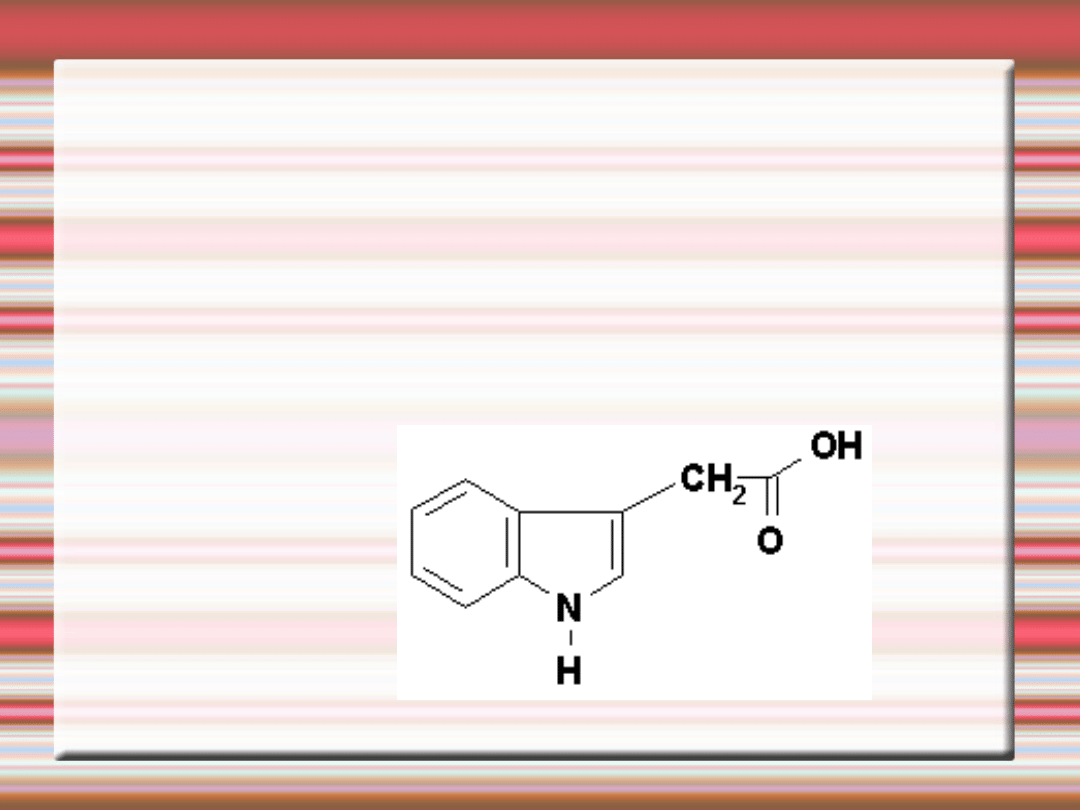
AUKSYNY- to związki organiczne, które charakteryzuje
•zdolność do wywoływania wzrostu elongacyjnego komórek
łodygi.
•Auksyny tworzą się przede wszystkim w pąkach
wierzchołkowych
•oraz w najmłodszych liściach i tam zwykle jest ich najwyższe
stężenie
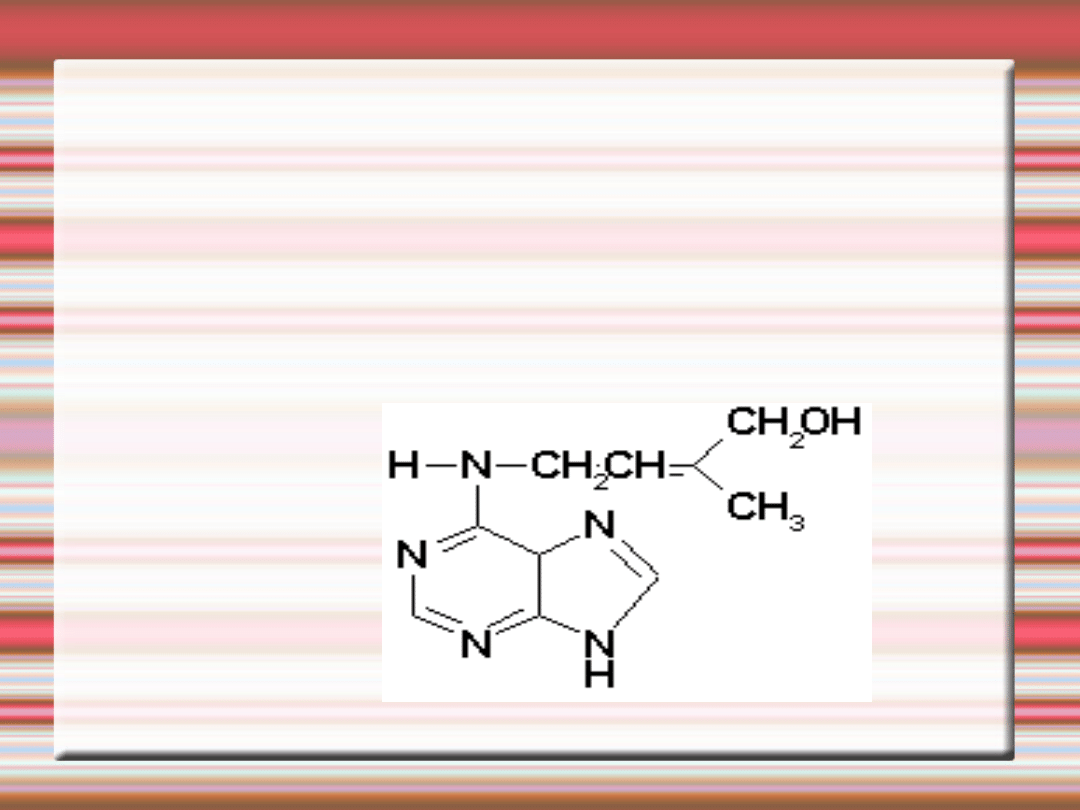
CYTOKININY- naturalne cytokininy są pochodnymi zasady
purynowej adeniny, są syntezowanie w różnych rodzajach tkanki
twórczej, ale głównym miejscem ich biosyntezy są merystemy
wierzchołkowe
•systemu korzeniowego, tkanka kalusowa
•oraz młode intensywnie rosnące owoce i
•nasiona .W obrębie roślin cytokininy charakteryzują się słabą
ruchliwością

Dziedziczenie zdolności do
regeneracji
Zdolność do
regeneracji
Cecha
jakościowa
Cecha
ilościowa
•Lucerna- o procesie
regeneracji decydują 2
współdziałające loci A/a,
B/b
•Różna odziedziczalność
i różna liczba poligenów
wpływająca na jej
zmienność całkowitą

Analiza
genomów
Porównanie profili ekspresji genów i białek z
kalusa embriogenicznego i tkanki bez potencjału
embriogenicznego.
Analiza mutantów o odmiennej reakcji lub
wykazujące zaburzenia rozwojowe i
funkcjonalne.

Metodyka
pracy
1 dzień:
•Sterylizacja narzędzi
•Przygotowanie pożywki
•Autoklawowanie
•Rozlanie pożywek do probówek
2 dzień:
•Izolacja hipokotyli, fragmentów korzenia i liścieni
•Umieszczenie eksplantatów na pożywkach w 3
powtórzeniach Warunki hodowli:
•4 tygodnie w komorze
•16 godzinny fotoperiod
•Tem. 24 C dzień 22 C w nocy

Wiersz 1 Wiersz 2 Wiersz 3 Wiersz 4
0
2
4
6
8
10
12
Kolumna 1
Kolumna 2
Kolumna 3
Wariant A -
kontrola
liścienie hipokotyle
korzenie

Wariant B -
NAA(1mg/l)
hipokotyl
korzeń

Wariant C -
BAP(1mg/l)

Wariant D -
NAA(1mg/l) +
BAP(1mg/l)
hipokot
yl
korze
ń

Wariant E -
NAA(1mg/l) +
BAP(0,1mg/l)
Wiersz 1 Wiersz 2 Wiersz 3 Wiersz 4
0
2
4
6
8
10
12
Kolumna 1
Kolumna 2
Kolumna 3
hipokotyl
korzeń

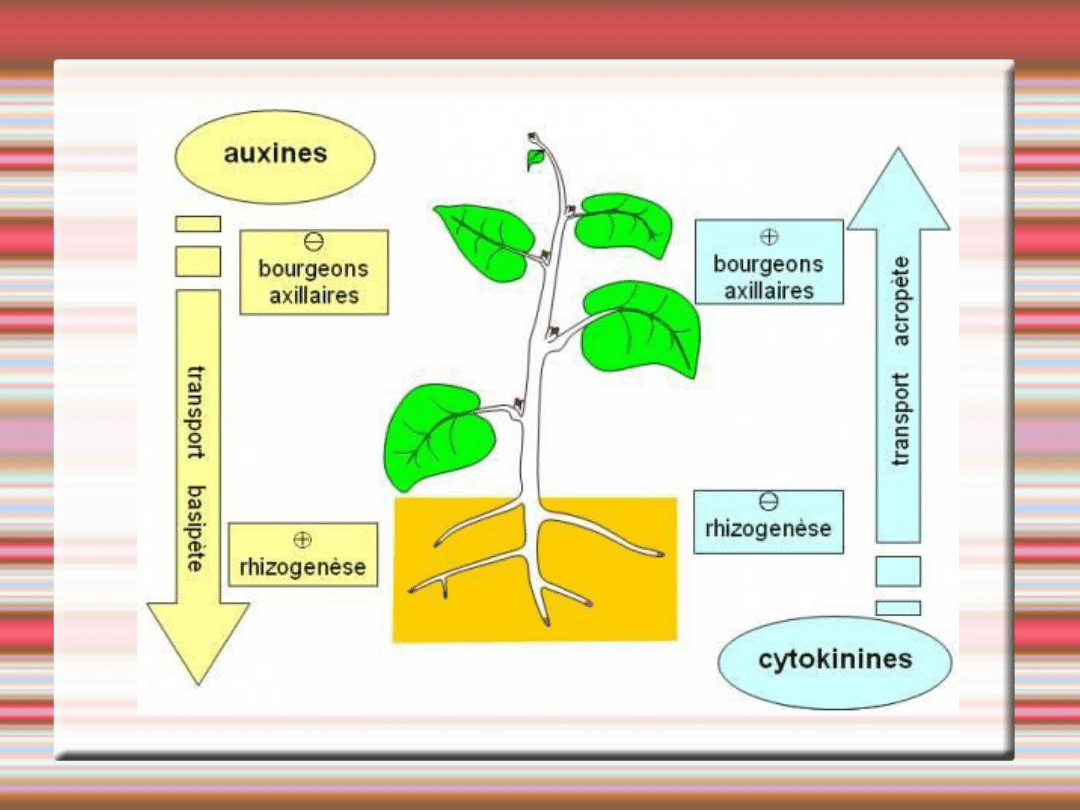
Organogenezę w kulturach in vitro możemy kontrolować
poprzez zawartość fitohormonów w pożywce.
Przy stymulacji eksplantatu dwoma hormonami
obserwujemy dominujący wpływ jednego z nich
występującego w wyższym stężeniu.
Auksyny i cytokininy stymulują odmienne kierunki
organogenezy.
Nie wszystkie eksplantaty są tak samo przydatne do
zakładania kultur in vitro.

Zastosowanie
praktyczne
hodowle twórcze
klonowanie roślin będących chimerami lub
roślin z dziedzicznie zróżnicowanymi
warstwami tkanek
mieszańce heterozyjne

kultury pąków
bocznych

kultury korzeni
włośnikowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
WPŁYW HORMONÓW NA WYGLĄD I SKÓRĘ CZŁOWIEKA, Kosmetyka - referaty RÓŻNE
5 Wpływ tradycji?rbarzyńskiej na kształtowanie się Europy
Wpływ hormonow na procesy metaboliczne w kościach, 2013
Wpływ hormonów na skórę, Kosmetyka (Technik usług kosmetycznych), Anatomia-dermatologia, Anatomia de
Wpływ mediów na wyzwalanie się agresywnych postaw wśród młodzieży i dzieci, Dokumenty praca mgr
Wpływ niepełnosprawności na kształtowanie się procesów poznawczych
wpływ wody na kształtowanie się rzeźby terenu
Wpływ hormonów na skórę, szkoła, anatomia
wpływ telewizji na kształtowanie się postaw ludzi LEAXOQA52RPE25VZZW35YB7QWQOEDZMU7SKBUOY
Fitohormony i wpływ hormonów na skórę
086 , Wpływ telewizji na kształtowanie się postaw ludzi
Wpływ światła na zazielenienie się rośliny
WPŁYW HORMONÓW NA WYGLĄD I SKÓRĘ CZŁOWIEKA, Kosmetyka - referaty RÓŻNE
więcej podobnych podstron