
KOROZJA MATERIAŁÓW
STOSOWANYCH W BUDOWNICTWIE
1

Terminem
korozja
określa się zjawisko
niszczenia materiałów pod wpływem działania
otaczającego je środowiska (atmosfery, opadów,
wód), jak i czynników technologicznych
uwalnianych do atmosfery w wyniku działalności
człowieka. Są nimi tlenki siarki, azotu, dwutlenek
węgla, kurz, itp. oraz wszelkiego rodzaju
chemikalia. Najczęściej zjawisko korozji odnosimy
do metali i ich stopów, jednakże dotyczy ono
również tworzyw niemetalowych, takich jak
beton, materiały ceramiczne, tworzywa sztuczne,
itp.
2

Korozji ulegają substancje mineralne (skały), materiały
wiążące (różnego rodzaju zaprawy budowlane), metale
(żeliwo, stal), substancje organiczne naturalne
syntetyczne.
Dla inżyniera budownictwa najważniejszą jest korozja
elektrochemiczna powodowana przez roztwór elektrolitów
(woda deszczowa pochłaniająca różne gazy z powietrza:
CO
2
, SO
2
. NO
2
, NH
3
itp.), woda rzeczna, woda morska i
woda w glebie. Przebieg korozji może się uzewnętrznić
jako ogólne, równomierne niszczenie materiału lub w
postaci miejscowych głębokich wżerów punktowych.
Racjonalne wykorzystanie techniczne materiałów i
zapewnienie jak największej trwałości konstrukcjom
budowlanym wymaga znajomości procesów korozyjnych i
umiejętności ich hamowania.
Głównym celem ochrony przed korozją jest dobór
właściwych materiałów punktu widzenia technicznego i
ekonomicznego) do pracy w danym środowisku
korozyjnym oraz zastosowanie odpowiednich sposobów na
zmniejszenie szybkości procesów korozyjnych.
3

•Korozja atmosferyczna
•Korozja ziemna
•Korozja morska
4

Korozja atmosferyczna
Szczególnym rodzajem korozji jest korozja atmosferyczna, bardzo
rozpowszechniona, ponieważ około 80% konstrukcji i budowli
eksploatuje się w warunkach atmosferycznych. Rozróżnia się trzy
rodzaje korozji atmosferycznej:
suchą, wilgotną i mokrą
.
Mechanizm korozji atmosferycznej jest określony stopniem
nawilgocenia powierzchni materiału i charakterem substancji
rozpuszczonych w warstewce wody. Szybkość procesu korozyjnego w
atmosferze zależy od następujących czynników:
1)
charakteru stosowanego materiału, jak również stanu jego
powierzchni,
2)
czasu działania atmosfery,
3)
klimatu — wilgotność atmosfery, temperatury
4)
zanieczyszczenia atmosfery:
•cząstki stałe — kurz, piasek, pył węglowy, sadza, związki chemiczne
rozpylone w powietrzu,
•cząstki ciekłe — mgła, kondensująca się para wodna nasycona
innymi związkami chemicznymi,
•cząsteczki gazów — dwutlenek węgla, dwutlenek siarki (1,5 miliona
SO
2
rocznie dostaje się do atmosfery ze spalania 100 milionów ton
węgla), tlenki azotu, siarkowodór, amoniak i inne.
Intensywność korozji atmosferycznej jest uzależniona od
agresywności atmosfery korozyjnej.
5

Korozja ziemna (w glebie)
Gleba jako środowisko korozyjne jest elektrolitem. Struktura i
tekstura gleby są określone składem chemicznym cząstek
stałych oraz ich wielkością. Porowatość gleby sprzyja
zatrzymaniu wody i napowietrzaniu. Na korozyjność gleby mają
wpływ następujące czynniki:
1. Rodzaj gleby, porowatość. Stwierdzono w piasku brak korozji, ta
część rurocią gu jest katodą a w glinie anodą.
2. Wilgotność gleby — w glebie suchej brak korozji, w glebie
wilgotnej ta część konstrukcji jest anodą.
3. Napowietrzenie — rurociąg w glebie jest lepiej napowietrzony
od górnej strony i ta część rury jest katodą, natomiast dolna
część rurociągu jest anodą ponieważ jest gorzej napowietrzona,
a tym samym natleniona, i tam następuje korozja.
4. Zawartość rozpuszczonych związków chemicznych.
Stwierdzono, że zawartość jonów chlorkowych i siarczkowych
uaktywnia proces korozji.
5. Kwasowość i alkaliczność gleby.
6. Przewodność elektryczna.
7. Obecność mikroorganizmów w glebie (bakterie, pleśnie,
grzyby). W glebie mogą być bakterie tlenowe, np. bakterie
siarkowe utleniające siarkę do kwasu siarkowego, który atakuje
żelazo i beton.
6

Korozja morska
Woda morska pod względem chemicznym stanowi roztwór
wielu soli o właściwościach buforowych. Woda morska
stanowi typowy elektrolit, o dobrym przewodnictwie, ma
odczyn słabo alkaliczny (pH 8-8,3); to wszystko sprzyja
pracy mikro- i makroogniw korozyjnych. Korozja morska
żelaza, stali i żeliwa przebiega prawie całkowicie z
depolaryzacją tlenową. Szybkość korozji jest regulowana
dopływem tlenu do powierzchni metalu. Obecność
agresywnego jonu chlorkowego wodzie morskiej powoduje
korozję wżerową nawet metali i stopów odpornych
działanie wielu agresywnych środowisk korozyjnych.
Szybkość korozji osiąga maksimum, jeżeli stężenie chlorku
sodowego w wody morskiej wynosi około 3% (zasolenie
Bałtyku wynosi około 1%, wód oceanicznych — około
3,5%).
7

Korozja materiałów kamiennych
Działanie wody deszczowej i gruntowej.
Woda deszczowa zawsze zawiera kwasy wytworzone w wyniku
rozpuszczenia występujących w powietrzu gazów, np.
dwutlenku węgla, dwutlenku siarki i tlenków azotu. Na działanie
takie najbardziej narażone są wapienie i piaskowce o lepiszczu
wapiennym:
CaCO
3
+ H
2
SO
4
CaSO
4
+ H
2
CO
3
CaCO
3
+ 2HNO
3
Ca(NO
3
)
2
+ H
2
O + CO
2
CaCO
3
+ H
2
CO
3
Ca(HCO
3
)
2
CaCO
3
+ H
2
O + CO
2
Niszczące działanie wody zawierającej kwasy polega na
przemianie węglanu wapniowego w rozpuszczalne sole, których
wyługowanie osłabia strukturę kamienia i powoduje
powstawanie szczelin i ubytków, a na powierzchni kamienia
wykrystalizowują wykwity powstałych soli.
Działanie czynników biologicznych.
Istnieją bakterie, które niszczą kamień, powodując utlenianie
lub redukcję występujących w kamieniu związków siarki. Inne
bakterie powodują przemianę węglanów w azotany, w wyniku
której wapień kruszy się i rozdrabnia na proszek.
Również mchy i glony mogą oddziaływać na kamień
niszcząco, wytwarzając agresywne substancje, np. kwasy
humusowe.
8

RODZAJE KOROZJI
W zależności od składu środowiska agresywnego
rozróżniamy następujące rodzaje korozji:
• korozja ługująca - spowodowana działaniem wód
miękkich,
• korozja kwasowęglowa - zależna od zawartości
agresywnego dwutlenku węgla,
• korozja ogólnokwasowa - związana z aktywnością
jonów wodorowych (pH),
• korozja siarczanowa - zależna od zawartości jonów
siarczanowych,
• korozja magnezowa - zależna od zawartości jonów
magnezowych.
9

Korozja ługująca
Przesączająca się przez beton woda reaguje z jego składnikami
i stopniowo wypłukuje wodorotlenek wapnia pozostawiając żel
krzemowy. Stwardniały zaczyn cementowy składa się z
produktów hydratacji minerałów klinkierowych oraz części
nieuwodnionych składników cementu. Produkty hydratacji są to
uwodnione krzemiany i gliniany wapnia, żelazian wapnia,
siarczanoglinian wapnia oraz krystaliczny wodorotlenek wapnia
Ca(OH)
2
. Ponadto w porach betonu znajduje się nasycony
roztwór Ca(OH)
2
. Najbardziej podatny na korozję jest
wodorotlenek wapnia i ten składnik posiada największe
znaczenie dla zachowania trwałości betonu, gdyż pozostałe
składniki stwardniałego zaczynu cementowego mogą trwałe
egzystować tylko w środowisku zasadowym. Wodorotlenek
wapnia powstaje w betonie w wyniku hydratacji alitu i belitu:
2(3 CaO • SiO
2
) + 6H
2
O 3 CaO • 2 SiO
2
• 3 H
2
O + 3 Ca(OH)
2
Wodorotlenek wapnia jest najbardziej wrażliwym na
rozpuszczanie składnikiem stwardniałego zaczynu
cementowego (rozpuszczalność rzędu 1200-1700 mg/dm3).
Dopóki Ca(OH)
2
znajduje się w porach betonu i utrzymuje
odczyn silnie zasadowy (pH >12) układ jest w stanie równowagi
i zachowuje trwałość.
10

Korozja ługująca
Rozpuszczenie i wypłukanie Ca(OH)
2
z zaczynu narusza
istniejący stan równowagi. Następuje obniżenie zasadowości
fazy ciekłej do wartości pH < 12 i stabilne wcześniej
minerały ulegają rozpuszczeniu:
2 CaO • SiO
2
• nH
2
O + 2H
2
O 2SiO
2
• nH
2
O + 2Ca(OH)
2
Analogicznie można rozpatrywać trwałość minerałów
powstałych przez uwodnienie glinianu i żelazianu wapnia.
Wskutek obniżenia stężenia Ca(OH)
2
początkowo następuje
pełny rozkład krzemianów, następnie pełny rozpad
glinianów, a w rezultacie zniszczenie betonu. Obecność soli,
nawet nie wchodzących w reakcje ze składnikami betonu
powoduje podwyższenie stężenia jonów w roztworze i
zwiększa siłę jonowa roztworu. Rozpuszczalność soli trudno
rozpuszczalnych rośnie wraz ze wzrostem siły jonowej.
Następuje więc wzrost wyługowania Ca(OH)
2
- wodorotlenku
wapnia z betonu i obniżenie jego wytrzymałości. Natomiast
obecność węglanów i wodorowęglanów wapnia obniża
korodujące działanie wody. Im wyższa jest twardość
przemijająca wody, tym mniejszą wywoła ona korozję.
11

Korozja kwasowęglowa
Działanie agresywnego dwutlenku węgla CO
2
polega na tym,
że część jego w wodach naturalnych znajduje się w
równowadze chemicznej z Ca(HCO
3
)
2
, jedynie nadmiar
wolnego CO
2
wykazuje działanie agresywne i nierozpuszczalny
węglan wapnia przechodzi w łatwo rozpuszczalny
wodorowęglan wapnia. Jest to specyfika procesów korozji
węglanowej lub kwasowęglowej. Procesy chemiczne korozji
węglanowej przedstawić można następującymi równaniami:
CO
2
+ Ca(OH)
2
CaCO
3
+ H
2
O
CaCO
3
+ CO
2
+ H
2
O Ca(HCO
3
)
2
Ca(OH)
2
+ 2CO
2
Ca(HCO
3
)
2
Przy niewielkich, dla wód naturalnych, stężeniach kwasu
węglowego H
2
CO
3
(jonów H
+
), ilość Ca(OH)
2
wodorotlenku
wapnia rozpuszczonego chemicznie jest znikoma w
porównaniu z ilością Ca(OH)
2
wodorotlenku wapnia
wyługowanego fizycznie. W tych warunkach rola kwasu
węglowego H
2
CO
3
sprowadza się głównie do rozpuszczania
skarbonizowanej warstwy na powierzchni betonu lub
uniemożliwi jej tworzenie. Zwiększa to przesiąkliwość betonu i
powoduje fizyczne wypłukiwanie z niego wodorotlenku wapnia.
12

Korozja ogólnokwasowa
Korozja wywołana wodami o cechach agresywności
kwasowej, polega na rozpuszczeniu Ca(OH)
2
ze
stwardniałego zaczynu cementowego w betonie, a
następnie na rozkładzie uwodnionych krzemianów
wapnia i glinianów wapnia. Korozja pod działaniem wód
kwaśnych jest analogiczna do korozji ługującej wywołanej
fizycznym wypłukiwaniem wodorotlenku wapnia Ca(OH)
2
.
Różnica polega na tym, że w wypadku korozji ługującej
obniżenie zasadowości odbywa się przy pomocy procesów
fizycznych (wypłukiwanie Ca(OH)
2
, natomiast w
przypadku korozji kwasowej, na drodze reakcji
chemicznych wodorotlenku wapnia Ca(OH)
2
, z kwasami.
Przy niewielkich stężeniach kwasu (jonów H
+
), co jest
charakterystyczne dla wód naturalnych posiadających pH
6-8, ilości wodorotlenku wapnia zneutralizowane kwasem
są nieznaczne w porównaniu z ilościami wodorotlenku
wapnia wyrugowanego fizycznie z betonu. Korozja betonu
pod działaniem dowolnego kwasu , może być
przedstawiona równaniem
Ca(OH)
2
+ 2H
+
= Ca
2+
+ 2H
2
O
13

Ostatecznymi produktami działania kwasów na
stwardniały zaczyn będą żel kwasu krzemowego oraz
sole wapnia i glinu danego kwasu. Rodzaj
powstających soli ma obok stężenia jonów
wodorowych istotny wpływ na szybkość niszczenia
betonu. Jeżeli sole powstające są łatwo
rozpuszczalne chlorki, azotany, wodorowęglany
(CaCl
2
, Ca(NO
3
)
2
, Ca(HCO
3
)
2
, A1C1
3
, A1(NO
3
)
3
) to są
one unoszone z betonu przez wodę. Proces ten
przyczynia się do zwiększania porowatości betonu, a
tym samym do przyspieszenia procesów korozyjnych.
Jeżeli produktami reakcji są trudno rozpuszczalne
szczawiany lub fosforany (CaC
2
O
4
, A1
2
(C
2
O
4
)
3
,
Ca
3
(PO
4
)
2
, A1(PO
4
), to okludując w porach mogą one
tworzyć warstewki ochronne utrudniające kontakt
roztworu agresywnego ze składnikami spoiwa
hamującymi postęp korozji.
14

Korozja siarczanowa
W wyniku oddziaływania siarczanów na stwardniały
beton powstaje gips i sól Candlota.
Ca
2+
+ SO
4
2-
CaSO
4
H
2
O CaSO
4
• 2H
2
O
(gips)
3CaO • A1
2
O
3
+ 3CaSO
4
+ 32 H
2
O
3CaO•A1
2
O
3
• 3CaSO
4
• 32H
2
O (sól
Candlota)
Powstające związki mają większą objętość, wywołują
znaczne naprężenia w porach, co powoduje rozsadzanie
stwardniałego betonu (tworzą się pęknięcia i rysy).
Działanie jonów siarczanowych SO
4
2-
jest najbardziej
agresywne wtedy, kiedy występują one w połączeniu z
kationami magnezu Mg
2+
, cynku Zn
2+
, glinu Al
3+
, miedzi
Cu
2+
, żelaza Fe
3+
, czyli w postaci soli słabych zasad. W
wyniku hydrolizy soli np. siarczanu żelaza Fe
2
(SO
4
)
3
następuje zwiększenie kwasowości roztworu:
Fe
3+
+ 3HOH Fe(OH)
3
+ 3H
+
Następuje wtedy dodatkowe działanie korozyjne,
podobne do korozji kwasowej.
15

Korozja magnezowa
Zawartość soli magnezu w wodzie (np. morskiej)
powoduje tzw. korozję ma gnezową wg reakcji:
MgSO
4
+ Ca(OH)
2
= CaSO
4
+ Mg(OH)
2
MgCl
2
+ Ca(OH)
2
= CaCI
2
+ Mg(OH)
2
Powstające sole wapnia np. chlorek wapnia CaCl
2
i inne mogą być następnie wymywane przez
wodę, inne sole jak np. siarczan wapnia CaSO
4
,
mogą tworzyć gips i sól Candlota. Wodorotlenek
magnezu występuje w postaci koloidu (żelu) nie
posiadającego własności wiążących, następuje
więc osłabienie wytrzymałości betonu. Wskutek
zamiany wodorotlenku wapnia na
nierozpuszczalny wodorotlenek magnezu,
zasadowość roztworu w porach betonu zmniejsza
się, co wpływa na rozpad krzemianów i glinianów
wapnia.
16

Korozja zbrojenia w żelbecie
Obecność zasady w betonie ma hamujący wpływ na
korozję zbrojenia. Stal w środowisku alkalicznym ulega
pasywacji. Stal w tych warunkach jest pokryta warstwą
pasywną, złożoną z Fe
2
O
3
i Fe
3
O
4
. Gdy jednak wokół
zbrojenia nastąpi obniżenie pH roztworu wskutek
karbonizacji:
Ca(OH)
2
+ CO
2
CaCO
3
+ H
2
O
Zmniejszenie pH do wartości poniżej 10 powoduje
zapoczątkowanie procesów korozji stali. Powstający
produkt korozji wodorotlenek żelazawy Fe(OH)
2
ma
większą objętość i rozsadza beton. W obecności chlorków
powstaje chlorek żelazawy, który lokalnie może być
źródłem kwasu solnego FeCl
2
+ 2H
2
O —> Fe(OH)
2
+
2HCl - powodującego korozję wżerową stali. Grubość
otuliny zbrojenia winna wynosić, w zależności od
agresywności środowiska, od 2-3 cm (a nawet 5-6 cm).
Stal przed ułożeniem powinna być bez rdzy, gdyż rdza
może izolować zaczyn cementowy od stali i hamować
działanie Ca(OH)
2
inhibitujące korozję stali zbrojeniowej.
17

TECHNIKA ZABEZPIECZEŃ ELEMENTÓW KONSTRUKCJI Z
MATERIAŁÓW MINERALNYCH
Zabezpieczenie betonowych konstrukcji
budowlanych polega głównie na uzyskaniu
odpowiednich cech strukturalnych, tzn. gęstości,
szczelności i chemoodporności. Jeżeli zachodzą
trudności zabezpieczenia betonu przez nadanie
mu struktury zapewniającej potrzebną
chemoodporność, stosuje się zabezpieczenie
izolacyjne w postaci powłok z materiałów
chemoodpornych.
Stąd zabezpieczanie betonu można podzielić na
dwie grupy:
a) zabezpieczanie strukturalne,
b) zabezpieczanie izolacyjne.
18

Technika zabezpieczeń strukturalnych
Zabezpieczenie strukturalne betonu może być
mechaniczne i chemiczne.
Uszczelnianie mechaniczne betonów
Wibrowanie
Zagęszczanie betonu przez wibrowanie. Nadają się do
tego mieszanki betonowe wilgotne i gęstoplastyczne.
Torkretowanie
Sucha mieszanka zaprawy cementowej tłoczona przez
sprężone powietrze miesza się z rozpyloną wodą
podawaną w dyszy na kilka centymetrów przed otworem
wyjściowym. Otrzymaną masę betonu wytryskuje się z
dużą siłą i przywiera ona do dowolnie nachylonej
powierzchni torkretowanej. Torkretowanie pozwala na
uzyskanie betonu szczelnego. Jest to jedyna metoda,
która pozwala łączyć nowy beton ze starym.
19

Uszczelnianie chemiczne betonów
Krzemianowanie
Krzemianowanie stosowane do uszczelnienia może być
wykonane przez nasycenie wierzchniej warstwy betonów i
kamieni roztworem chlorku wapnia lub chloranu (V) wapnia, a
następnie po wyschnięciu, naniesienie warstwy roztworu szkła
wodnego.
Na
2
Si0
3
+ CaCl
2
CaSiO
3
+ 2NaCl
Na
2
SiO
3
+ Ca(ClO
3
)
2
4CaSiO
3
+ 2NaClO
3
Powstający przy tym nierozpuszczalny CaSiO
3
- krzemian
wapnia wypełnia pory, a chlorek sodu NaCl i chloran sodu
NaClO
3
zmywa się wodą. Na powierzchni wydziela się
koloidalny kwas krzemowy i wzrasta nieco odporność na
działanie kwasów.
20

Uszczelnianie chemiczne betonów
Fluatowanie
Fluatowanie jest kosztowniejsze, lecz trwalsze od
krzemianowania. Stosuje się je do utrwalania i uszczelniania
powierzchni kamieni naturalnych i betonów. Aby uzyskać odporną
na wpływy atmosferyczne substancję do wypełniania porów,
betony i kamienie nie zawierające węglanu wapnia CaCO
3
,
wymagają uprzednio nasycenia chlorkiem wapnia CaCl
2
, a potem
fluatami. Fluaty są to roztwory wodne najczęściej
heksafluorokrzemianu cynku (ZnSiF
6
), heksafluorokrzemianu
magnezu (MgSiF
6
) lub innych fluorokrzemianów. Działają one
korodująco na metale i szkło, są toksyczne i mają odczyn kwaśny.
Fluaty działają uszczelniająco na powierzchnię betonów i tynków,
zmniejszając ich nasiąkliwość i ścieralność oraz zwiększają
mrozoodporność i chemoodporność. Fluaty używane są również
do neutralizacji podłoży cementowych pod malowanie farbami,
które ulegają zmydleniu pod wpływem alkaliów (np. farby
chlorokauczukowe, olejne. Przebiegające przy fluatowaniu
reakcje przedstawiają poniższe równania:
ZnSiF
6
+ 2Ca(OH)
2
= 2CaF
2
+ ZnF
2
+ SiO
2
+ 2H
2
O
ZnSiF
6
+ 2CaCO
3
= 2CaF
2
+ ZnF
2
+ SiO
2
+ 2CO
2
ZnSiF
6
+ 2CaCl
2
+ 2H
2
O = 2CaF
2
+ ZnF
2
+ SiO
2
+ 4HCl
Powstające nierozpuszczalne związki fluoru i krzemu uszczelniają
powierzchnię betonu, tynku, kamienia, zabezpieczając przed
działaniem wody.
21

Uszczelnianie chemiczne betonów
Tartaryzacja
Tartaryzacja polega na powierzchniowym powlekaniu
betonu kwasem winowym, H
2
C
4
H
4
O
6
, który tworzy z
wodorotlenkiem wapnia Ca(OH)
2
trudno rozpuszczalny
winianan wapnia:
HOOC-CHOH-CHOH-COOH + Ca(OH)
2
Ca(OOC-CHOH-
CHOH-COO) +2H
2
O
Kwas winowy jest odczynnikiem drogim i stosujemy go w
wyjątkowych obiek tach, np. zabezpieczenie zbiorników
betonowych na wino przed działaniem rozcieńczonych
kwasów organicznych. Stosowane są również inne
związki, jak np. kwas szczawiowy H
2
C
2
O
4
, kwas borowy
H
3
BO
3
, kwas fosforowy H
3
PO
4
, które reagując z
wodorotlenkiem wapnia Ca(OH)
2
lub węglanem wapnia
CaCO
3
wytrącają trudno rozpuszczalne sole.
C
2
O
4
2-
+ Ca
2+
CaC
2
O
4
2PO
4
3-
+ 3Ca
2+
Ca
3
(PO
4
)
2
22

Zabezpieczenie izolacyjne
Estry kwasów tłuszczowych (woski) lub sole sodu, potasu,
cynku, wapnia tych kwasów, zwane mydłami, rozpuszczone w
benzynie lub w innym rozpuszczalniku organicznym mają
właściwości hydrofobowe (są niezwilżane wodą). Pospolitym
środkiem do hydrofobowania jest roztwór mydła potasowego w
spirytusie. Stosunkowo tanio można hydrofobować
powierzchnie kamienne i betonowe roztworami opartymi na
węglowodorach i mydle. Emulsję parafinową o stężeniu 2-5%-
owym przygotowuje się następująco: roztwór mydła wlewa się
strumieniem do 20%-owego roztworu benzynowego parafiny
przy ciągłym mieszaniu przez jedną godzinę. Emulsją
dwukrotnie powleka się powierzchnie chronione.
Obecnie najczęściej do hydrofobowania stosuje się roztwory
metylosilikonów. Na dłuższy okres można hydrofobować tynki
przez dodanie do zaprawy stearynianu wapnia, np. w ilości 3-
5% w stosunku do masy użytego cementu. Zabezpieczone w
ten sposób tynki mają większą odporność na działanie
agresywnej atmosfery przemysłowej. Stosowane są również
dodatki tworzyw sztucznych, tzw. polimero-betony. Stosuje się
też malowanie powierzchni betonowych farbami emulsyjnymi
lub chlorokauczukowymi.
23

24

Problem korozji dotyczy w szczególności konstrukcji
wykonanych z żelaza, gdzie proces korozji nazywany jest
rdzewieniem. O skali problemu zniszczeń wywołanych
przez korozję świadczy fakt, że około 25% produkcji stali
jest zużywane na zastąpienie strat spowodowanych
korozją.
Produktem rdzewienia jest rdza, która okazuje się jest
uwodnionym tlenkiem żelaza(III) o przybliżonym wzorze
2Fe
2
O
3
*3H
2
O. Zauważono, że żelazo nie rdzewieje w
suchym powietrzu i wodzie pozbawionej całkowicie tlenu a
natomiast proces ten pojawia się, kiedy w wodzie pojawi
sie tlen a ulega przyspieszeniu w obecności kwasów,
naprężeń w metalu, przy styczności z metalem mniej
aktywnym oraz w obecności samej rdzy. Badania nad
korozją wykazały, że najczęściej przebiega ona według
mechanizmu elektrochemicznego i chemicznego. Stąd
zależności od czynników wywołujących korozję, warunków
i przebiegu procesu korozyjnego, występują różne rodzaje
korozji, a mianowicie;
korozja elektrochemiczna
korozja chemiczna
25
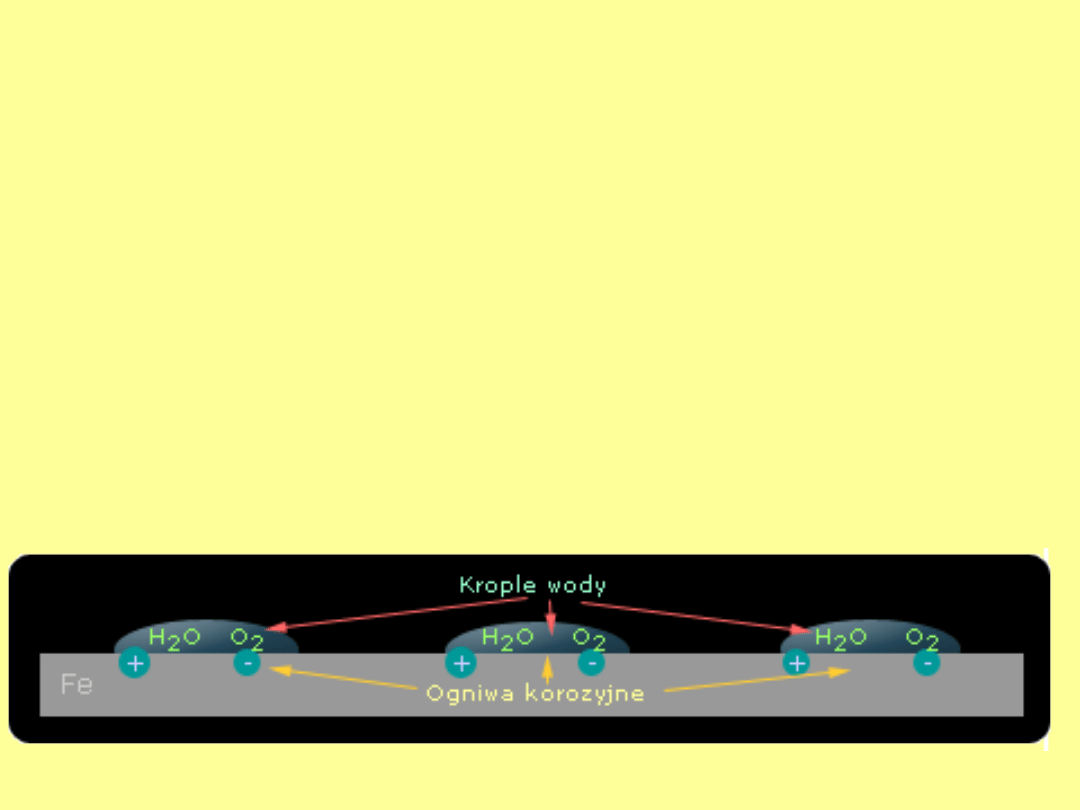
Korozja elektrochemiczna jest najbardziej
rozpowszechnionym rodzajem korozji z jakim
spotykamy się codziennie. Powstaje ona w
środowisku wilgotnym i ma mechanizm
elektrochemiczny, który polega na tworzeniu się
lokalnych ogniw korozyjnych na powierzchni
metalu. W każdym przypadku istotnym składnikiem
tych ogniw jest roztwór elektrolitu, który powstaje
w wyniku rozpuszczenia w wodzie takich substancji
jak tlen, dwutlenek węgla, dwutlenek siarki, tlenki
azotu i inne. W przypadku deszczu lub konstrukcji
ukrytych pod wodą na powierzchni metalu pojawia
się nieskończona ilość takich ogniw korozyjnych a
cała powierzchnia przykryta jest warstwą wody.
26

Rodzaje ogniw korozyjnych.
a) naprężeniowe, b) wtrąceniowe, c) z różnicy stężeń
Elektrody w ogniwie korozyjnym powstają
wskutek:
•różnicy naprężeń w samym metalu, powstałe w
czasie chłodzenia stopionego metalu,
•obecności w samym metalu wtrąceń innego
metalu, grafitu w przypadku stali węglowych lub
też elementów konstrukcyjnych wykonanych z
metalu bardziej szlachetnego,
•różnicy stężeń w roztworach soli lub tlenu,
mającymi kontakt z powierzchnią metalu.
27

Przyczyn korozji elektrochemicznej należy doszukiwać
się w wartościach potencjałów z szeregu
napięciowego metali a znajomość mechanizmu
pozwala nam zapobiegać korozji. Głównym winowajcą
powstawania korozji elektrochemicznej jest woda.
Każdy metal położony w szeregu napięciowym niżej
niż -0,83 V może zostać utleniony przez wodę w
standardowych warunkach w wyniku reakcji
połówkowej.
2H
2
O
(c)
+ 2e
-
<=> H
2(g)
+ 2OH
-
(aq)
E
o
= - 0,83 V
Taką wartość potencjału standartowego E
o
= - 0,83 V
możemy odczytać z tabeli szeregu napięciowego
metali. Z tej samej tabeli odczytamy, że dla pH = 7,
potencjał standardowy dla napisanej reakcji
połówkowej ma wartość E
o
= - 0,42 V. Ponieważ
potencjał standardowy żelaza jest prawie taki sam (E
o
= - 0,44 V dla reakcji Fe
(s)
<=> Fe
(aq)
2+
+ 2e
-
), żelazo
prawie nie jest utleniane przez czystą wodę. Z tego
powodu rury wykonane z żelaza mają zastosowanie
do transportu wody.
28

Warunki zmieniają się, gdy w wodzie pojawi się tlen O
2
lub
kationy wodoru H
+
. Wtedy należy wziąć pod uwagę
reakcje redukcji tlenu rozpuszczonego w wodzie lub
reakcje redukcji kationów wodoru H
+
. Odpowiednie
reakcje mają postać.
Reakcja redukcji tlenu rozpuszczonego w wodzie.
4H
(aq)
+
+ O
2(g)
+ 4e
-
--> 2 H
2
O
(c)
E
o
= + 1,23 V
lub przy pH = 7 2H
2
O
(c)
+ O
2(g)
+ 4e
-
--> OH
-
E
o
= + 0,82 V
W środowisku obojętnym, powstające aniony OH
(aq)
-
łączą
się z kationami Fe
(aq)
2+
i powstaje Fe(OH)
2
, który wytrąca
się w postaci osadu. Dalsze utlenienie Fe(OH)
2
prowadzi
do powstania hydratów Fe
2
O
3
*nH
2
O, które tworzą osad o
charakterystycznym rdzawym zabarwieniu.
Reakcja redukcji kationów wodoru.
2H
(aq)
+
+ 2e
-
--> H
2(g)
E
o
= 0,00 V
I w pierwszym i drugim przypadku wartość potencjału
przekracza potencjał żelaza, więc obecność tlenu lub
kationów wodoru w wodzie mogą utlenić żelazo do Fe
2+
.
29
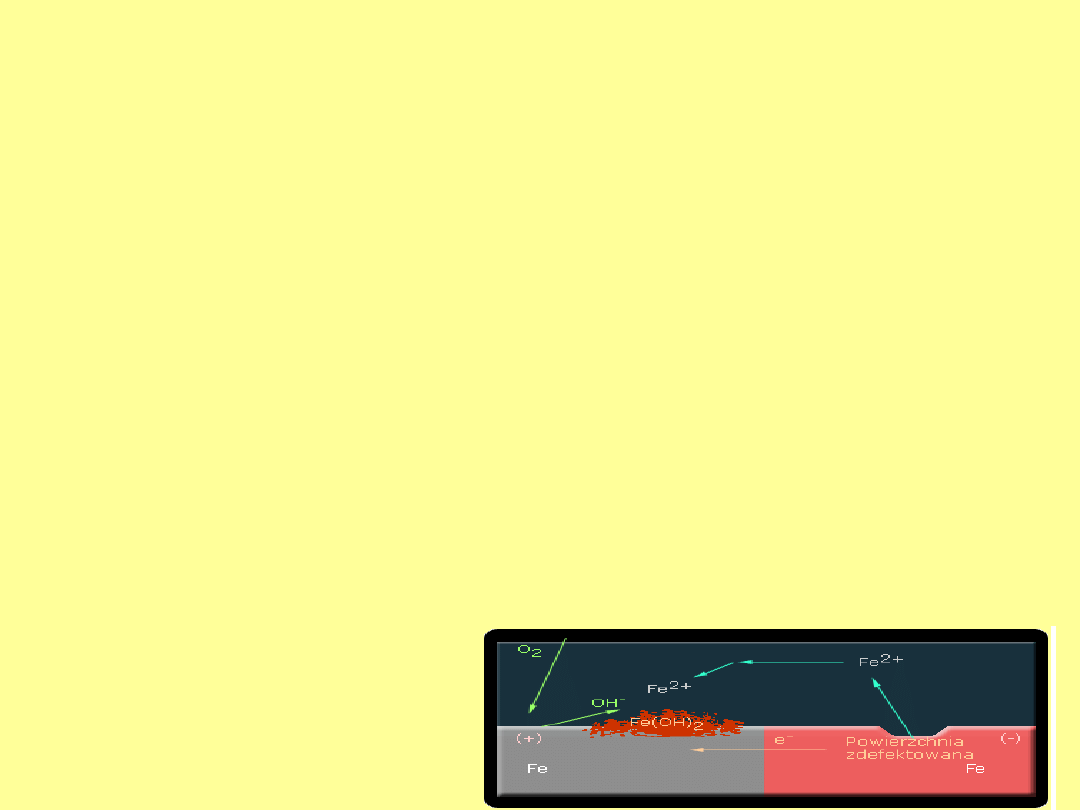
Korozja naprężeniowa
Ten typ korozji występuje na powierzchniach poddanych obróbce
skrawaniem, na powierzchniach blach po "stłuczce" oraz w
elementach podlegających ciągłym naprężeniom.
W wyniku naprężeń, powierzchnia metalu nie jest energetycznie
jednorodna. Powstają miejsca bogatsze energetycznie z których jony
metalu znajdujące się na powierzchni przechodzą do roztworu łatwiej
niż z powierzchni niezdefektowanej. Powierzchnia zdefektowana staje
się biegunem ujemnym a powierzchnia niezdefektowana biegunem
dodatnim ogniwa. W takim ogniwie na anodzie zachodzi proces
utleniania, w naszym przypadku żelaza zgodnie z reakcją połówkową.
Fe
(s)
--> Fe
(aq)
2+
+ 2e
-
Przebieg reakcji połówkowej wskazuje, że w tym obszarze następuje
rozpuszczanie anodowe i powstają wżery. W obszarze katodowym, z
uwagi na małe stężenie jonów Fe
(aq)
2+
, proces redukcji tych jonów nie
zachodzi, lecz ma miejsce inny proces, który w zależności od
środowiska będzie dotyczył redukcji jonów H
(aq)
+
lub redukcji tlenu
rozpuszczonego w roztworze. Przebieg tych reakcji został
przedstawiony wyżej.
30
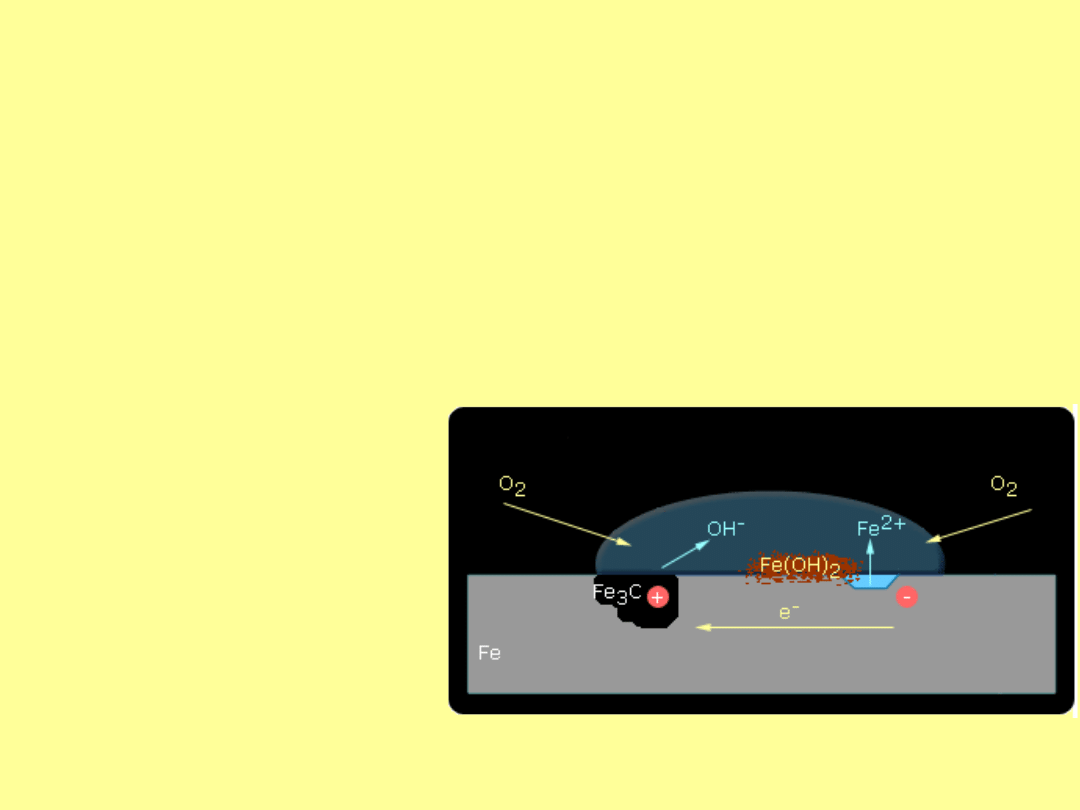
Korozja jako wynik obecności wtrąceń innych substancji
Ten rodzaj korozji powstaje, jeżeli w obszarze katodowym znajdą
się wtrącenia innej substancji. Tymi wtrąceniami mogą być inne
metale, związki chemiczne lub niemetale. Przykładem może być
stal węglowa w której znajdują sie wtrącenia grafitu i cementytu
Fe
3
C.
Katoda cementytu spełnia funkcję półogniwa redoks; sama nie
zużywa się. Jej zadanie polega na "transportowaniu" elektronów z
żelaza na granicę faz cementyt-woda, gdzie następuje redukcja
tlenu rozpuszczonego w elektrolicie.
W środowisku obojętnym na katodzie zachodzi reakcja
2H
2
O
(c)
+ O
2(g)
+ 4e
-
--> OH
-
natomiast na anodzie
Fe
(s)
--> Fe
(aq)
2+
+ 2e
-
Obszar anody ulega
rozpuszczaniu a jony
Fe
(aq)
2+
łączą sie z jonami
OH
(aq)
-
i powstaje
nierozpuszczalny Fe(OH)
2
,
który wpływem
rozpuszczonego w wodzie
tlenu przekształca się w
hydraty Fe
2
O
3
*nH
2
O (rdzę).
31
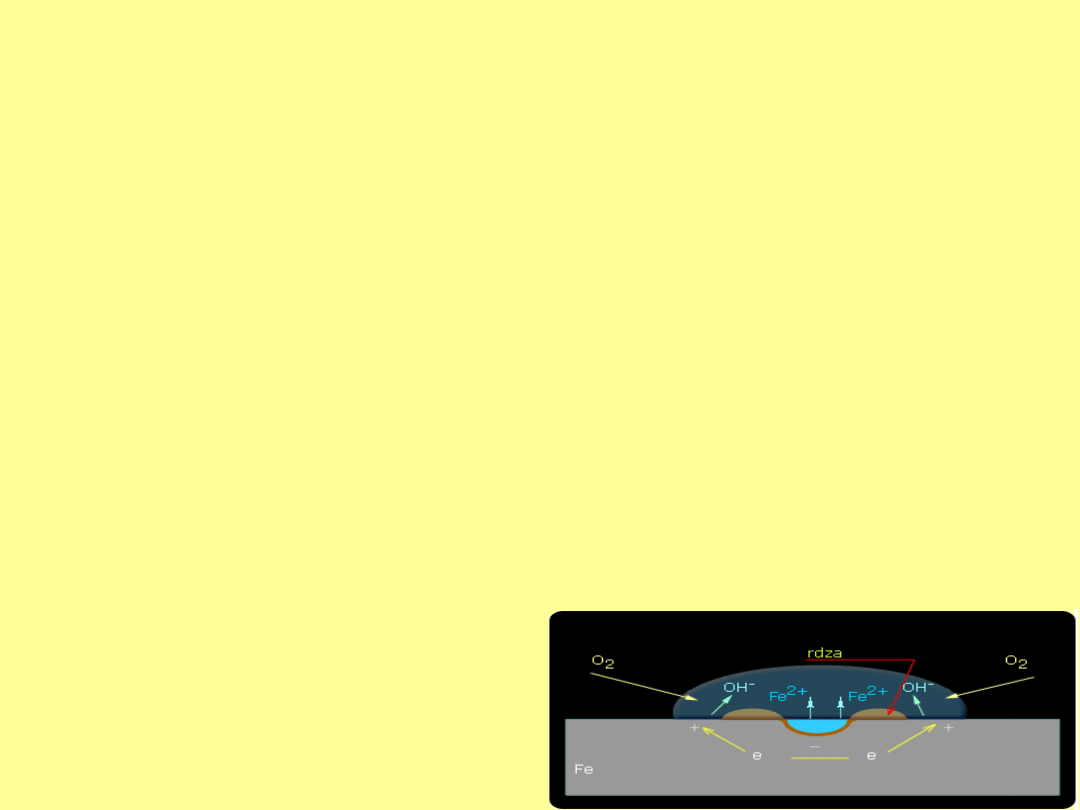
Korozja wynikająca z różnicy stężeń
Mikroogniwa korozyjne mogą również powstawać jako
ogniwa stężeniowe przez różne napowietrzenie elektrolitu.
Rozpuszczony w elektrolicie tlen w miejscach o dużym
stężeniu tworzy elektrodę tlenową, której potencjał jest
dodatni, inne zaś obszary powierzchni mają niższy
potencjał i są obszarem anodowym.
Części powierzchni metalu w miejscach o mniejszym
stężeniu tlenu są obszarem anodowym, gdzie następuje
rozpuszczanie metalu, a w miejscach o lepszym dostępie
tlenu - obszarem katodowym, gdzie biegnie redukcja
rozpuszczonego tlenu (depolaryzacja tlenowa)
W przypadku płytki z żelaza powstające w reakcji
katodowej jony OH
-
spotykają się z dyfundującymi od
obszarów anodowych jonami Fe
2+
dając nierozpuszczalny
Fe(OH)
2
, który wpływem rozpuszczonego w
wodzie tlenu przekształca się
w hydraty Fe
2
O
3
*nH
2
O, czyli
znaną rdzę.
32

Korozja chemiczna
Korozja chemiczna polega na bezpośrednim ataku czynnika
korozyjnego na metal lub stopy i charakteryzuje się tym, że przez
metal podczas reakcji z czynnikiem korozyjnym (utleniaczem) nie
przepływa prąd elektryczny. Wymiana elektronów między
metalem a utleniaczem przebiega w środowisku nie wykazującym
przewodnictwa jonowego. Reakcję korozji według mechanizmu
chemicznego można przedstawić za pomocą ogólnego równania.
mM + nU M
m
U
n
gdzie: M - metal, U - utleniacz
Najpospolitszym przykładem tego typu korozji jest korozja w
gazach w podwyższonej temperaturze, a w szczególności tzw.
zendrowanie żelaza. Żelazo czyli stal ogrzewane w powietrzu lub
ogólnie w atmosferze utleniającej, powleka się warstewką tlenków
żelaza głównie: Fe
3
O
4
, ale powstają także pewne ilości Fe
2
O
3
i FeO,
wskutek bezpośredniej reakcji między żelazem a tlenem czy też
innym czynnikiem utleniającym. Korozja chemiczna atakuje
zwykle równocześnie całą powierzchnię metalu narażoną na
zetknięcie z czynnikiem korozyjnym albo prowadzi do wytworzenia
szczelnie przylegającej ochronnej warstwy produktów korozji, albo
daje w wyniku warstwę porowatą, nie chroniącą metalu. W tym
drugim przypadku korozja trwa aż do zupełnego zniszczenia
metalu lub wyczerpania czynnika korozyjnego.
33

Pasywność
Pasywnością metalu nazywamy stan jego wysokiej
odporności chemicznej w ściśle określonych
warunkach. Elektrochemiczne przejście metalu w
stan pasywny związane jest ze wzrostem jego
potencjału elektrodowego. Stan pasywny tłumaczy
się istnieniem warstewki ochronnej na powierzchni
metalu odpornej na działanie środowiska w
określonych warunkach. Warstewka ochronna może
być wytworzona przez utlenienie powierzchni przez
tlen gazowy lub jako wynik procesu
elektrochemicznego, względnie według innych
teorii może być utworzona z zaabsorbowanego
tlenu. Przykładem jest glin, którego powierzchnia w
środowisku silnego utleniacza pokrywa się warstwą
tlenku. Tak przygotowana powierzchnia umożliwia
zastosowanie glinu, między innymi, do produkcji
puszek do napojów, samolotów, a także ram
okiennych.
34

Korozja równowmierna
Korozja rozprzestrzenia się równomiernie na całej powierzchni
przedmiotu metalowego. Ten rodzaj zniszczenia jest najmniej
niebezpiecznym wynikiem działań korozyjnych. Nie wpływa
bezpośrednio na zmianę własności wytrzymałościowych materiału,
lecz pośrednio przez zmniejszenie przekroju poprzecznego
przedmiotu.
Korozja miejscowa
Zniszczenie obejmuje tylko pewne miejsca powierzchni
przedmiotu metalowego zaznaczone w postaci plam, punktów i
wżerów. Ten rodzaj zniszczenia, zwłaszcza w postaci wżerów, które
mogą osiągnąć znaczną głębokość jest bardzo niebezpieczny dla
materiału. Wpływa silnie na zmniejszenie własności
wytrzymałościowych zarówno materiału, jak i konstrukcji.
Korozja międzykrystaliczna
Zniszczenie występuje na granicach ziaren postępując w głąb
materiału. Jest to najgroźniejszy rodzaj zniszczenia, powoduje silny
spadek własności wytrzymałościowych, w wielu przypadkach jest
trudny do zauważenia na powierzchni metalu. Do korozji
międzykrystalicznej skłonne są stopy glinu, austenityczne stale
żaroodporne wskutek wydzielania się nowej fazy z roztworów
stałych i powstawania związanych z tym naprężeń wewnętrznych
w materiale.
35
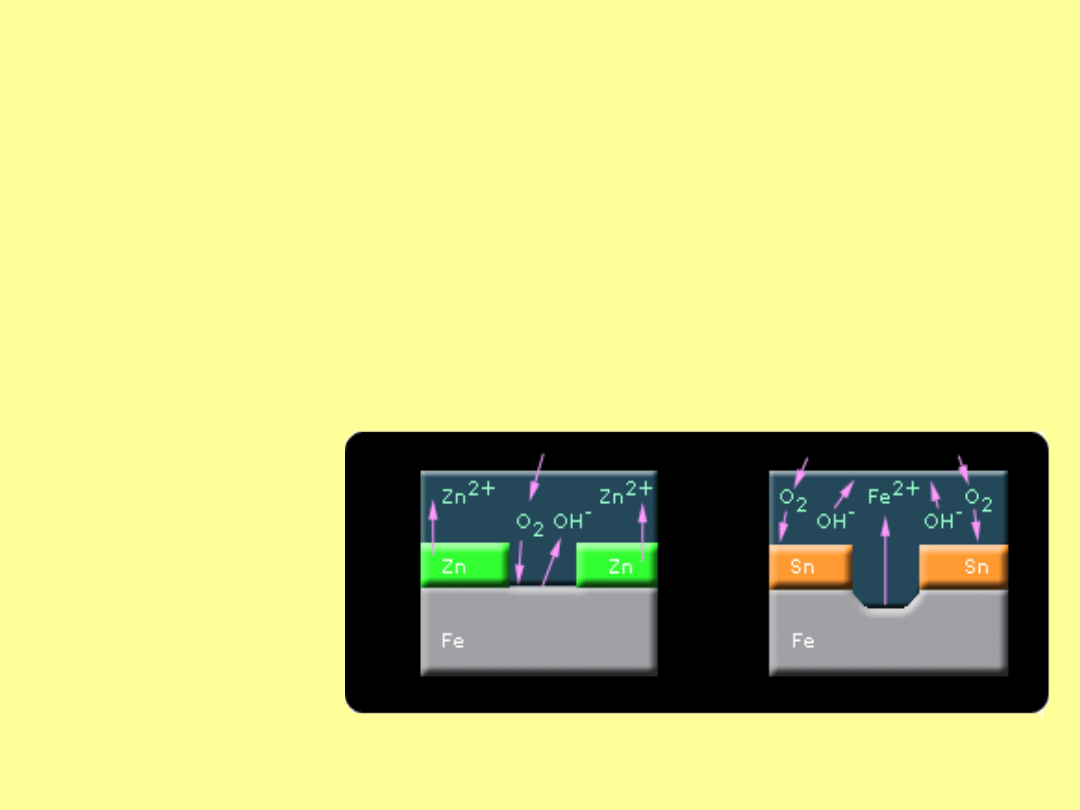
Korozja żelaza w miejscu ubytku ochronnej
powłoki
a) cynkowej b) cynowej
Ochrona przed korozją
Najprostszym sposobem zapobiegania korozji jest zabezpieczenie
powierzchni metalicznych przed powietrzem i wodą za pomocą
malowania. Lepsze efekty osiągamy na drodze galwanicznego
pokrywania metalu, np. żelaza cienką warstwą cynku. W
przypadku pokrycia blachy żelaznej cyną czyli metalem o
większym potencjale, -0,14 V, powłoka taka chroni żelazo tak
długo, dopóki nie powstanie na niej rysa. W miejscach powierzchni
odsłoniętych przez rysy i pokrytych wilgocią rozpoczyna działanie
ogniwo Fe|elektrolit|Sn. W wyniku działania tego ogniwa odkryta
powierzchnia będzie stanowiła obszar anodowy, w którym nastąpi
rozpuszczanie żelaza według równania.
Fe
(s)
--> Fe
(aq)
2+
+ 2e
-
Uwolnione elektrony
są zużywane w
procesie katodowym,
który podobnie jak
przy korozji
naprężeniowej może
dotyczyć redukcji
kationów H
(aq)
+
lub
redukcji tlenu
rozpuszczonego w
roztworze.
36

W przypadku blachy żelaznej ocynkowanej,
nawet jeśli powłoka ochronna zostanie
uszkodzona, to w utworzonym ogniwie
lokalnym Zn|elektrolit|Fe anodą będzie
bardziej elektroujemny cynk. W tym
przypadku nastąpi rozpuszczanie cynku i
ochrona żelaza.
Zn
(s)
--> Zn
(aq)
2+
+ 2e
-
Nie jest możliwe pokrywanie całych dużych
powierzchni stalowych cynkiem, np. statków,
rurociągów podziemnych, zbiorników na
paliwa, mostów. Ale efekt podobny do
pokrywania elementów stalowych cynkiem
osiągniemy stosując tzw. ochronę katodową.
37

Ochrona katodowa polega na tym, że do konstrukcji
chronionej dołącza się zewnętrzną anodę w postaci
metalu o potencjale elektrodowym niższym niż materiał
chronionej konstrukcji. Płyta taka nazywa się protektorem.
Połączenie protektora z konstrukcją chronioną wykonuje
się przez bezpośredni styk lub za pomocą przewodnika.
Dołączony do konstrukcji protektor dostarcza elektronów
potrzebnych do redukcji tlenu. Materiał chronionej
konstrukcji staje się katodą i nie koroduje. Dobrym
materiałem na protektor dla konstrukcji pracujących w
wodzie morskiej jest cynk. Ma on zastosowanie do
ochrony kadłubów statków, kotłów i rurociągów.
38

Z innych metod zapobiegających korozji
należy wymienić:
Stosowanie inhibitorów (opóźniaczy). Są to
substancje organiczne lub nieorganiczne, które
dodane do środowiska agresywnego,
zmniejszają wybitnie szybkość procesów
korozyjnych. Działanie inhibitorów tłumaczy
się tworzeniem trudno rozpuszczalnych
warstewek zaporowych w miejscach
katodowych lub anodowych metalu.
39
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
Kresowa księga sprawiedliwych T 12 Studia i materiały Warszawa 2007 ISBN 978 83 60464 61 8
Materialy Budowlane-3R, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
FOLIE MIESZANKA BETON, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
12 DEGRADACJA MATERIAŁÓW
12-helowceTECH, Materiały PG, Nieorgana
12 Rozwiązania materiałowo konstrukcyjne i technologiczne budynków mieszkalnych, użyteczności publi
METODA 3 RÓWNAŃ- wzorki, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
Korozja materiałów budowlanych
Materiałoznawstwo 03.12.2007, Materiałoznastwo
Ćwiczenie 12 Badanie materiałów twardych
12 Przegląd materiałówid 13577 ppt
11 12 Otrzymywanie materialow
zagadnienia EGZAMINACYJNE- toksykologia 17.12, BHP materiały, Toksykologia
,chemia L,korozja materiałów niemetalicznych
12 z 21, materiały do egzaminu
Beton CAŁY, NAUKA, budownictwo nowe 4.12.2011, Materiały budowlane
ALUMINIUM I STOPY ALUMINIUM - Lab 12, Studia, Materiałoznastwo, Metaloznastwo i Podstawy Obrobki Cie
rygory sesji zima 11 12, nauka o materialach-wykład
Nauka o Organizacji 16.12.2012 materiały od wykładowcy, UG 2013-2014 Zarządzanie, II rok, NOO P.Wale
więcej podobnych podstron