
Astma z alergicznym nieżytem
Astma z alergicznym nieżytem
nosa jako wspólna choroba
nosa jako wspólna choroba
dróg oddechowych
dróg oddechowych
Zakład Immunopatologii
Zakład Immunopatologii
Wydział Kształcenia Podyplomowego
Wydział Kształcenia Podyplomowego
Uniwersytet Medyczny w Łodzi
Uniwersytet Medyczny w Łodzi
Rafał Pawliczak
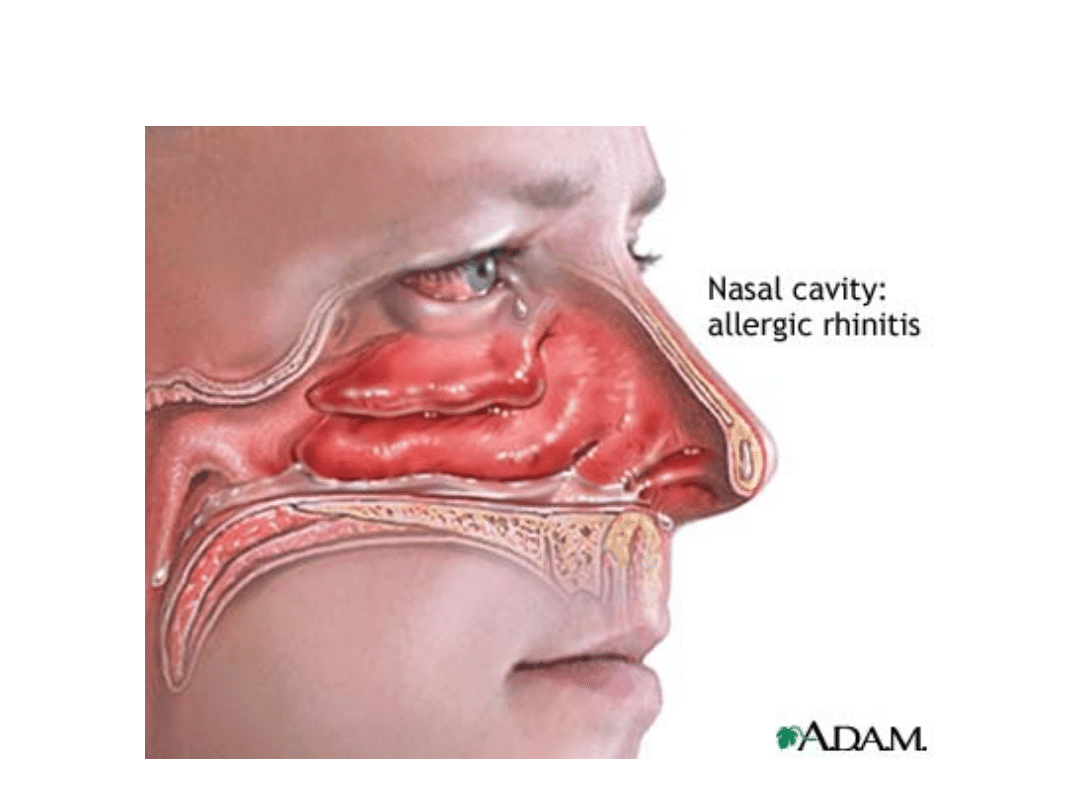
Alergiczny Nieżyt Nosa
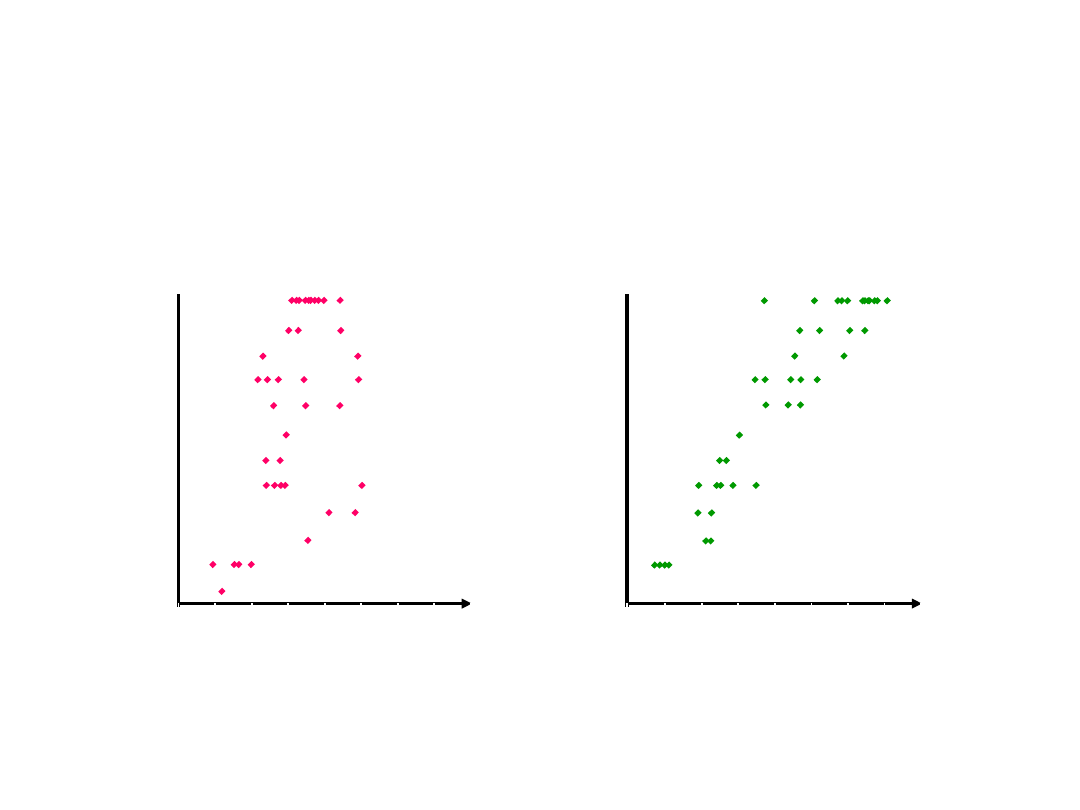
Alergiczny nieżyt nosa i
astma mają podobny
charakter występowania
Lancet 1998;351:1225–1232
UK
Australia
Kanada
Brazylia
USA
RPA
Niemcy
Francja
Argentyna
Algieria
Chiny
Rosja
0
5 10 15 20 25 30 35 40
występowanie w %
UK
Australia
Kanada
Brazylia
USA
RPA
Niemcy
Francja
Argentyn
a
Algieria
Chiny
Rosja
0
5 10 15 20 25 30 35 40
występowanie w %
Astma
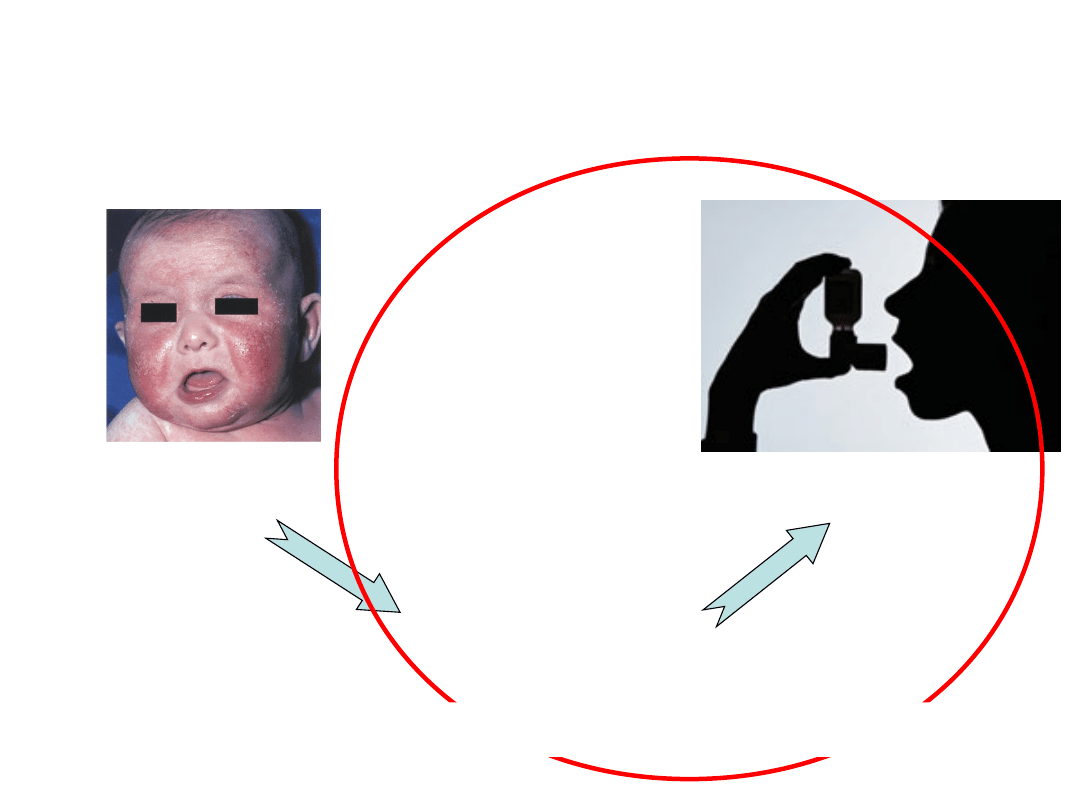
Marsz alergiczny
Marsz alergiczny
Atopowe zapalenie
Atopowe zapalenie
skóry
skóry
Alergiczny nieżyt nosa
Alergiczny nieżyt nosa
Astma oskrzelowa
Astma oskrzelowa
Wspólna choroba dróg oddechowych
Wspólna choroba dróg oddechowych
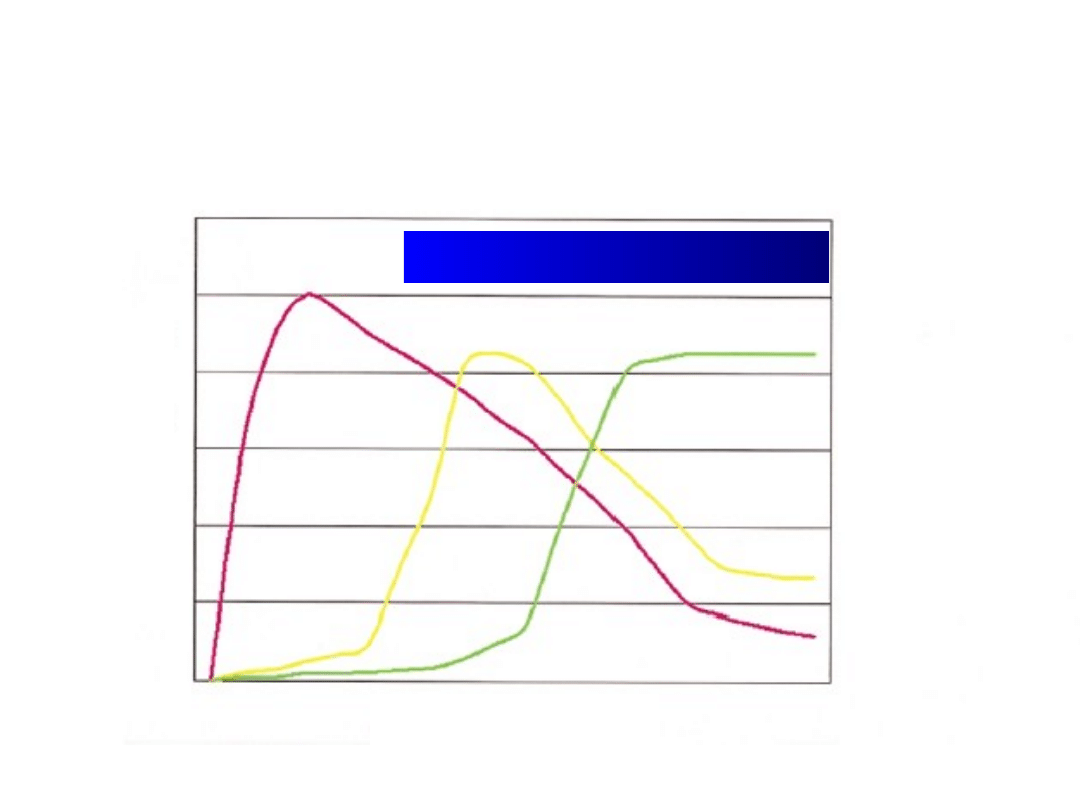
Marsz alergiczny
Marsz alergiczny
Wiek
Wiek
W
y
s
tę
p
o
w
a
n
ie
W
y
s
tę
p
o
w
a
n
ie
Atopowe
Atopowe
zapalenie skóry
zapalenie skóry
Alergiczny
Alergiczny
nieżyt nosa
nieżyt nosa
Astma
Astma
oskrzelowa
oskrzelowa
0
5
30
Wspólna choroba dróg oddechowych
Wspólna choroba dróg oddechowych

• Alergeny zewnętrzne
– Pyłki
– Pleśnie
• Alergeny wewnętrzne
– Roztocza kurzu domowego
– Alergeny zwierząt
– Owady (np. karaluchy)
– Pleśnie
– Lateks
• Alergeny zawodowe
– Zwierzęta laboratoryjne
– Leki
– Lateks
– Rotocza mączne i alergeny mąki
• NLPZ (np. aspiryna)
Alergiczny nieżyt nosa i astma
mają wspólne czynniki
wyzwalające
Na podstawie: National Institutes of Health Global Initiative for Asthma: Global Strategy for Asthma Management and Prevention:
A Pocket Guide for Physicians and Nurses. Publication No. 95-3659B. Bethesda, MD: National Institutes of Health, 1998; Workshop
Expert Panel Management of Allergic Rhinitis and its Impact on Asthma (ARIA) Pocket Guide. A Pocket Guide for Physicians and
Nurses, 2001.

Bousquet J i wsp. J Allergy Clin Immunol 2001;108:S148–S149
Astma i alergiczny nieżyt
nosa
są chorobami zapalnymi
•Astma jest chorobą o
podłożu zapalnym
– Zapalenie dolnych dróg oddechowych
wywołuje skurcz oskrzeli i nadreaktywność
dróg oddechowych, co powoduje objawy astmy
•Alergiczny nieżyt nosa jest
stanem
zapalnym
zależnym od IgE
– Zapalenie błony śluzowej nosa w odpowiedzi
na alergen wywołuje objawy ze strony nosa

Znani politycy chorujący na nieżyt
nosa
August
Klaudiusz
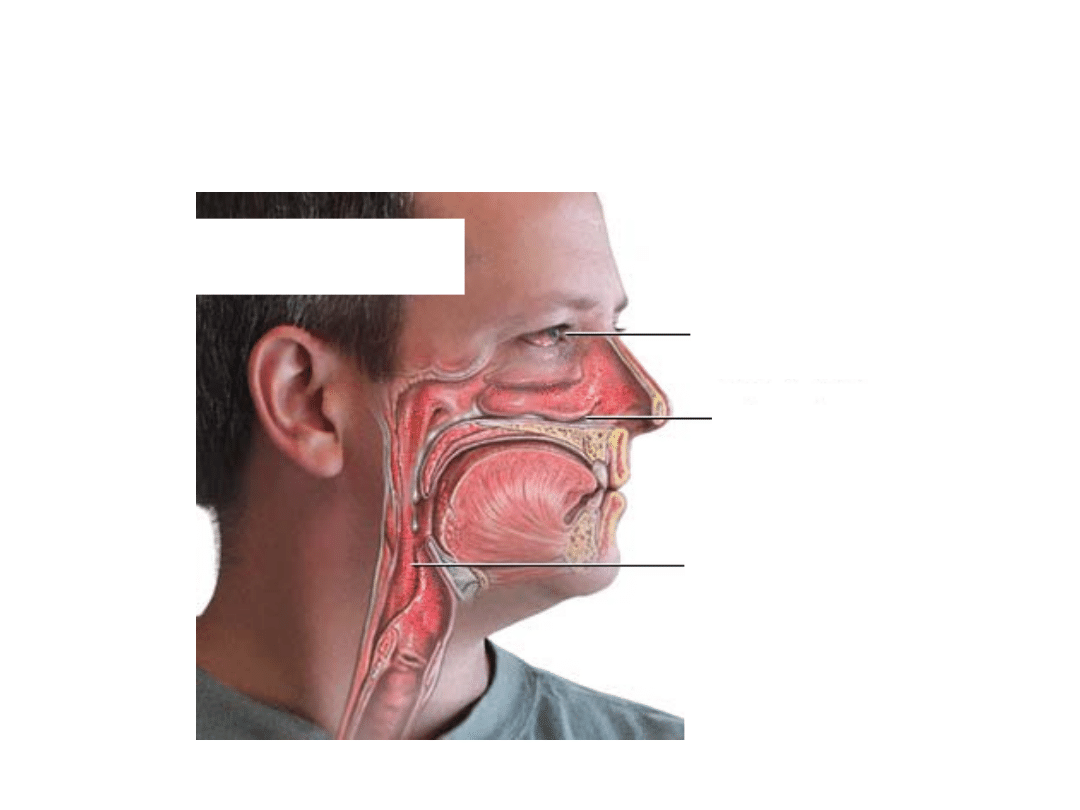
Objawy nieżytu nosa
Świąd uszu
Zaburzenia słuchu
Przekrwione oczy
Łzawienie
Zatkanie
Kichanie
Świąd nosa
Kaszel
Ból gardła
Świąd gardła
Spływanie wydzieliny
Chrząkanie
Zaburzenia
snu
Chrapanie
Zaburzenia
emocjonalne
Zaburzenia
intelektualne
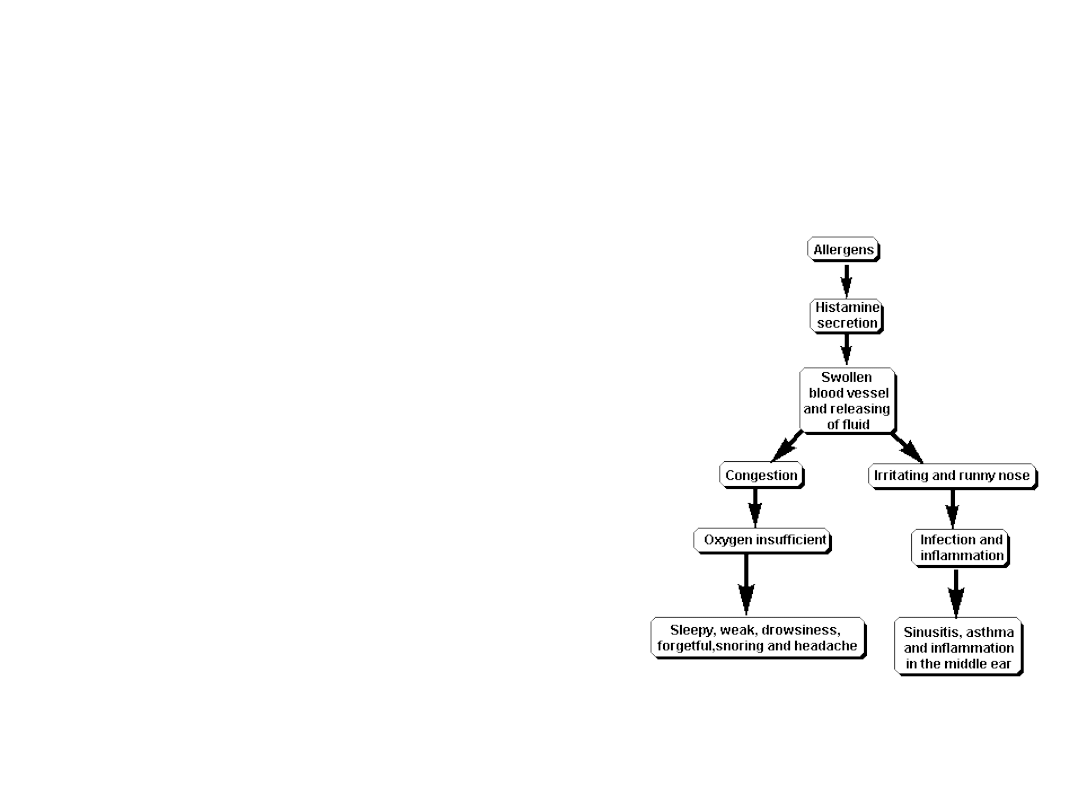
10 objawów nieżytu nosa
• Przewlekły kaszel
• Częste kichanie
• Świąd nosa
• Wodnisty wyciek
• Nieświeży oddech
• Nawracające zapalenia gardła
• Nawracające infekcje górnych
dróg oddechowych
• Mowa nosowa
• Zmęczenie
• Brak apetytu

Wielu pacjentów z astmą
cierpi na alergiczny nieżyt
nosa
Bousquet J i wsp. J Allergy Clin Immunol 2001;108(suppl 5):S147–S334; Sibbald B, Rink E Thorax 1991;46:895–901; Leynaert B
i wsp. J Allergy Clin Immunol 1999;104:301–304; Brydon MJ Asthma J 1996:29–32.
Do 80%
Pacjentów z astmą cierpi na alergiczny nieżyt
nosa
Wszyscy pacjenci z astmą
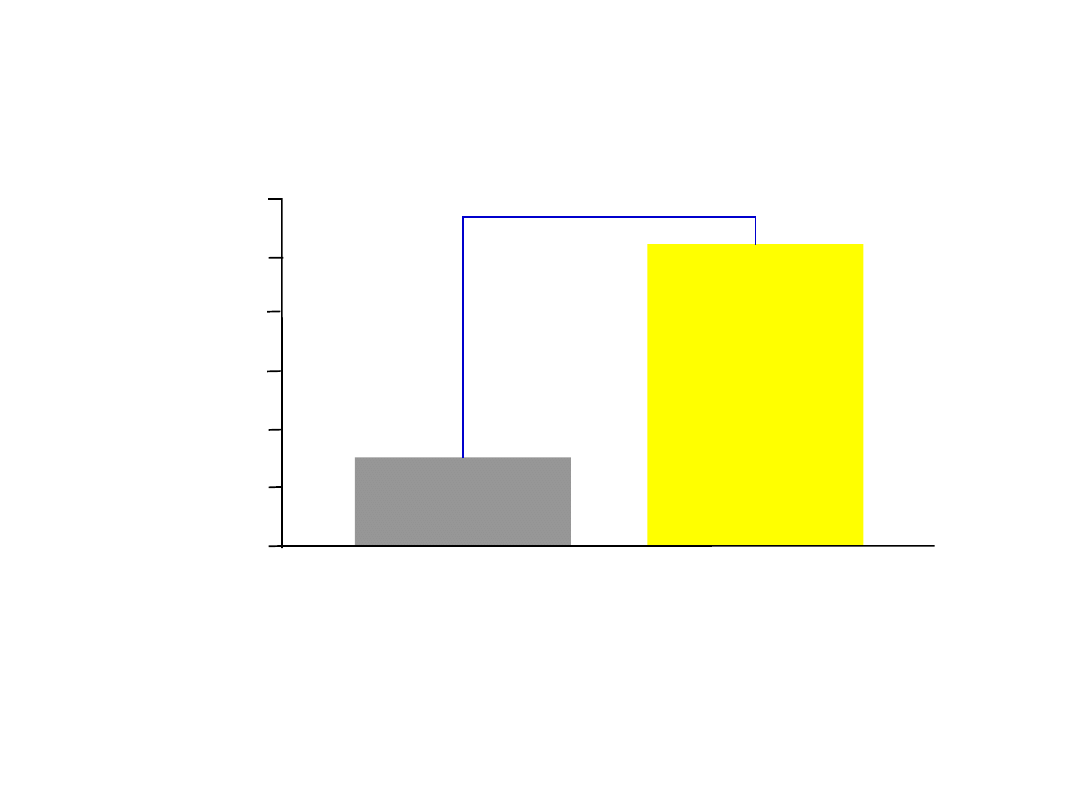
Alergiczny nieżyt nosa jest czynnikiem
ryzyka
dla rozwoju astmy
Alergiczny nieżyt nosa zwiększa ryzyko rozwoju astmy około trzykrotnie
738 osób (69% mężczyzn) w wieku średnio 40 lat obserwowanych przez 23 miesiące
Settipane RJ i wsp. Allergy Proc 1994;15:21–25
12
10
8
6
4
2
0
%
pacjentów u
których
rozwinęła się
astma
10,5
Alergiczny nieżyt
nosa w punkcie
wyjściowym
(n=162)
3,6
Bez alergicznego
nieżytu nosa w
punkcie wyjściowym
(n=528)
p<0,002
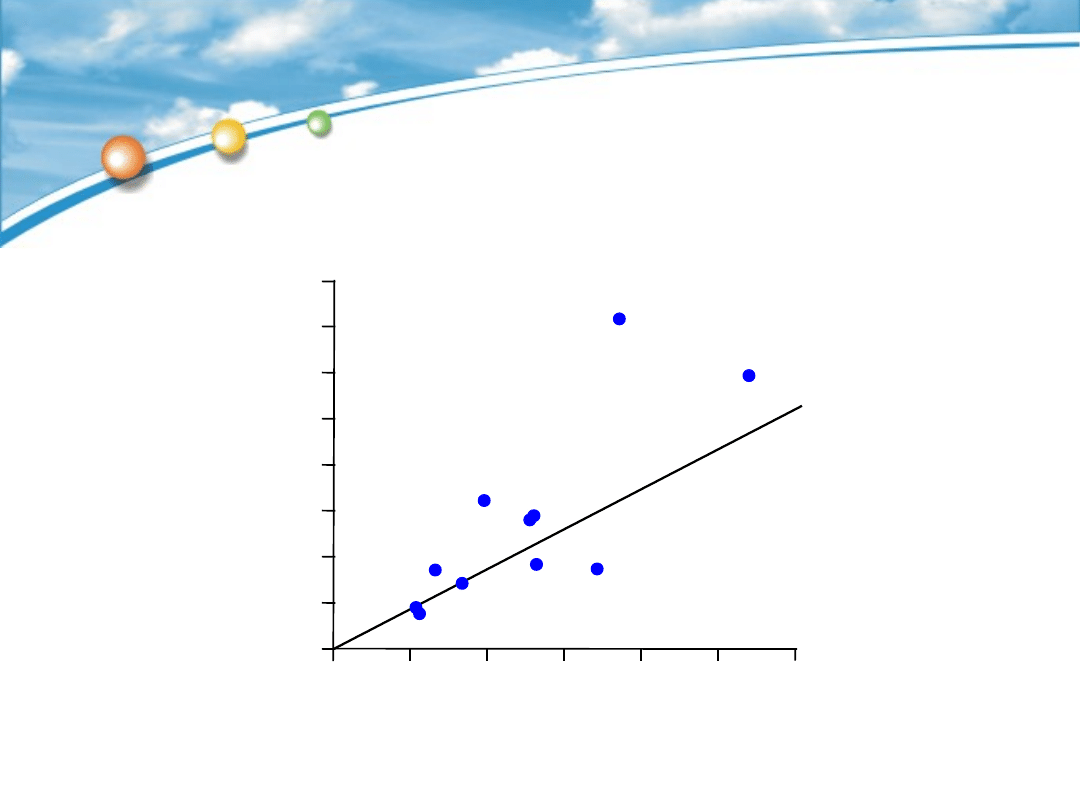
Eozynofile w
błonie śluzowej
nosa
u osób
z astmą
40
35
30
25
20
15
10
5
0
0
r=0,851, p<0.001
Eozynofile w błonie śluzowej
oskrzeli
u osób z astmą
5
10
15
20
25
30
(n=17)
Zmiany zapalne w błonie śluzowej nosa
i oskrzeli korelują ze sobą
Gaga M i wsp. Clin Exp Allergy 2000;20:663–669.
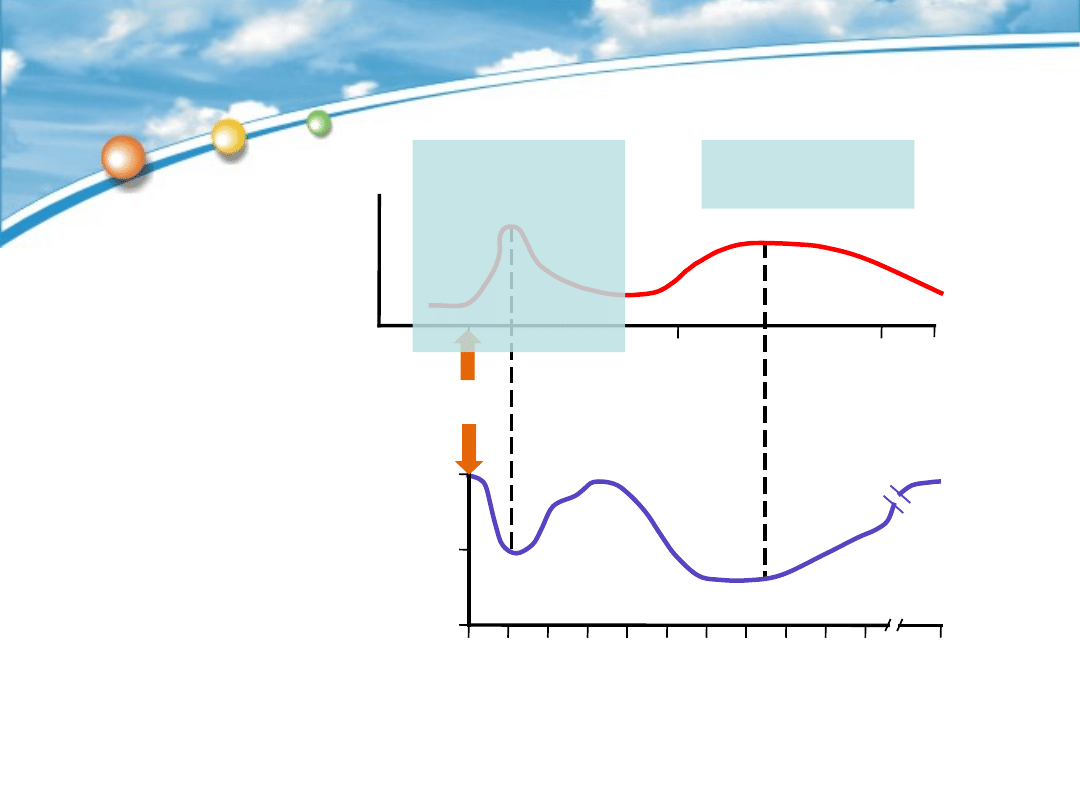
Varner AE, Lemanske RF Jr. In: Asthma and Rhinitis 2000:1172–1185
Togias A J Allergy Clin Immunol 2000;105:S599–S604
o
b
ja
w
ó
w
n
o
s
o
w
y
c
h
Czas po prowokacji
(godziny)
1
alerge
n
3–4
8–12
2
4
Wczesna faza
Późna
faza
FEV
1
(zmiana w
%)
Czas (godziny)
0
50
10
0
1
10
24
0
2
3
4
5
6
7
8
9
Górne drogi
oddechowe
Dolne drogi
oddechowe
Histamina
Leukotrieny
Prostaglandy
ny
Tromboksany
Heparyna
Proteazy
Cytokiny
Leukotrieny
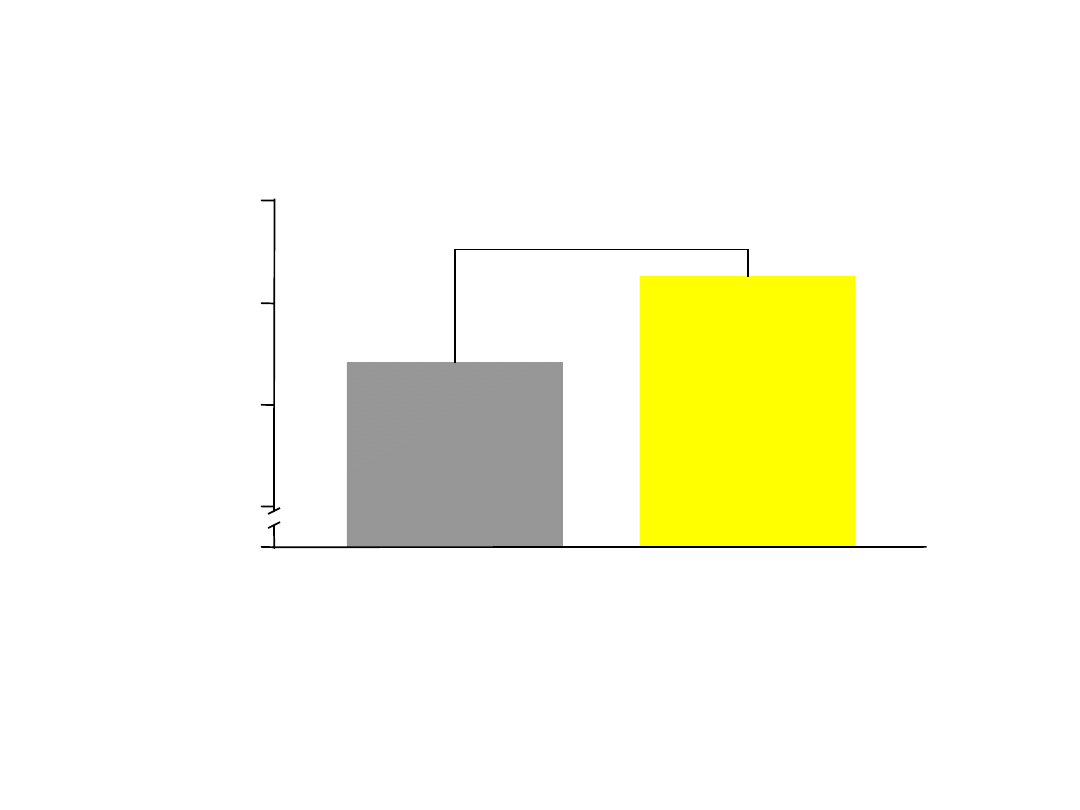
Alergiczny nieżyt nosa
pogarsza kontrolę astmy
Analiza post hoc wykorzystania środków medycznych/epizodów astmy u pacjentów chorych na astmę bez współwystępującego
alergicznego nieżytu nosa w okresie 52 tygodni.
Bousquet J i wsp. Clin Exp Allergy 2005;35:723-
727.
25
20
15
10
0
% pacjentów
21,3
Pacjenci z astmą i
alergicznym nieżytem
nosa (n=893)
17,
1
Pacjenci z astmą
(n=597)
p=0,04
6
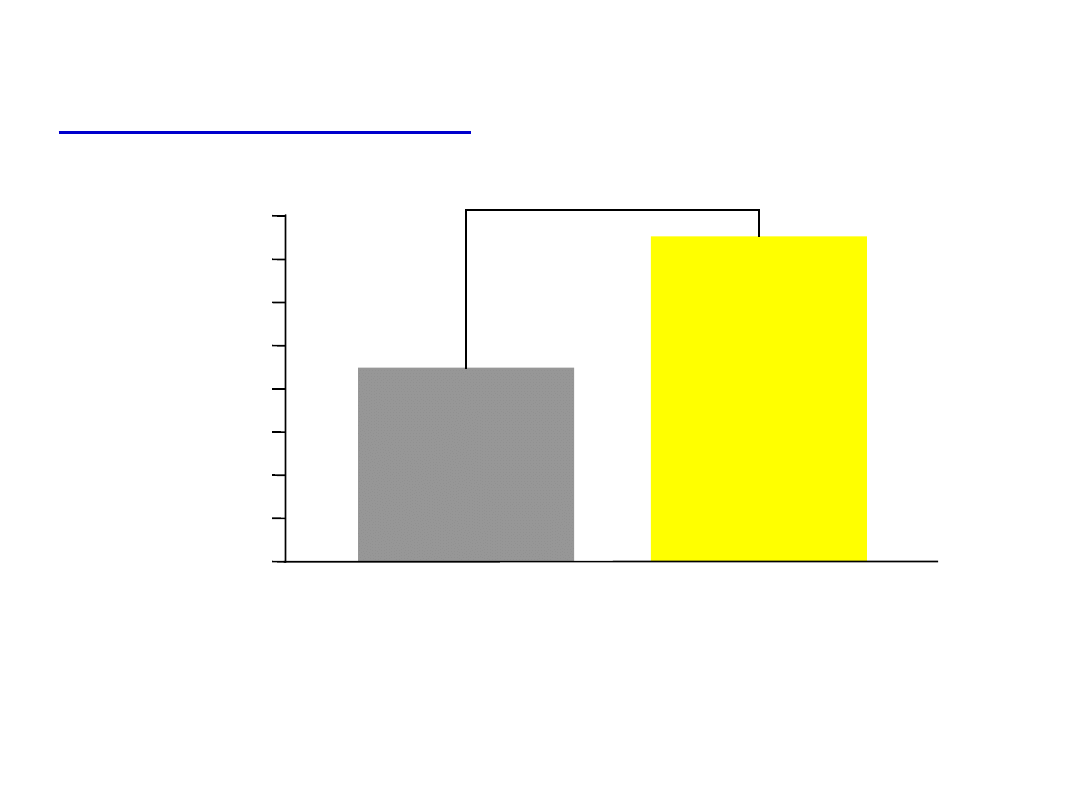
Alergiczny nieżyt nosa zwiększa
koszty leczenia chorych na astmę o
50%
Chorzy 16-55 lat z astmą i alergicznym nieżytem nosa w POZ
Price D i wsp. Clin Exp Allergy 2005;35:282-
287.
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
% pacjentów
hospitalizowa-
nych rocznie
0,76
Pacjenci z astmą i
alergicznym nieżytem
(n=4611)
0,4
5
Pacjenci z astmą
(n=22692)
p<0,006
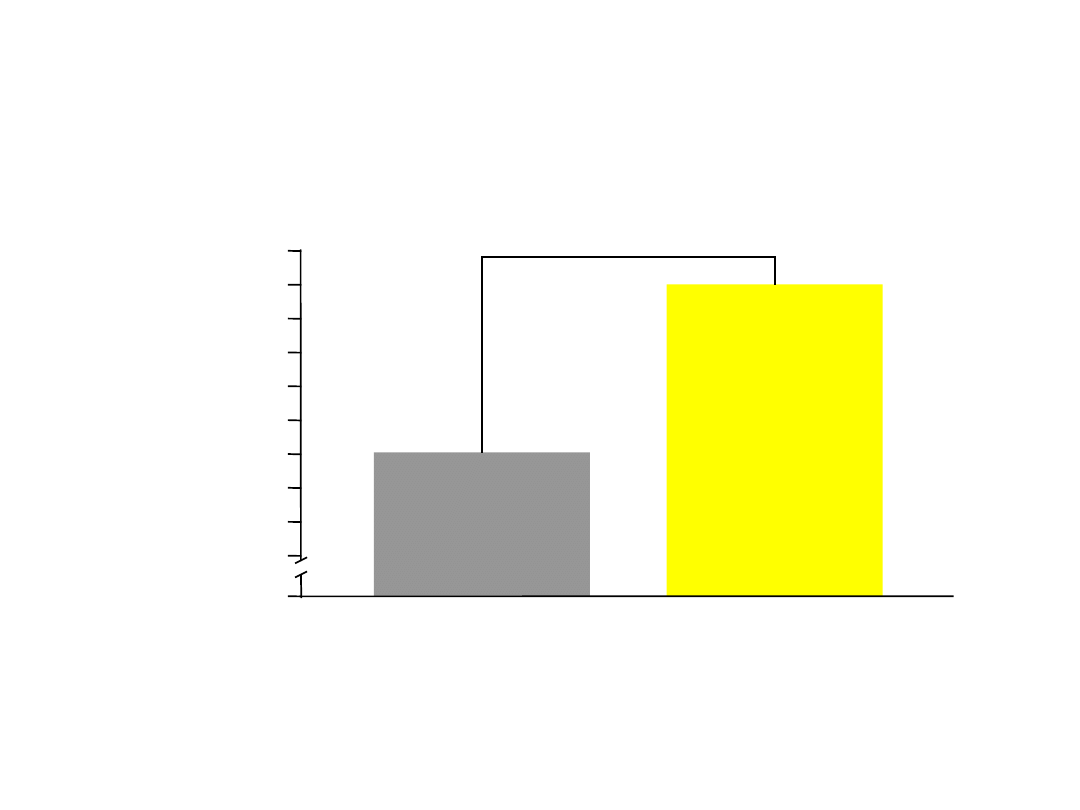
Alergiczny nieżyt nosa zwiększył liczbę
recept na krótkodziałające
betamimetyki (SABA)
Price D i wsp. Clin Exp Allergy 2005;35:282-
287.
Pacjenci z Astmą i ANN
(n=4611)
Pacjenci z Astmą
(n=22692)
3,3
3,2
3,1
3,0
2,9
2,8
2,7
2,6
2,5
2,4
0
Recepty dla
pacjenta
rocznie
3,2
2,7
p<0,000
1
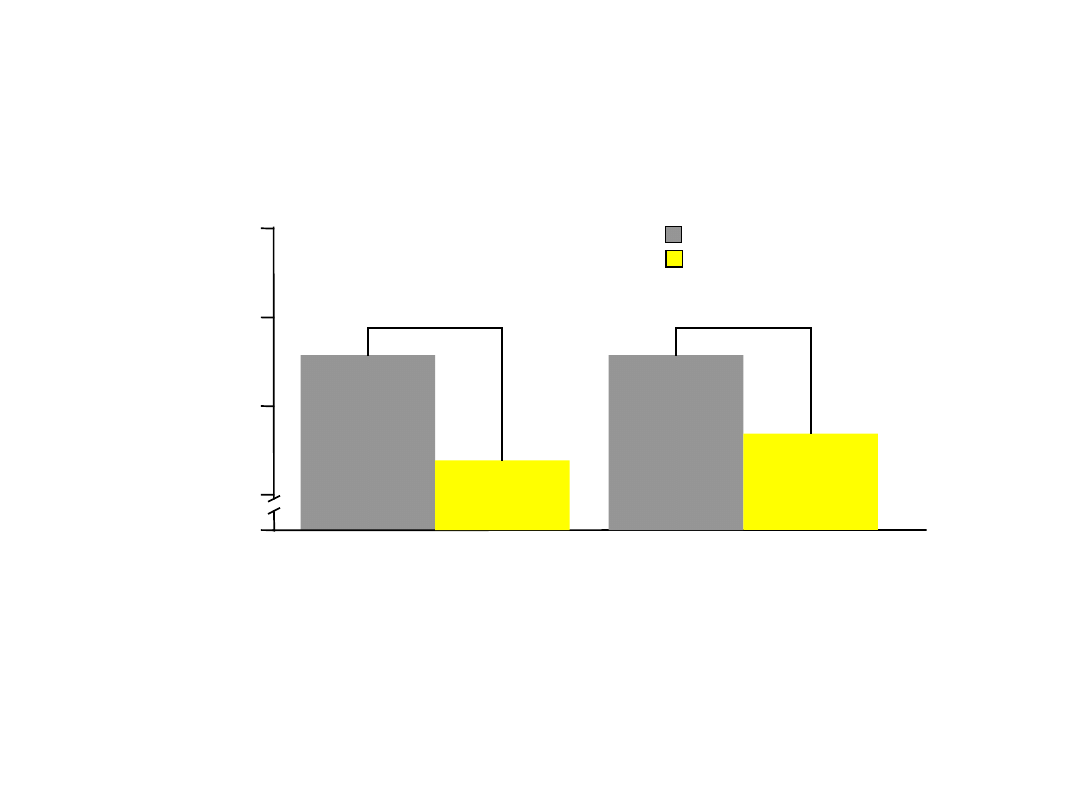
Montelukast poprawił kontrolę
astmy
Wieloośrodkowe badanie wpływu montelukastu w dawce 10 mg na alergiczny nieżyt nosa u pacjentów w wieku 15 do 85 lat z
astmą i ANN w sezonie alergicznym
Philip G i wsp. Curr Med Res Opin
2004;20(10):1549–1558.
•
Montelukast znacząco zmniejszył stosowanie beta
2
-mimetyków (p0,005 vs.
placebo)
2,8
2,6
2.4
2,2
0
Wynik
leczenia
(średni)
Lekarze
Pacjenci
2,5
2
2,28
2,52
2,34
Placebo (n=416)
Montelukast
(n=415)
Globalna ocena astmy*
p<0,0
1
p<0,0
5
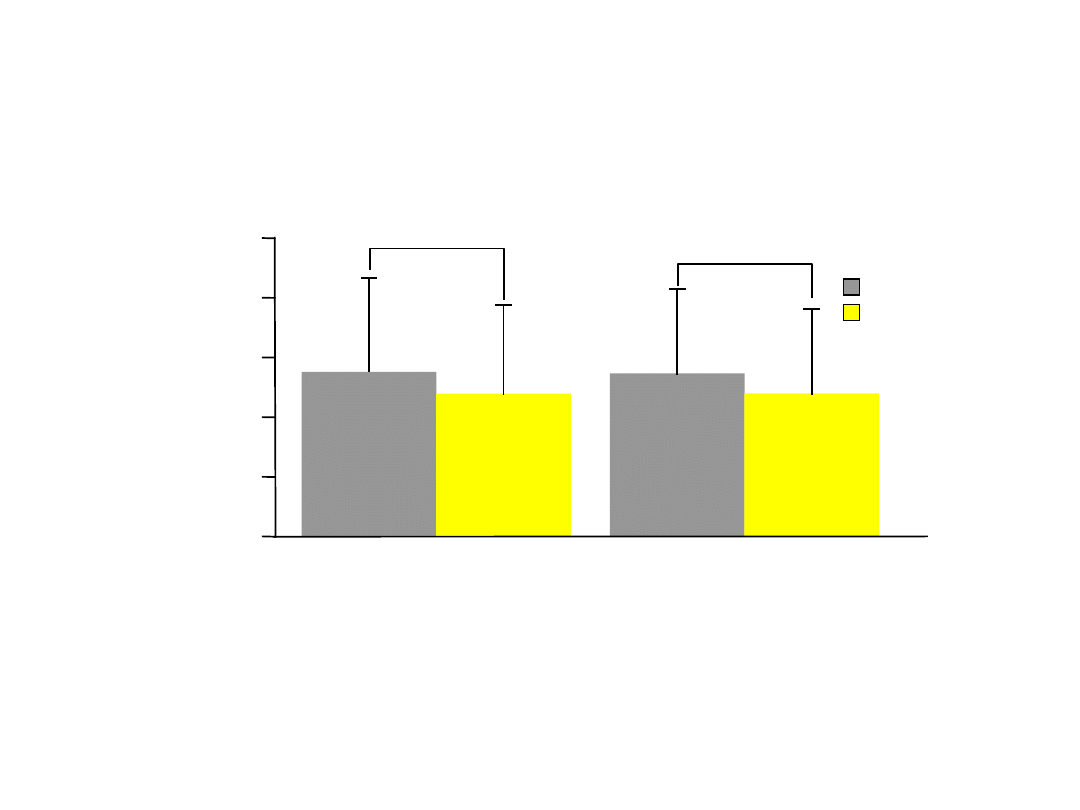
Montelukast poprawił globalną
ocenę stanu klinicznego i jakości
życia
•
Montelukast znacząco poprawił jakość życia związaną z objawami zapalenia błony
śluzowej nosa i spojówek w porównaniu do placebo (p<0,01)
Wieloośrodkowe badanie wpływu montelukastu w dawce 10 mg na alergiczny nieżyt nosa u pacjentów w wieku 15 do 85 lat z astmą i
ANN w sezonie alergicznym.
Philip G i wsp. Curr Med Res Opin
2004;20(10):1549–1558.
5
4
3
2
1
0
Wynik leczenia
(średnia±SD)
Lekarze
Pacjenci
2,7
7
2,39
2,76
2,41
Placebo (n=416)
Montelukast
(n=415)
Globalna ocena alergicznego nieżytu nosa*
p0,0
01
p0,0
01
Jak leczyć nieżyt nosa?
?
-1
-0,2
-0,4
-0,6
-0,8
Placebo
Zmiana skali objawów sezonowegonieżytu nosa i spojówek
E. O. Meltzer et al. J Allergy Clin Immunol 2000;105:917-22
Loratadyna
*
Montelukast
*
Loratadyna + Montelukast
*
460 pacjentów
15-75 lat
*p<0,05 vs. placebo

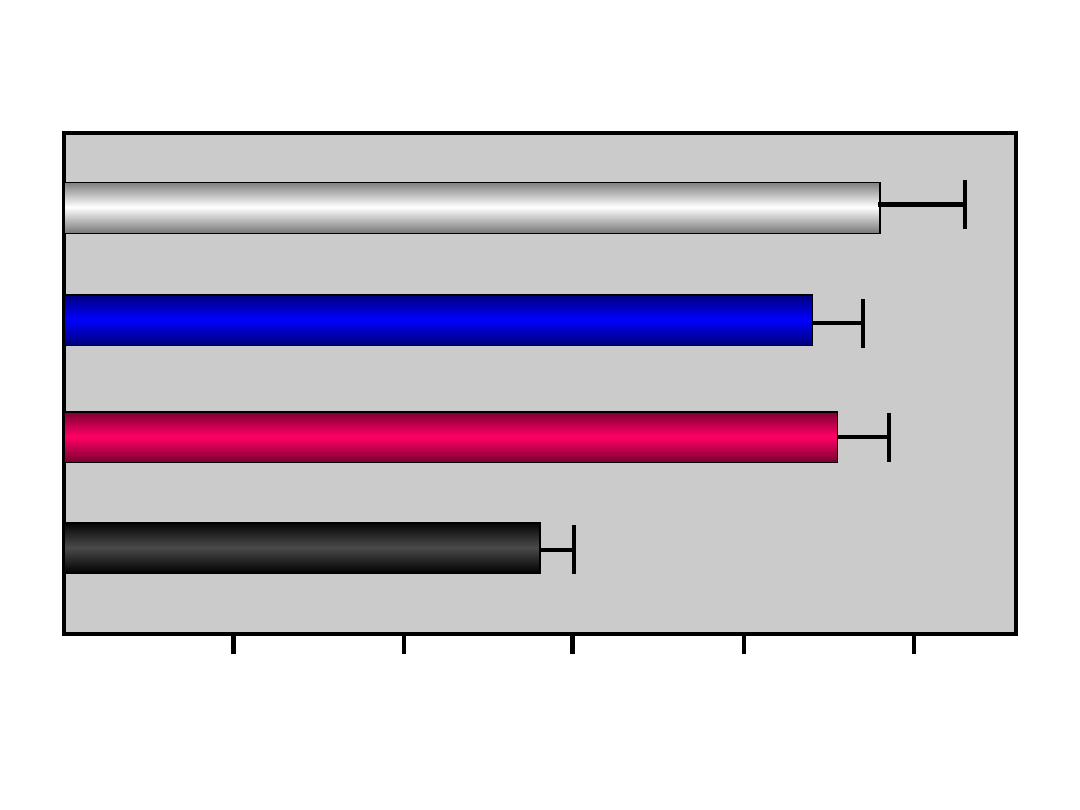
Skuteczność i
bezpieczeństwo leczenia
alergicznego nieżytu nosa
NNT
NNH
Cetyryzyna
8,9
33
Day et al.
Feksofenadyna
15,2
77
Wahn et al.
Desloratadyne
17,9
48
Berger and White
Loratadyne
34,5
67
Day et al.
Flutikazon
6
67
Ratner et al.
Budezonid
4,8
33
Fokkens et al.
Azelastyna
6,3
32
LaForce et al.
Montelukast
14,3
167
Ratner et al.
Omalizumab
12,3
13
Chervinsky et al.
Immunoterapia
4,6
14
Walker et al.
Karaayvaz et al.
NNT=liczba pacjentów, których trzeba leczyć aby pomóc jednemu choremu
NNH=liczba pacjentów, których trzeba leczyć aby zaszkodzić jednemu choremu
Najskuteczniejsze leczenie
alergicznego nieżytu nosa
NNT
NNH
Immunoterapia
4,6
14
Budezonid
4,8
33
Flutikazon
6
67
Azelastyna
6,3
32
Cetyryzyna
8,9
33
Omalizumab
12,3
13
Montelukast
14,3
167
Feksofenadyna
15,2
77
Desloratadyne
17,9
48
Loratadyne
34,5
67
NNT=liczba pacjentów, których trzeba leczyć aby pomóc jednemu choremu
NNH=liczba pacjentów, których trzeba leczyć aby zaszkodzić jednemu choremu
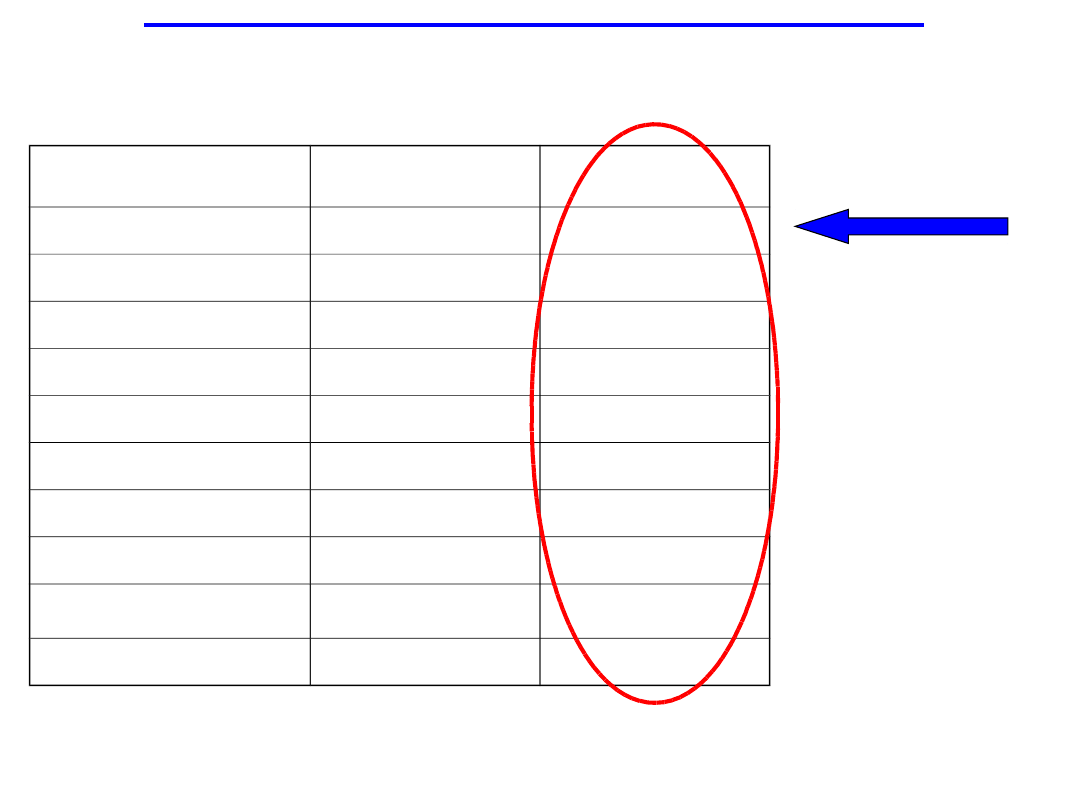
Najbardziej bezpieczne
leczenie alergicznego nieżytu
nosa
NNT
NNH
Montelukast
14,3
167
Feksofenadyna
15,2
77
Flutikazon
6
67
Loratadyne
34,5
67
Desloratadyne
17,9
48
Budezonid
4,8
33
Cetyryzyna
8,9
33
Azelastyna
6,3
32
Immunoterapia
4,6
14
Omalizumab
12,3
13
NNT=liczba pacjentów, których trzeba leczyć aby pomóc jednemu choremu
NNH=liczba pacjentów, których trzeba leczyć aby zaszkodzić jednemu choremu
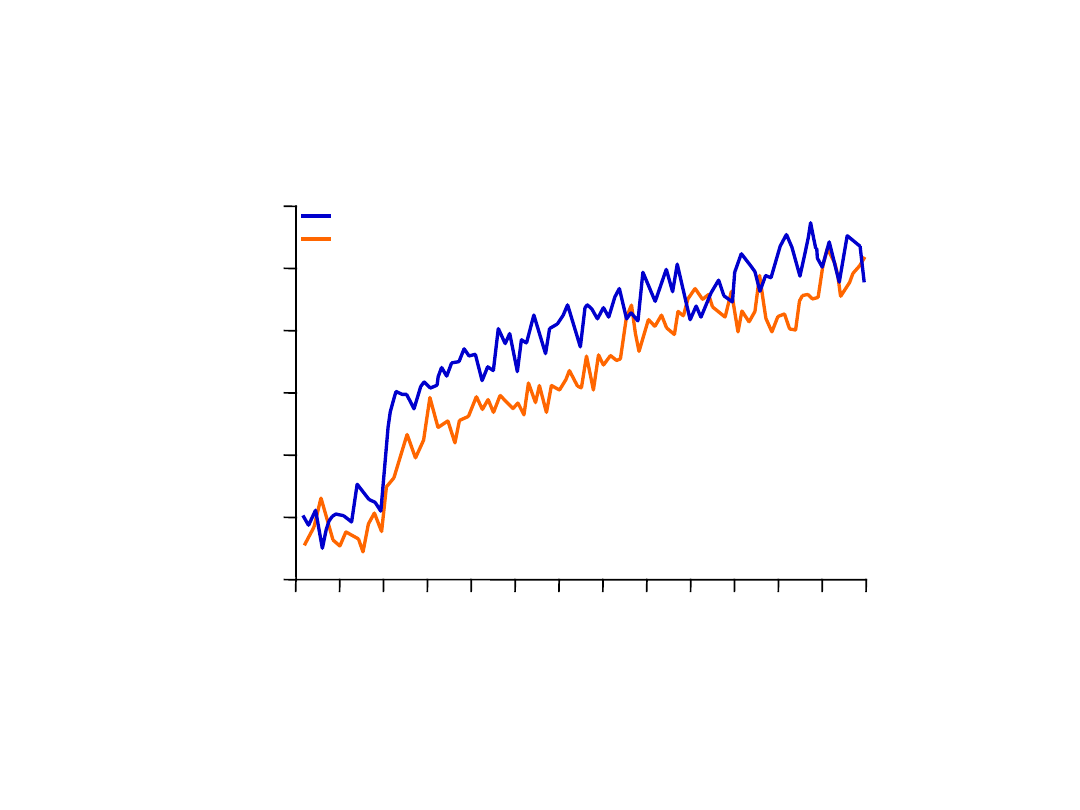
440
430
420
410
400
390
380
PEF=szczytowy przepływ wydechowy (peak expiratory flow)
*Pomiar średni przed podaniem badanego leku
Price DB i wsp. Thorax
2003;58:211–216.
Montelukast + Budesonid poprawił
poranny PEF w czasie 12 tygodni
Poranne
PEF*
(L/min)
–14
14
84
Dni po randomizacji
–7
0
7
21 28 35 42 56 63 70 77
Montelukast 10 mg + budesonid 800 µg
(n=448) Budesonid 1600 µg (n=441)
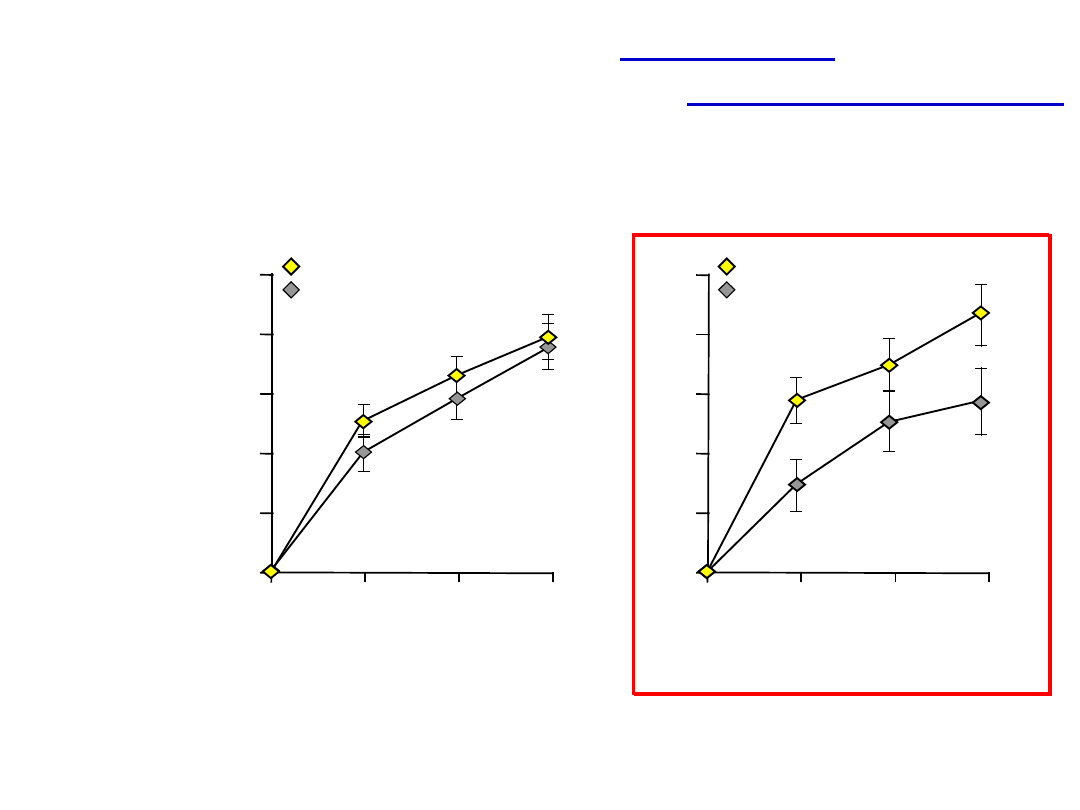
Montelukast zapewnił większą
poprawę porannego PEF niż budezonid
u pacjentów z astmą i
współistniejącym ANN
50
40
30
20
10
0
PEF - zmiana
od poziomu
wyjściowego
(L/min, LS*
średnia SEM)
0
4
8
12
0
4
8
12
Montelukast (n=433)*
Budesonid (n=425)**
p<0,0
3
p=0,3
6
Tygodnie
Pacjenci z astmą
Tygodnie
Pacjenci z astmą i
ANN
Montelukast (n=216)*
Budesonid (n=184)**
*
Montelukast 10 mg raz dziennie + budesonid 400 µg dwa razy dziennie; **Budesonid 800 µg dwa razy dziennie
Philip G i wsp.Curr Med Res Opin
2004;20:1549-1558.
50
40
30
20
10
0

Wytyczne ARIA zalecają podejście
złożone w leczeniu astmy i
alergicznego nieżytu nosa
•Pacjentów z ANN należy oceniać pod kątem
astmy
•Pacjentów z astmą należy oceniać pod
kątem ANN
•Strategia terapeutyczna powinna
obejmować leczenie górnych i dolnych
dróg oddechowych w zakresie skuteczności
i tolerancji
Bousquet J i wsp. J Allergy Clin Immunol 2001;108(suppl
5):S147–S334
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
astma i alergiczny niezyt nosa a nurkowanie
overview simatic controllers 04 2007 en plc
maska OP-1M pakiety 18.04.2007 r, wojskowe, Chemiczne
maska OP-1M pakiety 18.04.2007 r, wojskowe, Chemiczne
Alergiczny nieżyt nosa
PATOMORFOLOGIA KOŁO 8 (22.04.2007), patomorfologia, PATOMORFOLOGIA-egzamin, PATOMORFOLOGIA-egzamin,
Konspekt SUM REZERWY 04 2007, Finansowe
Profilaktyka alergicznego nieżytu nosa
bm wt 13 15 g1 se1 sp5 c5 03 04 2007
KONSPEKT SUM PODATKI ODROCZONE 04 2007, PODATKI ODROCZONE
Prawo budowlane, 17.04.2007 Wykład Prawo Budowlane, ---- brakuje 2,3 min
pato ko+éo VIII 22.04.2007, patomorfologia, pato testy, koło 8
materiałoznawstwo 7 - 03.04.2007, Materiałoznawstwo - wykłady
przewlekly niezyt nosa u 12letniego chlopca
Nowelizacja prawa OŚ 26 04 2007
Leczenie alergicznego nieżytu nosa u dorosłych i dzieci, Ratownictwo medyczne, Rozmaitości
Doradztwo rehabilitacyjne, Doradztwo rehabilitacyjne 17.04, Doradztwo rehabilitacyjne - wykład - 17-
więcej podobnych podstron