
Układy
Układy
wieloskładnikowe
wieloskładnikowe
Równowagi fazowe
Równowagi fazowe
- wstęp
- wstęp

Wielkości molowe
cząstkowe
s
3
2
1
n
n
n
n
Y
Y
......
,
,
Jeśli układ składa się z
s
składników, to
dowolna wielkość ekstensywna
Y
zależy od
składu układu czyli liczby moli poszczególnych
składników w układzie.
Dowolna wielkość molowa cząstkowa to
pochodna wielkości ekstensywnej po liczbie moli
i-tego
składnika, przy stałej liczbie moli
pozostałych składników i stałym ciśnieniu i
temperaturze.
'
,
,
,
n
T
p
i
i
p
n
Y
Y

Każda wielkość molowa cząstkowa jest wielkością
intensywną.
Dana wielkość ekstensywna układu może być
wyrażona jako :
s
i
1
i
i
p
i
Y
n
Y
,

'
'
'
'
'
,
,
,
,
,
,
,
,
,
,
,
,
,
,
,
n
T
p
i
i
p
n
T
p
i
i
p
n
T
p
i
i
p
n
T
p
i
i
p
n
T
p
i
i
p
n
G
G
n
S
S
n
H
H
n
U
U
n
V
V
molowa objętość cząstkowa
molowa energia wewnętrzna
cząstkowa
molowa entalpia cząstkowa
molowa entropia cząstkowa
molowa entalpia swobodna
cząstkowa
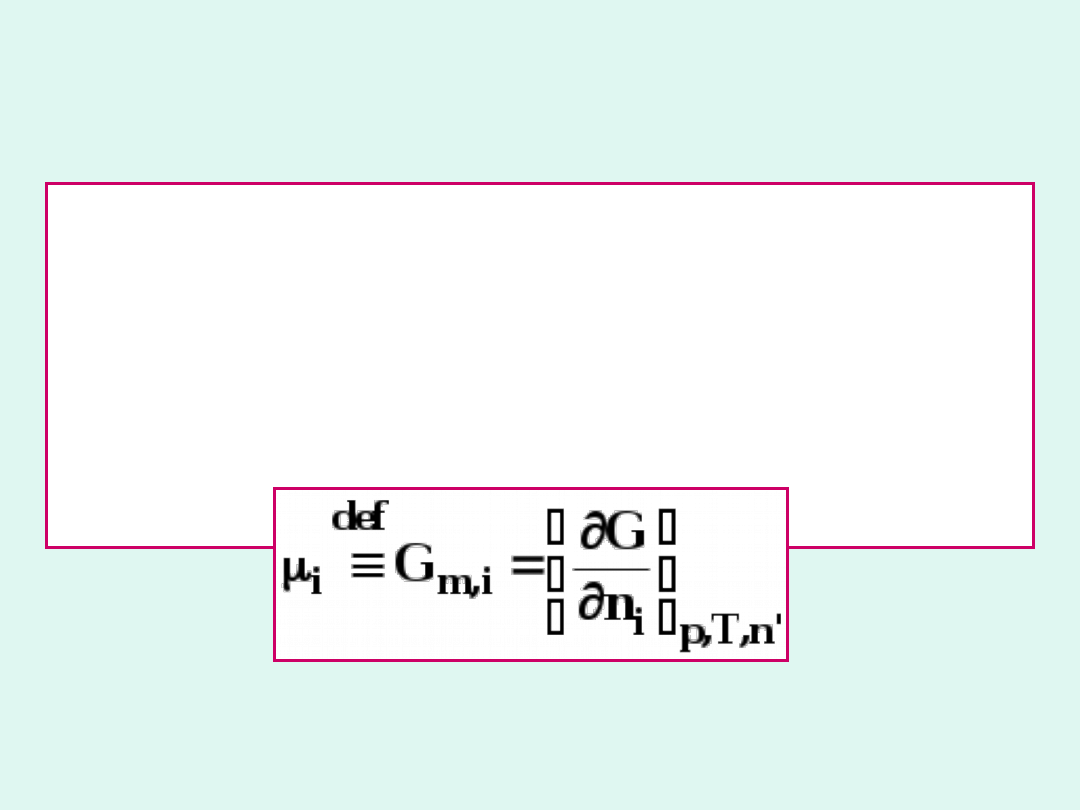
Potencjał chemiczny
Potencjał chemiczny
składnika i-tego to
zmiana
entalpii
swobodnej
układu
towarzysząca dodaniu 1 mola tego składnika
w stałej temperaturze i ciśnieniu do
nieskończenie dużej ilości układu, aby
zachował on stały skład (stałą liczbę moli
pozostałych składników).
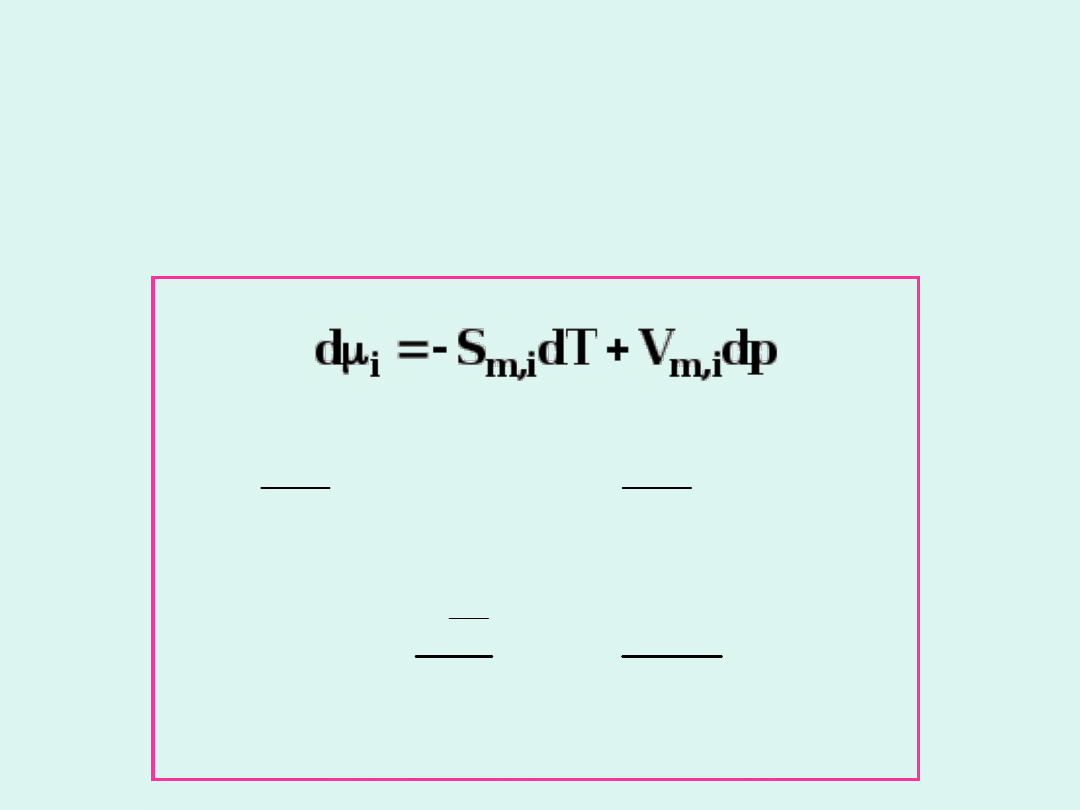
i
i
m,i
m,i
p
T
S
i
V
T
p
i
m,i
T
2
p
H
T
T
Własności potencjału
chemicznego
Potencjał chemiczny spełnia te same właściwości
co entalpia swobodna, tylko w odniesieniu do
wielkości molowych cząstkowych.

Dla układu wieloskładnikowego :
s
i
1
i
i
i
i
n
T
p
i
n
T
n
p
s
i
1
i
i
n
T
p
i
n
T
n
p
s
3
2
1
dn
Vdp
SdT
dG
n
G
V
p
G
S
T
G
dn
n
G
dp
p
G
dT
T
G
dG
n
n
n
n
p
t
G
G
'
'
,
,
,
,
,
,
,
,
.....
,
,
,
,

Dla procesów zachodzących pod stałym
ciśnieniem i w stałej temperaturze zmiana
entalpii swobodnej określa samorzutny
kierunek przebiegu procesu.
'
,
dw
dG
T
p
Jeśli
T = const
i
p = const
, to :
'
,
dw
dn
dn
dG
s
i
1
i
i
i
s
i
1
i
i
i
p
T
W
układzie
wieloskładnikowym
praca
nieobjętościowa może być wykonana w
wyniku zmiany składu układu w warunkach
izotermiczno-izobarycznych.

Jeżeli w układzie nie ma pracy nieobjętościowej,
to :
0
dn
s
i
1
i
i
i
W stanie równowagi
termodynamicznej
0
dn
s
i
1
i
i
i

s
i
1
i
i
i
s
i
1
i
i
i
s
i
1
i
i
i
dn
d
n
dG
n
G
Entalpia swobodna układu może być wyrażona jako
suma potencjałów chemicznych składników
pomnożonych przez liczbę moli.
s
i
1
i
i
i
s
i
1
i
i
i
s
i
1
i
i
i
s
i
1
i
i
i
d
n
dn
dn
Vdp
SdT
dn
Vdp
SdT
dG

0
d
n
Vdp
SdT
s
i
1
i
i
i
Równanie Gibbsa-Duhema
Gdy
p = const
i
T = const
, to :
0
d
n
s
i
1
i
i
i
Oznacza to, że potencjały chemiczne poszczególnych
składników w układzie wieloskładnikowym są ze sobą
nawzajem powiązane i zmiana jednego z nich
wywołuje zmiany innych.

Faza
Faza jest część układu jednorodna pod
względem fizycznym i chemicznym,
oddzielona od reszty układu fizyczną
powierzchnią
rozdziału,
o
takim
stosunku powierzchni do masy, że
można zaniedbać fluktuacje składu i
gęstości oraz zjawiska powierzchniowe.

Wyjaśnienia do definicji fazy
Jednorodna pod względem fizycznym i chemicznym –
w całej objętości fazy mamy jednakowe własności
fizyczne i chemiczne (a w szczególności skład).
Fizyczna powierzchnia rozdziału – powierzchnia
międzyfazowa, granica faz
Powierzchnia międzyfazowa może być bardzo duża, w
przypadku gdy jedna faza jest podzielona na mnóstwo
małych cząstek (na przykład emulsja oleju w wodzie,
gdzie faza olejowa jest podzielona na mnóstwo małych
kropelek). Wówczas o własnościach całego układu
zaczynają decydować własności powierzchni
międzyfazowej (zjawiska powierzchniowe).
Faza musi składać się z co najmniej takiej ilości
cząsteczek, aby statystyczna zmienność liczby
cząsteczek w elemencie objętości była nieistotna –
fluktuacje składu i gęstości muszą być zaniedbywalnie
małe.

roztwór stały –
jedna faza
dyspersja stała –
dwie fazy
Granica międzyfazowa nie zawsze jest
dostrzegalna na pierwszy rzut oka, dopiero
obserwacja na przykład pod mikroskopem pozwala
rozstrzygnąć, czy stop dwu metali jest roztworem
stałym czy mieszanina kryształków czy dyspersją.

Składniki niezależne
Składniki niezależne to te indywidua
chemiczne
(składniki)
obecne
w
układzie, których stężenia trzeba znać,
aby w sposób jednoznaczny móc określić
stężenia wszystkich składników we
wszystkich fazach układu.

Wyjaśnienia do definicji
składników niezależnych
Składniki niezależne to składniki układu, które
można wydzielić jako związki chemiczne z układu.
Składniki niezależne są nie powiązane ze sobą
żadnymi reakcjami chemicznymi.
Składniki niezależne rozpatrujemy niezależnie od
ich stanu fizycznego. Na przykład woda jako
składnik to cząsteczki H
2
O, niezależnie czy jest to
lód, woda ciekła czy para wodna.

n
– liczba wszystkich składników w układzie
(cząsteczek chemicznych lub jonów)
r
– liczba równań równowag chemicznych
wiążących poszczególne składniki ze sobą
w
– liczba warunków stechiometrycznych, jakie
muszą być spełnione przez składniki
s
– liczba składników niezależnych
w
r
n
s

Stopnie swobody
Stopnie swobody to te parametry
intensywne opisujące układ, które
można zmieniać niezależnie od siebie (w
pewnych granicach) bez zakłócenia
równowagi termodynamicznej układu
czyli bez zmiany liczby i rodzaju faz w
układzie.
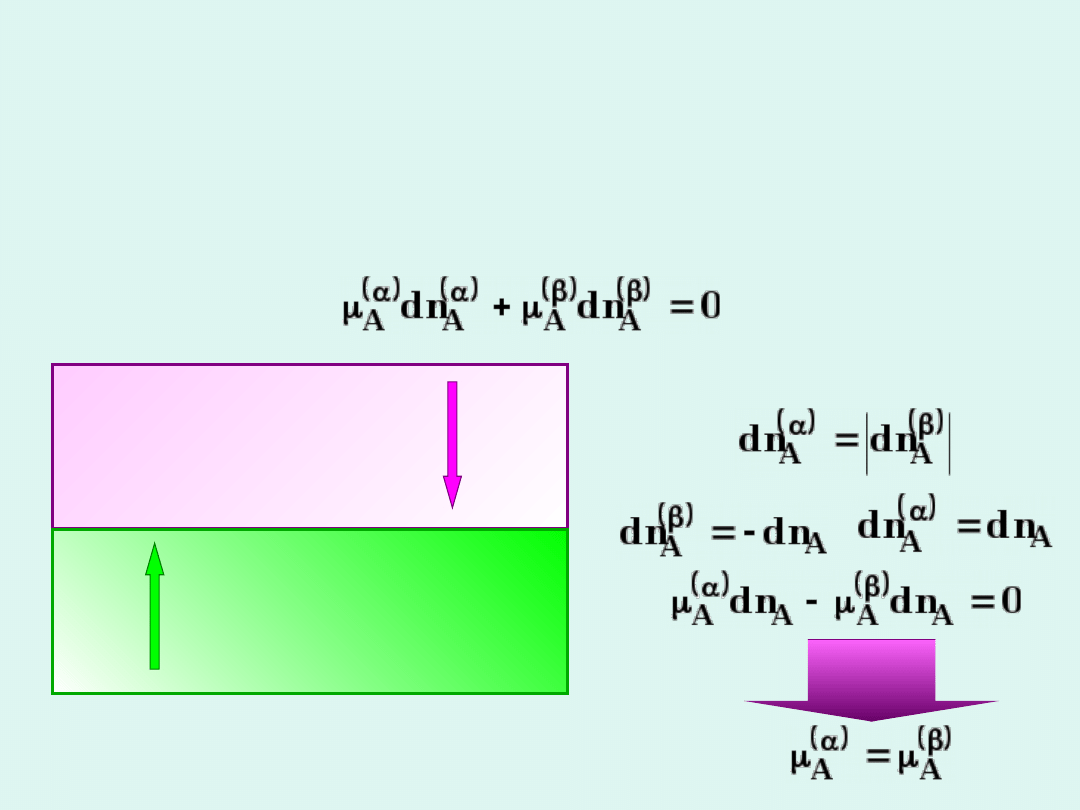
Załóżmy, że mamy układ dwuskładnikowy i dwufazowy,
będący w stanie równowagi termodynamicznej. Aby
skład obu faz pozostawał niezmienny, przepływ
substancji
A
z fazy
do
i w odwrotnym kierunku
musi być taki sam. Z warunku równowagi dla układów
wieloskładnikowych, wynika, że dla składnika
A
spełnione jest równanie :
faza
faza
dn
A
-dn
A

Z warunku równowagi dla układów
wieloskładnikowych wynika, że potencjał
chemiczny danego składnika niezależnego jest
jednakowy we wszystkich fazach. Dotyczy to
każdego ze składników niezależnych układu.
f
i
3
i
2
i
1
i
.....
Oznaczamy :
s
s
– liczba składników niezależnych
f
f
– liczba faz
z
z
– liczba stopni swobody (zmienność
układu)

Aby określić jednoznacznie stan układu
składającego się z
f
faz i zawierającego
s
składników niezależnych, należy określić
temperaturę i ciśnienie całego układu, oraz skład
każdej z faz. Ponieważ suma ułamków molowych
wszystkich składników wynosi 1, to aby określić
skład danej fazy w sposób jednoznaczny, trzeba
znać
(s-1)
ułamków.
1
s
i
1
i
j
i
j
s
x
1
x
Wobec tego liczba parametrów opisujących układ
wynosi :
f·(s-1)+2

Dla danego składnika mamy
(f-1)
równości
wiążących ze sobą nawzajem jego potencjał
chemiczny w różnych fazach. Dla
s
składników
liczba takich wiążących równań wynosi :
s·(f-1)
Liczba stopni swobody (zmienność układu) jest
równa różnicy liczby wszystkich parametrów
niezbędnych do opisu układu i liczby równań
wiążących te parametry ze sobą.
s
f
s
2
f
s
f
z
1
f
s
2
1
s
f
z

Reguła faz Gibbsa
2
f
s
z
Reguła faz Gibbsa określa zmienność układu
(liczbę stopni swobody) w zależności od liczby
składników niezależnych i liczby faz w układzie.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
WYKŁAD STUDENCI CH WRZODOWA WSTĘP 2
WYKŁAD STUDENCI CH WRZODOWA WSTĘP
1 Wykład Ch F wstęp
Wyklad I Problemy etyczne Wstep
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
Wykład Ch F I zasada
mediacje rodzinne, wyklad SWPS Wroclaw WSTEP DO MEDIACJI I METODY
Wykład Ch F potencjometria
5 Wykład Ch F II zasada1
więcej podobnych podstron