
Metody elektroanalityczne

Podział metod elektroanalitycznych
- potencjometria,
- konduktometria,
- elektrograwimetria,
- elektrografia,
- kulometria,
- polarografia,
- woltoamperometria,
- amperometria.

Elektroliza
–wszystkie zjawiska (reakcje
elektrochemiczne) na granicy faz przewodnik
metaliczny – roztwór, zachodzące podczas
przepływu przez elektrolit stałego prądu
elektrycznego.
Elektrolizą rządzą dwa prawa Faradaya
(1833).

I prawo Faradaya
Masy substancji (m) wydzielonych podczas
elektrolizy
na
elektrodach
są
wprost
proporcjonalne
do
wielkości
ładunku
elektrycznego (Q), który przepłynął przez
elektrolit
k –równoważnik elektrochemiczny (masa
substancji wydzielona na elektrodzie przez
ładunek 1C (1A w ciągu 1s)
kIt
kQ
m

2
1
2
1
Eq
Eq
m
m
2
1
2
1
Eq
Eq
k
k
const
k
Eq
k
Eq
2
2
1
1
II prawo Faradaya
Jednakowe ładunki elektryczne (Q) wydzielają
z różnych elektrolitów masy substancji (m)
proporcjonalne
do
ich
równoważników
chemicznych (Eq)
lub
lub
Stały dla wszystkich substancji stosunek
równoważnika chemicznego (Eq=M/z) do
elektrochemicznego (k) nosi nazwę
stałej
Faradaya
(
F = 96486,70.54 C/val
) –jest to
ładunek
potrzebny
do
wydzielenia
na
elektrodzie
jednego
gramorównoważnika
chemicznego substancji.
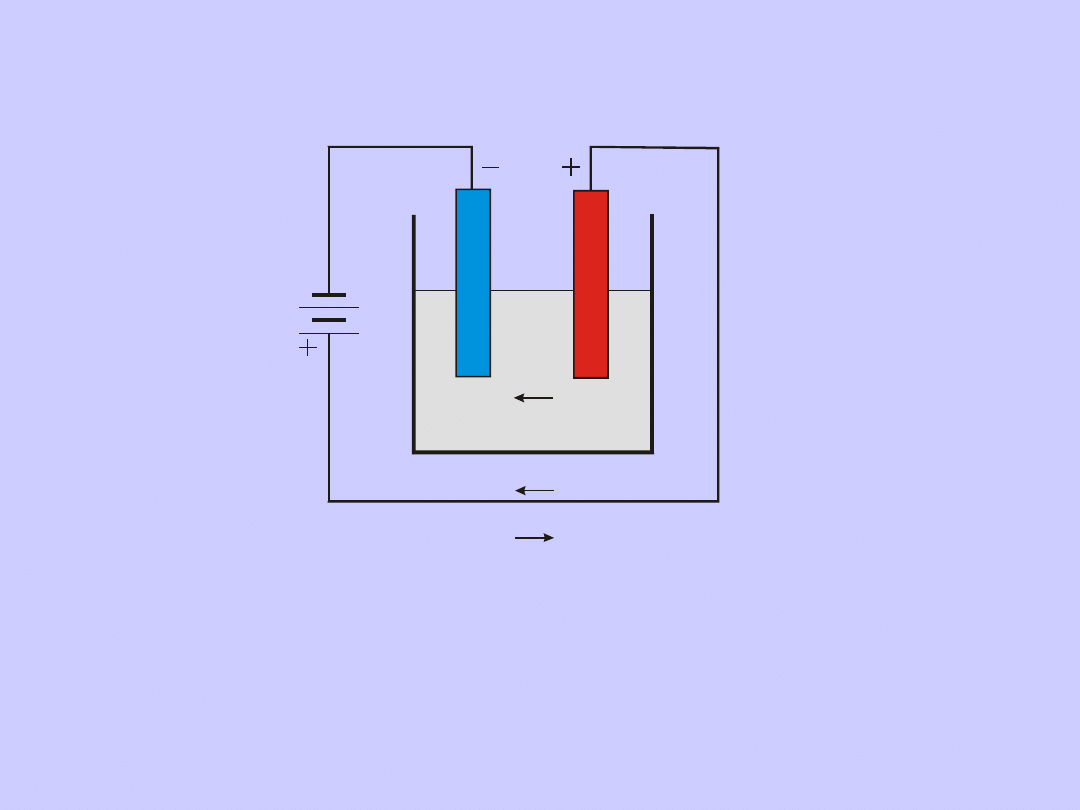
Uzasadnienie wartości liczbowej stałej Faradaya
K
A
T
O
D
A
A
N
O
D
A
I
I
e
Jeśli na katodzie wydzieliło się m gramów metalu wtedy
liczba elektronów, które zostały zredukowane (M
+
+ e
-
= M
0
)
wynosi: m/M
x
N
gdzie M – masa molowa, N – liczba Avogadro

Uzasadnienie wartości liczbowej stałej Faradaya
Dla metalu, którego stopień utlenienia jest większy od 1
(M
z+
+ ze
-
= M
0
), sumaryczny ładunek wymieniony między
elektrodą i roztworem wynosi:
gdzie e – ładunek elektronu, równy 1,622
x
10
-19
C
e
x
N = 1,622
x
10
-19
C
x
6,03
x
10
23
= 96500 C
Q
e
z
N
M
m

It
zF
M
F
It
z
M
eN
Q
z
M
m
F
Eq
zF
M
k
stąd równoważnik elektrochemiczny k wynosi:

Elektrograwimetria, analiza
elektrograwimetryczna, metoda
analizy ilościowej; polega na
wagowym oznaczeniu substancji
wydzielonej uprzednio
na elektrodzie.
W elektrograwimetri zawartość metali w
roztworze wyznaczana jest poprzez ich ilościowe
wydzielenie na (uprzednio zważonej) katodzie w
procesie elektrolizy. Metale przeszkadzające
usuwa się najczęściej za pomocą odpowiednich
odczynników kompleksujących. Niemetale
wyznacza się z pomiaru objętości wydzielonego
gazu na anodzie.

0
ln
0
M
M
a
a
nF
RT
E
E
n
Równanie Nernsta
E
0
– normalny potencjał elektrody, tj. potencjał elektrody
w roztworze o aktywności jonów metalu a
M
n+
= 1
R – stała gazowa,
T – temperatura [K],
F – stała Faradaya,
N – liczba elektronów biorących udział w reakcji.
a
M
0
= const. = 1
.
.
0
ln
red
utl
a
a
nF
RT
E
E
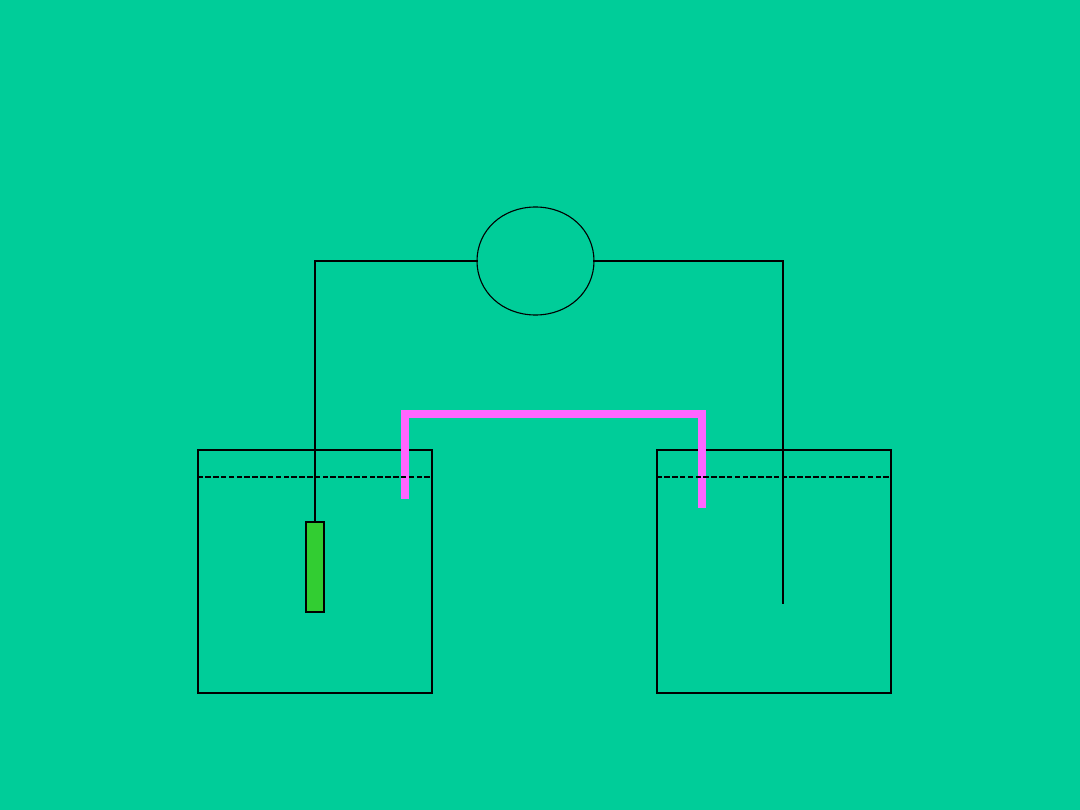
SEM = E
1
– E
2
SEM
Elektroda odniesienia
Klucz elektrolityczny
Elektroda wodorowa
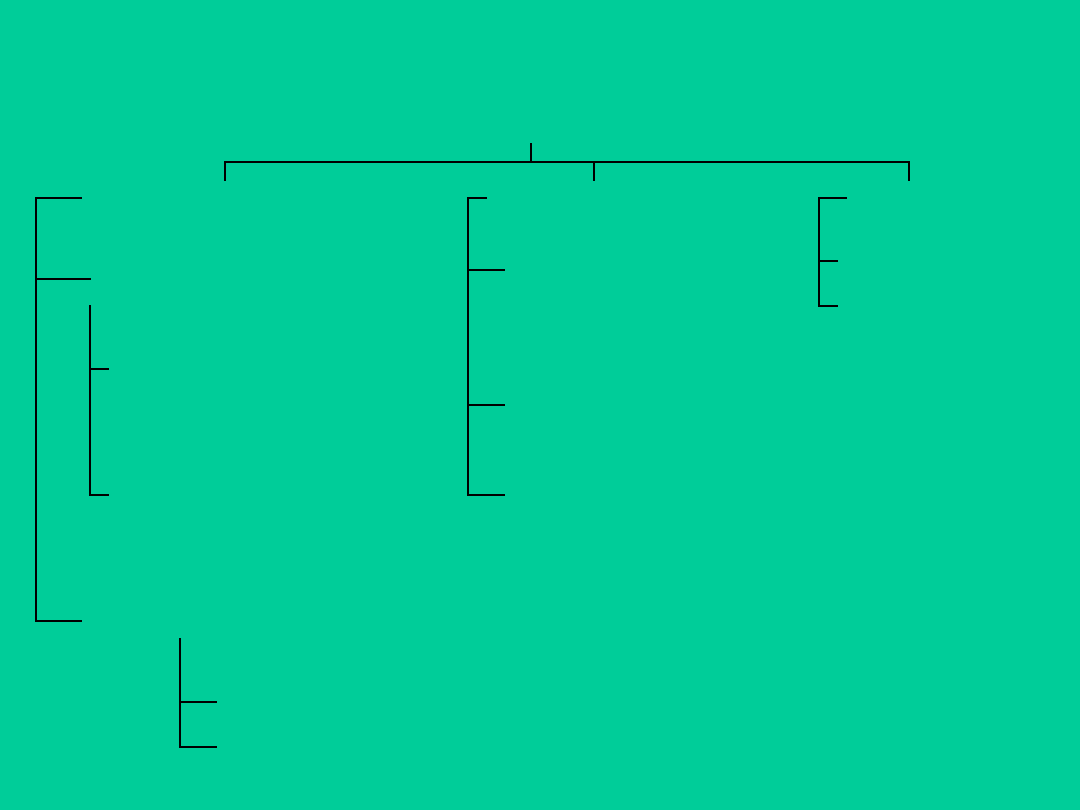
Elektrody jonoselektywne
stałomembranowe ciekłomembranowe
uczulane
enzymatyczne
gazowe
zawierające
kationity
zawierające anionity
zawierające związki makrocykliczne
szklane
do oznaczania stężenia
jonów wodorowych
do oznaczania stężenia
kationów jednowartościowych
krystaliczne
homogeniczne
heterogeniczne
Elektrody szklane do oznaczania stężenia jonów
wodorowych
Elektrody stałomembranowe

Elektrody stałomembranowe
Elektrody szklane do oznaczania stężenia kationów
jednowartościowych
Selektywność elektrod jest zależna od składu
chemicznego szkła,
z którego została wykonana membrana.
Skład elektrody szklanej do oznaczania pH:
Na
2
O – 14%, SiO
2
– 86% (% molowy), wsp. czułości Ag/Na
- 1400
Skład elektrody szklanej do oznaczania jonów Ag
+
i Na
+
:
Na
2
O – 11%, Al
2
O
3
– 18%, SiO
2
– 86% (% molowy)
Skład elektrody szklanej do oznaczania jonów K
+
i NH
4
+
:
Na
2
O – 27%, Al
2
O
3
– 4%, SiO
2
– 69% (% molowy) wsp.
czułości K/NH
4
- 1400
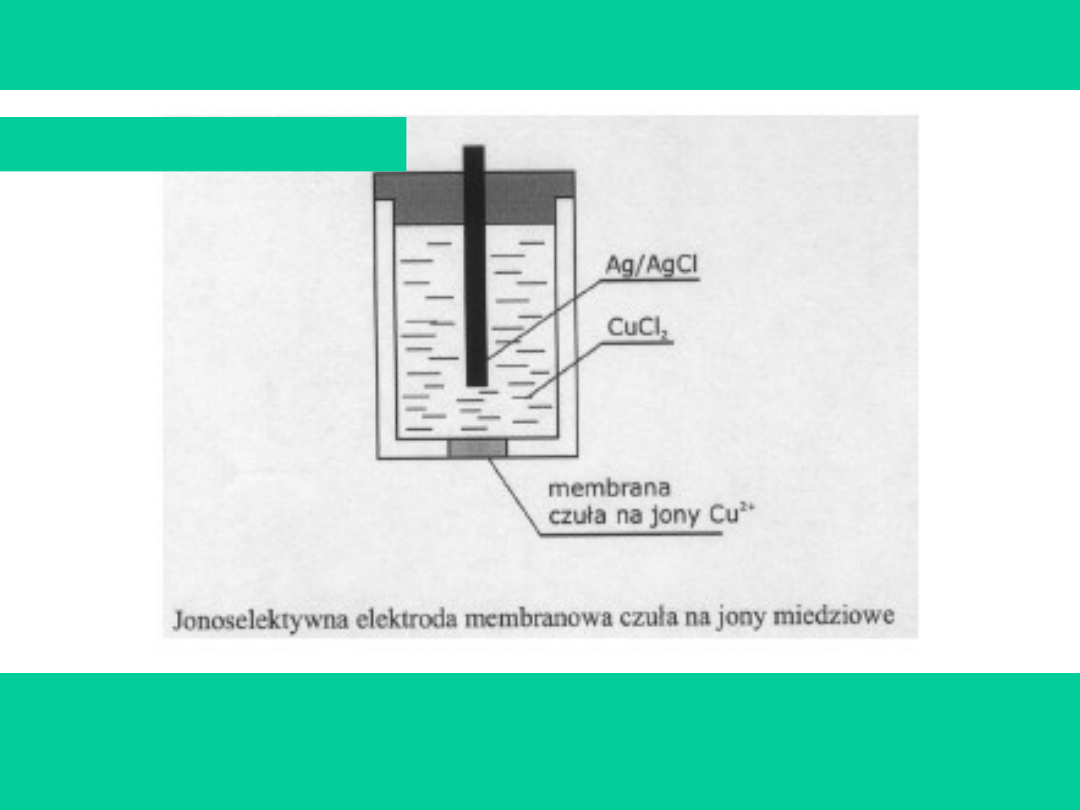
Elektrody stałomembranowe
Elektrody krystaliczne
homogeniczne i heterogeniczne

Elektrody stałomembranowe
Elektrody krystaliczne homogeniczne
Membranę stanowi monokryształ lub układ polikrystaliczny trudno
rozpuszczalnych związków.
Jedną z pierwszych elektrod krystalicznych była elektroda fluorkowa
opisana w 1966 r. przez Franta i Rossa. Membranę stanowił w niej
monokryształ fluorku lantanu lub fluorku innych pierwiastków ziem
rzadkich. Fluorki te wykazują elektryczne przewodnictwo wynikające
z ruchliwości jonów fluoru w sieci krystalicznej.
Schematyczny mechanizm przenoszenia ładunków:
LaF
3
+ dziura cząsteczkowa LaF
2
+
+ F
-
Elektrody krystaliczne homogeniczne
Oznaczan
y jon
Skład membrany
Zakres
stosowalności
mol/dm
3
Zakres pH
prawidłowej
pracy
elektrody
Jony
przeszkadzające
F
-
LaF
3
1 – 10
-6
5 - 8
OH
-
(pH>8,5)
S
2-
Ag
+
Ag
2
S
1 – 10
-23
13 – 14
2 - 9
Hg
2+
I
-
AgI +
Ag
2
S
1 – 10
-7
1 - 12
S
2-
, CN
-
CN
-
AgI +
Ag
2
S
10
-2
– 10
-6
11 - 13
S
2-
, I
-
Pb
2+
PbS +
Ag
2
S
0,1 – 10
-7
2 – 14
Ag
+
, Hg
2+
,
Cu
2+

Elektrody krystaliczne heterogeniczne
Elektrody stałomembranowe
Elektrody heterogeniczne składają się z substancji
aktywnej
zdyspergowanej na obojętnym nośniku. Zadaniem
nośnika jest
polepszenie właściwości mechanicznych membrany.
Jako substancje aktywne stosuje się trudno
rozpuszczalne sole
lub wymieniacze jonowe, natomiast jako nosniki
stosuje się
parafinę, polistyren, PCV lub gumę silikonową.
Nośnik powinien być substancją hydrofobową.
Oznaczan
y jon
Skład membrany
Zakres
stosowalności
mol/dm
3
Zakres pH
prawidłowej
pracy
elektrody
Jony
przeszkadzające
Cl
-
AgCl
1 – 10
-5
1 - 10
CN
-
, S
2
O
3
2-
, I
-
Elektrody ciekłomembranowe
Mała ruchliwość dwuwartościowych kationów w
stałych membranach zainspirowała opracowanie
membran ciekłych.
Jedną z pierwszych była opracowana przez Rossa w
1967 r. elektroda z ciekłą membraną do oznaczania
jonów wapnia.
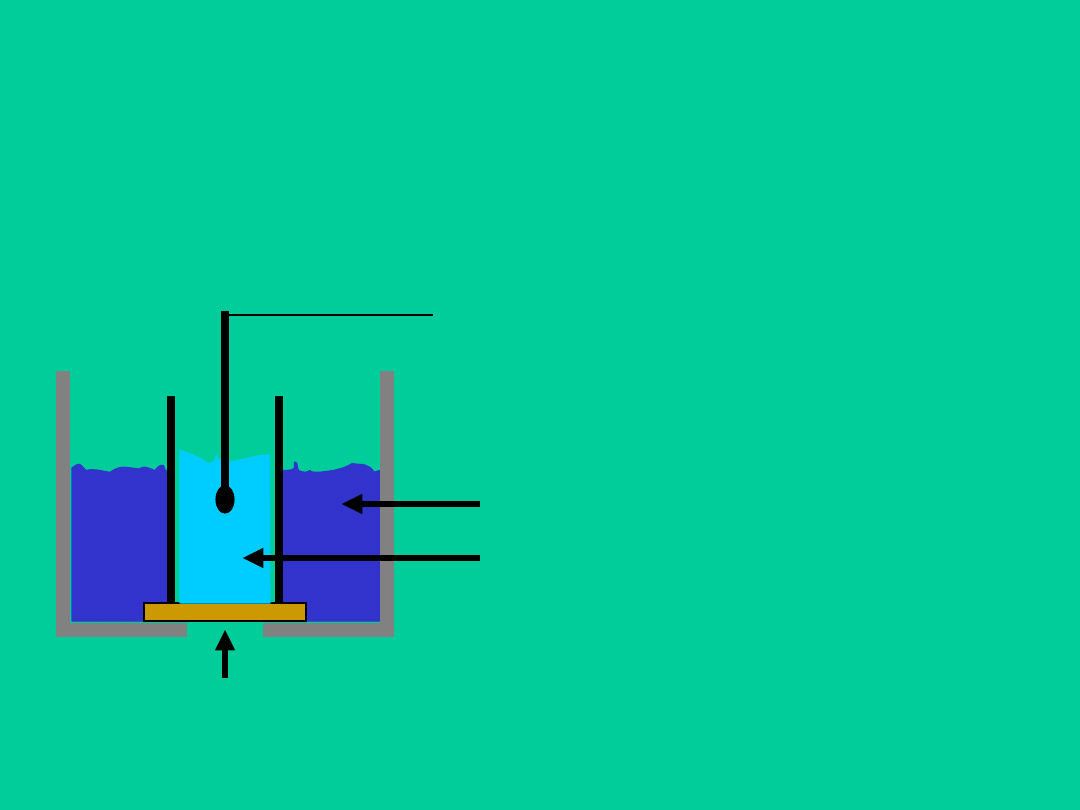
Membrana z hydrofobowego materiału (octan celulozy, spiekane szkło),
nasycona roztworem wymieniacza organicznego. Oddziela ona
zewnętrzny roztwór badany od wewnętrznego roztworu membrany o
stałym stężeniu jonów, na które czuła jest elektroda
Roztwór membrany
Roztwór wymieniacza organicznego

Elektrody ciekłomembranowe
Elektrody zawierające kationity.
W składzie roztworu wymieniacza organicznego są
stosowane ciekłe kationity. Najczęściej stosuje się
sole diestrów kwasu fosforowego lub sole kwasów
karboksylowych zawierające grupę tioeterową. Służą
m. in. do oznaczania: Zn
2+
, Cu
2+
, Ni
2+
, Ca
2+
.
Elektrody zawierające anionity.
W skład roztworu wymieniacza organicznego
wchodzą najczęściej czwartorzędowe sole amonowe.
Służą m. in. do oznaczania: NO
3
-
, ClO
4
-
, BF
4
-
, I
-
.
Elektrody zawierające obojętne związki
makrocykliczne,
np. roztwory makrocyklicznych
antybiotyków. Umożliwiają one np. pomiar stężenia
jonów potasu w obecności jonów sodu.

Oznaczan
y jon
Skład
wymieniacza
Zakres
stosowalności
mol/dm
3
Zakres pH
prawidłowej
pracy
elektrody
Jony
przeszkadzające
Ca
2+
(RO)
2
PO
2
-
1 – 10
-5
5,5 - 11
Zn
2+
, Fe
2+
,
Pb
2+
,
Cu
2+
Cl
-
R
4
N
+
0,1 – 10
-5
2 - 10
ClO
4
-
, I
-
,
NO
3
-
, Br
-
K
+
walinomyc
yna
1 – 10
-5
2 – 11
Rb
+
, Cs
+
,
NH
4
+
Elektrody ciekłomembranowe

Elektrody uczulane
Elektrody uczulane składają się z właściwej elektrody
jonoselektywnej i układu przetwarzającego lub
wyodrębniającego oznaczany składnik z próbki
analitycznej.
Do elektrod jonoselektywnych uczulanych należą
elektrody enzymatyczne i gazowe.

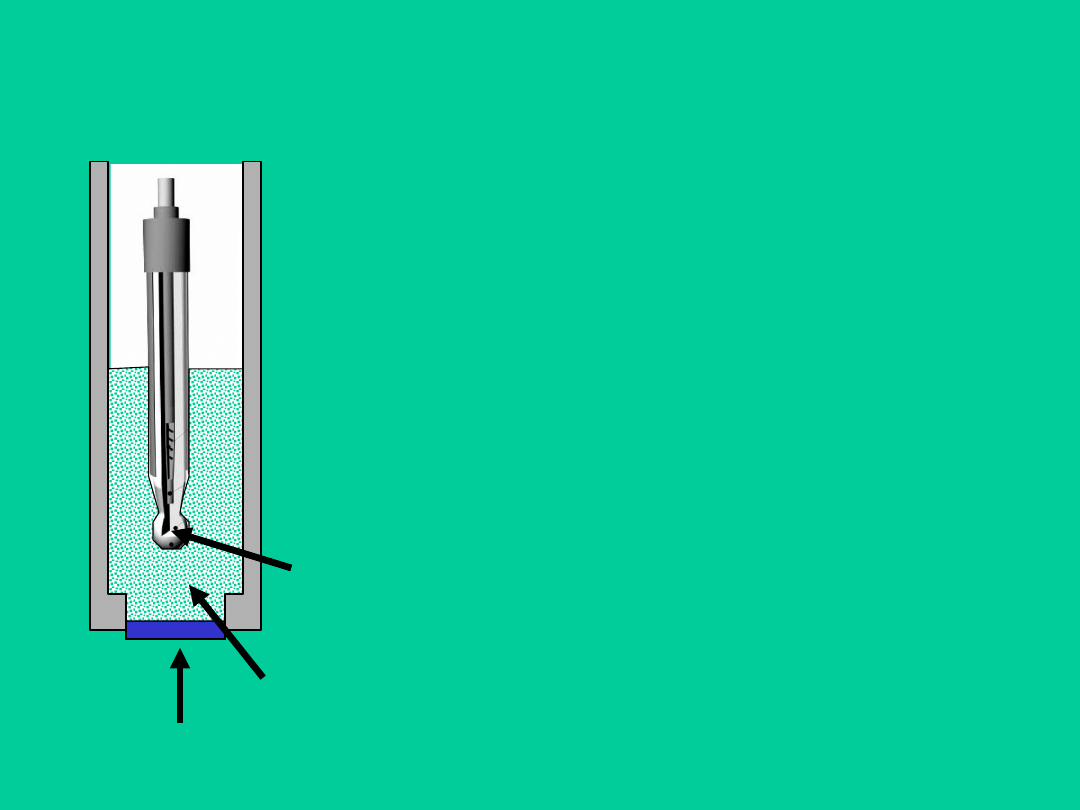
Klasycznym przykładem elektrody enzymatycznej jest elektroda
służąca
do
oznaczania
mocznika.
Cząsteczki
mocznika
dyfundujące z objętości roztworu przez pierwszą błonę
półprzepuszczalną do powierzchni elektrody ulegają w warstwie
żelu zawierającego enzym ureazę rozkładowi enzymatycznemu
zgodnie z reakcją enzymatyczną:
Powstałe w wyniku reakcji jony amonowe dyfundują przez drugą
półprzepuszczalną błonę do powierzchni elektrody szklanej
powodując zmianę jej potencjału.
Elektrody uczulane, enzymatyczne
4
2
2
2
2
2
2
NH
CO
H
O
H
NH
CO
ureaza
mocznik
jon amonowy
błona półprzepuszczalna
błona półprzepuszczalna
elektroda szklana
Elektrody uczulane, gazowe
1
2
3
4
Membrana przepuszczalna dla gazu
Roztwór wewnętrzny
Elektroda
do pomiarów pH
Wykorzystuje się je m. in. do pomiarów
stężenia CO
2
, SO
2
i NH
3
. Gaz dyfunduje
przez membranę
i rozpuszcza się w roztworze
wewnętrznym (roztwór wodny), na
skutek czego w roztworze zmienia się
stężenie jonów wodorowych:
CO
2
+ H
2
O HCO
3
-
+ H
+
SO
2
+ H
2
O HSO
3
-
+ H
+
NH
3
+ H
2
O NH
4
+
+ OH
-

Przykłady dziedzin zastosowania elektrod
jonoselektywnych:
Rolnictwo:
pasza - pomiary zawartości wapnia, chlorowców, sodu, potasu,
azotanów w celu zapewnienia odpowiedniej jakości wyrobów,
próbki gleby - oznaczania zawartości wapnia, azotanów, sodu,
potasu, boru i chlorowców
nawozy sztuczne - oznaczanie azotu i azotanów oraz oznaczanie
potasu i wapnia.
Medycyna:
krew, surowica - pomiar zawartości potasu, wapnia, chlorków
i fluorków w próbkach małej ilości.
mocz - łatwe oznaczanie zawartości jodków, fluorków, wapnia
i jonów amonowych.
Ponadto można przeprowadzić analizy śliny, potu, kultur
bakterii
i próbek biologicznych.
Ponadto: przemysł spożywczy, agronomia, chemia, fizyka,
biologia, stomatologia, ochrona środowiska itd.

Konduktometria
polega na pomiarze
przewodnictwa elektrycznego lub oporu
roztworu znajdującego się między
dwiema elektrodami obojętnymi w
warunkach stosowania zmiennego
napięcia, o częstotliwości nie
przekraczającej
10
5
Hz.

Podział technik
konduktometrycznych:
1.konduktometria klasyczna,
2.konduktometria bezelektrodowa
małej częstotliwości,
3.konduktometria wielkiej
częstotliwości.
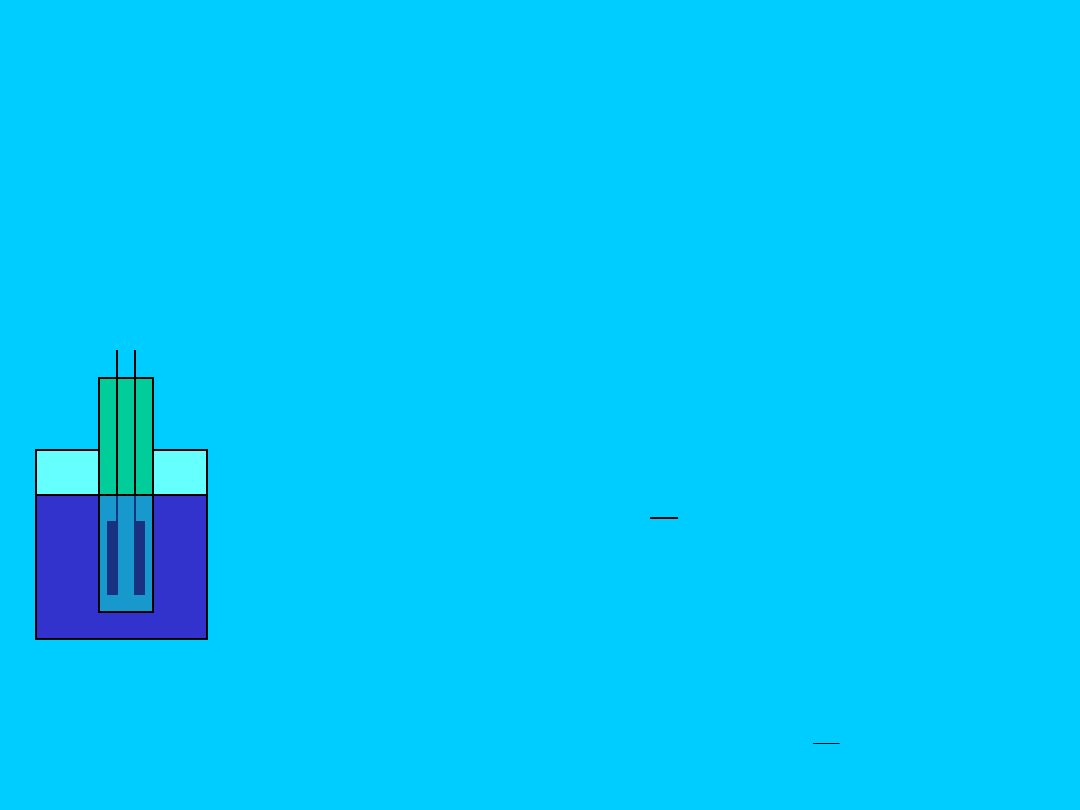
Konduktometria klasyczna
, polega
na pomiarze przewodnictwa słupa cieczy
zawartego między dwiema elektrodami
platynowymi, do których przykłada się
napięcie prądu zmiennego o częstotliwości
ok. 10
5
Hz
(na ogół od 1 do 10 kHz).
Ładunek elektryczny w roztworach elektrolitów
przepływa w wyniku uporządkowanego ruchu
jonów w polu elektrycznym. Zgodnie z prawem
Ohma rezystancja (opór) wyraża się wzorem:
]
[
A
l
R
gdzie: opór właściwy słupa cieczy o
przekroju (A) 1 cm
2
oraz długości (l) 1cm.
Stosunek l/A nazywa się stałą naczynka
elektrolitycznego lub pojemnością oporową
naczynka k:
]
cm
[
]
[
1
cm
A
l
k
~

Konduktometria klasyczna
Dla
elektrolitów
zazwyczaj
podaje
się
konduktancję
elektrolityczną (przewodność elektryczną czynną):
gdzie: konduktywność elektrolityczna
(przewodność właściwa) słupa cieczy o przekroju (A) 1 cm
2
oraz długości (l) 1cm.
Konduktancja
elektrolityczna
i
przewodność
właściwa
elektrolitów zależą od:
rodzaju elektrolitu,
stężenia,
temperatury - zamienia się zarówno koncentracja nośników
jak i ruchliwość.
W danej temperaturze przewodnictwo właściwe elektrolitu jest
funkcją stężenia. W roztworach o małym stężeniu
konduktywność elektrolitu zwiększa się niemal liniowo ze
wzrostem stężenia
simens
S
l
A
R
G
]
[
]
[
]
[
1
1
1
]
cm
S
[
1
]
[
1
1
1
cm
S
k
G
k
R

Zakładając,
że
roztwór
jest
dostatecznie
rozcieńczony (siły oddziaływania międzyjonowego są
pomijalnie małe) i jony są kulami o średnicy
niezależnej od natury rozpuszczalnika (pomijamy
solwatację) wówczas ruchliwość jonu można określić
następującą zależnością:
gdzie: - wartościowość jonu, - ładunek
elementarny,
- promień jonu, - lepkość roztworu.
r
e
z
u
o
i
i
6
i
z
o
e
r
Konduktometria klasyczna
Ruchliwość jonów metalu w rozcieńczonych
roztworach wodnych wynosi około 5·10
-4
cm
2
·V
-1
·s
-1
Ruchliwość jonów wodorowych w rozcieńczonych
roztworach wodnych wynosi około : 36,2 ·10
-4
cm
2
·V
-
1
·s
-1

Konduktometria klasyczna
Porównywanie konduktancji elektrolitycznej różnych
elektrolitów
umożliwia
tzw.
przewodnictwo
molowe (konduktywność molowa) :
Przewodnictwo molowe jest liczbowo równe
konduktancji elektrolitycznej jaką wykazuje warstwa
elektrolitu o objętości V (cm
3
) zawierająca 1 mol
substancji, umieszczona między dwiema elektrodami
znajdującymi się od siebie w odległości
1 cm.
]
mol
cm
S
[
1000
c
1
2

Konduktometria klasyczna
Przewodność molowa (dla elektrolitu typu AB),
składa się z przewodności kationu i przewodności
anionu :
Przewodnictwo molowe elektrolitu zależy od jego
stężenia i wraz z rozcieńczeniem roztworu wzrasta do
wielkości
zwanej
graniczną
przewodnością
molową .
Gdy
(prawo Kohlrauscha)
A
B
dysocjacji
stopień
:
gdzie
B
A
AB
o
o
B
o
A
o
to
c
1
0

Konduktometria klasyczna
W przypadku elektrolitów typu A
n
B
m.
łatwiej porównywać
przewodność różnych związków za pomocą przewodności
równoważnikowej.
Uwaga! W układzie SI pojęcie gramorównoważnik
oraz przewodność równoważnikowa nie występuje.
Przewodność równoważnikową
można zdefiniować następująco:
Przewodnictwo równoważnikowe elektrolitu A
n
B
m
jest
zawiązane
z
przewodnictwem
molowym
następującą zależnością:
gdzie: ładunek kationu lub anionu,
liczba kationów lub anionów powstałych podczas
dysocjacji elektrolitu A
n
B
m
.
e
ln
norma
stężenie
N
N
1000
*
m
z
n
z
*
z
;
z
m
;
n
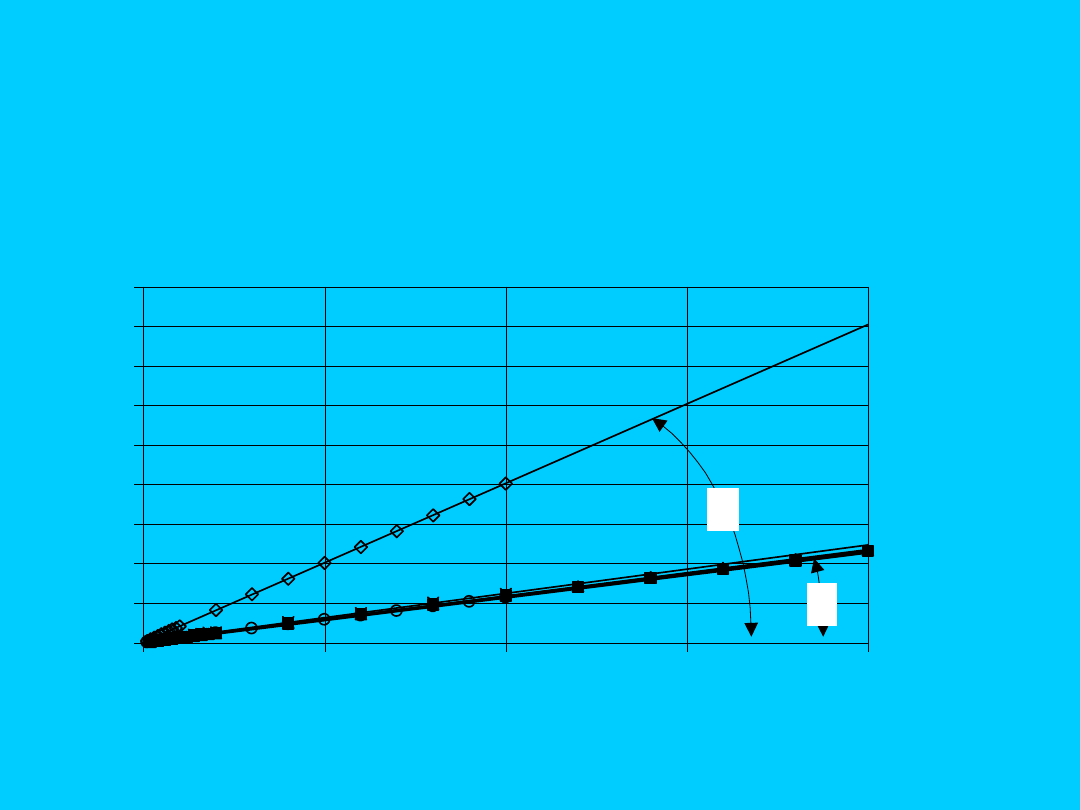
0
100
200
300
400
500
600
700
800
900
0
0,5
1
1,5
2
c* [mol/dm
3
]
[S/cm]
HCl
PbCl
2
MnCl
2
ZnCl
2
NiCl
2
NaCl
Zmiany konduktywności w zależności od stężenia rozcieńczonych
roztworów elektrolitów, T = const.
Konduktometria klasyczna
0
50
100
150
200
250
300
350
400
450
0
0,1
0,2
0,3
0,4
0,5
0,6
0,7
0,8
0,9
1
c*
HCl
/ (c*
HCl
+ c*
MtCl
)
[
S
/c
m
]
0
50
100
150
200
250
300
350
400
450
1
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0
c*
MtCl
/ (c*
HCl
+ c*
MtCl
)
[
S
/c
m
]
MnCl
2
NiCl
2
ZnCl
2
NaCl
PbCl
2
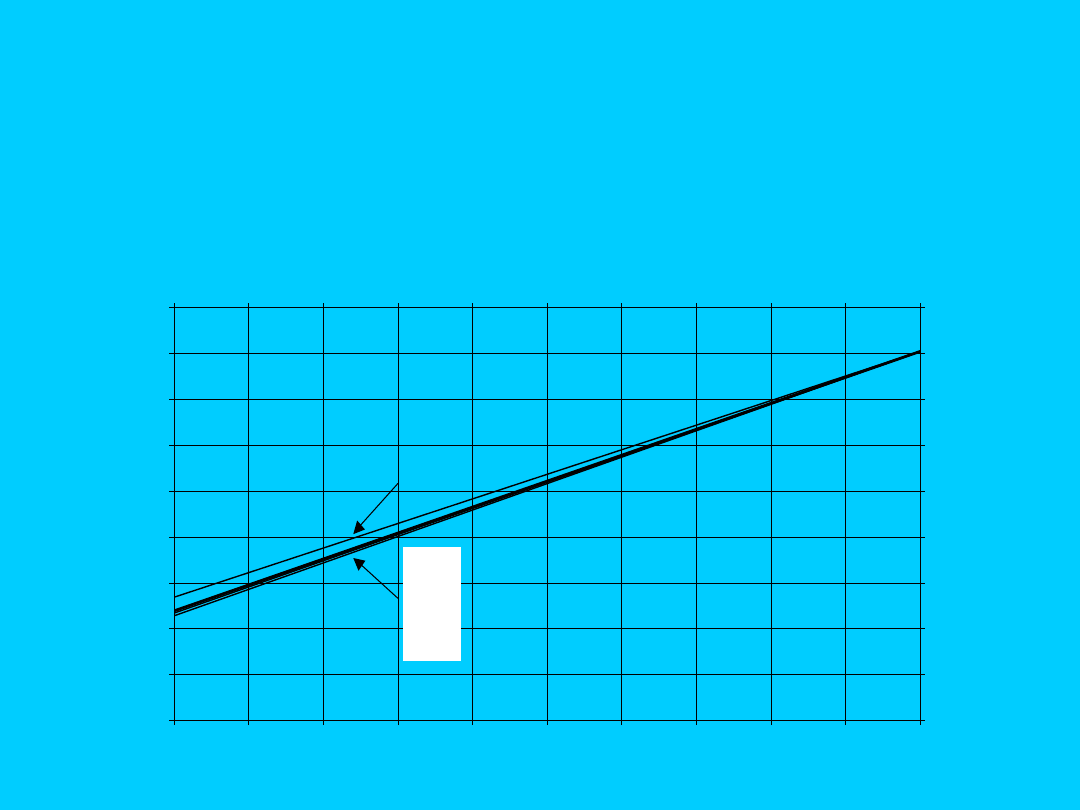
Zmiany konduktywności w zależności od ułamka
gramorównoważnikowego jonów wodorowych w
roztworach elektrolitów, T = const. c
Kt
= const.
Konduktometria klasyczna
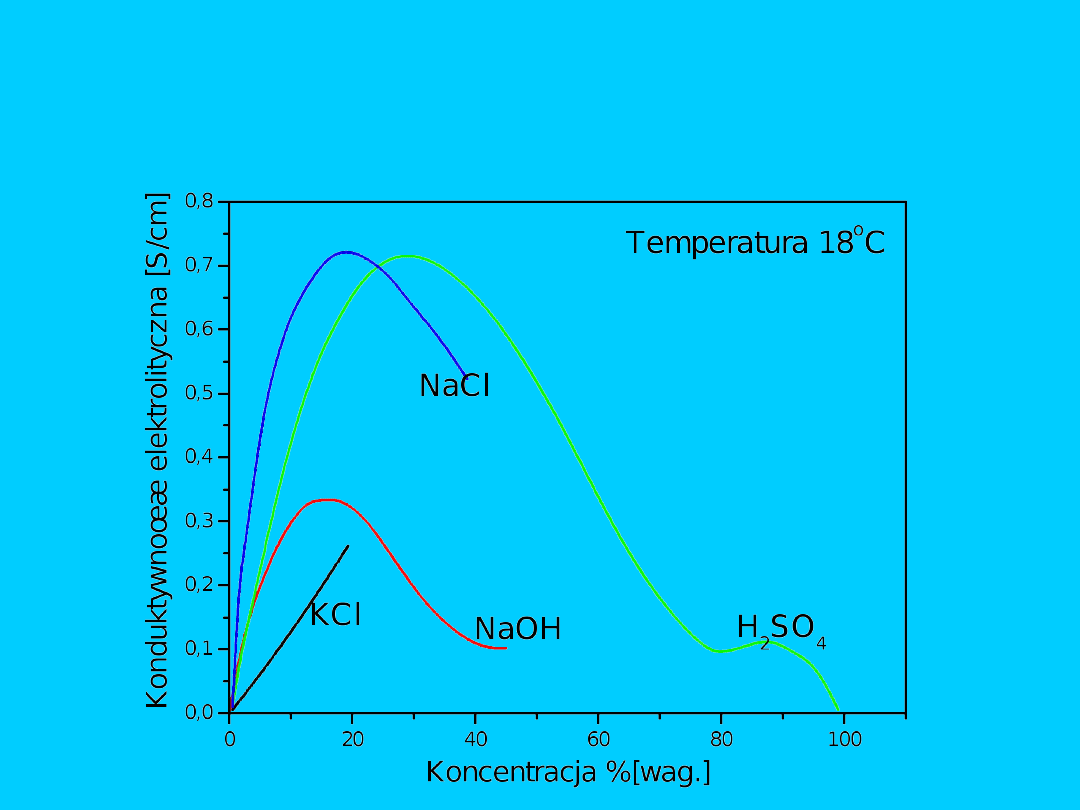
Zależność konduktywności elektrolitów od koncentracji w stężonych
roztworach wodnych
Konduktometria klasyczna

Konduktometria klasyczna
Zastosowanie
Oprócz ogólnie znanych przykładów wykorzystania
metod konduktometrii klasycznej (pomiar stopnia
zasolenia oraz analiza miareczkowa), dzięki dużej
czułości (na poziomie 10
-7
– 10
-6
mol/dm
3
), są one
stosowane do badania wielu procesów chemicznych i
biologicznych, m. in.:
- do wyznaczania stopni i stałych dysocjacji
elektrolitów słabych,
- do wyznaczania iloczynów rozpuszczalności soli
trudno rozpuszczalnych,
- do wyznaczania stałych trwałości kompleksów,
- do badania kinetyki procesów dyfuzyjnych,
- do badania rozwoju kultur bakteryjnych,
- w medycynie i inżynierii materiałowej,
- w inżynierii rolniczej.
Konduktometria klasyczna
Zastosowanie (pomiar pH)
0
0,1
0,2
0,3
0,4
0,5
0,6
0
5
10
15
20
25
c*
H
[mol/dm
3
]
c*
H
[mol/dm
3
]
x 10
-3
x 10
-3
Niepewność wskazań przyrządów pomiarowych:
= 0,1 S/cm
pH = 0,02
c*
H
= 7,5x10
-3
mol/dm
3
,
co odpowiada wartości pH = 5,12
c*
H
= 8,4x10
-3
mol/dm
3
,
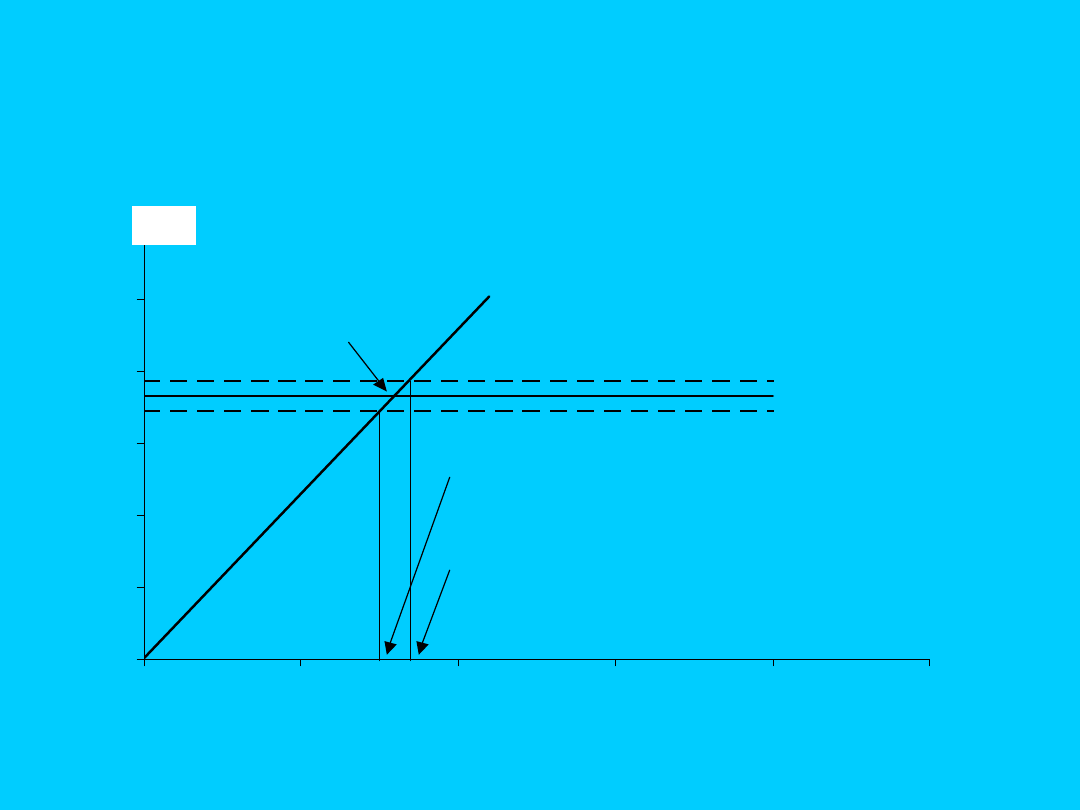
co odpowiada wartości pH = 5,08
c*
H,gr
pH
*
H
c
260
a
,
*
H
c
290
a
,
*
H
c

Konduktometria bezelektrodowa
małej częstotliwości
Konduktometria bezkontaktowa
(bezelektrodowa)
Stosowana w przypadkach, gdy nie jest możliwe
lub wskazane zanurzanie elektrod w
analizowanym roztworze.
Badany roztwór umieszczany jest w
zamkniętym, niemetalowym (np. szklanym,
z tworzywa sztucznego) naczyniu,
umieszczonym pomiędzy uzwojeniami dwóch
transformatorów.
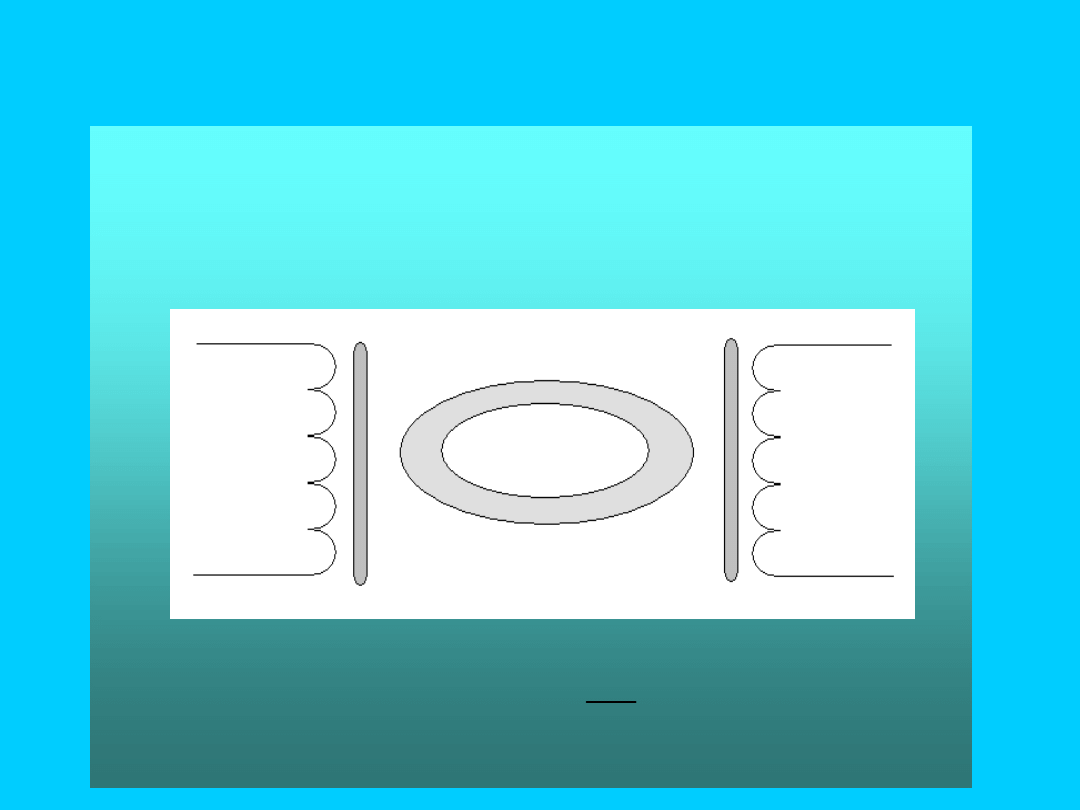
Konduktometria bezelektrodowa
małej częstotliwości
Schemat konduktometru
bezelektrodowego
R
E
k
E
1
2
E
1
E
2
Transformator 1
Transformator 2

Konduktometria bezelektrodowa
wielkiej częstotliwości (oscylometria)
Oscylometria polega na pośrednim pomiarze
admitancji
(przewodności pozornej) lub impedancji (oporu
pozornego) naczyńka pomiarowego zawierającego
badany roztwór, podczas przyłożenia napięcia
przemiennego wielkiej częstotliwości. Zmiany
własności elektrycznych są związane ze zmianami
stężenia, można więc z pomiaru parametrów obwodu
wnioskować o stężeniu roztworu.

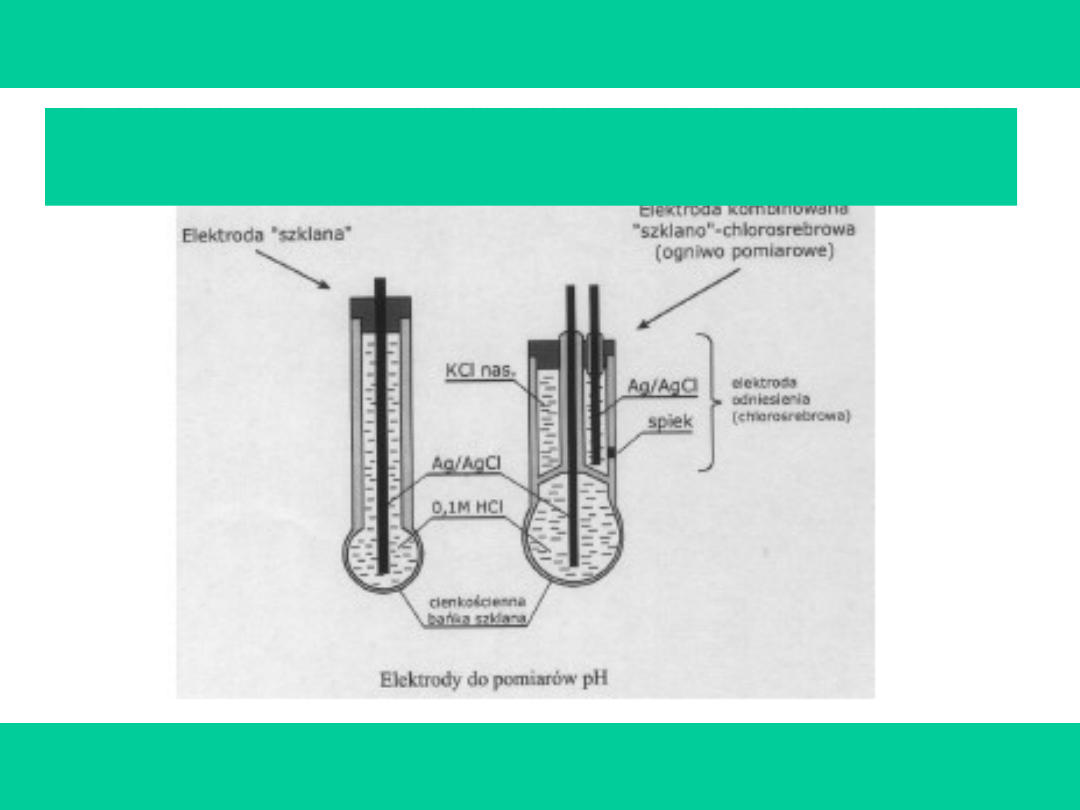
Pomiary konduktometryczne i pehametryczne
należą do podstawowych metod
wykorzystywanych w analizie chemicznej. Ich
prekursorami byli m. in. M. Faraday [1791-1867],
S.A. Arrhenius [1859-1927], F.W. Kohlrausch
[1840-1910] oraz F. Haber [1868-1934], który
wraz z
Z. A. Klemensiewiczem [1886-1963] zbudował
elektrodę szklaną do pomiarów pH
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
Długi pytania na egzamin, PWTRANSPORT, semIII, Elektrotechnika II
PIII - teoria, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektro
Elektronika i elektrotechnika II, SiMR, Elektronika i Elektrotechnika II
elektra P4, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronik
przerzutniki, Studia, semestr 4, Elektronika II, Elektr(lab)
Sprawozdanie z ćwiczenia nr 2(transformator), Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pa
elektra M4, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronik
jasiek pytania, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektr
M2, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II, Elektra, Elektronika i Elek
Sprawozdanie z +wiczenia nr 1, Studia, AAAASEMIII, 3. semestr, Elektrotechnika II, Pack, Pack
Lab Maszyny elektryczne I II ga seria
elektroniczna ii
Wnioski do stanu jałowego trafo, Studia, SiMR, II ROK, III semestr, Elektrotechnika i Elektronika II
układy kombinacyjne, Studia, semestr 4, Elektronika II, cw2
Metodyka wykład II
uklady impulsowe nasze, Studia, semestr 4, Elektronika II, Elektr(lab)
Cw 27maciej, TRANSPORT, SEMESTR VI, ELEKTRONIKA II, elektonika 2 lab(1), Cw 27
więcej podobnych podstron