Czynniki wirusowe i
bakteryjne
przyczyną schorzeń
układu
oddechowego u
bydła
Joanna Cieplak
Wiktoria Borzymowska

Choroby zakaźne układu
oddechowego u bydła:
wywoływane poprzez pojedynczy
specyficzny patogen
zespół oddechowy bydła – jego etiologia
jest wieloczynnikowa

Endemiczne zapalenie płuc cieląt =
enzootyczne zapalenie płuc cieląt =
EBP (Enzootic Bronchopneumonia)
zwana również:
Syndromem oddechowym bydła =
BRDC (Bovine Respiratory Disease
Complex)

Syndrom oddechowy
bydła:
schorzenie układu oddechowego o
etiologii wieloczynnikowej
najczęściej u cieląt 2 – 4 miesięcznych
(okres zaniku odporności biernej)
patogeneza złożona – ważne tu są
interakcje pomiędzy:
- układem immunologicznym zwierzęcia,
- czynnikami zakaźnymi,
- warunkami środowiskowymi.


Czynniki wirusowe
wywołujące EBP:
Wirus parainfluenzy 3 – PI3V
Wirus syncytialny bydła – BRSV
Adenowirusy bydlęce – BAV 1-9
Herpeswirus bydlęcy 1 – BHV 1.1
BVD wirus
Rinowirusy bydlęce – BRV 1-3
Reowirusy

Bakteryjne czynniki
wywołujące EBP:
rodzina Pasteurellaceae:
Mannheimia haemolytica
Pasteurella multocida
Mycoplasmy:
Mycoplasma mycoides
Mycoplasma bovis
niektórzy z autorów zaliczają to czynników
etiologicznych syndromu oddechowego robaki
płucne

Środowiskowe czynniki
wywołujące EBP:
niepełne ukształtowanie
immunologiczne i niezupełny rozwój płuc
warunki bioklimatyczne (temperatura,
wentylacja, itd.)
nadmierne zagęszczenie cieląt
nagłe zmiany paszy
zróżnicowanie wiekowe stada
stres odsadzeniowy
stres transportowy

Ważne!
większość z czynników zakaźnych może
powodować samodzielnie zakażenie
natomiast u bydła infekcje mieszane są
raczej zasadą niż wyjątkiem!
wybuchy choroby i objawy kliniczne
mają charakter sezonowy jesienno -
zimowy

Dlaczego EPB jest zła?
średnio 25-50 % cieląt choruje w
pierwszym roku życia
koszty to suma strat związana ze:
śmiertelnością
kosztami terapii medycznej
zmniejszonych przyrostów (wysoki
współczynnik wykorzystania paszy)

Wirus parainfluenzy 3 – PI3V
Szeroko rozpowszechniony u dzikich i
domowych przeżuwaczy oraz u ludzi
(inne warianty antygenowe)
Zakażenie latentne – „odporność
niema”
Najbardziej narażone
niezabezpieczone i niechronione
już odpornością siarową cielęta

Wirus parainfluenzy 3 – PI3V
-
Czasem groźny też dla młodych i
dorosłych, z dziedzicznym poziomem
przeciwciał we krwi
-
Niekorzystne warunki środowiskowe
mają udział w chorobotwórczości
-
Wikła łagodne przypadki wirusowo-
nieżytowego enzootycznego zapalenia
płuc

Wirus parainfluenzy 3 –
PI3V
patogeneza:
Uszkadza rzęski nabłonka oddechowego
Wpływa na makrofagi pęcherzykowe
Wikła zakażenia BRSV, mykoplazmami,
pastereullami, bakteriami ropnymi ->
rozwój martwicy
Prowadzi to do ciężkiego, włóknikowego
lub ropnego, enzootycznego zapalenia
płuc i ich rozedmy
Wywołuje też ronienia
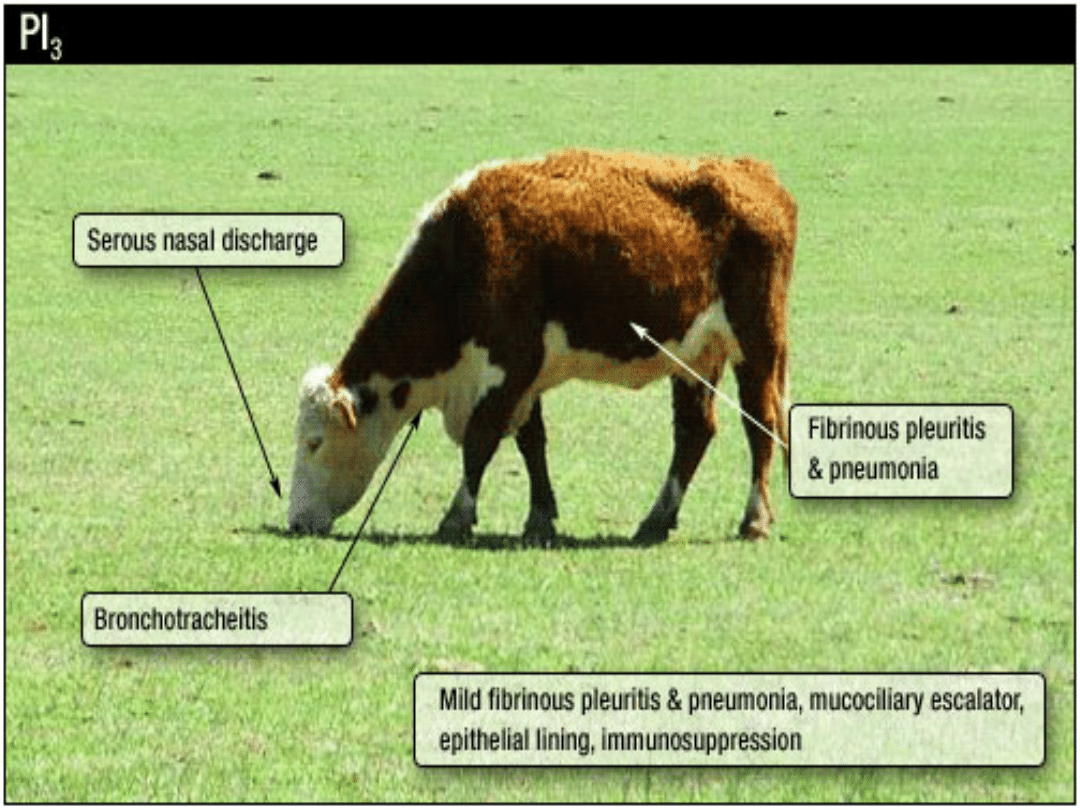

Wirus parainfluenzy 3 –
PI3V
wykrywanie:
Histopatologicznie: zapalenie oskrzeli,
oskrzelików i płuc (neutrofile, proliferacja
nabłonka płuc, wzrost liczby komórek CLARA)
Badanie surowicy lub wysięk z nosa
metodami HAH, AGID, ELISA – szukamy IgA
lub IgG – najlepiej 4 tyg. po zakażeniu
Wirus i jego antygeny wykrywalne także we
wczesnej fazie zakażenia w wymazie z nosa,
tchawicy
W tkankach dotkniętych chorobą – hodowle
komórkowe (efekt cytopatyczny)
IF i IPMA

Wirus parainfluenzy 3 –
PI3V
szczepienia:
Szczepionki donosowe lub paraenteralne
Inaktywowane lub żywe
Szczepionki wielokomponentowe
Jednak ważniejsze odpowiednie warunki
bytowe
W sytuacjach stresowych warto podać
cielętom preparaty immunomodulujące
(wzrost produkcji interferonu)

Adenowirusy bydlęce – BAV
1-9:
Bardzo szeroko rozpowszechnione
Należą do 9 różnych grup antygenowych
2 podgrupy serologiczne
Izolowane z przypadków ostrego zapalenia górnych dróg
oddechowych
Wirusy cytopatyczne
Wrażliwe młode zwierzęta i cielęta (3-4 miesiące)
Źródło zakażenia: latentni nosiciele i nowe w stadzie,
chore zwierzęta (ich kał, mocz, wydzieliny z nosa i oczu)
Zakażeniu sprzyja słaba odporność siarowa, zakażenia
innymi patogenami, złe warunki środowiskowe

BAV 1-9:
Atakują układ oddechowy, co objawia się
(po 7-10 dniach od zakażenia) :
-
Wypływem z nosa
-
Dusznością
-
Gorączką
-
Wypływem z oczu
-
Tachykardią
-
Apatią
-
Utratą masy ciała

BAV 1-9:
Rozwój pneumoenteritis – większa
śmiertelność
Oprócz schorzeń układu oddechowego
BAV powodują
- zapalenie jelit (szarożółta biegunka)
- zapalenia wielostawowe
- ronienia
- zaburzenia płodności

BAV 1-9
Przebieg zakażenia dorosłych zwierząt
od bezobjawowo do ostrego zapalenia
płuc
Zwykle tylko wychudzenie, spadek
produkcji mleka, kaszel

BAV 1-9
wykrywanie:
AP: przebudowa i zgrubienie tkanki płucnej,
rozedma, a gdy wikłają pasterele pojawia się
ropa i włóknik, wirus wykrywalny dzięki IFA
Histopatologicznie: zapalenie pęcherzyków
płucnych, zapalenie proliferacyjno-
obstrukcyjne oskrzelików, śródmiąższowe
zapalenie płuc, wtręty komórkowe
Wirus obecny w wydzielinie z nosa, w kale,
punktatach ze stawów (SN, ELISA, AGID)

BAV 1-9
szczepienia:
Duży problem, więc szczepimy
Szczepionki przeciw EBP zawierają
komponenty przeciwdziałające BAV
Przeciwciała głównie powierzchniowe (na
błonach śluzowych układu oddechowego), nie
w surowicy
Jedynie okresowa odporność
1.
Szczepimy matkę w ostatnim trymestrze ciąży,
dwukrotnie, w odstępie 3-4 tygodni, cielę w 6-8
tyg. Życia, powtórzenie w 10-12 tygodniu życia
2.
Szczepimy wyłącznie cielę, w 6-8 tyg. Życia,
powtórzenie po 4-6 tygodniach

Bydlęcy wirus syncytialny
– BRSV
Pneumowirus, rodzaj Paramyxoviridae, RNA-
wirus
Szeroko rozpowszechniony u domowych i dzikich
przeżuwaczy (Europa, Azja, Ameryka)
Powinowactwo do dolnych dróg oddechowych,
Główny czynnik wikłający EBP
Zakażenia bezobjawowe, nosicielstwo
Jednak często dochodzi do uaktywnienia wirusa
(zimno, transport, nowe zwierzęta w stadzie, za
duża obsada, kwasica metaboliczna, obecność
drobnoustrojów chorobotwórczych i wirusa BVD-
MD); prowadzi to do dużych strat ekonomicznych

Bydlęcy wirus syncytialny
– BRSV - patogeneza
Przekazywany drogą kropelkową
Podgrupy A, B i AB (A i B wywołują cięższe
zachorowania)
Uszkadza nabłonek i rzęski błony śluzowej
układu oddechowego, upośledza lokalne
mechanizmy odpornościowe dróg
oddechowych
Namnaża się w błonie śluzowej i
pneumocytach, co prowadzi często do
rozedmy i ostrego przebiegu choroby

Bydlęcy wirus syncytialny
– BRSV – odporność
zwierząt
Większość dorosłego bydła – ochrona aktywna
„Stille Feiung” – odziedziczone przeciwciała
Zwierzęta te chronione są przed zachorowaniem,
ale nie przed namnażaniem się w ich organizmie
wirusa i nie przed siewstwem
Głównie rola IgA – na powierzchni błon
śluzowych
Nie dochodzi do nabycia odporności
wewnątrzmacicznie, więc przeciwciała od
serododarnich matek są przekazywane cielętom
w siarze
Mimo tego cielęta w wieku 2-5 miesięcy są już
podatne na zakażenie BRSV

Bydlęcy wirus syncytialny
– BRSV – odporność
zwierząt
W stadzie wrażliwym zakażenie do 100%,
objawy kliniczne u 50%, śmiertelność 10-
20%
W stadach mlecznych zakażenie
rozprzestrzenia się w ciągu 3-10 dni, a w
stadach mięsnych w ciągu kilku miesięcy
(różne warunki chowu)
Najbardziej wrażliwe cielęta, w wieku 2-3
miesięcy najcięższy przebieg choroby,
zwłaszcza u ras mięsnych

Bydlęcy wirus syncytialny
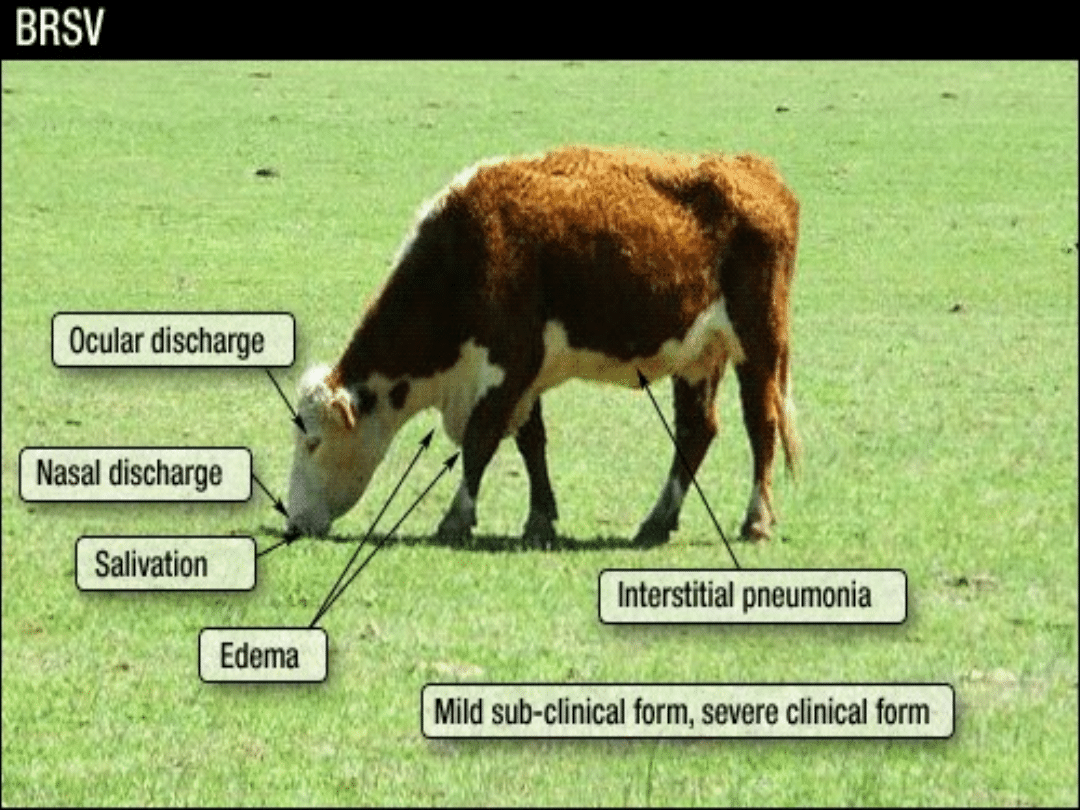
– BRSV – objawy kliniczne
Objawy pojawiają się w 6-12 dni po zakażeniu (często dopiero po
wytworzeniu przeciwciał)
U cieląt zakażonych latentnie objawy są zauważalne z opóźnieniem
Postać URT (lżejsza) i LRT
Inny podział to wczesny i późny syndrom BRSV
-> wczesny: cielęta, które od okresu wiosennego do letniego są
jeszcze cielętami ssącymi; mało zwierząt choruje i straty są
niewielkie
-> późny: w okresie 3 tyg. do 3 mies. od odsadzenia
Zaburzenia oddechowe pierwotnie obstrukcyjne, później
restrykcyjne
Nieprawidłowy prawo-lewy przepływ krwi
Znaczne zaburzenie pomiędzy wentylacją a perfuzją płuc
Zmniejszenie pobierania paszy i wody, suchy kaszel, gorączka,
apatia, tachykardia, tachypnoe, surowczy wypływ z oczu i nosa,
obrzęk powiek i skóry głowy – objawy sugerują zakażenie tylko
BRSV, choroba szybko ustępuje

Bydlęcy wirus syncytialny
– BRSV – objawy kliniczne
Jeśli nie ustąpi – współzakażenia (PI3V, BAV, BVD-MD, M.
haemolytica), rozedma płuc -> pienista ślina, silna
duszność mieszana bądź wydechowa
Charakterystyczna postawa: wyciągnięta głowa,
oddychanie przez jamę ustną, wysunięty język
Osłuchowo zaostrzone szmery wydechowe, zaburzenia ze
strony układu krążenia
Opukowo stłumienia i odgłosy bębenkowe
Sinica błon śluzowych
Odwodnienie
Odma podskórna przedpiersia
Kaszel może utrzymywać się długo po wyleczeniu
Śmiertelność ok. 30 %

Bydlęcy wirus syncytialny
– BRSV – objawy kliniczne
Zakażenia u sztuk dorosłych
-> jeśli dorastały w stadzie, w którym
wirus krążył, nie wykazują objawów
-> jeśli były nieszczepione lub w pełni
wrażliwe – duszność pojawia się po 1-2
h, zapaść i śmierć

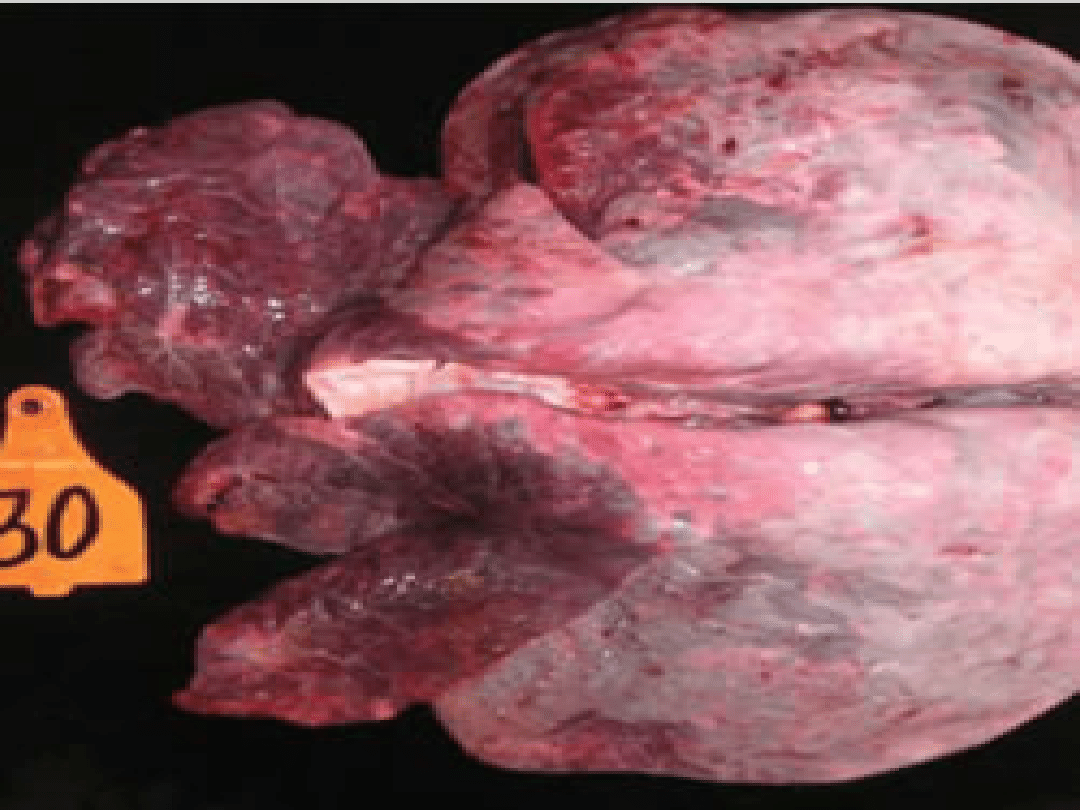
Bydlęcy wirus syncytialny
– BRSV - AP
Płuca z przerośniętą i pogrubioną tkanką
Krwawienia podsurowiczówkowe i
podśluzówkowe
Rozedma
Płuca z krwistym wysiękiem, błona śluzowa
pokryta pienistym wysiękiem
Histopatologicznie: wysiękowe/martwicowe
zapalenie płuc, śródmiąższowe zapalenie
płuc, wielojądrzaste syncytialne komórki
nabłonkowe, eozynofile, wtręty komórkowe

Bydlęcy wirus syncytialny
– BRSV – objawy kliniczne
Rozpoznanie powinno opierać się o:
1. izolację wirusa lub wykrycie
antygenu w tkankach
2. badanie serologiczne
3. badanie histopatologiczne

Bydlęcy wirus syncytialny
– BRSV - diagnostyka
Serokonwersja – pary surowic (po 4-6
dniach) (IF, ELISA, IHA, VN)
Obecność antygenów w wymazie z nosa,
tchawicy (IFA, PLA, DIF, ELISA, RT-PCR)
Próby zbiorcze mleka (ELISA)
rozmazy z nosa pobrane z głębokich
obszarów, z domieszką krwi
Popłuczny z tchawicy, płuc
Bioptaty tkanki płucnej (IF, PCR)

Bydlęcy wirus syncytialny –
BRSV – diagnostyka
różnicowa
IBR/IPV
Pastereloza
Robaczyce płuc
Inne wirusowe choroby układu
oddechowego o ostrym przebiegu

Bydlęcy wirus syncytialny
– BRSV - leczenie
Izolacja chorych zwierząt
Dobre warunki
Antybiotyki
Leki antyhistaminowe
NLPZ
Glikokortykosteroidy (tylko ciężkie
przypadki obrzęku płuc)
Wlewy dożylne

Bydlęcy wirus syncytialny
– BRSV - profilaktyka
Osobne utrzymywanie różnych grup
wiekowych zwierząt
Kwarantanna nowo zakupionych
zwierząt
Zagęszczenie nie większe niż 10
osobników w boksie

Bydlęcy wirus syncytialny
– BRSV - profilaktyka
Szczepienia: modyfikowany żywy wirus – i.v., i.m., wirus
inaktywowany
Ryzykowne – nadwrażliwość na podobny wirus HRSV –
wystąpienie ciężkiej, śmiertelnej postaci choroby
Szczepimy zdrowe osobniki, powyżej 3 m.ż., uprzedzając
sytuacje mogące wywołać zachorowanie, zwłaszcza w
stadach, w których badania serologiczne nie wykazały
obecności wirusa
2 dawki w przeciągu 3-4 tygodni
Szczepienie przypominające co roku
Przeciwciała siarowe nie chronią w pełni cielęta przed
zakażeniem
Można szczepić krowy cielne

Bydlęce rinowirusy (BRV
1-3):
Pikornaviridae
Obecne w błonach śluzowych układu
oddechowego zwierząt chorych i
zdrowych
3 różne typy
Szeroko wśród bydła rozpowszechnione
Patogenność niewysoka (nawet, gdy
infekcje mieszane)

BRV 1-3:
Infekcje z reguły podkliniczne
Czasem jednak występują objawy:
- wypływ z nosa
- kaszel
- gorączka
- apatia

BRV 1-3
wykrywanie:
AP: liczne, drobne ogniska martwicze
nabłonka nosa i tchawicy, niewielkie
obszary objęte zapaleniem
śródmiąższowym płuc
Histopatologicznie: owe zapalenie objawia
się zgrubiałymi pęcherzykami płucnymi,
limfatycznym naciekiem okołooskrzelowym,
wysiękiem, rozedmą, niedodmą
Badanie surowicy metodą IF

BRV 1-3
szczepienia:
Pewnie szczepimy bo
Odporność siarowa praktycznie nie
istnieje

Reowirusy:
Szeroko rozpowszechnione u bydła (Ameryka,
Afryka, Europa, Azja), 3 serotypy
Udział w powodowaniu EBP prawdopodobnie
niewielki, błonę śluzową układu oddechowego
kolonizują raczej orthoreowirusy, ułatwiając
wnikanie bakteriom
Zakażenia zazwyczaj bezobjawowe (Respiratory
Enteric Orphan)
Gdy dołączy się pasterela – objawy kliniczne
Kuczmany – wektory i przenosiciele mechaniczni

Reowirusy
Zakażenie drogą oddechową lub
alimentarną
Namnażają się w cytoplazmie komórek
nabłonkowych
Wiremia trwa około 1 tygodnia, wirus
wykazywalny w wydzielinie z nosa i worka
spojówkowego
Tropizm do małżowin nosowych, tchawicy,
płuc, migdałków, węzłów chłonnych
Synergizm z Chlamydophila sp.

Reowirusy
Cielęta zakażano eksperymentalnie
reowirusami bydlęcymi i ludzkimi,
objawy:
- gorączka,
- śluzowo-ropny wyciek z nosa
- biegunka
- zapalenie płuc, na ich powierzchni
krwinki tworzyły „krwawe jeziorka”

Reowirusy
Wymaz lub wydzielina z jamy nosowej
PCR
Hodowla komórkowa
Badanie par surowic (pierwsza para
równocześnie z wymazem, druga po 2-3
tyg.)

Reowirusy – szczepienia:
Odporność siarowa do 5 m.ż.
Komponent w szczepionkach przeciw
EBP
Skuteczność trudna do oceny

Rodzina Pasteurellaceae:
Mannheimia haemolytica serotyp A1
(niedawno P. haemolytica)
Pasteurella multocida
zarazki oportunistyczne – mogą
kolonizować górne odcinki układu
oddechowego bydła i są tu prawidłową
florą
G – ziarniako-pałki
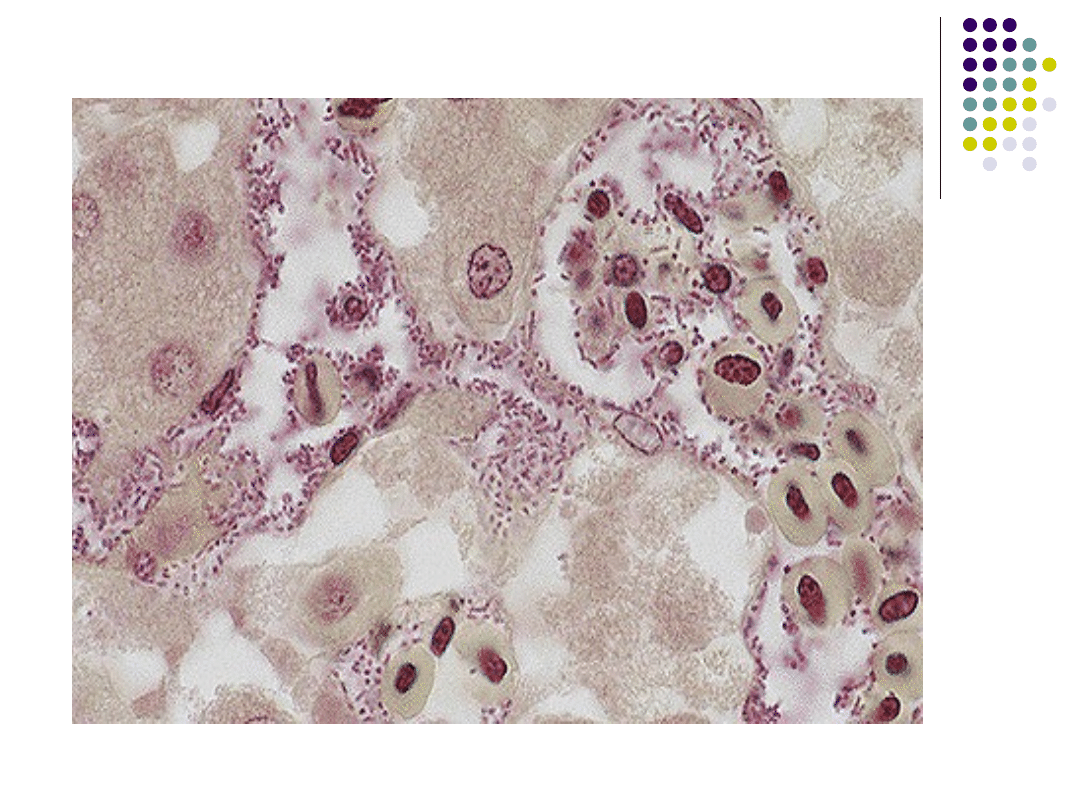

M. haemolytica, zakażenia
pierwotne:
SHIPPING FEVER – gorączka transportowa
musi tu być drobnoustrój o silnej
zjadliwości = osłabienie zwierza
często obserwowane u zwierząt po
transporcie (STRES!) w 7-10 dniu
utrzymuje się około 3 tygodnie
czynnikiem predysponującym jest też
łączenie zwierząt w różnym wieku lub z
różnych obór (zakażenie różnymi
serotypami)

M. haemolytica,
zakażenia wtórne:
wchodzą w skład RDS
ważne tu pierwotne procesy
umożliwiające wniknięcie do dolnych
dróg oddechowych (u zdrowych
efektywnie usuwane poprzez rzęski,
makrofagi itd.)
ważne też te wszystkie czynniki
środowiskowe o którym mowa już była

Mannheimia haemolytica
A1 objawy kliniczne:
odpowiedzialna w większości za najcięższe
postacie kliniczne choroby – często z
szybkim zejściem śmiertelnym
objawy już po 1 – 5 dniach od zakażenia
postaci:
posocznicowa
- u najmłodszych zdarza się
- szczególnie, gdy wcześniej było zakażenie
wirusowe
- widać nagłe pogorszenie stanu zdrowia i
śmierć

Mannheimia haemolytica
A1 objawy kliniczne:
postać płucna
- najczęściej
- wysoka gorączka (40 – 41°C)
- śluzowo-ropny i ropny wypływ z nosa
- łzawienie, piana na pysku
- bolesny kaszel i objawy ostrej duszności
(pozycja odciążająca)
- tachycardia, świszczący oddech
- oczywiście osłabienie, apatia, niechęć do…
jedzenia… :P
- i co ciekawe czasami wodnista biegunka

Mannheimia haemolytica
A1 objawy kliniczne:
postać obrzękowa:
- rzadko bardzo
- u cieląt starszych
- obrzęki okolicy krtani, gardła, przedpiersia,
odbytu i ewentualnie płuc
śmiertelność 1 – 10%
jeśli nie kończy się śmiercią – po 5-15
dniach przechodzi w postać przewlekła
(upośledzenie rozwoju zwierząt)

Mannheimia haemolytica
A1 czynniki zjadliwości:
leukotoskyna LKT:
antyfagocytarny polisacharyd kapsularny CP
białka błony zewnętrznej kontrolowane
jonem Fe (
iron regulatedouter membrane proteins IROMPs
)
sialoproteinaza
LPS
fimbrie – ułatwiają adherencję do komórki
gospodarza

Mannheimia haemolytica A1
główny bohater
LEUKOTOKSYNA:
egzotoksyna o szczególnym powonowactwie
do leukocytów
zwana rzadziej cytotoksyną
wiąże się też z makrofagami płucnymi,
neutrofilami, płytkami krwi
szczyt produkcji 6 h po zakażeniu
wiąże się z CD 18 i uruchamia
wewnątrzkomórkowe szlaki przewodzenia,
co daje rozpad tych komórek

Mannheimia haemolytica A1
główny bohater
LEUKOTOKSYNA:
rozpad komórek na dwóch drogach:
niekontrolowane wnikanie jonów Ca do komórki
- ↑ ciś. osmotycznego i lizę komórki
jednocześnie aktywuje fosfolipazę A2 i
uwalnianie kwasu arachidonowego – czyli
wszystkie mediatory prozapalne
w niskich stężeniach pobudza leukocyty, a
następnie zmusza je do apoptozy

Mannheimia haemolytica A1
główny bohater
LEUKOTOKSYNA:
w wyniku rozpadu leukocytów mamy do
czynienia z uwalnianiem:
enzymów proteolitycznych
wolnych rodników
co doprowadza do zaostrzenia stanu
zapalnego i rozwoju zmian
patologicznych w tkance płucnej
czynne zakażenia wirusowe zwiększają
wrażliwość leukocytów na LKT

Mannheimia haemolytica
A1 AP:
włóknikowo – matwicowe zapalenie płuc
płuca marmurkowate – naprzemiennie
rozmieszczone obszary:
świeżych czerwonych i starych czarnych wybroczyn
zwątrobiałych szarych
żółtawych objętych martwicą płatów płuc
granice między zmianami wyraźnie
zaznaczone przez zwłókniałe lub
obrzęknięte przegrody międzypłacikowe
są też obszary objęte rozedmą

Mannheimia haemolytica
A1 AP:
zmiany symetryczne, w przednich
płatach płuc
miejscowe lnn. obrzęknięte, wilgotne na
przekroju (bo zastój chłonki)
wysięk zapalny włóknikowo – ropny
włóknikowe zapalenie opłucnej
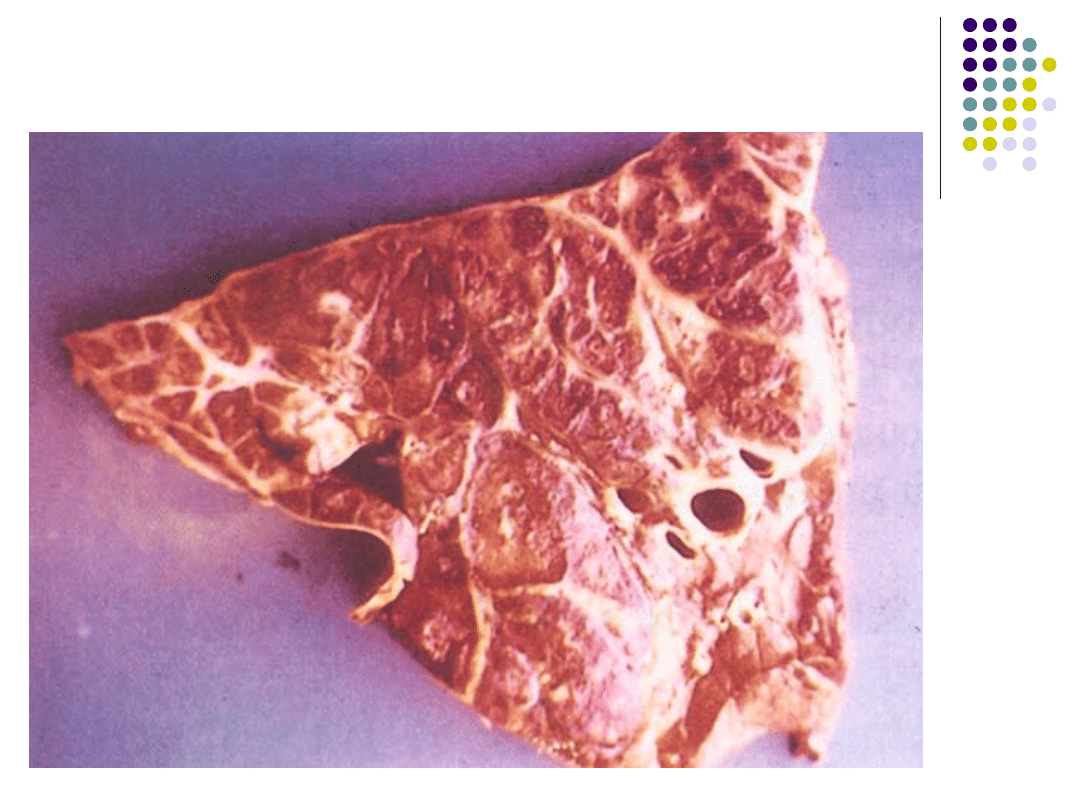
włóknikowo – matwicowe bronchopneumonia

Mannheimia haemolytica
A1 rozpoznanie:
badanie hodowlane oraz antybiogram!
materiał pobieramy pośmiertnie z płuc lub
przyżyciowo z dolnych dróg oddechowych lub z
płynu uzyskanego z płukania pęcherzyków
płucnych
to bardzo ważne – gdyż Mannheimia zasiedla
górne drogi oddechowe zdrowego bydła!
mogą to być też wycinki narządów miąższowych
pobieraj na podłoża transportowe bo ona
wrażliwa
badanie sekcyjne
badania serologiczne są tu bez sensu

Mannheimia haemolytica
A1
postępowanie:
ważne żeby rozpocząć antybiotykoterapię
nawet przed antybiogramem – skierowaną
przeciw M. haemolytica
antybiotykoterapia powinna być
przedłużona aby zminimalizować
możliwość powstania ropni w płucach (przy
postaci przewlekłej)
stosujemy też leki przeciwzapalne – gdy
przekrwienie i obrzęk płuc duże

Mannheimia haemolytica
A1 szczepionki:
wykorzystuje się produkcję przeciwciał
przeciwko IROMPs – Ig produkowane w
odpowiedzi niszczą komórki bakteryjne
na drodze fagocytozy i aktywacji
dopełniacza
najważniejsze są jednak Ig przeciw LKT
zaleca się immunizację matek cieląt
oraz cieląt już w drugim tygodniu życia

Mannheimia haemolytica
A1 szczepionki:
do szczepionek dodaje się podwójnego
adiuwantu – aby przezwyciężyć Ig
matczyne i wywołać odpowiedź
immunologiczną
starsze zwierzęta szczepi się aby
zmniejszyć siewstwo patogenów

Mannheimia haemolytica
A1 szczepionki:
Bovilis Bovipast Rsp (zawiera inaktywowany
BRSV, PI3 oraz M. Haemolytica)
Pastobov (antygen A1 Pasteurella
haemolytica)
podawać 2 tygodniowym cielętom 2 x w
odstępie 4 tygodni – s.c. na szyi
odporność 12 miesięcy

Mannheimia haemolytica
A1 szczepionki:
Hiprabovis pneumos:
M.haemolytica A1 – LKT
naktywowany szczep H. somni
u cieląt powyżej 2 miesięcy, dwie dawki
w odstępie 21 dni
bolesne podanie + zwyżka temperatury
po podaniu

Pasteurella multocida:
może być pierwotnym lub wtórnym
czynnikiem zakaźnym
w postaci pierwotnej – najczęściej jako
posocznica krwotoczna (zaraza bydła i
dziczyzny – ch. Bollingera)
wtórnie głównie serotyp A3
komensal – izolowany zarówno od
zdrowych jak i chorych
ważne są tu czynniki usposabiające do
zakażenia

Pasteurella multocida,
dlaczego jest zła:
wtórne zakażenia mają bardzo
gwałtowny przebieg
duża zachorowalność 50% i dosyć
wysoka śmiertelność 10%
chociaż w mniejszym stopniu uszkadza
układ oddechowy niż M. haemolytica –
występuje znacznie częściej

Pasteurella multocida,
czynniki zjadliwości:
polisacharyd z kwasem hialuronowym –
o charakterze haptenu – pozwala na
niekontrolowane namnażanie się
bakterii, gdyż nie wywołuje odpowiedzi
immunologicznej

Pasteurella multocida AP:
ropne odoskrzelowe pneumonie, bez
wytwarzania włóknika
przedniobrzuszne zmiany konsolidacyjne :P
(zagęszczenia) oraz ropny wysięk w
drogach oddechowych
często pogłębia zmiany zapoczątkowane
przez M. haemolytica, ale tu zapalenie
bardziej wyrażone, opłucnowe zmiany mniej
pospolite i nie ma za bardzo zakrzepicy
naczyń limfatycznych śródmiąższowych
oraz martwicy

Mykoplazmy:
patogeny obligatoryjne:
M. mycoides - CBPP
M. bovis – obligatoryjny patogen układu
oddechowego
patogeny fakultatywne:
M. bovirhinis,
M. dispar,
M. arginini,
Archeoplasma laidlawii
ureaplasmy
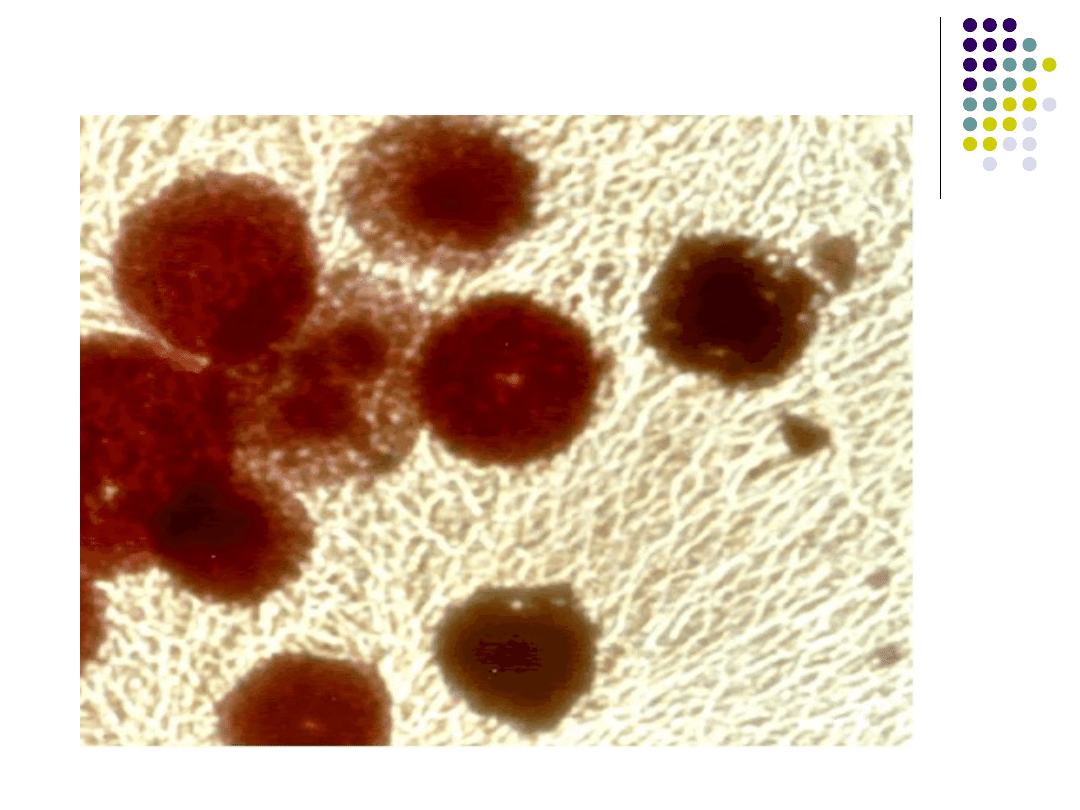
M. bovis

Mykoplazmy:
bakterie pozbawione ściany komórkowej, za
to z potrójną błoną komórkową (więc ich
kształt jest niestabilny)
bardzo wrażliwe na czynniki środowiskowe –
najbardziej na wysychanie i światło
przenoszone wraz z wydzieliną z nosa,
moczem, nasieniem, mlekiem od zdrowych
nosicieli – mogą zasiedlać śluzówki układu
oddechowego, rozrodczego, wymienia lub
oczu
rosną tylko na podłożach wzbogaconych

Mycoplasma mycoides
subsp. mycoides:
Zaraza płucna bydła (Pleuropneumonia
contagiosa bovum) =
CBPP (Contagious bovine
pleuropneumonia)

Mycoplasma mycoides
subsp. mycoides,
podtypy:
SC – small colonies – wywołuje CBPP
(bardzo małe kolonie – widoczne dopiero
pod mikroskopem)
LC – large colonies – patogenny
szczególnie dla owiec i kóz; czasami
stwierdzany przy zapaleniu spojówek i
stawów u cieląt oraz wymienia u krów

Zaraza płucna bydła:
znana od XVII wieku
dotyczy bydła i gatunków pokrewnych:
bawoły, bizony, renifery
wrażliwość związana z rasą – bardziej
podatne na zakażenie bydło europejskie
niż afrykańskie
obecnie stacjonarnie występuje w Azji;
endemicznie w Portugalii, Hiszpanii,
Włoszech - i jej przebieg jest raczej
łagodny

Zaraza płucna bydła,
zakażenie:
kontakt bezpośredni – droga aerogenna,
kropelkowa
bardzo ważni są tutaj nosiciele –
odpowiedzialni za rozprzestrzenianie
zakażenia
źródło mykoplazm:
wydzieliny z dróg oddechowych
mocz
lochie poporodowe
nasienie
wydzieliny spod napletka

Zaraza płucna bydła,
zakażenie:
inkubacja: 1 tydzień – 3 miesiące (3 – 6
tygodni)
w tym czasie powoli rozwijają się zmiany w
płucach oraz następuje wydalanie bakterii do
środowiska
zachorowalność zależnie od czynników
sprzyjających: 10 – 100%
śmiertelność – 50%
zwierzęta, które przeżyły: nosiciele i siewcy!

Zaraza płucna bydła,
objawy kliniczne ostre:
początkowo apatia, brak apetytu, spadek
kondycji oraz gorączka
zwierzęta odstają od stada
dochodzi do nadmiernego przekrwienia płuc –
duszność, pozycja odciążająca (odstawione
łokcie), sztywny chód, wygięty grzbiet
oddech jest płytki i może towarzyszyć mu
wokalizacja
czasami pojawiają się dłużej trwające okresy
bezdechu
pojawia się kaszel spontaniczny, łatwo go też
wywołać lekkim opukiwaniem ściany klatki
piersiowej

pojawia się początkowo zapalenie oskrzeli i
oskrzelików, następnie tkanki międzypłacikowej
(obrzęk i zakrzepy i drobne ogniska martwicze)
następnie dochodzi do krupowego zapalenia
płuc
pojawiają się obrzęki (szczególnie okolica
przedpiersia)
u cieląt do 6 miesięcy pojawia się zapalenie
stawów z kulawizną
Zaraza płucna bydła,
objawy kliniczne ostre:

stan się pogłębia w wyniku zwątrobienia
płuc i zapalenia opłucnej:
całkowita apatia
atonia przedżołądków
wilgotny bolesny kaszel
wysoka gorączka (41 - 42°C)
osłabienie ogólne
słychać tarcia opłucnowe, świsty i rzężenia
Zaraza płucna bydła,
objawy kliniczne ostre:

po 10 – 15 dniach stan staje się
krytyczny:
zaleganie
zaburzenia oddechowe
śmierć
jeśli zwierzę przeżyje: w tkance płucnej
zostają na zawsze otorbione obszary z
mykoplazmami (sekwestry)
Zaraza płucna bydła,
objawy kliniczne ostre:

Zaraza płucna bydła, objawy
kliniczne podostre i
przewlekłe:
tu zmiany są mniej wyrażone
te zakażenia są częstsze
występuje kaszel i nawracające
zaburzenia oddechowe

CBPP – zmiany AP:
duża ilość klarownego, żółtawego płynu w
jamie opłucnowej zawierającego włóknik
dużo nalotów włóknikowych na opłucnej
trzewnej i ściennej
zrosty listków opłucnowych
obrzęk płuc z typowymi zmianami
krupowego zapalenia płuc w różnych
stadiach rozwoju
obrzęk lnn. śródpiersiowych

CBPP – zmiany AP:
płuca są marmurkowate: zabarwienie tkanki
od różowej do ciemnoczerwonej + starsze
szarożółte – wszystko to pooddzielane
pograbiałymi przegrodami międzypłatowymi
zmiany martwicze: sekwestry o średnicy 1–
20 cm!:
część ulega zwapnieniu
większość zawiera galaretowato-płynne struktury
z mykoplazmami
mogą się okresowo otwierać do światła oskrzeli!

CBPP – zmiany AP:
WAŻNE! płuco lewe i prawe zmienione w
różnym stopniu!!
zmiany są niesymetryczne i przede
wszystkim w płatach przeponowych
histopatologicznie:
zapalenie oskrzeli i pęcherzyków złuszczanie
się nabłonka śluzówki
następnie ciężkie włóknikowe zapalenie płuc i
opłucnej z zakrzepicą naczyń, martwicą płuc i
wypełnieniem płynem obrzekowym

CBPP rozpoznanie:
na podstawie objawów klinicznych oraz AP
szukamy zarazka w materiale
krew
mocz
wymazy z gardła
hodujemy i izolujemy na specjalnych
podłożach
serologicznie IF, precypitacja, PCR, OWD,
ELISA, immunobloting

CBPP leczenie?
CHOROBA ZWALCZANIA Z URZĘDU I
PODLEGAJĄCA OBOWIĄZKOWI REJSTRACJI!!!
leczenie dopuszczalne tylko w krajach,
gdzie występuje stacjonarnie (tylozyna,
enrofloksacyna, spiromycyna)
ty też szczepimy szczepionkami żywymi
atenuowanymi
wszędzie indziej – osobniki chore i nosiciele
– UBÓJ SANITARNY
ważne aby nie zawlec – więc obrót zwierząt
tylko ze stad wolnych + kwarantanna

Mykoplazmy
fakultatywne:
izolowane również od zdrowych zwierząt
często jednak u chorych
są chorobotwórcze u zwierząt z
immunosupresją, zakażonych wirusami
lub pasteurellami
po zakażeniu drogą aerogenną oraz
osłabienia sił obronnych organizmu –
dochodzi do ujawnienia się objawów
chorobowych

Mykoplazmy
fakultatywne, objawy
kliniczne:
zaburzenia oddechowe
kaszel
gorączka
apatia
tachykardia
gdy brak jednoczesnego zakażenia
pasteurellami choroba przebiega łagodnie i
powoduje powstawanie przeciwciał
czasami dochodzi do zapalenia
wielostawowego i synovitis – może
doprowadzić do śmierci

Mykoplazmy
fakultatywne, AP:
w podklinicznych zakażeniach:
nieżytowo-obturacyjne zapalenie oskrzeli
okołooskrzelikowe i okołonaczyniowe
nacieczenie limfocytarne
zapalenie pęcherzyków płucnych (M. dispar)
czasami obszary objęte martwicą, z dużą ilością
leukocytów (M. bovis)
zakażenie z pasteurellką:
wysiękowo – włóknikowe zapalenie płuc

Mykoplazmy
fakultatywne,
rozpoznanie:
badanie hodowlane – podłoża wzbogacone
w pepton, surowicę końską, drożdże
można różnicować gatunki PCR
ważne! uzyskanie wyniku dodatniego nie
wyklucza zakażeń innymi patogenami
wykrywanie antygenów mykoplazmowych w
tkance płucnej IF, ELISA
ważne wyniki całego stada – nie tylko
pojedynczego osobnika

Mykoplazmy, leczenie:
antybiotykoterapia (enrofloksacyna,
danfloksacyna, tiamulina, kanamycyna,
tilmykozyna, oksytetracyklina)
ważne zapewnienie zwierzętom właściwych
warunków zoohigienicznych
izolować nowo narodzone cielęta
bazując na badaniach serologicznych i
kontroli mleka – stwarzać stada wolne od
mykoplzm
za morzami szczepią i.m. lub dotchawiczo
(inaktywowana)


dziękujemy za
wysłuchanie naszego
jąkania:
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
Wyszukiwarka
Podobne podstrony:
NAGLE ZAGROŻENIA W SCHORZENIACH UKŁADU ODDECHOWEGO
Udział pielegniarki w opiece nad pacjentem geriatrycznym w schorzeniach układu oddechowego (POChP) p
Nagle zagrozenia w schorzeniach ukladu oddechowego
CX Leki stosowane w schorzeniach ukladu oddechowego, MEDYCYNA O, Pulmonologia
Pediatria. Schorzenia układu oddechowego, Wykłady, PEDIATRIA
Diagnostyka różnicowa objawów podmiotowych w schorzeniach układu oddechowego
REHABILITACJA DZIECI ZE SCHORZENIAMI UKŁADU ODDECHOWEGO 4
Schorzenia układu oddechowego Ania Wojtyczka
NAGLE ZAGROŻENIA W SCHORZENIACH UKŁADU ODDECHOWEGO
Opieka pielęgniarska w schorzeniach układu oddechowego
Zakażenia wirusowe i bakteryjne układu oddechowego u bydła
Choroby bakteryjne i wirusowe układu oddechowego bydła
Choroby bakteryjne i wirusowe układu oddechowego bydła gr 5B
Czynniki ryzyka występowania chorób układu oddechowego, studia, zdrowie publiczne 3
wirusowe zakażenia układu oddechowego, Mikrobiologia
Diagnostyka wirusowych zakażeń układu oddechowego, Mikrobiologia
więcej podobnych podstron