

a więc pozwalają utrzymać pH roztworu
na
określonym poziomie
a więc pozwalają utrzymać pH roztworu
na
określonym poziomie
wprowadzenia
do nich
niewielkich
ilości mocnych
kwasów czy
zasad
R O Z T W O R Y B U F O R O W E
są to roztwory, które nie zmieniają
wyraźnie
wartości pH, mimo:
rozcieńcze
nia wodą
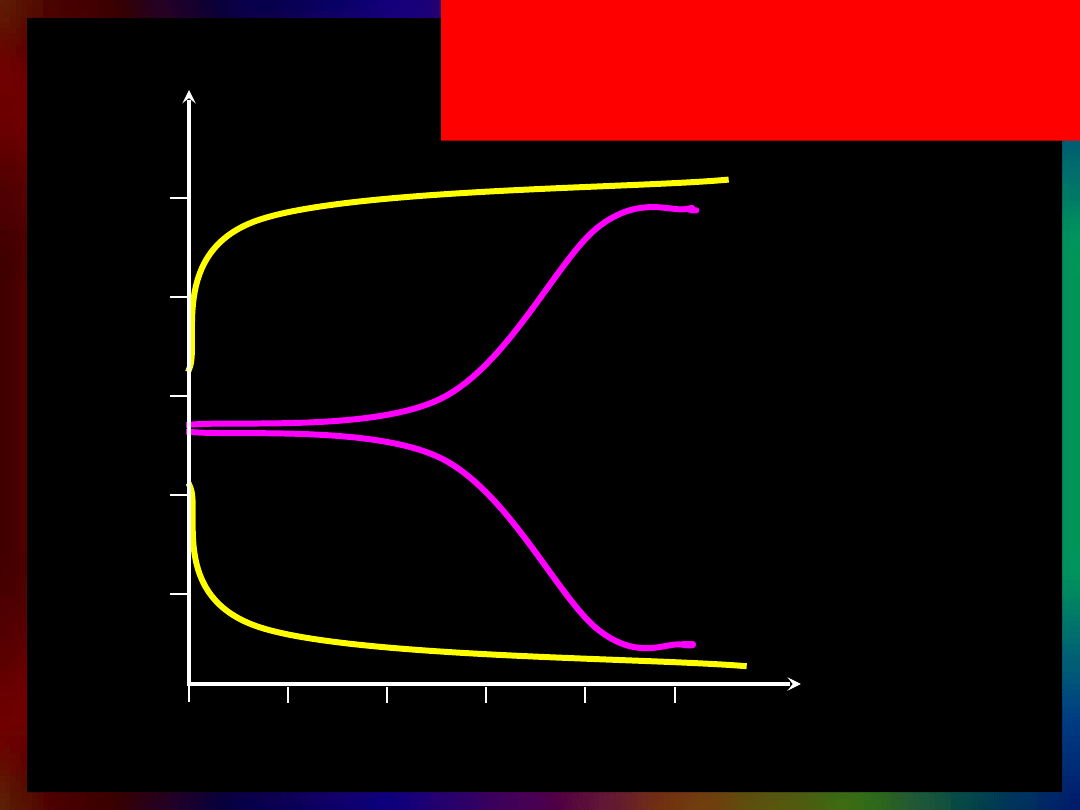
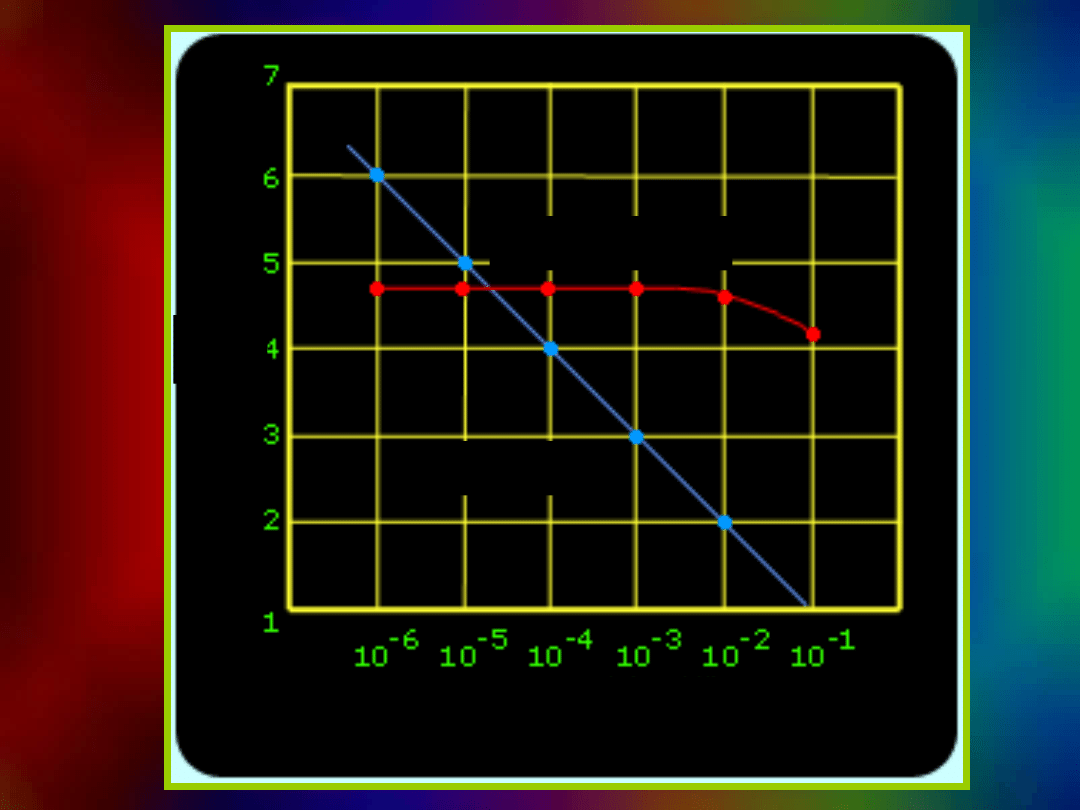
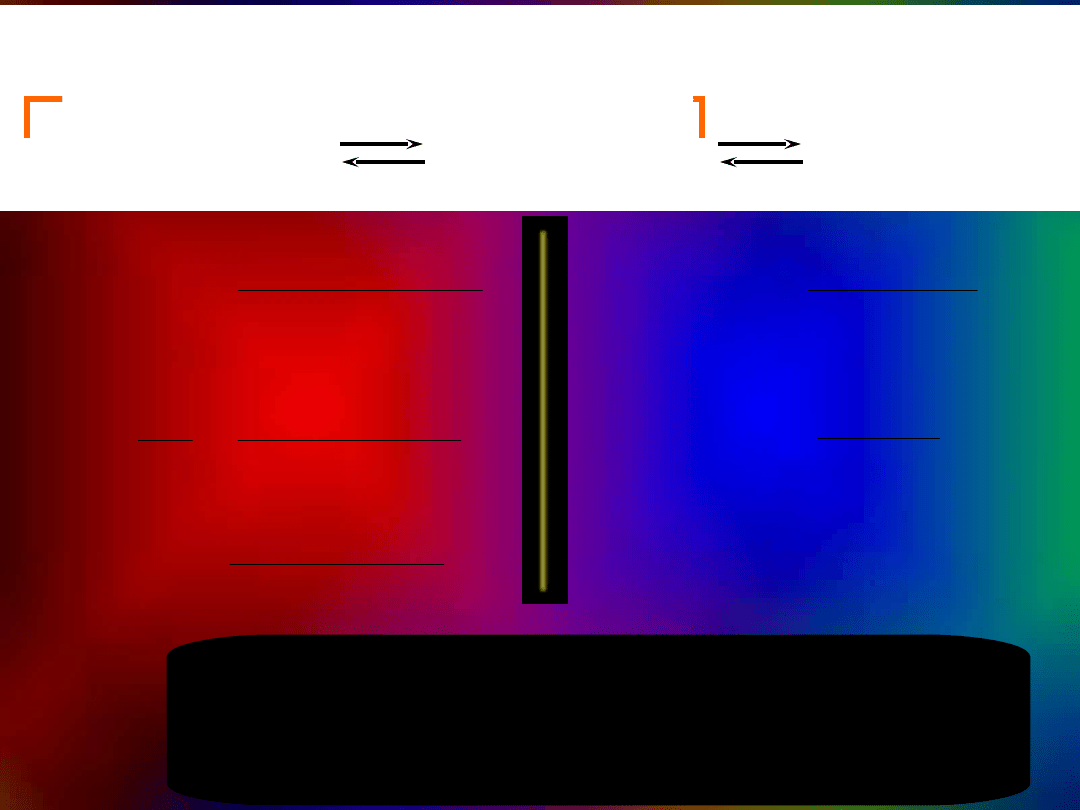
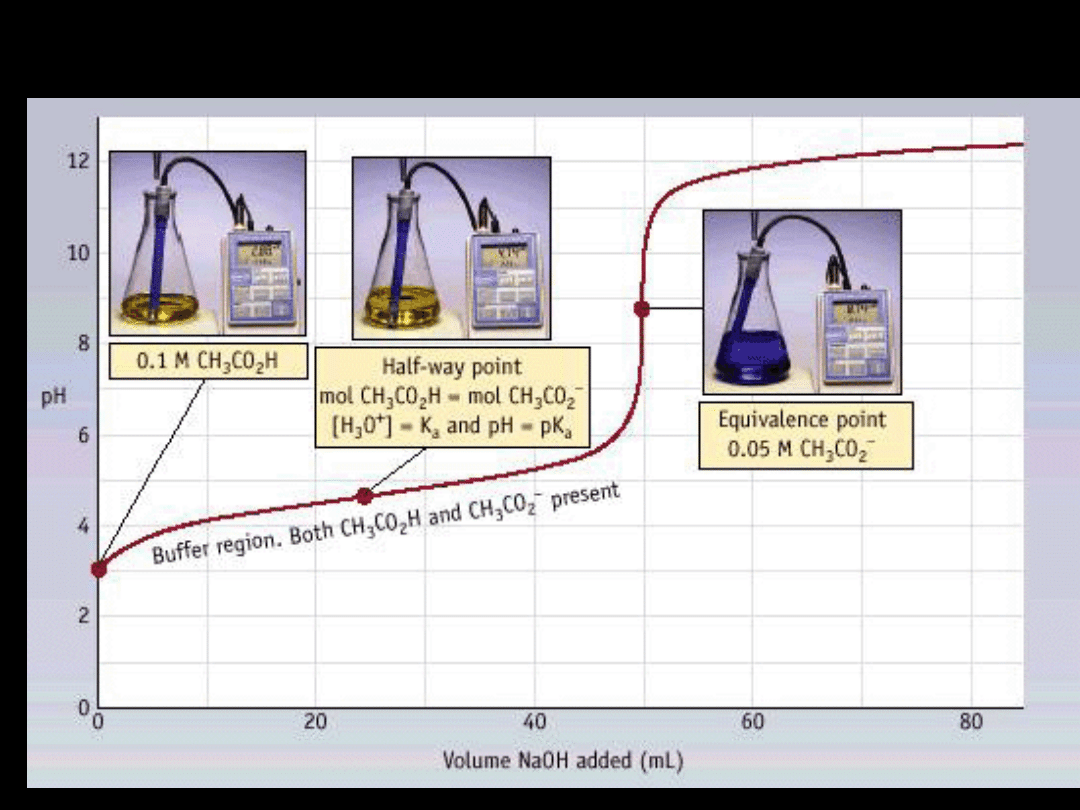
Wpływ mocnego kwasu i mocnej
zasady
na pH wody i buforu
woda + NaOH
bufor +NaOH
bufor + HCl
woda + HCl
pH
objętość/ml
10
50
40
30
20
0
08
10
12
4
6

Najprostsze roztwory
buforowe
są to mieszaniny:
— słabego kwasu i jego soli z
mocną zasadą
(np.CH
3
COOH i
CH
3
COONa)
—słabej zasady i jej soli z mocnym
kwasem
( np. NH
3
.
H
2
O i
NH
4
Cl)
—soli kwasów dysocjujących
wielostopniowo
(np. NaH
2
PO
4
i
Na
2
HPO
4
)

W przypadku słabego kwasu [HA]
i jego soli z mocną
zasadą [NaA]:
W przypadku słabego kwasu [HA]
i jego soli z mocną
zasadą [NaA]:
— kwas jest słabo
zdysocjowany
— kwas jest słabo
zdysocjowany
A
O
H
O
H
HA
3
2
A
O
H
O
H
HA
3
2
Stała
protolizy
kwasu
wyraża
się
wzorem:
]
HA
[
]
O
H
][
A
[
K
3
a
]
HA
[
]
O
H
][
A
[
K
3
a

— sól [NaA] jest dobrze zdysocjowana i w
roztworze
obecne są tylko jony A
–
NaA Na
+
+
A
–
HA
C
]
HA
[
HA
C
]
HA
[
A
C
]
A
[
A
C
]
A
[
i
stąd
]
A
[
]
HA
[
K
]
O
H
[
a
3
A
O
H
O
H
HA
3
2
A
O
H
O
H
HA
3
2
]
HA
[
]
O
H
][
A
[
K
3
a
]
HA
[
]
A
[
log
pK
]
A
[
]
HA
[
log
pK
pH
a
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
— wartości stałej
dysocjacji
— stosunku stężeń soli
i kwasu
— wartości stałej
dysocjacji
— stosunku stężeń soli
i kwasu
]
C
[
]
C
[
log
pK
pH
HA
A
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
pH danego buforu jest zależne od:

Jeśli do roztworu buforu
HA/A
–
A
O
H
O
H
HA
3
2
O
H
HA
O
H
A
2
3
wskutek tego początkowe pH
roztworu
praktycznie
nie
ulegnie
zmianie
dodać pewną ilość
mocnego
kwasu,
czyli jonów
H
3
O
+
to:

COO
CH
O
H
O
H
COOH
CH
3
3
2
3
O
H
COOH
CH
O
H
COO
CH
2
3
3
3
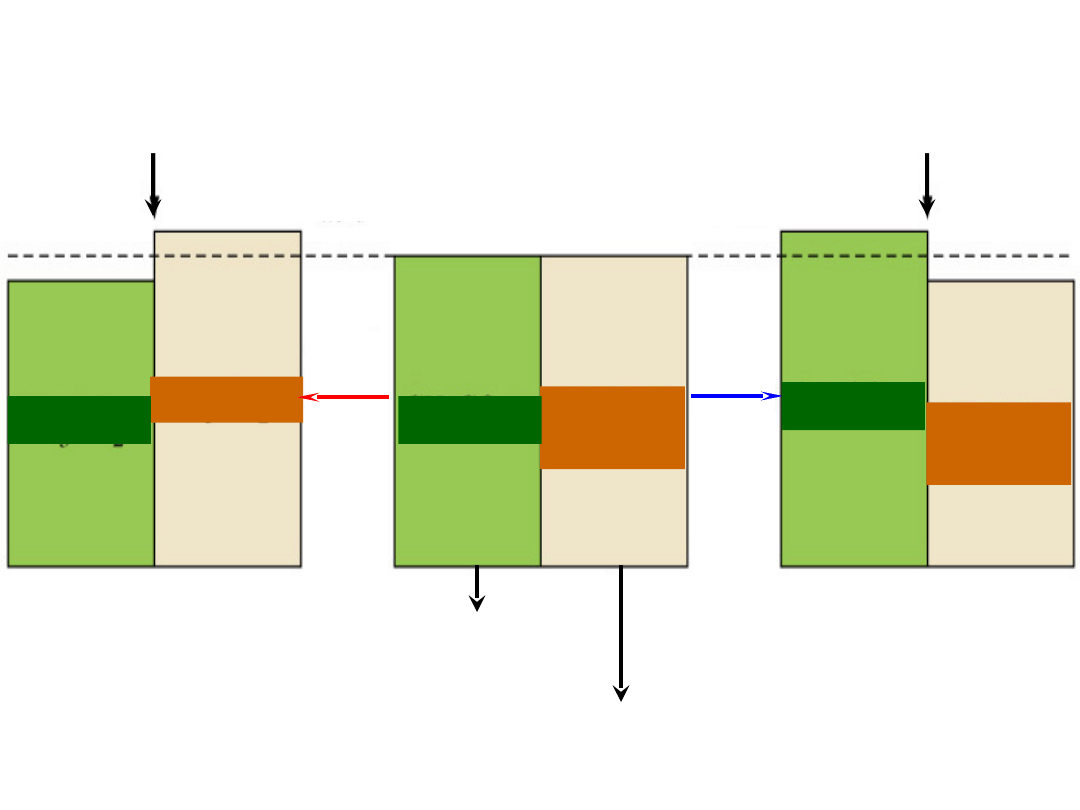
CH
3
CO
2
H
Dodanie
kwasu
Dodanie
zasady
CH
3
CO
2
H
CH
3
CO
2
–
Po dodaniu
zasady
OH
–
H
3
O
+
CH
3
CO
2
–
CH
3
CO
2
–
CH
3
CO
2
H
CH
3
COO
-
+
H
3
O
+
CH
3
COOH + H
2
O
CH
3
COOH +
OH
-
CH
3
COO
-
+ H
2
O
Po dodaniu
kwasu

O
H
A
HA
OH
2
O
H
A
HA
OH
2
W przypadku dodania do roztworu
pewnej ilości
mocnej zasady:
W przypadku dodania do roztworu
pewnej ilości
mocnej zasady:
COO
CH
O
H
O
H
COOH
CH
3
3
2
3
3
3
2
CH COOH OH
CH COO
H O
-
-
+
�
+
A
O
H
O
H
HA
3
2
A
O
H
O
H
HA
3
2
Jon hydroksylowy reaguje ze
słabym, niezdysocjowanym
kwasem
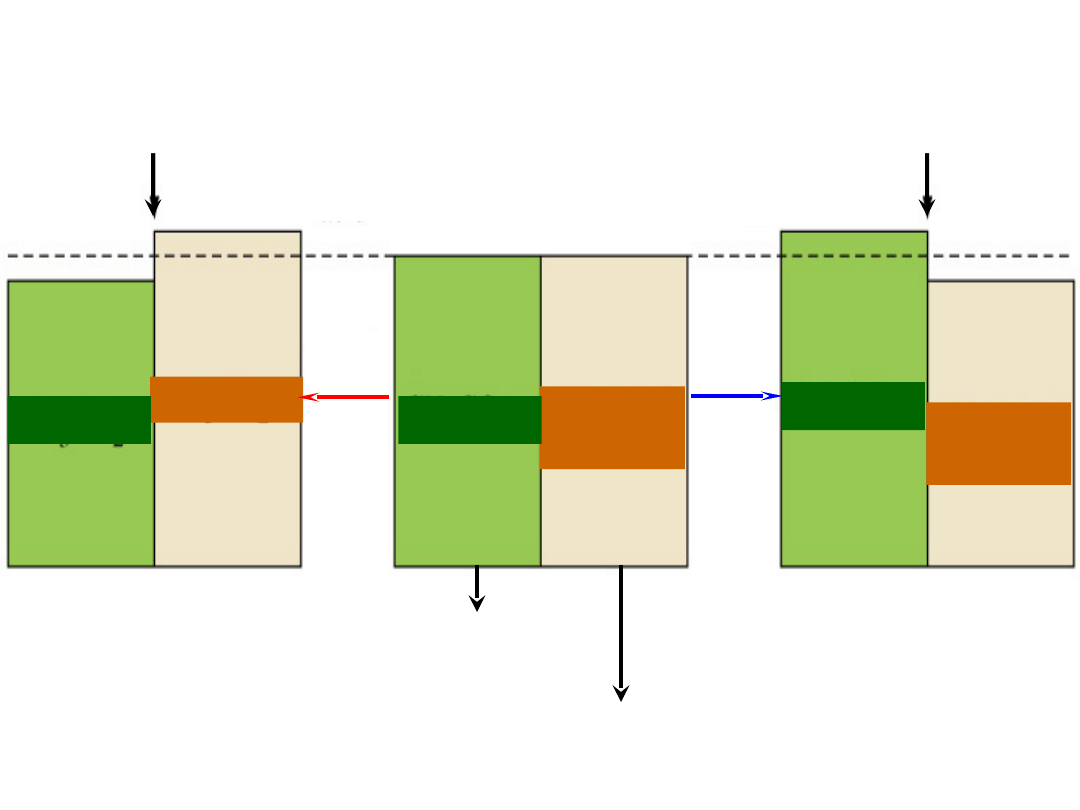
CH
3
CO
2
H
Dodanie
kwasu
Dodanie
zasady
CH
3
CO
2
H
CH
3
CO
2
–
Po dodaniu
zasady
OH
–
H
3
O
+
CH
3
CO
2
–
CH
3
CO
2
–
CH
3
CO
2
H
CH
3
COO
-
+
H
3
O
+
CH
3
COOH + H
2
O
CH
3
COOH +
OH
-
CH
3
COO
-
+ H
2
O
Po dodaniu
kwasu

zmieniając
stosunek
stężeń
kolejno od
10:1
przez
1:1
do
1:10
otrzymujemy
kolejno:
1
pK
1
10
log
pK
pH
a
a
a
a
pK
1
1
log
pK
pH
1
pK
10
1
log
pK
pH
a
a
zakres
stosowalno
ści
buforów
:
1
pK
pH
a
1
pK
pH
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
0
6
5
7
8
4
3
2
1
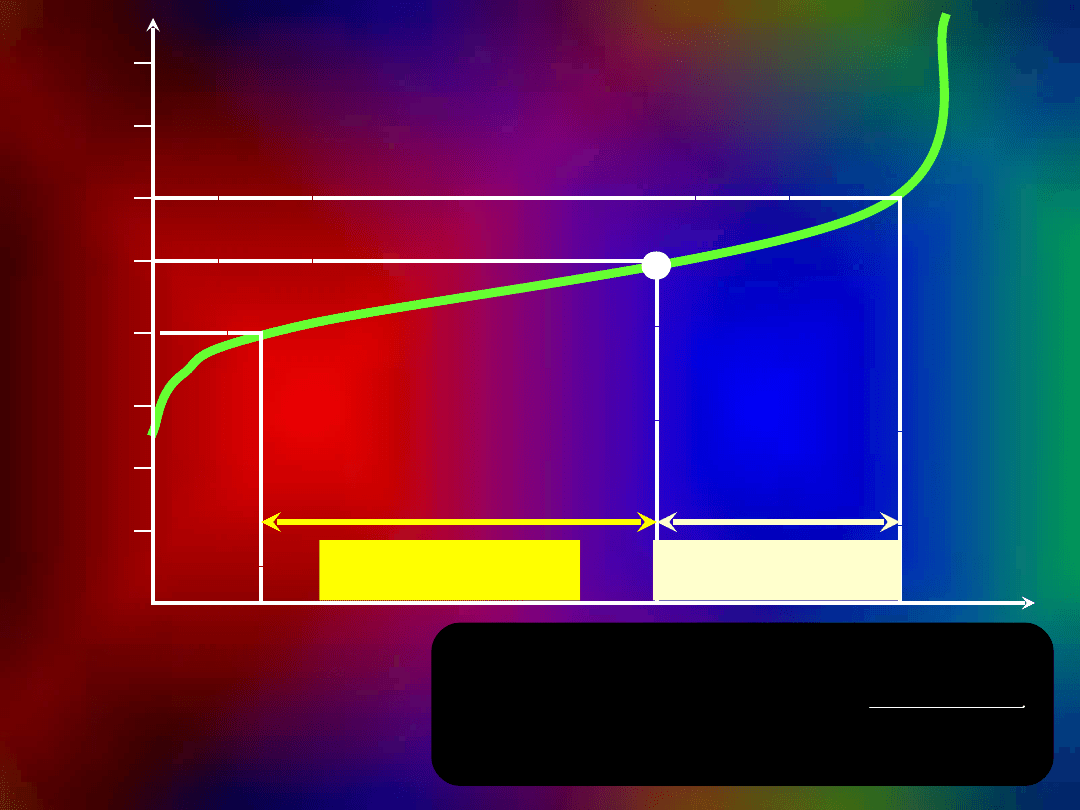
pH<pK
a kwasu
pH> K
a kwasu
buforowanie
zasad
buforowanie
kwasów
BUFOR
pK
a kwasu
= 5,0
pH
]
B
[
]
OH
][
BH
[
K
b
]
BH
[
]
B
[
K
]
OH
[
b
]
O
H
[
K
]
OH
[
3
w
]
BH
[
]
B
[
K
]
O
H
[
K
b
3
w
]
B
[
K
]
BH
[
K
]
O
H
[
b
w
3
]
B
[
]
BH
[
log
pK
pK
pH
b
w
stąd:
Jeśli bufor jest mieszaniną
słabej zasady
i jej soli z mocnym
kwasem:
OH
BH
O
H
B
2
Dodanie do zasady amonowej NH
3
xH
2
O jej soli z mocnym
kwasem (NH
4
Cl) powoduje wzrost stężenia w roztworze
jonów NH
4
+
i na skutek tego przesunięcie równowagi
reakcji protolizy zasady w lewo
Cl
NH
)
aq
(
Cl
NH
4
4
4
NH
4
NH
dodanie
Przesuniecie równowagi
w
kierunku powstawania
NH
3
OH
NH
O
H
NH
4
2
3
4
NH
OH
NH
O
H
NH
4
2
3
OH
BH
O
H
B
2

4
NH
BH
4
C
C
]
BH
[
]
NH
[
3
NH
B
3
C
C
]
B
[
]
NH
[
B
BH
b
w
C
C
log
pK
pK
pH
OH
NH
O
H
NH
4
2
3
OH
BH
O
H
B
2
3
4
3
NH
NH
NH
w
C
C
log
pK
pK
pH
w związku
z powyższym:
w związku
z powyższym:
Przesuniecie
równowagi w kierunku
powstawania NH
3
Dodanie do roztworu buforu amonowego
mocnej zasady – czyli jonów
hydroksylowych [OH
–
]
powoduje, że
reagują z nimi jony amoniowe z
utworzeniem słabo zdysocjowanej zasady
amonowej
OH
NH
O
H
NH
4
2
3
OH
OH
dodanie
3
4
3
NH
NH
NH
w
C
C
log
pK
pK
pH

Dodanie do roztworu buforu amonowego
mocnego kwasu – czyli jonów
wodorowych [H
+
]
powoduje,
że reagują z nimi cząsteczki amoniaku z
utworzeniem słabo jonów amoniowych
Przesuniecie równowagi w kierunku
powstawania NH
4
+
O
H
NH
O
H
NH
2
4
3
3
dodanie
H
3
O
+
3
4
3
NH
NH
NH
w
C
C
log
pK
pK
pH

zakres
stosowalno
ści
buforów
:
1
pK
pK
pH
b
w
1
pK
pK
pH
b
w
1
K
pK
1
10
log
K
pK
pH
b
w
b
w
a
b
w
b
w
pK
pK
pK
1
1
log
pK
pK
pH
1
K
pK
10
1
log
K
pK
pH
b
w
b
w
]
C
[
]
C
[
log
pK
pK
pH
B
BH
b
w
]
C
[
]
C
[
log
pK
pK
pH
B
BH
b
w
zmieniając
stosunek
stężeń
kolejno od
10:1
przez
1:1
do
1:10
otrzymujemy
kolejno:

stosunku stężeń
słabego składnika w
postaci zdysocjowanej i
niezdysocjowanej
stosunku stężeń
słabego składnika w
postaci zdysocjowanej i
niezdysocjowanej
pH buforu jest zależne od:
pK słabego kwasu lub
zasady
pK słabego kwasu lub
zasady
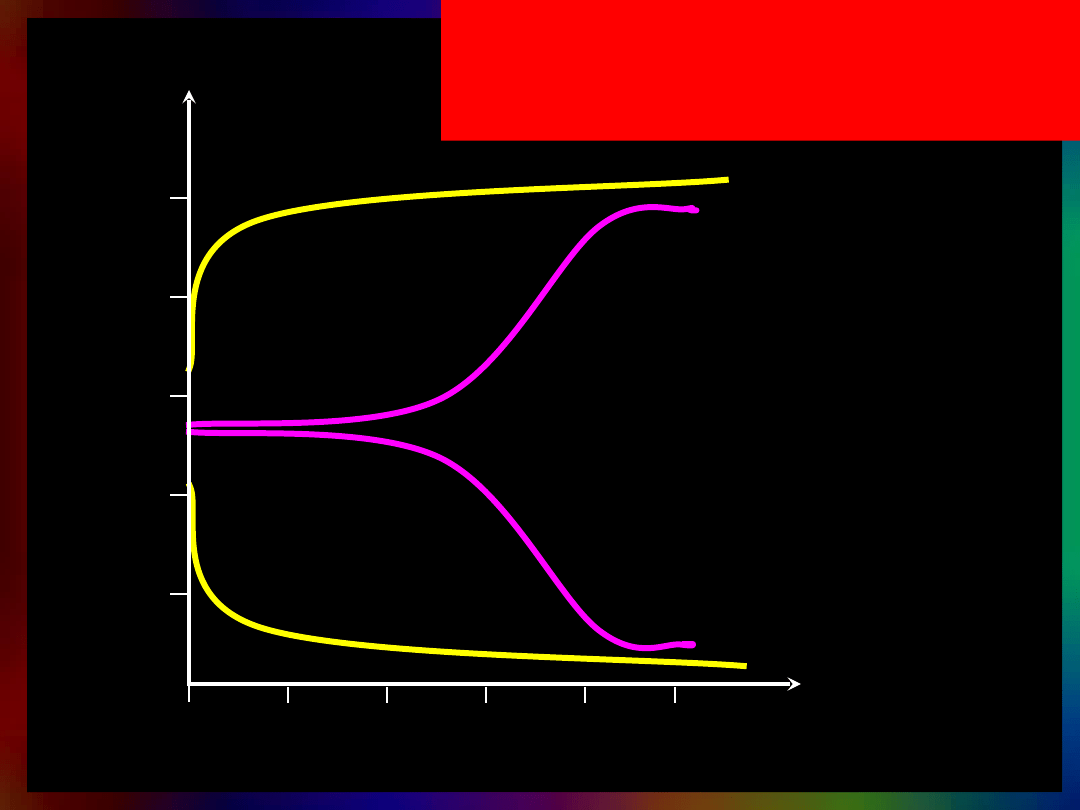
Wpływ mocnego kwasu i mocnej
zasady
na pH wody i buforu
woda + NaOH
bufor +NaOH
bufor + HCl
woda + HCl
pH
objętość/ml
10
50
40
30
20
0
08
10
12
4
6

Najczęściej stosowane układy buforujące,
obejmujące cały zakres wartości pH
pH= 0
1M HCl
pH= 2
0,01M HCl
pH=
4,7
1MCH
3
COOH+1M
CH
3
COONa
pH=
7,2
1M KH
2
PO
4
+1M Na
2
HPO
4
pH=
9,2
1M NH
4
Cl+1M NH
3
pH=
12
0,01M NaOH
pH=
14
1M NaOH
)
HPO
PO
H
(
2
4
4
2
)
O
H
O
H
(
2
3
)
COO
CH
COOH
CH
(
3
3
)
NH
NH
(
3
4
)
OH
O
H
(
2
)
O
H
O
H
(
2
3
)
OH
O
H
(
2



pH
c
pH
c
c
–
ilość mocnego kwasu lub
mocnej zasady w molach
pH
–
obserwowana przy tym
zmiana wartości
pH roztworu
Zdolność buforowania —
jaką
ma dany roztwór
buforowy
zawierający układ kwas
–
zasada,
można wyrazić
pojemnością buforową,
określaną wzorem:

]
OH
[
]
O
H
[
])
O
H
[
K
(
]
O
H
[
CK
3
,
2
3
2
3
a
3
a
]
OH
[
]
O
H
[
])
O
H
[
K
(
]
O
H
[
CK
3
,
2
3
2
3
a
3
a
C -
ogólne stężenie składników buforujących
(C =
C
a
+C
b
)
pojemność buforowa jest
wprost proporcjonalna do
C
znaczną pojemność buforową
mają układy o dużym
stężeniu H
3
O
+
lub OH
–
, a
zatem dość stężone roztwory
mocnych kwasów i zasad
Gdy 3<pH<11, a C>10
–1
M,
[H
3
O
+
] i [OH
–
] są dostatecznie
małe, aby można nie brać ich pod
uwagę:
2
3
a
3
a
])
O
H
[
K
(
]
O
H
[
CK
3
,
2
2
3
a
3
a
])
O
H
[
K
(
]
O
H
[
CK
3
,
2
gdy pH = pK
a
C
58
,
0
C
58
,
0

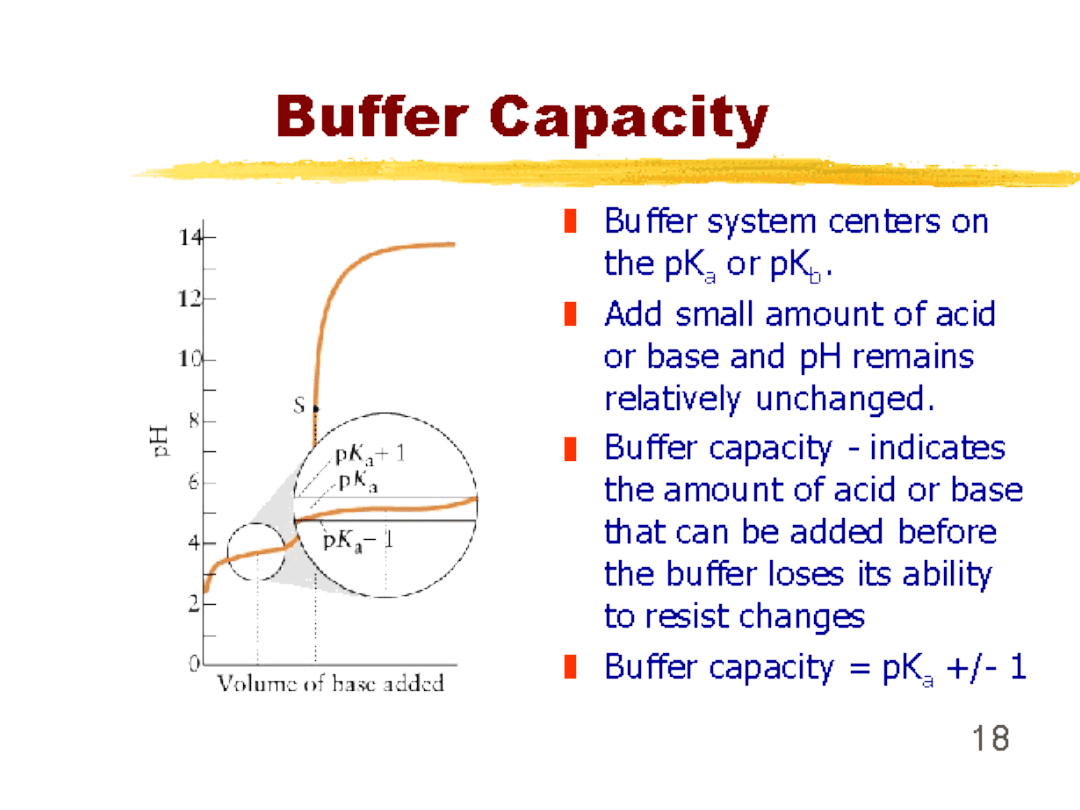
Pojemność buforowa układu
wzrasta gdy:
zwiększa się
wartość C
[przy stałym
stosunku C
a
/C
b
]
stosunek C
a
/C
b
zbliża się do
jedności
[przy stałej
wartości C]
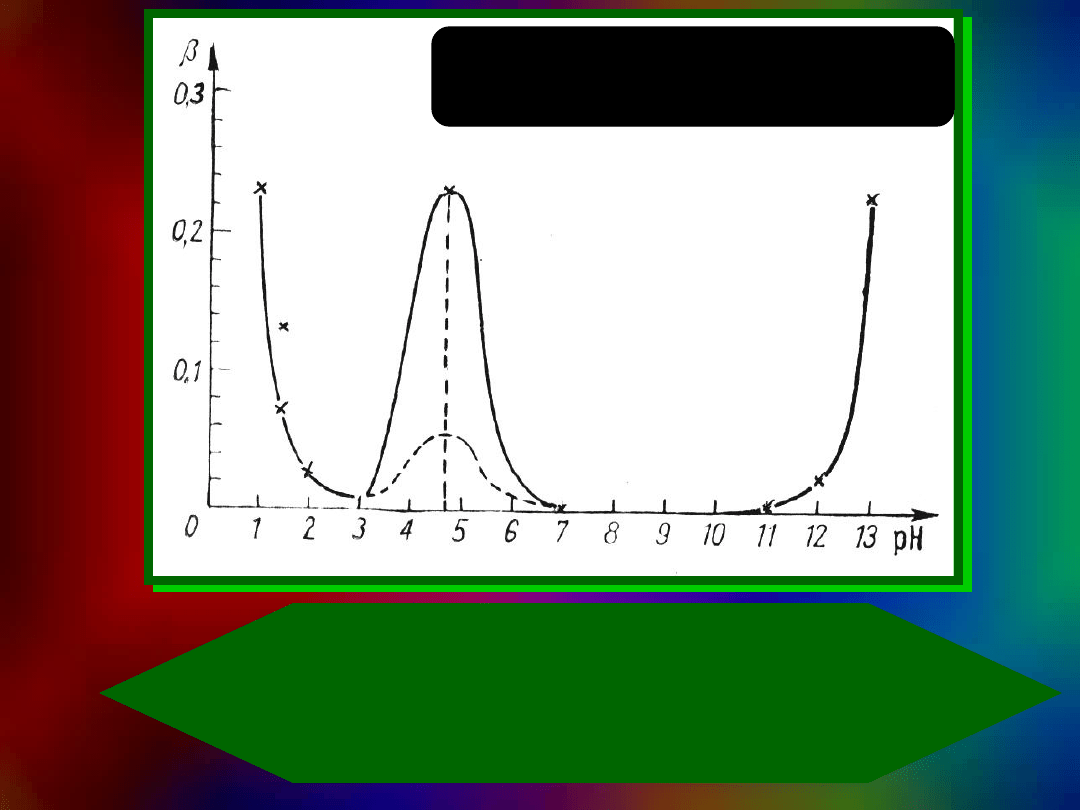
Zależność pojemności
buforowej od pH w
układzie par sprzężonych:
mocny kwas-mocna zasada
i kwas octowy-jonoctanowy.
Krzywa ciągła - 0,4 M CH
3
COOH,
Krzywa przerywana - 0,1 M CH
3
COOH
pK
a

pH
buforu
[stosunku stężeń
kwasu i jego
soli]
stężenia
roztworu
buforowe
go
Pojemność
buforowa
zależy od:
Pojemność
buforowa
zależy od:

największą
pojemność buforową
mają
roztwory, w
których
stosunek stężeń
soli i kwasu
(ewentualnie zasady) jest
równy jedności
praktyczny
zakres stosowania buforu
jest
ograniczony w przybliżeniu do
wartości
pH w granicach pK 1
poza
tym
interwałem
pojemność
buforowa szybko maleje
pojemność buforowa
zależy również
od
stężenia roztworu buforowego
im większe jest stężenie buforu,
tym większa jest jego pojemność buforowa
im większe jest stężenie buforu,
tym większa jest jego pojemność buforowa
Woda+HCl
Bufor+HCl
Stężenie HCl (mol/l)
pH
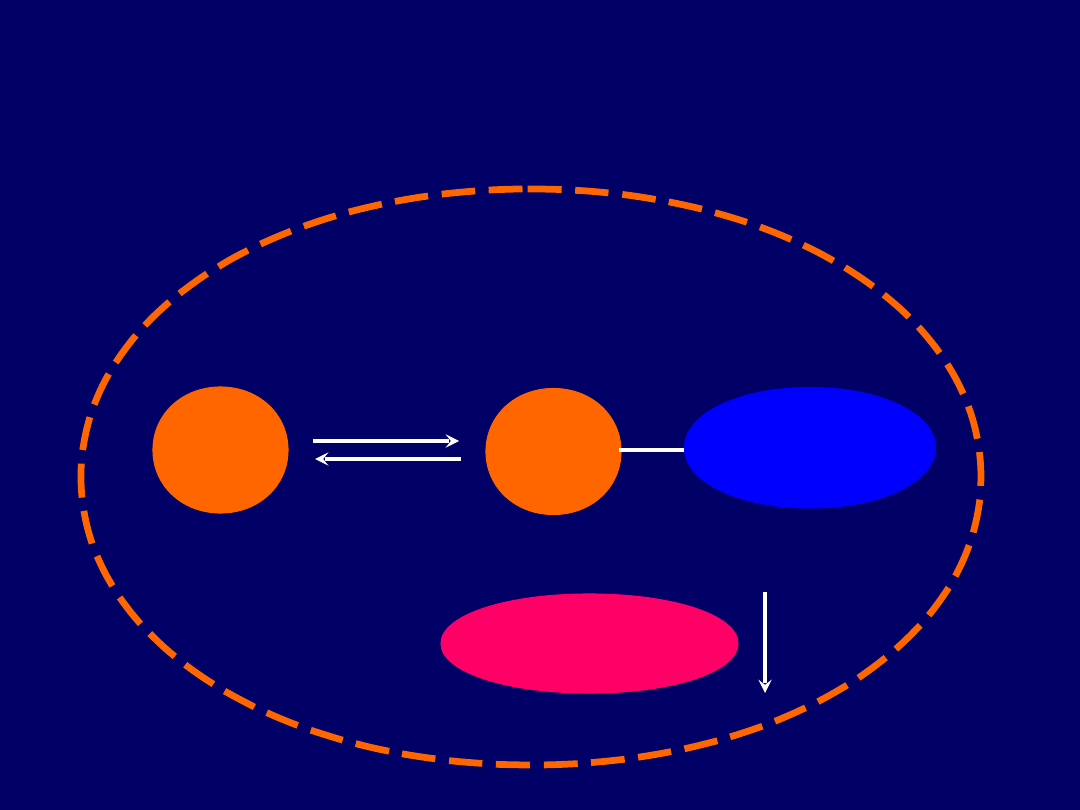
H
H
+
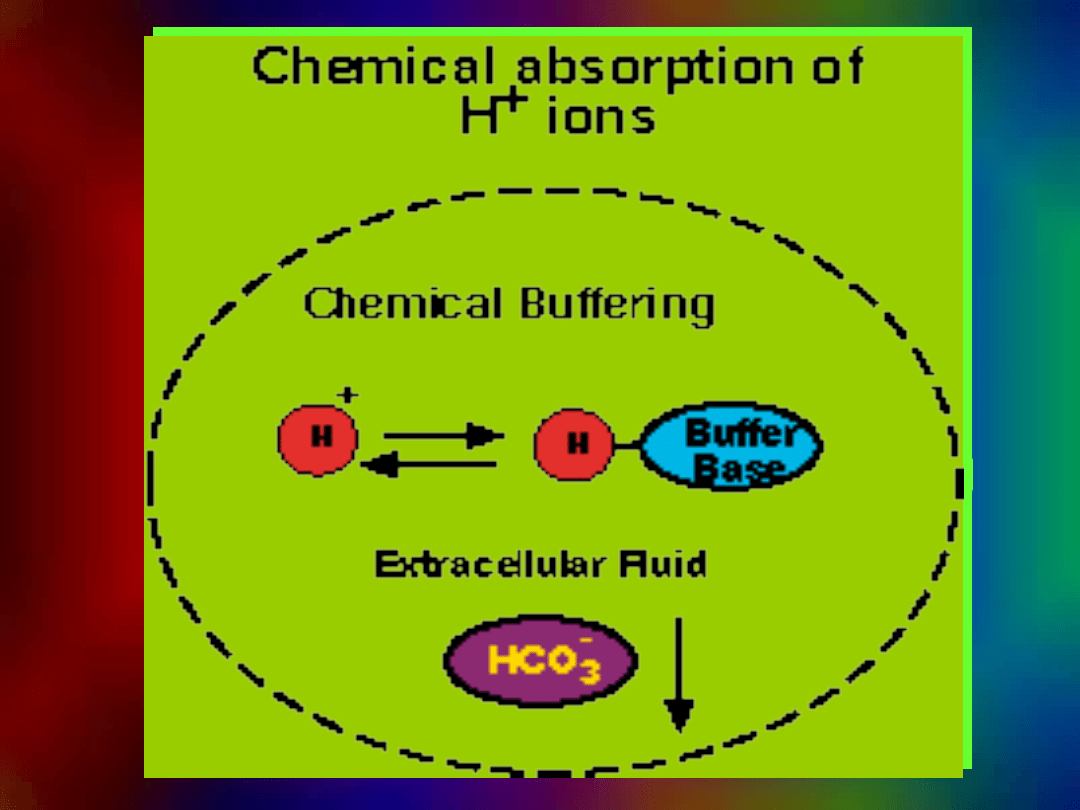
Bufor
forma zasadowa
3
HCO
Krew, mocz
Mechanizm buforowania
Buforowanie jonów H
+

Przygotowanie buforu o określonym
pH
Obliczyć jakie stężenie powinny mieć
składniki układu aby uzyskać potrzebne
pH
Obliczyć stosunek sól:kwas
konieczny do uzyskania pH
przygotowywanego buforu
Wybrać słaby kwas o pK
a
zbliżonej do
wartości pH przygotowywanego buforu
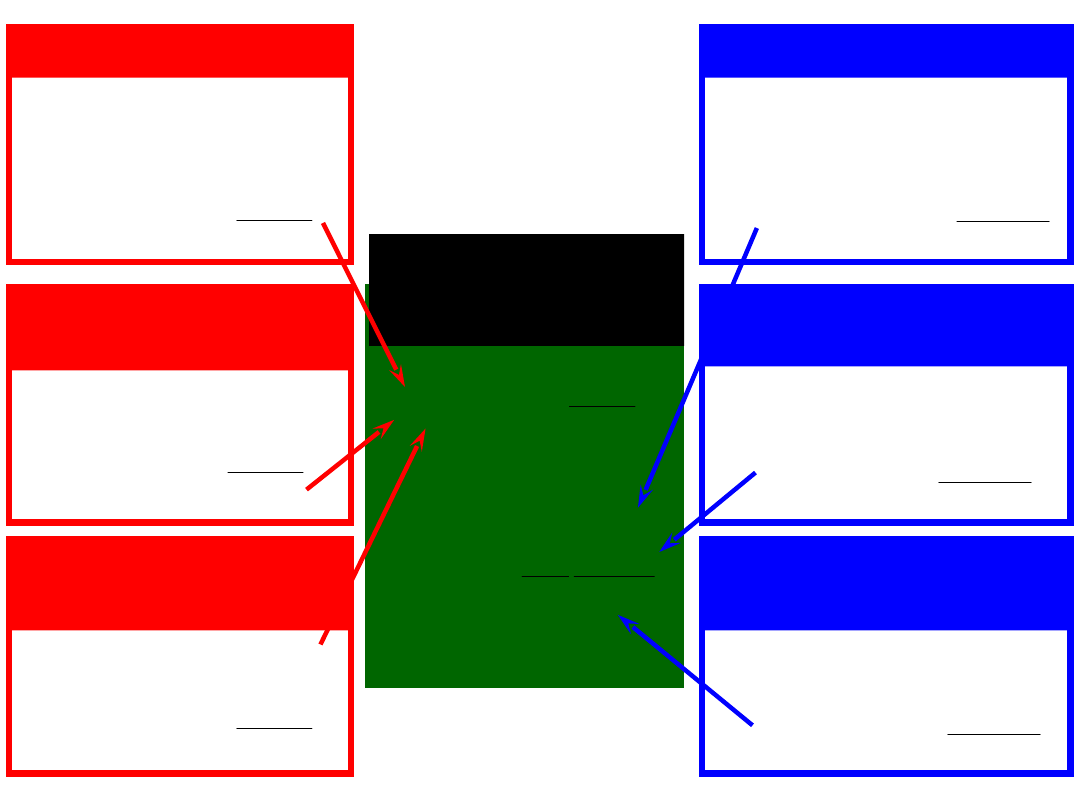
Słaby kwas - HA
Słaba zasada - B
Sól słabej zasady –
BH
+
Słaba zasada - B
i jej sól – BH
+
Słaby kwas – HA
i jego sól – A
-
Sól słabego
kwasu – A
-
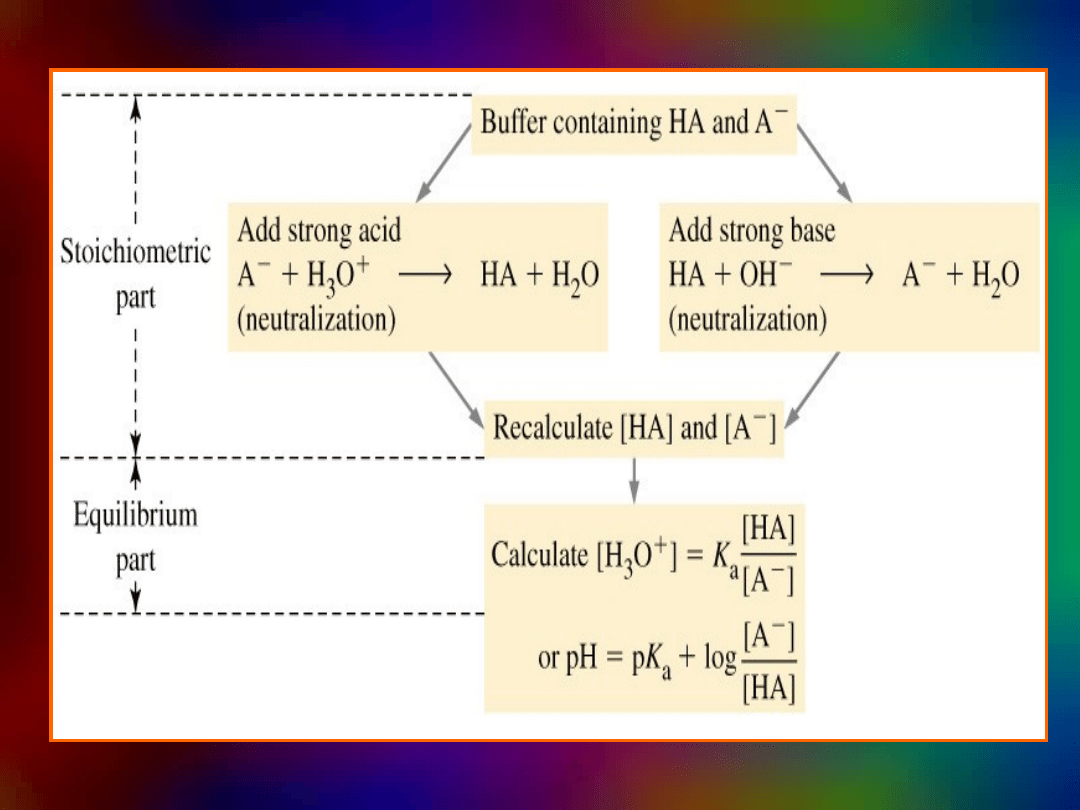
Miareczkowanie
mocną zasadą
(
NaOH)
HA + OH
–
A
–
+
H
2
O
aż do uzyskania
oczekiwanego
]
A
[
]
HA
[
Zmieszanie składników
HA i A
–
Miareczkowanie mocnym
kwasem
(HCl)
A
–
+ H
+
HA
aż do uzyskania
oczekiwanego
]
A
[
]
HA
[
Miareczkowanie kwasem
(HCl)
B + H
+
BH
+
aż do uzyskania
oczekiwanego
]
B
[
]
BH
[
Zmieszanie
składników
B i BH
+
Miareczkowanie
zasadą
(NaOH)
BH
+
+ OH
–
B + H
2
O
]
B
[
]
BH
[
]
A
[
]
HA
[
K
]
O
H
[
a
3
]
O
H
[
3
]
B
[
]
BH
[
K
K
b
w
Oczekiwane
pH
]
A
[
]
HA
[
aż do uzyskania
oczekiwanego
aż do uzyskania
oczekiwanego
]
B
[
]
BH
[
aż do uzyskania
oczekiwanego
Sposoby postępowania
Sposoby postępowania

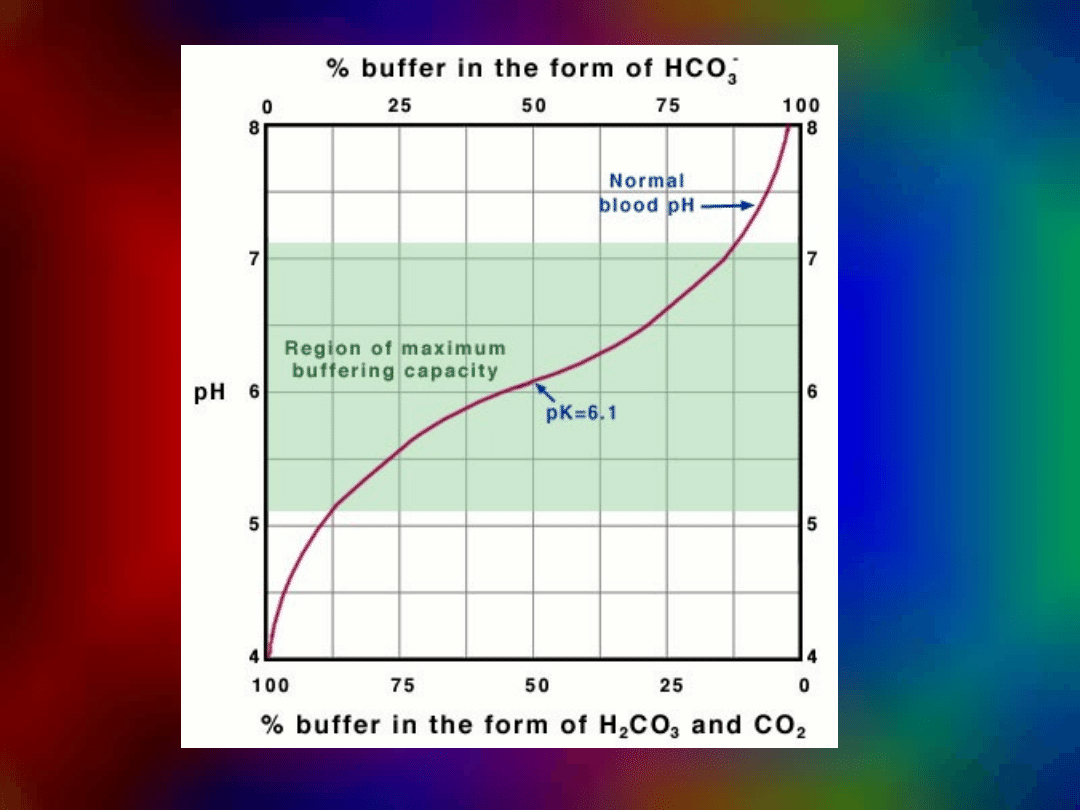
7,0 < pH krwi < 7,8
7,0 < pH krwi < 7,8
pH krwi utrzymywane jest na stałym
poziomie dzięki:
zawartości buforów we
krwi
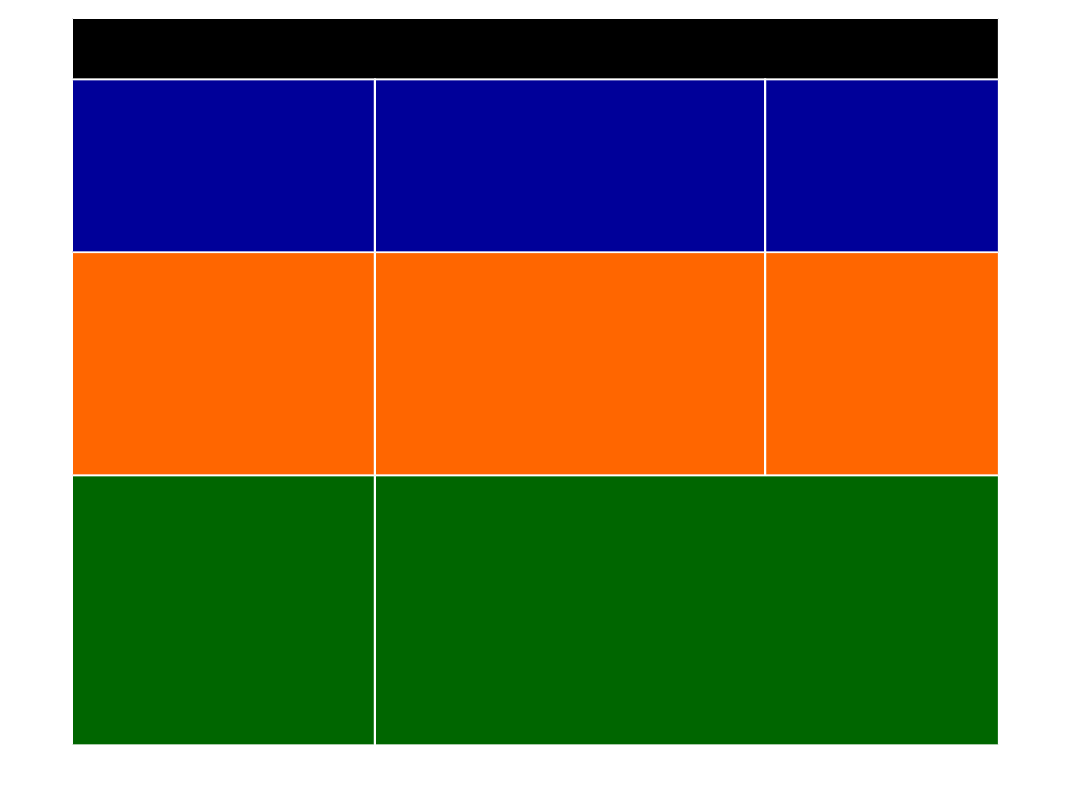
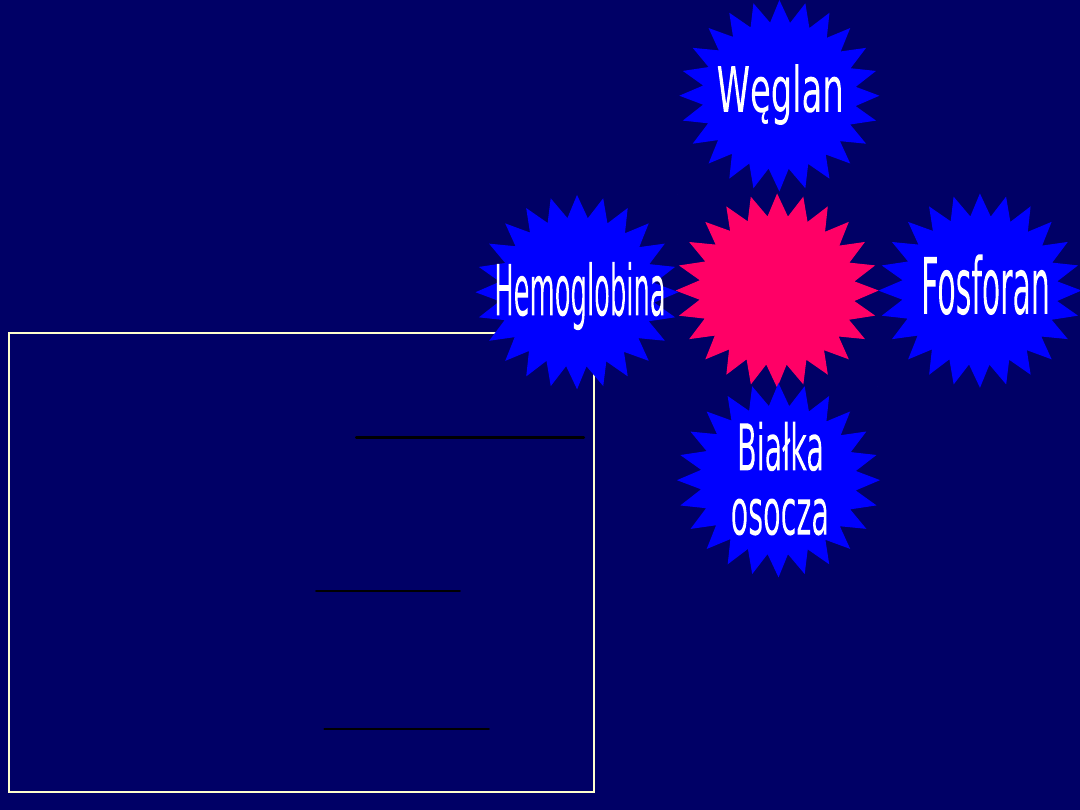
Bufor
węglanowy
Bufor
fosforanow
y
Bufor
białkowy
głównie
hemoglobina
wiążąca O
2
(Fe grupy hemowej)
lub
H
+
(białko)
Zapewniają około
90%
pojemności buforowej
krwi
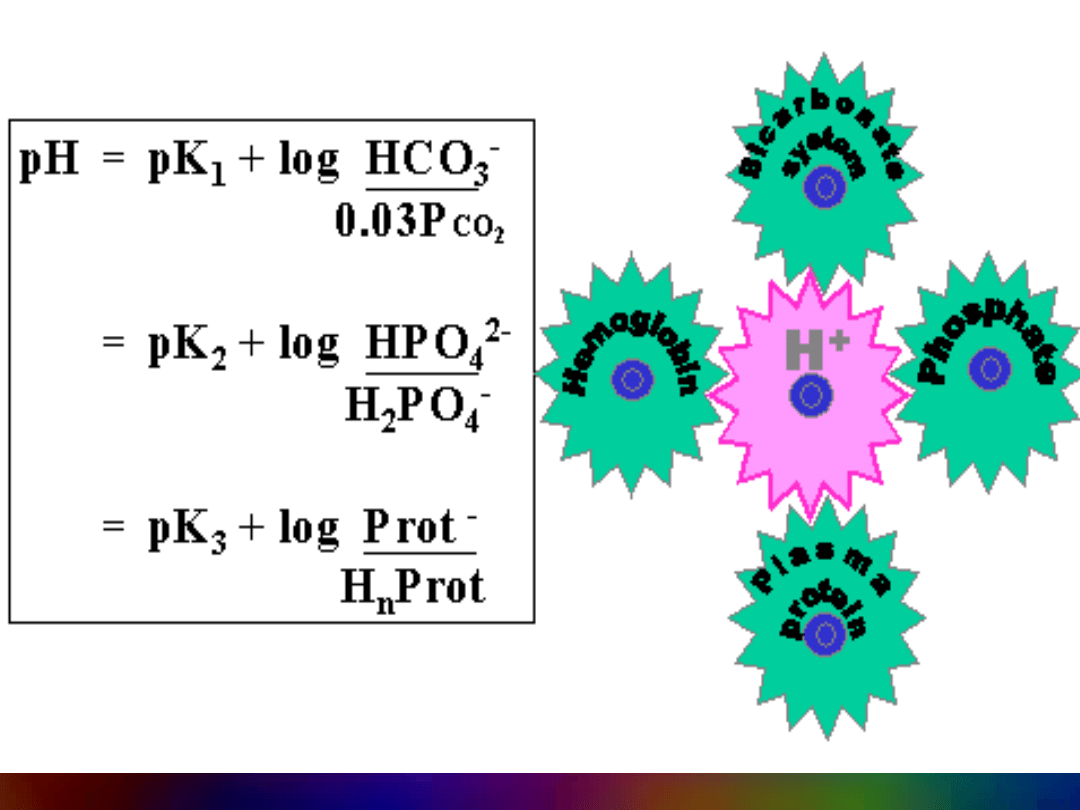
BUFORY KRWI:
3
3
2
HCO
/
CO
H
1
,
6
pK
a
8
,
6
pK
a
4
2
4
3
PO
H
/
PO
H
2
3
1
PCO
03
,
0
HCO
log
pK
pH
4
2
2
4
2
PO
H
HCO
log
pK
ot
Pr
H
ot
Pr
log
pK
n
3
H
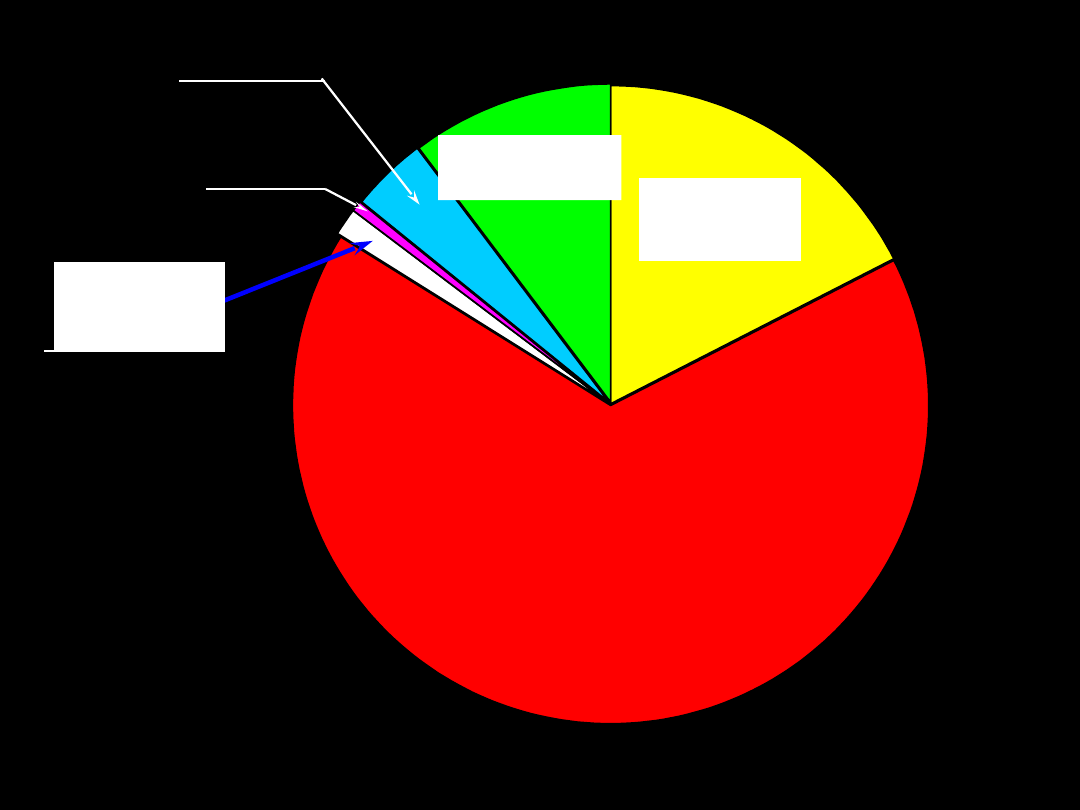
Kwasowe składniki krwi
Cl
Kwasy
organiczne
Białka
3
HCO
2
4
SO
4
HPO
]
HCO
][
H
[
]
CO
H
[
K
3
3
2
1
]
CO
H
[
]
CO
[
K
3
2
2
2
]
K
HCO
][
H
[
]
CO
H
[
a
3
3
2
]
K
HCO
][
H
[
]
CO
H
[
a
3
3
2
2
2
K
]
CO
[
)
aq
(
3
)
aq
(
3
HCO
O
H
O
H
CO
H
2
)
aq
(
3
2
)
g
(
2
)
I
(
2
CO
O
H
2
reakcja
kwas
—
zasada
K
a
K
1
]
K
[
]
CO
[
]
CO
H
[
2
2
3
2
]
]
CO
H
[
HCO
][
H
[
K
1
K
3
2
3
1
a
K
2
]
HCO
[
]
CO
[
K
K
]
H
[
3
2
2
a
]
HCO
[
]
CO
[
log
)
k
log(
]
H
log[
3
2
]
HCO
[
]
CO
[
log
pK
pH
3
2

usuwanie CO
2
podwyższa
wartość pH krwi
Usuwanie
HCO
3
-
obniża
wartość pH
krwi
Szybka praca serca
zmniejsza usuwanie
CO
2
]
HCO
[
]
CO
[
log
pK
pH
3
2

równanie
Hendersona-
Hasselbacha
3
3
2
HCO
H
CO
H
]
CO
H
[
]
HCO
][
H
[
K
3
2
3
]
CO
H
[
]
HCO
[
log
pK
pH
3
2
3
O
H
CO
2
2
)
03
,
0
(
40
24
log
1
,
6
icznie
log
fizjo
pH

1
20
log
1
,
6
2
,
1
24
log
1
,
6
4
,
7
3
,
1
1
,
6
y
respirator
y
respirator
non
log
pK
CO
HCO
log
pK
pH
2
3
4
,
7
)
10
(
log
]
H
log[
pH
4
,
7
4
,
7
)
10
(
log
]
H
log[
pH
4
,
7
eliminacji CO
2
przez płuca
eliminacji HCO
3
-
przez nerki


]
C
[
]
C
[
log
pK
pH
HA
A
a
]
C
[
]
C
[
log
pK
pH
HA
A
a
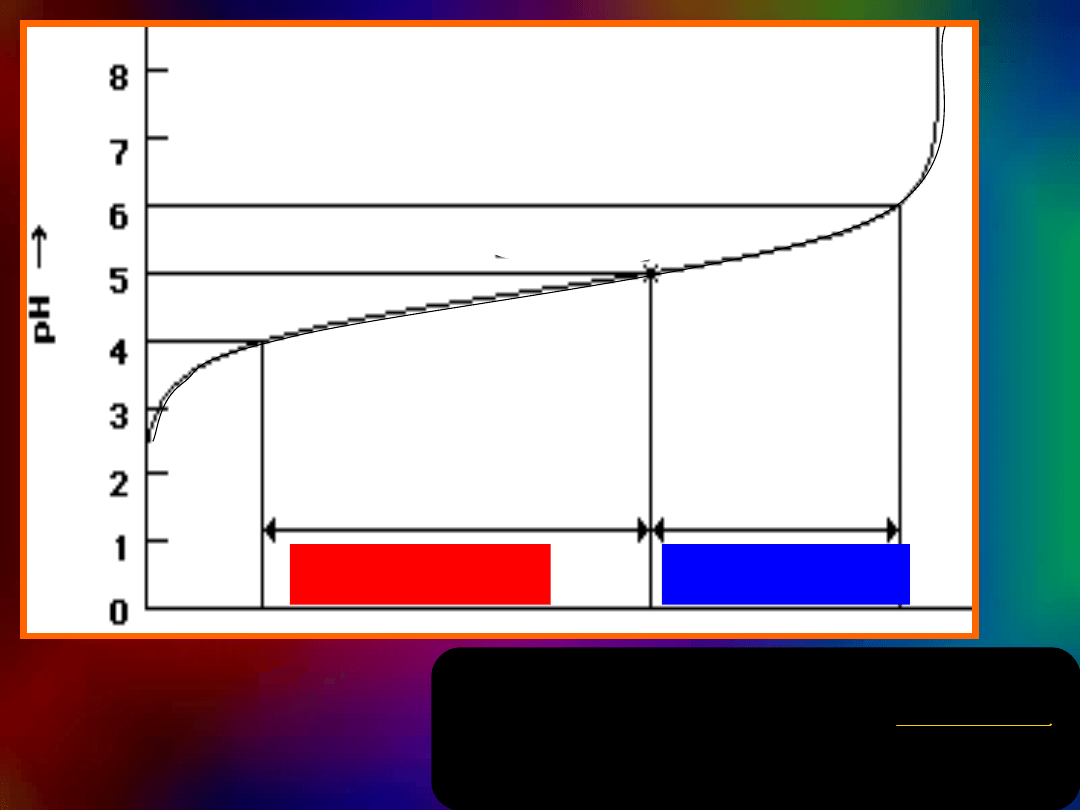
pH<pK
a kwasu
pH> K
a kwasu
pK
a kwasu
= 5,0
B u f o r
buforowa
nie
zasad
buforowani
e
kwasów
0
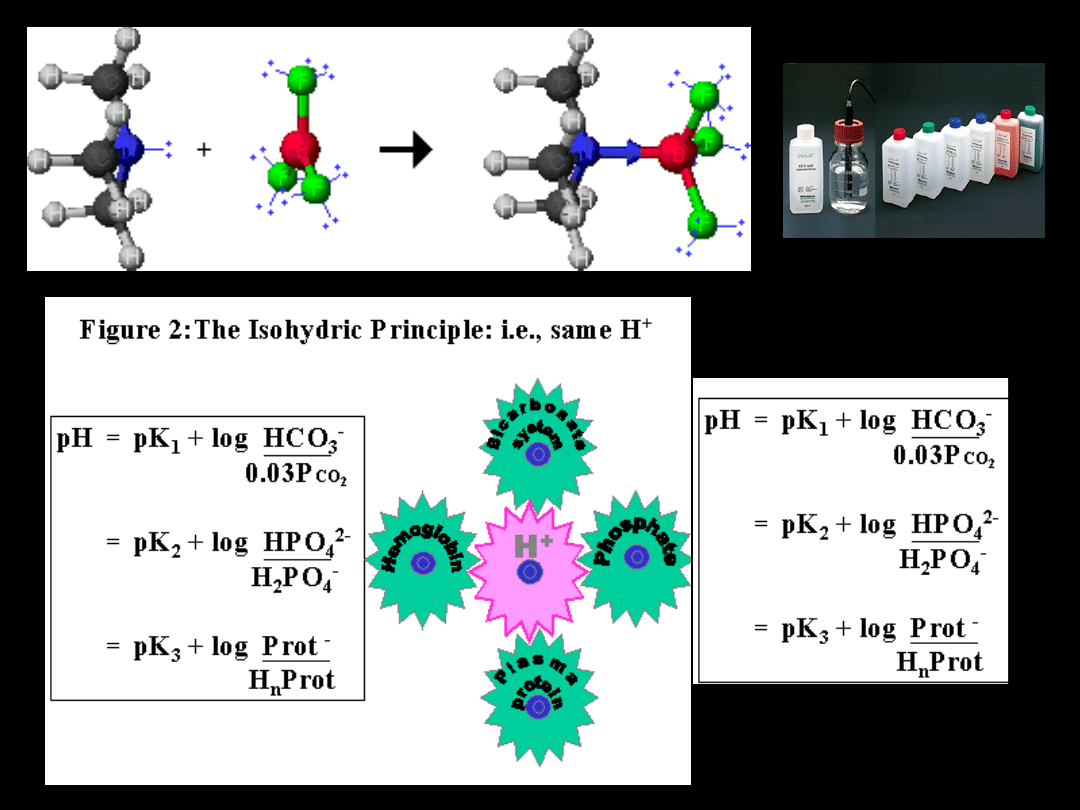
Acid base reaction
acid Ba
2
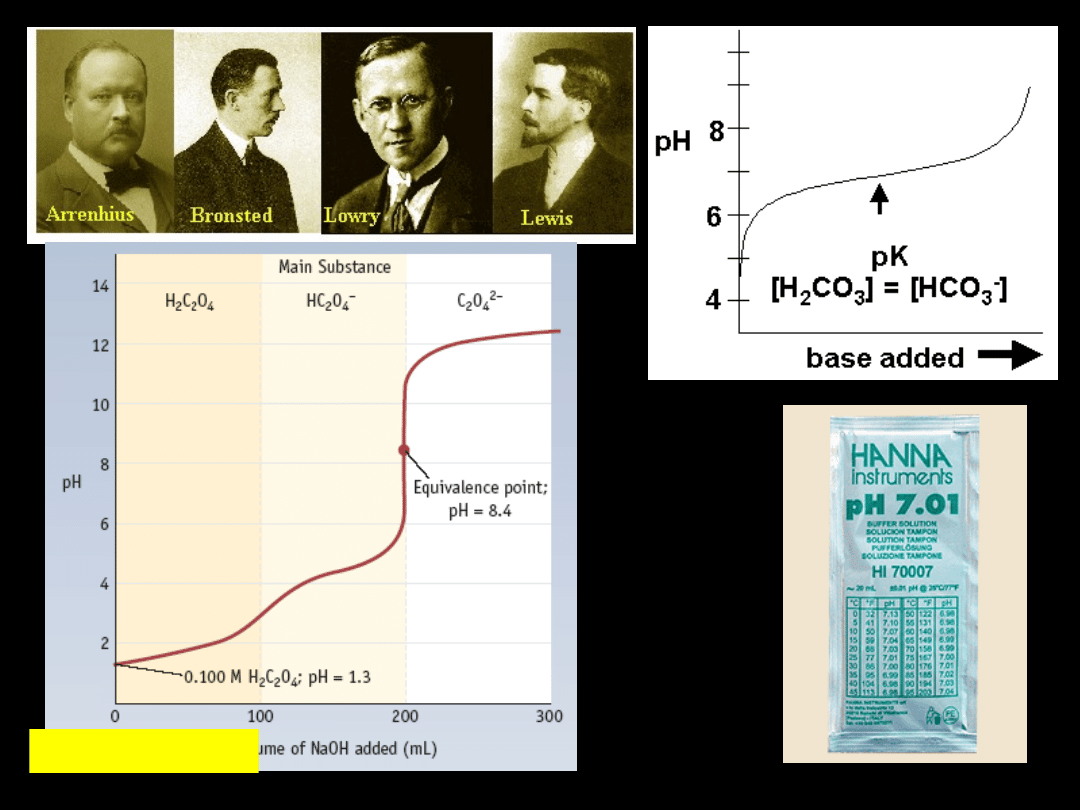
H
2
C
2
O
4
titratuion

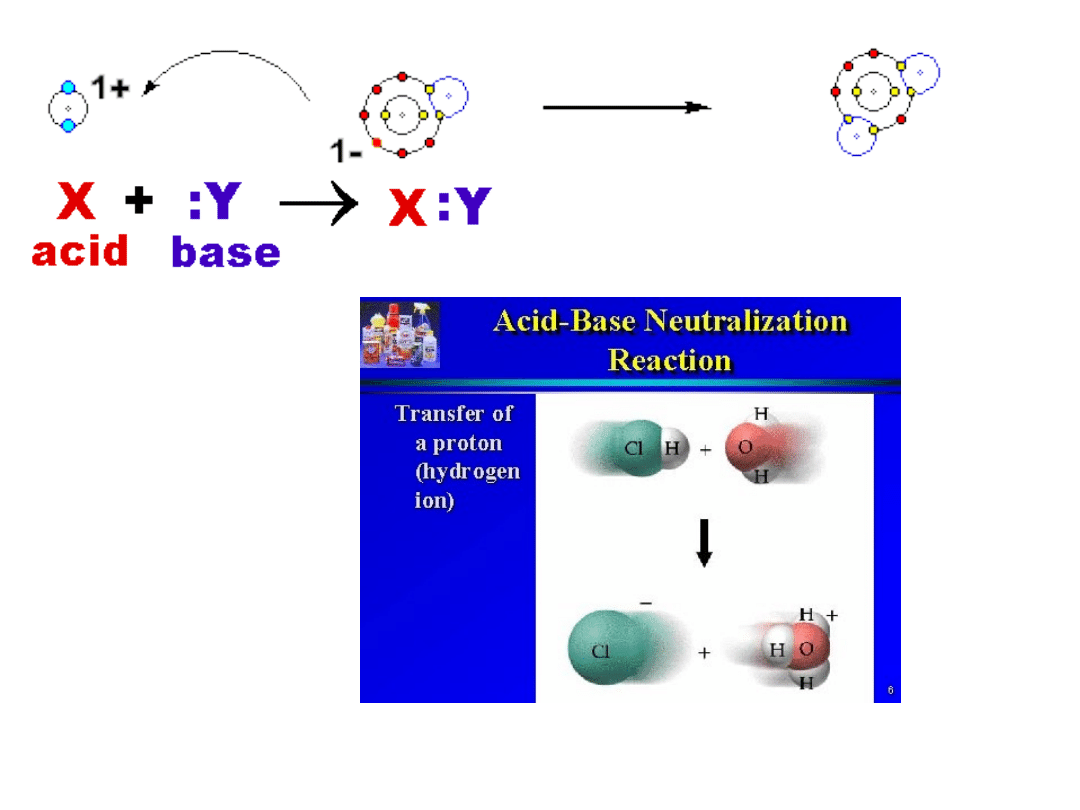
Lewis acid
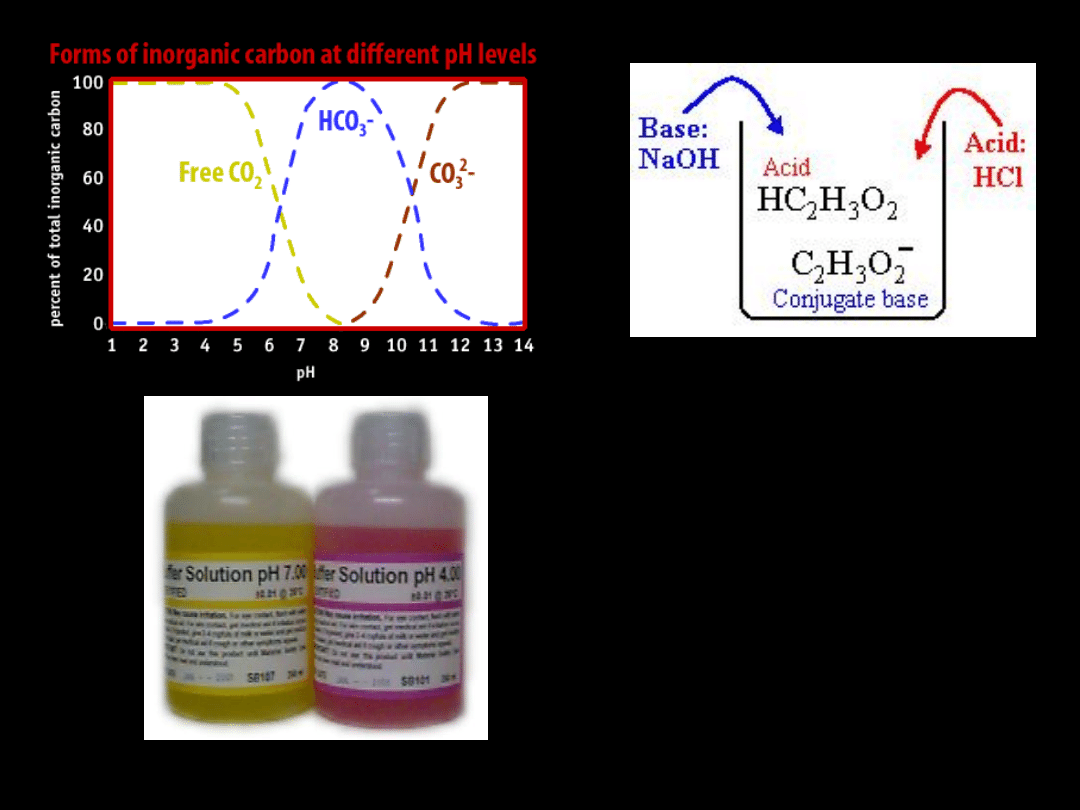
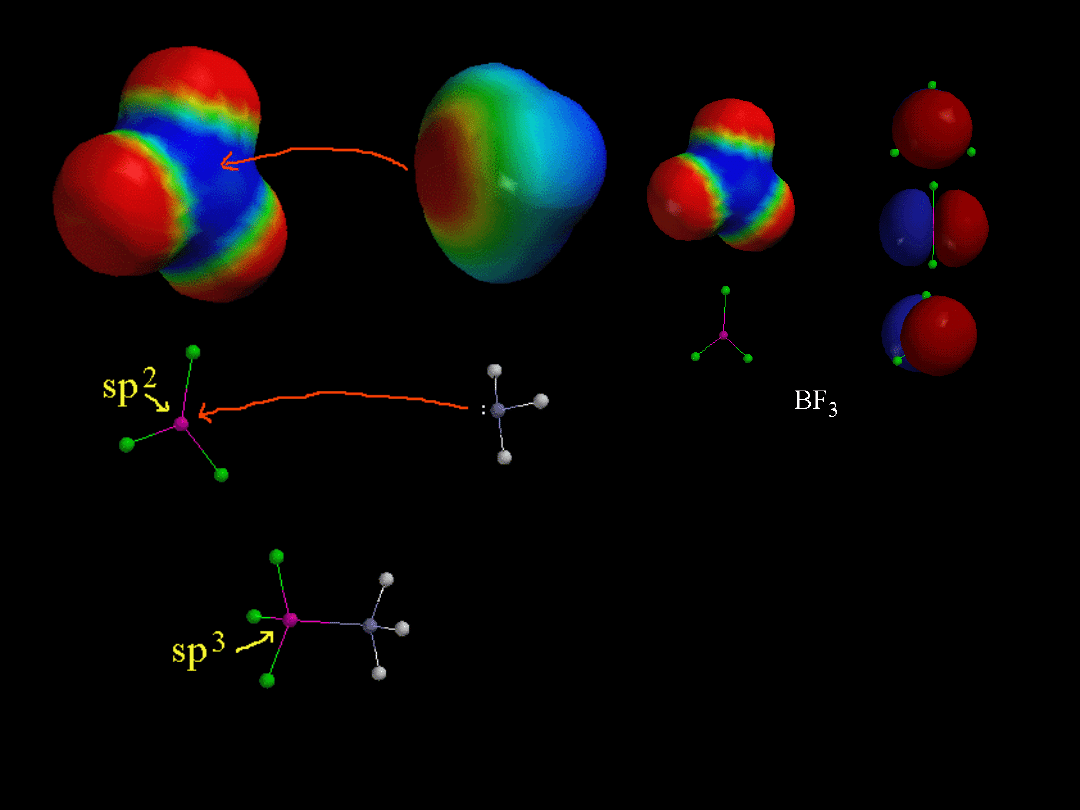
BF
3
NH
3
Lewis
acids and basis
BF
3
Lewis acids
and basis
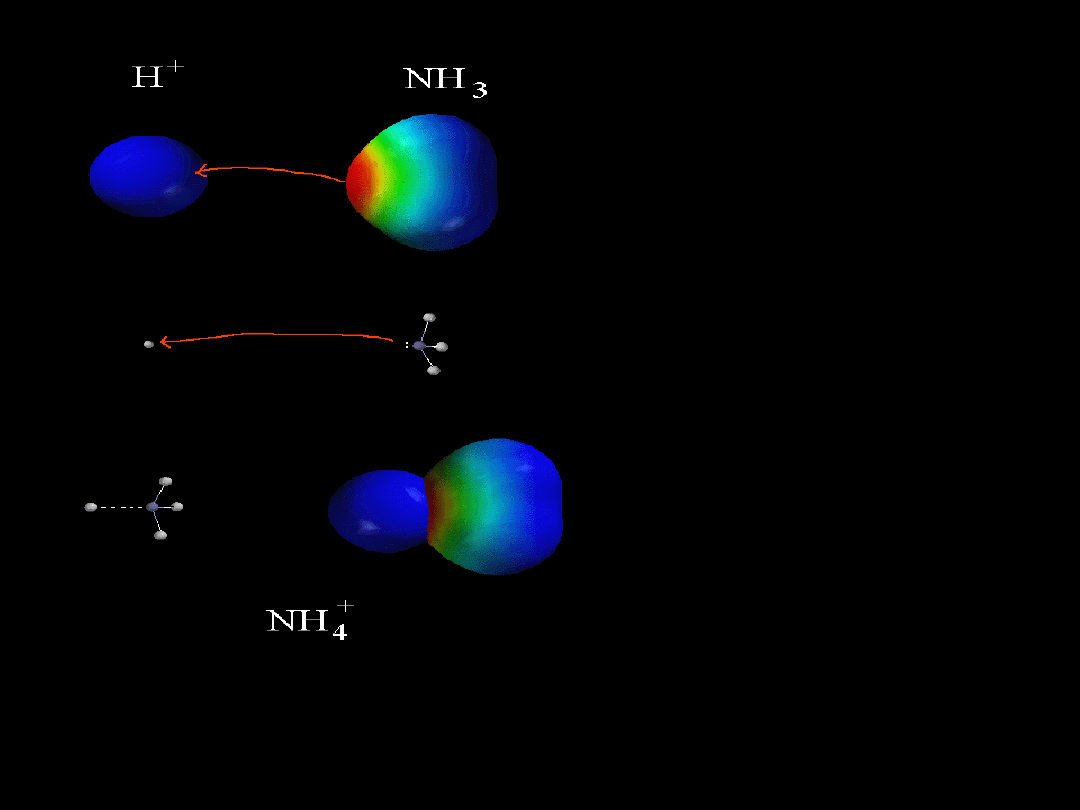
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
Wyszukiwarka
Podobne podstrony:
Semestr 1, Wykład 12, WYK˙AD XII
Pytania z Patofizjologii zebrane do 12 wИеcznie wersja 0 01 DODANE TESTY z wyjШЖ, wykИadвwek i egza
9 wykad Ukady dyspersyjne [F] 2006
10 wykad Statyka kinetyka chemiczna[F 2006]
15 wykad ukad okresowy[F]2006
ROZTWORY BUFOROWE O ZNANYM pH W 12, Studia SGGW, WNoŻ Inżynierskie 2008-2012, Sem III, Chem żywn
25 wykad 15 gr azotowce 01 2006[F]
23 wykad 13 gr[1] borowce[F]2006
wyk%c5%82ad 2 21 10 12
wyk%c5%82ad 3 25 11 12
wyk%c5%82ad 4 17 11 12
wyk%c5%82ad 3 20 10 12
Doradztwo rolnicze wyk%c5%82ad 4 9 12 12
9 wykad Ukady dyspersyjne [F] 2006
wyk%c5%82ad 1 21 10 12
Wyk%c5%82ad 13 12 01 13
wyk%c5%82ad 6 8 12 12
Doradztwo rolnicze wyk%c5%82ad 1 14 10 12
wyk%c5%82ad 1 13 10 12
więcej podobnych podstron