
fazę rozpraszającą
fazę
rozproszoną
układ złożony z co najmniej
dwóch
substancji
stanowiących:

gaz w gazie
ciecz w gazie
ciało stałe w gazie
gaz w cieczy – roztwór ciekły
ciecz w cieczy – roztwór
ciekły
ciało stałe w cieczy -
roztwór ciekły
gaz w ciele stałym
ciecz w ciele stałym
ciało stałe w ciele stałym -
roztwór stały
W zależności od
stanu skupienia
substancji rozpraszającej i substancji
rozproszonej
mogą istnieć następujące
rodzaje układów dyspersyjnych
:
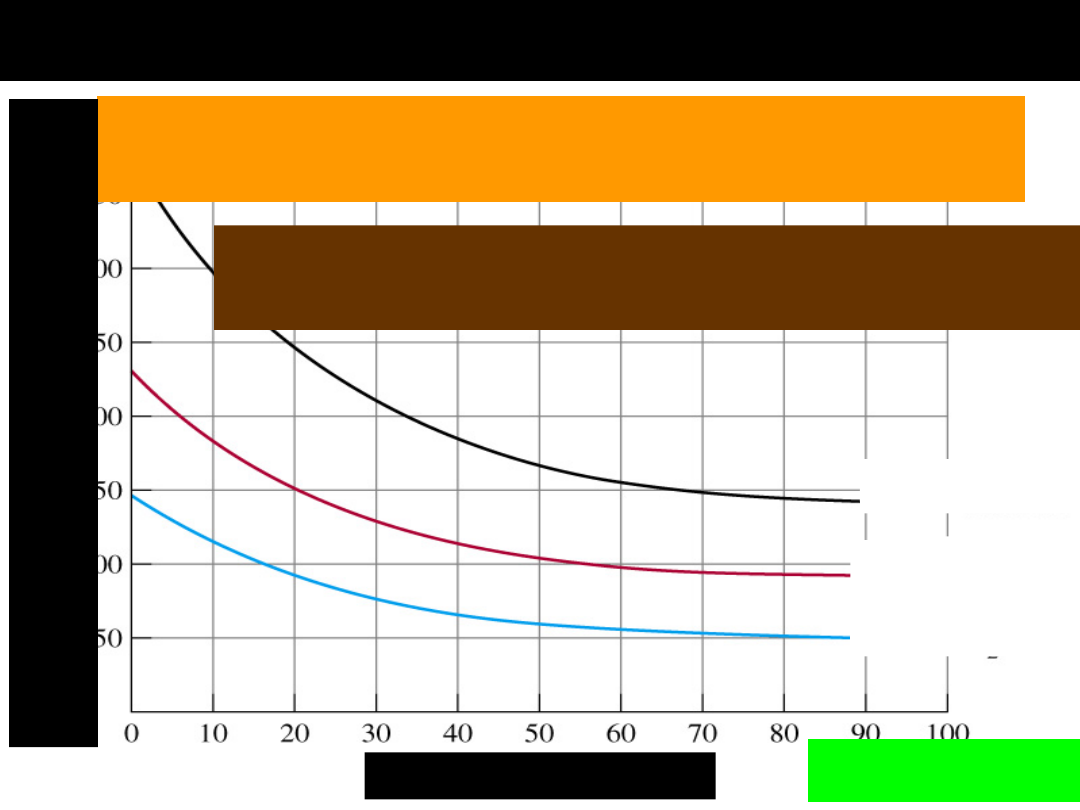
ROZPUSZCZALNOŚĆ GAZÓW W
CIECZACH
rozpuszczalność różnych gazów w tym
samym ciekłym rozpuszczalniku jest różna
ze wzrostem temperatury rozpuszczalność
gazu w cieczy maleje — PRAWO BEHRA
Total air
O
2
in air
N
2
in air
R
O
Z
P
U
S
Z
C
Z
A
L
N
O
Ś
Ć
,
m
g
g
a
zu
/1
0
0
g
w
o
d
y
TEMPERATURA,
0
C
Gaz w cieczy
ROZPUSZCZALNOŚĆ GAZÓW
W CIECZACH
na ogół gazy,
z wyjątkiem amoniaku
i chlorowcowodorów
,
rozpuszczają się lepiej
w cieczach
organicznych
niż w wodzie
Gaz w cieczy

m = kp
m masa gazu
rozpuszczonego
k współczynnik
proporcjonalności
dla danej cieczy
p ciśnienie
Masa gazu
rozpuszczonego
w danej objętości
cieczy
jest w stałej
temperaturze
wprost
proporcjonalna
do ciśnienia gazu
nad cieczą
Gaz w cieczy
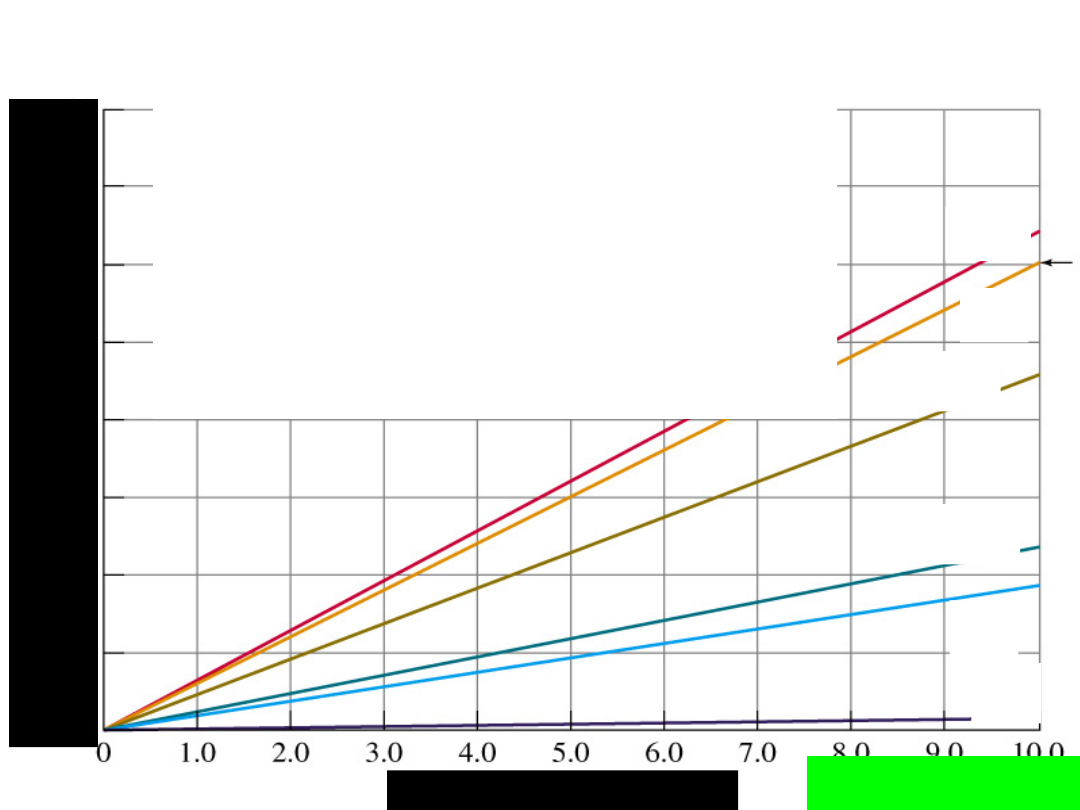
H
2
N
2
CH
4
O
2
Ar
NO
zależność rozpuszczalności
gazów
w cieczy od ciśnienia
wyraża —
PRAWO
HENRY’EGO
(1803r.)
R
O
Z
P
U
S
Z
C
Z
A
L
N
O
Ś
Ć
,
m
g
g
a
zu
/1
0
0
g
w
o
d
y
CIŚNIENIE GAZU,
atm
Gaz w cieczy

ROZPUSZCZALNOŚĆ CIECZY
W CIECZY
ROZPUSZCZALNOŚĆ CIECZY
W CIECZY
Typ I
ciecze
rozpuszczają
się
wzajemnie we
wszystkich
możliwych
stosunkach:
np. alkohol etylowy i woda
Typ II
ciecze praktycznie biorąc, są w
sobie
wzajemnie nierozpuszczalne:
np. woda i benzen
Typ
III
ciecze rozpuszczają się w
sobie w
stopniu ograniczonym, zależnym
od
temperatury
np. w układzie utworzonym z
wody
i eteru tworzą się dwie
warstwy cieczy
ciecz w cieczy

Biorąc pod uwagę stopień
rozdrobnienia
fazy
rozproszonej,
rozróżnia się następujące roztwory ciekłe
(
ciało stałe w cieczy
):
Biorąc pod uwagę
stopień
rozdrobnienia
fazy
rozproszonej,
rozróżnia się następujące
roztwory ciekłe
(
ciało stałe w cieczy
):
układy nietrwałe
, zawierają cząstki
fazy
rozproszonej:
o bardzo dużych rozmiarach
powyżej 100m
widoczne gołym okiem lub przez
mikroskop
świetlny
osadzające się na dnie zbiornika,
lub
unoszące się do góry
1. Zawiesiny
1. Zawiesiny
Ciało stałe w cieczy

układy trwałe
, zawierają cząstki fazy
rozproszonej:
o rozdrobnieniu cząsteczkowym
rozmiary — pojedynczych
cząsteczek
lub rzędu
pojedynczych
cząsteczek
widoczne
w
mikroskopie
elektronowym
nie rozdzielające się w czasie
długotrwałego
stania
2.Roztwory właściwe
2.Roztwory właściwe
Ciało stałe w cieczy
drobne cząstki substancji
rozproszonej
roztworu koloidalnego można
zobaczyć
za pomocą
ultramikroskopu
,
a
najdrobniejsze widoczne są
przez
mikroskop elektronowy
rozmiary cząstek fazy
rozproszonej
mniejsze od cząsteczek
zawiesin, a większe od
cząstek
rozproszonych w roztworach
właściwych
3.Roztwory koloidalne
[roztwory
niewłaściwe]
3.Roztwory koloidalne
[roztwory
niewłaściwe]
Ciało stałe w cieczy

jednorodne
układy doskonale
ze sobą
zmieszanych
cząsteczek
ośrodka
rozpraszającego i
cząsteczek
substancji
rozproszonej
w roztworach
właściwych zachodzi
dokładne wzajemne
przenikanie się
rozpuszczalnika i
ciała
rozpuszczonego,
przy czym za
rozpuszczalnik
przyjmujemy
substancję, która
zachowuje swój
pierwotny stan
skupienia
Ciało stałe w cieczy

Ze względu na
stan skupienia
roztwory
dzieli się na:
stałe
–
stopy metali
ciekłe
– sól fizjologiczna, wódka
gazowe
–
atmosfera, gazy do
anestezji
Ciało stałe w cieczy

roztwór zawierający
największą ilość substancji
stałej,
jaką określona objętość
danego rozpuszczalnika
zdolna jest rozpuścić w
danych warunkach
ciśnienia i temperatury
Ciało stałe w cieczy


miarą rozpuszczalności danej substancji w
rozpuszczalniku
jest stężenie roztworu nasyconego
stopień nasycenia zależy:
od
natury
ciał tworzących
roztwór
w wysokim stopniu od
temperatury
w mniejszym stopniu od
ciśnienia
miarą rozpuszczalności danej substancji w
rozpuszczalniku
jest stężenie roztworu nasyconego
stopień nasycenia zależy:
od
natury
ciał tworzących
roztwór
w wysokim stopniu
od
temperatury
w mniejszym stopniu
od
ciśnienia
ROZPUSZCZALNOŚĆ SUBSTANCJI
STAŁEJ W CIECZY
ROZPUSZCZALNOŚĆ SUBSTANCJI
STAŁEJ W CIECZY
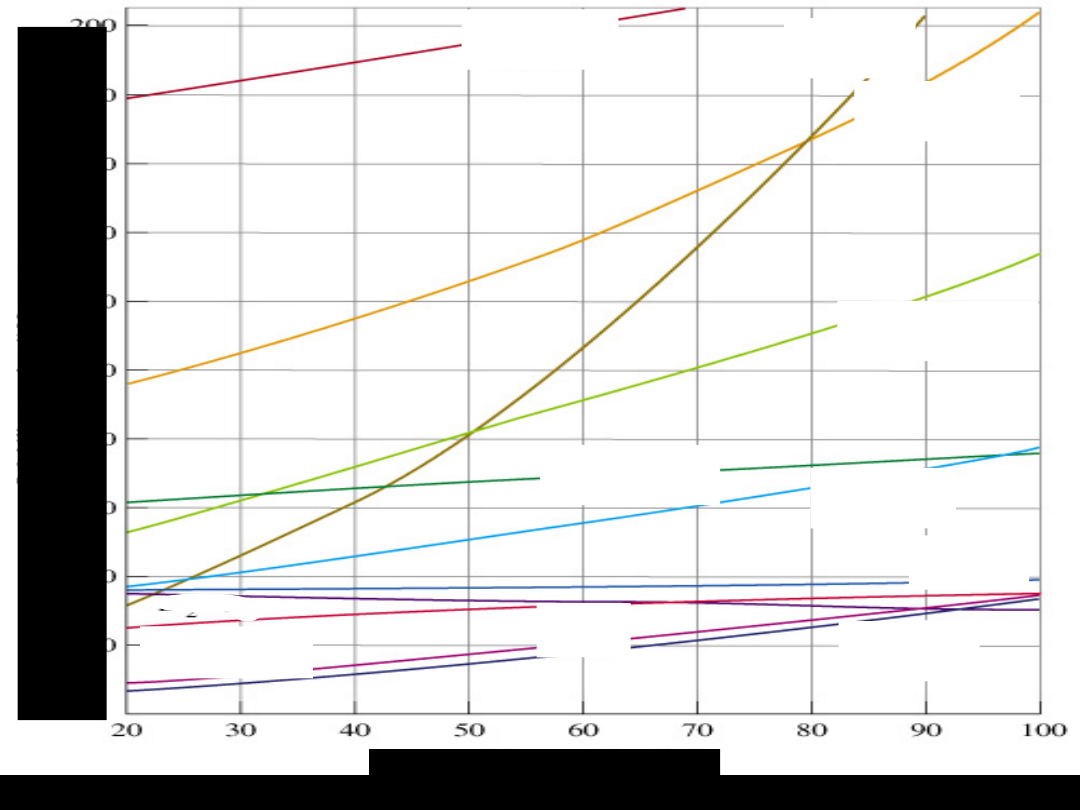
Cs
2
SO
2
NaClO
3
KNO
3
Pb(NO
3
)
2
K
2
CrO
4
NH
4
Cl
NaCl
KlCO
3
KCl
Li
2
SO
4
Ba(NO
3
)
2
R
O
Z
P
U
S
Z
C
Z
A
L
N
O
Ś
Ć
,
g
r
o
zt
w
o
ru
/1
0
0
g
w
o
d
y
TEMPERATURA,
0
C


Zależnie od wymiarów cząstek układów
dyspersyjnych rozróżniamy:
AMIKRONY
od 1 nm do 5 nm
widzialne
w mikroskopie
elektronowym,
SUBMIKRONY
od 5 nm do 200 nm
widoczne w
ultramikroskopie,
MIKRONY
od 200 nm do 100
m
widoczne w
mikroskopie
zwykłym
1.
3.
2.

Roztwory właściwe
Roztwory
koloidalne

Zależnie od stanu skupienia fazy
rozdrobnionej
i
ośrodka
dyspersyjnego
rozróżniamy szereg typów układów koloidalnych
Zależnie od
stanu skupienia fazy
rozdrobnionej
i
ośrodka
dyspersyjnego
rozróżniamy szereg typów układów koloidalnych
Podział koloidów wg W. OSTWALDA
Ośrodek
dyspersyjn
y
Faza
rozproszo
na
Nazwa
układu
Przykłady
gaz
ciecz
gazozole
mgła
gaz
ciało stałe gazozole
dym, kurz
ciecz
gaz
piany, zole
piana mydlana
ciecz
ciecz
emulsje
mleko
homogenizowane
ciecz
ciało stałe zole
suspensoi
dy
roztwory koloidalne w
wodzie siarczków,
wodorotlenków lub
metali
ciało stałe
gaz
piany
stałe
okluzje powietrza w
ciałach stałych np.
minerał sepiolit
ciało stałe
ciecz
piany
stałe
kryształy z
okludowaną wodą
ciało stałe
ciało stałe zole stałe
kryształy z inkluzjami
krystalicznymi
Najbardziej rozpowszechnione i najlepiej
zbadane są
z o l e
z ośrodkiem dyspersyjnym
ciekłym, zwykle nazywane
roztworami
koloidalnymi
hydrozola
mi
-
roztwory
koloidowe,
w których
ośrodkiem
dyspersyjny
m jest woda
alkozola
mi
-
roztwory
w alkoholu
organozol
ami
-
roztwory
w cieczach
organicznych
Pod względem
stosunku fazy rozproszonej
do fazy ciekłej, koloidy
można podzielić na:
liofilowe
liofilowe
liofobowe
liofobowe

Cząstki koloidu liofilowego ulegają
solwatacji
Cząstki koloidu liofilowego ulegają
solwatacji
Do grupy koloidów liofilowych należą
koloidy
cząsteczkowe
Cząstki koloidu liofobowego nie
ulegają solwatacji, albo ulegają tylko
w bardzo nieznacznym stopniu
Cząstki koloidu liofobowego nie
ulegają solwatacji, albo ulegają tylko
w bardzo nieznacznym stopniu

Koloidy pod wpływem:
- ogrzewania,
-
mocnych
elektrolitów,
- odparowania
- wymrożenia
ulegają koagulacji
żel
koagulacja
zol
żel
peptyzacja
zol

W zależności od zachowania się osadów
powstających podczas osadzania się fazy
rozproszonej, koloidy dzieli się na:
W zależności od zachowania się osadów
powstających podczas osadzania się fazy
rozproszonej, koloidy dzieli się na:
odwracalne
nieodwracalne
zol odwracalny
odparowany do
sucha daje się
łatwo
peptyzować
wytrącone osady koloidów
nieodwracalnych przy
zwykłym zetknięciu się z fazą
ciekłą nie dają zolu
wszystkie koloidy liofobowe
są nieodwracalne

Ze względu na budowę
cząsteczki koloidy dzielimy
na:
Ze względu na budowę
cząsteczki koloidy dzielimy
na:
fazowe
cząsteczkowe
asocjacyjne
KOLOIDY FAZOWE
wyróżniają się fizyczną
niejednorodnością
—
powstają przez rozdrobnienie większych
cząstek
lub strącenie z roztworów właściwych
—
są to koloidy
liofobowe
—
cząstki fazy rozproszonej tworzą
odrębną fazę
o ogromnej powierzchni rozdziału
—
koloidami tego typu są zole AgCl, AgI,
Ag
2
S
3
KOLOIDY CZĄSTECZKOWE
—
fazę rozproszoną stanowią
pojedyncze
makrocząsteczki, składające się z
tysięcy
atomów
—
charakter koloidalny jest wynikiem
ich budowy
chemicznej, a nie agregacji
—
są to koloidy liofolowe
—
należą do nich polimery, białka
KOLOIDY ASOCJACYJNE
—
powstają przez samorzutne skupienie
się dużej
liczby małych cząsteczek w agregaty,
po
przekroczeniu pewnego stężenia
—
należą do nich roztwory mydeł
i innych
detergentów
obniżenie temp., zatężenie
ZOL ROZTWÓR
WŁAŚCIWY
obniżenie temp., zatężenie
ZOL
ROZTWÓR
WŁAŚCIWY
ZOL ROZTWÓR
WŁAŚCIWY
podwyższenie temp., rozcieńczanie
ZOL
ROZTWÓR
WŁAŚCIWY
podwyższenie temp., rozcieńczanie
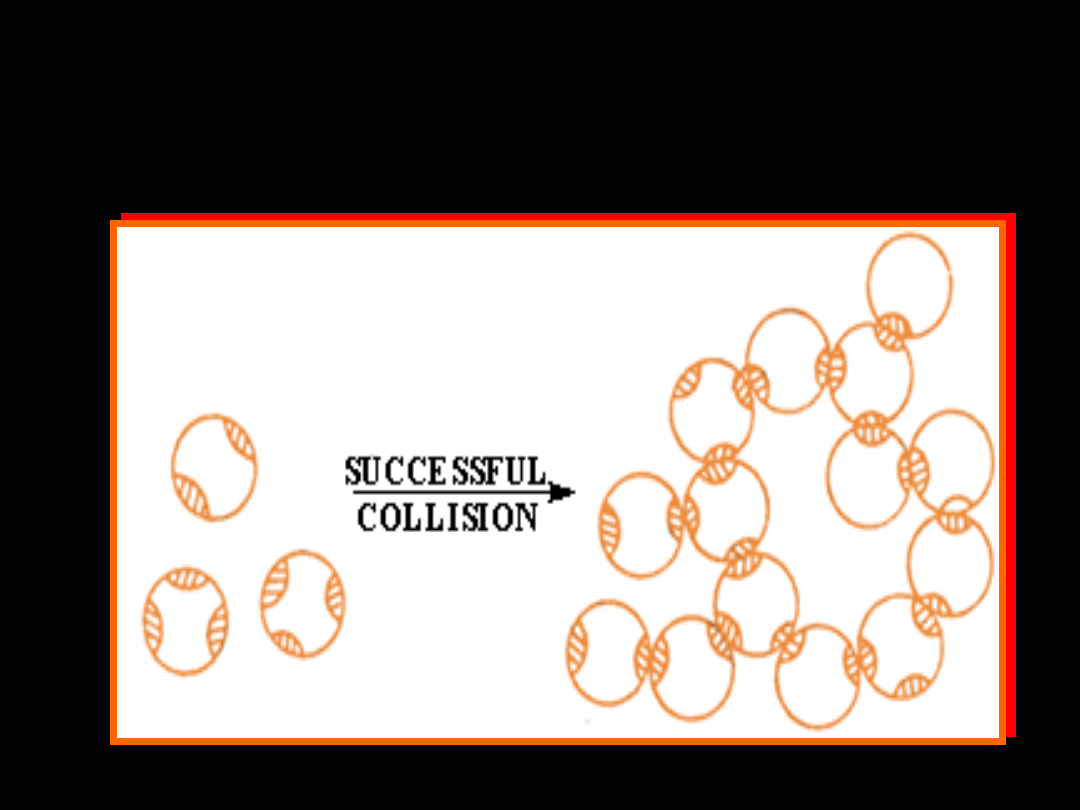
Asocjacja cząsteczek
koloidów


na drodze
rozdrobnie
nia cząstek
większych
metody
dyspersyj
ne
przez
tworzenie
agregatów
złożonych
z
oddzielnych
cząsteczek
metody
kondensac
yjne
UKŁADY
KOLOIDALNE
można
otrzymywać:


Właściwości układów
koloidalnych
są związane z:
Właściwości układów
koloidalnych
są związane z:
—
rozwiniętą
powierzchnią
fazy rozproszonej
— wymiarami cząstek
—
wymiarami cząstek
brak
stożka
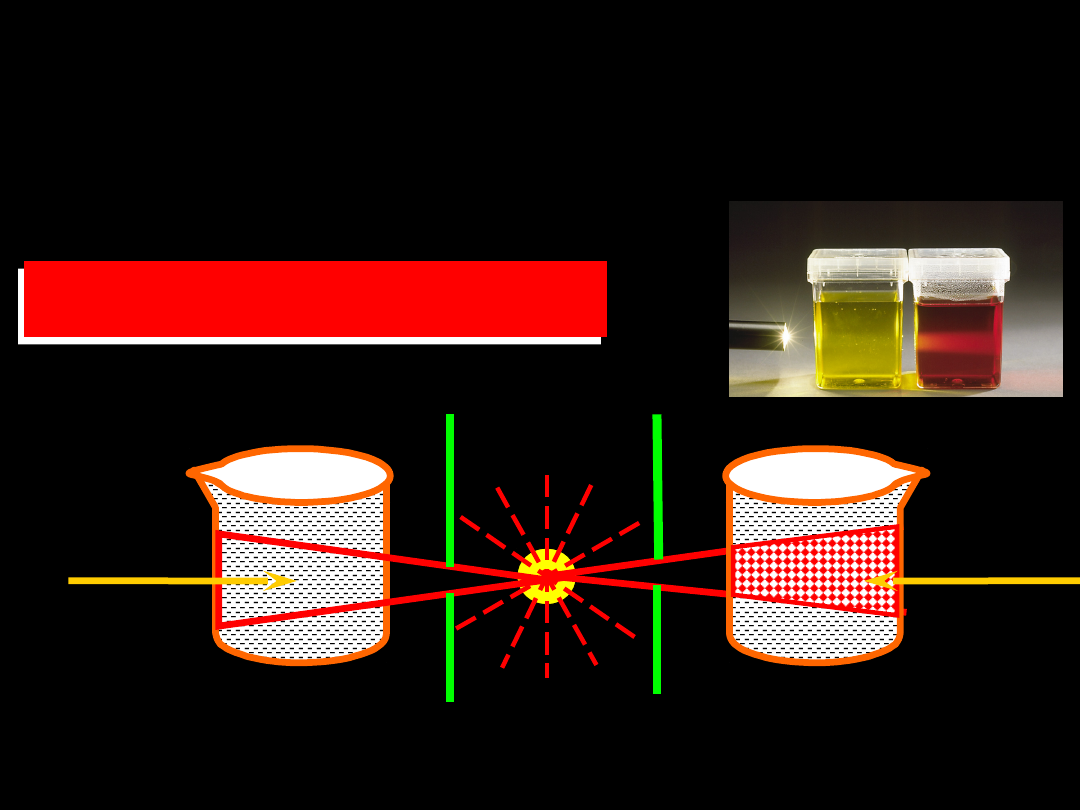
EFEKT TYNDALLA
EFEKT TYNDALLA
stożek
Tyndalla
roztwór
właściw
y
źródło
światła
roztwór
koloidaln
y
Użycie
ultramikroskopu
pozwala obserwować
światło rozproszone na poszczególnych
cząstkach koloidalnych
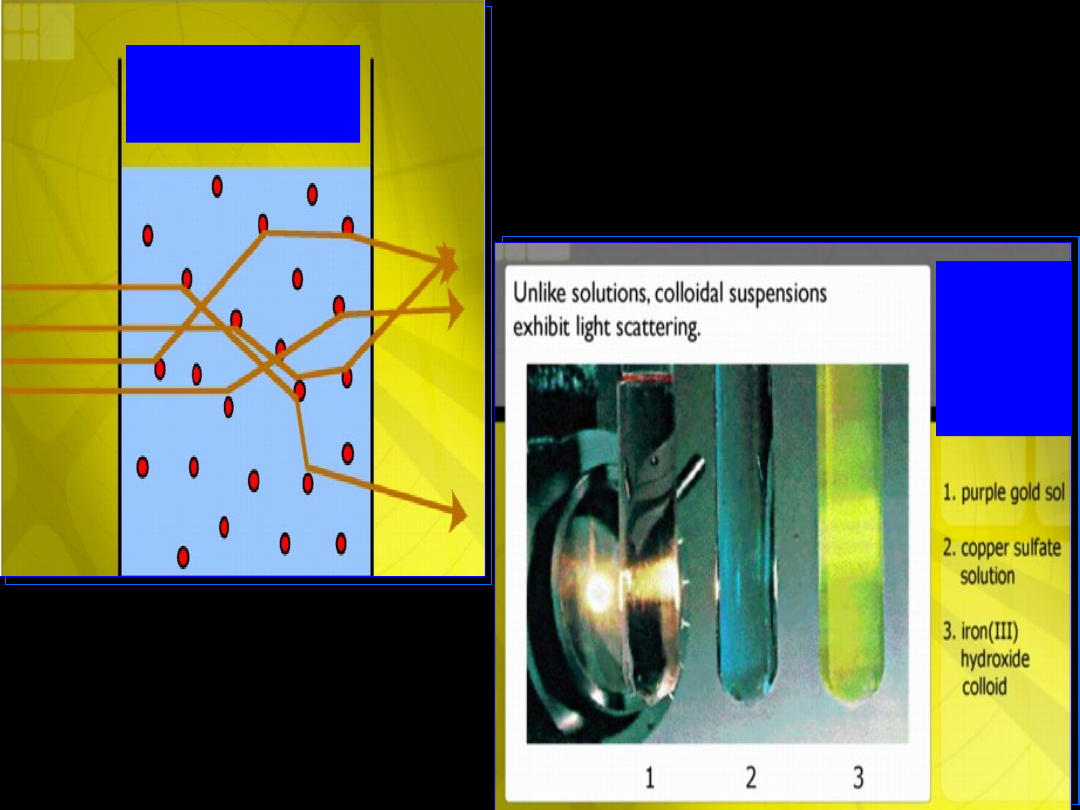
Tyndal
effect
Tynda
l
effect

Przejście światła
przez roztwór właściwy i koloidalny
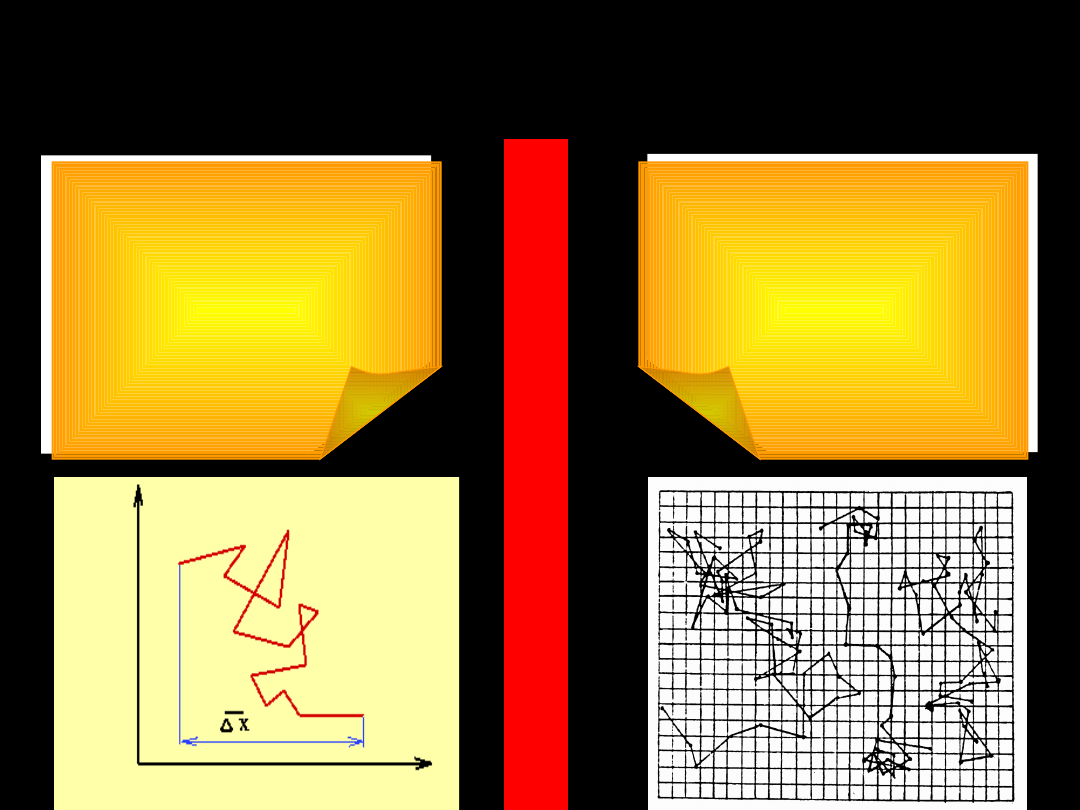
R
U
C
H
Y
B
R
O
W
N
A
Ruchy te zwane
ruchami Browna są
wynikiem zderzeń,
którym ulegają
cząstki koloidalne
z cząstkami
ośrodka
dyspersyjnego
Ruchy Browna
występują wyraźniej
w koloidach
hydrofobowych
niż
w hydrofilowych
Cząstki koloidalne zawieszone w cieczy,
oglądane pod ultramikroskopem, wykazują
ciągły, nieuporządkowany ruch drgający
Cząstki koloidalne zawieszone w cieczy,
oglądane pod ultramikroskopem, wykazują
ciągły, nieuporządkowany ruch drgający

cząsteczki lub jony są przepuszczalne
cząsteczki koloidowe są zatrzymane
proces rozdzielania
substancji
wykorzystujący różnice
ich zdolności
przenikania przez
błony
półprzepuszczalne —
— zwierzęce, roślinne
lub otrzymanych
sztucznie
(np. pęcherz wołowy,
pergamin,
błony z kolodium)
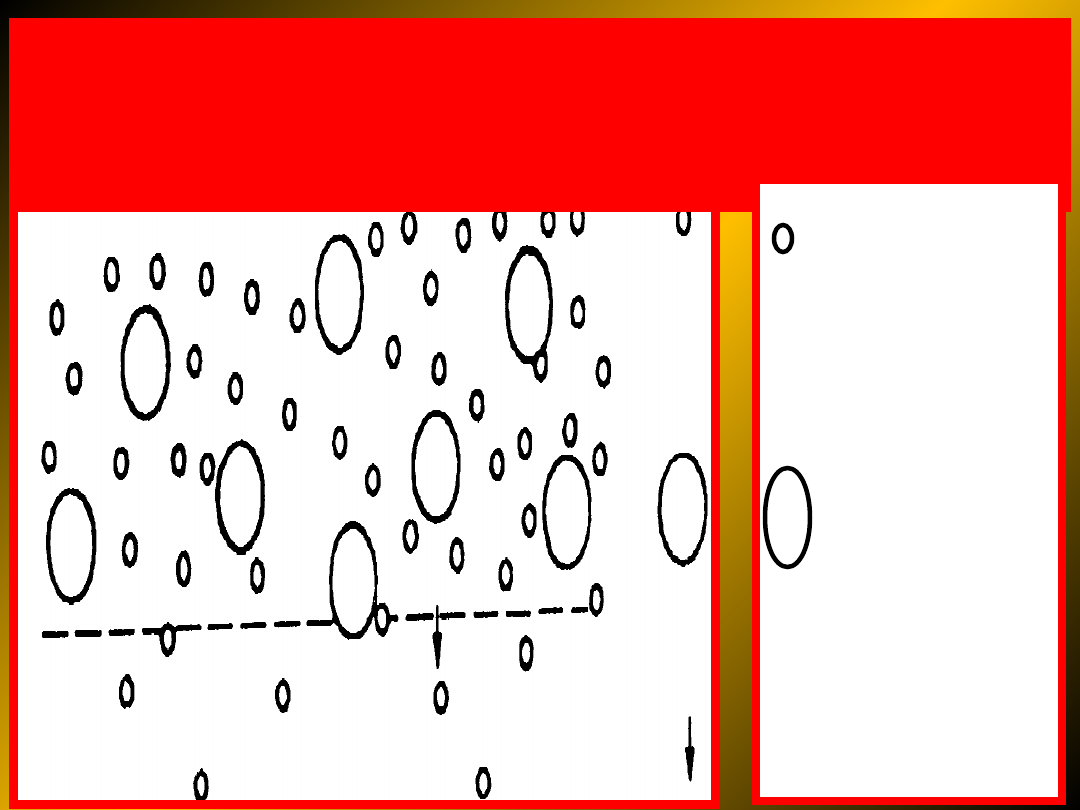
S C H E M A T
procesu dyfuzyjnego na błonie
półprzepuszczalnej
substancja o
rozdrobieniu
cząsteczkowy
m lub
jonowym –
zanieczyszcze
nia układu
koloidalnego
cząstka
koloidalna
kierunek
dyfuzji
zanieczyszcz
eń (dążność
układu do
wyrównania
stężeń)
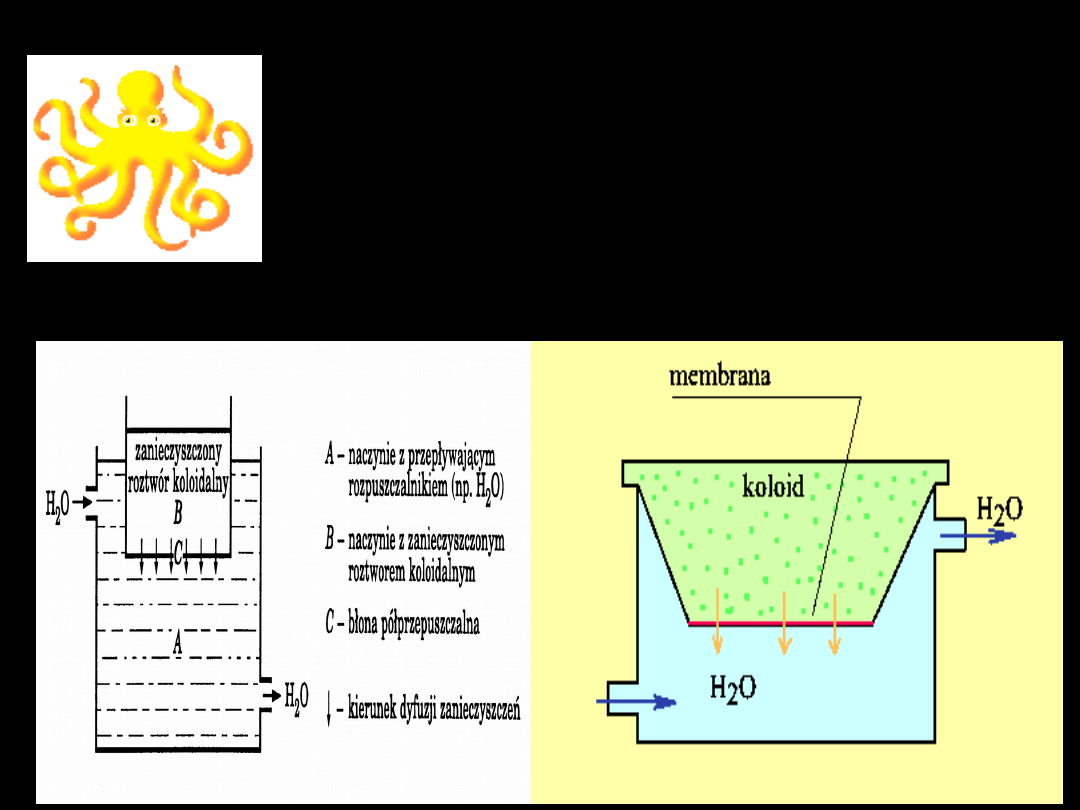
A
C
B
Schemat dializy
DIALIZĘ
najczęściej
stosuje się do oczyszczania
układu koloidalnego od
zanieczyszczeń
substancjami
niekoloidalnymi
rozpuszczonymi w ośrodku
dyspersyjnym
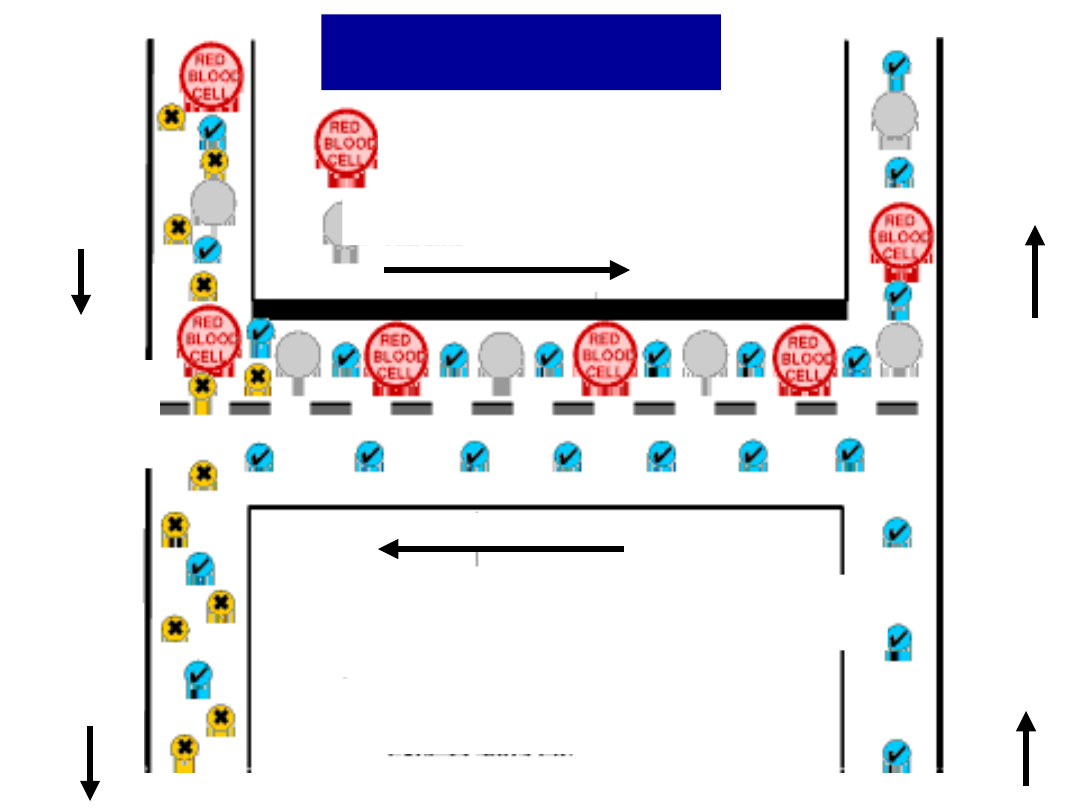
Białka osocza
Erytrocyty
Hemodializa
Kre
w
wpływają
ca
błona
dializacy-
jna
Substancje potrzebne dla organizmu
(glukoza, aminokwasy)
Substancje szkodliwe
(mocznik, nadmiar soli)
Płyn
dializa
-cyjny
wypływa
-
jący
Płyn
dializa-
cyjny
wpływ
Krew
wypływ
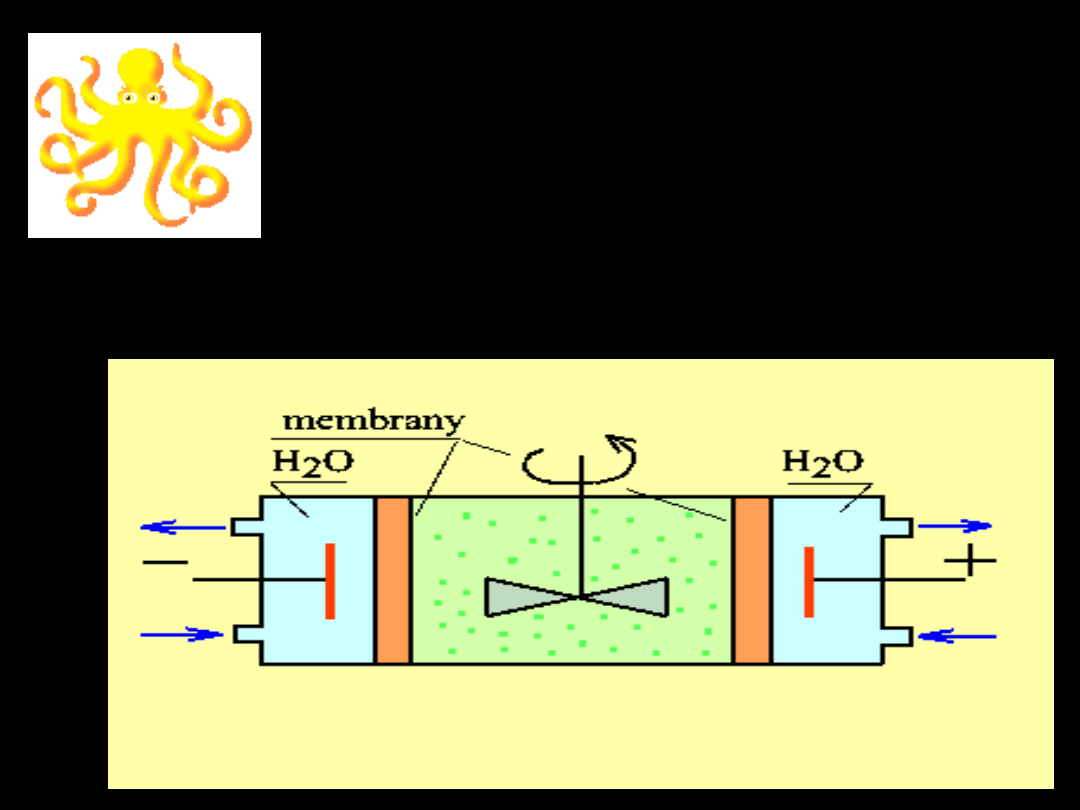
Szybszą metodą
oczyszczania koloidów od
zanieczyszczeń
elektrolitycznych jest
— ELEKTRODIALIZA
—
proces dializy połączony
z
elektrolizą
Szybszą metodą
oczyszczania koloidów od
zanieczyszczeń
elektrolitycznych jest
— ELEKTRODIALIZA
—
proces dializy połączony
z
elektrolizą
Schemat elektrodializy

ŁADUNEK ELEKTRYCZNY
CZĄSTEK KOLOIDALNYCH
ŁADUNEK ELEKTRYCZNY
CZĄSTEK KOLOIDALNYCH
cząstki
koloidalne
naładowane są
elektrycznie
cząstki
koloidalne
naładowane są
elektrycznie
ładunek koloidów może
być wywołany:
ładunek koloidów może
być wywołany:
selektywną
adsorpcję
poszczególnych
jonów
elektryzacją
stykową
dysocjacją
elektrolityczną
cząstek
koloidalnych
[As
2
S
3
]
m
.
nHS
– .
(n–x)H
+
jądro
granula
powłoka
adsorpcyjna
+
=
granula
powłoka adsorpcyjna
jadro
micela
powłoka
dyfuzyjna
{[As
2
S
3
]
m
.
nHS
–
.
(n–x)H
+
} + xH
+

zmiany składu jonowego cieczy mogą
wywołać
zmianę
ładunku
elektrycznego warstw
ten sam koloid może mieć w
różnych warunkach ładunek
dodatni lub ujemny
AgI
powstały na drodze reakcji:
3
3
AgNO
KI
AgI KNO
+ �
+
3
3
AgNO
KI
AgI KNO
+ �
+
ładunek dodani
przy nadmiarze AgNO
3
ładunek ujemny
przy stosowaniu nadmiaru
KI,
może mieć:
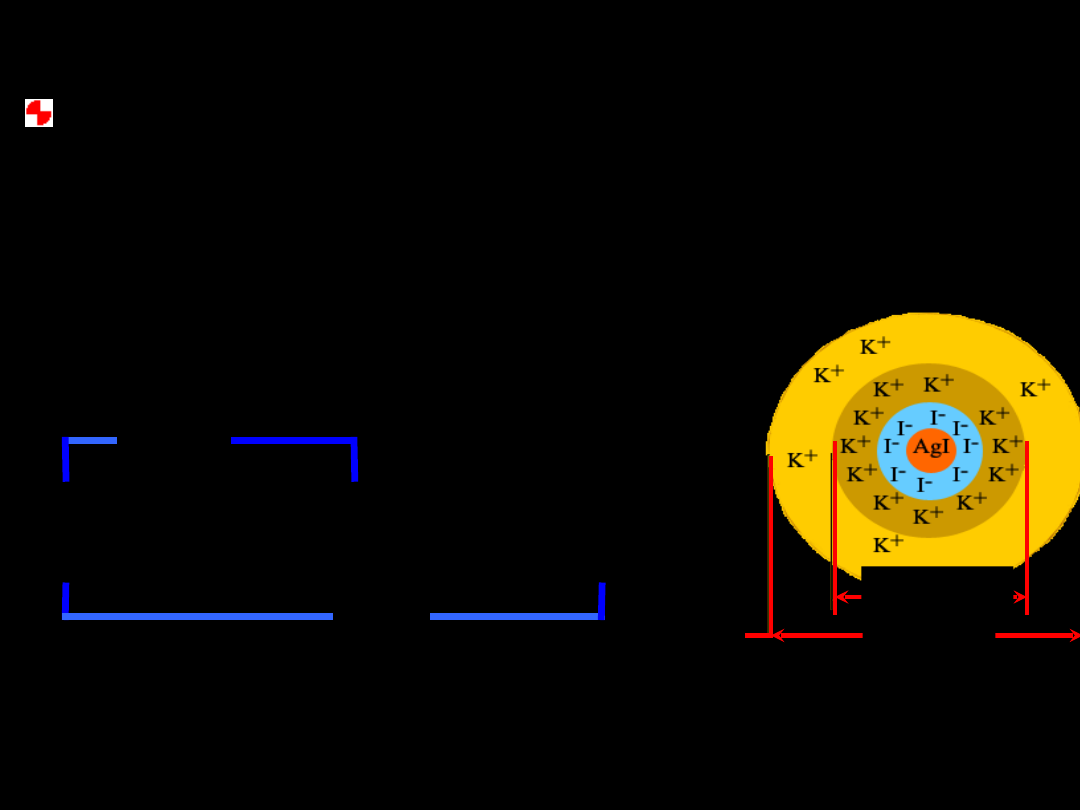
ładunek ujemny
przy stosowaniu nadmiaru KI,
m
{[AgI]
nI (n x)K } xK
-
+
+
� � -
+
m
{[AgI]
nI (n x)K } xK
-
+
+
� � -
+
obecności
w
AgI
Micela
powłoka
dyfuzyjna
{[AgI]
m
.
nI
–
.
(n–x)K
+
} +
xK
+
granula
powłoka
adsorpcyjna
jądro
micela
granula
micela
KI K
+
+ I
–
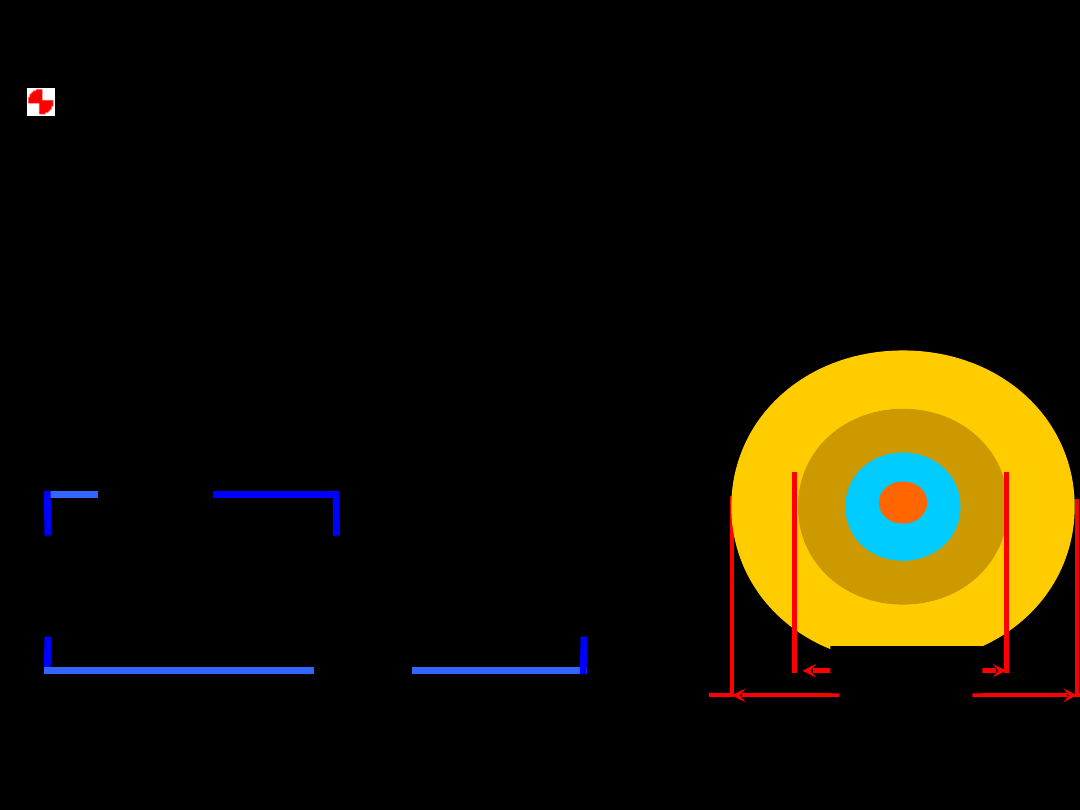
ładunek dodani
przy nadmiarze AgNO
3
m
3
3
{[AgI]
nAg (n x)NO } xNO
+
-
-
�
-
+
m
3
3
{[AgI]
nAg (n x)NO } xNO
+
-
-
�
-
+
obecności
w
AgI
Micela
powłoka
dyfuzyjna
granula
powłoka
adsorpcyjna
jądro
{[AgI]
m
.
nAg
+
.
(n–x)NO
3
-
} +
x
NO
3
-
I
-
micela
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
Ag
+
Ag
+
Ag
+
Ag
+
Ag
+
Ag
+
AgI
granula
micela
3
3
AgNO
Ag
NO
+
-
�
+

druga przyczyna ładunku cząstek
koloidowych
—
elektryzacja
stykowa
druga przyczyna ładunku cząstek
koloidowych
—
elektryzacja
stykowa
zgodnie z tzw.
regułą Coehna
ciało o niższej stałej dielektrycznej
ładuje się ujemnie w zetknięciu z
ciałem
o
wyższej
stałej
dielektrycznej,
dlatego
w
roztworze
wodnym
cząstki
koloidów na ogół mają ładunek
ujemny

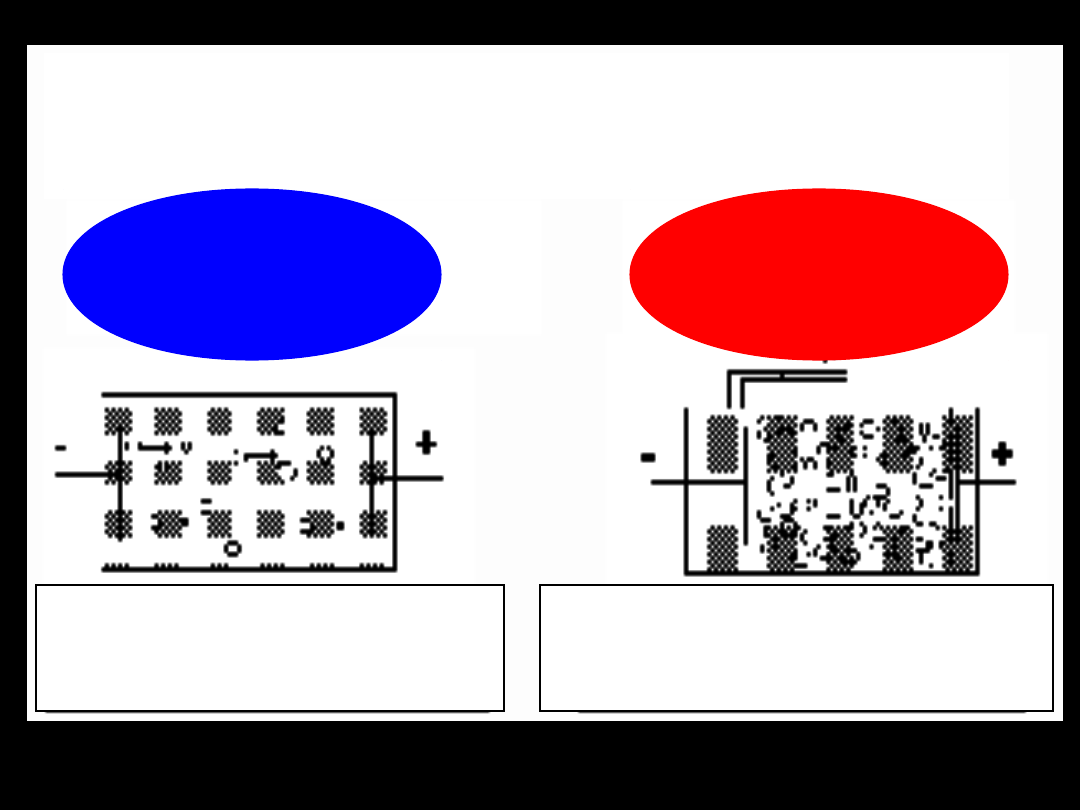
ELEKTROFOREZA
E l e k t r o f o r e z
a
zjawisko elektrokinetyczne
polegające na
ruchu naładowanych
elektrycznie cząstek koloidowych
pod wpływem napięcia
elektrycznego
albo
ku katodzie
katoforeza
lub
ku anodzie
anoforeza
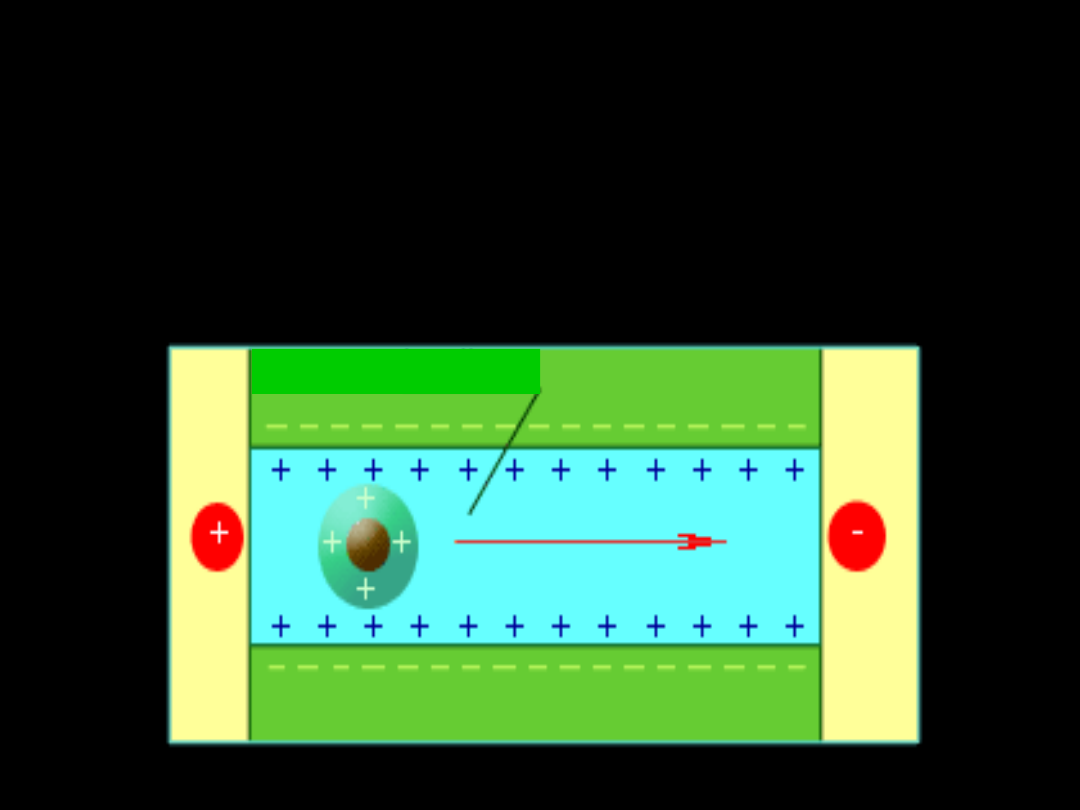
Ruch
cząstek koloidu
w czasie
elektrofeorezy
cząstka koloidu
E
LEKTROOSMOZA
zjawisko
elektrokinetyczne
polegające na
wywołaniu
przez napięcie
elektryczne
ruchu cieczy
względem
nieruchomej
fazy rozproszonej
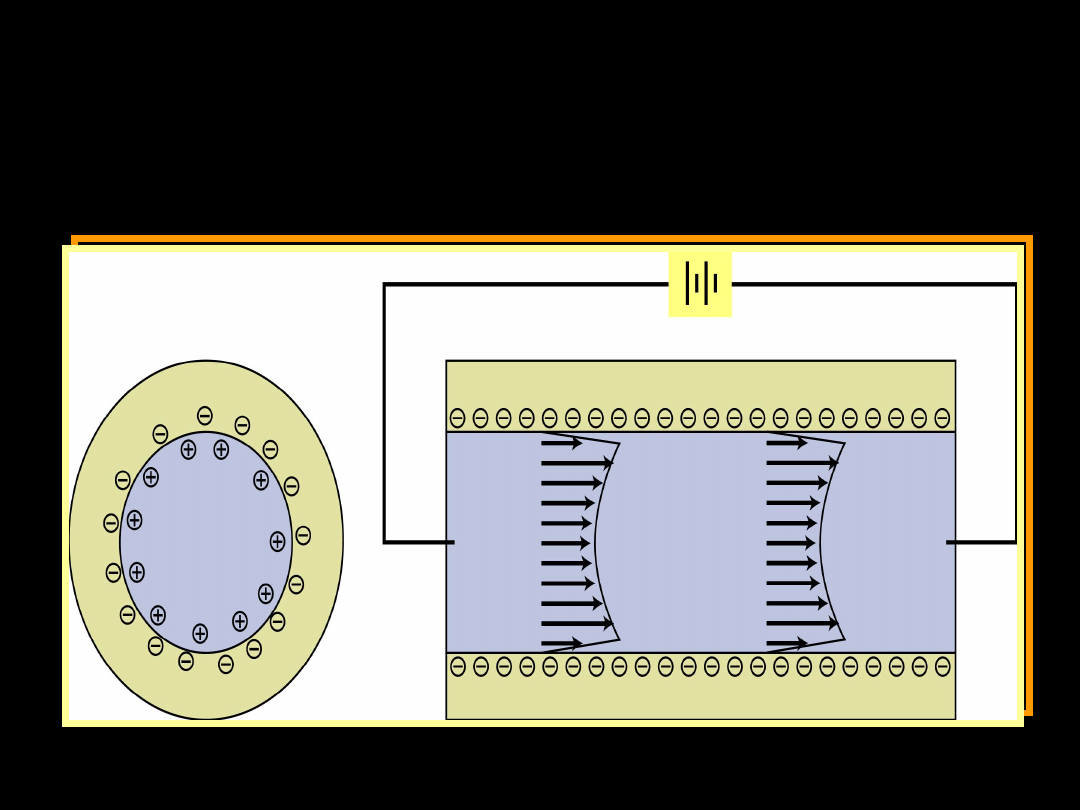
Zjawisko elektroosmozy
Faza stacjonarna – roztwór
Faza ruchoma – cząsteczki koloidu
Faza stacjonarna – cząsteczki koloidu
Faza ruchoma – roztwór
Elektroforeza
Elektroosmoza
D
YFUZJA
w układach koloidalnych
jest zwykle utrudniona
ze względu na:
— duże rozmiary cząstek
— dużą ich bezwładność

Szybkość dyfuzji jest określona
przez prawo Ficka:
x
c
q
D
v
x
c
gdzie:
v
szybkość dyfuzji (masa lub liczba
cząsteczek
dyfundujących w jednostce czasu),
D
współczynnik dyfuzji
q
przekrój, przez który odbywa się
dyfuzja
gradient stężenia, czyli różnica stężeń
cząsteczek
dyfundujących w dwóch warstwach
cieczy
odległych od siebie o x

w roztworach właściwych
wskutek dyfuzji dochodzi do
równomiernego
rozmieszczenia cząsteczek
rozpuszczonych w całej
objętości rozpuszczalnika,
w układach koloidalnych
często nie dochodzi do
całkowitego wyrównania
stężeń, gdyż obok zjawiska
dyfuzji zachodzi zjawisko
sedymentacji cząstek
koloidalnych
LEPKOŚĆ
KOLOIDÓW
Lepkość koloidów jest na ogół większa
od
lepkości
czystego
ośrodka
dyspersyjnego
Lepkość zolów liofobowych niewiele
się różni od lepkości rozpuszczalnika,
gdyż zwykle stężenia tych zoli są małe
Lepkość koloidów liofilowych może
się znacznie różnić od lepkości
ośrodka dyspersyjnego, gdyż stężenia
tych roztworów mogą być znaczne

K
OAGULACJA
Z
OLI
K
OAGULACJA
Z
OLI
KOAGULACJ
A
—
zmniejszenie
stopnia
dyspersji
układu
koloidowego
ZOLE
przechodz
ą
w żele
i zachodzi
sedymenta
cja koloidu

Kationy i aniony o takiej samej
wartościowości jonu zestawione są
według wzrastającej zdolności
koagulacji koloidów w
szeregi
liotropowe
Li
Na
K
Rb
Cs
Li
Na
K
Rb
Cs
2
2
2
2
Mg
Ca
Sr
Ba
2
2
2
2
Mg
Ca
Sr
Ba
Cl
Br
NO
I
CNS
3
Cl
Br
NO
I
CNS
3
Działanie koagulujące elektrolitów
zależy od wartościowości jonu o
ładunku przeciwnym w stosunku do
ładunku cząstek koloidalnych
Koagulację można uzyskać przez
pozbawienie cząstek koloidowych ich
ładunku elektrycznego
Koagulację można uzyskać przez
pozbawienie cząstek koloidowych ich
ładunku elektrycznego

Koagulacja
koloidów
hydrofobowych
zwykle
zachodzi
łatwo
już
przy
niewielkich stężeniach elektrolitu
Koagulacja koloidów hydrofilowych o
cząsteczkach
pokrytych
warstwą
zaadsorbowanych
cząsteczek
wody
zachodzi trudniej tj. przy większych
stężeniach elektrolitu

Przyśpieszoną koagulację koloidu
można osiągnąć przez podwyższenie
temperatury układu i wzrost energii
kinetycznej cząstek
Koagulację
koloidów
dodatnich
można uzyskać przez naświetlenie
promieniami
-
Czynnikiem
koagulującym
jest
również
odparowywanie
lub
wymrażanie ośrodka dyspersyjnego
Przyśpieszoną koagulację koloidu
można osiągnąć przez podwyższenie
temperatury układu i wzrost energii
kinetycznej cząstek
Koagulację
koloidów
dodatnich
można uzyskać przez naświetlenie
promieniami
-
Czynnikiem
koagulującym
jest
również
odparowywanie
lub
wymrażanie ośrodka dyspersyjnego

Przeciwdziałanie
koagulacji
Przeciwdziałanie
koagulacji
zaadsorbowanie na powierzchni cząstek
koloidowych ładunków elektrycznych –
jonów
dodanie koloidu ochronnego -
hydrofilowego

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 11
- Slide 13
- Slide 14
- Slide 15
- Slide 17
- Slide 18
- Slide 20
- Slide 21
- Slide 23
- Slide 24
- Slide 26
- Slide 27
- Slide 28
- Slide 31
- Slide 32
- Slide 33
- Slide 35
- Slide 37
- Slide 40
- Slide 42
- Slide 43
- Slide 44
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 60
- Slide 61
- Slide 64
- Slide 65
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 74
- Slide 76
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 84
- Slide 85
- Slide 86
- Slide 88
- Slide 89
- Slide 92
- Slide 95
- Slide 96
- Slide 98
- Slide 101
- Slide 103
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
Wyszukiwarka
Podobne podstrony:
9 wykad Ukady dyspersyjne [F] 10 2008
15 wykad ukad okresowy[F]2006
10 wykad Statyka kinetyka chemiczna[F 2006]
23 wykad 13 gr[1] borowce[F]2006
12 wykad roztwory buforowe [F]2006
25 wykad 15 gr azotowce 01 2006[F]
Ci±¬a bliąniacza (wyk ad&[1][1] 10 2006)
uk ad pokarmowy
6 wykad WiĄzania chemiczne[F]
Wyk%c5%82ad Niepewno%c5%9b%c4%87 pomiaru
uk-ad krwionoÂny. aq, Biomedyczne podstawy rozwoju i wychowania
UK AD LIMFATYCZNY, rodzaje i zasady masażu
Pytania z Patofizjologii zebrane do 12 wИеcznie wersja 0 01 DODANE TESTY z wyjШЖ, wykИadвwek i egza
uk+éad kr¦ů+ enia
Generatory drgan sinusoidalnych1, Celem ˙wiczenia jest zapoznanie si˙ z wybranymi podstawowymi uk˙ad
PRZEGR 1, Sprawdzi˙ pod wzgl˙dem cieplno-wilgotno˙ciowym przegrod˙ budowlan˙ pionow˙ o nast˙puj˙cym
TEATR OPRACOWANIA I sem, Raszewski- Uk+éad S, Raszewski - układ S
więcej podobnych podstron