

Podstawowe dane
Właściwości fizyczne manganu
Występowanie i otrzymywanie manganu
Właściwości chemiczne manganu
Związki manganu na II stopniu utlenienia
Związki manganu na IV stopniu utlenienia
Związki manganu na VI stopniu utlenienia
Związki manganu na III i V stopniu utlenienia
Związki manganu na VII stopniu utlenienia
Wpływ środowiska reakcji na redukcję jonów MnO
4-
Redukcja jonów MnO
4-
w środowisku kwaśnym
Redukcja jonów MnO
4-
w środowisku obojętnym
Redukcja jonów MnO
4-
w środowisku zasadowym
Podsumowanie
Dla dociekliwych
Spis treści
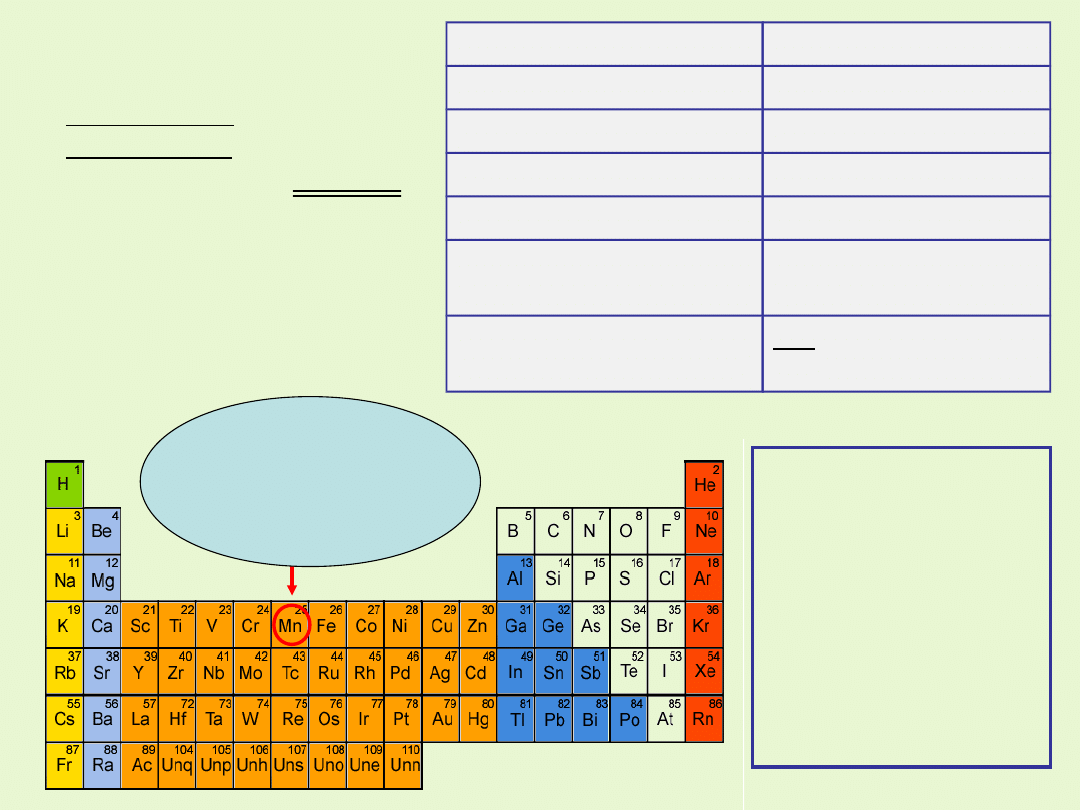
Podstawowe dane
Symbol
Mn
Nazwa łacińska
Manganum
Nazwa angielska
Manganese
Liczba atomowa
25
Masa atomowa
54,94 u
Elektroujemność
(Pauling)
1,55
Stopnie utlenienia
+2,+4,+6,+7
(+3,+5)
Grupa 7 (VII B)
Okres IV
Blok energetyczny d
Konfiguracja
elektronowa
5
2
6
2
6
2
2
3d
4s
3p
3s
2p
2s
1s
Izotopy
Trwały jest tylko
izotop
55
Mn, który
stanowi niemal
100% składu
izotopowego
manganu
występującego w
naturze.

Występowanie i otrzymywanie
Mangan stanowi 0,08% masy skorupy ziemskiej.
Najważniejszą rudą manganu jest braunsztyn lub piroluzyt MnO
2
,
zanieczyszczony zawsze przez związki żelaza. Poza tym w metalurgii
manganu mają znaczenie braunit Mn
2
O
3
, manganit MnO(OH), hausmanit
Mn
3
O
4
i szpat manganu MnCO
3
.
Obecny jest w centrach reaktywności wielu enzymów (jest niezbędny dla
zdrowia jako katalizator w metabolizmie węglowodanów i lipidów).
Metaliczny mangan można otrzymać poprzez:
- redukcję tlenków glinem w reakcji aluminotermii:
3MnO
2
+ 4Al → 2Al
2
O
3
+ 3Mn
3Mn
3
O
4
+ 8Al →9Mn + 4Al
2
O
3
-elektrolizę wodnych roztworów soli manganu (II),
- w wyniku redukcji MnO
2
węglem.

Właściwości fizyczne
Stan skupienia
stały
Budowa
krystaliczna
Barwa
srebrzysta - szara
Gęstość
7,4 g/cm
3
Twardość
(prawie tak twardy jak skaleń)
Kruchość
kruchy (można proszkować w
moździerzu)
Ciepło właściwe
486 J/kg×K
Temperatura topnienia
1220
o
C
Temperatura wrzenia
2060°C
Przewodność elektryczna
0,695×10
6
S/m
Właściwości magnetyczne
paramagnetyk
Zależnie od temperatury, przyjmuje cztery formy alotropowe
mające różne gęstości: poniżej 700 °C: odmiana α, między
700 °C a 1079 °C: odmiana β, między 1079 °C a 1143°: odmiana
γ, powyżej 1143°: odmiana δ

Właściwości chemiczne
Mangan w szeregu napięciowym metali zajmuje miejsce między glinem i
cynkiem, dlatego łatwo rozpuszcza się w kwasach nieutleniających
wypierając wodór i tworzy sole, w których występuje jako jon Mn
2+
, z
wody wypiera wodór.
W stanie litym w powietrzu w temperaturze pokojowej jest trwały,
natomiast rozdrobniony utlenia się łatwo.
Ogrzewany na powietrzu spala się na tlenek manganu (II).
Reaguje z siarką, chlorem, a nawet z azotem ( w t >1200
o
C) dając
azotek Mn
3
N
2
.
Wykazuje zdolność do występowania na różnych stopniach utlenienia
od +1 do +7 ( 7 elektronów walencyjnych). Najważniejsze stopnie
utlenienia to II, IV, VII.
Najtrwalszym stopniem utlenienia dla manganu jest II ( zwłaszcza w
środowisku kwaśnym).
Na II stopniu utlenienia występuje w postaci jonów Mn
2+
,
Związki manganu na III stopniu utlenienia wykazują tendencje do
dysproporcjonowania na związki manganu II i IV.
Charakter tlenków zmienia się z zasadowego na kwasowy w miarę
podwyższenia stopnia utlenienia.
)
,
,
(
2
3
2
VII
VI
V
Mn
kwasowe
MnO
ny
amfoterycz
O
Mn
zasadowy
MnO
zasadowy
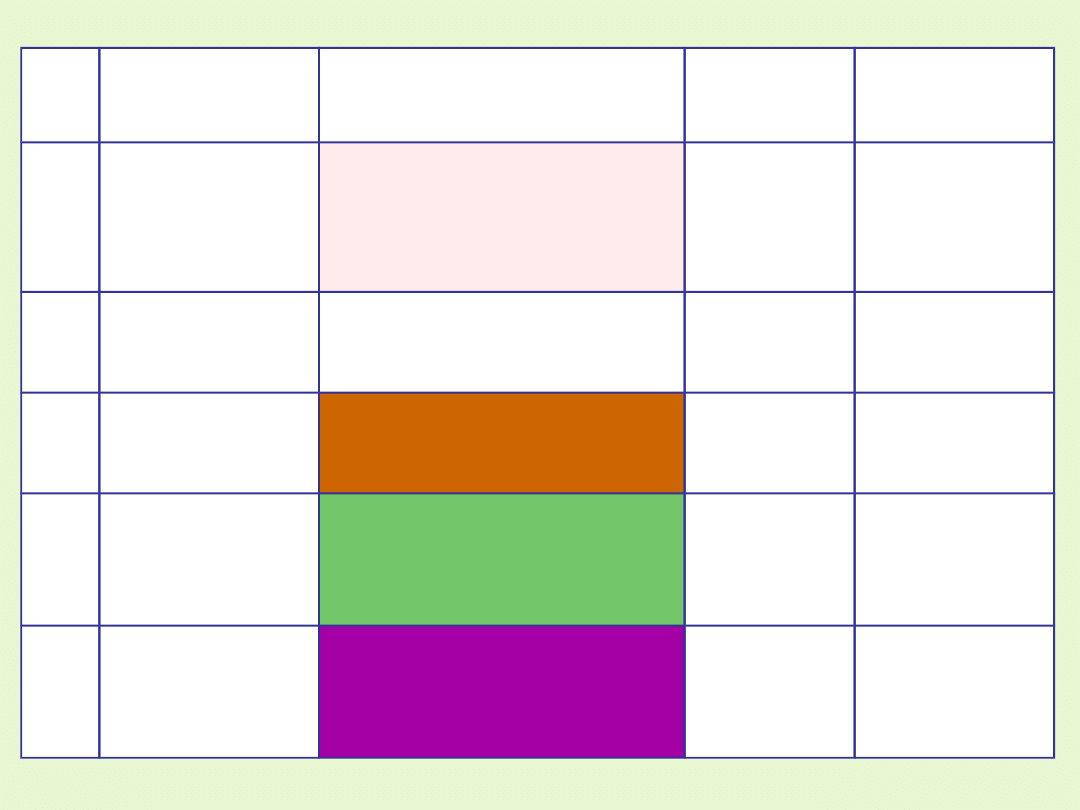
Związki
Barwa w
roztworze
Bezwodne
II
Cechy
metaliczne
Mn
2+
sole manganu
trwałe w roztworach
wodnych
jasno
różowa
biała(MnSO
4
)
blado -
różowa
MnCl
2
III
Cechy
metaliczne
Sole Mn
3+
manganu
trwałe w kryształach
czerwone
IV
Cechy
amfoteryczne
Tlenek
MnO
2
- braunsztyn
brunatny
VI
Cechy
kwasotwórcze
MnO
4
2-
- manganian
zielona
fioletowe
VII
Cechy
kwasotwórcze
MnO
4
-
- manganian(VII)
fioletowo –
czerwona
fioletowo-
czerwone
Związki manganu na II stopniu utlenienia
Związki manganu(II) zawierają mangan dwuwartościowy i
są najtrwalsze
ze wszystkich połączeń manganu.
Tlenek manganu (II)
MnO (szaro-zielonkawy)
ma charakter zasadowy.
MnO + 2HCl → MnCl
2
+ H
2
O
Wodorotlenek manganu(II)
jest nierozpuszczalny w wodzie i
tworzy biały osad
Ma wyłącznie charakter zasadowy
.
Pod wpływem tlenu atmosferycznego utlenia się do brunatnego
uwodnionego tlenku manganu (IV): 2Mn(OH)
2
+ O
2
→ 2MnO
2
·H
2
O
W roztworach wodnych mangan(II) występuje w postaci jonów Mn
2+.

Związki manganu na III i V stopniu utlenienia
Tlenek manganu(III) wykazuje właściwości zasadowe.
Reaguje z odpowiednimi kwasami dając sole manganu(III), które są
bardzo nietrwałe i łatwo ulegają dalszemu utlenieniu. Pod działaniem
wody ulegają prawie całkowitej hydrolizie.
Mn
2
O
3
występuje w przyrodzie jako minerał braunit.
W laboratorium jest otrzymywany w postaci czarnego
proszku w wyniku ogrzewania MnO
2
:
2
3
2
2
O
O
Mn
2
MnO
4
Mangan na stopniu utlenienia (V) wykazuje właściwości niemetaliczne i
tworzy manganiany (V) – podmanganiany (MnO
4
3-
).
W roztworach wodnych obojętnych i zakwaszonych ulegają
dysproporcjonowaniu do związków Mn(IV) i Mn(VI):
OH
4
MnO
MnO
O
H
2
MnO
2
2
2
4
2
3
4

Związki manganu na IV stopniu utlenienia
Tlenek manganu(IV)
występuje w przyrodzie jako minerał
braunsztyn
(pirouluzyt) i jest najtrwalszym związkiem manganu(IV).
Ogrzewany w powietrzu(>530
o
C) rozkłada się z utworzeniem
tlenku manganu(III) i wolnego tlenu:
Ogrzany jeszcze mocniej przechodzi w najtrwalszy mieszany tlenek –
2MnO·MnO
2
Zarówno uwodniony jak i bezwodny MnO
2
wykazuje właściwości
amfoteryczne.
1.W reakcji z kwasami zachowuje się jak tlenek zasadowy,
jednocześnie wykazując właściwości utleniające:
Sole manganu(IV) są bardzo nietrwałe i szybko ulegają rozkładowi,
zwłaszcza w podwyższonej temperaturze.
2. W reakcji z zasadami i tlenkami metali tworzy nietrwałe i
trudne do otrzymania sole – manganiny(IV):
CaO + MnO
2
→ CaMnO
3
W środowisku zasadowym, przy dostępie tlenu utlenia się do
manganianów.
O
H
2
Cl
MnCl
HCl
4
MnO
2
2
2
T
2
O
H
2
O
MnSO
2
SO
H
2
MnO
2
2
2
4
4
2
2
O
H
2
MnO
2
O
OH
4
MnO
2
2
2
4
2
2
2
3
2
2
O
O
Mn
2
MnO
4
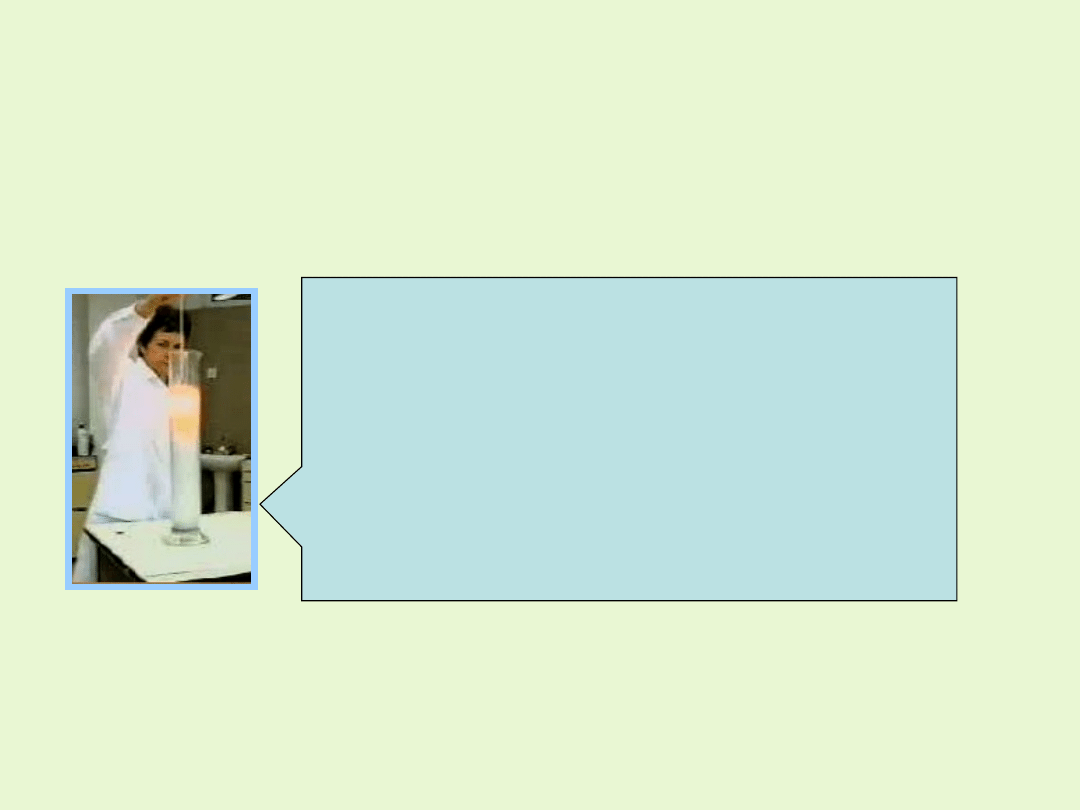
Dwutlenek manganu jest katalizatorem niektórych reakcji, m.in. rozkładu
nadtlenku wodoru, a w mieszaninie z tlenkiem miedzi przyspiesza
utlenianie tlenku węgla (CO) do dwutlenku węgla (CO
2
), co
wykorzystywane jest do oczyszczania powietrza (np. w pochłaniaczach
masek przeciwgazowych).
Po wrzuceniu do perhydrolu kilku kryształków
tlenku manganu (IV) rozpoczyna się burzliwa
i gwałtowna reakcja, w czasie której trwania
roztwór intensywnie się ogrzewa, co powoduje
wrzenie wody i ucieczkę powstałej pary
wodnej, wymieszanej z tlenem przez wylot
kolby.
Reakcja z czasem słabnie, aż do całkowitego
rozkładu tlenku manganu (IV).
Związki manganu na VI stopniu utlenienia
Manganiany(VI) sole - odpowiadające bezwodnikowi kwasowemu MnO
3
posiadają właściwości utleniające.
W roztworach wodnych mają barwę zieloną.
Trwałe są tylko w roztworach zasadowych.
W roztworach obojętnych i kwaśnych ulegają dysproporcjonowaniu na
tlenek manganu(IV) i manganiany(VII).
Kwas manganowy(VI) H
2
MnO
4
nie jest znany w stanie wolnym. Jon
kwasu manganowego(VI) nie może bowiem istnieć w roztworze obok
jonów wodorowych.
Otrzymywane są przez stapianie tlenku manganu(IV) z wodorotlenkami
litowców i utleniaczami.
O
H
2
MnO
MnO
2
H
4
MnO
3
2
2
4
2
4

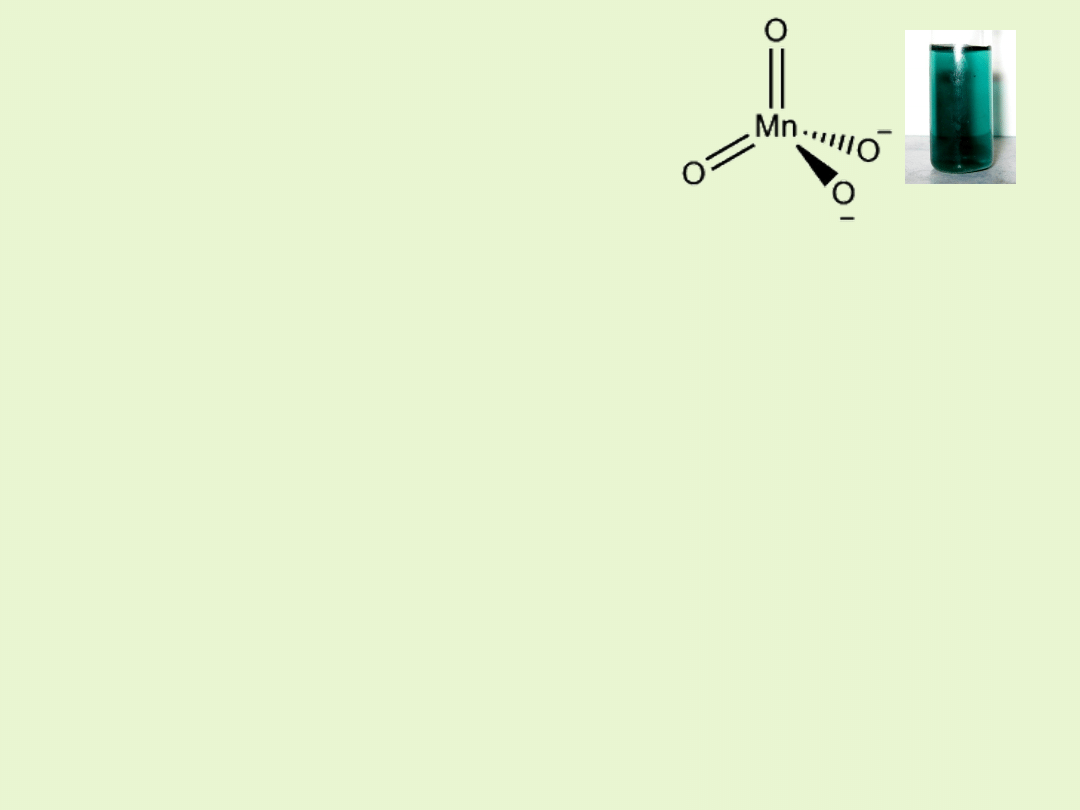
Związki manganu na VII stopniu utlenienia
Kwas manganowy(VII) /nadmanganowy/ HMnO
4
nie jest znany,
natomiast znamy jego bezwodnik Mn
2
O
7
.
Jony MnO
4
-
mają intensywną fioletowo – czerwoną barwę.
W temperaturze powyżej 230
o
C ulega rozkładowi termicznemu:
2KMnO
4
→ K
2
MnO
4
+ MnO
2
+ O
2
↑
Związki manganu(VII) są silnymi utleniaczami.
Związki manganu występującego na VII
stopniu utlenienia są silnymi utleniaczami,
jednak ich właściwości utleniające zależą od
odczynu roztworu!!
Wpływ środowiska reakcji na redukcję jonów MnO
4
-
.
2
MnO
2
Mn
4
MnO
2
4
MnO
ΟΗ
3
2
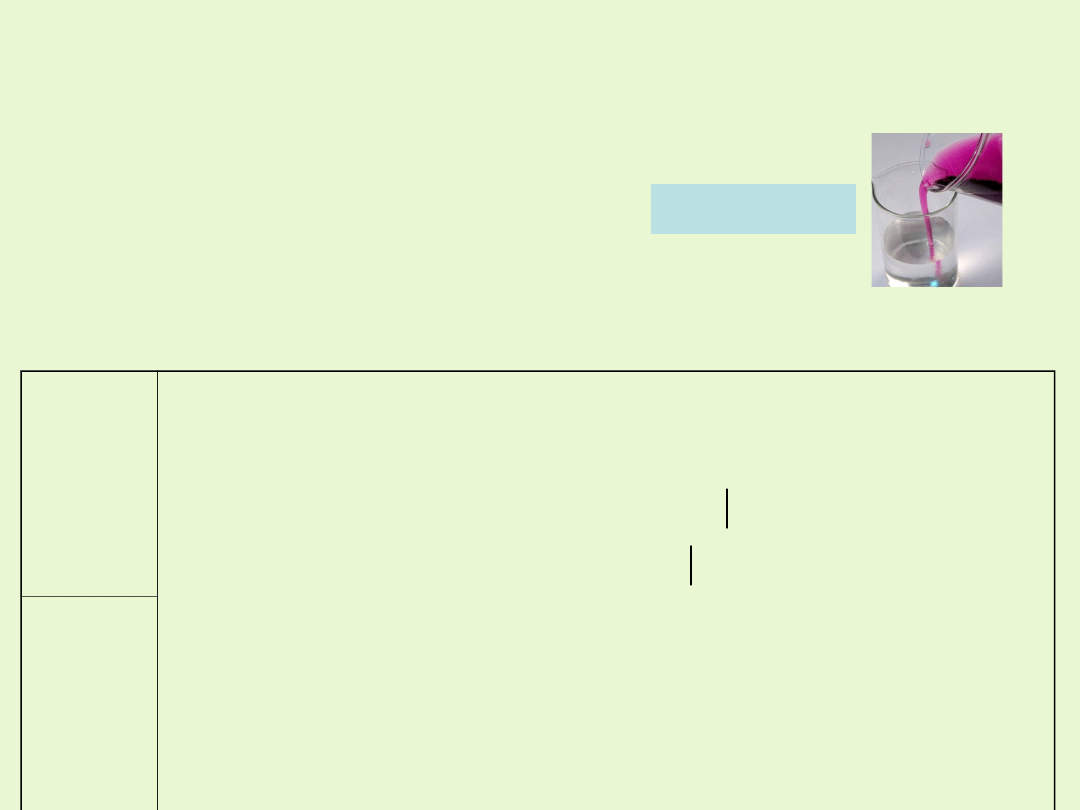
Redukcja jonów MnO
4
-
w środowisku kwaśnym
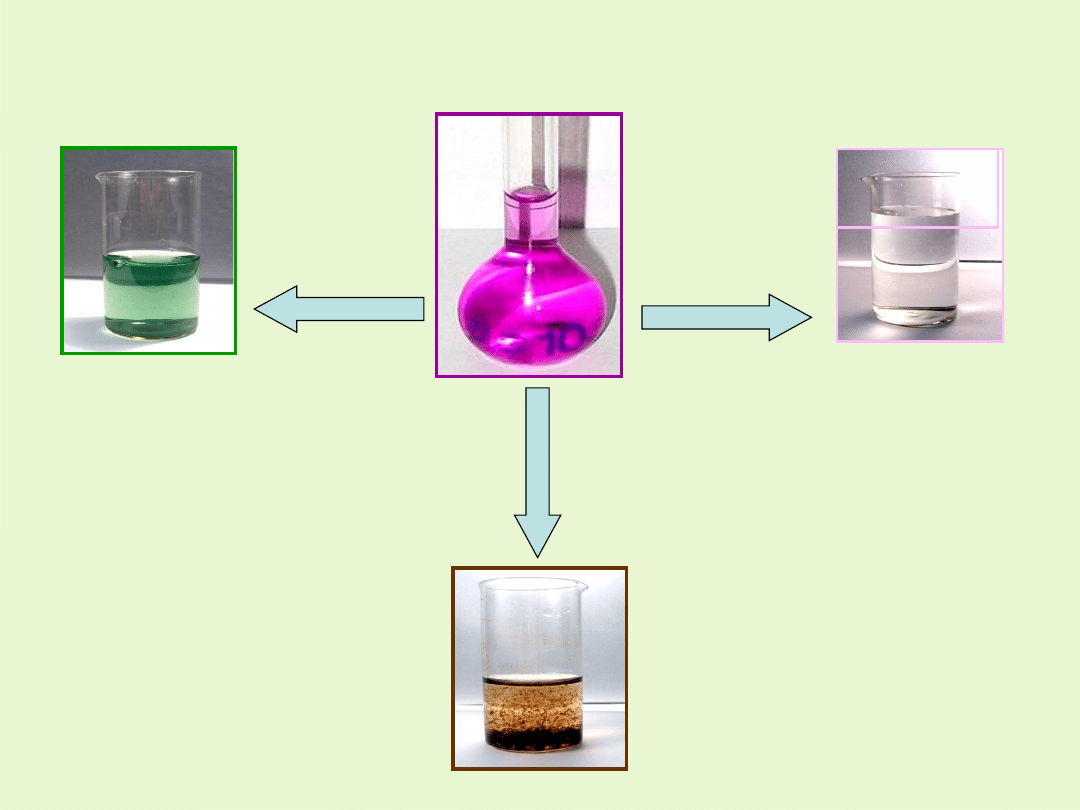
W środowisku kwaśnym manganian(VII) ulega redukcji do manganu (II).
Roztwór zmienia barwę z fioletowej
na blado różową (bardzo słabo zabarwiony)
2
4
Mn
MnO
Substrat
y
KMnO
4
K
2
SO
3
H
2
SO
4
Produkt
y
MnSO
4
K
2
SO
4
H
2
O
O
H
O
S
K
SO
Mn
SO
H
O
S
K
O
Mn
K
2
4
VI
2
4
II
4
2
3
IV
2
4
VII
3
6
2
3
5
2
5
2
2H
SO
O
H
2e
SO
O
4H
Mn
8H
5e
MnO
2
4
2
2
3
2
2
4
O
H
O
S
K
SO
Mn
SO
H
O
S
K
O
Mn
K
2
4
VI
2
4
II
4
2
3
IV
2
4
VII
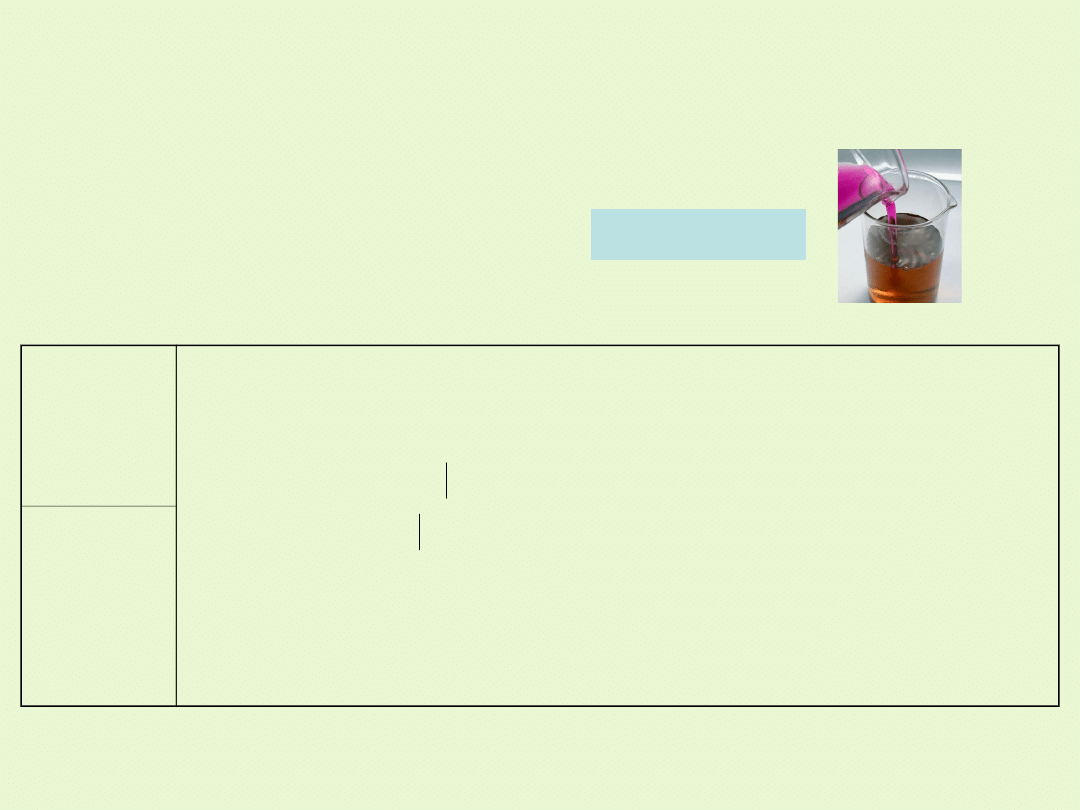
Redukcja jonów MnO
4
-
w środowisku obojętnym
W środowisku obojętnym jony MnO
4
-
(VII) ulegają redukcji do
MnO
2
(IV). Z roztworu wytraca się brunatny osad tlenku
manganu(IV).
2
4
MnO
MnO
Substraty
KMnO
4
K
2
SO
3
H
2
O
Produkty
MnO
2
K
2
SO
4
H
2
O
KOH
2KOH
SO
3K
2MnO
O
H
SO
3K
2KMnO
4
2
2
2
3
2
4
KOH
SO
K
MnO
O
H
SO
K
KMnO
4
4
2
2
2
3
2
3
2
2
3
2
4
2
3
2
4
SO
e
SO
MnO
e
MnO
H
SO
O
H
e
SO
OH
MnO
O
H
e
MnO
6
3
3
6
3
8
2
4
6
2
2
4
2
2
3
2
2
4
Redukcja jonów MnO
4
-
w środowisku zasadowym
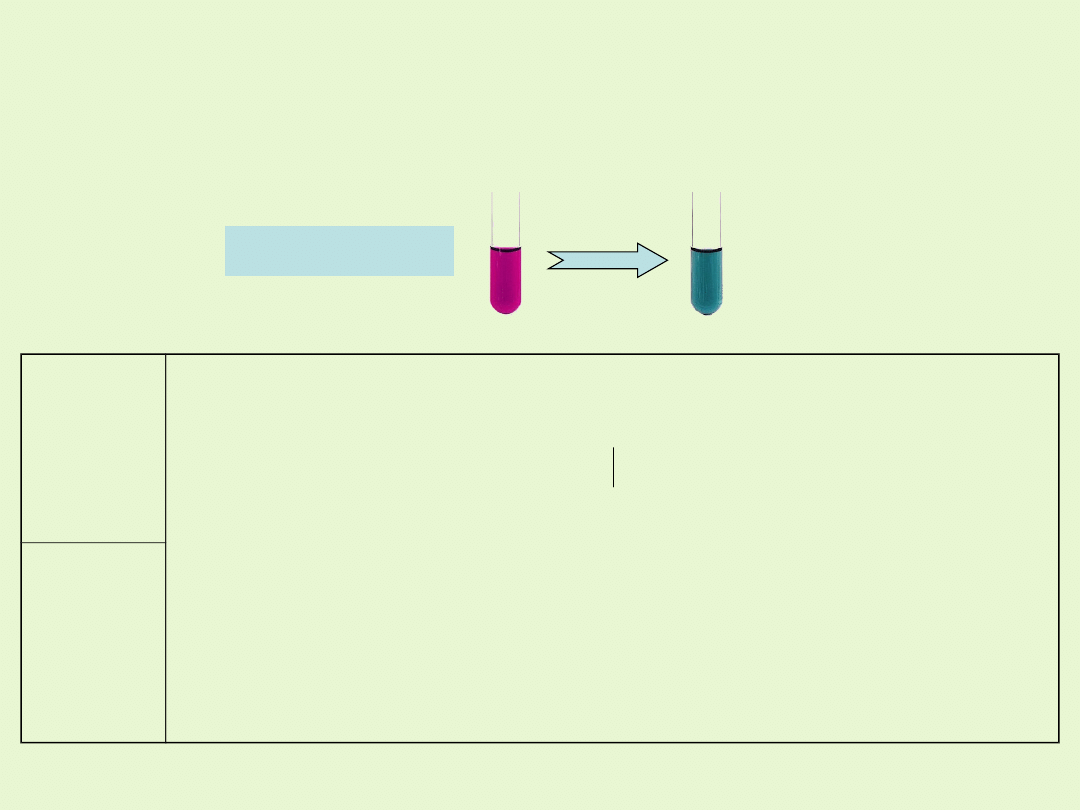
W środowisku zasadowym manganian(VII) /nadmanganian/ ulega
redukcji do manganu(VI) , wskutek czego roztwór zmienia barwię na
zieloną.
Substrat
y
KMnO
4
K
2
SO
3
KOH
Produkty
K
2
MnO
4
K
2
SO
4
H
2
O
2
4
4
MnO
MnO
O
H
SO
2OH
2e
-
SO
2
MnO
e
MnO
2
-
2
4
-
-
2
3
-
2
4
-
4
O
H
O
S
K
O
Mn
2K
2KOH
O
S
K
O
Mn
2K
2
4
VI
2
4
VI
2
3
IV
2
4
VII
O
H
O
S
K
O
Mn
K
KOH
O
S
K
O
Mn
K
2
4
VI
2
4
VI
2
3
IV
2
4
VII
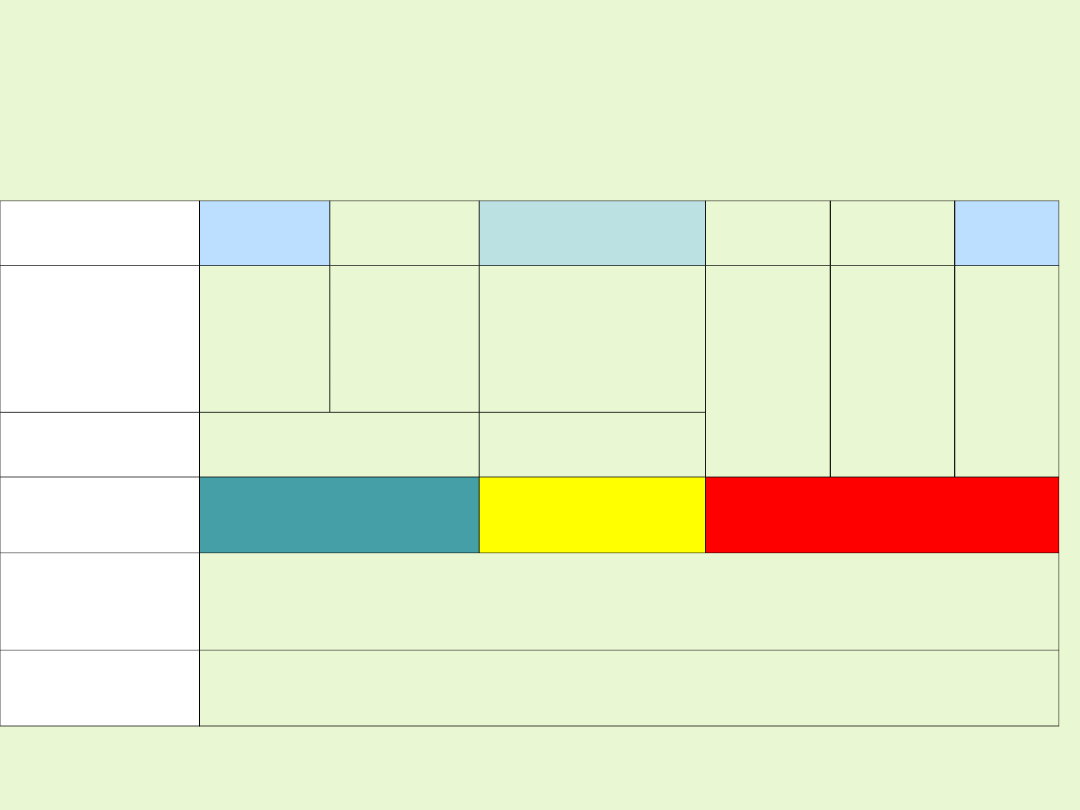
stopień
utlenienia
II
III
IV
V
VI
VII
przykład
związku
MnO
Mn(OH)
2
Mn
2
O
3
MnO(OH)
MnO
2
MnO(OH)
2
MnO
4
3 -
MnO
4
2 -
MnO
4
-
przykład
związku
MnO · Mn
2
O
3
charakter
chemiczny
zasadowy
amfoteryczn
y
kwasowy
własności
niemetaliczn
e
rosną
→
własności
utleniające
rosną
→
Podsumowanie
Mangan tworzy trwałe związki na stopniach utlenienia II, IV, VII.

4
MnO
Redukcja MnO
4
-
Środowis
ko
Zmiana
stopnia
utlenieni
a
Równanie reakcji
Kwasowe
H
3
O
+
Obojętne
H
2
O
Zasadow
e
OH
-
2
4
Mn
MnO
2
4
MnO
MnO
2
4
4
MnO
MnO
O
H
O
S
O
Mn
2
2OH
O
S
O
Mn
2
VI
VI
IV
VII
2
2
4
2
4
2
3
4
2OH
3SO
2MnO
O
H
3SO
2MnO
2
4
2
2
2
3
4
O
3H
O
S
2Mn
6H
O
S
5
O
Mn
2
2
2
4
VI
II
2
2
3
IV
VII
5
4

2
2
4
2
4
2
2
2
)
(
)
(
Mn
MnO
MnO
MnO
OH
MnO
OH
Mn
Mn
Mn
7
6
5
4
3
2
1
1
Mn + 2H
+
→ Mn
2+
+H
2
2
Mn
2+
+2OH
-
→Mn(OH)
2
3
Mn(OH)
2
+1/2O
2
→MnO(OH)
2
4
5
6
2 MnO
4
-
+ 3 SO
3
2-
+ H
2
O → 2 MnO
2
+ 3 SO
4
2-
+ 2 OH
-
7
MnO
2
+4HCl→MnCl
2
+Cl
2
+2H
2
O
O
H
2
MnO
2
O
OH
4
MnO
2
2
2
4
2
2
O
H
2
MnO
MnO
2
H
4
MnO
3
2
2
4
2
4
Trochę równań reakcji
4
2
4
2
2
2
2
4
2
4
2
2
4
2
3
3
2
4
2
2
2
4
2
4
2
2
4
2
2
4
2
4
2
4
2
4
2
2
4
2
3
2
2
4
2
2
2
2
2
2
2
SO
H
2
SO
K
MnO
2
O
H
2
SO
3
KMnO
2
CO
2
+
SO
Na
+
KNO
2
+
MnO
Na
KNO
2
+
CO
Na
2
+
MnSO
O
H
4
+
Cl
2
+
KCl
2
+
MnCl
HCl
8
+
MnO
K
KOH
4
+
KMnO
2
+
MnO
O
H
2
+
MnO
K
3
O
H
2
+
SO
K
2
+
KMnO
2
+
MnO
SO
H
2
+
MnO
K
3
O
H
3
+
KCl
+
MnO
K
3
KOH
6
+
KClO
+
MnO
3
O
H
2
+
MnO
Na
2
O
+
NaOH
4
+
MnO
2
Cl
+
O
H
2
+
MnCl
HCl
4
+
MnO
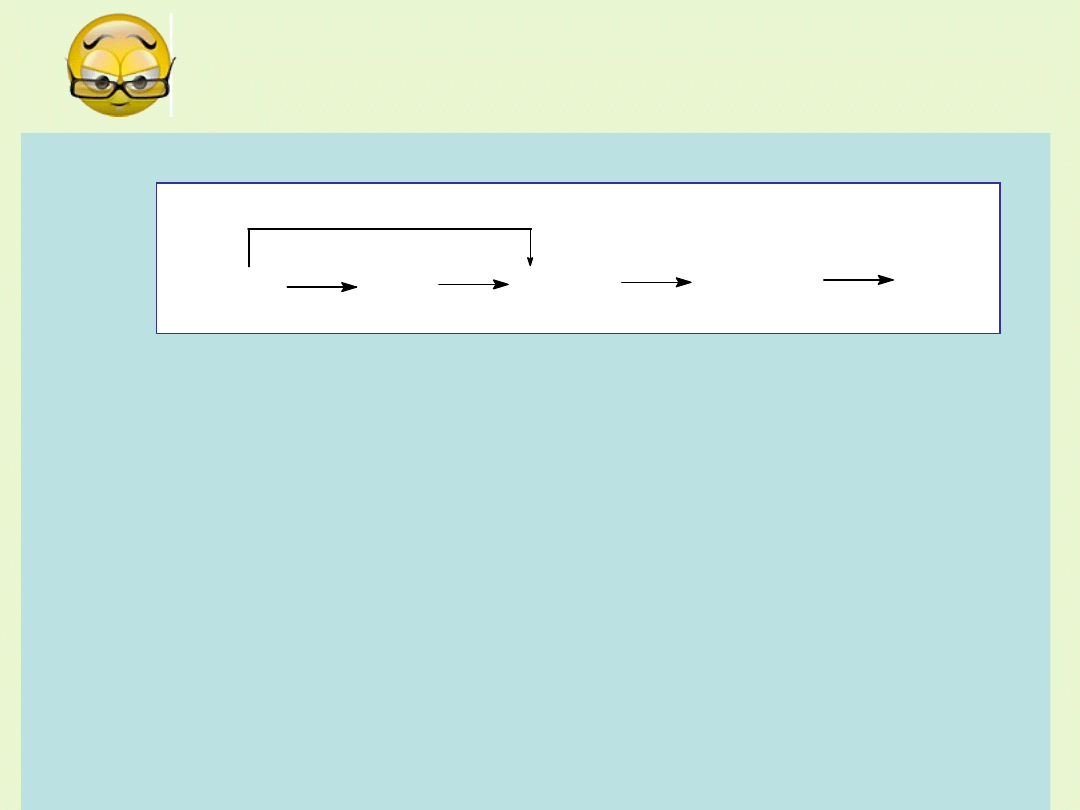
Dla dociekliwych ( z egzaminu dojrzałości
2006)
Poniżej przedstawiono schematycznie reakcje zachodzące z udziałem
związków manganu.
A. Napisz równania reakcji przedstawionych na powyższym schemacie.
B. Podaj nazwy związków manganu z powyższego schematu.
C. Określ skład jądra atomu manganu i napisz pełną konfigurację atomu
w stanie podstawowym. Podaj maksymalny stopień utlenienia tego
pierwiastka w związkach chemicznych.
D. Związki manganu na stopniu utlenienia VII wykazują właściwości
utleniające.
Reakcja manganianu(VII) potasu z kwasem solnym prowadzi do
otrzymania chloru, odpowiedniej soli manganu, chlorku potasu i wody.
Napisz równanie tej reakcji. Współczynniki dobierz metodą bilansu
elektronowego. Oblicz, jaka objętość chloru (odmierzonego w
warunkach normalnych) może się wydzielić w tej reakcji, jeśli do
reakcji użyto 0,02 mola KMnO
4
i nadmiar kwasu solnego. Załóż, że
reakcja zachodzi ze 100% wydajnością.
MnCO
3
MnO
MnSO
4
Mn(OH)
2
MnO
2
1
2
3
4
5

E. Do odkażania ran stosowany jest wodny roztwór manganianu(VII)
potasu o
stężeniu 0,1%.
Wykonaj odpowiednie obliczenia i opisz sposób przygotowania 150
cm
3
tego roztworu. Załóż, że gęstość roztworu jest równa 1g/cm
3
.
F*. Mangan tworzy tlenki na II, III, IV i VII stopniu utlenienia. Napisz wzory
sumaryczne tych tlenków. Określ, jaki charakter chemiczny wykazują
tlenki manganu na najniższym i najwyższym stopniu tlenienia.
Odpowiedź uzasadnij podając odpowiednie równania reakcji
zachodzących z udziałem kwasu solnego lub zasady sodowej.
F**. Mangan tworzy tlenek MnO
2
, który reaguje z gorącym kwasem
solnym
z wydzieleniem chloru, a w reakcji z kwasem siarkowym(VI) z
wydzieleniem tlenu. Napisz równania obu reakcji i określ, jaka rolę w
każdej z nich pełni MnO
2
.
G*.Metaliczny mangan otrzymywany jest metodą aluminotermiczną.
Reakcja zachodzi pomiędzy metalicznym glinem i tlenkiem manganu
o wzorze Mn
3
O
4
. Zapisz równanie tej reakcji oraz oblicz, ile gramów
Mn
3
O
4
trzeba użyć, aby otrzymać 0,5 g manganu, jeśli reakcja
zachodzi z 80% wydajnością.

G**. Metaliczny mangan można otrzymać metodą elektrolizy wodnych
roztworów soli manganu. Napisz równania reakcji elektrodowych oraz
sumaryczne równanie elektrolizy siarczanu(VI) manganu(II). Oblicz, ile
gramów manganu otrzymano podczas elektrolizy wodnego roztworu
siarczanu(VI) manganu(II) prowadzonego prądem o natężeniu 2 A w
czasie 30 min.
H*. Roztwór manganianu(VII) potasu jest stosowany do identyfikacji
węglowodorów nienasyconych. Napisz wzór i podaj nazwę węglowodoru
nienasyconego, zbudowanego z trzech atomów węgla, który może być
zidentyfikowany w reakcji
z roztworem KMnO4. Napisz jakie obserwacje towarzyszą tej reakcji.
H**. Podczas reakcji identyfikacji węglowodorów nienasyconych
roztworem manganianu(VII) potasu zachodzi reakcja opisana
równaniem:
KMnO
4
+ CH
2
=CH
2
+ H
2
O CH
2
(OH)-CH
2
(OH) + KOH + MnO
2
W oparciu o bilans elektronowy dobierz współczynniki
stechiometryczne tej reakcji.

BIBLIOGRAFIA
„ Repetytorium chemia od A do Z” M. Klimaszewska
„Chemia 3”– podręcznik ( zakres rozszerzony) S. Hejwowska, R.
Marcinkowski,J. Staluszka
„ Chemia ogólna i nieorganiczna” A. Bielański
http://portalwiedzy.onet.pl/
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Mangan i jego zwiazki
06 4 Mangan i jego związki zadania do lekcji nr 2
Wegiel i jego zwiazki z wodorem, odpowiedzi IIIg
MATERIAŁ NA CHEMIĘ 'Węgiel i jego związki z wodorem' pojęcia
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem C D, Chemia nowej ery 3 ( 2011 - 2012 ) -
Chrom i jego zwiazki
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem A B, Chemia nowej ery 3 ( 2011 - 2012 ) -
Węgiel i jego związki z wodorem
Chrom i jego związki
Węgiel i jego związki z wodorem
Chrom i jego zwiazki
Mangan i jego zwiÄ…zki[1]
Krzem i jego związki
07 4 Chrom i jego związki zadania do lekcji nr 2
M Smoliński BISKUP KAMIEŃSKI HERMAN VON GLEICHEN I JEGO ZWIĄZKI Z ZAKONAMI KRZYŻOWYMI
Śliwiński Kasztelan krakowski Spycimir z Tarnowa i jego związki genealogiczne z moznowładztwem mało
Schematy najważniejszych reakcji chemicznych, którym ulegają miedź i jego związki chemiczne
Kadm i jego związki w środowisku pracy
więcej podobnych podstron