

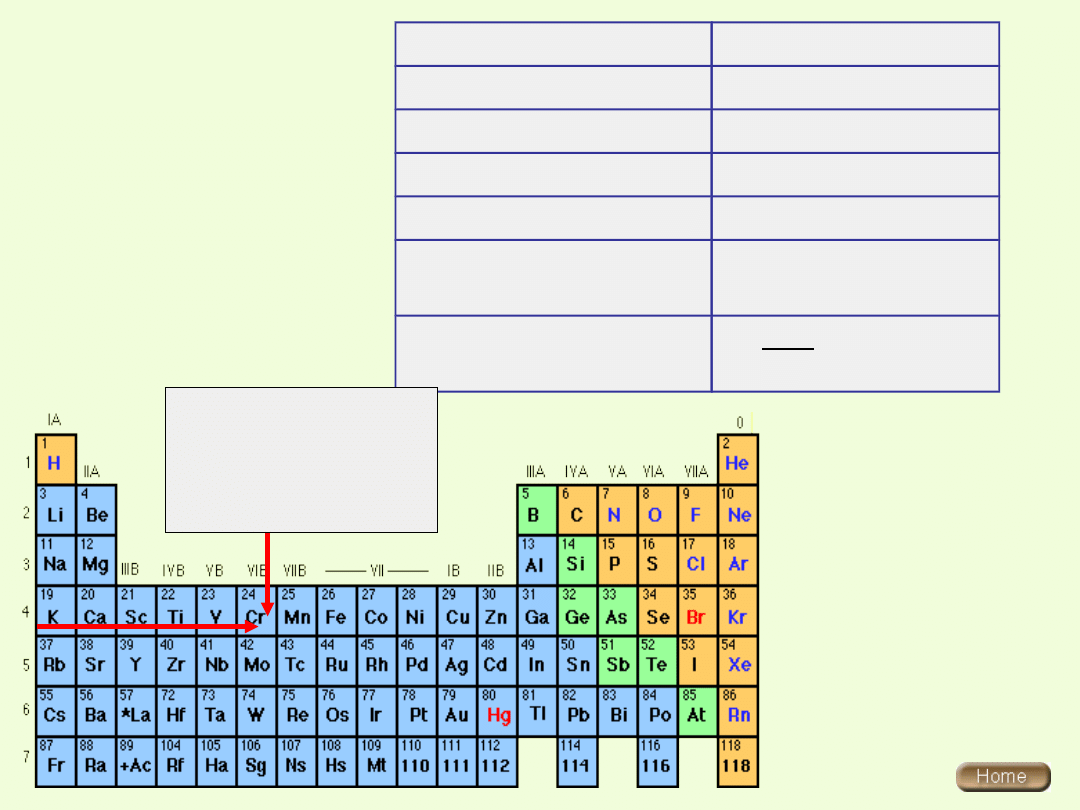
Chrom:
-
-
-
konfiguracja elektronowa atomu
-
-
Właściwości związków chromu na VI stopniu utlenienia
Podstawowe dane
Symbol
Cr
Nazwa łacińska
chromium
Nazwa angielska
chromium
Liczba atomowa
24
Masa atomowa
51,996 u
Elektroujemność
(Pauling)
1,6
Stopnie utlenienia
+2,+3,+6 (+1 ,
+4,+5)
Grupa 6 (VIB)
Okres 4
Blok energetyczny d

Izotopy
Występujący w przyrodzie chrom stanowi mieszaninę czterech różnych
izotopów; żaden z nich nie jest promieniotwórczy (
52
Cr – 84%,
50
Cr –
4,3%,53Cr – 9,5%,
54
Cr -2,3%. Wszystkie sztucznie otrzymane izotopy
są promieniotwórcze i nie mają większego znaczenia praktycznego.
Występowanie i otrzymywanie
Chrom zajmuje pod względem rozpowszechnienia w skorupie ziemskiej
18 miejsce. Zajmuje także 4 miejsce pod względem rozpowszechnienia
wśród pierwiastków uważanych za ważne ze względu na ich rolę
biologiczną i toksyczność.
Występuje jako naturalny składnik skał, minerałów, gleby i wody oraz
gazów i pyłów wulkanicznych a także emisji wywołanej erozją skał i
gleby.
Duża jego ilość jest też emitowana do atmosfery przy wydobyciu rud i
ich przeróbce przez przemysł metalurgiczny i chemiczny.

W przyrodzie występuje w minerałach:
chromicie FeCr
2
O
4
, krokoicie PbCrO
4
, uwarowicie Ca
3
Cr
2
(SiO
4
)
3
, ochrze
chromowej Cr
2
O
3
i chromitycie Fe
2
O
3
×2Cr
2
O
3
.
Otrzymywanie:
Chrom otrzymuje się z rudy chromitowej przez jej prażenie w
obecności węglanu sodu, wymywanie wodą powstałego chromianu
sodu, przeprowadzenie go w dwuchromian (przez zakwaszenie
środowiska) i redukcji tak powstałego związku do tlenku chromu (III)
Cr
2
O
3
.
Dalszą redukcję do wolnego chromu przeprowadza się w procesie
aluminotermii:
Cr
2
O
3
+ 2Al --> Al
2
O
3
+ 2Cr + 109 kal.
Chrom o wysokim stopniu czystości uzyskuje się dzięki elektrolizie.
Aluminotermia - proces metalurgiczny polegający na redukcji
tlenków metali sproszkowanym aluminium; podczas procesu,
w wyniku utleniania aluminium, wydzielają się znaczne ilości ciepła,
co powoduje wzrost temperatury (do 3000°C)

Konfiguracja elektronowa atomu chromu
1
5
6
2
6
2
2
4
3
3
3
2
2
1
s
d
p
s
p
s
s
Dla chromu należałoby oczekiwać konfiguracji 3d
4
4s
2
, jednak
konfiguracja z pięcioma niesparowanymi elektronami o orbitalach 3d
okazuje się energetycznie bardziej korzystna i jeden z elektronów 4s
przechodzi do 3d
( promocja elektronowa).
Promocja elektronów
to zjawisko, które zachodzi w atomach i polega na
międzypoziomowym przeniesieniu elektronu na wolny orbital w celu
uzyskania
trwałej konfiguracji.Zjawisko to pojawia się wtedy, gdy różnica energii
między wypełnianymi poziomami jest niewielka, a zyski energetyczne
wynikające na przykład z większej symetrii orbitali są duże (np. Cu,
Ag, Nb,Ru).
Chrom należy do pierwiastków przejściowych bloku d
( zewnątrzprzejściowych)
Właściwości fizyczne chromu
Znane są dwie odmiany alotropowe chromu. Najpospolitsza -
trwała w temperaturze pokojowej - ma strukturę regularną,
przestrzennie centrowaną. Druga odmiana, trwała w wysokiej
temperaturze ma zwartą strukturę heksagonalną.
Stan skupienia
stały
Budowa
krystaliczna
Barwa
srebrzysta z niebieskawym
odcieniem
Gęstość
7,17 g/cm
3
( metal ciężki)
Twardość
wyjątkowo twardy
Kruchość
kruchy
Ciepło właściwe
450 J/(kg×K)
Temperatura topnienia
1856,85 °C
Temperatura wrzenia
2571,85 °C
Przewodność elektryczna
przewodnik (7,74*10
6
S/m)
Właściwości magnetyczne
paramagnetyk
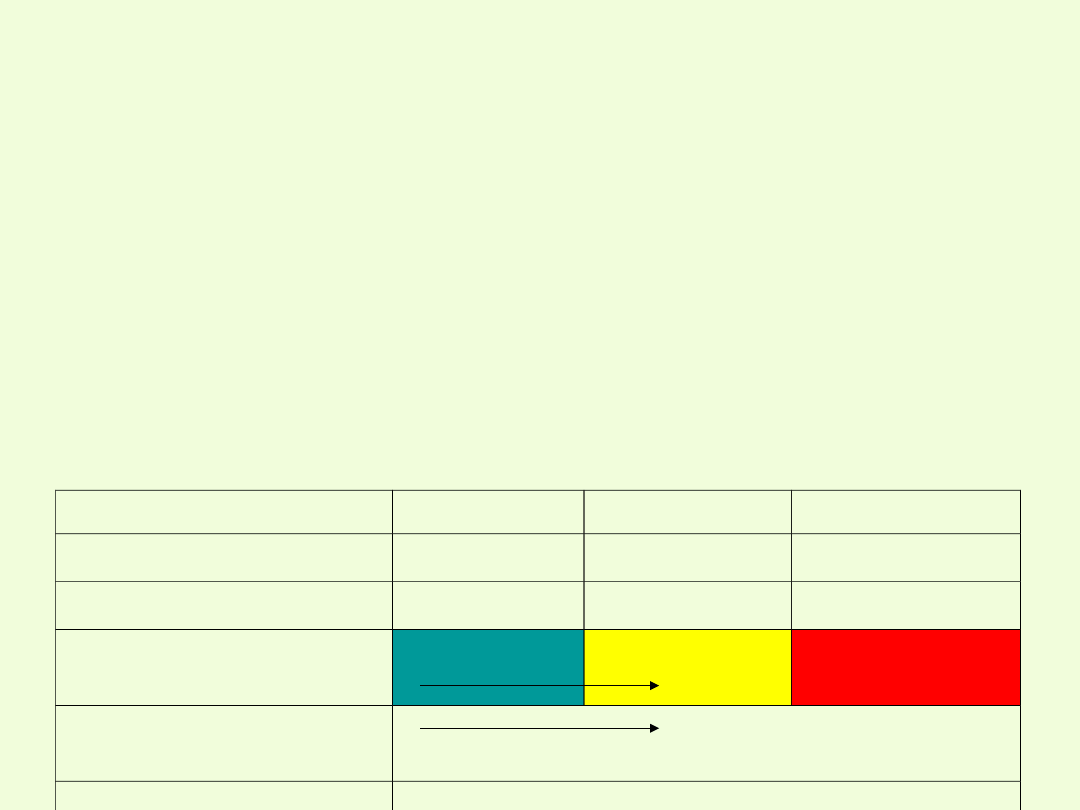
Właściwości chemiczne chromu
Chrom podobnie jak mangan wykazuje dużą różnorodność połączeń
występując jako pierwiastek stechiometrycznie dwuwartościowy,
trójwartościowy i sześciowartościowy.
Związki chromu na stopniach utlenienia +1, +4 i +5 są trwałe tylko w
stanie stałym, w roztworach wodnych chrom(IV) i (V) ulega
dysproporcjonowaniu na chrom (III) i (VI).
Charakter chemiczny chromu wraz ze wzrostem stopnia utlenienia
zmienia się podobnie jak w przypadku manganu.
Na +II stopniu utlenienia – właściwości metaliczne (Cr
2+
)
Na +III stopniu utlenienia – właściwości amfoteryczne
Na +VI stopniu – właściwości niemetaliczne
stopień utlenienia
II
III
VI
przykład związku
CrO
Cr
2
O
3
CrO
3
przykład związku
Cr(OH)
2
Cr(OH)
3
CrO
4
2-
,Cr
2
O
7
2-
charakter
chemiczny
zasadowy
amfoteryczny kwaśny
własności
miemetaliczne
rosną
własności
utleniające
rosną

W temperaturze pokojowej jest odporny na działanie wody,
fluorowców, siarki, azotu, węgla,
Chrom ma ujemny potencjał standardowy, ale łatwo ulega
pasywacji w stężonych kwasach utleniających.
Reaguje z kwasem solnym lub tlenowymi rozcieńczonymi:
- bez dostępu tlenu – daje sole w których jest
dwuwartościowy
- z dostępem powietrza daje sole w których jest
trójwartościowy
Chrom nie utlenia się na powietrzu, dopiero silnie ogrzany ulega
utlenieniu.

A. Tlenek chromu (II)
Czarny tlenek chromu (II) CrO powstaje w wyniku utleniania
amalgamatu chromu tlenem atmosferycznym. Ogrzewany w
obecności powietrza wiąże tlen i rozżerzając się przechodzi w tlenek
chromu (III) Cr
2
O
3
4CrO +O
2
→ 2Cr
2
O
3
Ma charakter zasadowy
CrO + 2HCl →
CrCl
2
+ H
2
O; CrO + KOH – reakcja nie zachodzi
B. Sole chromu (II)
Są bardzo silnymi reduktorami. Jon Cr
2+
na zimno (w obecności jonów
obcych metali jako katalizatorów), a także w czystym roztworze na
gorąco, rozkłada wodę z wydzieleniem wodoru: Cr
2+
+ H
+
= Cr
3+
+ 1/2
H
2
Roztwory soli mają najczęściej barwę niebieską.
C. Wodorotlenek chromu(II)
Strąca się w postaci ciemno-brunatnego osadu z roztworu Cr
2+
po
dodaniu do niego mocnej zasady.
W czasie odwadniania odszczepia wodór i przechodzi w Cr
2
O
3
.
Amalgamaty to ogólna nazwa stopów metali, w których jednym z podstawowych
składników jest rtęć. Amalgamaty tworzy się poprzez rozpuszczenie innych metali
w rtęci w warunkach otoczenia, stąd stopy te można również uważać za roztwory,
przy czym mogą to być roztwory o ciekłym lub stałym stanie skupienia.
Związki chromu na II stopniu utlenienia
Związki chromu na III stopniu
utlenienia
A. Tlenek chromu(III)
(zielony)
Tlenek chromu(III) wykazuje charakter amfoteryczny
1. Reaguje z kwasami:
2. Reaguje z zasadami:
O
H
3
CrCl
2
HCl
6
O
Cr
2
3
3
2
4
2
3
2
NaCr(OH)
2
O
H
3
NaOH
2
O
Cr
B. Wodorotlenek chromu(III)
1. Reakcja z kwasami:
S: Osad Cr(OH)
3
rozpuścił się dając zielony
roztwór.
W: Wodorotlenek chromu(III) wszedł w reakcję
z HCl
O
H
3
CrCl
HCl
3
Cr(OH)
2
3
3
O
H
Cr
H
3
Cr(OH)
2
3
3
HCl
Osad
Cr(OH)
3
CrCl
3
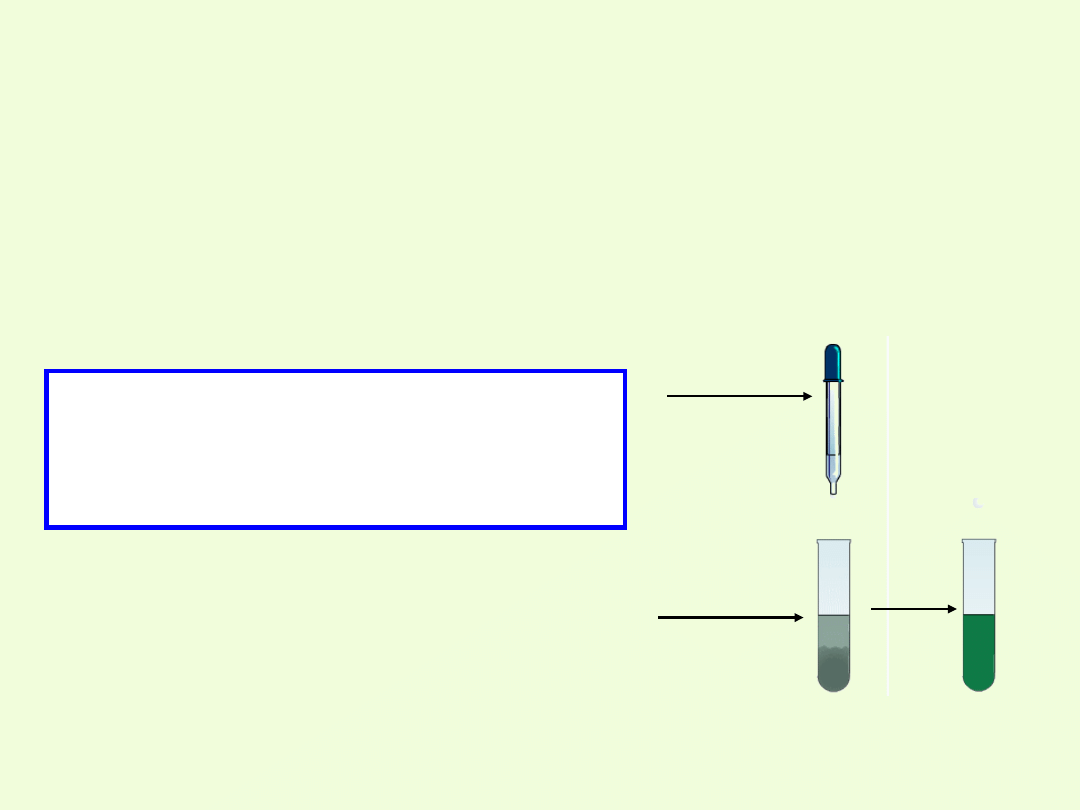
2.Reakcja z zasadami:
Do osadu Cr(OH)
3
dodano roztwór wodorotlenku
sodu.
S. Osad znika, a ciecz przyjmuje zielone
zabarwienie.
W. Wodorotlenek chromu(III) wszedł w reakcję z
zasadą.
4
3
)
(
)
(
OH
Cr
Na
NaOH
OH
Cr
Na
3
CrO
3
Osad
Cr(OH)
3
NaOH
Wodorotlenek chromu (III)
ma charakter
amfoteryczny

C. Właściwości redukujące chromu(III)
W środowisku zasadowym sól chromu (III) przechodzi w chromian (VI)
(zmiana barwy z zielonej na żółtą)
O
H
8
Cl
6
CrO
2
OH
16
Cl
3
Cr
2
O
H
8
CrO
2
OH
10
O
3H
Cr
2
O
H
8
KCl
6
CrO
2K
KOH
10
O
H
3
CrCl
2
2
2
4
2
3
2
2
4
2
2
3
2
4
2
2
2
3
2
4
3
Cr
CrO
UTLENIACZ
OH

Właściwości związków chromu na VI stopniu utlenienia
Związki chromu(VI) są bardzo silnymi utleniaczami.
Tlenek chromu (VI) (tritlenek chromu )
Otrzymywanie: Czerwone kryształy wydzielają się po dodaniu do
roztworu dwuchromianu potasu stężonego kwasu siarkowego.
O
H
SO
K
CrO
2
SO
H
O
Cr
K
2
4
2
3
4
2
7
2
2
Właściwości:
Tlenek o charakterze kwasowym.
Dobrze rozpuszcza się w wodzie z wytworzeniem istniejącego
tylko w roztworze żółtego kwasu chromowego H
2
CrO
4
.
W reakcji z zasadami tworzy sole:
Jest silnym utleniaczem np:
2
3
CO
3
Cr
2
C
3
CrO
2
O
H
CrO
K
KOH
2
CrO
2
4
2
3
2
3
2
3
O
2
/
3
O
Cr
CrO
2
T
O
H
3
O
Cr
N
CrO
2
NH
2
2
3
2
2
3
3

Chromiany i dichromiany(VI) /dwuchromiany (VI)/
Chromiany(VI) - sole kwasu chromowego(VI) H
2
CrO
4
.
Jon CrO
4
2-
ma żółtą barwę i dlatego wszystkie chromiany są
zabarwione na żółto.
Rozpuszczalność chromianów jest zbliżona do rozpuszczalności
analogicznych siarczanów (sole metali alkalicznych oraz magnezu,
wapnia i strontu są łatwo rozpuszczalne w wodzie).
Dichromiany(VI) - sole kwasu dichromowego(VI) H
2
Cr
2
O
7
.
Po dodaniu do roztworu chromianu jakiegokolwiek kwasu, nawet
bardzo słabego, tworzy się dichromian.
Charakteryzują się one barwą pomarańczową.
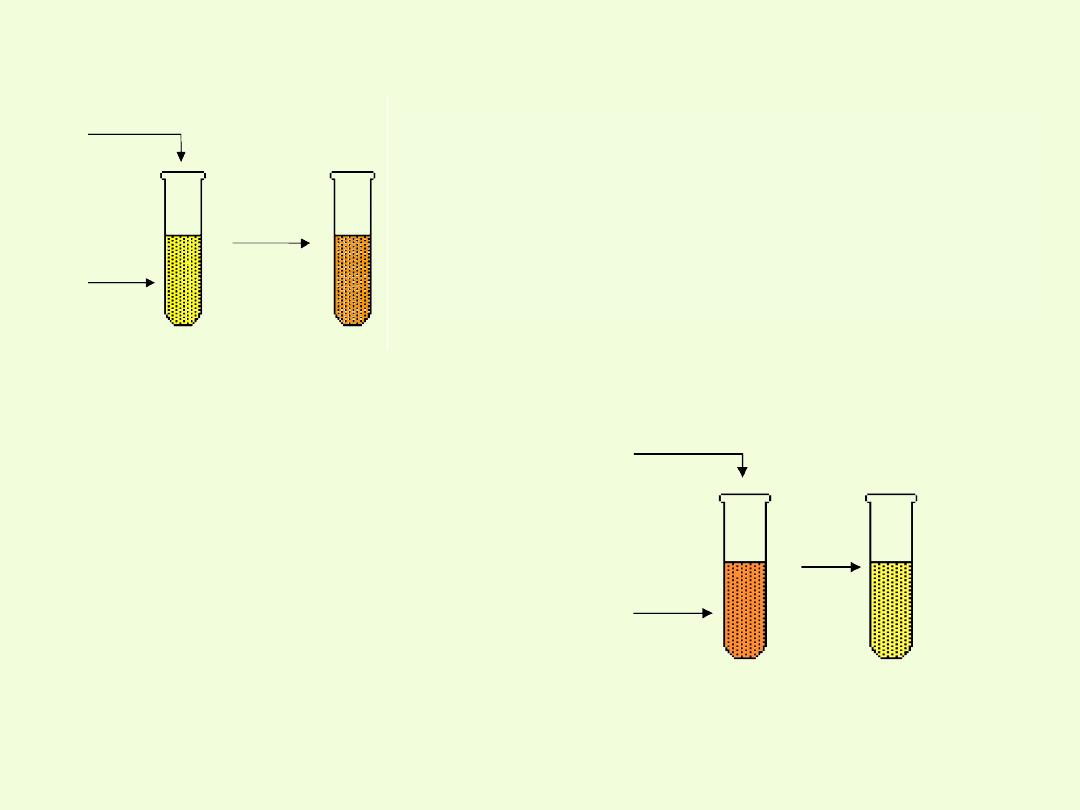
4
2
CrO
K
7
2
2
O
Cr
K
HCl
Po dodaniu do roztworu chromianu potasu
jakiegokolwiek kwasu, nawet bardzo słabego,
następuje zmiana barwy z żółtej na pomarańczową
wskutek tworzenia się dwuchromianów:
2K
2
CrO
4
+ H
2
SO
4
= K
2
Cr
2
O
7
+ H
2
O + K
2
SO
4
2CrO
4
2-
+ 2H
+
= Cr
2
O
7
2-
+ H
2
O
Po dodaniu do roztworu dichromianu
potasu jonów wodorotlenowych
następuje zmiana barwy z
pomarańczowej na żółtą.
K
2
Cr
2
O
7
+ 2 KOH = 2 K
2
CrO
4
+ H
2
O
Cr
2
O
7
2-
+2OH
-
= 2CrO
4
2-
+ H
2
O
4
2
CrO
K
7
2
2
O
Cr
K
KOH
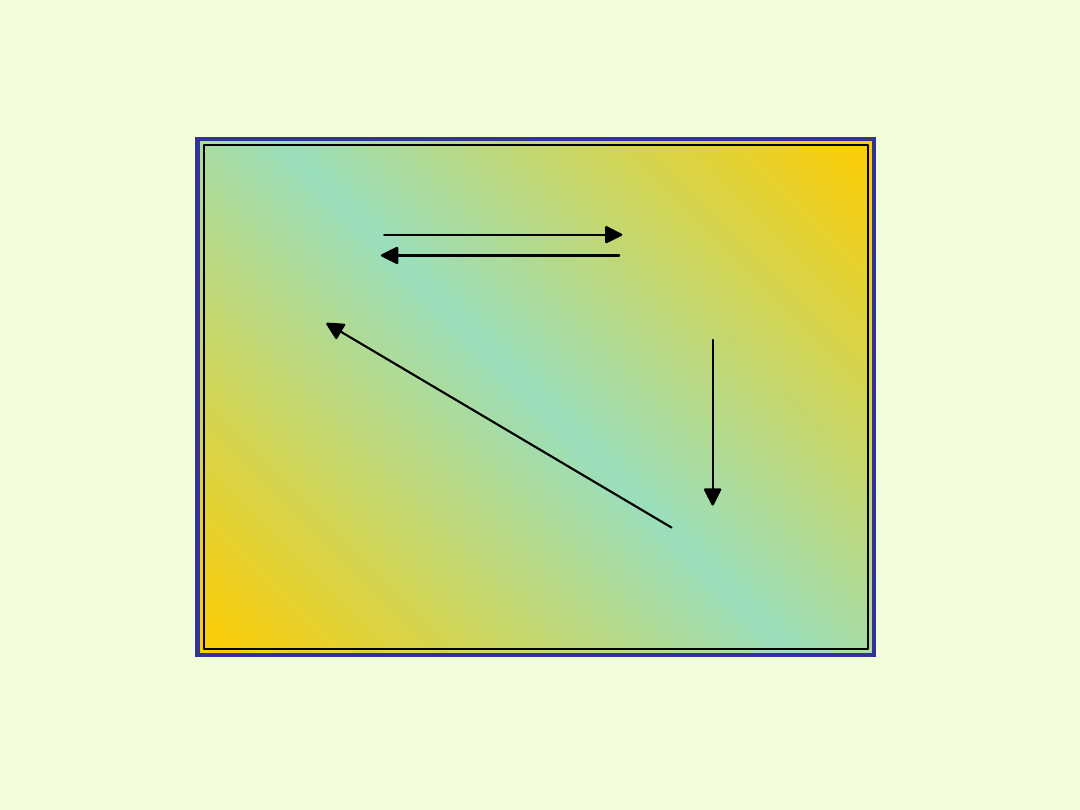
Przejście jonów dichromianowych w chromianowe i
odwrotnie

Wniosek:
Jony chromianowe (VI) powstają w środowisku lekko
zasadowym,
zaś jony dichromianowe w środowisku kwaśnym.
Jony dichromianowe(VI) mogą przechodzić w jony
chromianowe(VI) i odwrotnie.
Chromiany mają silne właściwości utleniające, szczególnie w
roztworach zakwaszonych. Chrom ze stopnia utlenienia VI redukuje
się do chromu III.
Przykłady:
Utleniają one siarkowodór do wolnej siarki, węgiel do dwutlenku
węgla, itp.,
O
H
15
S
3
Cr
2
O
H
8
S
H
3
O
Cr
2
3
3
2
2
7
2
O
H
24
CO
3
Cr
4
O
H
16
C
3
O
Cr
2
2
2
3
3
2
7
2
Dwuchromiany sodu lub potasu topią się podczas ogrzewania, a w
temperaturze białego żaru ulegają rozkładowi w myśl równania:
2
3
2
4
2
7
2
2
3O
+
O
2Cr
+
CrO
4K
O
Cr
4K
Kwas solny ulega utlenieniu do chloru:
2
2
3
7
2
2
3Cl
+
O
7H
+
2CrCl
+
2KCl
14HCl
+
O
Cr
K
Jeżeli roztwór jest zakwaszony kwasem siarkowym, redukcja nastąpi
tylko w obecności środków pochłaniających tlen, a więc redukujących,
np:
O
H
CHO
CH
SO
K
)
(SO
Cr
SO
H
O
Cr
K
OH
H
C
2
3
4
2
3
4
2
4
2
7
2
2
5
2

Podsumowanie
Chrom jest pierwiastkiem należącym do pierwiastków przejściowych
bloku d.
Ze względu na swoja konfigurację elektronową
może występować na stopniach utlenienia od I do VI.
Na stopniach utlenienia I, IV, V tworzy związki trwałe tylko w stanie
stałym.
Związki chromu (II) są silnymi reduktorami, są nietrwałe i ulegają
utlenieniu do związków chromu (III). CrO wykazuje charakter
zasadowy, a jony Cr
2+
barwią roztwory na niebiesko.
Chrom na III stopniu utlenienia tworzy najtrwalsze związki. Cr
2
O
3
i
Cr(OH)
3
wykazują charakter amfoteryczny. Związki na tym stopniu
utlenienia charakteryzują się barwą zieloną.
Tlenek chromu(VI) ma charakter kwasowy. Rozpuszcza się w wodzie
tworząc kwas chromowy(VI) – żółty lub pomarańczowy kwas
dichromowy(VI). Oba nie istnieją w stanie wolnym. Ich sole to
chromiany (śr. OH
-
) i dichromiany (śr. H
3
O
+
)
Związki chromu(VI) są utleniaczami.
1
5
6
2
6
2
2
s
4
d
3
p
3
s
3
p
2
s
2
s
1
K2CrO4
H+
żółty
pomarańczowy
K2Cr2O7
+VI
+VI
OH -
H+
Cr3+
zielony
OH -
utleniacz
reduktor

Dla dociekliwych
Działając nadtlenkiem wodoru (30%) na oziębiony lodem roztwór
dichromianu otrzymuje się peroksochromian (nadtlenochromian),
granatowo – fiołkowe nietrwałe kryształy o wzorze KCrO
6
×H
2
O
- w obecności znacznego nadmiaru KOH strącają się w temperaturze
pokojowej czerwone, dość trwałe kryształy o wzorze K
3
CrO
8
.

Bibliografia
Antoni Basiński - Chemia Nieorganiczna i Ogólna
„Chemia 3”– podręcznik ( zakres rozszerzony) S. Hejwowska, R.
Marcinkowski,J. Staluszka
„ Chemia ogólna i nieorganiczna” A. Bielański
http://pl.wikipedia.org/
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
Wyszukiwarka
Podobne podstrony:
Chrom i jego zwiazki
Chrom i jego zwiazki
07 4 Chrom i jego związki zadania do lekcji nr 2
Wegiel i jego zwiazki z wodorem, odpowiedzi IIIg
MATERIAŁ NA CHEMIĘ 'Węgiel i jego związki z wodorem' pojęcia
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem C D, Chemia nowej ery 3 ( 2011 - 2012 ) -
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem A B, Chemia nowej ery 3 ( 2011 - 2012 ) -
Węgiel i jego związki z wodorem
Chrom i jego zwiÄ…zki
Węgiel i jego związki z wodorem
Mangan i jego związki
Mangan i jego zwiazki
Krzem i jego związki
06 4 Mangan i jego związki zadania do lekcji nr 2
M Smoliński BISKUP KAMIEŃSKI HERMAN VON GLEICHEN I JEGO ZWIĄZKI Z ZAKONAMI KRZYŻOWYMI
Śliwiński Kasztelan krakowski Spycimir z Tarnowa i jego związki genealogiczne z moznowładztwem mało
Schematy najważniejszych reakcji chemicznych, którym ulegają miedź i jego związki chemiczne
Kadm i jego związki w środowisku pracy
więcej podobnych podstron