
KRZEM
JEGO ZWIĄZKI
I

PIERWIASTEK WYIZOLOWANY W
1823 ROKU PRZEZ
SZWEDZKIEGO CHEMIKA J. J.
BERZELIUSA.
Nazwa łacińska pochodzi od
słowa SILEX co znaczy
krzemień.
Nazwa polska wywodzi
się od łacińskich słów
lapis cremaus, co
oznacza kamień dający
ogień.

Zawartość wybranych
pierwiastków w różnych formach
materii (%).
Pierwiastki Litosfera Woda oceaniczna
Człowiek Lucerna
tlen 49,42 85,90 62,8
67,9
krzem 25,75 0,0003
0,004 0,009
żelazo 4,7 0,000001 0,005
0,003
wapń 3,39 0,040 1,38
0,58
wodór 0,88 10,80 9,31
8,72
węgiel 0,09 0,03 19,40
11,30
azot 0,03 0,00005 5,14
8,25

WYSTĘPOWANIE
• w stanie rodzimym nie
występuje
• w stanie związanym w
postaci krzemianów,
glinokrzemianów oraz
wolnego tlenku krzemu
IV stanowi 27%
litosfery

Grupa 14
O
k
re
s
3
Si
14
Masa
atom.28,0855
IV II
SILICIUM
Elektroujemn
ość 1,8
Ne
3s
2
3p
2
blok:p
WĘGLOWCE
[ ]

IZOTOPY KRZEMU
3 naturalne
trwałe
11 sztucznych promieniotwórczych np.
T
1/2
=160 lat
28
Si
92,23
%
29
S
i
4,6
%
30
Si
3,1%
32
S
i

KONFIGURACJA
ELEKTRONOWA
1s
2
2s
2
p
6
3s
2
p
2
K
L
M

METODY OTRZYMYWANIA
KRZEMU
SiO
2
+ Mg Si +
MgO
2
2
•redukcja SiO
2
magnezem
•redukcja mieszaniny piasku
i rudy żelaza węglem-
żelazokrzem do celów
metalurgicznych
•termiczny rozkład SiHCl
3
-
preparaty o wysokiej
czystości

WŁAŚCIWOŚCI FIZYCZNE
•półmetal i
półprzewodnik
•krystaliczne ciało
stałe o metalicznym
połysku
•pierwiastek bardzo
twardy i kruchy
•wysoka
temperatura
topnienia
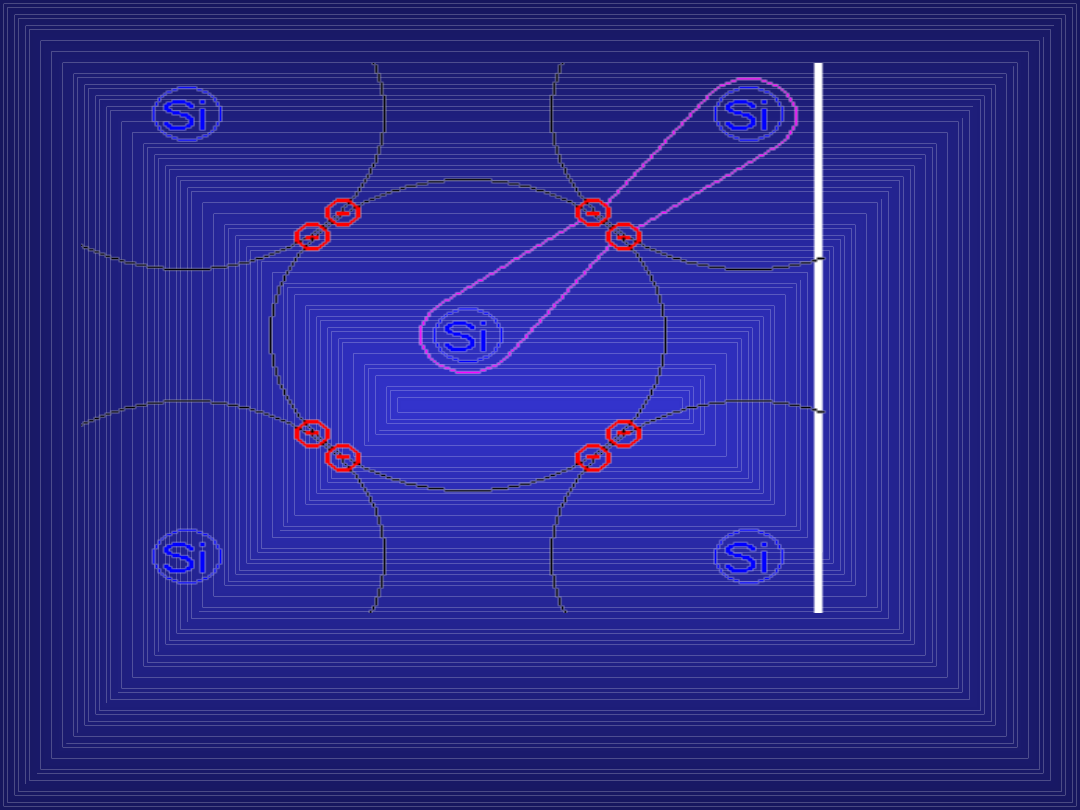
BUDOWA KRYSZTAŁU
KRZEMU
W sieci krystalicznej krzemu występują
wiązania atomowe. Atomy w sieci są
rozmieszczone w takich odległościach,
że ich powłoki zachodzą na siebie.
,

WŁAŚCIWOŚCI
CHEMICZNE
•w temperaturze pokojowej mało
aktywny
•po podgrzaniu reaguje z tlenem,
metalami, zasadami
Si + O
2
SiO
2
Si + 2Mg
Mg
2
Si
Si + 2NaOH Na
2
SiO
3
+ 2H
2
tlenek krzemu
(IV)
metakrzemian
sodu
krzemek
magnezu

KRZEM JAKO
MIKROELEMENT
• występuje w gruczołach dokrewnych-
grasicy, nadnerczach i przysadce
mózgowej
• odgrywa ważną rolę w gospodarce
hormonalnej ludzi starszych
• obniża poziom cholesterolu we krwi
•wpływa na elastyczność, wygląd i
zdrowie skóry, włosów i paznokci
• uczestniczy w tworzeniu tkanki
łącznej i chrząstek

Dawka krzemu z pożywieniem 18-
1200mg/dzień
Produkty spożywcze bogate w
krzem:
otręby, fasola, groch, warzywa
korzeniowe
Zioła zawierające dużą ilość
rozpuszczalnej krzemionki :
skrzyp polny, pokrzywa, perz,
podbiał, rdest ptasi, poziewnik
Przy chorobach, szczególnie skóry, zaleca
się stosowanie wewnętrzne i zewnętrzne
odwarów z tych ziół.

Kryształy krzemu służą do
produkcji:
• tranzystorów
•
układów scalonych
• laserów
•
diod emitujących
światło
•
ogniw słonecznych

Krzem stosowany też
jest:
•jako odtleniacz do
stopów miedzi
•jako dodatek do stali
stopowych w celu polepszenia
ich właściwości
mechanicznych i odporności
na korozje
•do wytwarzania
detektorów fal krótkich
•do wytwarzania
soczewek do promieni
podczerwonych

tlenek krzemu (IV) SiO
2
KRZEMIONKA
występuje w trzech odmianach
polimorficznych
•krystobalit
•trydymit
-
•kwarc
model
struktu
ry
kwarcu

CYTRYN
DOBRZE
WYKSZTAŁCON
E KRYSZTAŁY
KWARCU
AMETYS
T
KRYSZTAŁ GÓRSKI

CZYSTA BEZPOSTACIOWA
KRZEMIONKA TO OPAL.
ODMIANA
OPALU -
AGAT

REAKCJE SiO
2
•z kwasem
fluorowodorowym
SiO
2
+ HF SiF
4
+
H
2
O
4
2
•z wodorotlenkiem sodu
SiO
2
+ NaOH Na
2
SiO
3
+ H
2
O
2
•z węglem
SiO
2
+ C Si + CO
2

KRZEMIONKA JEST
PODSTAWOWYM
SKŁADNIKIEM:
•glin
•gleb
•skał (granity, gnejsy)
•piasku
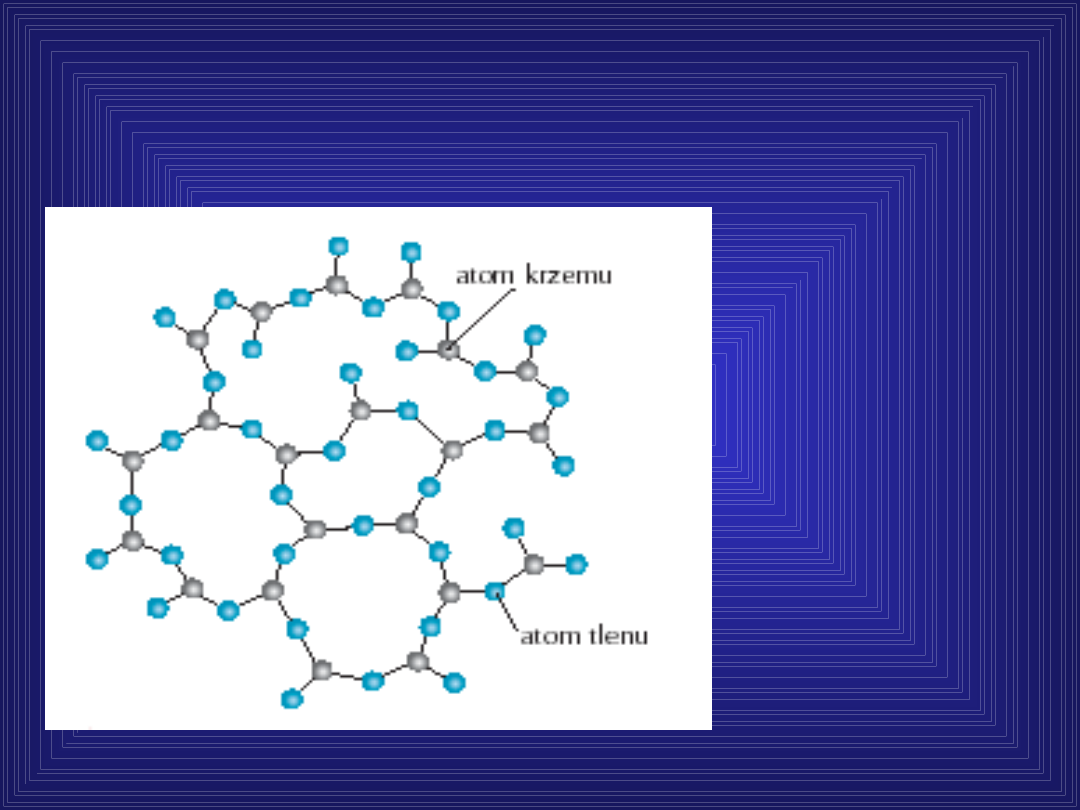
schemat
ułożenia
atomów
w stanie
szklisty
m
Stopiony SiO
2
po szybkim
oziębieniu zastyga w sztywną
bezpostaciową masę-
szkło
kwarcowe.
Struktura szkła kwarcowego wg.
Zachariasena

SZKŁA KRZEMIANOWE
• szkło sodowo-wapniowe Na
2
O
.
CaO
.
6 SiO
2
to szkło okienne
•
szkło potasowo-ołowiowe to tzw.
szkło kryształowe i optyczne szkło
flint
•szkło jenajskie to szkło
trudnotopliwe np. Pyrex, Duran,
Supremax

Szkła otrzymywane w technice
„ zol-żel”
Technika „zol-żel”polega na syntezie szkieł
poprzez reakcje chemiczne w temperaturach
zbliżonych do pokojowej.
•układ PbO
2
/SiO
2
stosowany jest w
światłowodach
•układ ZnO/SiO
2
stosowany jest w
dyskach optycznych ROM
•układ TiO
2
/SiO
2
stosowany jest w
laserach
i koncentratorach światła
słonecznego

KWASY KRZEMOWE
SiO
2
.
H
2
O H
2
SiO
3
Kwas metakrzemowy
SiO
2
.
2H
2
O H
4
SiO
4
Kwas
ortokrzemowy
2 SiO
2
.
H
2
O
H
2
Si
2
O
5
Kwas
metadwukrzemowy

Ciekawe nieorganiczne związki
krzemu
•
azotek krzemu
Si
3
N
4
związek o twardości
diamentu i znacznej
odporności chemicznej
stosowany do konstrukcji
ceramicznych silników
samochodowych i turbin
gazowych
SiO
2
+ C + N
2
Si
3
N
4
+
CO
6
2
6
kat
T

techniczny SiC
KARBORUND
–
substancja bardzo twarda(9,5-9,7
w skali Mohra), należąca do
beztlenkowych materiałów
ceramicznych, stosowana do
wyrobu materiałów ściernych.
WĘGLIK KRZEMU SiC
SiO
2
+ C SiC +
CO
3
2

Czterochlorek krzemu
SiCl
4
ciecz bezbarwna o ostrym
zapachu, bardzo łatwo
hydrolizuje tworząc białe
dymy uwodnionego
dwutlenku krzemu SiO
2
oraz kwas solny.
Stosowany jest w wojsku
do wytwarzania zasłon
dymnych.

Krzem tworzy z wodorem
krzemowodory zwane
silanami.
SiH
4
MONOSILA
N
Si
2
H
6
DWUSILAN
( krzemoet
an)
Silany
reagują gwałtownie
z tlenem i wybuchowo z
fluorowcami.
SiH
4
+ 2O
2
SiO
2
+ 2
H
2
O
SiH
4
+ Cl SiH
3
Cl +
HCl
chlorosilan

W wyniku kondensacji pochodnych
chlorowych silanów otrzymuje się
siloksany.
H
3
SiCl + H
2
O H
3
Si-O-SiH
3
+
HCl
2
2
Z chlorosilanów i siloksanów
otrzymuje się polimery
krzemoorganiczne (polisiloksany)
potocznie zwane silikonami.
Si
R
R
O
S
i
R
R
n
R
-grupa
alkilowa lub
aromatyczna
n
-liczba merów

Kopolimery silikonowo –
organiczne mają
właściwości
ciekłokrystaliczne i
stosowane są w
elektrooptyce,
magnetooptyce i
termooptyce
.
Emulsje wodne silikonów oraz
poliolefin i różnych środków
sieciujących stosowane są do
usuwania rysunków graffiti
bez niszczenia tynków.
Kompozyty organiczno-
nieorganiczne zwane
silseskwioksanami mają
właściwości ciekłokrystaliczne i
świecące.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
Krzem i jego związki 2
Krzem i jego związki
Wegiel i jego zwiazki z wodorem, odpowiedzi IIIg
MATERIAŁ NA CHEMIĘ 'Węgiel i jego związki z wodorem' pojęcia
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem C D, Chemia nowej ery 3 ( 2011 - 2012 ) -
Chrom i jego zwiazki
Odpowiedzi do sprawdzianu Węgiel i jego związki z wodorem A B, Chemia nowej ery 3 ( 2011 - 2012 ) -
Węgiel i jego związki z wodorem
Chrom i jego związki
Węgiel i jego związki z wodorem
Mangan i jego związki
Mangan i jego zwiazki
Chrom i jego zwiazki
06 4 Mangan i jego związki zadania do lekcji nr 2
07 4 Chrom i jego związki zadania do lekcji nr 2
M Smoliński BISKUP KAMIEŃSKI HERMAN VON GLEICHEN I JEGO ZWIĄZKI Z ZAKONAMI KRZYŻOWYMI
Śliwiński Kasztelan krakowski Spycimir z Tarnowa i jego związki genealogiczne z moznowładztwem mało
Schematy najważniejszych reakcji chemicznych, którym ulegają miedź i jego związki chemiczne
więcej podobnych podstron