
Aminokwasy

Białka – polikondensaty*
zbudowane z reszt
aminokwasowych połączonych
wiązaniem polipeptydowym ,
umownie przyjęto, że są to
cząsteczki o masie powyżej 10 kDa.
Mniejsze cząsteczki zwyczajowo
określa się jako polipeptydy.
Oligopeptydy zawierają kilka –
kilkanaście reszt aminokwasowych.
* Podczas polimeryzacji
monomerów jedynym produktem
jest otrzymywany polimer. Podczas
polikondensacji dodatkowo
wydzielane są także inne związki
np. woda
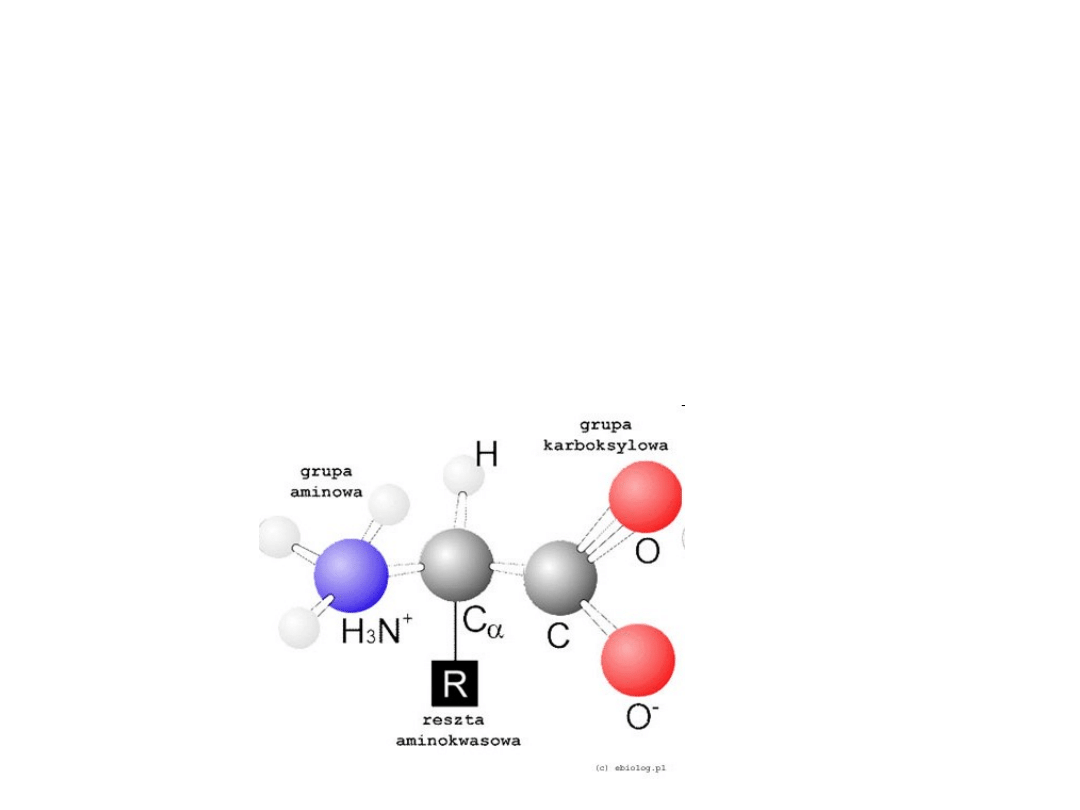
Aminokwasy białkowe
Alfa-aminokwasy używane do syntezy białek.
Alfa oznacza, że grupa
aminowa
i
karboksylowa
są przyłączone do tego
samego atomu węgla
CIEKAWOSTKA BETA-
AMINOKWAS
R1 – C – C – COOH
|
NH2
Węgie
l beta
Węgi
el alfa
β-Alanina jest składnikiem
dwupeptydu karnozyny (β-alanylo-L-
histydyny), której biosynteza
uzależniona jest od dostępności β-
alaniny jako substratu. Karnozyna
buforuje spadek pH związany m.in. z
powstawaniem kwasu mlekowego w
mięśniach w trakcie wysiłku. Z tego
względu przyjmowanie β-
alaniny zmniejsza zmęczenie fizyczne.
β-Alanina powstaje w wątrobie w
wyniku degradacji uracylu.
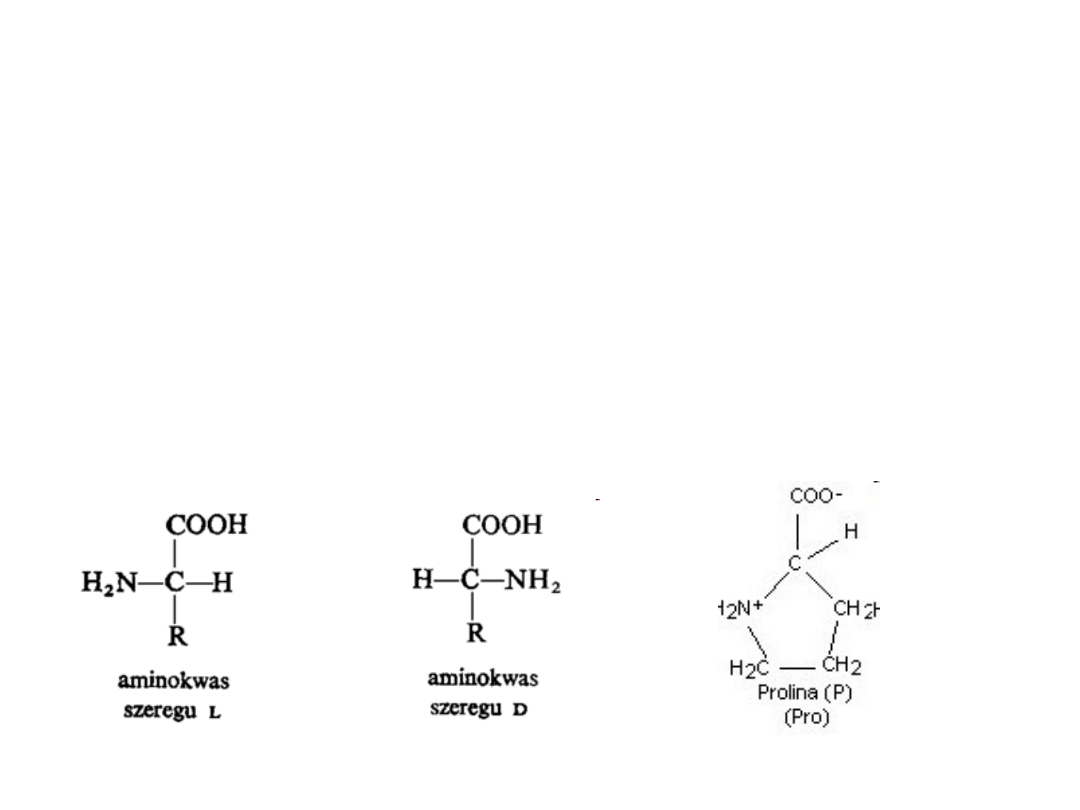
Aminokwasy białkowe
- wszystkie aminokwasy białkowe u
eucaryota są L –aminokwasami, za
wyjątkiem glicyny (brak chiralnego
atomu węgla)
- dodatkowo prolina jest w istocie
iminokwasem (iminą) – N jest związany
z 2 atomami węgla
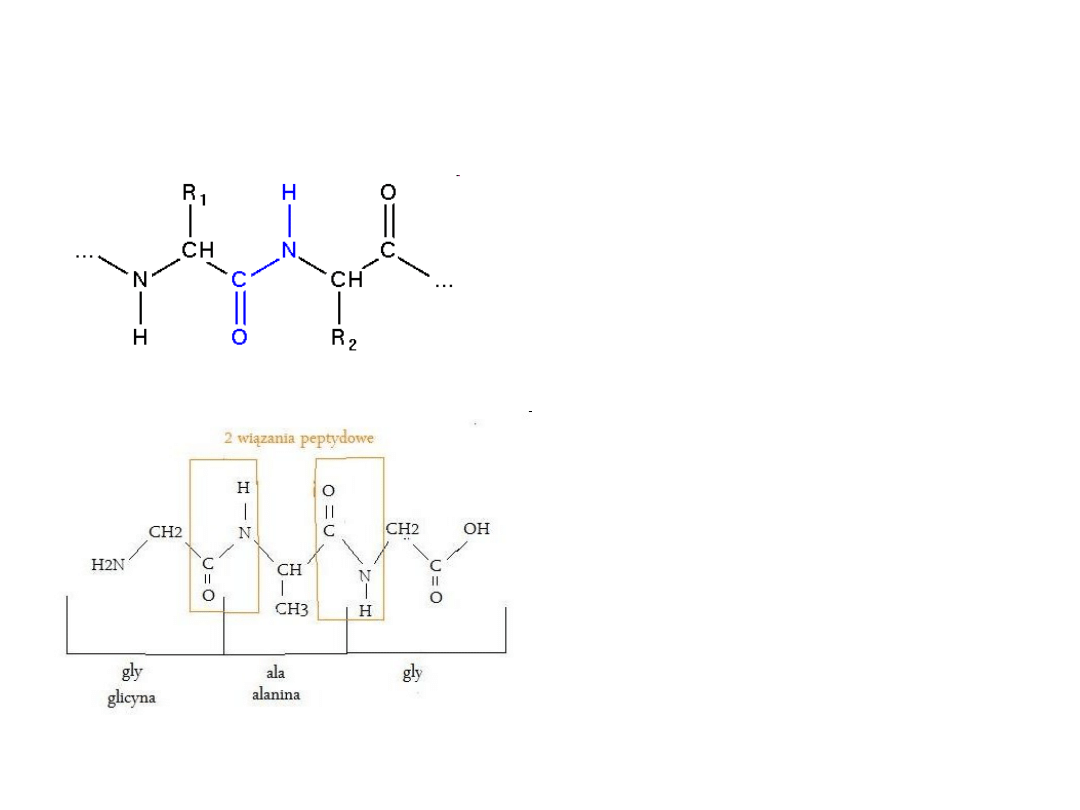
Wiązanie peptydowe
(w istocie wiązanie amidowe)
pomiędzy resztami
aminokwasowymi.
Jest to wiązanie kowalencyjne
między grupą α-aminową jednego
aminokwasu i grupą α-
karboksylową drugiego
aminokwasu.
Wiązanie peptydowe wykazuje
częściowo charakter wiązania
podwójnego, jest więc stosunkowo
sztywne i płaskie.
PAMIĘTAJ – w łańcuchu
polipeptydowym występują
RESZTY AMINOKWASOWE – nie
aminokwasy – aminokwas to
pojedynczy prosty związek.
Wiązanie peptydowe
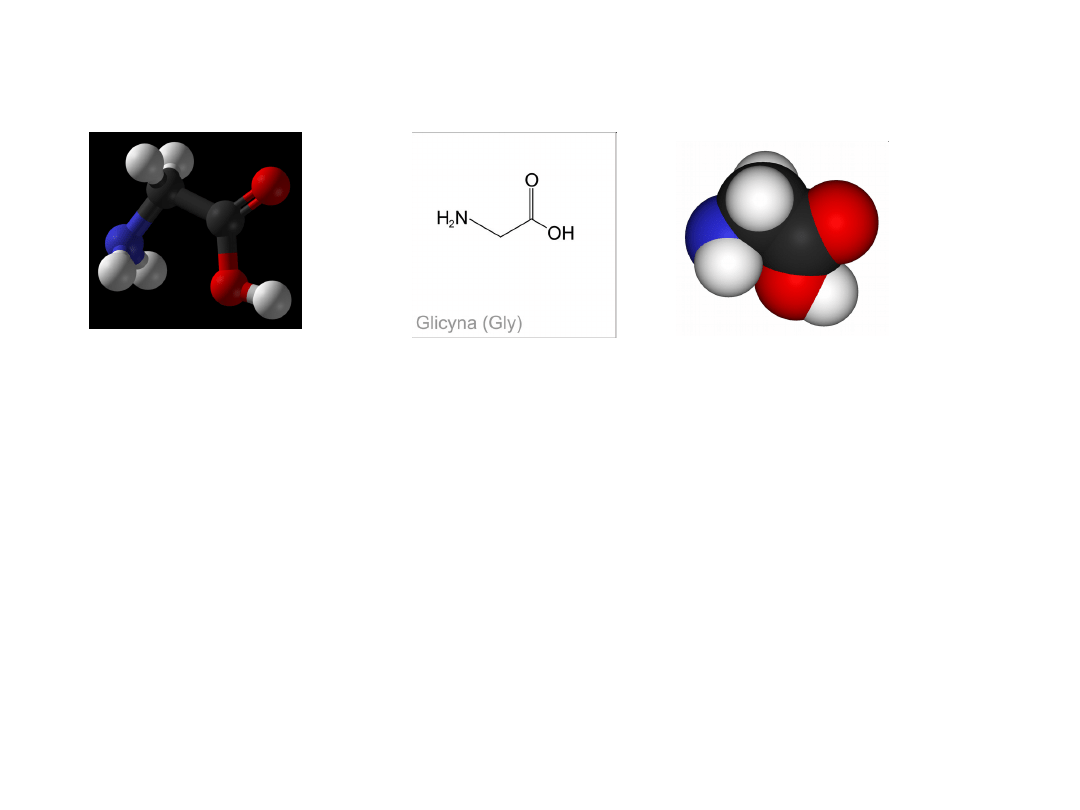
Glicyna – najprostszy
aminokwas
aminokwas – musi mieć
grupę aminową i
karboksylową
przyłączyć do jednego C
dodać atomy wodoru
NH2
COOH
NH2
– C – COOH
NH2
– CH2 –
COOH
Aminokwasy – jak je zapamiętać?

NH2 – C – COOH
Glicyna jako samodzielny aminokwas występuje przede wszystkim w roli
przekaźnika w ośrodkowym układzie nerwowym (CSN).
W peroksysomach hepatocytów glicyna ulega sprzęgnięciu z pierwotnymi
kwasami żółciowymi, tworząc w ten sposób sole żółciowe.
Glicyna bierze udział w biosyntezie puryn de novo.
Wraz z sukcynylo-CoA bierze udział w syntezie hemu.
Ludzki organizm potrafi syntetyzować glicynę, dlatego nazywa się ją
aminokwasem endogennym.
H
H
Glicyna

NH2 – CH – COOH
|
R
Z glicyny można
wyprowadzić wzór na
ogólną postać aminokwasów
– teraz wystarczy już tylko
podmieniać
R

NH2 – CH – COOH
|
CH3
Alanina
Łańcuch boczny alaniny stanowi
grupa metylowa
.
Ponieważ przy atomie węgla α występują cztery
różne podstawniki, alaninę zalicza się do grupy
aminokwasów optycznie czynnych. Alanina jest
aminokwasem niepolarnym alifatycznym,
chemicznie niereaktywnym i hydrofobowym.
Alanina jest aminokwasem endogennym.

NH2 – CH – COOH
|
CH3
Alanina
Ile ma a?

NH2 – CH – COOH
|
CH
3
A
l
a
nin
a
Ile ma a?
3

NH2 – CH – COOH
|
CH3
Wiedząc jak wygląda alanina można łatwo
wymyślić jak wygląda fenyloalanina
Musi to być połączenie alaniny i grypy fenylowej –
C6H5
Gdzie ją dodać?
NH2 – CH – COOH
|
CH3
Wiedząc jak wygląda alanina można łatwo
wymyślić jak wygląda fenyloalanina
Musi to być połączenie alaniny i grypy fenylowej –
C6H5
Gdzie ją dodać?
Jeśli tutaj to ta
grupa będzie
zablokowana –
brak możliwości
utworzenia
wiązania
peptydowego
Zamiast wodoru?
W praktyce
możliwe, ale…
Wzór ogólny na
aminokwasy
podpowiada, że w
tym przypadku nie
jest to właściwe
miejsce
Tu jest OK..
NH2 – CH – COOH
|
CH2
|
-alanina
Fenylo-
Genetycznie uwarunkowana, wrodzona choroba metaboliczna o nazwie
fenyloketonuria, powoduje, że osoby na nią chorujące nie mogą we właściwy
sposób metabolizować fenyloalaniny, co jest powodem wzrostu jej stężenia
we krwi. Nadmiar fenyloalaniny ma toksyczne działanie na niektóre
struktury mózgu i może doprowadzić do nieodwracalnych uszkodzeń. Z tego
względu każdy noworodek jest badany na obecność tego zaburzenia
metabolicznego i w wypadku jego stwierdzenia stosuje się dietę restrykcyjną
mającą na celu zmniejszenie ilości fenyloalaniny we krwi.
Z fenyloalaniny można produkować amfetaminę.
Fenyloalanina – hydrofobowy aminokwas
aromatyczny, egzogenny.
Fenyloalanina posiada dwa enancjomery, z
których forma L występuje naturalnie w
przyrodzie i jest przyswajana przez
organizmy żywe, zaś formę D można
otrzymać w sposób syntetyczny.
NH2 – CH – COOH
|
CH2
|
Z fenyloalaniny można zrobić inny aminokwas:
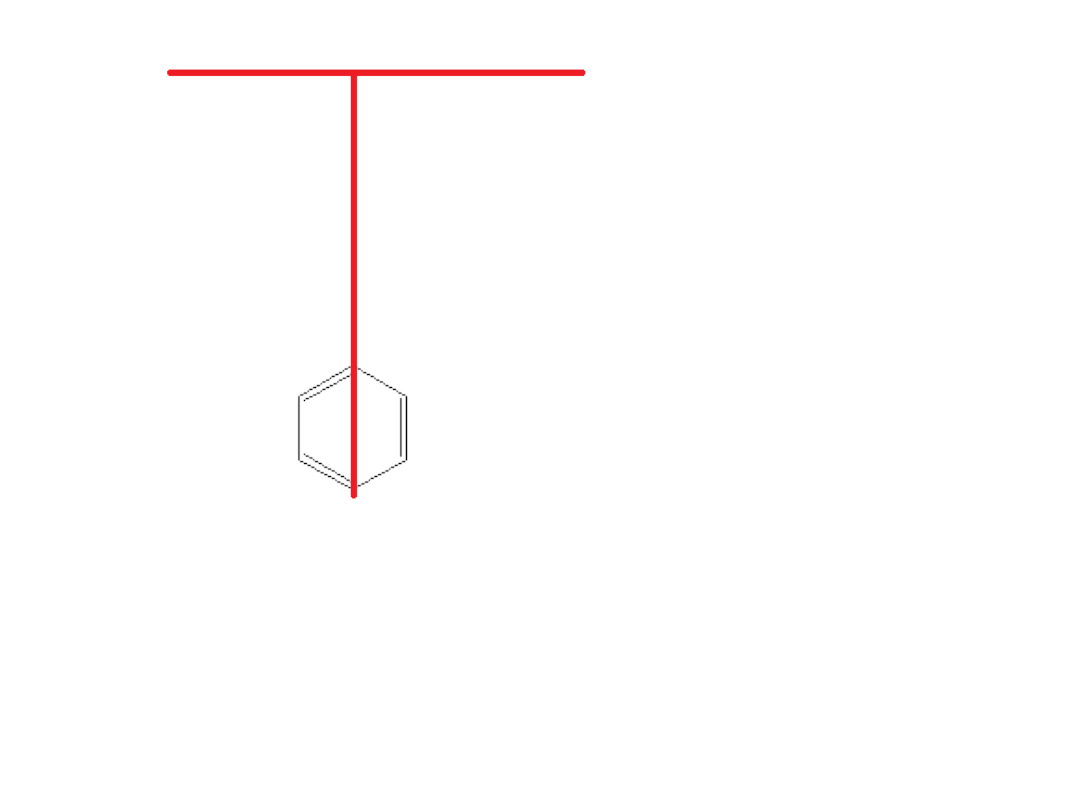
NH2 – CH – COOH
|
CH2
|
Z fenyloalaniny można
zrobić inny aminokwas:
T
YR
O
ZYNĘ
|
OH
Jest aminokwasem endogennym, tzn. organizm ludzki oraz większość
zwierząt jest w stanie syntetyzować go pod warunkiem dostatecznego
zaopatrzenia w fenyloalaninę, od której tyrozyna różni się obecnością
jednej grupy hydroksylowej.
Tyrozyna spełnia ważne biologiczne
zadania jako wewnątrzkomórkowy
przekaźnik (może być fosforylowana
przez kinazy białkowe), a także jest
prekursorem ważnych hormonów i
biologicznie czynnych substancji
(tyroksyna, trójjodotyronina,
adrenalina, noradrenalina oraz
dopamina).

NH2 – CH – COOH
|
CH
/ \
/ \
CH3 CH3
Walina (Val)
- aminokwas egzogenny, niepolarny o alifatycznym,
rozgałęzionym łańcuchu bocznym.

NH2 – CH – COOH
|
CH
/ \
/ \
CH3 CH3
WALINA (ang.
v
alin, skrót
v
al) czy
widzisz
V
?

NH2 – CH – COOH
|
CH2
|
CH3-CH-CH3
LEUCYNA
Występuje we wszystkich białkach, duże ilości
w albuminach i ciałach występujących w
osoczu.
Należy do grupy aminokwasów egzogennych,
niewytwarzanych przez organizm ludzki.

NH2 –
C
H – COOH
|
C
H2
|
CH3-
CH-CH3
LEUCYNA. Czy widzisz L?

NH2 –
C
H – COOH
|
C
H2
|
CH3-C
H-CH3
LEUCYNA. Czy widzisz L?

NH2 – CH – COOH
|
CH2
|
CH3-CH-CH3
Znając leucynę można wymyślić jak wygląda
IZOLEUCYNA.
IZO wskazuje że to będzie izomer leucyny,
czyli wzór sumaryczny nie zmieni się ale coś
trzeba przestawić. Wielu możliwości nie ma.
Przenieś jedną zapałkę…

NH2 – CH – COOH
|
CH
|
CH3-CH
Znając leucynę można wymyślić jak wygląda
IZOLEUCYNA.
IZO wskazuje że to będzie izomer leucyny,
czyli wzór sumaryczny nie zmieni się ale coś
trzeba przestawić. Wielu możliwości nie ma.
Przenieś jedną zapałkę…
-CH3

NH2 – CH – COOH
|
CH
|
CH3-CH
Znając leucynę można wymyślić jak wygląda
IZOLEUCYNA.
IZO wskazuje że to będzie izomer leucyny,
czyli wzór sumaryczny nie zmieni się ale coś
trzeba przestawić. Wielu możliwości nie ma.
Przenieś jedną zapałkę…
-CH3

NH2 – CH – COOH
|
CH
|
CH3-CH
Znając leucynę można wymyślić jak wygląda
IZOLEUCYNA.
IZO wskazuje że to będzie izomer leucyny,
czyli wzór sumaryczny nie zmieni się ale coś
trzeba przestawić. Wielu możliwości nie ma.
Przenieś jedną zapałkę…
-CH3

NH2 – CH – COOH
|
CH
|
CH3-CH
Znając leucynę można wymyślić jak wygląda
IZOLEUCYNA.
IZO wskazuje że to będzie izomer leucyny,
czyli wzór sumaryczny nie zmieni się ale coś
trzeba przestawić. Wielu możliwości nie ma.
Przenieś jedną zapałkę…
-CH3

NH2 – CH – COOH
|
CH
|
CH3-CH
2
IZOLEUCYNA
-CH3
Izomer leucyny, aminokwas alifatyczny występujący w praktycznie
każdym białku, obojętny elektrycznie.
Należy do aminokwasów egzogennych czyli nie może być
syntetyzowany w organizmie człowieka i musi być dostarczany z
pożywieniem.
Duże jego ilości znajdują się w kazeinie, hemoglobinie, białkach osocza
krwi.

BCAA (aminokwasy
rozgałęzione)
• trzy wyjątkowe aminokwasy (walina,
leucyna i izoleucyna) należą do grypy
niezbędnych, czyli takich, których nasz
organizm nie wytwarza, stąd muszą być
dostarczone w diecie. Obok glutaminy, to
najważniejsze aminokwasy wysiłkowe, które:
- stanowią źródło energii w czasie
długotrwałych wysiłków (cykl alaninowo –
glukozowy) – aminokwasy te nie są
metabolizowane przez wątrobę, dzięki
czemu stanowią łatwo dostępne paliwo,
szczególnie w czasie długotrwałych
wysiłków;
- odraczają moment zmęczenia – blokują
przepływ tryptofanu do mózgu (tryptofan w
mózgu przekształca się w „nasenną”
serotoninę); dzięki czemu w trakcie wysiłku
nie dopada człowieka zmęczenie.
Aminokwasy te stały się nieodłącznym
składnikiem przed i potreningowego
zestawu suplementacyjnego.

NH2 – CH – COOH
|
CH3
Alanina
Czy da się z niej zrobić coś
jeszcze?

NH2 – CH – COOH
|
CH2
|
S
H
cy
S
teina
Endogenny aminokwas, wchodzi w skład wielu białek. Wraz z homocysteiną i
metioniną tworzy grupę aminokwasów siarkowych (cysteina jest najprostszym z
nich).
Cząsteczka cysteiny zawiera grupę tiolową (–SH), dzięki której jest zdolna do
tworzenia mostków siarczkowych – jednego z czynników wpływających na
trzeciorzędową strukturę białek.
Cysteina występuje głównie w białkach zbóż oraz kukurydzy.
Cysteina po dekarboksylacji jako cysteamina znajduje się w koenzymie A, wchodzi
w skład tripeptydu glutationu (γ-glutamylo-cysteinylo-glicyny), w którym jej grupa
tiolowa jest grupą czynną w reakcjach redoks.
Jej pochodna N-acetylocysteina jest wykorzystywana w medycynie przy
zatruciach paracetamolem i jako środek mukolityczny (ułatwiający odkrztuszanie)
np. w mukowiscydozie albo rozedmie.

NH2 – CH – COOH
|
CH2
|
O
H
Seryna
Jak zapamiętać: jaka?
seryn
O
wa
Endogenny aminokwas kodowany (biogenny), wchodzi w skład białek,
takich, jak np. kazeina w mleku czy fibroina jedwabiu.
Jest obojętna elektrycznie.
Niezbędna w diecie człowieka, pełni ważną funkcję w trawieniu białek
jako składnik proteaz serynowych m.in.. trypsyny i chymotrypsyny.

Zabawa długością
łańcucha bocznego

NH2 – CH – COOH
|
CH3
Alanina (jeszcze
raz)

NH2 – CH – COOH
|
CH3
Alanina (jeszcze
raz)
<<< zauważ
1C

NH2 – CH – COOH
|
CH
OH
|
CH3
<<< zauważ
2C
tre
O
nina
Obojętny elektrycznie aminokwas.
Należy do aminokwasów niezbędnych (nie może być syntetyzowany w
organizmie człowieka i musi być dostarczany z pożywieniem).
Treonina jest aminokwasem optycznie czynnym posiadającym drugi
asymetryczny atom węgla obok węgla α.
Produkty o dużej zawartości treoniny to twaróg, drób, ryby, mięso,
soczewica, i ziarno sezamowe.

NH2 – CH – COOH
|
CH2
|
COOH
<<< zauważ
2C

NH2 – CH – COOH
|
C
H2
|
C
OOH
<<< zauważ
2C
Kwas asparaginowy
= ASPARAGINIAN
Aminokwas białkowych o charakterze kwasowym.
Anion karboksylowy tego kwasu (forma anionowa jest formą przeważającą
w warunkach fizjologicznych) to asparaginian.
Uczestniczy w syntezie puryn i pirymidyn oraz mocznika.
Jest produktem pośrednim w cyklu Krebsa.
Zapotrzebowanie na niego jest w całości pokrywane przez syntezę w
organizmie, zatem jest to aminokwas endogenny.

Asparaginian w medycynie
• Asparaginian magnezu i asparaginian potasu to
bardzo dobrze przyswajalne sole magnezu i
potasu. Biopierwiastki (magnez i potas), aby
dostać się do krwiobiegu muszą przeniknąć
przez pofałdowaną błonę jelita cienkiego
pokrytą cienkimi kosmkami. Komórki kosmków
są tak zbudowane, że zewnętrzna strona ich
błony od strony światła jelita ma ładunek
dodatni. Jony magnezu także mają ładunek
dodatni. Jednoimienne ładunki powodują silne
odpychanie się, utrudniając biopierwiastkom
przenikanie do wnętrza komórki. Magnez i
potas, aby ominąć barierę znajdują substancję
"maskującą" dodatni ładunek i ułatwiającą
przenikanie przez ścianę jelita. Udowodniono,
że rolę tę dobrze pełnią niektóre słabe kwasy
organiczne: mlekowy, cytrynowy. Jednak
najlepiej rolę tą spełniają aminokwasy (w tym
wodoroasparaginiany). Asparaginian magnezu i
asparaginian potasu są polecane przy częstym
zmęczeniu, stresie, chorobach serca, miażdżycy
czy też pojawiających się skurczach mięśni.

NH2 – CH – COOH
|
C
H2
|
C
OOH + NH3
ASPARAGINIAN + AMONIAK = ?

NH2 – CH – COOH
|
C
H2
|
C
OONH2 + H2O
AMID KWASU APARAGINOWEGO

NH2 – CH – COOH
|
C
H2
|
C
OONH2
ASPARAGINA
Aminokwas endogenny, powszechny składnik białek.
Duże ilości asparaginy występują w białkach nasion, a także w stanie
wolnym w płynach komórkowych i tkankach.
Asparagina jest wykorzystywana jako magazyn amoniaku w tkankach
zwierzęcych i roślinnych.
Dobrze rozpuszcza się w gorącej wodzie, źle w alkoholu i eterze. Ogrzewana
z mocnymi kwasami lub zasadami rozkłada się na kwas asparaginowy i
amoniak.
Była stosowana w lecznictwie przeciw artretyzmowi oraz w postaci soli
rtęciowej przeciw kile

NH2 – CH – COOH
|
C
H2
|
C
H2
|
C
OOH
KWAS GLUTAMINOWY
CZYLI
GLUTAMINIAN
Aminokwas białkowy o charakterze kwasowym. Anion karboksylowy tego
kwasu (forma anionowa jest formą przeważającą w warunkach
fizjologicznych) to glutaminian.
Enancjomer L kwasu glutaminowego jest aminokwasem endogennym,
obecnym w prawie wszystkich białkach.
Kwas L-glutaminowy jest ważnym neuroprzekaźnikiem pobudzającym w
korze mózgowej ssaków. Uczestniczy w przemianach azotowych, poprzez
przemianę w glutaminę.
Kwas glutaminowy jest stosowany w leczeniu schorzeń układu nerwowego.

NH2 – CH – COOH
|
C
H2
|
C
H2
|
C
OOH
KWAS
GLUTAMINOWY
CZYLI
GLUTAMINIAN
SZTUCZKA ABY SIĘ NIE POMYLIĆ:
A jest w alfabecie przed G
2 jest w szeregu liczb naturalnych
mniejsze od 3
NH2 – CH – COOH
|
C
H2
|
C
OOH
ASPARAGINIAN

NH2 – CH – COOH
|
C
H2
|
C
H2
|
C
OO
NH2
GLUTAMINA
Glutamina odgrywa kluczową rolę w metabolizmie azotu. Toksyczny amoniak
powstający w przemianach aminokwasów w różnych tkankach jest
asymilowany przez jego reakcję z kwasem glutaminowym, prowadzącym do
powstania glutaminy.
Ze względu na to, że glutamina jest syntezowana w organizmach żywych z
kwasu glutaminowego nie jest ona aminokwasem egzogennym i nie musi być
obecna w pożywieniu.

GLUTAMINA
I
GLUTAMINIAN
TO NIE
TO SAMO!
Glutamini
an
– anion kwasu
glutaminowego.
Podobnie kwas fosforowy – fosfor
an
kwas siarkowy – siarcz
an
Popularny środek polepszający smak i
zapach produktów żywnościowych –
glutaminian sodu
Sztuczka aby się nie pomylić:
Glut
amina
Amina wskazuje na obecność azotu

TAK SAMO JEST W
PRZYPADKU
ASPARAGINY I
ASPARAGINIANU

NH2 – CH – COOH
|
CH3
Alanina będzie punktem
wyjścia
NH2 – CH – COOH
|
CH2
tryptofan
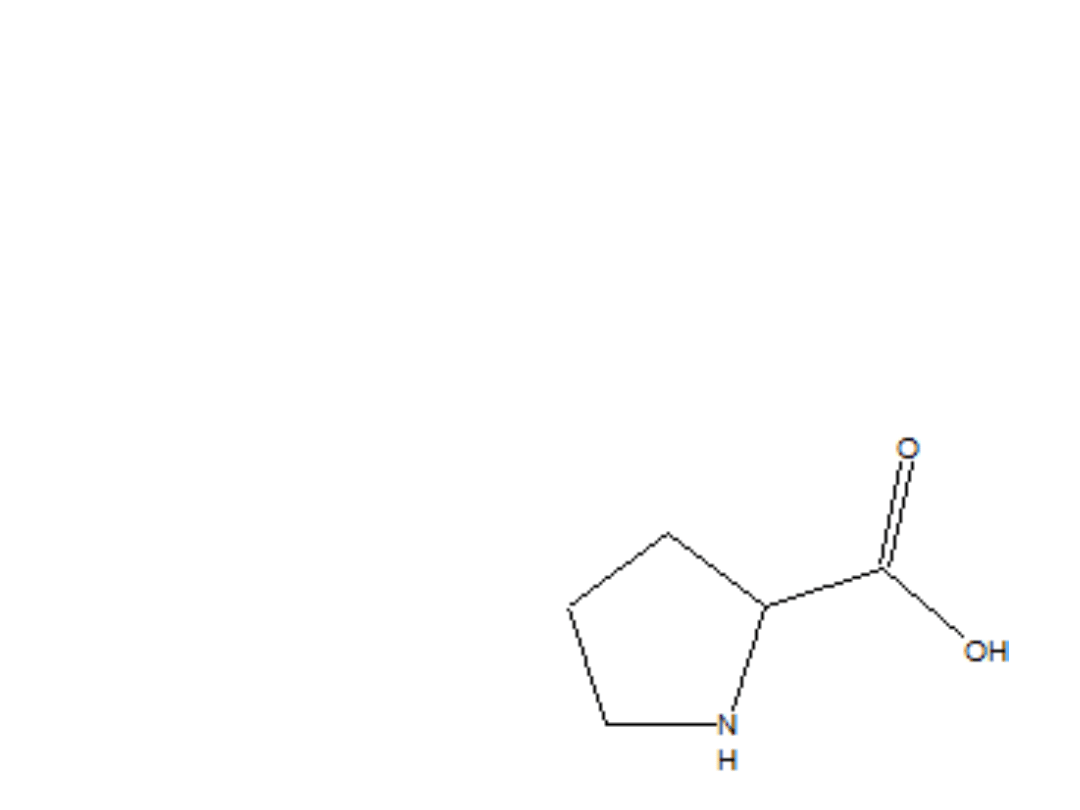
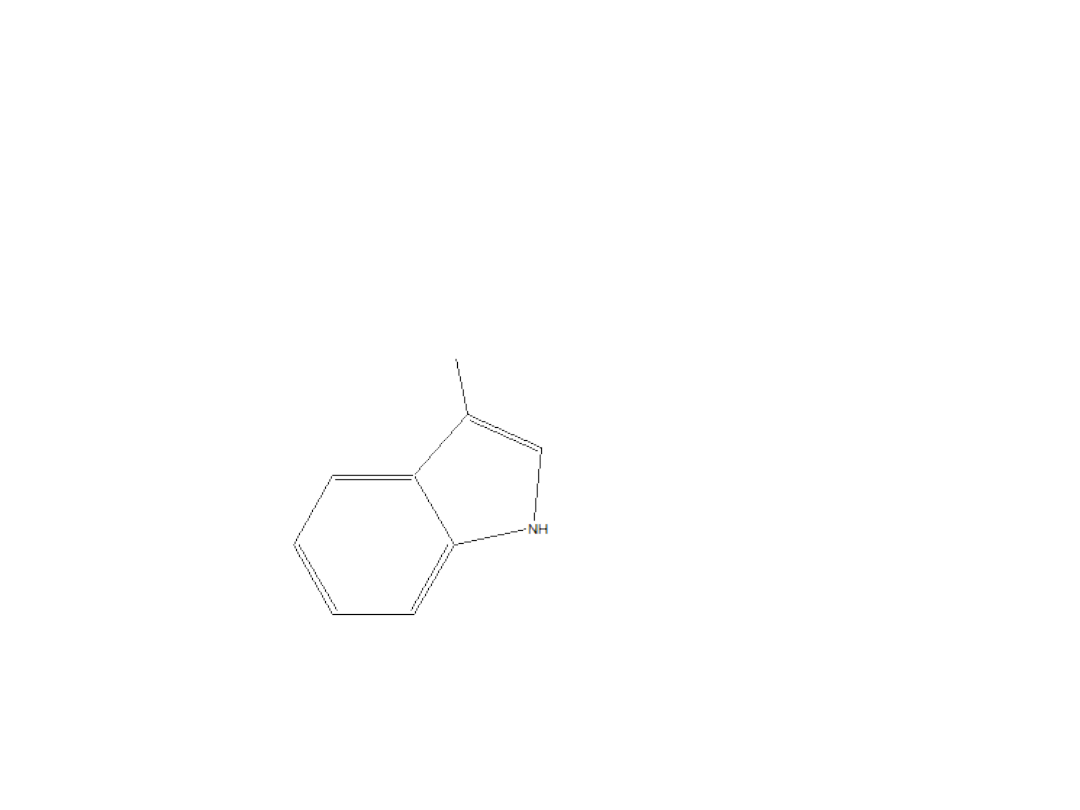
NH – CH – COOH
| |
CH CH
\ /
CH
prolin
a
„ludzik”

NH2 – CH – COOH
|
C
H2
|
C
H2
|
S
|
CH3
Met
i
on
i
na
Ile i?
Met na
początku
zawsze
oznacza
CH3-
Pomocne
przykłady:
MetOH
EtOH

Mam nadzieję, że to
pomoże wam w nauce
wzorów aminokwasów
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
Karczewska-Gzik Agnieszka Co trzeba wiedzieć o metodzie projektu
Co trzeba wiedzieć o KORPORACJACH
ZAGADNIENIA DO EGZAMINU CO TRZEBA WIEDZIEĆ
Poradnik co trzeba wiedziec zeb Nieznany
LateX - def, AGH Matematyka Stosowana (WMS), Latex - krótko co trzeba wiedzieć
Co trzeba wiedzieć i umieć aby zaliczyć II kolokwium
Co trzeba wiedzieć przekraczajac granice Polski poradnik wakacyjny
BTS Wszystko, co trzeba wiedzieć o królach K POPU Zupełnie nieoficjalny przewodnik Mackenzie Malcol
Co trzeba wiedzieÄ o MIDI
Co trzeba wiedzieć o diagnozie klinicznej
Co trzeba wiedzieć o żelatynie
Co trzeba wiedzieć o MIDI
di com pl acta co trzeba wiedzie o antypirackim pakcie
BMS Li ion Co To Jest i co trzeba wiedzieć o modułach i ogniwach litowych Blog ABC RC
więcej podobnych podstron