
Zjawiska transportu w układach biologicznych
Stan równowagi termodynamicznej
– stan w którym
parametry tego stanu (objętość, ciśnienie, temperatura,
energia) nie zmieniają się w czasie i kiedy nie występują
żadne przepływy.
Proces termodynamiczy
– przechodzenie układu
termodynamicznego z jednego stanu w inny.
Dowolny
proces termodynamiczny charakteryzują bodziec i
strumień.
Są to dwie wielkości sprzężone. Wszystkie
procesy termodynamiczne powstają pod wpływem
bodźców
Bodziec – Gradient odpowiedniej wielkości.
Bodźce są wektorami.
Bodźce wewnętrzne – proces jest samorzutny
Bodźce zewnętrzne – proces jest wymuszony
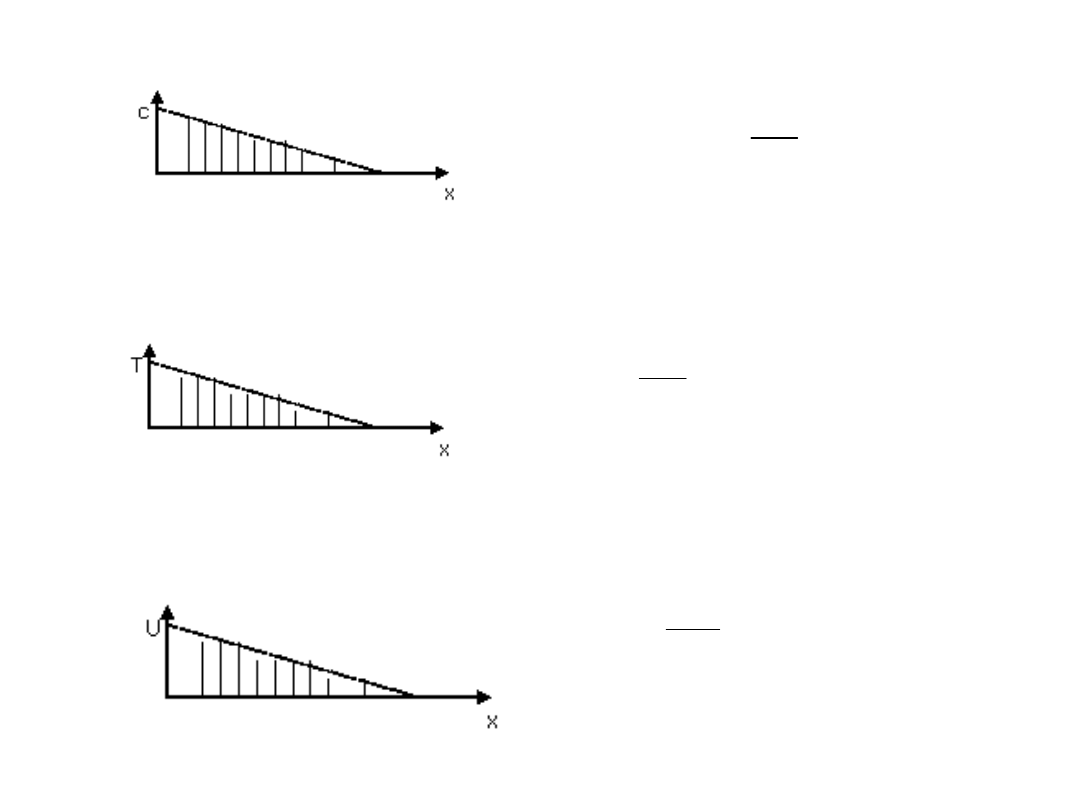
x
c
X
c
1. Bodziec dyfuzyjny
gradient stężenia
c – stężenie
x - odległość
2. Bodziec odpowiedzialny za przepływ ciepła
gradient temperatury
T – temperatura
X - odległość
3. Bodziec odpowiedzialny za przepływ prądu
gradient potencjału
U – potencjał
X – odległość
x
T
X
T
x
U
X
U

Transport masy. Dyfuzja. Strumień dyfuzyjny.
Prawo Ficka
x
c
D
J
D
Zgodnie z prawem Ficka wielkość strumienia dyfuzyjnego jest
wprost proporcjonalna do gradientu stężenia dyfundującej
substancji.
Gradient stężenia jest równy ilorazowi różnicy stężeń (c)
pomiędzy dwoma punktami i odległości między nimi (x).
Współczynnik proporcjonalności (D) nazywany jest
współczynnikiem dyfuzji danej substancji. Zależy on od rodzaju
dyfundującej substancji, rodzaju ośrodka w którym zachodzi
dyfuzja oraz od temperatury.

Transport ładunków. Strumień ładunków.
Transport ładunków. Strumień ładunków.
Jeśli cząsteczki posiadają wypadkowy ładunek elektryczny
(są jonami) to o ich rozmieszczeniu w roztworze będzie
decydowała nie tylko dyfuzja lecz również ruch pod
wpływem pola elektrycznego. Wędrówkę jonów pod
wpływem pola elektrycznego nazywamy migracją. strumień
jonów opisany jest następującym równaniem:
x
V
DczF
J
mig
gdzie D jest współczynnikiem dyfuzji, c - stężeniem
jonów, z - ilością ładunków elementarnych
przenoszonych przez jeden jon, F - stałą Faraday'a, V/x
- gradientem potencjału elektrycznego.
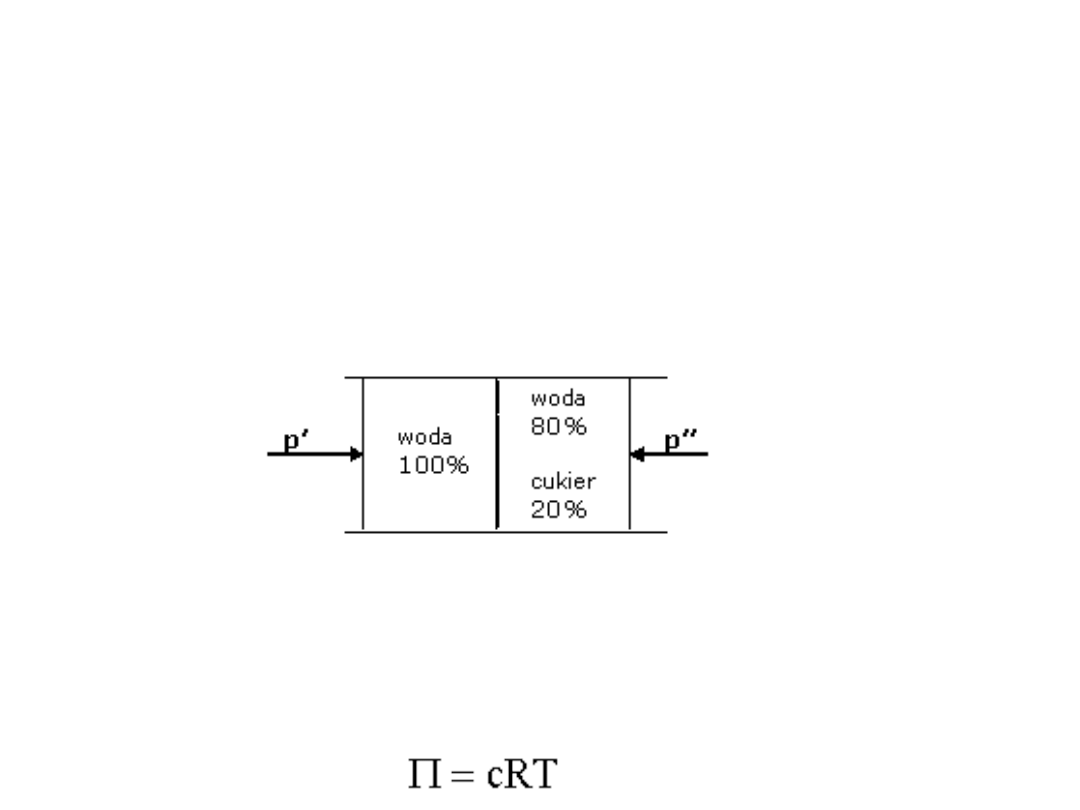
Osmoza. Transport osmotyczny
Błoną półprzepuszczalną nazywamy każdą przegrodę,
przez którą mogą przenikać drobne cząsteczki np.
rozpuszczalnika, nie przenikają natomiast cząsteczki
duże, np. białka.
Jeżeli dwa roztwory o różnych stężeniach przedzielimy
błona półprzepuszczalną, to po pewnym czasie
zauważymy zjawisko samorzutnego wyrównywania
stężeń po obu stronach błony:
Jeżeli chcemy utrzymać 20% stężenie cukru to
musimy zwiększyć ciśnienie p’’. Czyli
p’’ > p’
Różnicę ciśnień (p’’ – p’) = nazywamy ciśnieniem
osmotycznym
Ciśnienie osmotyczne opisuje równanie van Hoffa:
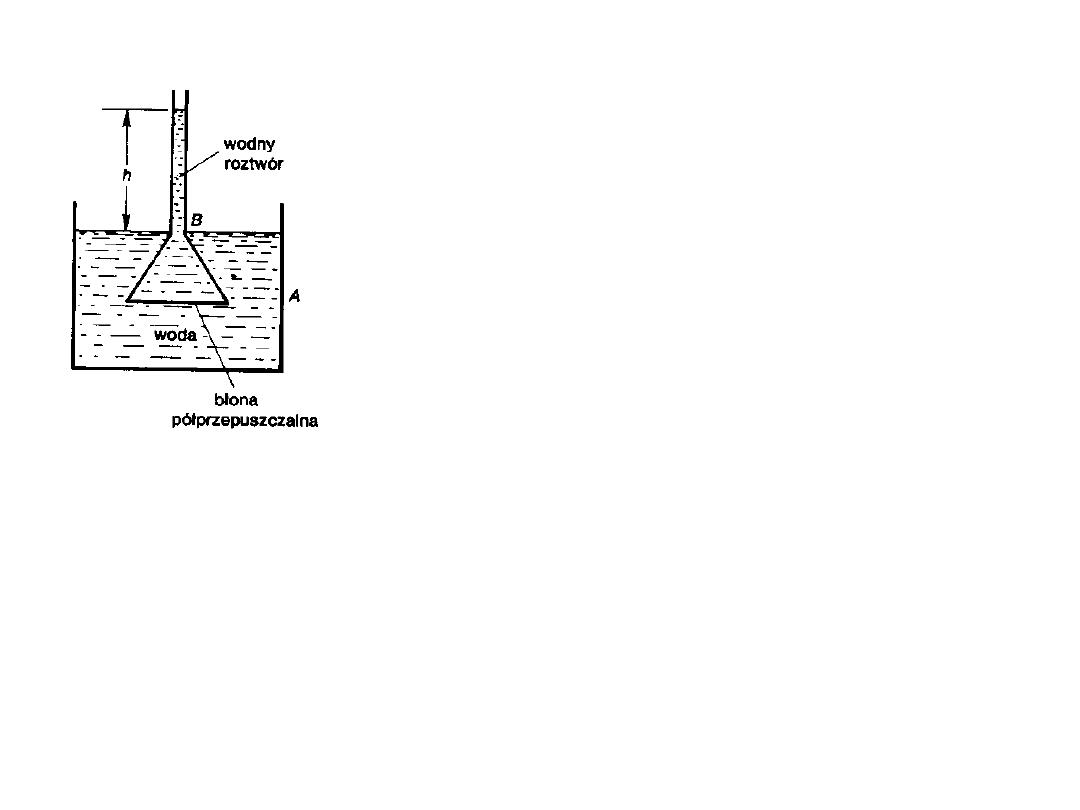
Ciśnienie osmotyczne możemy mierzyć za pomocą osmometru
A – naczynie z wodą, B – naczyńko
osmotyczne zawierające roztwór, h –
wysokość wzniesionego słupa cieczy.
Pod wpływem różnicy stężeń wody
będzie on przepływała z A do B. Poziom
cieczy w rurce pionowej będzie się
podnosił dopóty, dopóki ciśnienie
hydrostatyczne słupa cieczy nie
zrównoważy ciśnienia osmotycznego
Woda porusza się swobodnie w obie strony przez błonę
komórkową, a duże cząsteczki np. białko nie przechodzą
przez błonę. Nie chcemy dopuścić do migracji wody do
środka komórki bo zmieni się stężenie białka w komórce.
Jest to osiągane poprzez większe ciśnienie p’’ wewnątrz
komórki.
Ta nadwyżka ciśnienia w komórce p’’ = p’ +
nazywa się ciśnieniem osmotycznym.
Ciśnienie
osmotyczne zapobiega transportowi wody, czyli
zahamowuje transport osmotyczny.

Roztwór o większym stężeniu jonów (mniejsze stężenie
wody nazywa się hipertoniczny, a roztwór o mniejszym
stężeniu jonów (większe stężenie wody) nazywa się
hipotoniczny.
Zahamować przechodzenie wody przez błonę możemy też
w inny sposób. Wystarczy dodać do wody taką ilość
dowolnej substancji, by stężenie nowego roztworu było
równe stężeniu roztworu po drugiej stronie. Otrzymamy
wówczas tzw. roztwór izotoniczny z pierwszym. Nazwa
izotoniczny oznacza, że wywiera on identyczne ciśnienie
osmotyczne.
Izotoniczność roztworu ma olbrzymie
znaczenie przy sporządzaniu tzw. płynów infuzyjnych,
czyli takich, które podaje się pacjentowi bezpośrednio do
krwioobiegu
, by np. uzupełnić chwilowo ubytek krwi na
skutek krwotoku. Jeżeli podany płyn infuzyjny nie byłby
izotoniczny z krwią spowodowałby albo hemolizę
(rozerwanie krwinek przez wniknięcie do wnętrza
komórki dużej ilości wody - płyn hipotoniczny) albo
obkurczenie krwinek (woda z wnętrza komórki próbowała
by rozcieńczyć płyn infuzyjny o zbyt dużym stężeniu -
hipertoniczny).

Strumień elektrodyfuzyjny. Równowaga Nernsta (napięcie Nernsta)
Gdy w rozpatrywanym układzie występuje zarówno
różnica stężeń jonów jak i różnica potencjałów
elektrycznych to wówczas strumień jonów będzie
"złożeniem" procesu dyfuzji i migracji. Mówimy wtedy o
występowaniu strumienia elektrodyfuzyjnego.
Prawo Nernsta. Napięcie Nernsta - napięcie
równowagowe (V
w
-V
z
).
Przy różnicy potencjałów (V
w
-V
z
) transport wynikający z
różnicy stężeń jest równoważony przez transport
wynikający z różnicy potencjałów
)
c
c
ln(
T
k
)
V
V
(
q
w
z
B
z
w
c
w
– stężenie danego jonu wewnątrz komórki, c
z
– stężenie
zewnątrz komórki, V
w
– potencjał wewnątrz komórki, V
z
–
potencjał zewnątrz komórki, q –ładunek jonu, T –
temperatura Kelvina, k
B
–stała Boltzmanna,
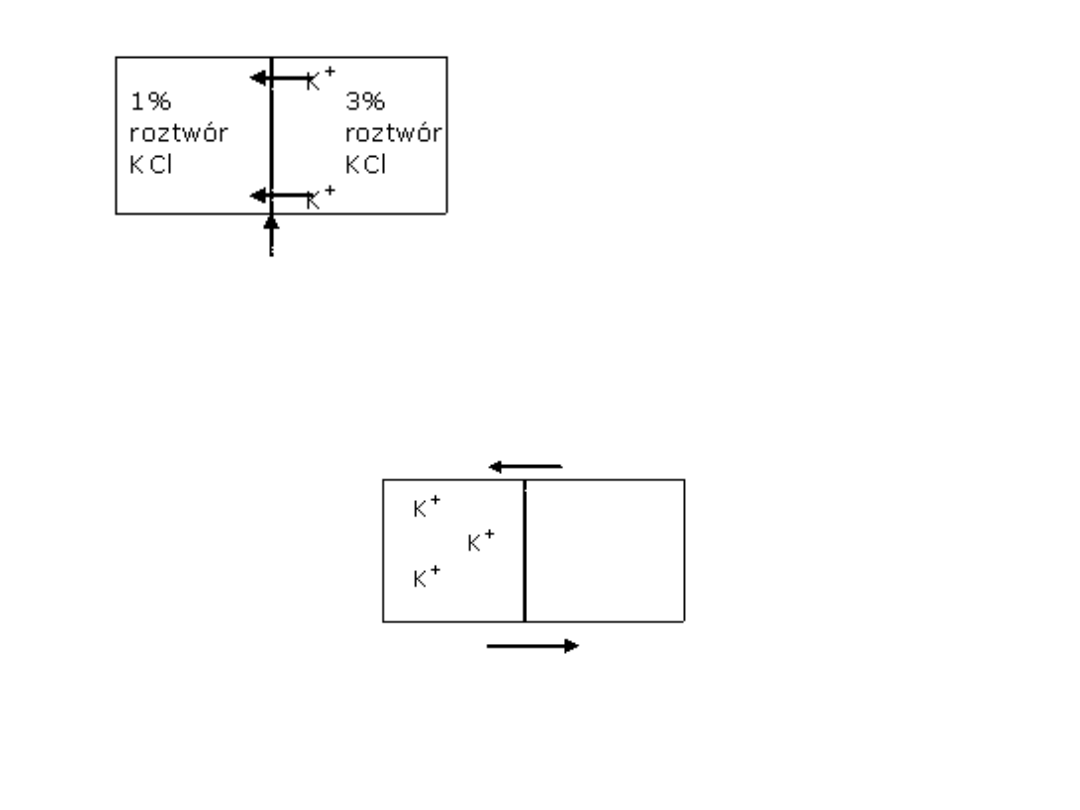
Jony K
+
przenikają z obszaru
II do I ze względu na różnicę
stężenia tak długo dopóki
narastająca różnica
potencjałów elektrycznych
nie zahamuje tego procesu
Błona
nieprzepuszczalna
dla jonów Cl
Strumień dyfuzyjny jonów K
+
wynikający z różnicy stężeń
Strumień elektryczny jonów K
+
wypychanych z obszaru gdzie
zrobiło się ich za dużo
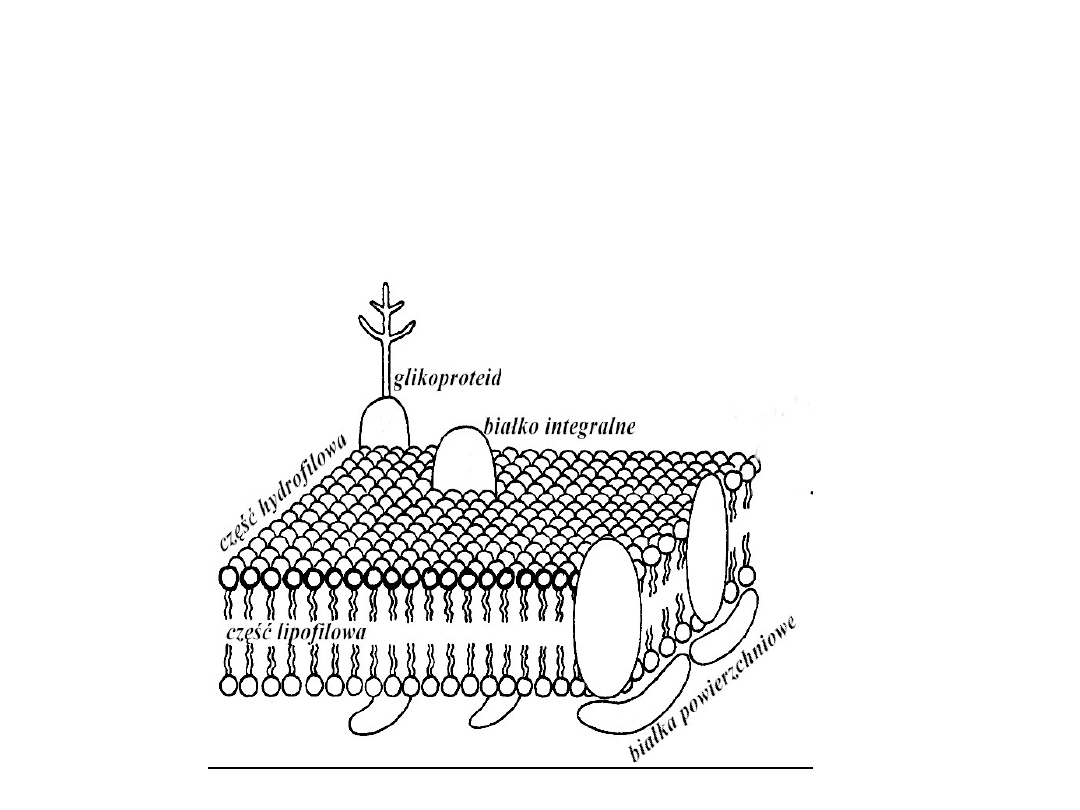
Sumaryczna różnica potencjałów. Napięcie Donnana
Bioelektryczność. Transport jonów przez błony komórkowe
Jeżeli w elektrolicie istnieje kilka rodzajów jonów to błona
ma zdolność sterowania strumieniem każdego z nich
oddzielnie. Napięcie Donnana jest bardziej ogólne od
Napięcia Nernsta.
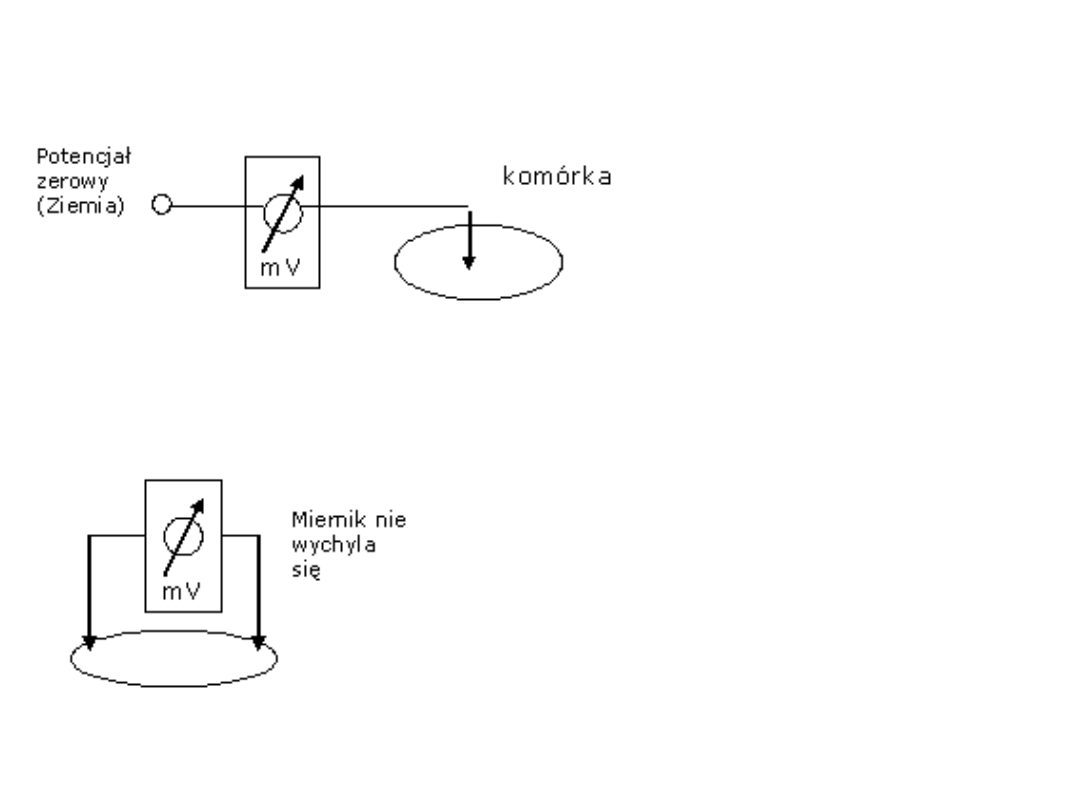
Pojęcie potencjału
Potencjał „V” punktu
czyli napięcie
elektryczne pomiędzy
tym punktem, a
dowolnie wybranym
punktem którego
potencjal równa się
zero.
Napięcie czyli różnica potencjałów
Dwa punkty
pomiędzy którymi
napięcie wynosi zero
nazywa się punktami
o takim samym
potencjale
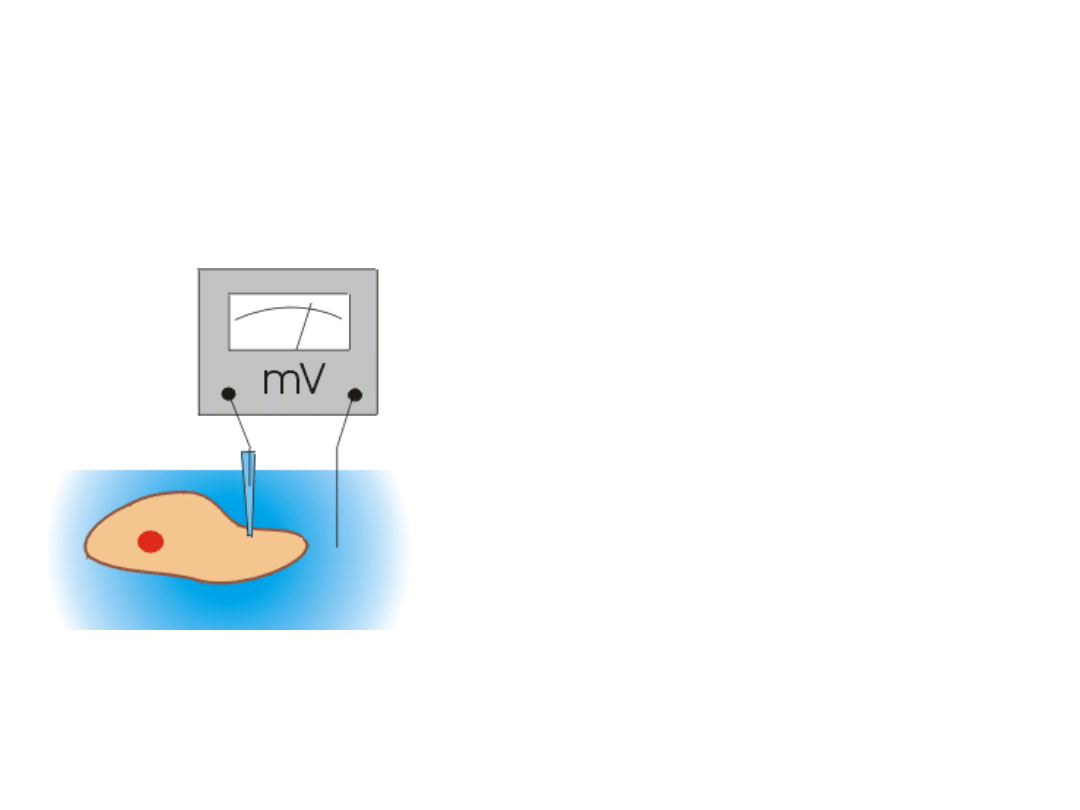
Potencjał błonowy
Potencjałem błonowym lub membranowym nazywamy
różnicę potencjałów pomiędzy wnętrzem komórki i jej
otoczeniem (V
m
= V
w
- V
z
).
Wygodnie jest przyjąć (i taka
jest obowiązująca konwencja), że potencjał po
zewnętrznej stronie błony wynosi zero (V
z
= 0).
Miliwoltomierz mierzy różnicę
potencjałów pomiędzy
wnętrzem i otoczeniem
komórki, czyli potencjał
błonowy.

Potencjały spoczynkowe komórek dla wybranych rodzajów
komórek
Rodzaj komórki
Napięcie (V
w
– V
z
)
gdzie V
z
= 0
(mv)
Olbrzymi akson
(komorka nerwowa
kałamarnicy)
-70
Komórka
mięśniowa
-90
Erytrocyt
-10
Komórka jajowa
jeża
-40
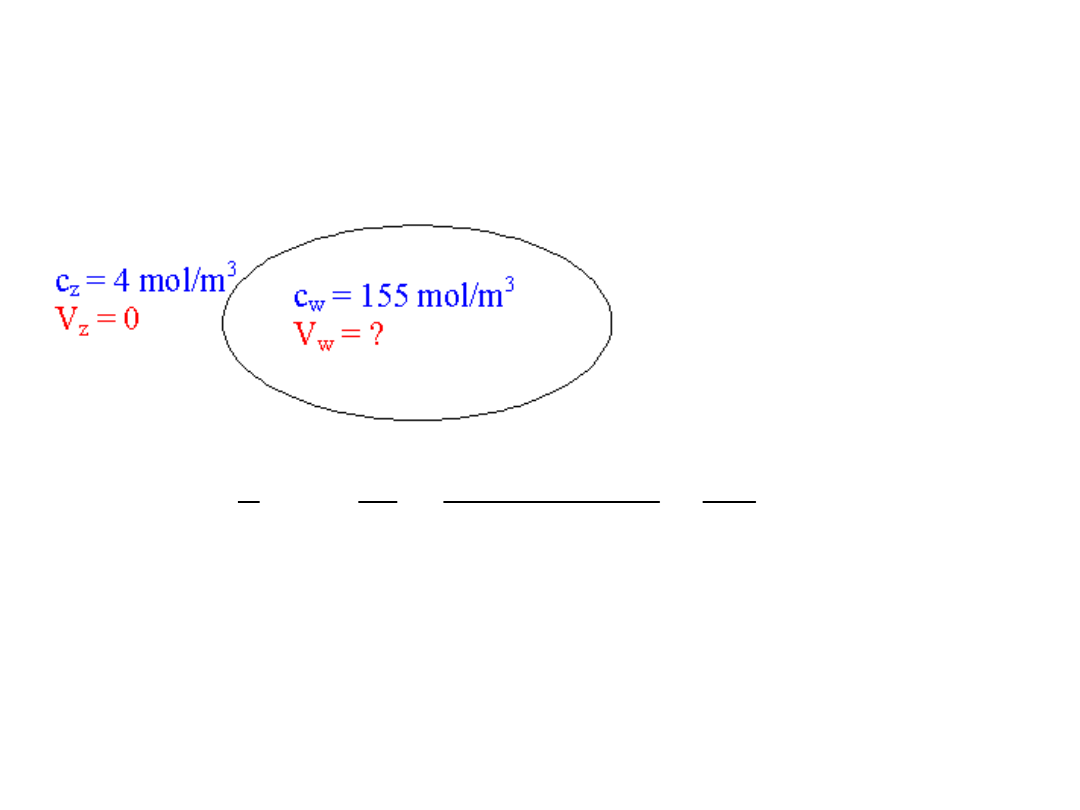
Potencjał spoczynkowy komórek wynikający z
równania Nernsta i rzeczywisty potencjał spoczynkowy
1. Jony potasu K
+
- równanie Nernsta
mV
98
)
155
4
ln(
10
6
.
1
310
10
38
.
1
)
c
c
ln(
T
k
q
1
)
V
V
(
19
23
w
z
B
z
w
Zatem potencjał spoczynkowy komórek V
w
jest mniej
ujemny (np. -90 mV) niż wynikałby z rożnicy stężeń dla
jonów K
+
(równania Nernsta).
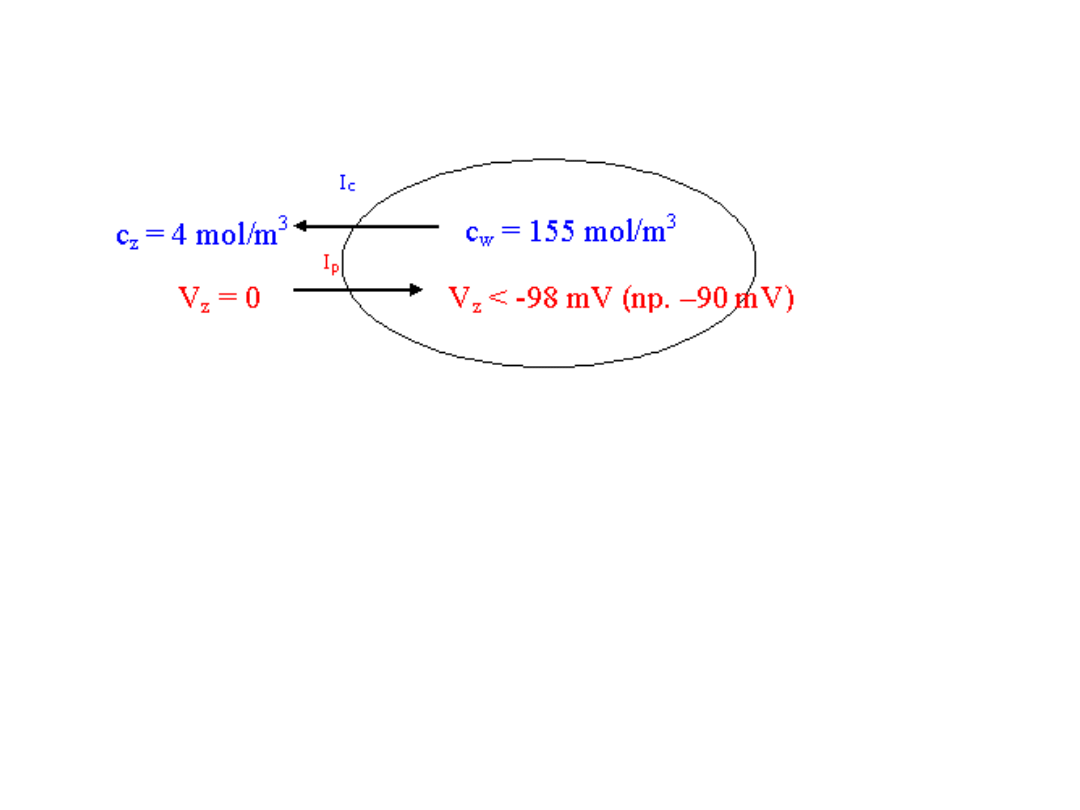
I
c
– strumień dyfuzyjny K
+
wynikający z różnicy stężeń
I
p
– strumień K
+
powodowany różnicą potencjałów
Czyli dla jonów K
+
musi być wiekszy strumień I
c
niż I
p
czyli I
c
> I
p
.
Czyli wypadkowy ruch jonów potasu jest z komórki
.
Dla podtrzymania istniejącej różnicy stężeń przy
istniejącej różnicy potencjałów musi istnieć
mechanizm
powodujący powrót jonów potasu do
komórki (transport aktywny).
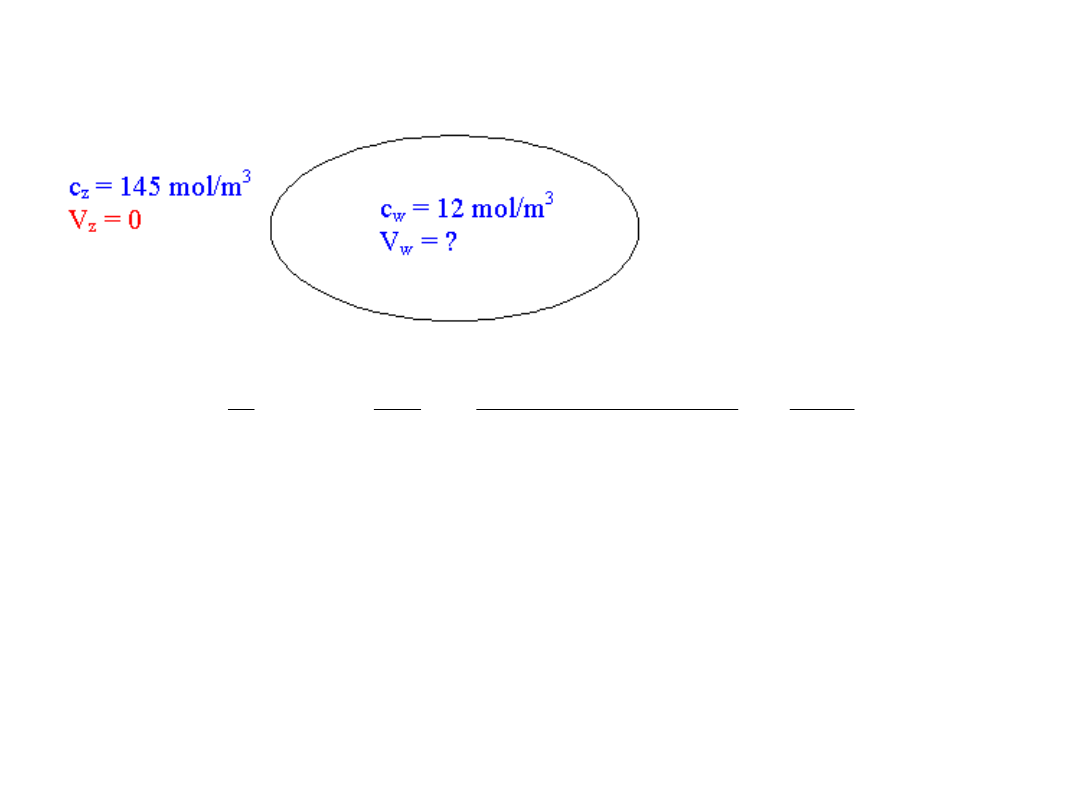
2. Jony sodu Na
+
- rownanie Nernsta
Zatem potencjał spoczynkowy komórek V
w
(np. -90 mV)
jest przeciwnego znaku niż wynikałby z różnicy stężeń
dla jonów Na
+
(równania Nernsta).
mV
66
)
12
145
ln(
10
6
.
1
310
10
38
.
1
)
c
c
ln(
T
k
q
1
)
V
V
(
19
23
w
z
B
z
w
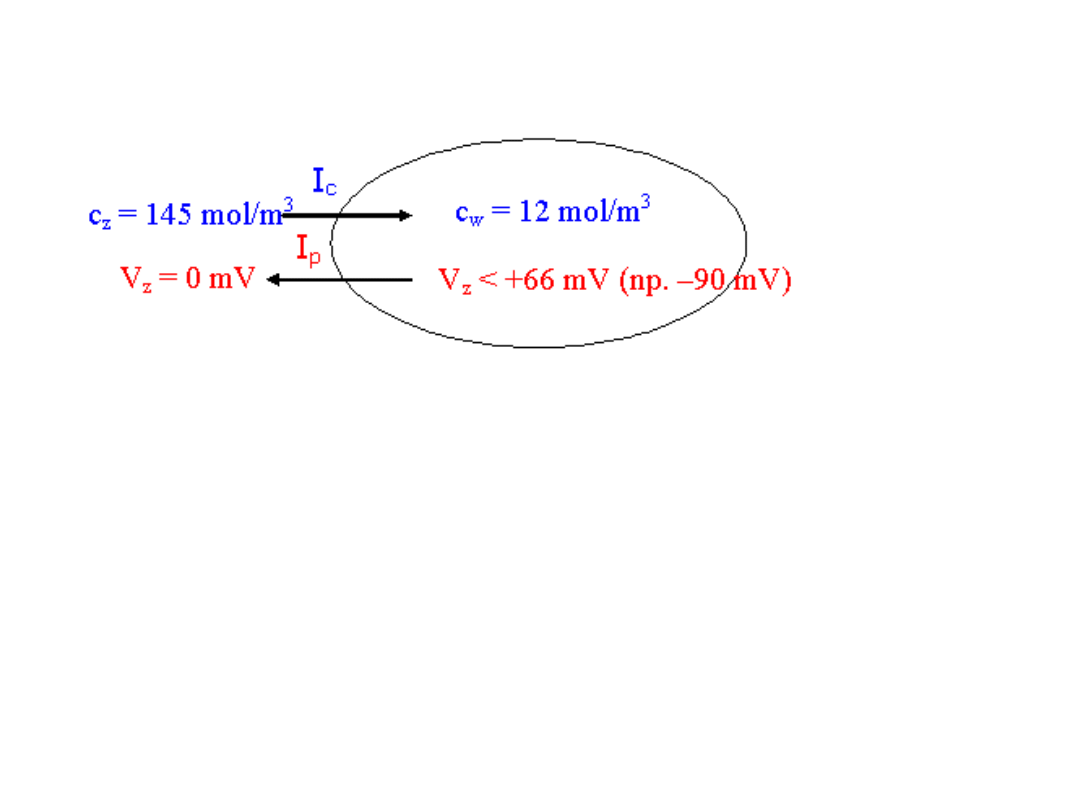
I
c
– strumień dyfuzyjny wynikający z różnicy stężeń
I
p
– strumień powodowany różnicą potencjałów
Czyli dla jonów Na
+
musi być wiekszy strumień I
p
niż I
c
czyli I
p
> I
c
.
Czyli wypadkowy ruch jonów sodu jest do komórki.
Dla
podtrzymania istniejącej różnicy stężeń przy istniejącej
różnicy potencjałów musi istnieć mechanizm
powodujący
wypychanie jonów sodu z komórki
(transport aktywny).
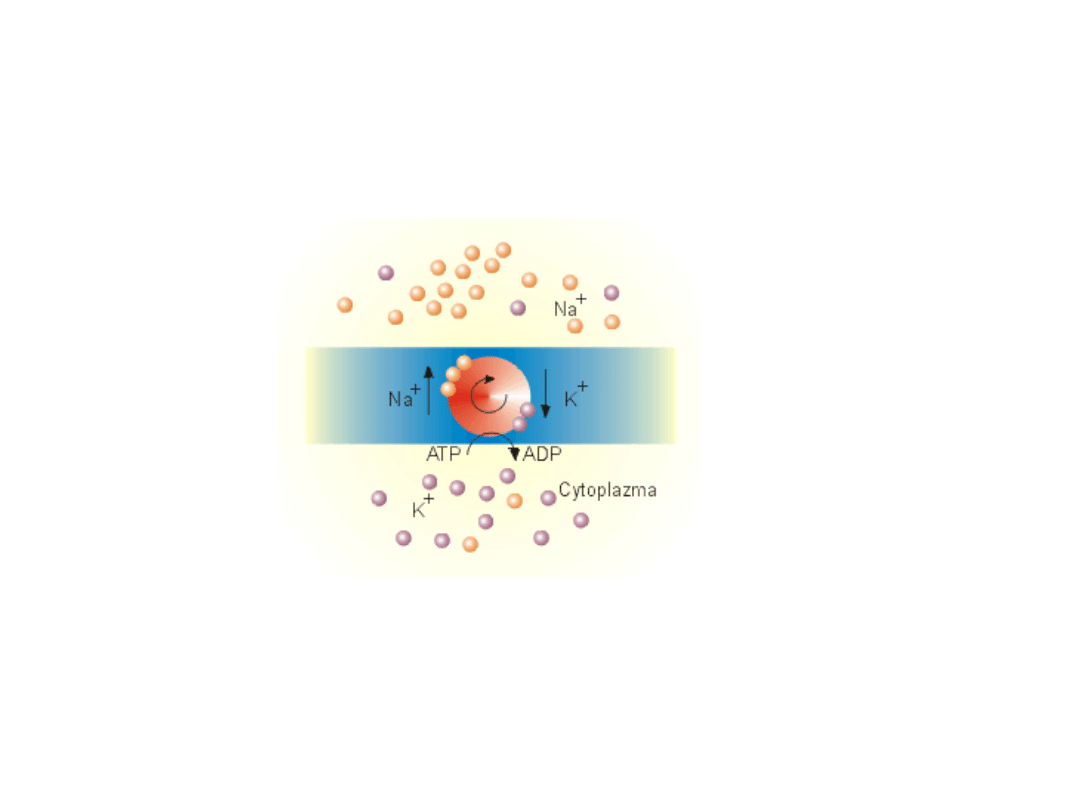
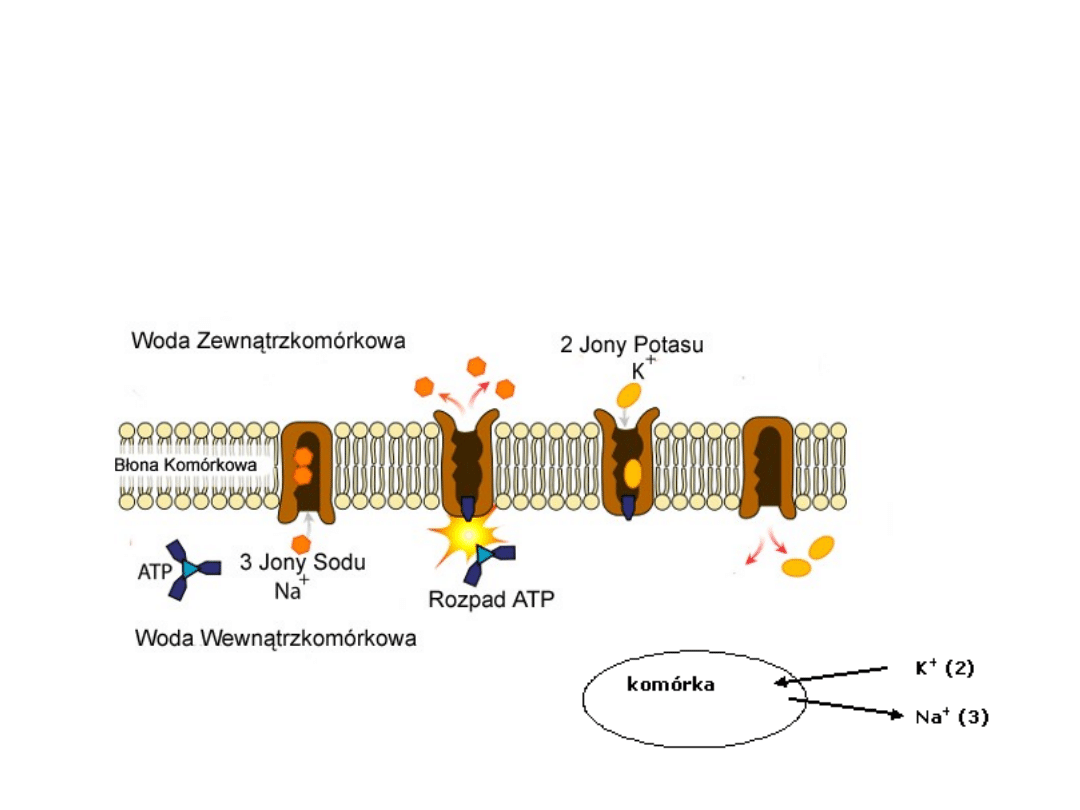
TRANSPORT AKTYWNY – POMPA SODOWO-POTASOWA
Pompa sodowo-potasowa. Transportuje ona bowiem jony
sodu z wnętrza komórki na zewnątrz, jednocześnie
przenosząc jony potasu w kierunku odwrotnym. Na jedną
rozłożoną przez tę pompę cząsteczkę ATP przypada
transport trzech jonów sodu i dwóch jonów potasu.
Transportem aktywnym nazywamy transport substancji
wymagający nakładu energii.
Źródłem energii bardzo
często jest hydroliza ATP
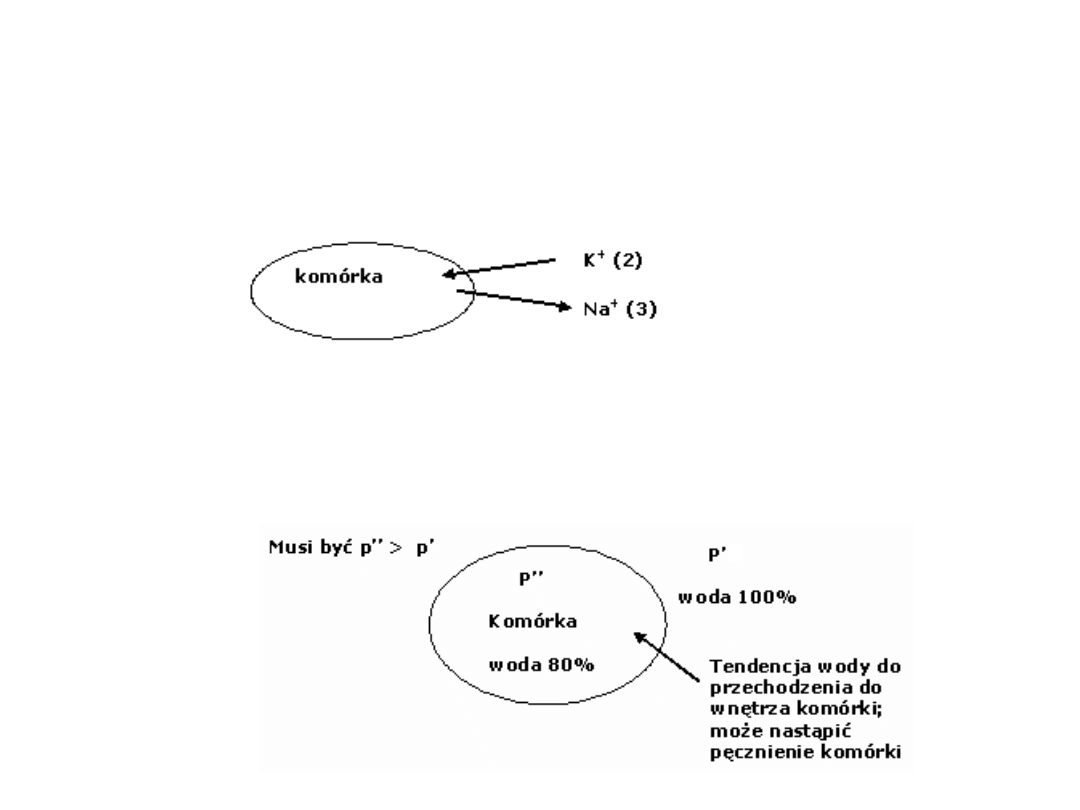
Rolą transportu aktywnego jest utrzymywanie różnicy stężeń
oraz utrzymywanie określonego potencjału spoczynkowego
1. Wyprowadza z komórki 3 jony Na+ i równocześnie
wprowadza do komórki 2 jony K+ czyli wytwarza niewielką
różnicę potencjałów (poprawka do równania Nernsta)
2. Podwyższa ciśnienie w komórce. Zatem ma wpływ na
wartość ciśnienia osmotycznego i reguluje objętość
komórki. Zablokowanie pompy prowadzi do pęcznienia
komórek i pękania błon.
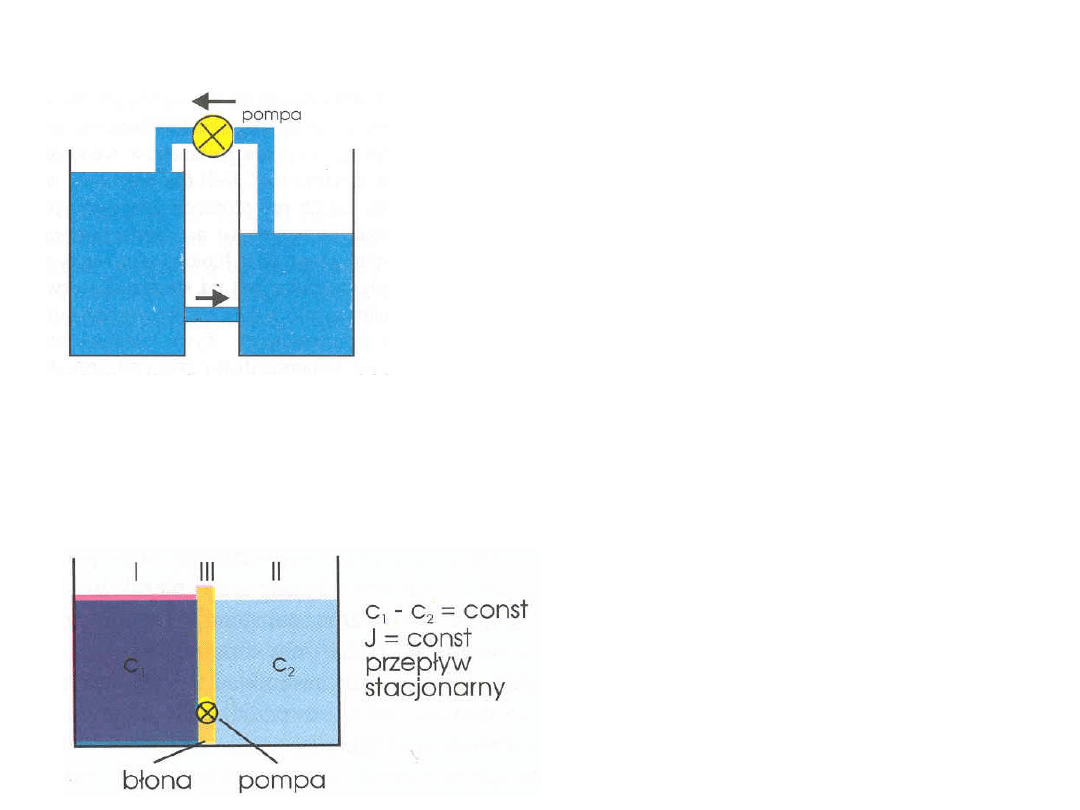
Analogia transportu aktywnego do działania pompy
Do utrzymania stałej różnicy poziomów
wody w dwóch naczyniach połączonych
rurką konieczne jest wprowadzenie
mechanizmu pompy. W odróżnieniu od
biernego zjawiska transportu wymaga to
nakładu energii i dlatego nazywa się
transportem aktywnym. Transport więc
musi być sprzężony energetycznie z
jakimś procesem dostarczającym energii.
Takim procesem dostarczającym energii
jest hydroliza ATP
Różnica stężeń w układzie trójprzedziałowym jest
utrzymywana dzięki aktywnemu transportowi
Dzięki aktywnemu
transportowi w komórce jest
utrzymywana stała różnica
stężeń. Skok stężenia
występuje pomiędzy
powierzchnią błony od strony
wewnętrznej (I) i wewnątrz
błony (III).
Pompa SODOWO-POTASOWA inna nazwa to NA+/K+ATP-
aza to ważny enzym uczestniczący w aktywnym
transporcie kationów sodu i potasu utrzymujący potencjał
błonowy. W 1997 roku Jens C. Skou za badania nad tą
cząsteczką otrzymał nagrodę nobla z chemii.
Hydroliza - rozpad cząsteczek pod wpływem kontaktu z wodą ATP -
(przenośnik energii) Jest siłą napędową tego enzymu potrzebną do
pompowania tego jonów sodu i potasu.
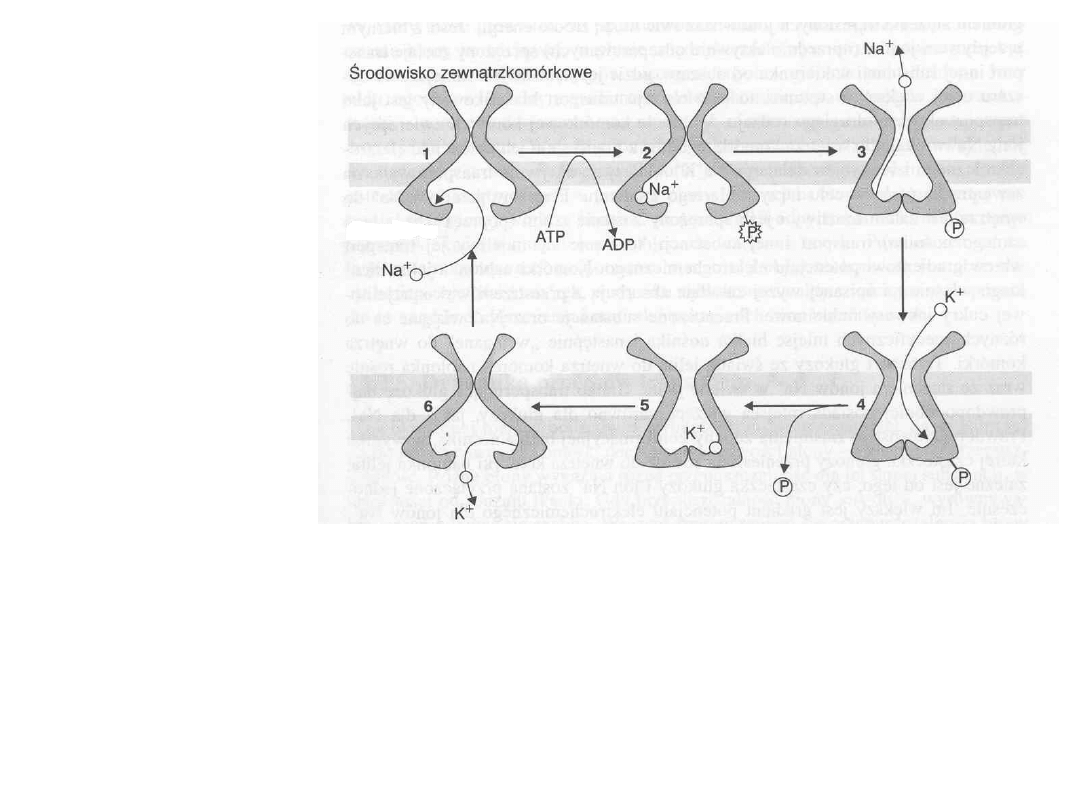
Na
+
K
+
ATPaza zmienia konformacje tak że jon NA+ zostaje
przeniesiony na zwnątrz komórki i tam uwolniony. Następnie
jon
K
+
przyłącza się do Na
+
K
+
ATPazy znajdującej się po zewnętrznej
części błony
. Towarzyszy temu odłączanie grupy fosforanowej
(defosforylacja).
Po przemianach konformacyjnych Na
+
K
+
ATPazy
jon K+ zostaje przeniesiony do wnętrza komórki i uwolniony.
Na
+
K
+
ATPaza przyjmuje pierwotny kształt
Cykl rozpoczyna się
od
przyłączenia do
fragmentu
Na+K+ATPazy,
znajdującego się
wewnątrz komórki,
trzech jonów Na+
oraz cząsteczki
ATP
, która ulega
rozpadowi na grupę
fosforanową HPO4-
2 która wiąże się z
Na+K+ATPazą
(fosforylacja)
i ADP
który
oddysocjowuje od
niej.
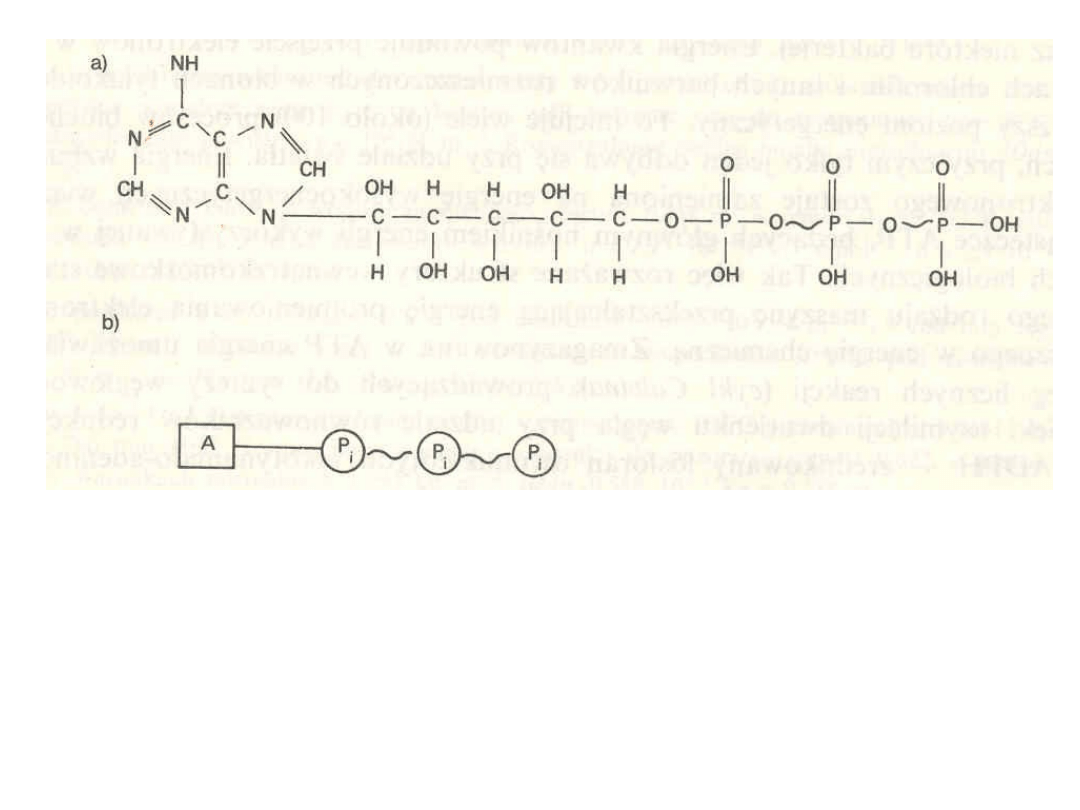
ATP: a) wzór strukturalny cząsteczki
b) model graficzny; znaku ~ używa się dla zaznaczenia
„wysokoenergetycznych wiązań” chemicznych, P
i
– oznacza resztę
kwasu fosforowego
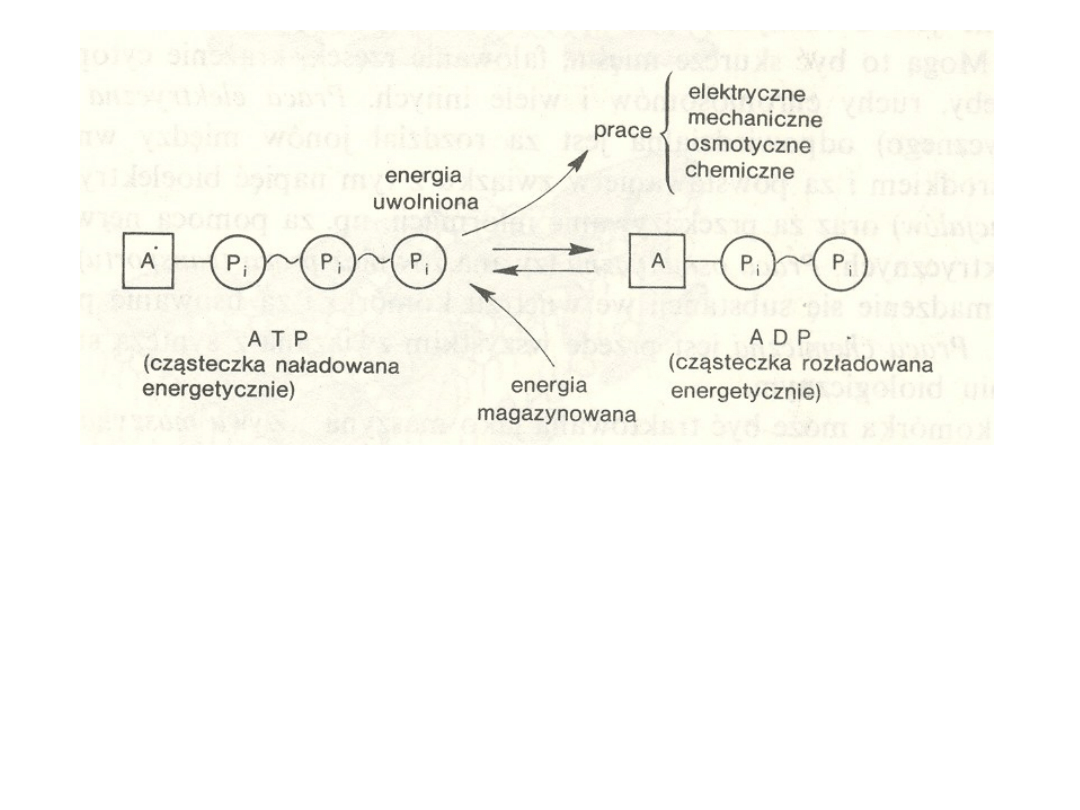
Schemat przemian energetycznych z udziałem ATP i ADP
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Zjawiska transportu, Studia, Fizyka, ćwiczenia
13 Zjawiska transportu (2)
ZJAWISKA TRANSPORTU, Szkoła, Fizyka 02
zjawiska transportu
Zjawiska transportu 2 id 590654 Nieznany
Zjawiska transportu, Studia, Fizyka, ćwiczenia
zjawiska transportu
Zjawisko dopplera, TRANSPORT PWR, STUDIA, SEMESTR II, FIZYKA, fizyka-wyklad, zagadnienia opracowane,
zjawiska powierzchniowe i transportu zadania
EŚT 07 Użytkowanie środków transportu
IK Transport a środowisko
Urządzenia transportu pionowego
EKONOMIKA TRANSPORTU IX
Ubezpieczenia związane z transportem drogowym
więcej podobnych podstron