
CHEMIA
studia dzienne
magisterskie
rok II
Politechnika Wrocławska
semestr letni
poniedziałek 10-12
egzamin

Wykład:
Wykład:
Chemia w
procesach
geologiczny
ch
JUWENILNY
DOPŁYW
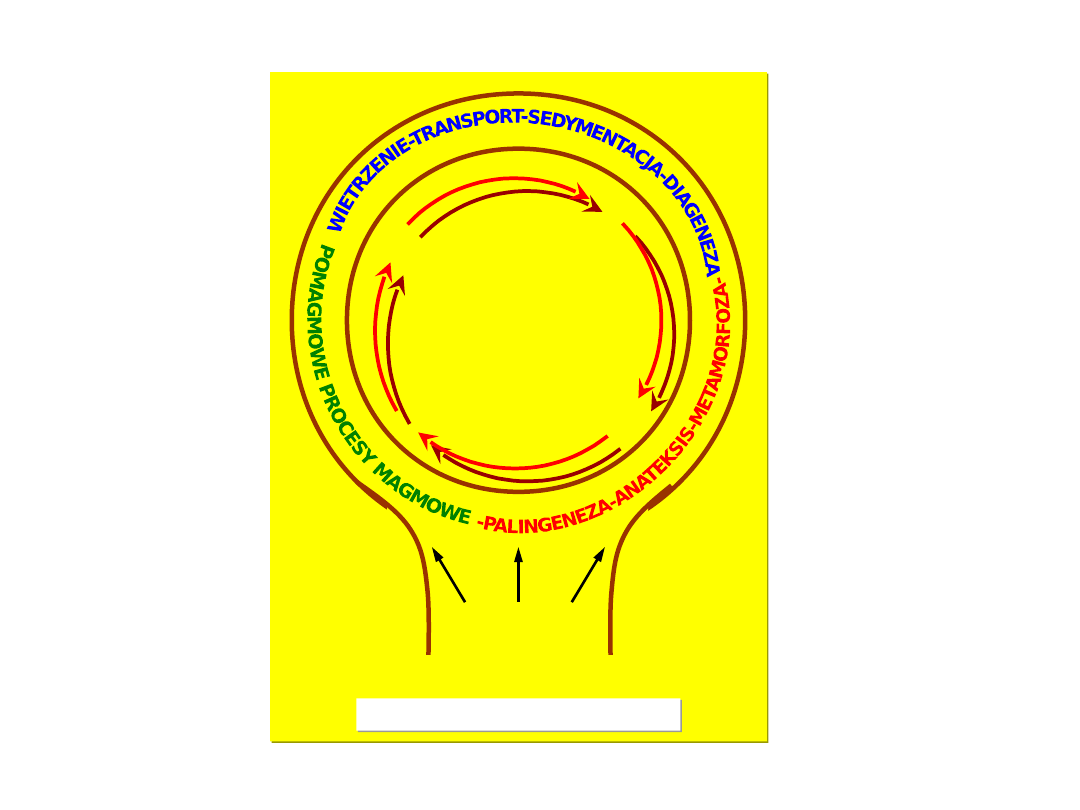
Cykl rozwojowy skorupy
ziemskiej
Cykl rozwojowy skorupy
ziemskiej
magma macierzysta
stop siarczkowy
magma bazaltowa
oliwin
piroksen
biotyt
hornblenda
anortyt
andezyn
bytownit
labrador
oligoklaz
albit
skalenie
szeregi Bowena
Pow
staw
anie skaleni w
w
yniku bardzo w
olnej rów
now
agow
ej krystalizacji m
agm
y
(Mg, Fe)
2
[SiO
4
] + SiO
2
= (Mg, Fe)
2
[Si
2
O
6
]
oliwin + SiO
2
= pirokseny( enstatyt-ferrosilit)
CaAl
2
Si
2
O
8
+ 4SiO
2
+ Na
2
O= 2 NaAlSi
3
O
8
+ CaO
anortyt + kwarc + Na
2
O = albit + CaO
magma macierzysta
stop siarczkowy
magma diorytowa
magma granodiorytowa
magma bazaltowa
oliwin
pirokseny
biotyt
hornblenda
anortyt
oligoklaz
kwarc + skalenie
plagioklazy
hornblenda
magma granitowa

Magma bazaltowa
skały bazaltowe
(zawierają plagioklazy zasadowe i
pirokseny oraz nieco hornblendy i
biotytu)
Szybka krystalizacja magmy
bazaltowej
Ca
Na
K
Mg
Fe
Gabro
Dioryt
Piroksenit
Perydotyt
Granit
Sjenit
Fajalit
Lujawryt
Ijalit
Granodioryt
SiO2
Th
Ba
Zr
Sr
Cl
Ti
Nb
Ta
Pt
Zr
P
Ni
Cr
Co
Ti
V
S
S
Cu
Li
Be
Ta
Y
Ti
P
Co
Ni
Nb
U
Au
Bi
Ag
As Pb
Sn
Zn
Hg
B W
Mg
Sb
Pb
Zn
Cu
As
F
Związek pierwiastków z typami skał
magmowych
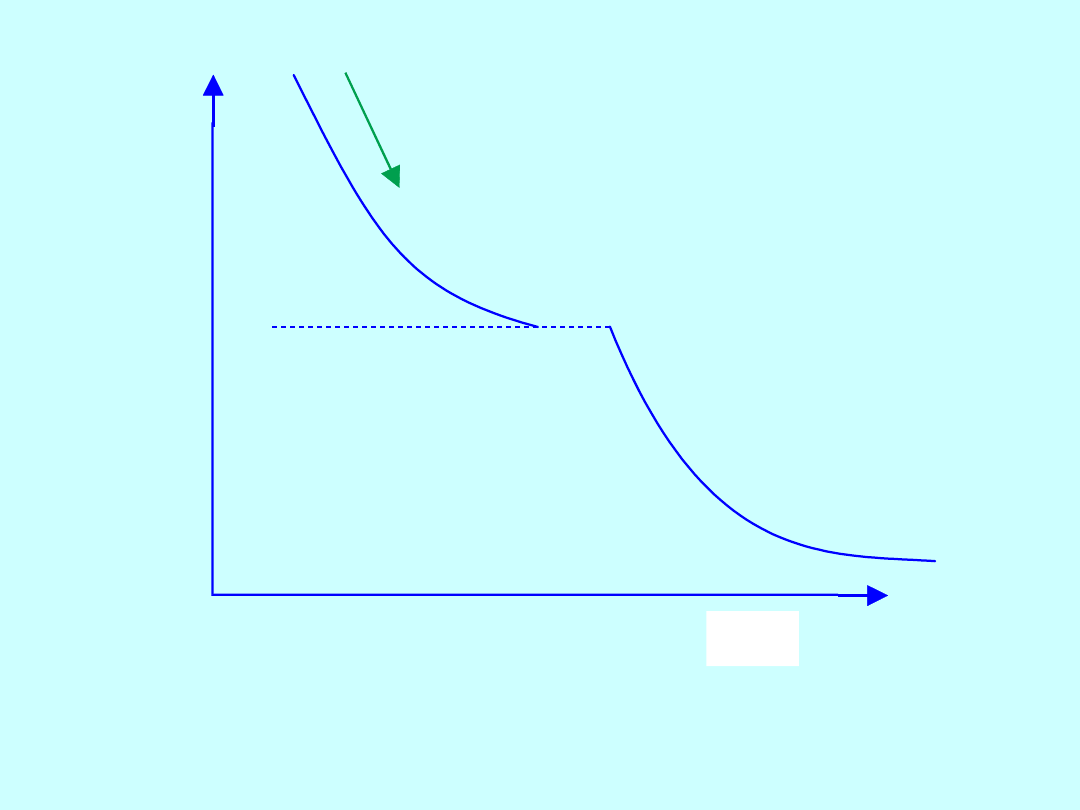
temperatura
krzepnięcia
T
czas
Krzywa krystalizacji stopu jednorodnego
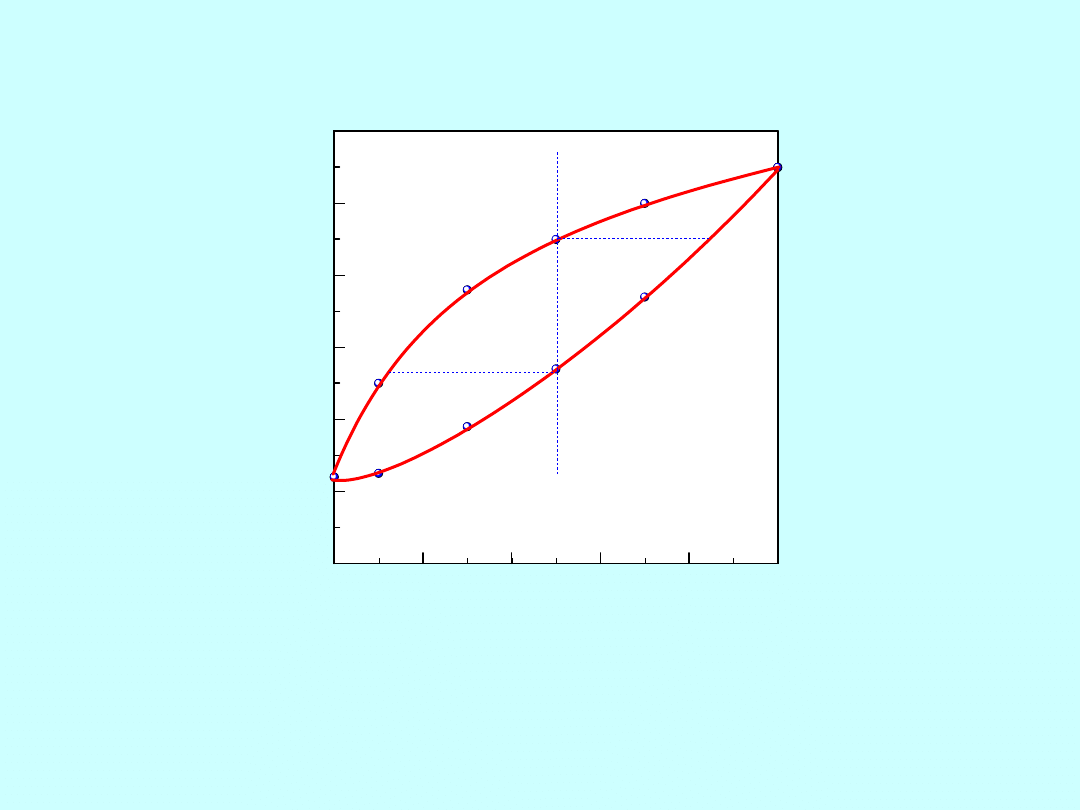
0
20
40
60
80
100
1000
1100
1200
1300
1400
1500
1600
ciecz (c)
c. stałe (s)
(c + s)
albit
anortyt
NaAlSi3O8
CaAl2Si2O8
A
B
C
D
Te
m
p
e
ra
tu
ra
, oC
skład , % wag.
Krystalizacja stopu dwuskładnikowego
albit-anortyt
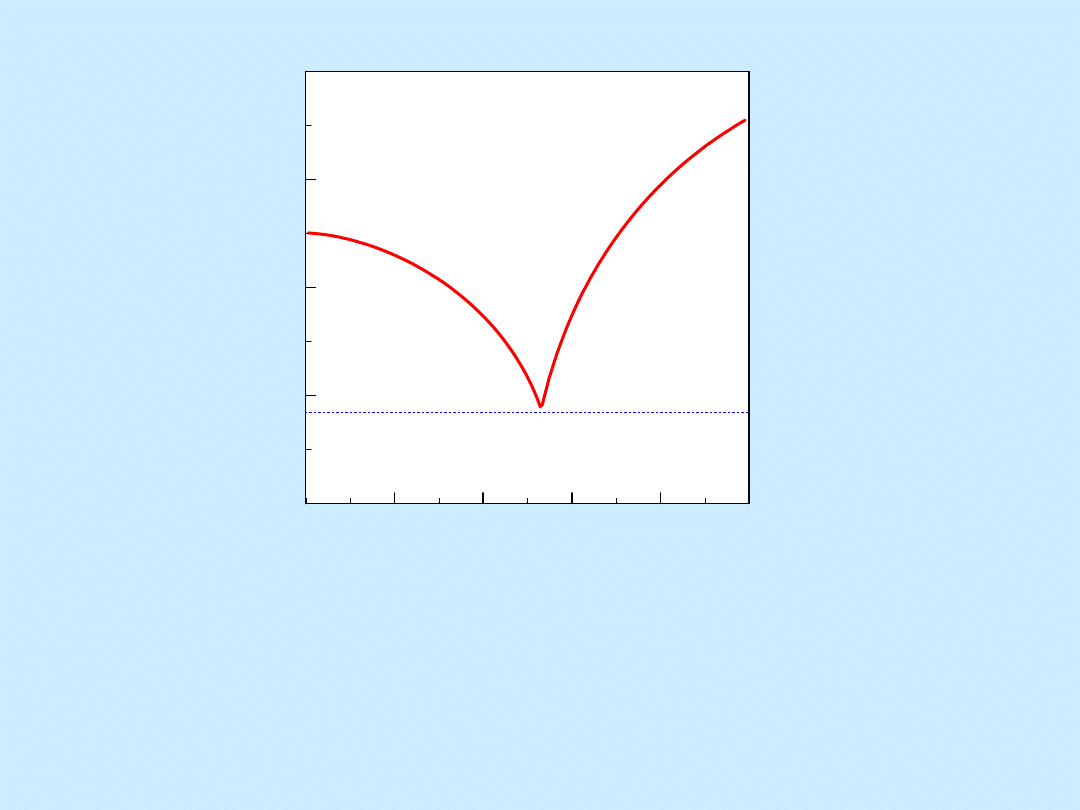
0
20
40
60
80
100
1200
1300
1400
1500
1600
ciecz (c)
c. stałe (d+a)
(c + d)
diopsyd
anortyt
CaMgSi2O6
CaAl2Si2O8
E
Te
m
p
e
ra
tu
ra
, oC
skład , % wag.
(c + a)
Krystalizacja stopu dwuskładnikowego anortyt-
diopsyd

80
80
80
% wag.
1713
o
60
60
60
40
40
40
20
20
20
NaAlSiO
4
krystobalit
KAlSiO4
SiO2
1750
o
1526
o
kalsilit
carnegieit
kwarc
szereg nefelinu
KAlSi3O8
KAlSi2O6
mikroklin
leucyt
NaAlSi3O8
albit
skalenie
alkaliczne
trydymit
nefeliny
r. stały
(K,Na)AlSiO
4
1615
o
1150
o
990o
1410
o
1068
o
1280
o
pospolite nefeliny
skałotwórcze
=
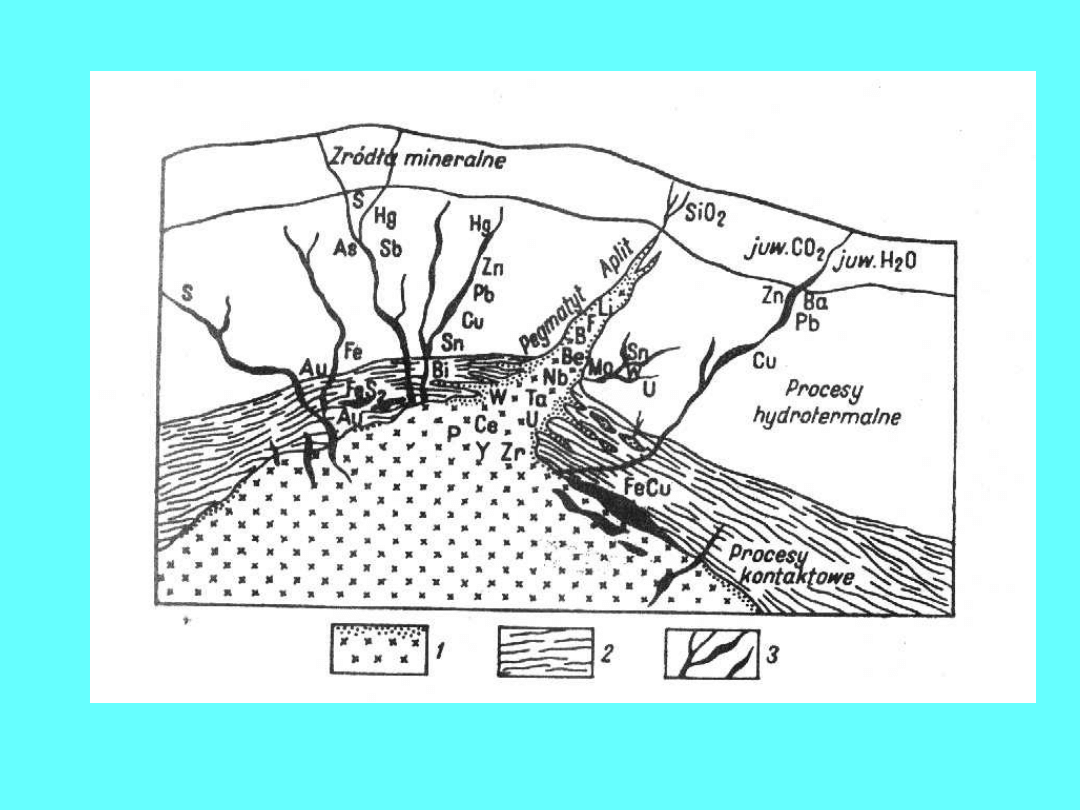

Procesy pomagmowe: wietrzenie, transport,
sedymentacja
Iloczyn rozpuszczalności:
CaCO
3
= Ca
2+
+ CO
3
2-
jest zdefiniowany jest jako:
K = [Ca
2+
] [CO
3
2-
] / [CaCO
3
]
L = K [CaCO
3
] = [Ca
2+
] [CO
3
2-
] L=5x10
-9
(20
o
C)
Związek
iloczyn rozpuszczalności (L)
CaF
2
(fluoryt) 4x10
-11
AgCl
(chlorargyryt)
1.8x10
-10
Cu
2
S
(chalkozyn)
7.2x10
-49
BaSO
4
(baryt) 9.8x10
-11
CaSO
4
(gips)
9.1x10
-6
CaCO
3
(kalcyt) 5x10
-9
MgCO
3
(magnezyt)
2x10
-8
Ca(OH)
2
4.68x10
-6
Wietrzenie:
rozpuszczanie
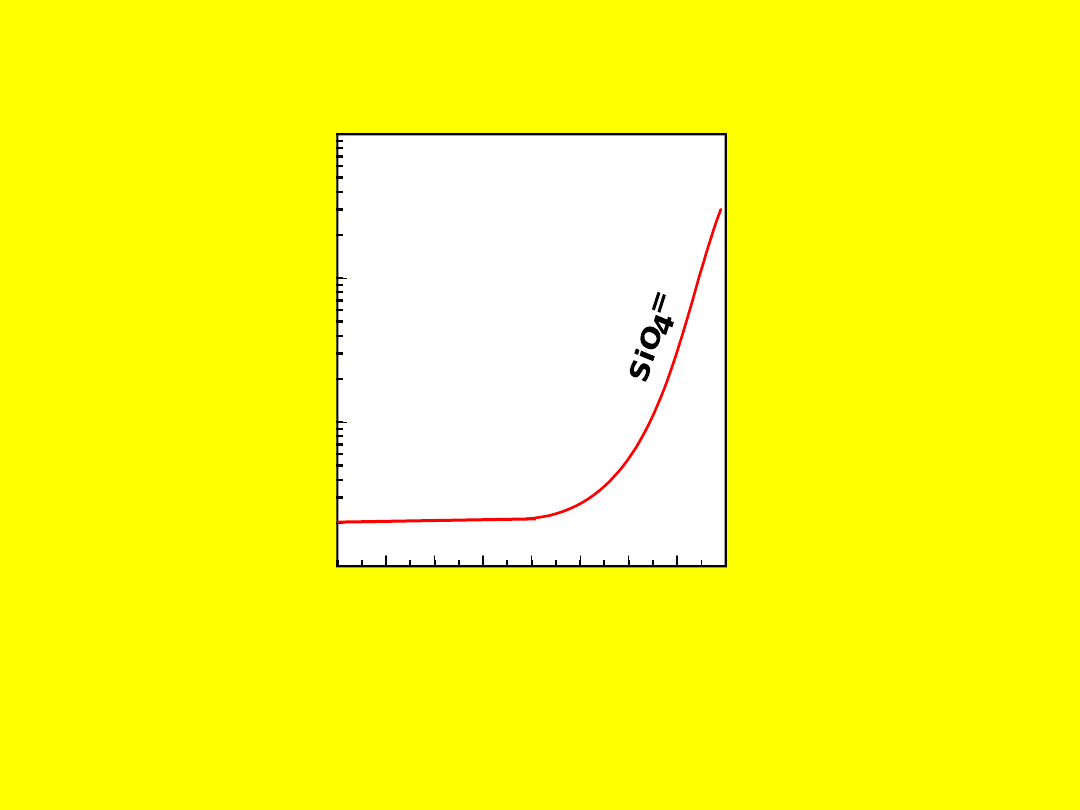
4
5
6
7
8
9
10 11 12
0.001
0.01
0.1
1
s
tę
ż
e
n
ie
,
m
o
l/
d
m
3
pH
H4SiO4
rozpuszczalność SiO
2 w wodzie w temp. 25
oC
SiO
2
(kwarc) + 2H
2
O = H
4
SiO
4
(kwas krzemowy)

Hydratacja jest procesem zmiany minerałów bezwodnych w uwodnione.
Proces ten może powodować przeobrażenia masy mineralnej, ale nie prowadzi do jej
destrukcji. Najlepszym przykładem jest uwadnianie się anhydrytu do gipsu:
CaSO
4
(anhydryt) + 2H
2
O CaSO
4
.
2H
2
O (gips)
Hydratacja towarzyszy innym procesom o czym będzie mowa później.

Hydroliza Proces taki prowadzi do rozkładu głównych składników skał
pierwotnych, tzn. glinokrzemianów na krzemionkę i wodorotlenek glinu. W klimacie
umiarkowanym przebiega ona tylko częściowo
6KAlSi
3
O
8
+ 4H
2
O 2KAl
3
Si
3
O
10
(OH)
2
+ 12SiO
2
+ 4K
+
+ 4OH
-
skaleń potasowy
illit(uproszczony)
2KAl
3
Si
3
O
10
(OH)
2
+ 5H
2
O 3Al
2
Si
2
O
5
(OH)
4
+ 2K
+
+ 2OH
-
illit(uproszczony)
kaolinit
W klimacie tropikalnym hydroliza skalenia może przebiegać całkowicie
prowadząc do powstania hydrargilitu:
4KAlSi
3
O
8
+ 8H
2
O 4Al(OH)
3
+ 12SiO
2
+ 4K
+
+ 4OH
-
skaleń potasowy
hydrargilit
Inny przykład:
3K[AlSi
3
O
8
] + H
2
O = KAl
2
(OH)
2
Si
3
O
10
+ 6SiO
2
+ K
2
O
skaleń potasowy (np. ortoklaz) + H
2
O = muskowit + 6SiO
2
+ K
2
O

Karbonatyzacja jest procesem wypierania z masy mineralnej anionów
krzemianowych przez CO
2
lub aniony węglanowe CO
3
2-
i HCO
3
-
(Polański, 1988).
Proces ten prowadzi np. do dolomityzacji pierwotnych skał krzemianowych:
Ca(Mg, Fe)[Si
2
O
6
] + 2H
2
O + 2CO
2
Ca(Mg, Fe)CO
3
+ 2H
2
SiO
3
.
Jak widać z tej reakcji procesowi karbonatyzacji towarzyszy często proces
hydrolizy. Innym przykładem współdziałania wody i dwutlenku węgla w procesie
wietrzenia jest przeobrażanie się siarczków miedzi w zasadowy węglan miedzi -
malachit Cu
2
[(CO
3
)(OH)
2
]. Procesowi karbonatyzacji może ulega np. serpentyn
tworząc talk i magnezyt (Borkowska, Smulikowski1973). Złoża tego typu
występują na Dolnym Śląsku.
Mg
6
[(OH)
8
Si
4
O
10
] + 3CO
2
Mg
3
[(OH)
2
Si
4
O
10
] + 3MgCO
3
+ 3H
2
O

Utlenianie (oksydacja) ma zasadnicze znaczenie dla procesów wietrzenia.
Prowadzi w szerokim zakresie do przeobrażania związków trudno
rozpuszczalnych w łatwo rozpuszczalne np. siarczki w siarczany, jony niżej
utlenione w jony wyżej utlenione. Oksydacja w połączeniu z procesem
rozpuszczania powoduje silną destrukcję i niszczenie skał pierwotnych.
Utlenianiu łatwo ulegają siarczki. Mechanizm ich utleniania jest skomplikowany,
ale można go, na przykładzie galeny sprowadzić do sumarycznej reakcji:
PbS + 2O
2
PbSO
4
galena anglezyt
Inny przykład utleniania to reakcja:
Fe
2
SiO
4
+ 0.5 O
2
+ 2 H
2
O Fe
2
O
3
+ H
4
SiO
4
fajalit
hematyt kwas krzemowy
Czerwone, brunatne i żółte barwy utlenionych złóż żelaza wynika z
obecności w nich związków, w których żelazo występuje na różnym stopniu
uwodnienia i utlenienia. Oprócz żelaza utlenianiu mogą ulegać jony: S
-2
S
6+
,
Mn
2+
Mn
4+
i
Cr
+3
Cr
6+
.

czapa żelazna
strefa pierwotna
strefa cementacyjna
strefa wietrzenia
siarczki pierwotne
strefa r
edukcj
i
strefa o
ksydacj
i
strefa karb
onatyzacji
strefa hyd
ratacji
strefa biosf
ery
wtórne siarczki
siarczany
węglany
wodorotlenki
Podział środowiska wietrzeniowego na strefy
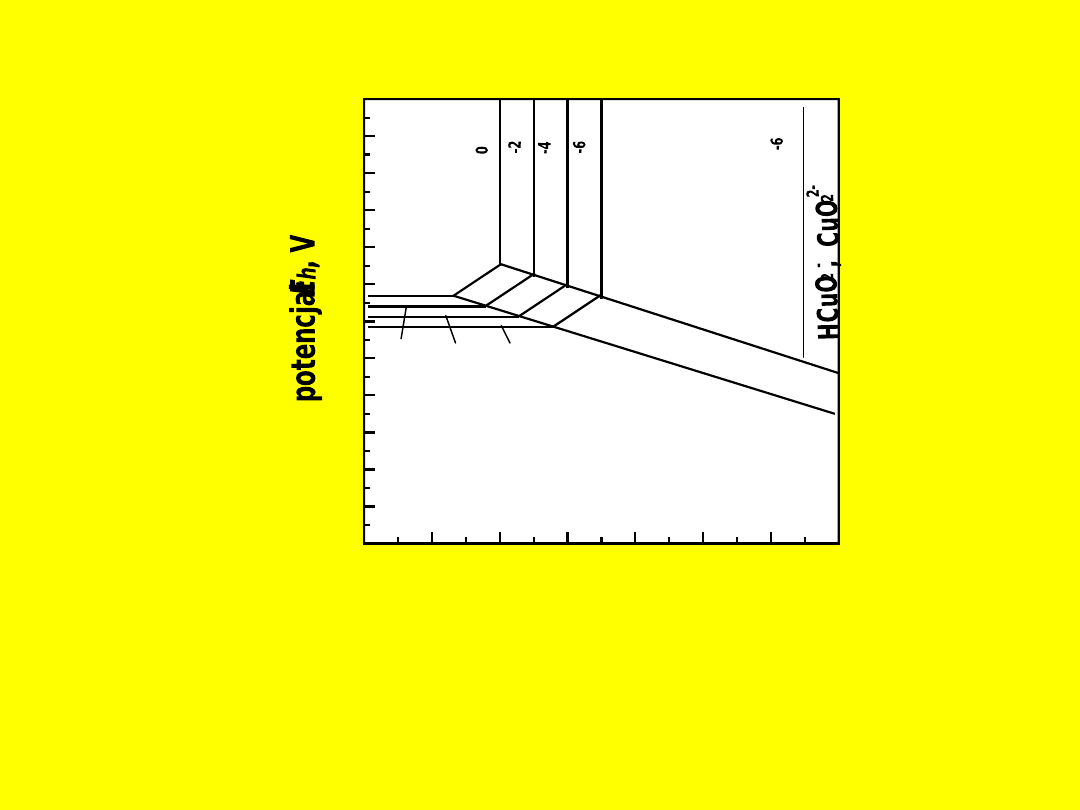
0
2
4
6
8
10
12
14
pH
-1
-0,8
-0,6
-0,4
-0,2
0
0,2
0,4
0,6
0,8
1
1,2
CuO
Cu
Cu
2
O
Cu
2+
10
0
10
-2
10
-4
10
-6
1
0
1
0
1
0
1
0
1
0
Rys. 12.47. Diagram
E
h
–pH dla układu Cu–H
2
O w tem
peraturze 25 °C (298 K).
Diagram
oparto na reakcjach: Cu
2
O +
H
2
O =
2CuO +
2H
+
+
2e (E =
0,747 – 0,0591 pH);
2Cu +
H
2
O =
Cu
2
O +
2H
+
+
2e (E =
0,471 – 0,0591 pH);
Cu =
Cu
2+
+
2e (E =
0,337 +
0,0295 lg
[Cu
2+
]);
Cu
2
O +
2H
+
=
2Cu
2+
+
H
2
O +
2e (E =
0,203 +
0,0591 pH +
0,0591 lg
[Cu
2+
]);
Cu
2+
+
H
2
O =
CuO +
2H
+
(pH =
3,44 – 0,5 lg
[Cu
2+
]) (Łętowski, 1975)

pH
7,8
p
H
=
7
8,0
7,0
HEMATYT
LIMONIT
TLENKI Mn
krzemiany Fe
kalcyt
fosfor
KALCYT
hematyt
limonit
tlenki Mn
krzemiany Fe
fosfor
krzemionka
duże zasolenie
GIPS
ANHYDRYT
HALIT
DOLOMIT
itd.
g
ra
n
ic
a
w
a
p
ie
n
ia
granica substancji organicznej Eh=0
+0,1
+0,0
-0,2
-0,3
Eh
(mV)
SUB. ORG.
FOSFORYT
PIRYT
KRZEMIONKA
rodochrozyt
kalcyt
min. uranu
siarczki met. cięż.
p
H
=
7
p
H
=
7
,8
KALCYT
SUB. ORG.
piryt
fosforyt
gips
anhydryt
halit
sub. org.
piryt
gips
anhydryt
halit
sub. org.
dolomit
gips
anhydryt
halit
dolomit
sub. org.
KRZEMIANY Fe
SYDERYT
GLAUKONIT
RODOCHROZYT
SUB. ORG., SiO2
fosforyt, kalcyt
min. uranu
kalcyt
sub. org.
syderyt
fosforyt
glaukonit
kalcyt
hematyt
limonit
tlenki Mn
glaukonit
Wpływ pH i Eh na skład mineralny osadów
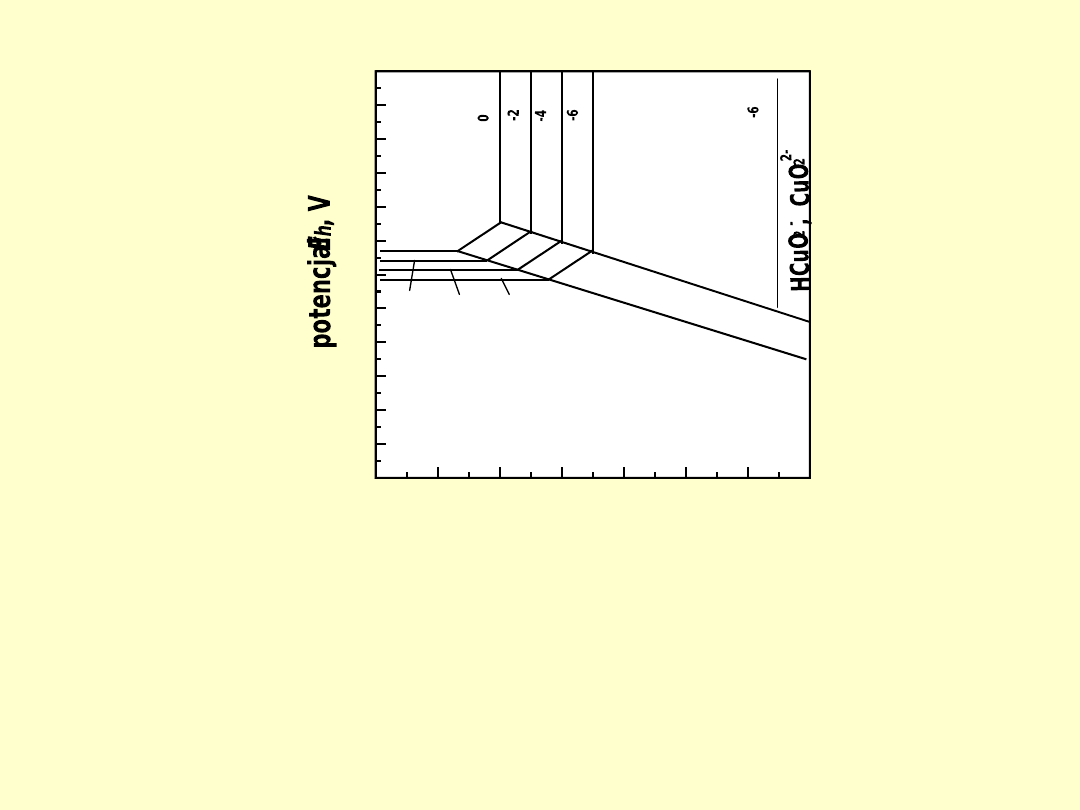
0
2
4
6
8
10
12
14
pH
-1
-0,8
-0,6
-0,4
-0,2
0
0,2
0,4
0,6
0,8
1
1,2
CuO
Cu
Cu
2
O
Cu
2+
10
0
10
-2
10
-4
10
-6
1
0
1
0
1
0
1
0
1
0
Diagram
E
h
–pH dla układu Cu–H
2
O w tem
peraturze 25 °C (298 K).
Diagram oparto na reakcjach: Cu
2
O +
H
2
O =
2CuO +
2H
+
+
2e (E =
0,747 – 0,0591 pH);
2Cu +
H
2
O =
Cu
2
O +
2H
+
+
2e (E =
0,471 – 0,0591 pH);
Cu =
Cu
2+
+
2e (E =
0,337 +
0,0295 lg
[Cu
2+
]);
Cu
2
O +
2H
+
=
2Cu
2+
+
H
2
O +
2e (E =
0,203 +
0,0591 pH +
0,0591 lg
[Cu
2+
]);
Cu
2+
+
H
2
O =
CuO +
2H
+
(pH =
3,44 – 0,5 lg
[Cu
2+
]) (Łętowski, 1975)

DIAGENEZA
Pierwotnie strącony w morskim osadzie węglan wapnia wskutek
długotrwałego oddziaływania zawartych w wodzie morskiej jonów magnezu ulega
reakcji następczej:
2CaCO
3
+ Mg
+2
CaMg(CO
3
)
2
+ Ca
2+
.
Zjawisko to często prowadzi do całkowitej dolomityzacji osadu.
Oddziaływania jonów żelaza zawartych w wodzie morskiej na świeżo strącony
siarczek miedzi może dojść do powstania siarczku mieszanego -chalkopirytu:
2CuS + Fe
+2
CuFeS
2
+
Cu
2+
Strącone siarczki cynku, ołowiu i miedzi w osadzie mogą ulec przejściu wyłącznie w
siarczek miedzi, którego jony dyfundując z wyższych warstw roztworu oddziaływają
na osad:
ZnS + Cu
+2
CuS + Zn
2+
PbS + Cu
2+
CuS + Pb
2+
.
Zmiana warunków fizykochemicznych w osadzie zachodzić może w wyniku reakcji
biochemicznych.
Syderytyzacja osadu tzn. wypieranie z węglanu wapnia jonów Ca
2+
przez jony Fe
2+
i
powstanie syderytu:
Fosfatyzacja osadu tzn. wypieranie węglanów przez fosforyty
Sylifikacja osadu tzn. wypieranie węglanów przez krzemionkę
Pirytyzacja osadu .....

Metamorfoza
: najważniejszą rolę odgrywają temperatura i ciśnienie.
W tym warunkach skały węglanowe reagują z krzemionka i zachodzi reakcja:
CaMg(CO
3
)
2
+ 2SiO
2
CaMgSi
2
O
6
+ 2CO
2
dolomit
kwarc diopsyd
dwutlenek węgla
Ciśnienie wynika z ciężaru nadkładu.
Podwyższone ciśnienie prowadzi do tworzenia minerałów o większej gęstości.
(reguła przekory LeChaterliera-Brauna)
2CaSiO
3
+ Ca(Al
2
Si
2
O
8
) Ca
3
Al
2
(SiO
4
)
3
+ SiO
2
wolastonit anortyt
granat
kwarc
Objętość molowa lewej strony równania wynosi 180,1 a dla prawej zaś 150.5.
Document Outline
- PowerPoint Presentation
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
Proces pielęgnowania wykład 3 ppt
2 Charakterystyka wychowania jako procesu pedagogicznegoid 19780 ppt
1 Infrastruktura, technika i technologia procesów logistyczid 8534 ppt
2 2 indentyfikacja wplywu logistyki na procesy gospodarczeid 20042 ppt
Logistyka procesów zakupu i dystrybucji ppt
Wsparcie jako element procesu pielęgnowania wykład ppt
Chemiczne podstawy procesów geologicznych
18 Logistyka zaopatrzenia Analiza zapasów i procesów magazid 17872 ppt
21 prezentacja Komunikacja w procesie umieraniaid 29108 ppt
02 01 2011 Projektowanie Procesow w VTECid 3497 ppt
PROCESY BIOTRANSFORMACJI TRUCIZN ppt
11 Procesy i przemianyid 12239 ppt
Proces rozwoju grupy ppt
PROCESY GEOLOGICZNE
Procesy geologiczne i klamatyczne w przeszłości i ich wpływ na współczesne życie na ziemix
Geografia Geologia Procesy geologiczne zachodzące wewnątrz Ziemi
14 Logistyka zaopatrzenia Organizacja procesów magazynowycid 15668 ppt
więcej podobnych podstron