
Podstawy korozji
1 Definicja
2 Wprowadzenie
3 Formy korozji
4 Metody ochrony przed
korozją
5 Monitorowanie korozji

Definicja
Korozja - niszczenie metali, będące wynikiem
ich oddziaływania ze środowiskiem.

Czasami określenie korozja stosuje się w
odniesieniu do niszczenia tworzyw
sztucznych, betonu lub drewna, chociaż
przyjmuje się że w tym przypadku lepszym
określeniem jest degradacja.

Wprowadzenie
Korozja jest zjawiskiem naturalnym
Całkowite jej zahamowanie jest bardzo
trudne i nie zawsze celowe
Są duże problemy z tworzywami
sztucznymi wolno korodującymi
Procesy korozyjne są często pożyteczne
– trawienie metali, baterie, warstwy
pasywne

Przykłady zaatakowań
korozyjnych

Przykłady zaatakowań
korozyjnych

Czynniki wpływające na
korozję
Wewnętrzne
Rodzaj metalu
Skład chemiczny
Struktura
Stan powierzchni
Obróbka cieplna
Obróbka
mechaniczna
Naprężenia własne
Zewnętrzne
Rodzaj środowiska
Skład środowiska
Temperatura
Prędkość
przepływu
Ciśnienie
atmosferyczne
Polaryzacja
zewnętrzna

Rodzaje korozji
Zależnie od mechanizmu
elektrochemiczna i
chemiczna
Zależnie od środowiska
korozja wodna
korozja atmosferyczna
korozja wysokotemperaturowa

Mechanizm korozji
elektrochemicznej
Na powierzchni metalu można
zlokalizować miejsca mające charakter
anod
i
katod
Na anodach zachodzi proces utleniania:
Fe Fe
+2
+ 2e
Na katodach zachodzi proces redukcji:
1/2 O
2
+ H
2
O + 2e = 2 OH
-
2H
+
+ 2e = H
2

Rodzaje ogniw korozyjnych
Różne materiały
Różne stężenia
Różne
napowietrzenie
Zróżnicowane
naprężenia
Materiał skorodowany –
materiał
nieskorodowany
Zróżnicowane
temperatury
Stężenie tlenu
Anoda –
niskie
stężenie
tlenu
Katoda –
wysokie
stężenie tlenu
Metal
Woda
Powietrz
e
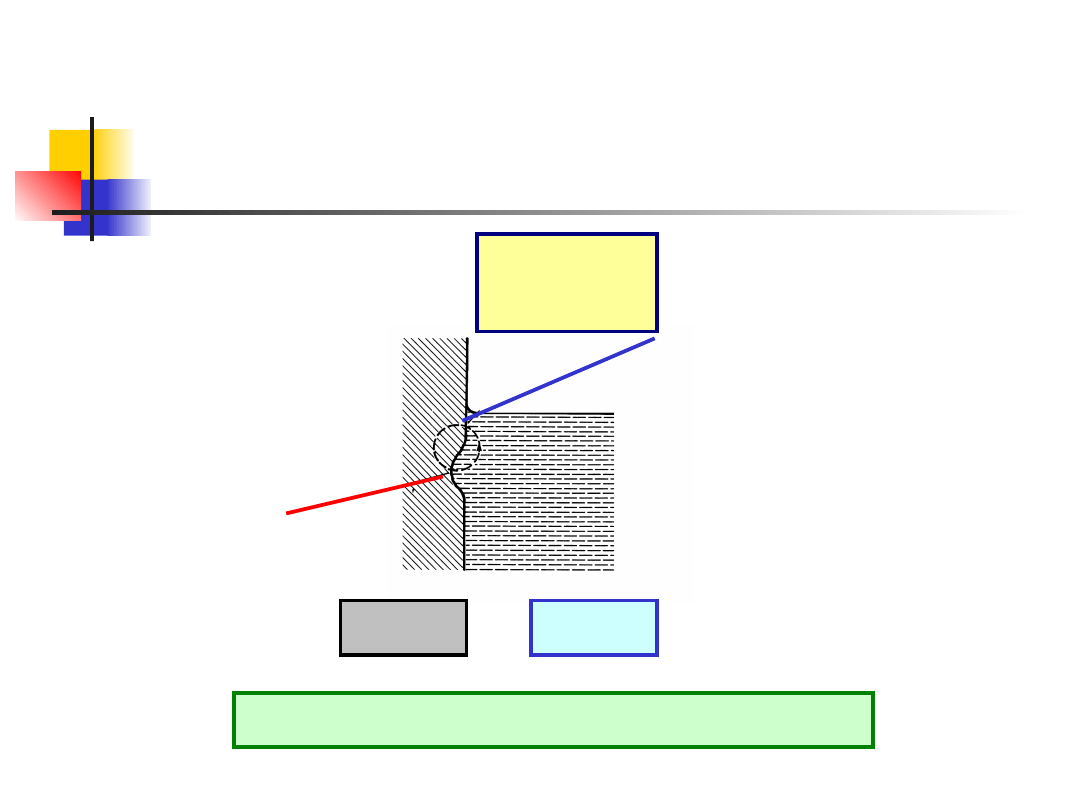
Korozja na linii wodnej

Formy korozji
Osiem postaci korozji
Korozja ogólna
Korozja galwaniczna
Korozja wżerowa
Korozja szczelinowa
Korozja międzykrystaliczna
Korozja selektywna
Erozja – korozja
Korozja naprężeniowa
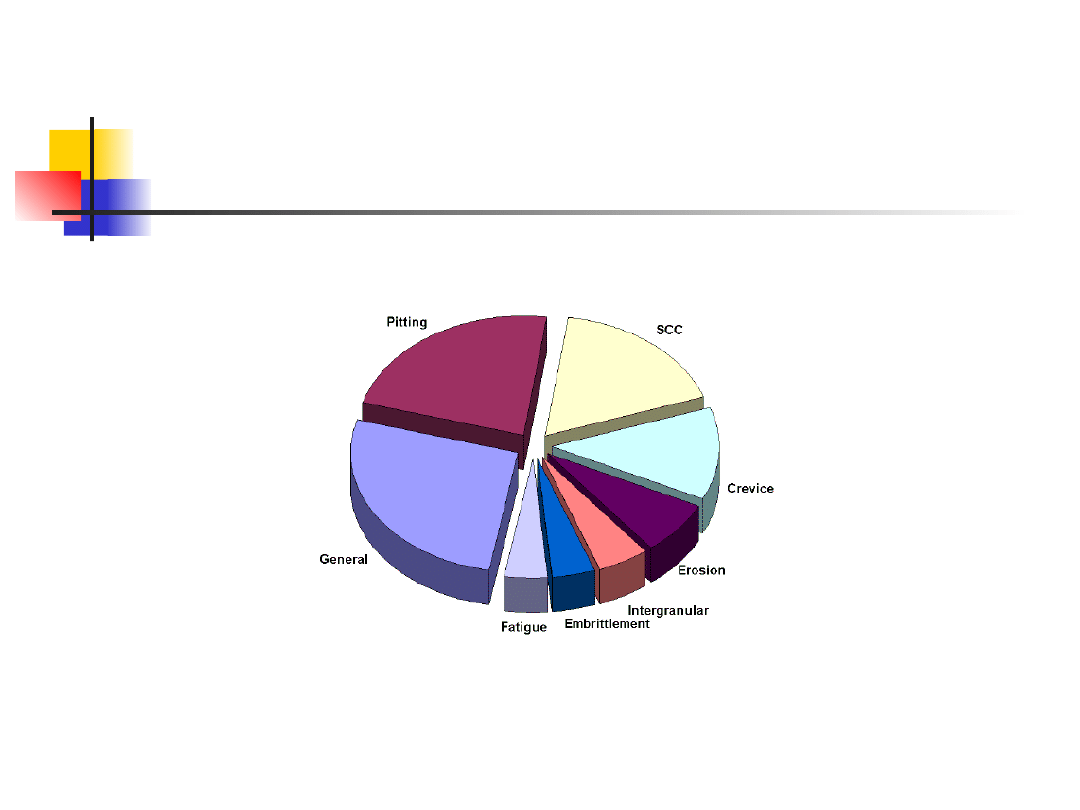
Formy korozji

Formy korozji - ogólna
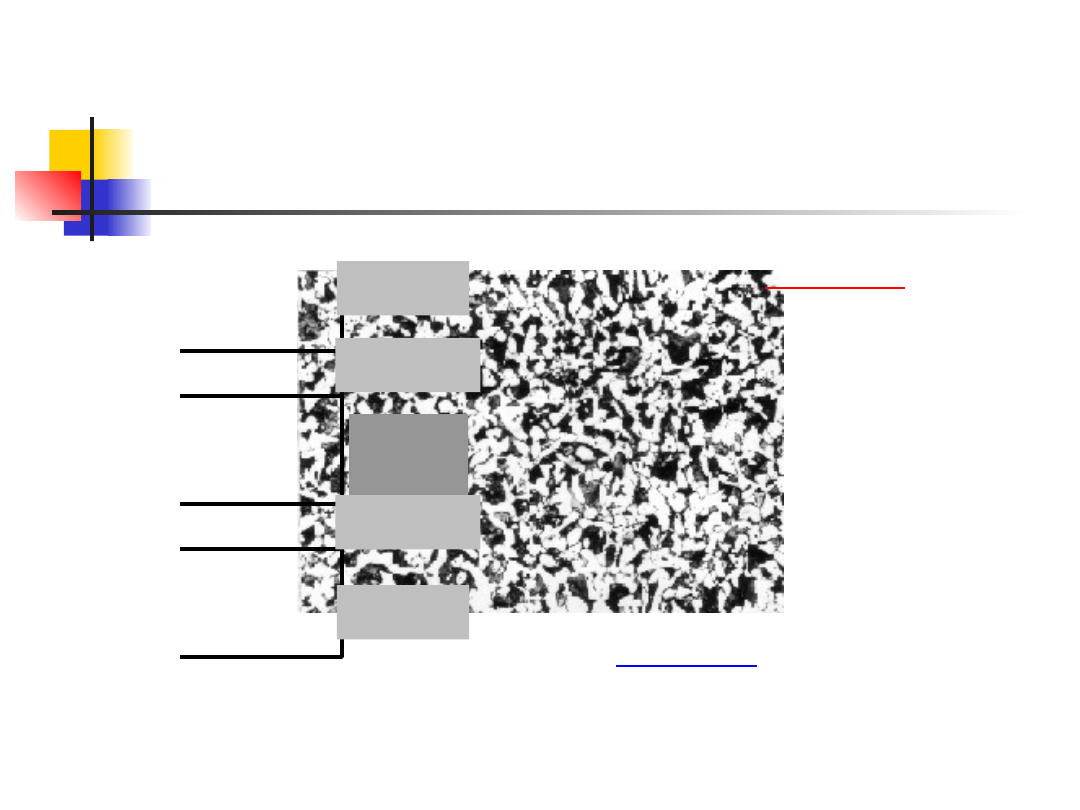
Korozja ogólna –
też ogniwa galwaniczne
Fe
3
C
Fe
3
C
anoda
katoda
anod
a
katoda
anoda
Anoda:
Fe Fe
2+
+ 2e
-
Katoda:
O
2
+ H
2
O + 4e
-
4(OH)
-
Fe
2+
+ 2(OH)
-
Fe(OH)
2

Szereg napięciowy metali
Uszeregowanie metali w zależności od
wartości ich potencjałów korozyjnych
względem elektrody wodorowej (NEW)
Wskazuje na tendencję do korozji
Metale o potencjałach wyższych od NEW
– metale szlachetne
Metale o potencjałach niższych od NEW –
metale nieszlachetne
Formy korozji -
galwaniczna
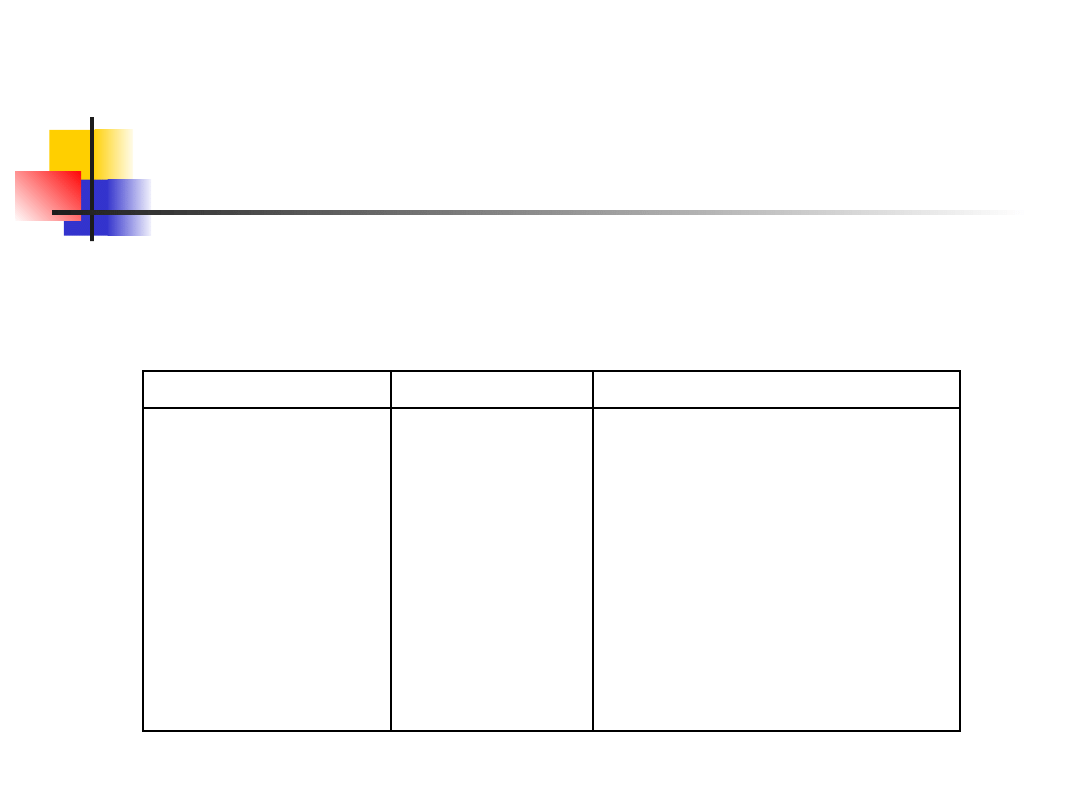
Tablica 1. Praktyczny szereg napięciowy
wybranych metali w 3 % NaCl
Metal
Symbol
Potencjał względem NEW
Platyna
Tytan
Srebro
Miedź
Nikiel
Ołów
Żelazo
Glin
Cynk
Pt
Ti
Ag
Cu
Ni
Pb
Fe
Al.
Zn
+ 0,47 V
+ 0,37 V
+ 0,30 V
+ 0,04 V
- 0,03 V
- 0,27 V
- 0,40 V
- 0,53 V
- 0,76 V
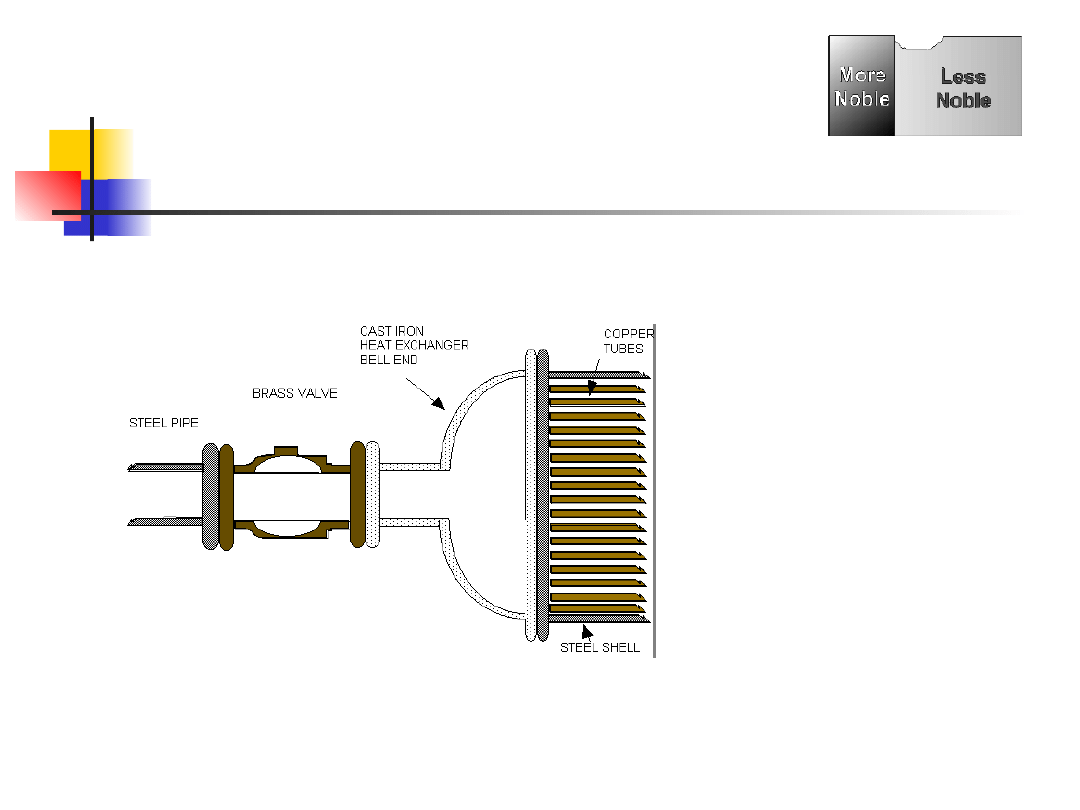
Formy korozji -
galwaniczna
Formy korozji
Korozja wżerowa
Korozja wżerowa jest jedną z postaci
korozji lokalnej. Charakteryzuje się tym, że
atak zlokalizowany jest na niewielkich,
dyskretnych miejscach na powierzchni
metalu. Korozja wżerowa ma miejsce
głównie w obojętnych i kwaśnych
roztworach zawierających
chlorki lub inne
halogenki.
Miejscami inicjacji korozji
wżerowej mogą być wtrącenia
niemetaliczne, mikroszczeliny powstające
podczas obróbki mechanicznej.

Korozja wżerowa
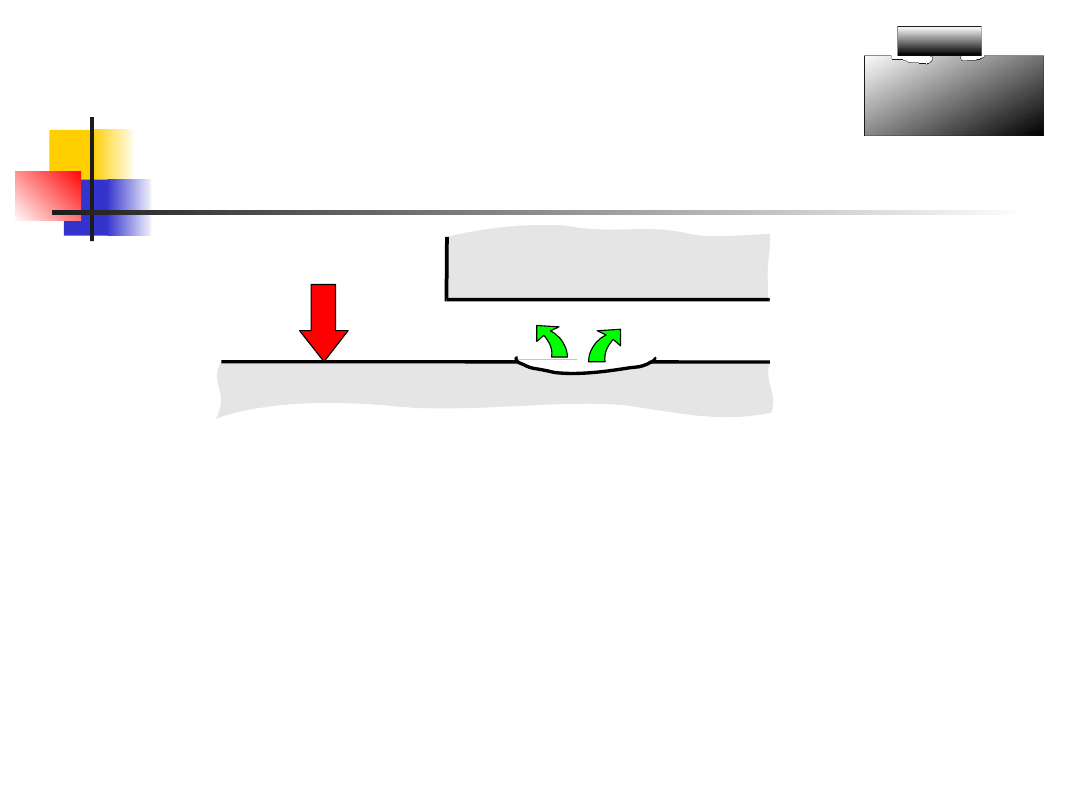
Formy korozji -
szczelinowa
Metal
O
2
Fe
3+
Metal
Fe
3+
Podobna do korozji wżerowej
Niskie [O] – obszar anodowy
Wysokie [O] – obszar katodowy
Najczęściej występuje przy połączeniach
śrubowych i kołnierzowych, pod osadami,
kurzem itp.

Formy korozji -
szczelinowa
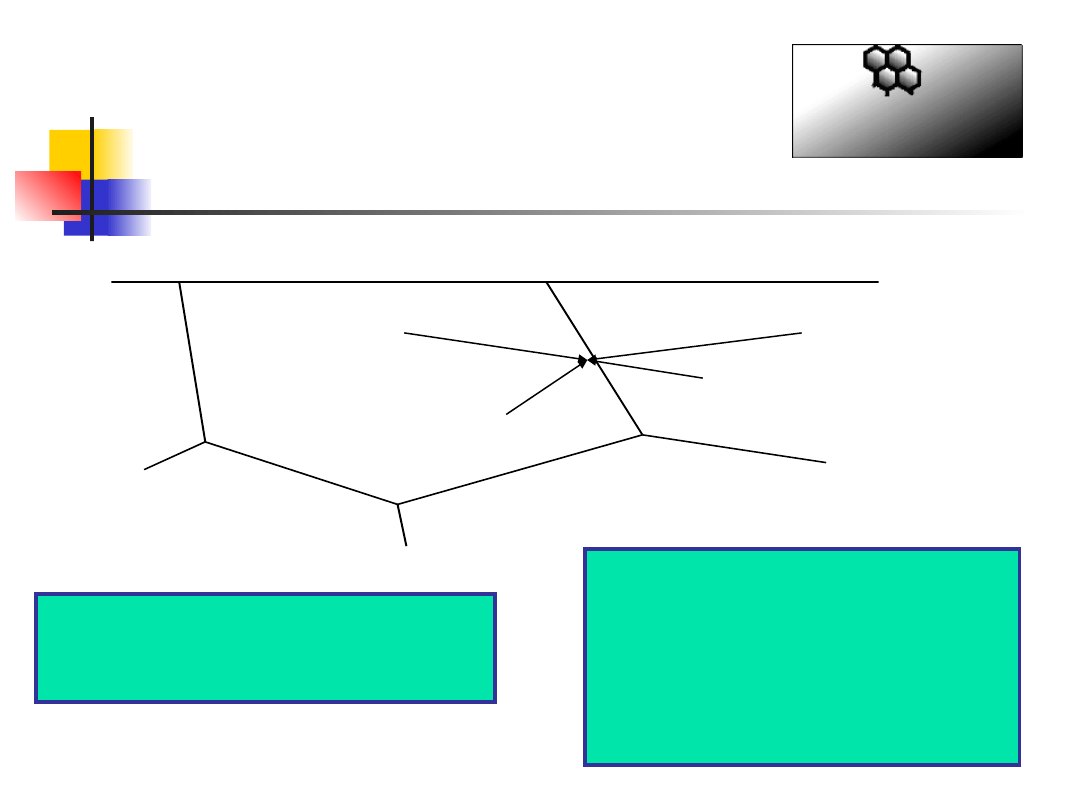
Formy korozji -
korozja
międzykrystaliczna
C
C
C
C
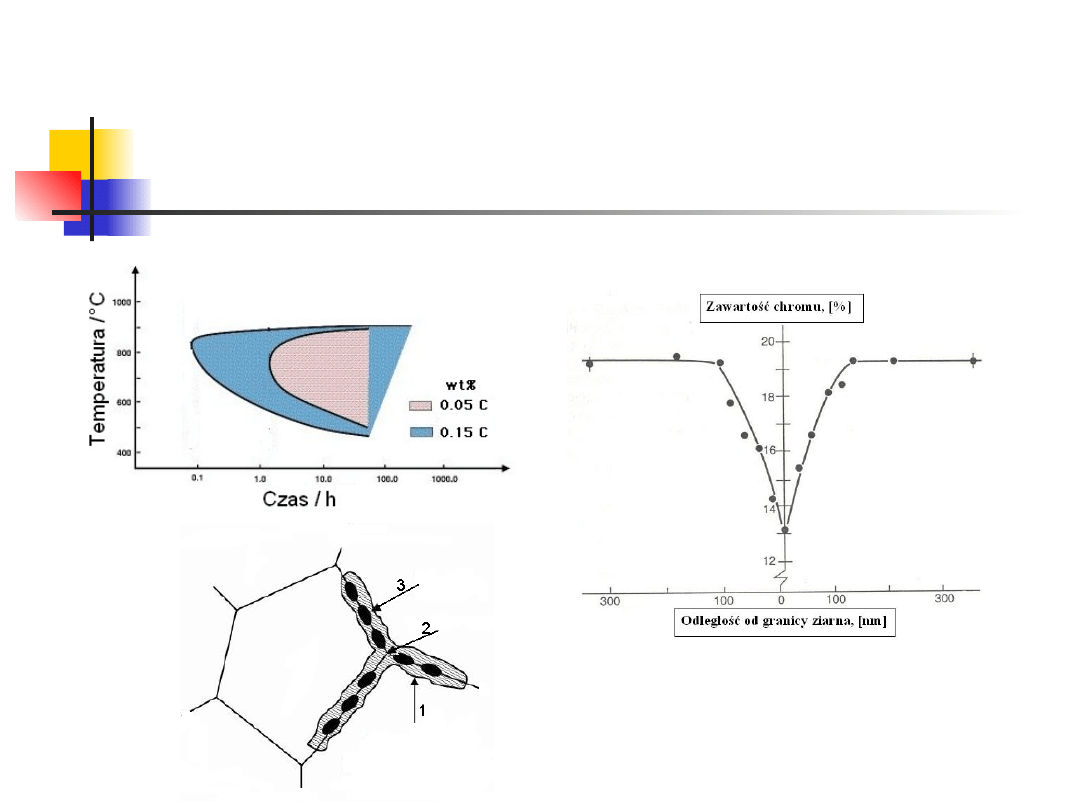
Gdy stal stopową ogrzewa się do
temperatury ok.650
o
C, tworzą się
węgliki Cr przy granicach ziaren
Jeżeli stężenie chromu na
granicy ziaren spadnie
wystarczająco (poniżej ok.
9%), nie wystąpi w tym
miejscu pasywacja, i
występować będzie korozja
granicy ziaren
Formy korozji

Formy korozji
Korozja międzykrystaliczna

Formy korozji
Używanie stali stopowych o niskiej zawartości
węgla
Używanie stali stabilizowanych,
zawierających pierwiastki łatwo tworzące
węgliki (Nb lub Ti) w celu związania węgla
Dla istniejących konstrukcji, które uległy
uczuleniu obróbka cieplna w celu wyrównania
stężenia chromu w masie stali (proces trudny
z punktu widzenia praktycznego)

Formy korozji -
selektywna
Stopy zawierające jeden składnik bardziej
szlachetny i drugi (stanowiący podstawowy
składnik stopu) bardziej aktywny
(np. brąz, Cu + Zn)
Podstawowy składnik stopu może ulegać
rozpuszczeniu pozostawiając matrycę ze
stopu bardziej szlachetnego
Odcynkowanie brązów(mosiądzów)
Grafityzacja żeliwa szarego
Powoduje utratę wytrzymałości
mechanicznej bez oczywistej zmiany
kształtu.

Formy korozji – erozja korozja
Przepływ może
powodować:
Zwiększenie szybkości
transportu tlenu do
powierzchni metalu
(
+
pomaga pasywacji,
-
zwiększa szybkość
korozji)
Zwiększa szybkość
rozpuszczania się
warstw produktów
korozji
Mechanicznie usuwa
warstwy tlenkowe
Formy korozji
Korozja naprężeniowa
Specyficzne współdziałanie
środowiska korozyjnego
i naprężeń (własnych lub
zewnętrznych).
Cl-, OH- - stale stopowe;
amoniak – stopy miedzi;

Ochrona przed korozją
Podstawowym celem ochrony przed
korozją jest zmniejszenie szybkości
korozji do akceptowalnego
poziomu.

Znaczenie ochrony przed
korozją
Straty do
3 tys. $
na mieszkańca
ok. 30% strat –
brak wiedzy
Środki zainwestowane w badania i
szkolenie są
bardzo opłacalne
Ochrona ma duże znaczenie
proekologiczne
pozwala unikać
skażeń i chroni instalacje ochrony
środowiska (IOS, oczyszczalnie)

Metody ochrony przed
korozją
Ochrona powłokowa
(uniwersalna,
powszechna – 80% zabezpieczeń)
Ochrona elektrochemiczna
(w
zanurzeniu, zwykle uzupełnienie
powłokowej)
Ochrona katodowa (protektory,
zewnętrzne źródła prądu stałego,
Ochrona anodowa.
Modyfikacja środowiska
(inhibitory,
odtlenianie, klimatyzacja, osuszanie)

Metody ochrony przed
korozją
Dobór materiałów
Stopy metali
Kompozyty
Nanowarstwy
Odpowiednie projektowanie konstrukcji
Projekt konstrukcji powinien ułatwiać
przygotowanie powierzchni, malowanie,
nadzór i renowację.

Ochrona powłokowa
Zadaniem tego typu ochrony jest
oddzielenie środowiska korozyjnego
od materiału podlegającego
ochronie.
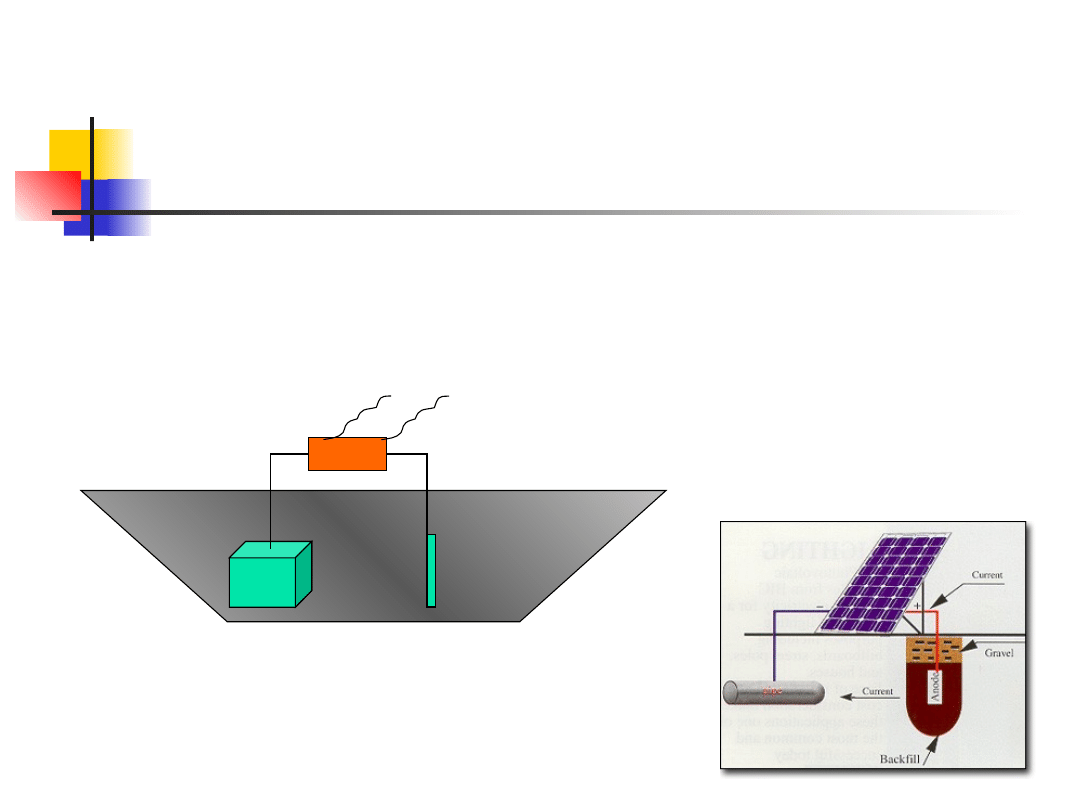
Ochrona elektrochemiczna
Dwa sposoby realizacji ochrony katodowej:
-Polaryzacja z zewnętrznego źródła prądu stałego
-Podłączenie konstrukcji do roztwarzanych anod

Ochrona elektrochemiczna
Podłączenie konstrukcji do
roztwarzanych anod

Modyfikacja środowiska
Ograniczanie wilgotności atmosfery
Zmniejszenie zawartości tlenu
Dodatek inhibitorów korozji
Korekcja pH (głównie alkalizacja)
Zmiana temperatury
Dodatek biocydów
Dobór
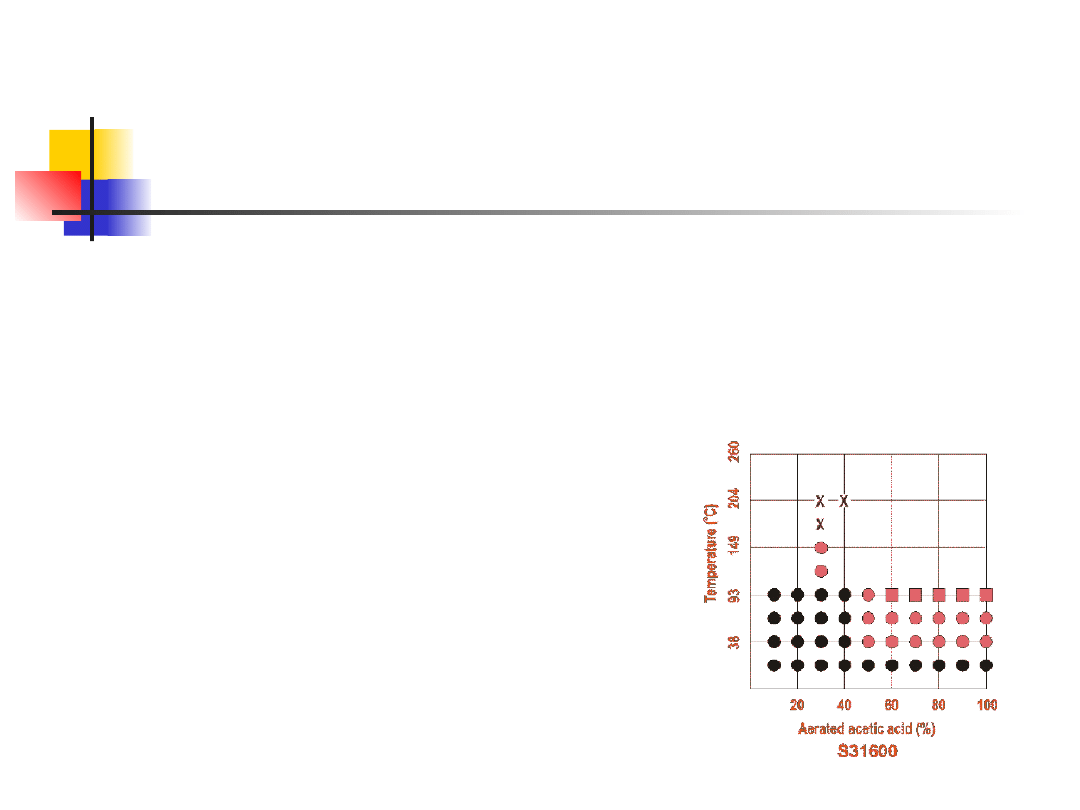
materiałów
W literaturze dostępne są ogromne ilości
danych dotyczących szybkości korozji
większości metali o znaczeniu
technologicznym w różnych środowiskach
korozyjnych.

Monitorowanie korozji
W celu kontroli procesów korozyjnych
monitorujemy dwa główne parametry
Czynniki powodujące korozję – pH,
chlorki, wilgotność, zanieczyszczenia
atmosfery, itp.
Aktualne wartości
parametrów
związanych
z procesem
korozy
jnym –
czyli np. prąd korozyjny.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
pomiary korozyjne
Pomiary korozyjne 5
ściąga pomiary 3, semestr 5, pomiary korozyjne
Pomiary korozyjne 4 pomiar potencjalu
Pomiary korozyjne 2
download Zarządzanie Produkcja Archiwum w 09 pomiar pracy [ www potrzebujegotowki pl ]
2 1 Podstawowe czynności pomiarowe w geodezji
BYT 2005 Pomiar funkcjonalnosci oprogramowania
6 PKB 2 Pomiar aktywności gospodarczej rozwin wersja
Praktyczna interpretacja pomiarów cisnienia
wyklad 13nowy Wyznaczanie wielkości fizykochemicznych z pomiarów SEM
13a Pomiary jakosci
NIEPEWNOŚĆ POMIARU
Strategia pomiarów środowiska pracy
PEM (10) Nieoewność pomiaru
2 8 Błedy pomiarów
Pomiar odpylaczy kotłowych
więcej podobnych podstron