Chemia
Chemia
Prof. dr hab. Krystyna A. Skibniewska
Katedra Podstaw Bezpieczeństwa WNT
E-mail: kas@uwm.edu.pl

Plan wykładu I1I
Plan wykładu I1I
Budowa i właściwości gazów, cieczy
i ciał stałych.
Termodynamika chemiczna.
Amfoteryczność.
Hydroliza.
Obliczenia stechiometryczne

Wcześniej mówiono strukturę atomów i
cząsteczek. Ale wokół nas zwykle
występują ich zbiorowiska
Gazy
- nie mają określonego kształtu i
objętości (kształt i objętość naczynia). Gaz
wywiera ciśnienie na ściany naczynia,
ściskając naczynie dość łatwo można
zmienić objętość. Brak uporządkowania
cząsteczek.

Równanie gazu
Równanie gazu
doskonałego
doskonałego
pv = RT
Gdzie: p – ciśnienie, v = objętość, T =
temperatura
o
K, R = stała gazowa
Gaz doskonały – założenie, że nie ma
oddziaływania miedzy cząsteczkami
(dostatecznie wysoka temp. i niskie ciśnienie).
Siły van der Waalsa – siły międzycząsteczkowe.
Zanikają wraz ze spadkiem ciśnienia lub
podwyższeniem temperatury. Pozwalają na
skroplenie gazu. Są skutkiem istnienia dipoli,
polaryzacji cząsteczki, lub dyspersji.

Ciecze
– przyjmują kształt naczynia
ale mają powierzchnię. Objętość w
małym stopniu zależy od ciśnienia.
Cząsteczki mogą się przesuwać
względem siebie ale nie wychodzą
poza zasięg wzajemnych
oddziaływań.
Napięcie powierzchniowe. Kapilarność.
Płynność. Lepkość. Lepkość rozpuszczalnika i
roztworu. Zależność lepkości od temperatury –
na ogół maleje ale np. w kitach siarkowych
rośnie. Ciecze sztywne.

Ciała stałe
Ciała stałe
– posiadają strukturę
– posiadają strukturę
krystaliczną. Mają sztywną postać
krystaliczną. Mają sztywną postać
czyli stałą objętość i kształt. Stan
czyli stałą objętość i kształt. Stan
uporządkowany
uporządkowany
.
.
Ciała krystaliczne – sieć krystaliczna o
określonym kształcie dla danego związku
chemicznego. Stały skład. Prawo stałości
kątów. Zależność własności od kierunku. Topi
się w określonej temperaturze.
Ciała bezpostaciowe – zastygły bez
krystalizacji. Nie ma temperatury topnienia.
Podgrzewane, poprzez stan plastyczny
przechodzi w ciecz.

Budowa kryształu
Budowa kryształu
Układ krystalograficzny, oś
krystalograficzna, atom lub jon
centralny, liczba koordynacyjna.
Kryształy: molekularne (zestalone
gazy szlachetne, zestalony
metan), kowalencyjne (diament,
SiC), jonowe (NaCl), metaliczne.
Ten sam pierwiastek lub związek chemiczny w zależności od
sposobu powstawania i warunków zewnętrznych (np.
temperatury) może występować w różnych strukturach
krystalicznych (C: diament, grafit, sadza, grafen)

Nagroda Nobla w
Nagroda Nobla w
dziedzinie fizyki 2010
dziedzinie fizyki 2010
Grafen jest to niezwykle cienka, o grubości
jednego atomu warstwa grafitu. Pomimo,
że powstaje nawet podczas pisania
zwykłym ołówkiem, proces otrzymywania
czystego grafenu poprzez skrawanie
ultracienkich warstw grafitu jest niezwykle
kosztowny, czyniąc go prawdopodobnie
najdroższym materiałem na Ziemi. W tej
chwili główną przeszkodą w popularyzacji
grafenu w produkcji procesorów są bardzo
wysokie koszty uzyskania go z grafitu.
Ostatnio Polacy opracowali metodę
otrzymywania grafenu.

Nagroda Nobla w
Nagroda Nobla w
dziedzinie fizyki 2010 c.d.
dziedzinie fizyki 2010 c.d.
Przeźroczyste warstwy grafenu o grubości jednego
atomu są niezwykle wytrzymałe mechanicznie i
termicznie. Do tego grafen jest bardzo dobrym
przewodnikiem. Wystarczy jednak prosta obróbka
chemiczna, tak jak niedawno odkryta metoda
dołączania atomów wodoru, aby z idealnego
przewodnika stał się prawie idealnym izolatorem (tzw
grafan). Co więcej, można osiągnąć również
praktycznie wszystkie stadia pośrednie. Już w
niedalekiej przyszłości może się okazać możliwe
konstruowanie praktycznie całych układów scalonych
w oparciu jedynie o cienką warstewkę grafenu. Być
może niezbyt odległa jest wizja stworzenia
przeźroczystych ekranów, które można bardzo łatwo
odkształcać, a tak często pojawiających się w filmach
science-fiction.

Warto też wspomnieć o jeszcze jednej niesłychanej
własności grafenu. Elektrony poruszają się w nim tak
szybko, że do ich opisu nie można stosować równania
Schrödingera a jedynie jego relatywistyczny odpowiednik
- równanie Diraca. Grafen jest zatem doskonałym
materiałem do testowania relatywistycznych własności
materii, pomagając w zrozumieniu budowy nawet tak
egzotycznych obiektów astrofizycznych takich jak białe
karły czy gwiazdy neutronowe.
Zasługi Andre Gejma i Konstantina Nowosiełowa polegają
przede wszystkim na wyizolowaniu grafenu i dokładnym
opisaniu jego niezwykłych własności, pozwalających na
budowanie tzw. procesorów grafenowych. Grafen to
dwuwymiarowy kryształ złożony z atomów węgla,
zbudowany z sześcioczłonowych pierścieni tego
pierwiastka. Budową przypomina zatem plaster miodu.
Nagroda Nobla w
Nagroda Nobla w
dziedzinie fizyki 2010 c.d.
dziedzinie fizyki 2010 c.d.


Nagroda Nobla w
Nagroda Nobla w
dziedzinie fizyki 2010 c.d.
dziedzinie fizyki 2010 c.d.
Najważniejszą właściwością kryształu jest
znakomite przewodzenie prądu i ciepła.
Dzięki temu nadaje się do budowy
energooszczędnych tranzystorów, z
których zbudowane są procesory,
stanowiące "mózg" każdego komputera.
W przyszłości grafen posłuży
prawdopodobnie do budowy
superszybkich komputerów, z
procesorami o taktowaniu nawet 500-
1000 GHz.
Grafen może zastąpić krzem jako materiał
do budowy procesorów.

Budowa krystaliczna warunkuje takie cechy
fizyczne materiałów, jak twardość,
łupliwość, załamanie światła, a także
rozpuszczalność, ciepło i temperaturę
topnienia.
Materiały mogą być zbudowane wg kilku
wzorców sieci krystalicznej (sieć
mieszana).
Grafit: wiązanie atomowe w warstwach, siły Van der Waalsa między warstwami;
Talk: wiązanie jonowe w warstwach, siły Van der Waalsa między warstwami;
Gips: wiązanie jonowe w warstwach, mostki wodorowe między warstwami.
Budowa kryształu c.d.
Budowa kryształu c.d.
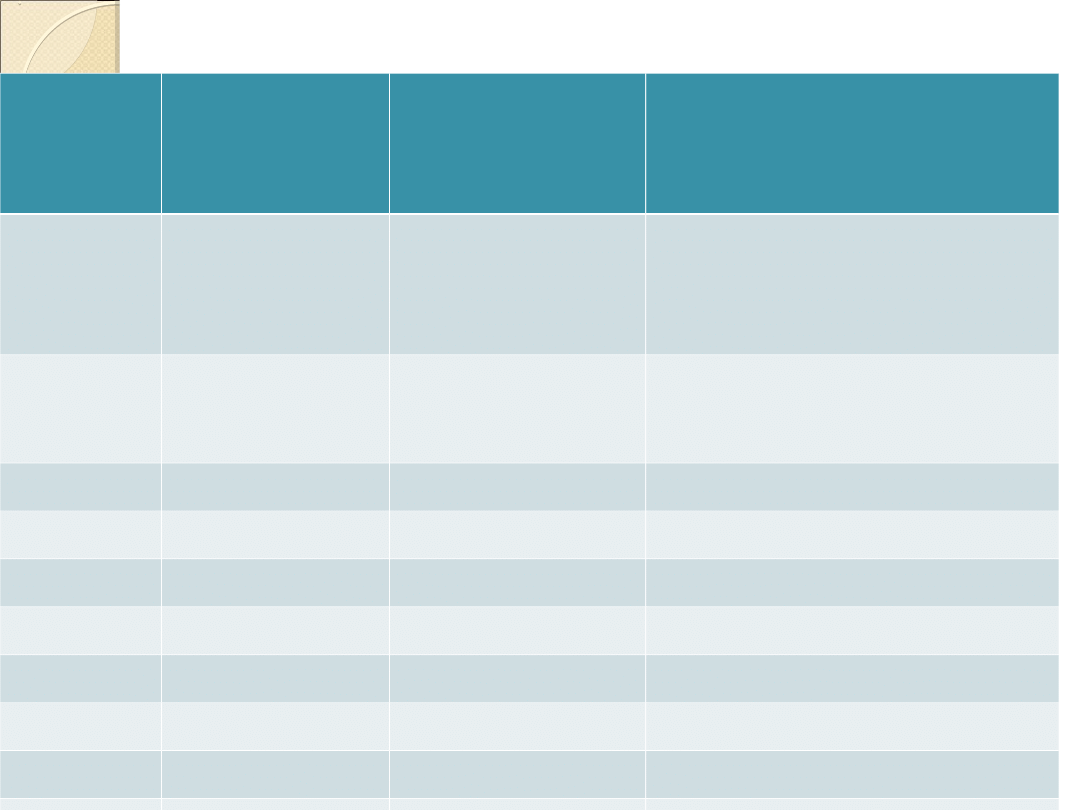
Skala twardości wg Mohsa
Skala twardości wg Mohsa
Stopień
twardośc
i
Substancja
Wzór
chemiczny
Wiązanie sieciowe
1
Talk
Mg
3
(Si
4
O
10
) (OH)
2
Struktura pakietowa: w
warstwach jonowe, między
warstwami siły Van der
Waalsa
2
Gips
CaSO
4
.
2H
2
O
w warstwach jonowe,
między warstwami mostki
wodorowe
3
Kalcyt
CaCO
3
jonowe
4
Fluoryt
CaF
2
jonowe
5
Apatyt
Ca
5
(PO
4
)
3
(F,Cl)
jonowe
6
Ortoklaz
K[AlSi
3
O
8
]
jonowe
7
Kwarc
SiO
2
atomowe spolaryzowane
8
Topaz
Al
2
(F,OH)
2
SiO
4
jonowe
9
Korund
Al
2
O
3
atomowe spolaryzowane
9,5 (10)
Węglik krzemu SiC
atomowe
10 (15)
Diament
C
atomowe

Budowa atomu – stan podstawowy i
wzbudzony. Jonizacja. Stan energetyczny
atomu w zależności od stanu.
Promieniowanie.
Termochemia – nauka o cieplnych efektach
przemian chemicznych.
I zasada termodynamiki – w układzie
zamkniętym suma wszystkich rodzajów
energii pozostaje stała, niezależnie od
zachodzących przemian.
E = constans

Ciepło molowe
Ciepło molowe
Im wyższa temperatura, tym większa
prędkość ruchu cząsteczek
(w gazach
swobodne, postępowe oraz obrotowe i drgające, w cieczach
mniej swobodne, w kryształach jedynie drgające)
.
Ciepło molowe Q [J/m] – ilość energii
potrzebnej do ogrzania 1 mola
substancji o 1K.
Q zależy od temperatury – w pobliżu 0K
zbliża się do 0, gdyż ustaje ruch
cząsteczek.

Każdej reakcji chemicznej towarzyszy
wydzielenie lub pobranie pewnej ilości
energii, najczęściej w postaci ciepła.
Reakcje egzo- i endotermiczne (+ lub –
∆H).
CaCO
3
+ 178,5 kJ → CaO + CO
2
CaO + H
2
O → Ca(OH)
2
+ 67,0 kJ
∆H to efekt cieplny reakcji zachodzącej pod
stałym ciśnieniem, zwany zmiana entalpii
składników reakcji.

Zagadnienia na ćwiczenia
Zagadnienia na ćwiczenia
Amfoteryczność.
Hydroliza soli.
Obliczenia stechiometryczne
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
Zao bud 1
Zao bud 2
Dz i zao bud 4
Dz i zao bud 5
Dz i zao bud 5
Zao bud 1
Dz bud 4
Wykład och zao 6
BUD OG wykład 11 3 Geosyntetyki
BUD OG wykład 11 1 Tworzywa sztuczne
Wykład och zao 3a
wykład III bud ciało i szybkość
Bud II ćw proj 4
Kal kosz wprow 2014 zao
mat bud 006 (Kopiowanie) (Kopiowanie)
bud 13
więcej podobnych podstron