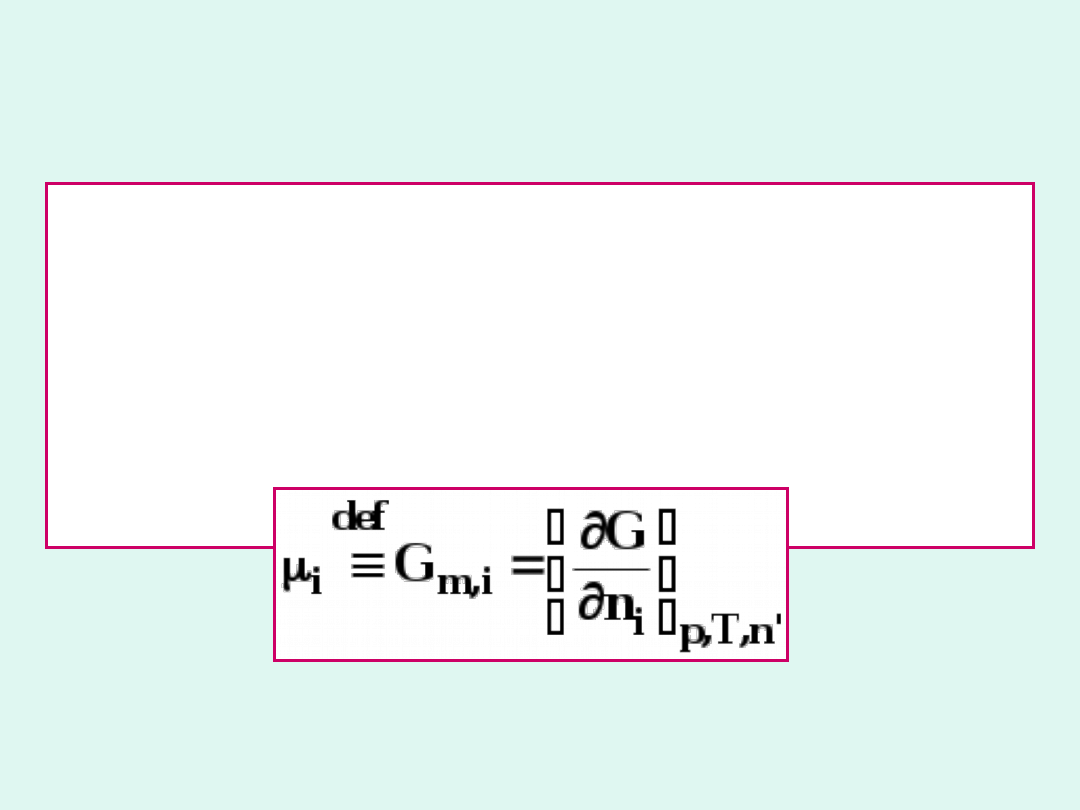
Potencjał chemiczny
Potencjał chemiczny
składnika i-tego to
zmiana
entalpii
swobodnej
układu
towarzysząca dodaniu 1 mola tego składnika
w stałej temperaturze i ciśnieniu do
nieskończenie dużej ilości układu, aby
zachował on stały skład (stałą liczbę moli
pozostałych składników).
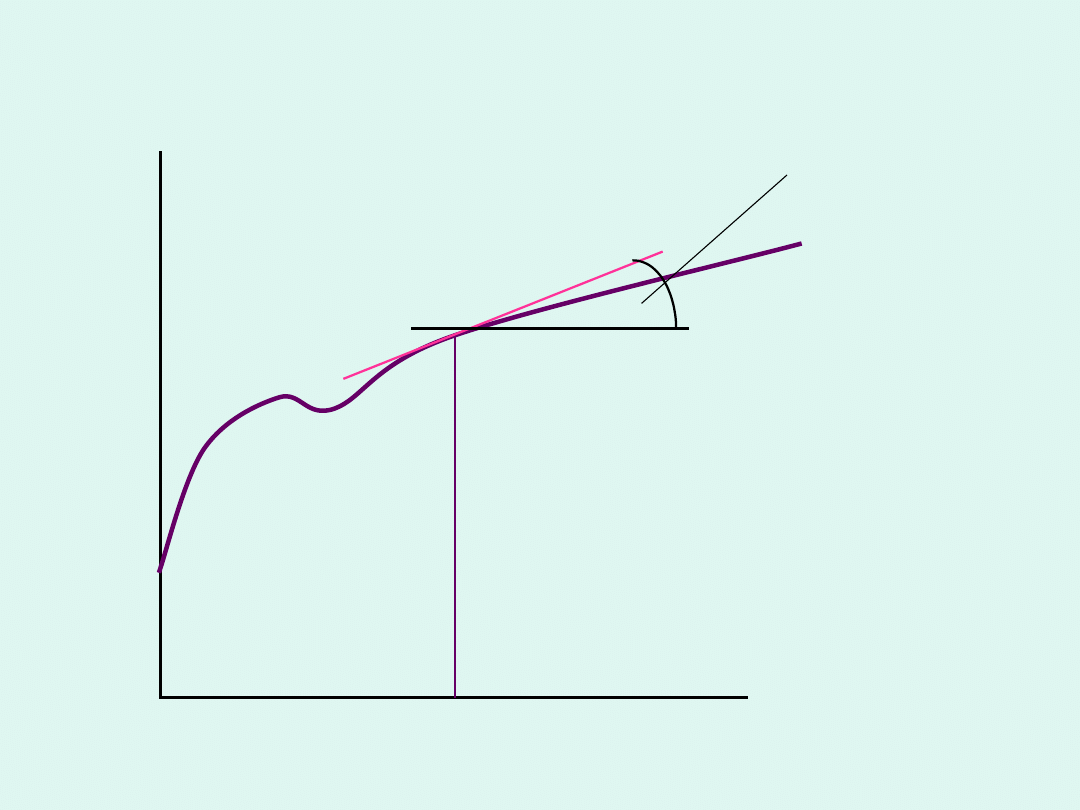
n
i
G
n'
i
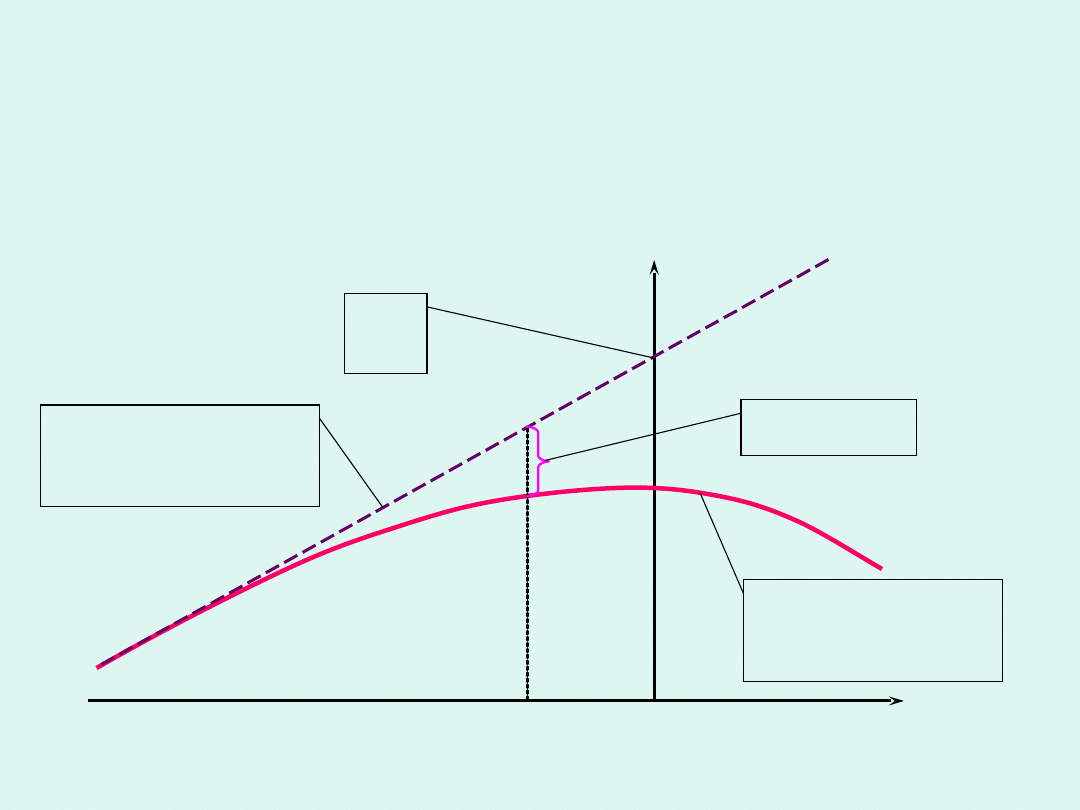
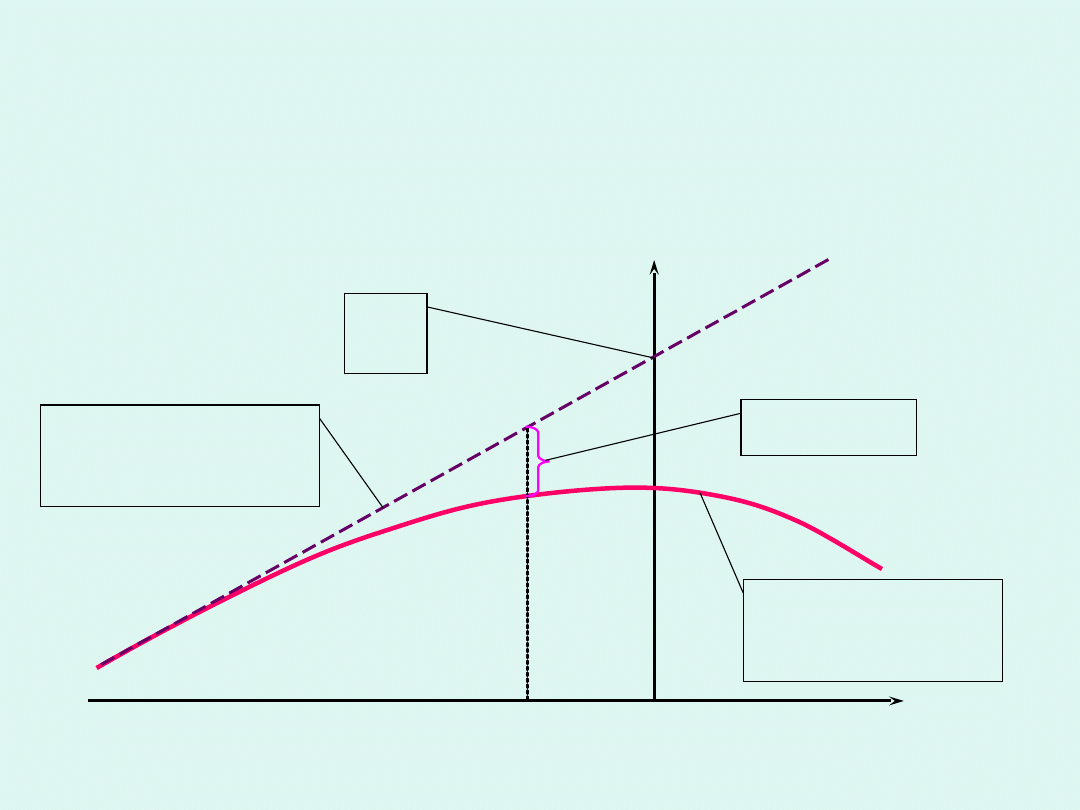
tg =
i
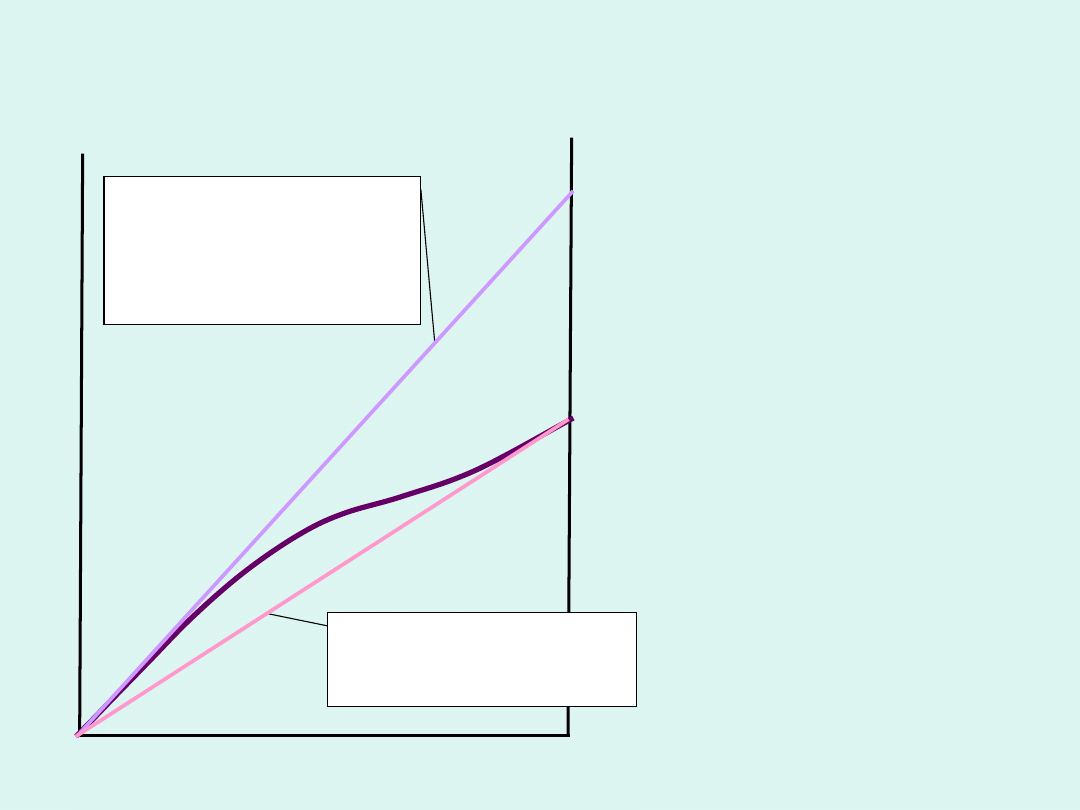
skład
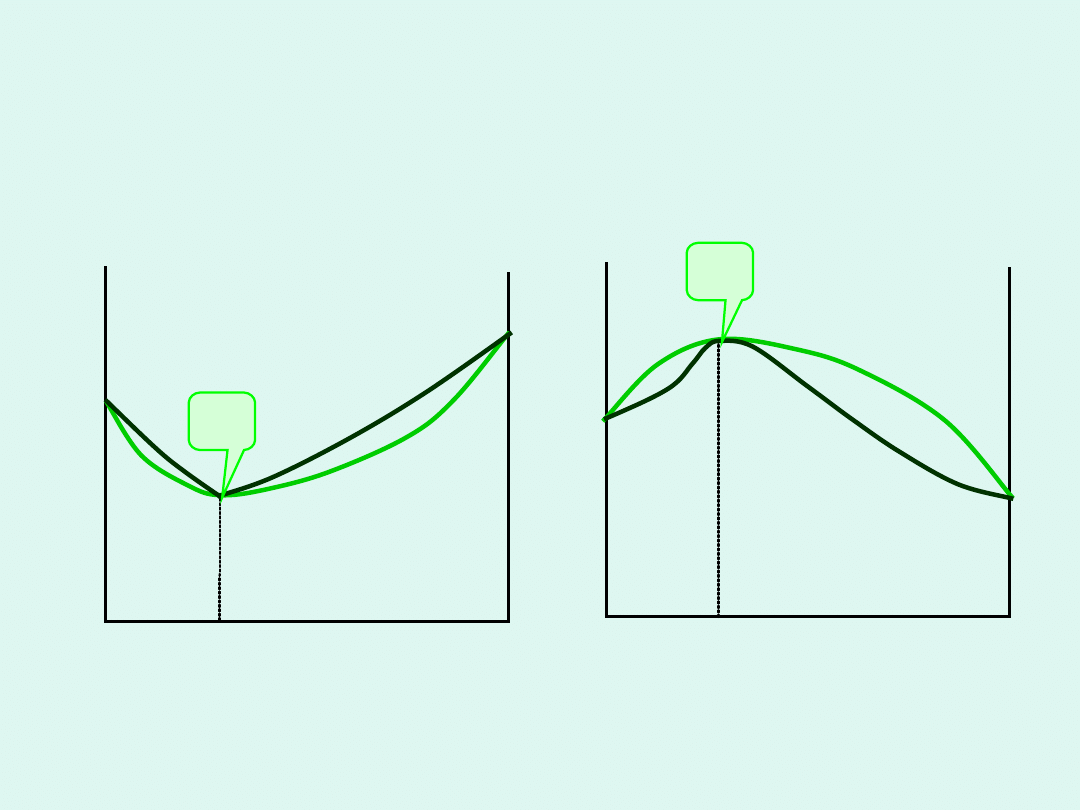
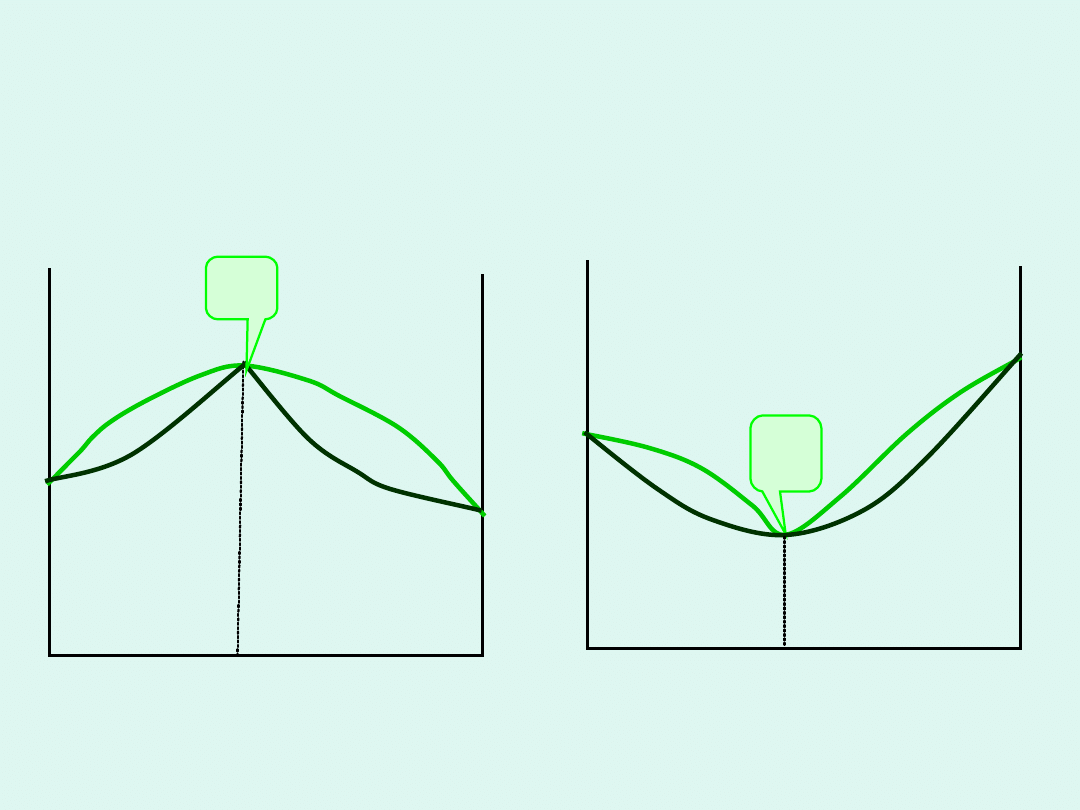
Graficzna interpretacja potencjału
chemicznego
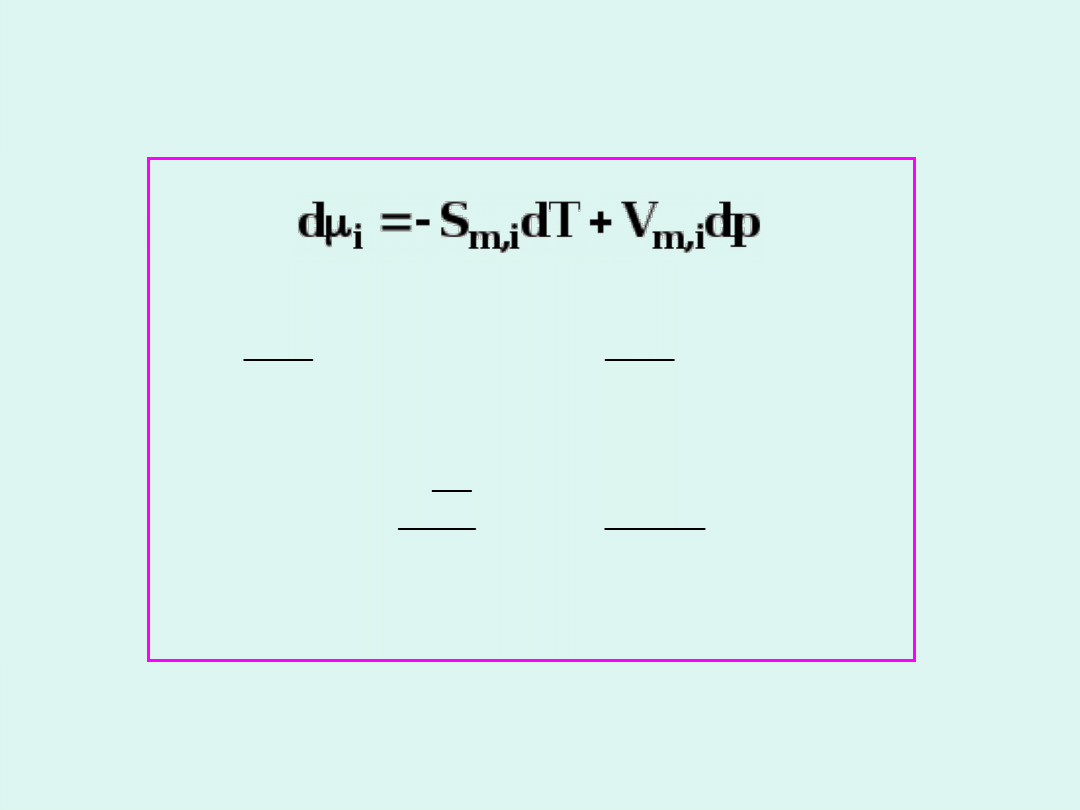
i
i
m,i
m,i
p
T
S
i
V
T
p
i
m,i
T
2
p
H
T
T
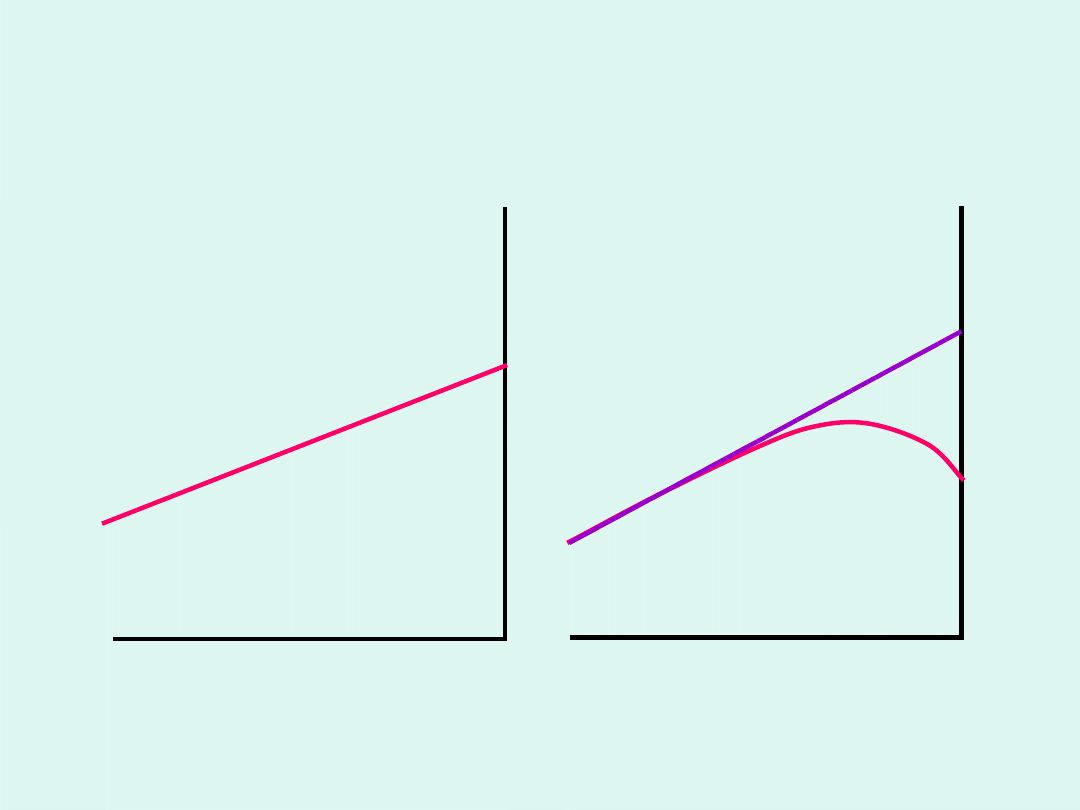
Własności potencjału
chemicznego

Wyjaśnienie do
definicji fazy
roztwór stały –
jedna faza
dyspersja stała –
dwie fazy

Układ jest w stanie równowagi
termodynamicznej gdy :
Jest w stanie
równowagi termicznej
,
czyli
temperatura w każdym
punkcie układu jest taka sama.
Jest w stanie
równowagi
mechanicznej
, czyli
ciśnienie w
każdym punkcie układu jest takie
samo.
Jest w stanie
równowagi
chemicznej
, czyli stężenia
poszczególnych składników w
każdym punkcie określonej fazy układu
są takie same.
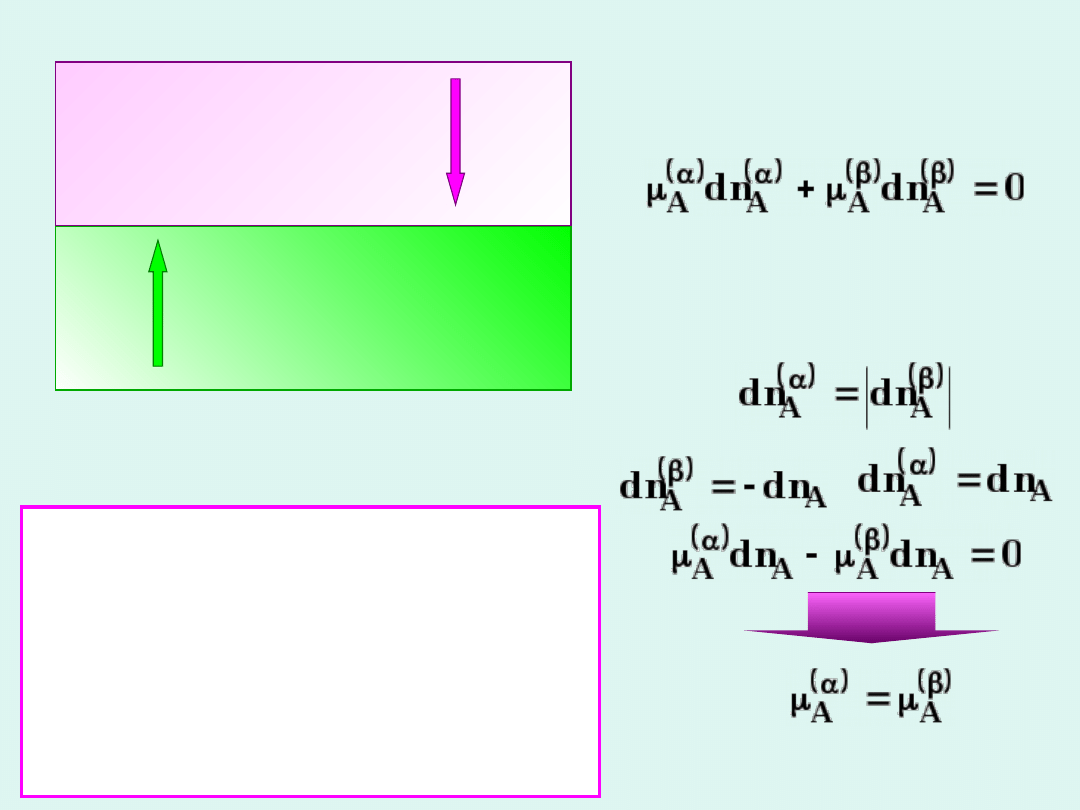
faza
faza
dn
A
-dn
A
Stosujemy
równanie Gibbsa-
Duhema
Przepływ w obie
strony jest taki
sam
f
i
2
i
1
i
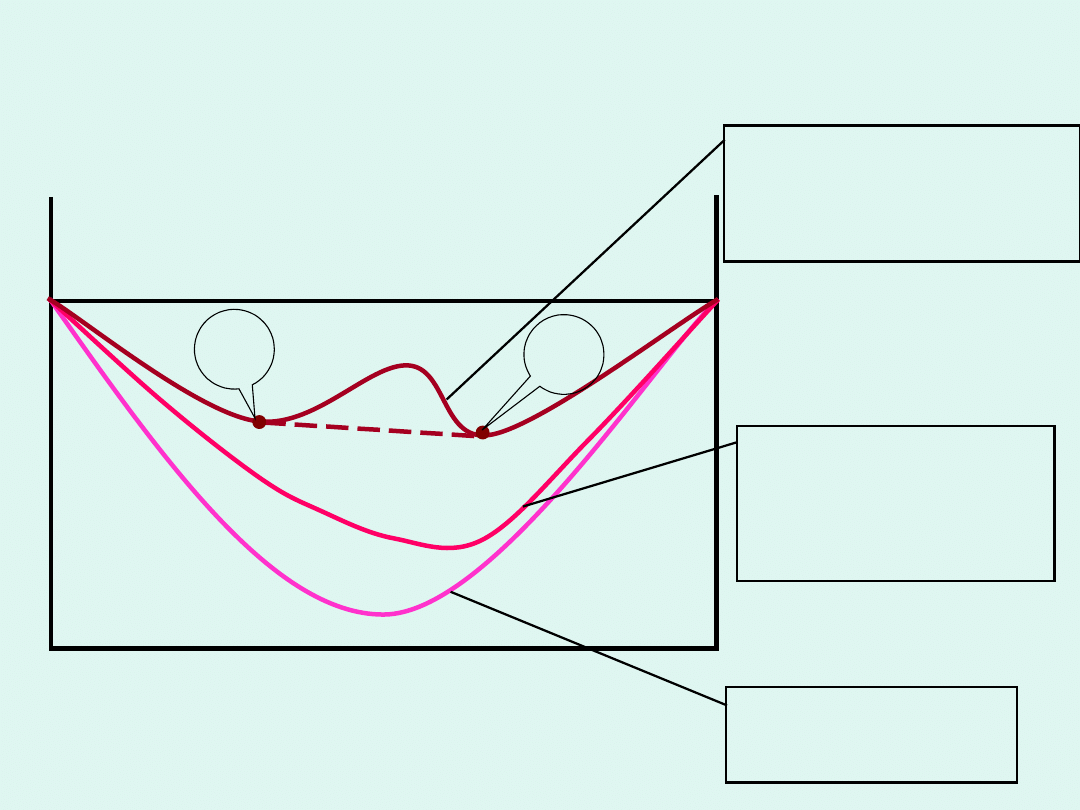
Ogólny warunek
równowagi w układzie
wieloskładnikowym i
wielofazowym
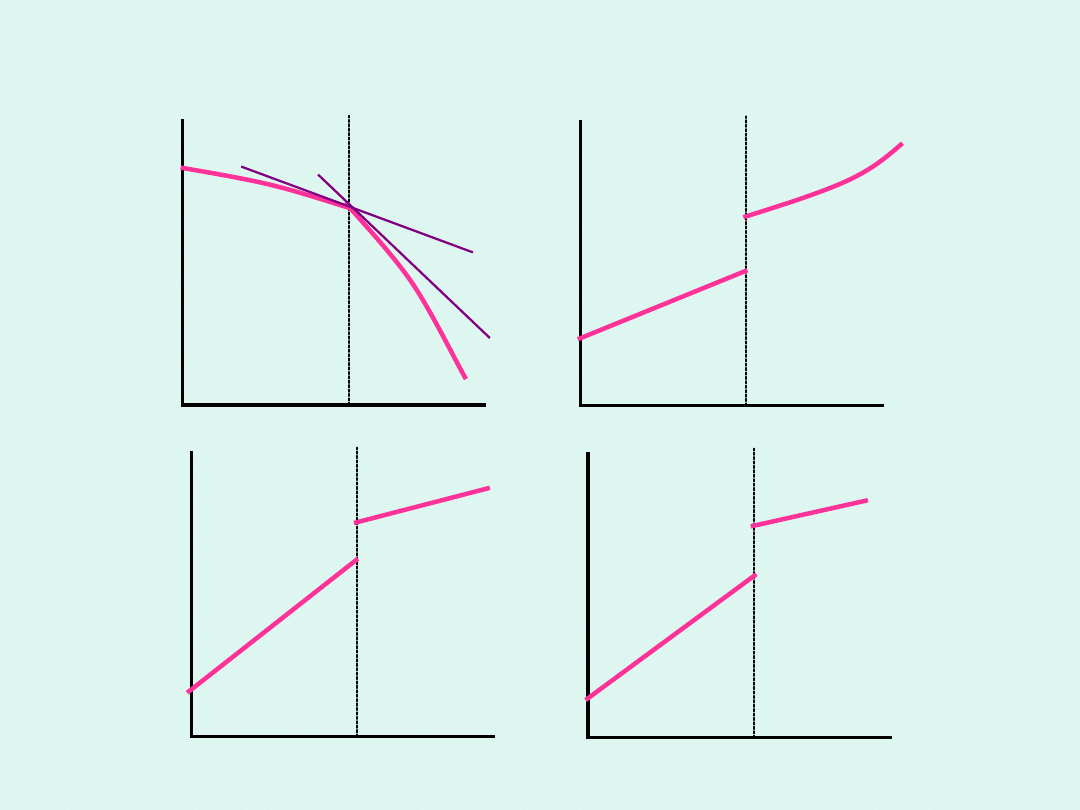
temperatura T
V
H
S
temperatura T
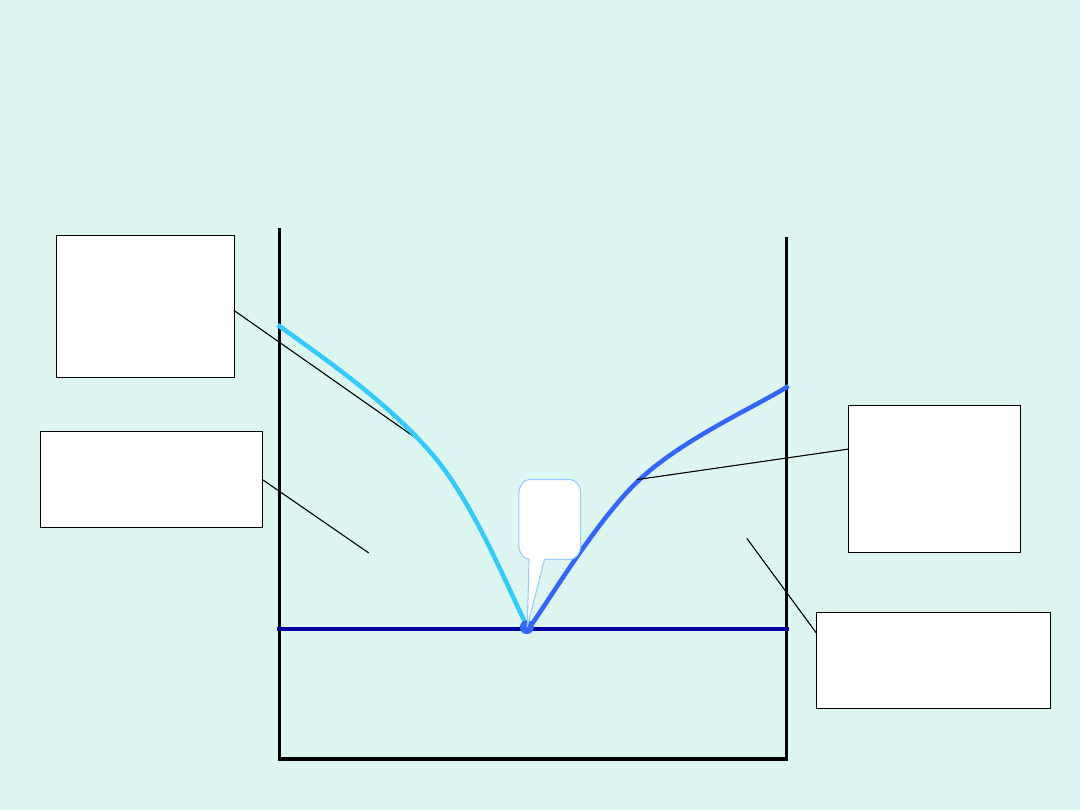
Przemiany fazowe pierwszego
rodzaju
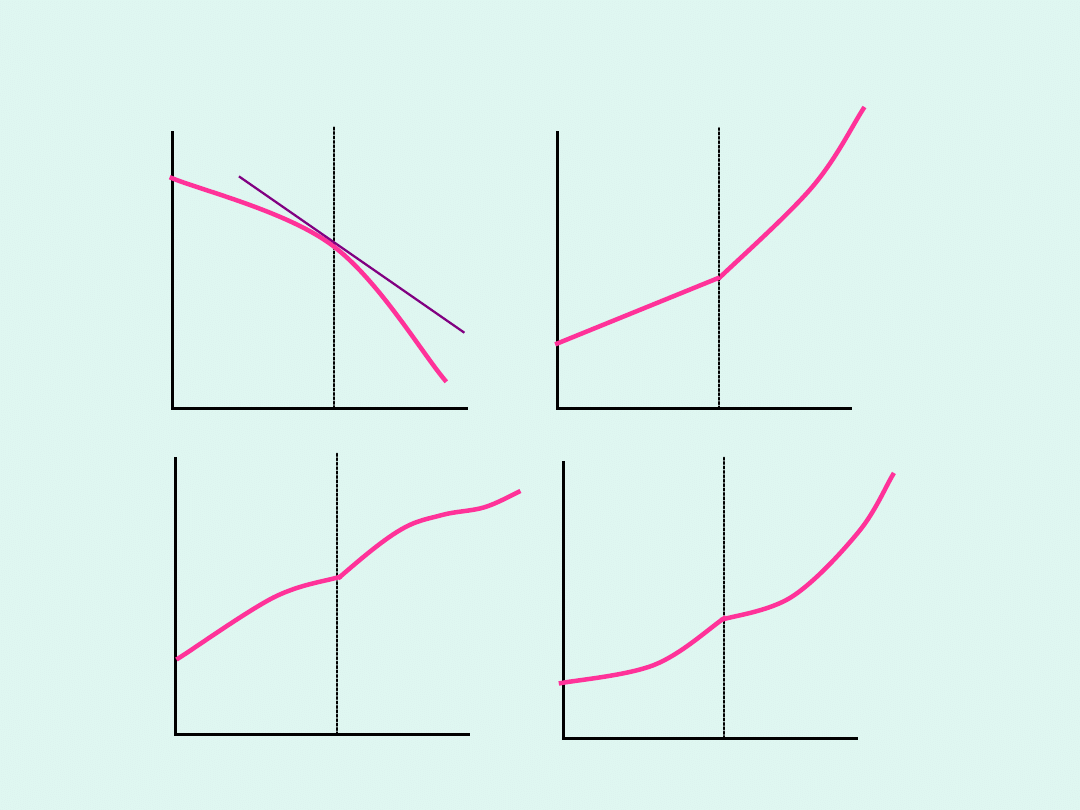
temperatura
T
V
S
H
temperatura
T
Przemiany fazowe drugiego rodzaju
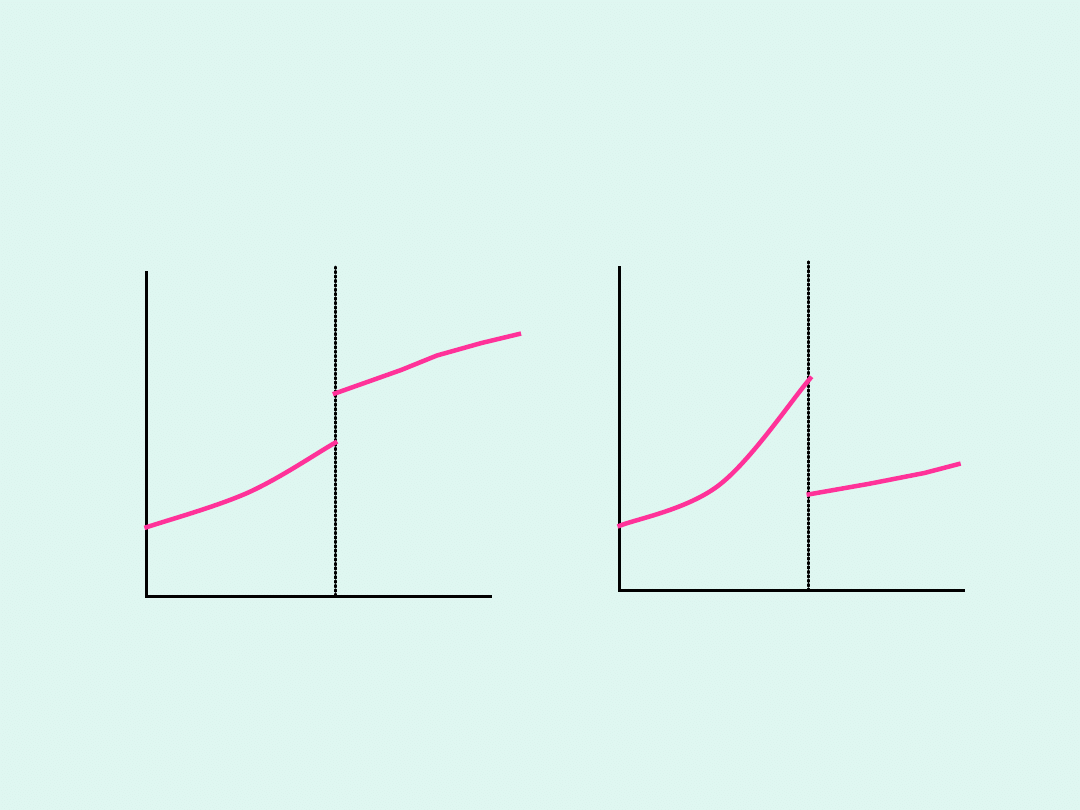
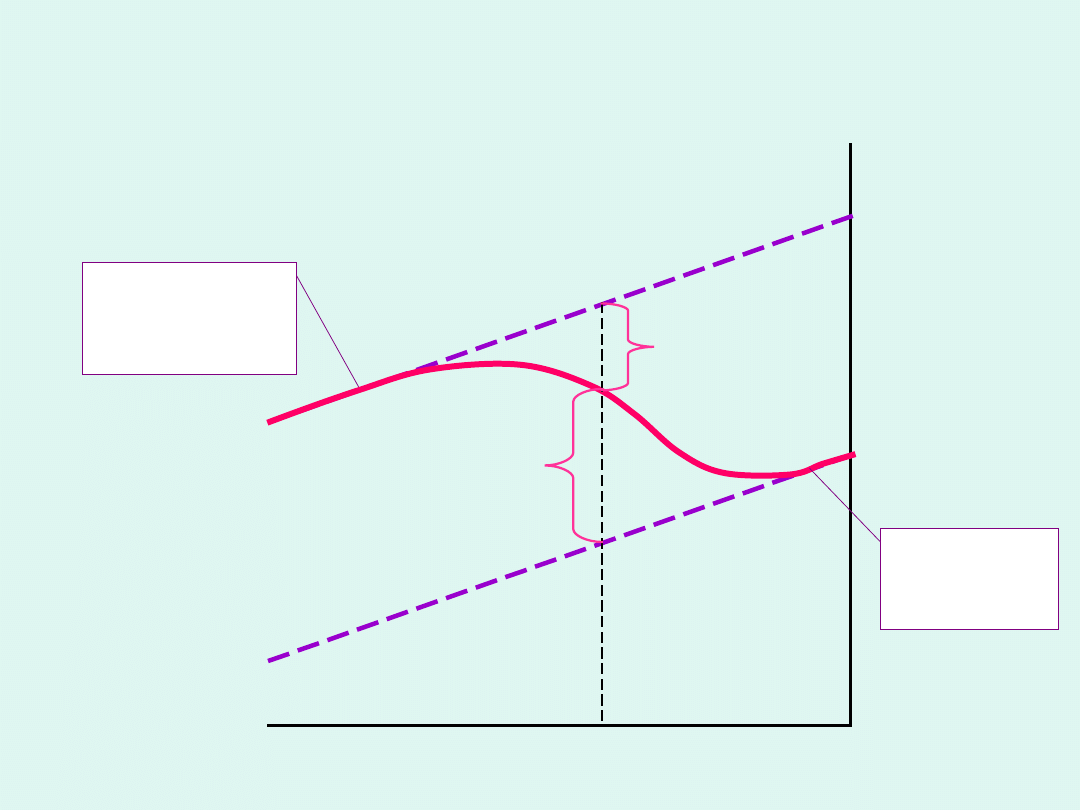
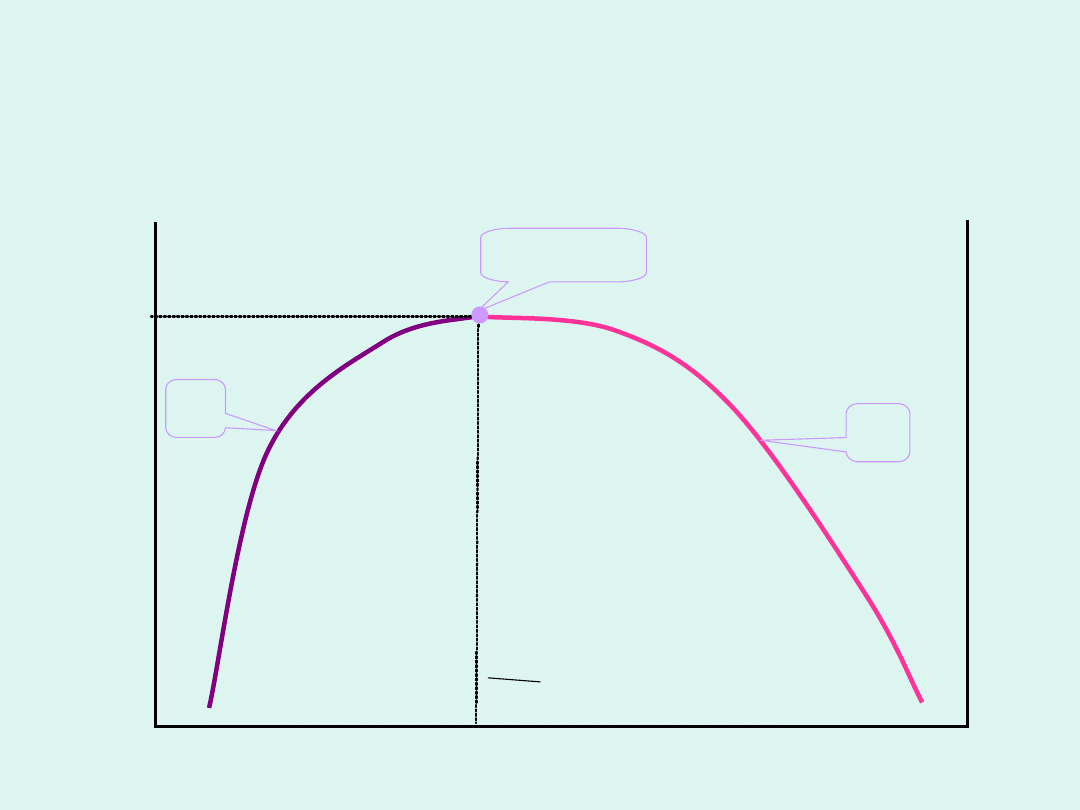
W przemianach fazowych drugiego rodzaju
skokowo zmieniają się drugie pochodne
potencjału chemicznego po temperaturze.
c
p
współczynnik
rozszerzalności
termicznej
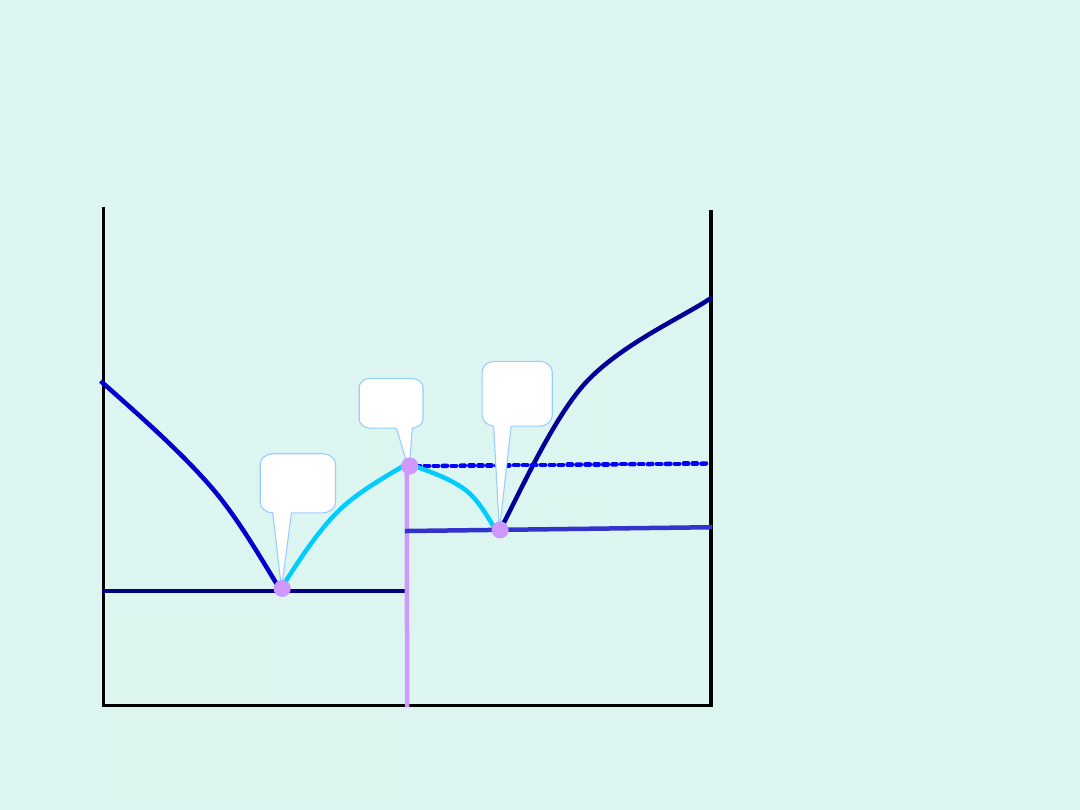
temperatura T
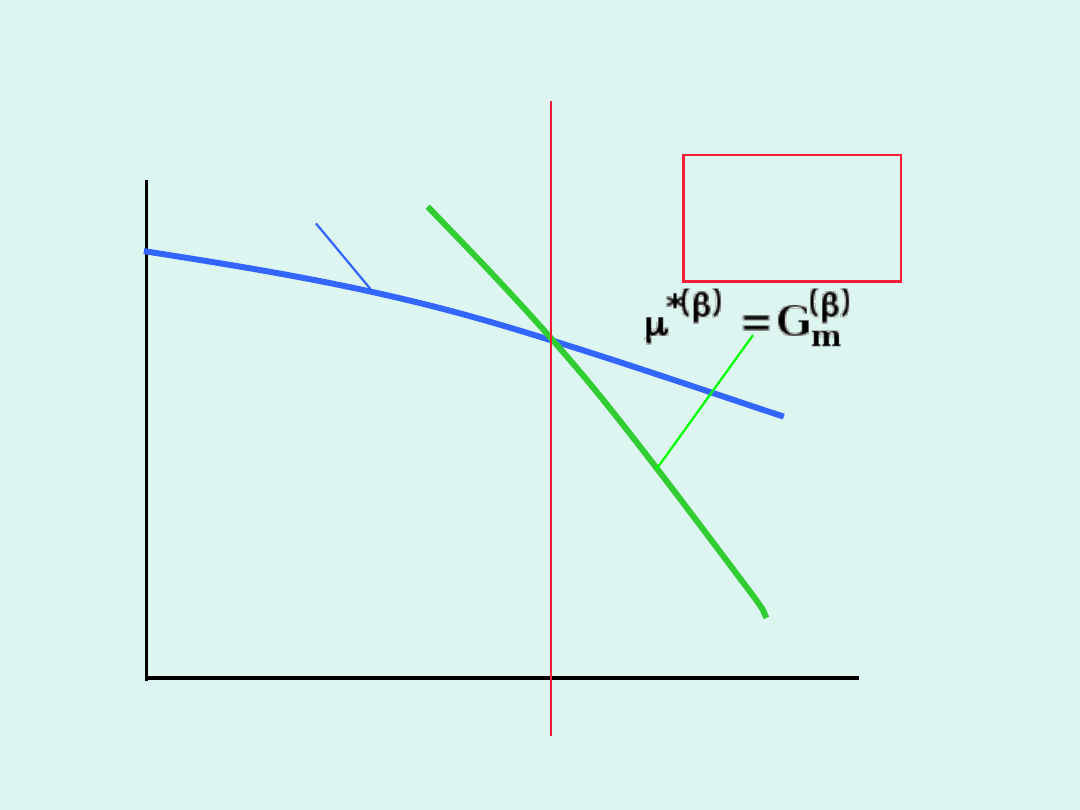
m
m
G
G
m
G
*
T
faza
faza
temperatura przemiany fazowej
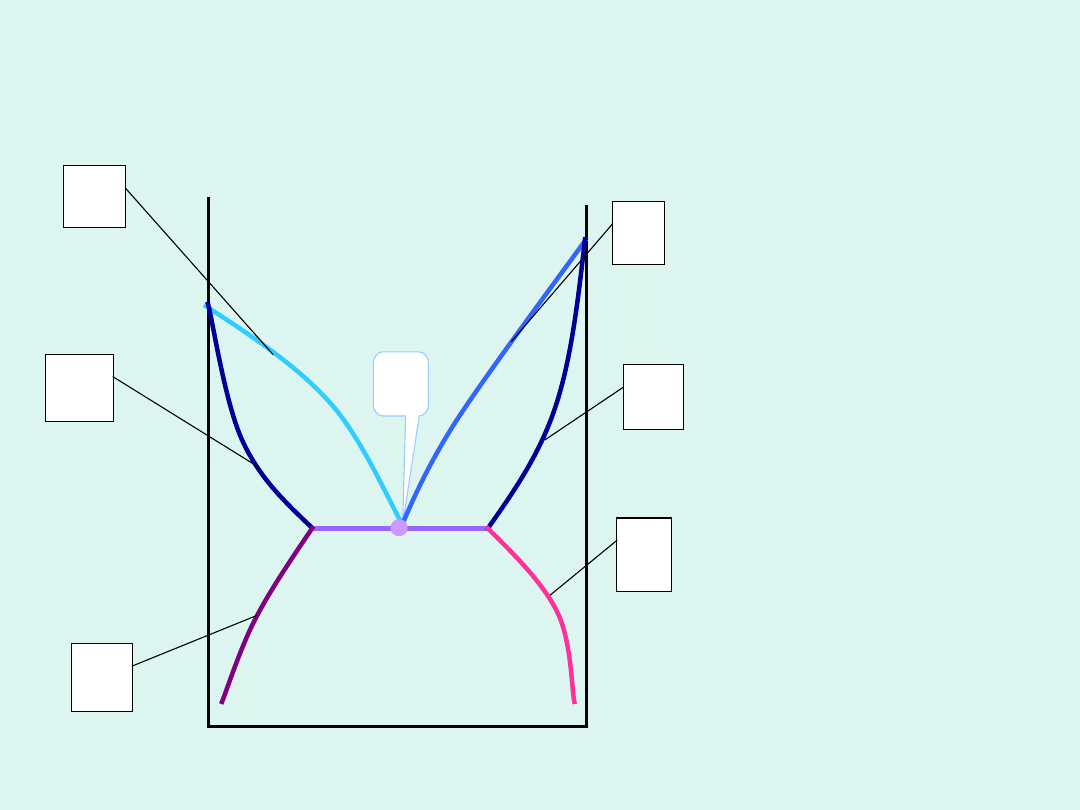
Warunek równowagi w układzie
jednoskładnikowym i dwufazowym
p =
const

Zastosowanie równania Clausiusa
do topnienia
m
top
top
m
top
V
T
H
dT
dp
?
V
V
V
0
T
0
H
ciecz
m
ciecz
m
m
top
m
top
topnienie
stałe
ciało
top
stałe
ciało

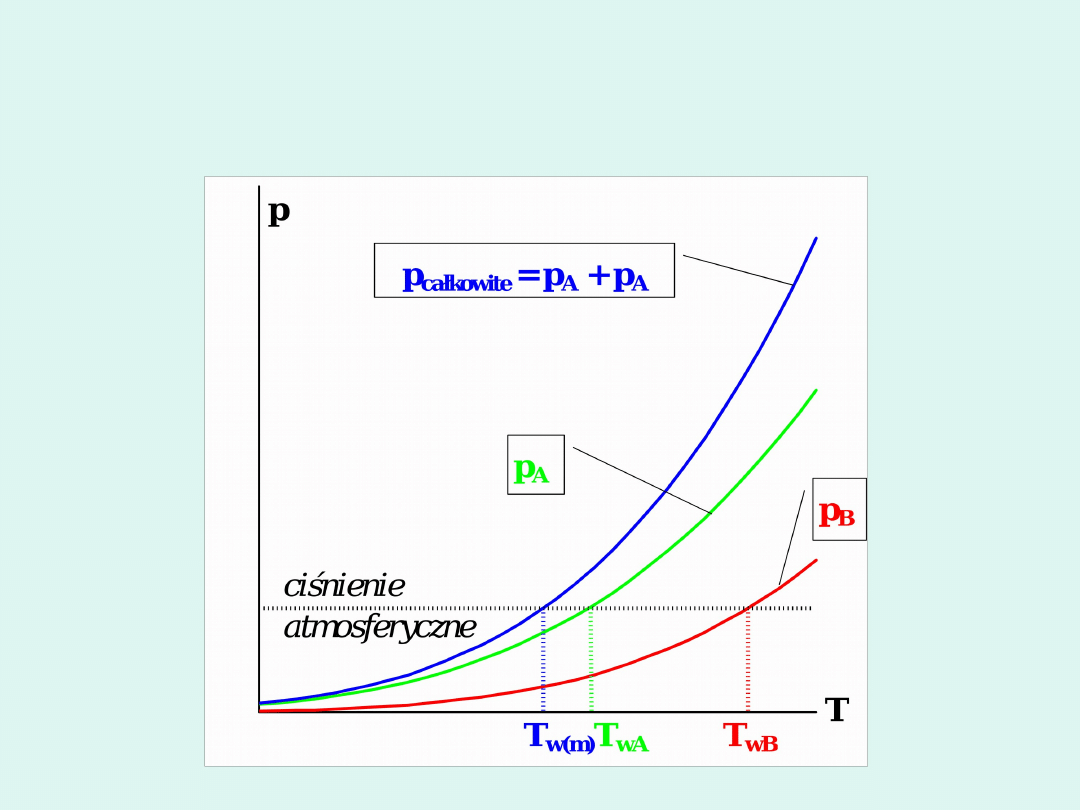
Dla większości substancji :
0
V
V
V
V
V
m
ciecz
m
m
m
ciecz
m
stałe
ciało
top
stałe
ciało
0
dT
dp
0
V
T
H
m
top
top
m
top
Wobec tego :
Oznacza to, że gdy temperatura rośnie,
to rośnie ciśnienie równowagowe
przemiany. I na odwrót : temperatura
topnienia rośnie, gdy rośnie ciśnienie.
Woda jest wyjątkiem
:
1 mol lodu ma
objętość ~
19,6 cm
3
1 mol wody ma
objętość ~ 18
cm
3
0
V
V
V
V
V
m
ciecz
m
m
m
ciecz
m
stałe
ciało
top
stałe
ciało
0
dT
dp
0
V
T
H
m
top
top
m
top
Oznacza to, że gdy temperatura rośnie,
to maleje ciśnienie równowagowe
przemiany. I na odwrót : gdy ciśnienie
rośnie, temperatura topnienia lodu
maleje.
T
p
lód
woda
Zależność
ciśnienia,
pod którym zachodzi
topnienie wody od
temperatury.
Nachylenie
linii
określa znak w
tym wypadku
ujemny.
dT
dp
Co jest przyczyną tego wyjątkowego
zachowania ?
Cząsteczka wody jest wybitnie polarna i
obdarzona
momentem
dipolowym.
Pomiędzy cząsteczkami wody tworzą się
wiązania
wodorowe,
które
są
ukierunkowane w ściśle określony sposób
w przestrzeni.
wiązanie
wodorowe
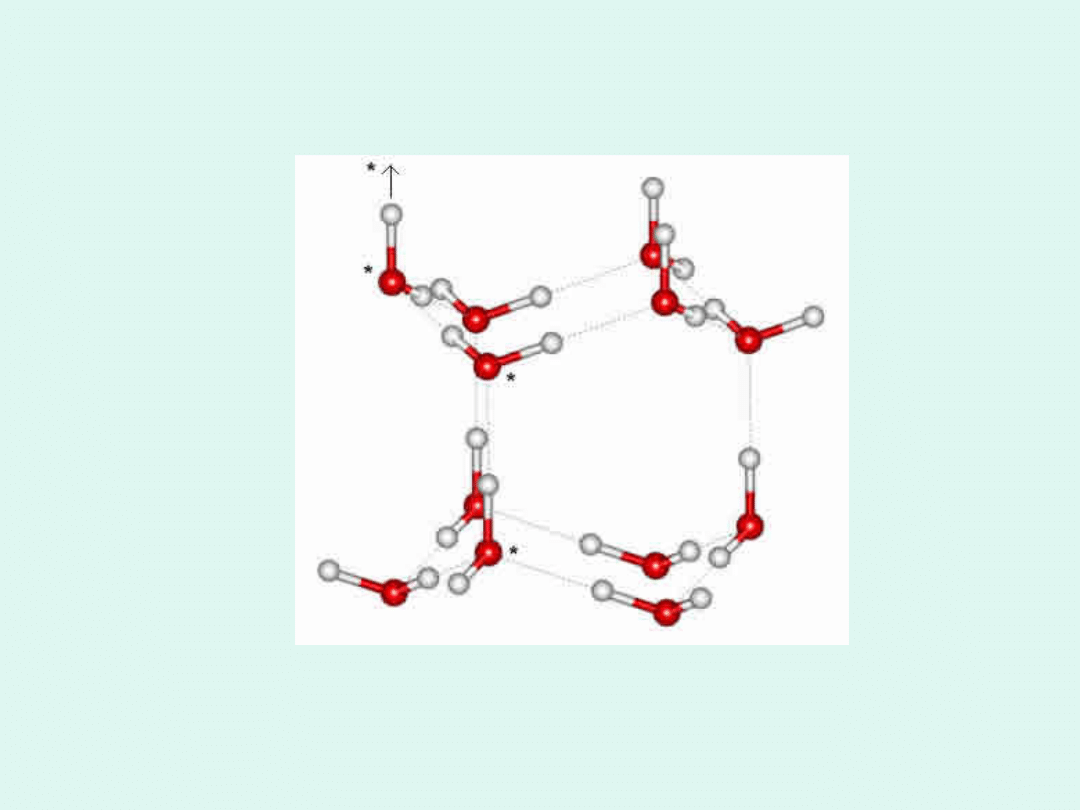
Heksagonalna struktura lodu

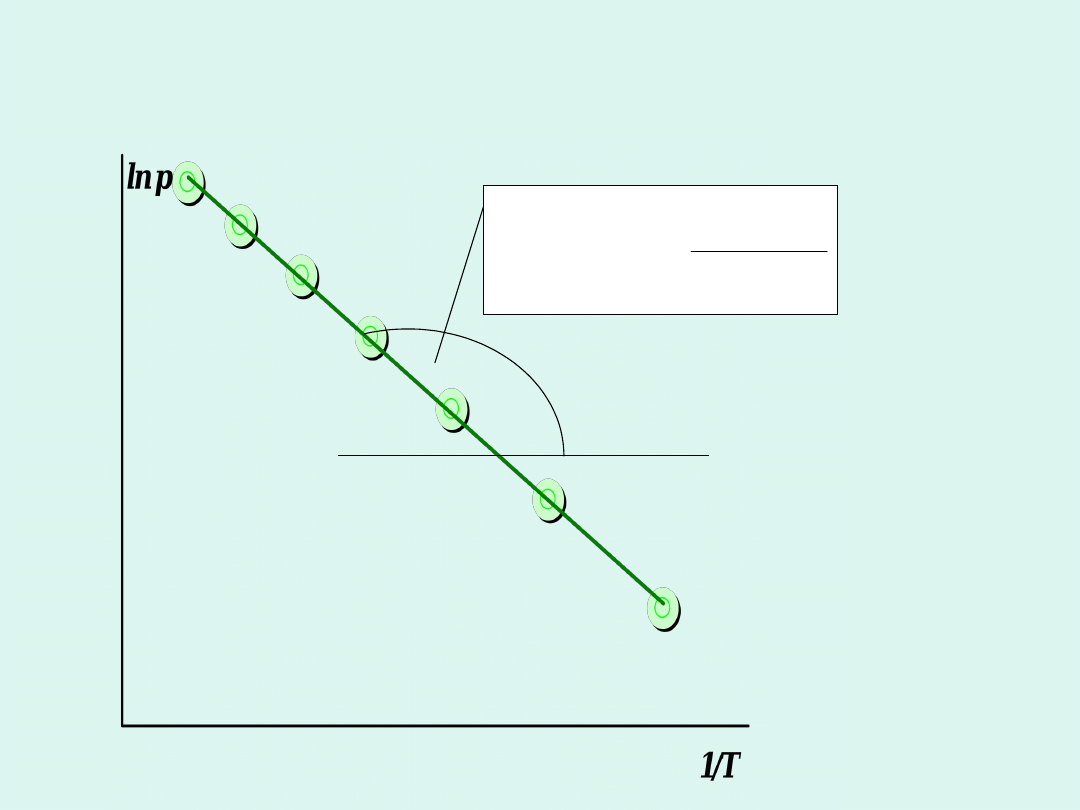
R
H
tg
a
m
par
Wyznaczanie entalpii parowania
a
R
H
m
par
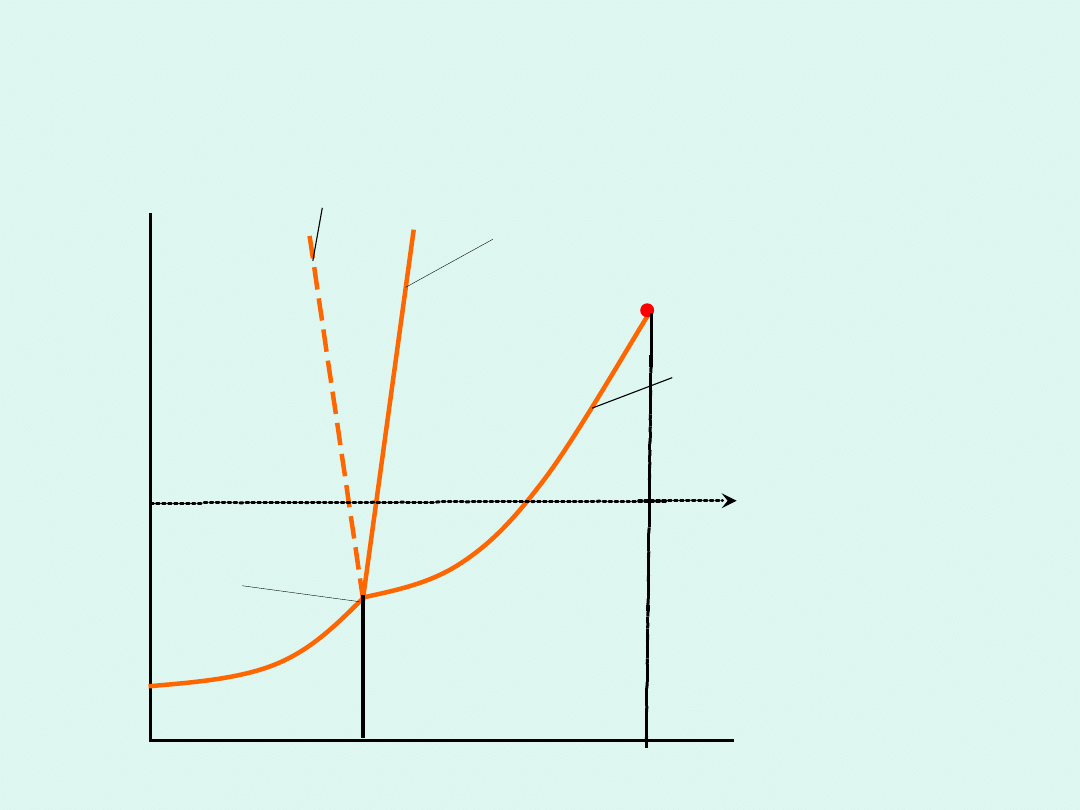
para
ciecz
ciało
stałe
p
T
punkt krytyczny
punkt
potrójny
typowe
zachowanie
nietypowe
zachowanie
(woda)
T
p
T
kr
p
atm
Schematyczny diagram fazowy
układu jednoskładnikowego
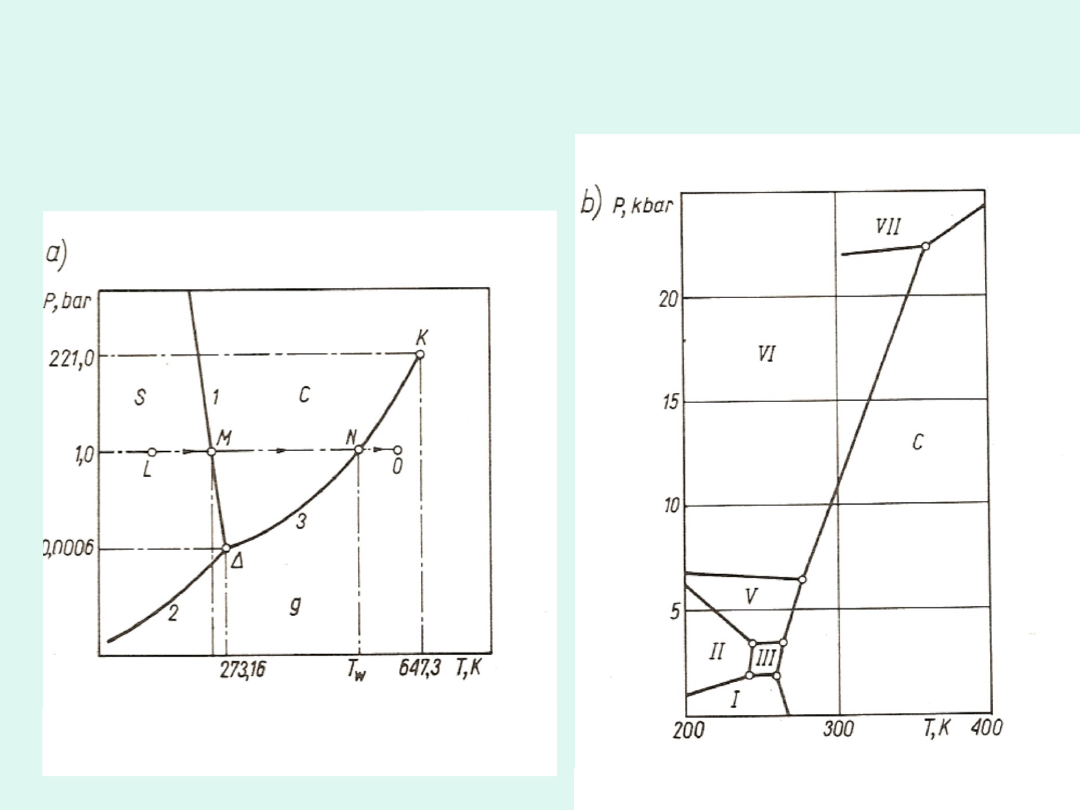
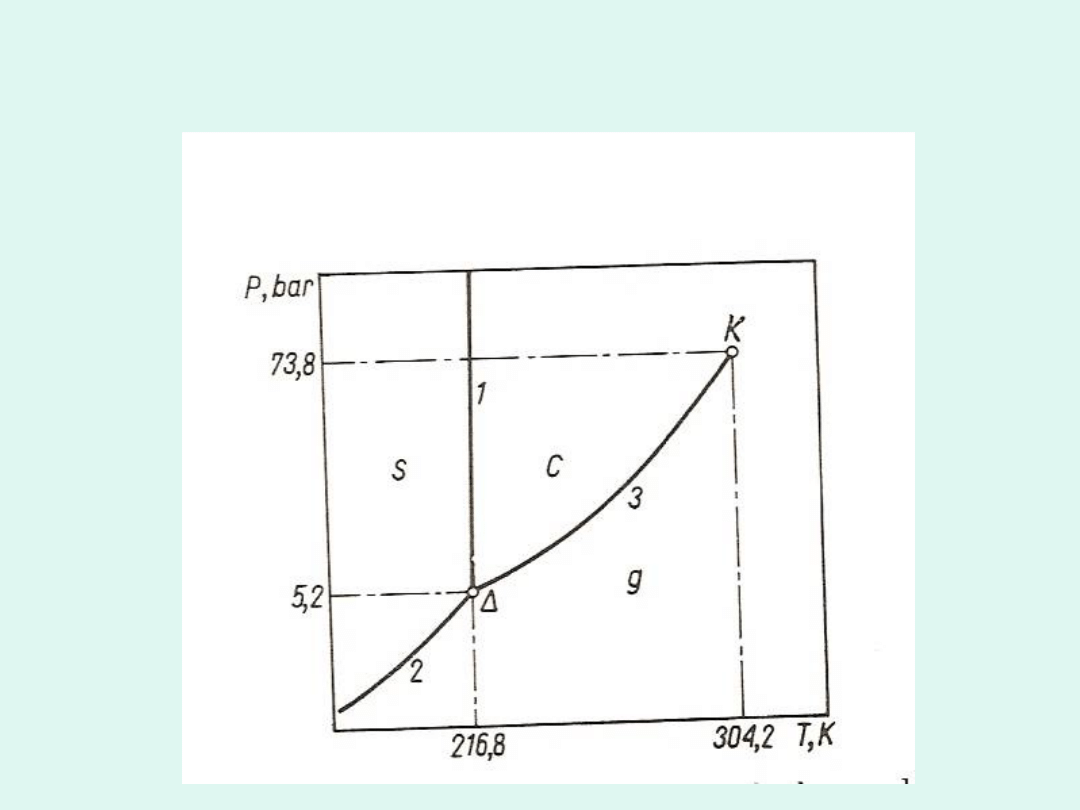
Wykres fazowy wody
Wykres fazowy CO
2
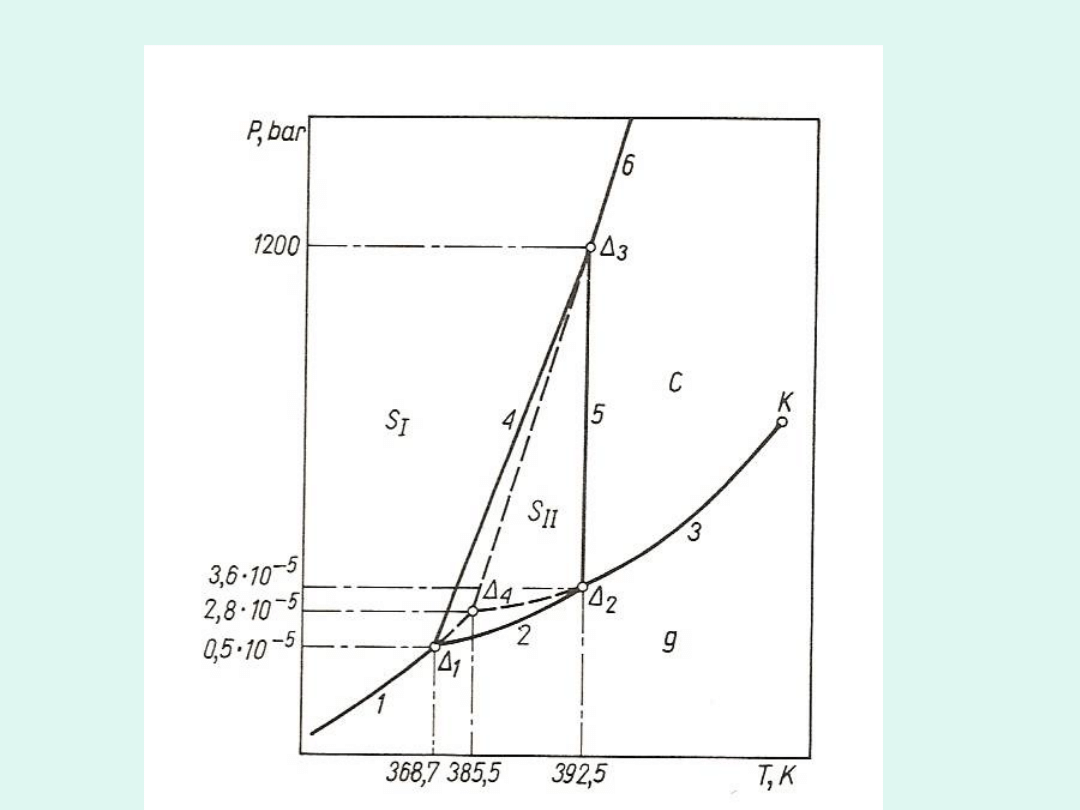
Wykres fazowy dla siarki

p
2
0 x
1(c)
→
1
1 ← x
2(c)
0
p
1
p
T = const
*
1
p
*
2
p
p
p
Ilustracja prawa Raoulta
*
2
*
1
c
1
*
2
*
2
c
2
2
*
1
c
1
1
p
p
x
p
p
p
x
p
p
x
p
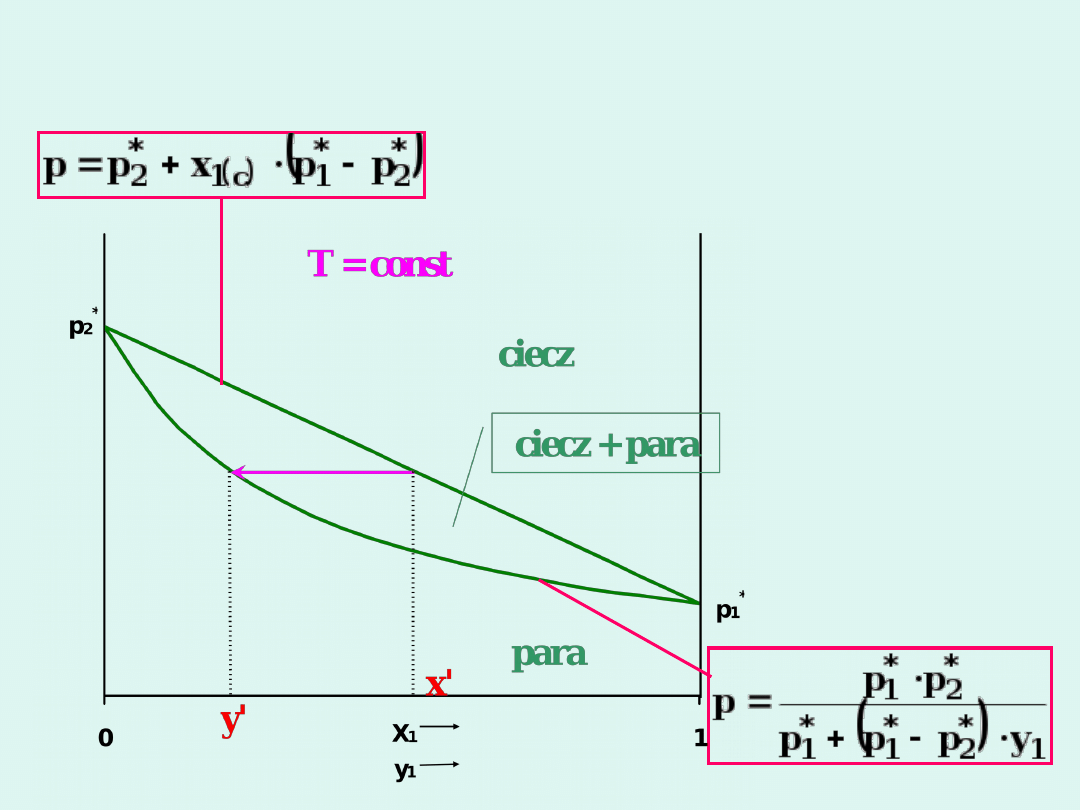
Wykres fazowy dla układu
dwuskładnikowego spełniającego
prawo Raoulta
p
p
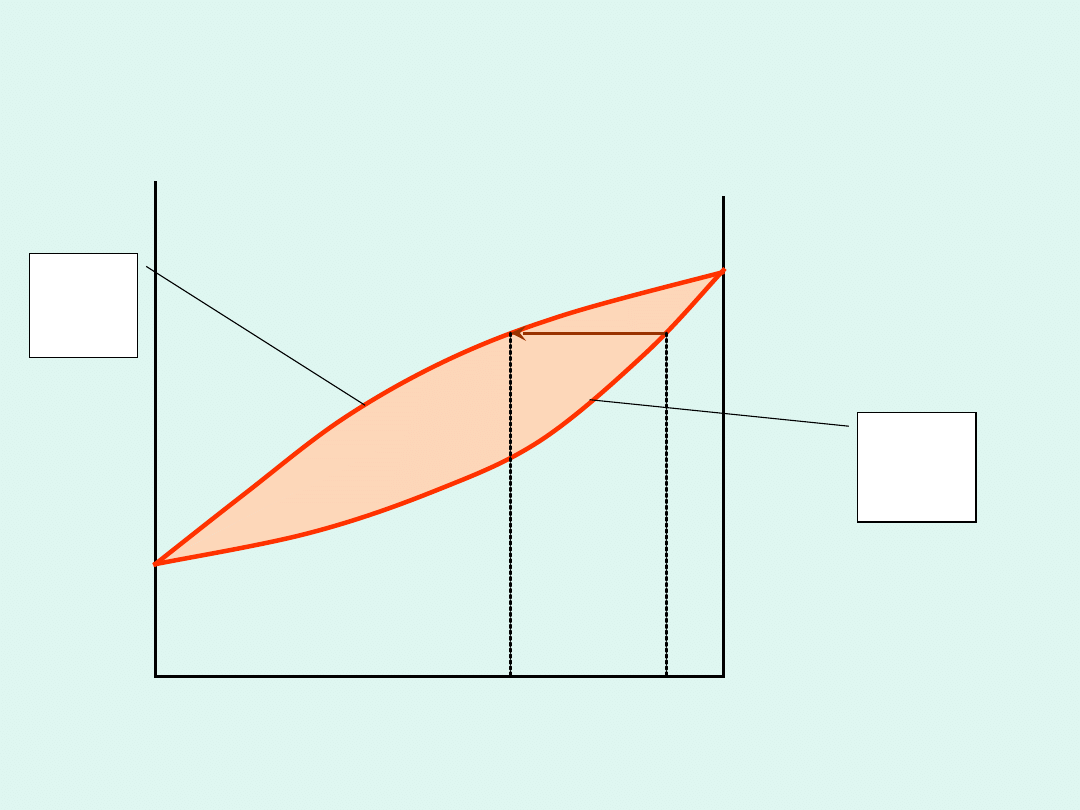
p = const
0 x
1
→
1 y
1
→
para
ciecz
ciecz + para
T
1
o
T
2
o
y' x'
T
T
Wykres fazowy dla układu
dwuskładnikowego spełniającego
prawo Raoulta (roztworu
doskonałego)
linia
ciec
zy
lini
a
par
y

T = const
0 x
2
→
1
roztwór
idealnie
rozcieńczony
(prawo
Henry'ego)
roztwór
doskonały
(prawo
Raoulta)
K
H
p
2
*
p
p
Różnice pomiędzy prawem Raoulta i Henry’ego –
interpretacja stałej Henry’ego
*
2
c
2
2
p
x
p
H
c
2
2
K
x
p
Prawo
Raoulta
Prawo
Henry’ego
0
0
ln x
2
ln x
2
*
2
rzecz
2
o
2
roztwór doskonały roztwór
idealnie
rozcieńczony
Interpretacja stanu standardowego
0 x
1
→
1
0 x
1
→
1
p
p
p
p
T =
const
Odchylenia od prawa Raoulta
dodatnie
ujemne
RT ln
'
RT ln
ln x
2
x
2
0
prawo
Raoulta
prawo
Henry'ego
*
2
o
2
Dobór stanu stanu
standardowego dla roztworów
rzeczywistych w oparciu o
prawo Raoulta i prawo
Henry’ego oraz znaczenie
współczynników aktywności
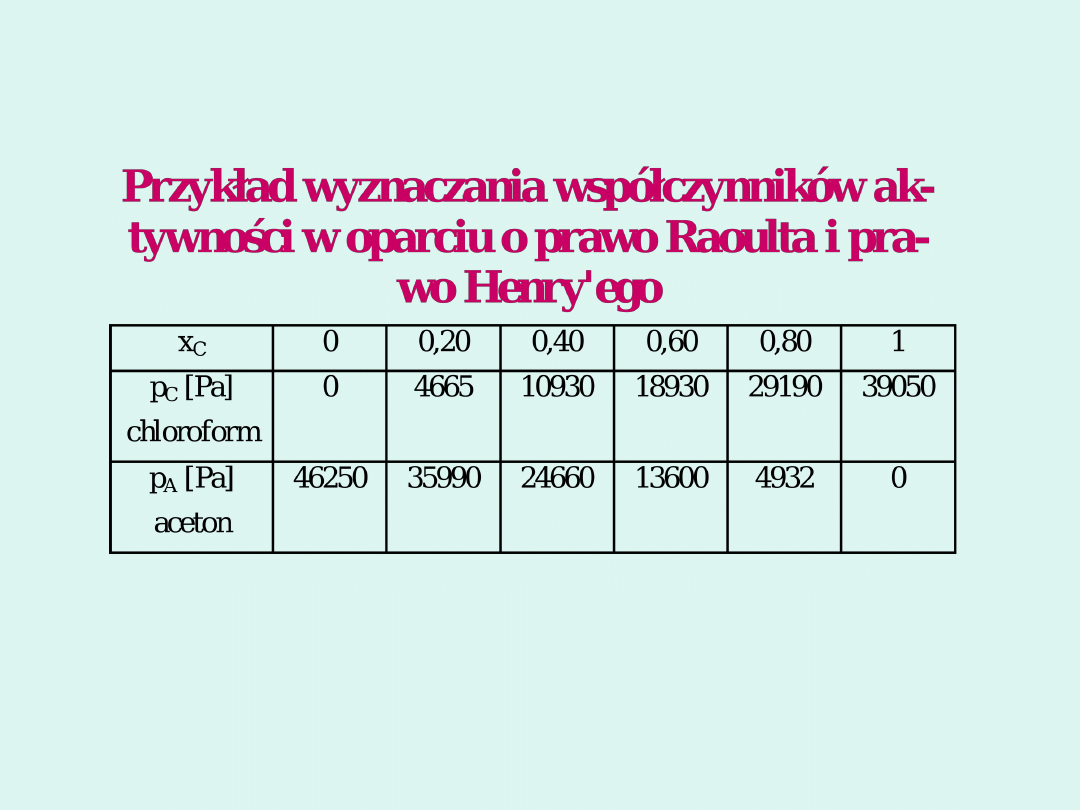
t =
35°C
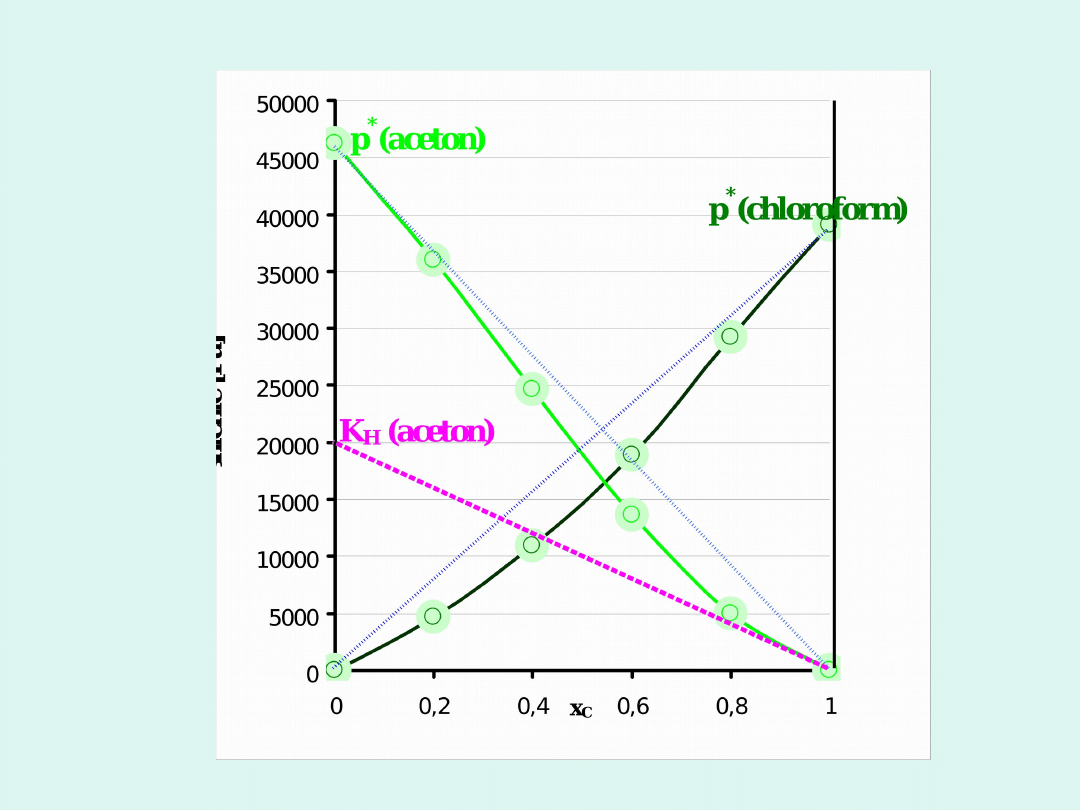
Stała Henry’ego dla acetonu w
chloroformie odczytana z wykresu wynosi
K
H
= 20 000 Pa
dla x
A
= 0,4 p
A
=13 600 Pa
7
,
1
20000
4
,
0
13600
K
x
p
735
,
0
46250
4
,
0
13600
p
x
p
H
A
rzecz
A
'
2
*
A
A
rzecz
A
2
c
m2
roztwór
rzeczywisty
hipotetyczny stan
standardowy
roztwór idealnie
rozcieńczony
0
1
a
2
Dobór stanu standardowego dla substancji
rozpuszczonej w roztworze rzeczywistym,
gdy skład wyrażony jest przez stężenie
molalne (w mol/kg)
0
ln
c
m2
roztwór
idealnie
rozcieńczony
roztwór
rzeczywisty
2
ln
RT
2
Interpretacja stanu standardowego i
współczynnika aktywności substancji
rozpuszczonej w roztworze rzeczywistym,
gdy skład wyrażony jest jako stężenie
molalne (w mol/kg)
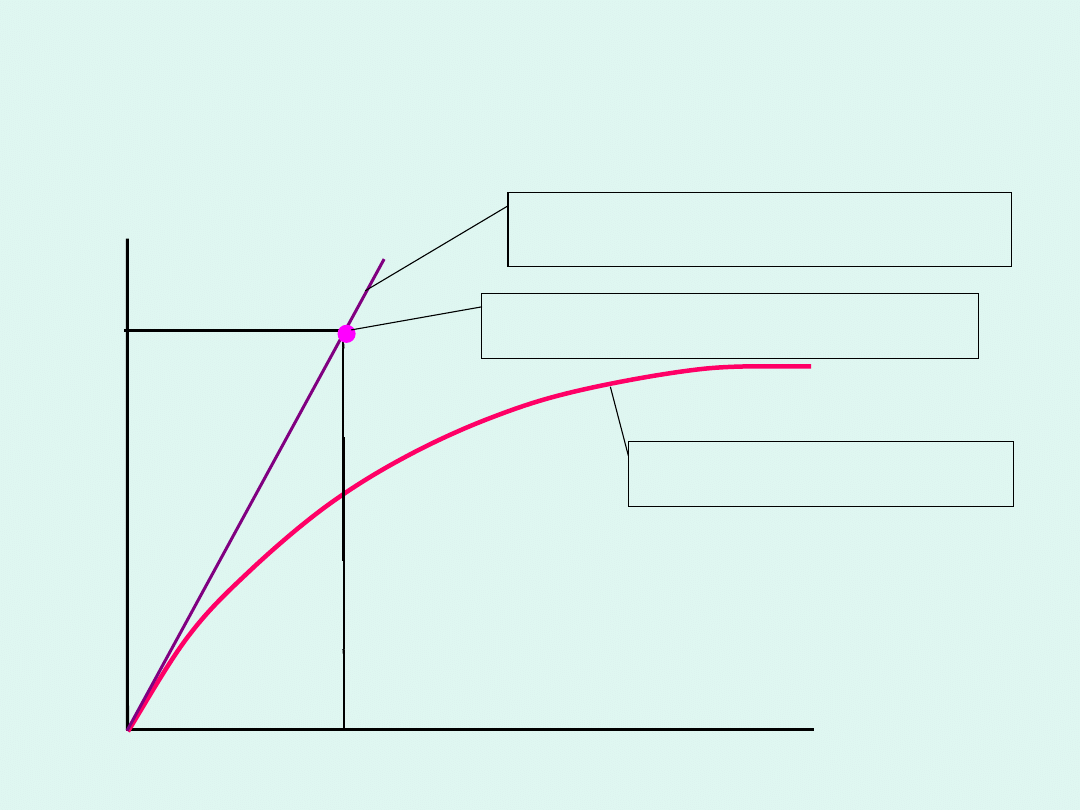
c
2
roztwór
rzeczywisty
hipotetyczny stan
standardowy
roztwór idealnie
rozcieńczony
0
1
a
2
Dobór stanu standardowego dla substancji
rozpuszczonej w roztworze rzeczywistym,
gdy skład wyrażony jest przez stężenie
molowe (w mol/dm
3
)
0
ln c
2
roztwór
idealnie
rozcieńczony
roztwór
rzeczywisty
2
ln
RT
2
Interpretacja stanu standardowego i
współczynnika aktywności substancji
rozpuszczonej w roztworze rzeczywistym,
gdy skład wyrażony jest jako stężenie
molowe (w mol/dm
3
)
T=con
st
0 x
1
→
1
0 x
1
→
1
ciecz
ciecz
para
para
p
p
p
p
ciecz i para
w
równowadze
odchylenia
ujemne
odchylenia
dodatnie
Wykresy fazowe układu dwu cieczy o
nieograniczonej mieszalności wykazujące
niewielkie odstępstwa od prawa Raoulta
T = const
p = const
ciecz
ciecz
para
para
0 x
1
→
1
0 x
1
→
1
A
A
Azeotrop ujemny - układ z maksymalną
temperaturą wrzenia
p
p
T
T
A
– punkt azeotropowy
x
AZ
= y
AZ
T = const
p = const
Azeotrop dodatni - układ z minimalną
temperaturą wrzenia
T
A
– punkt azeotropowy
x
AZ
= y
AZ
0 x
1
→
1
0 x
1
→
1
ciecz
para
A
ciecz
para
A
p
p
T
roztwór
doskonały
małe
odchylenia od
zachowania
doskonałego
duże odchylenia
od zachowania
doskonałego
p, T =
const
mix
G
m
0
0
1
x
1
→
A
B
Entalpia swobodna mieszania dwu
cieczy
T
GM
jedna faza
ciekła
dwie fazy
ciekłe
GKTM
A
B
0 x
1
→
1
p = const
x
GM
T
T
Wykres fazowy dla układu dwu cieczy o
ograniczonej mieszalności z górną krytyczną
temperaturą mieszalności
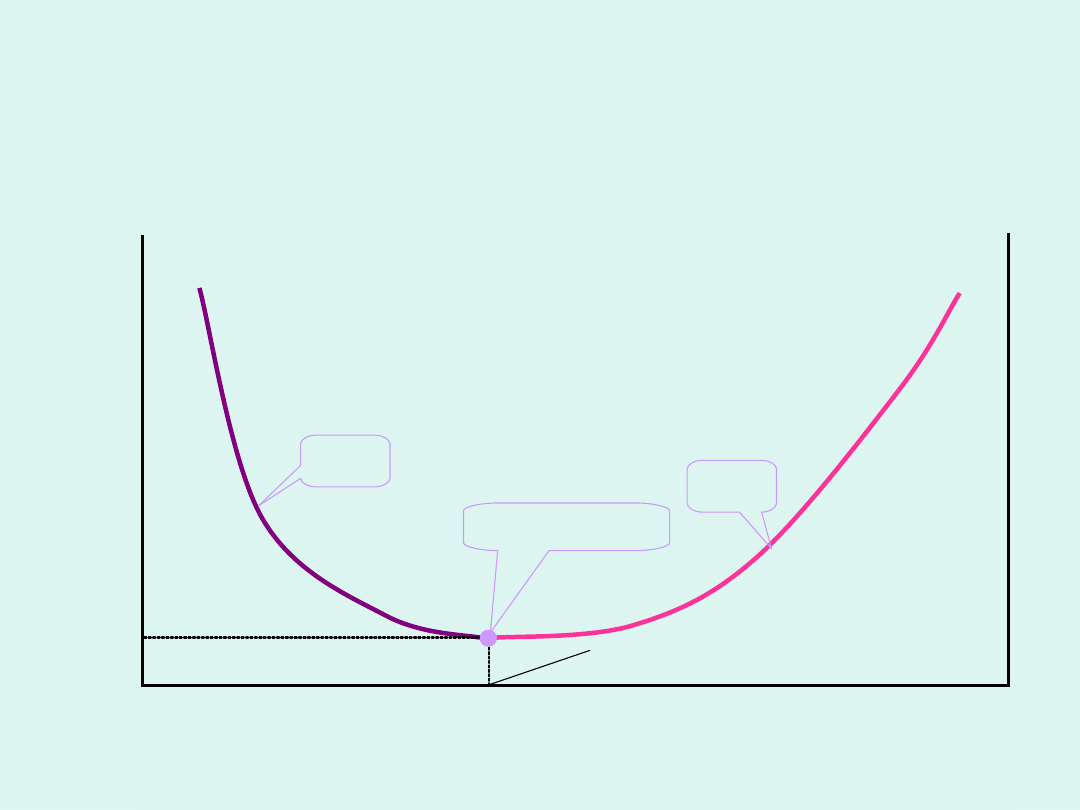
T
DM
jedna
faza
ciekła
dwie fazy
ciekłe
DKTM
B
A
0 x
1
→
1
p = const
x
DM
T
T
Wykres fazowy dla układu dwu cieczy o
ograniczonej mieszalności z dolną
krytyczną temperaturą mieszalności
T
GM
jedna faza
ciekła
dwie fazy
ciekłe
GKTM
A
B
0 x
1
→
1
p = const
DKTM
T
DM
x
GM
x
DM
T
T
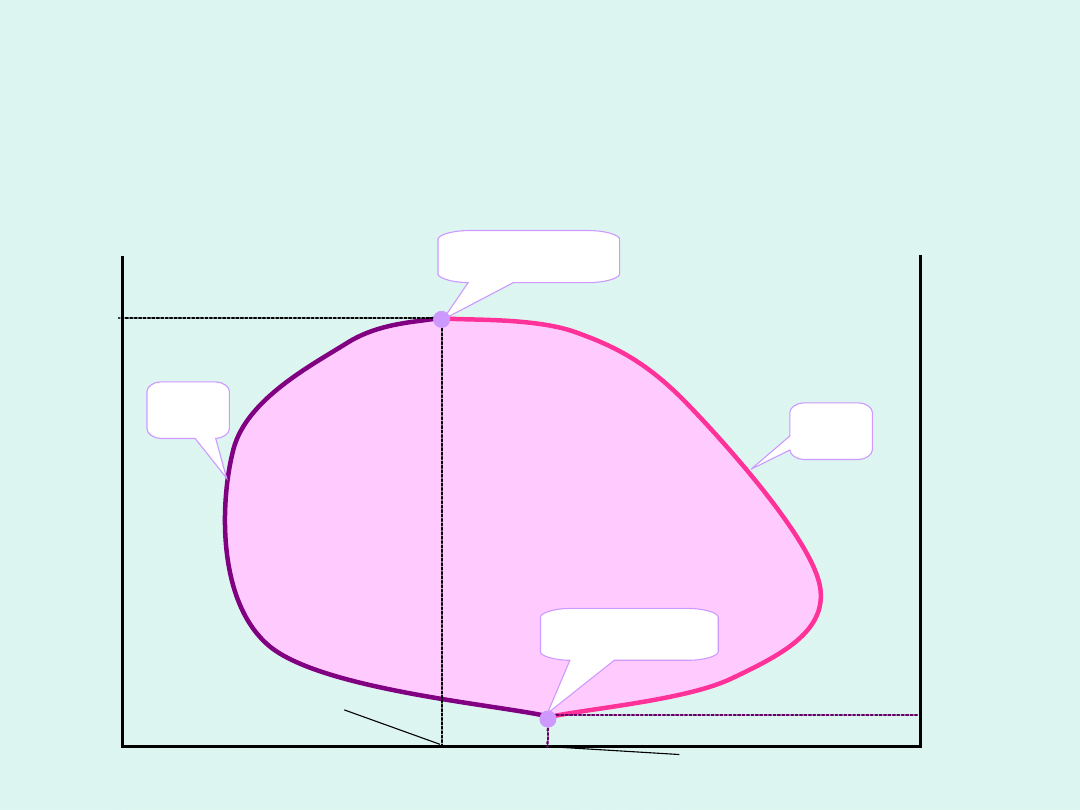
Wykres fazowy dla układu dwu cieczy o
ograniczonej mieszalności z dolną i górną
krytyczną temperaturą mieszalności
dwie fazy
ciekłe
T
p
punkt
hiperkrytyczny
DKTM
GKTM
jedna faza
ciekła
Zależność dolnej i górnej krytycznej
temperatury mieszalności od ciśnienia
T
jedna faza ciekła
par
a
0 x
1
→
1
A
dwie fazy ciekłe
GKT
M
T
ciecz +
para
p =
const
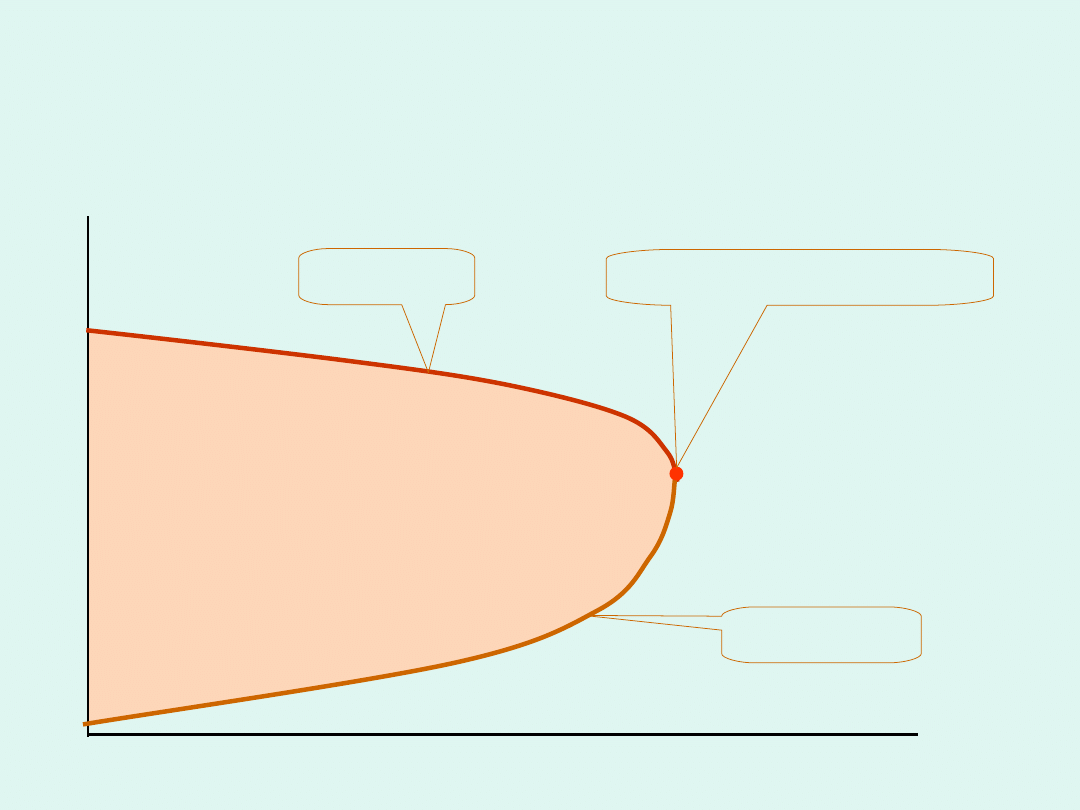
Przykładowe wykresy fazowe równowag
ciecz-para dla układu dwu cieczy o
ograniczonej mieszalności
przykład :
woda -fenol
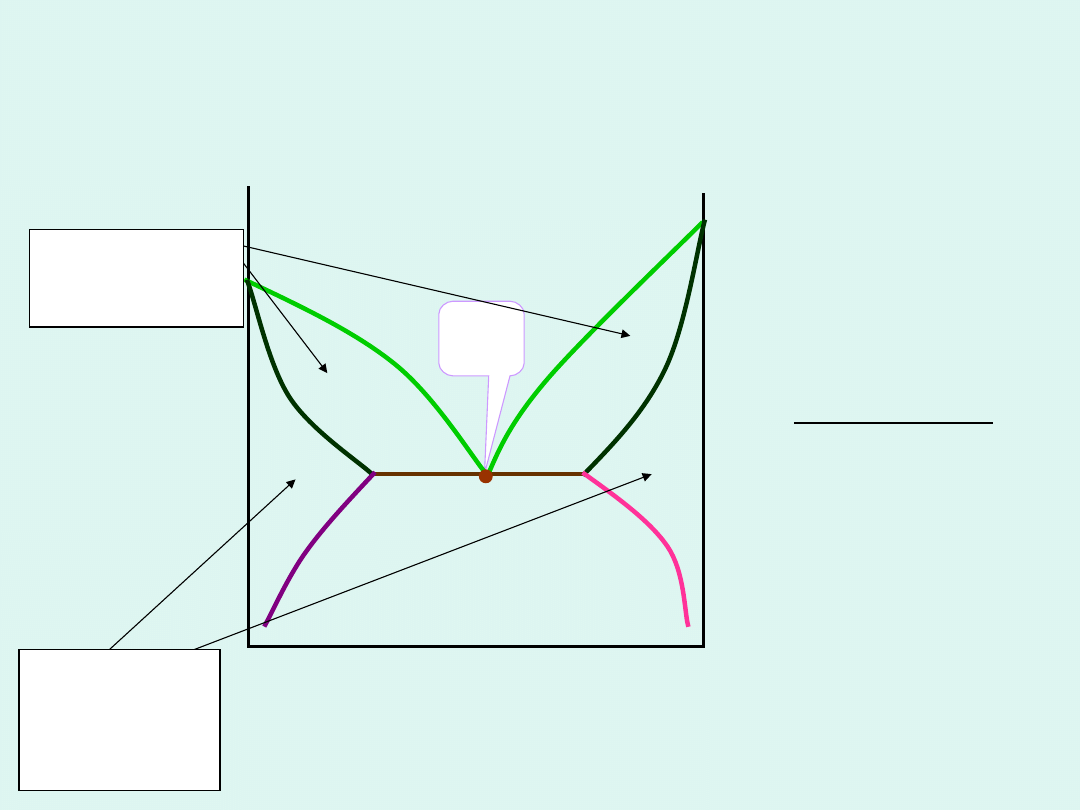
Przykładowe wykresy fazowe równowag
ciecz-para dla układu dwu cieczy o
ograniczonej mieszalności
T
dwie fazy ciekłe
par
a
0 x
1
→
1
H
A
T
p =
const
ciecz +
para
jedna
faza
ciekła
przykład :
woda – 2-
butanol
HA – punkt
heteroazeotrop
owy
Destylacja dwu cieczy całkowicie
niemieszających się

Równowagi ciecz – ciało stałe w
układzie dwuskładnikowym
Prezentujemy zawsze przy p = const
Podstawowe typy :
Całkowita mieszalność obu
składników w stanie ciekłym i stałym
Całkowita mieszalność obu składników
w stanie ciekłym i całkowita
niemieszalność w stanie stałym
Całkowita mieszalność obu składników
w stanie ciekłym i tworzenie związku
przejściowego trwałego tylko w stanie
stałym
Całkowita mieszalność w stanie
ciekłym i ograniczona w stanie stałym
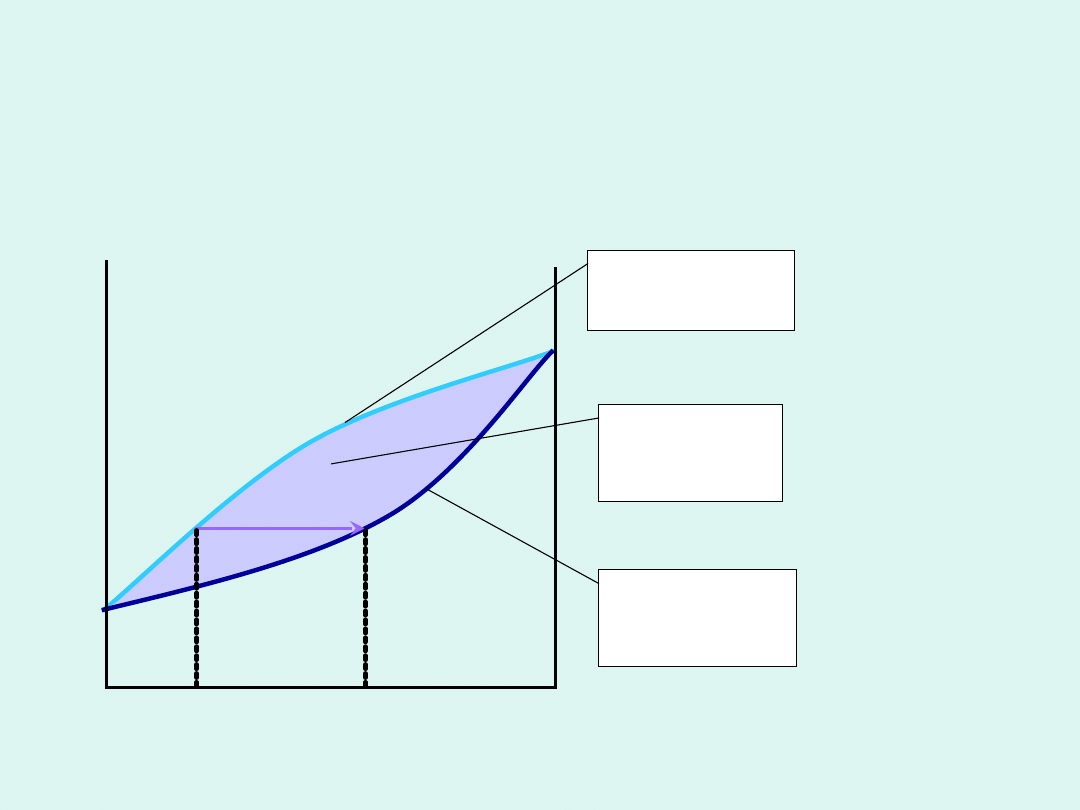
Przykłady wykresów fazowych układów
dwuskładnikowych z całkowitą
mieszalnością w stanie ciekłym i
stałym
0 x
1
→
1
T
ciało
stałe
ciecz
skład
cieczy
skład fazy
stałej
x’
(c)
x’
(s)
T
Zachowa
nie obu
składnikó
w
zbliżone
do
doskonał
ego
ciecz +
ciało
stałe
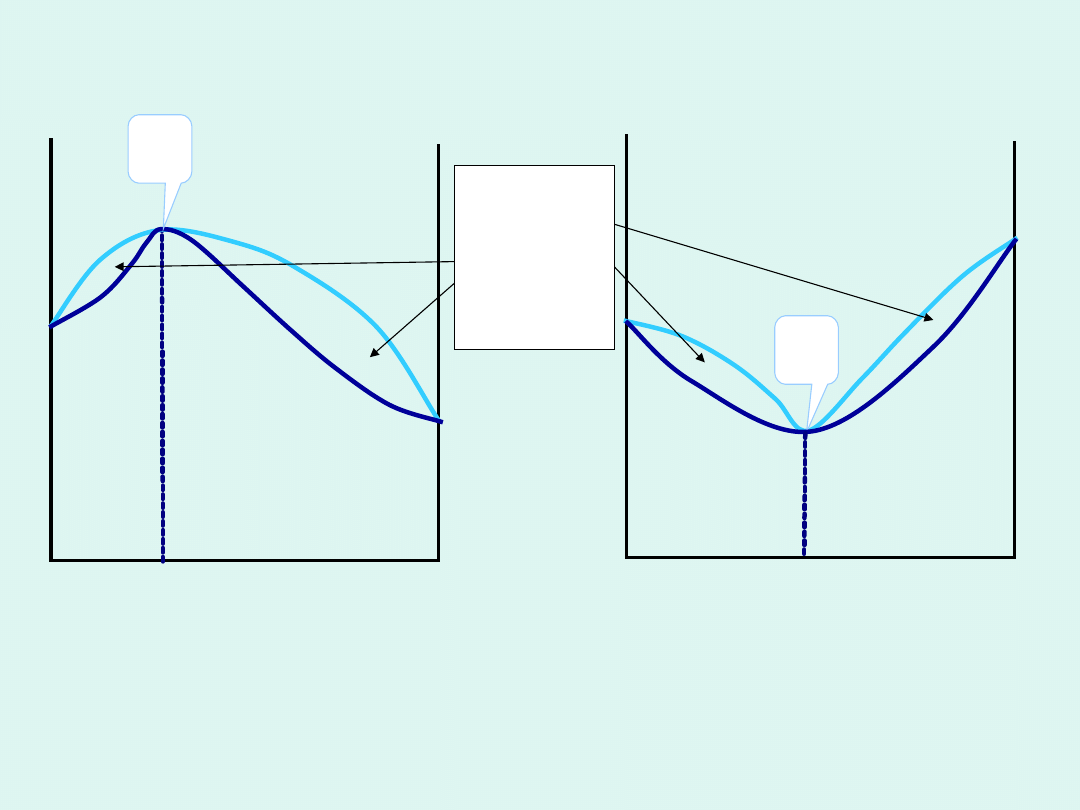
ciecz
ciało
stałe
0 x
1
→
1
B
ciecz
ciało
stałe
0 x
1
→
1
B
T
T
T
T
x
B
x
B
z maksymalną temperaturą z minimalną
temperaturą
topnienia topnienia
B – w tym punkcie skład fazy ciekłej i stałej
jest taki sam
układy wykazujące odchylenia od
zachowania doskonałego
ciecz
+
ciało
stałe
ciecz i
czysty stały
1
ciecz i
czysty
stały 2
roztwór
nasyco
ny 1 w
2
E
T
czyste stałe 1 i 2
ciecz
roztwó
r
nasyco
ny 2 w
1
T
0 x
1
→
1
Wykres fazowy układu dwuskładnikowego
wykazującego całkowitą mieszalność w
fazie ciekłej i całkowicie niemieszających
się w fazie stałej

Doskonale znany przykład układu
eutektycznego
woda – NaCl
x
E NaCl
= 0,2242 t
E
= -21,2°C
Zastosowanie :
Mieszanina chłodząca
Usuwanie lodu z ulic zimą
T
nasycone
stała faza
i
stała faza
ciecz
0 x
1
→
1
E
1
2
A
B
C
F
G
H
T
Punkt
E
to
punkt
eutektyczny.
- stały roztwór
składnika 1 w 2
- stały roztwór
składnika 2 w 1
1
– obszar równowagi
cieczy i nasyconej
stałej fazy
2
- obszar równowagi
cieczy i nasyconej
stałej fazy
A,F – temperatura
topnienia w funkcji
składu cieczy
B,G – temperatura
topnienia w funkcji
składu fazy stałej
C,H – linie nasycenia
dla roztworów stałych
Wykresy fazowe układów dwuskładnikowych
wykazujących całkowitą mieszalność w fazie
ciekłej i ograniczoną w fazie stałej
0 x
1
→
1
M
ciecz
T
M
T
T
E
1
stały 2 i
stały
związek 12
E
2
stały 1 i
stały
związek
12
Wykresy fazowe układów dwuskładnikowych
wykazujących całkowitą mieszalność w fazie
ciekłej, tworzących związek przejściowy trwały
tylko w stanie stałym
M
– punkt
topnienia
przejściow
ego
związku
12
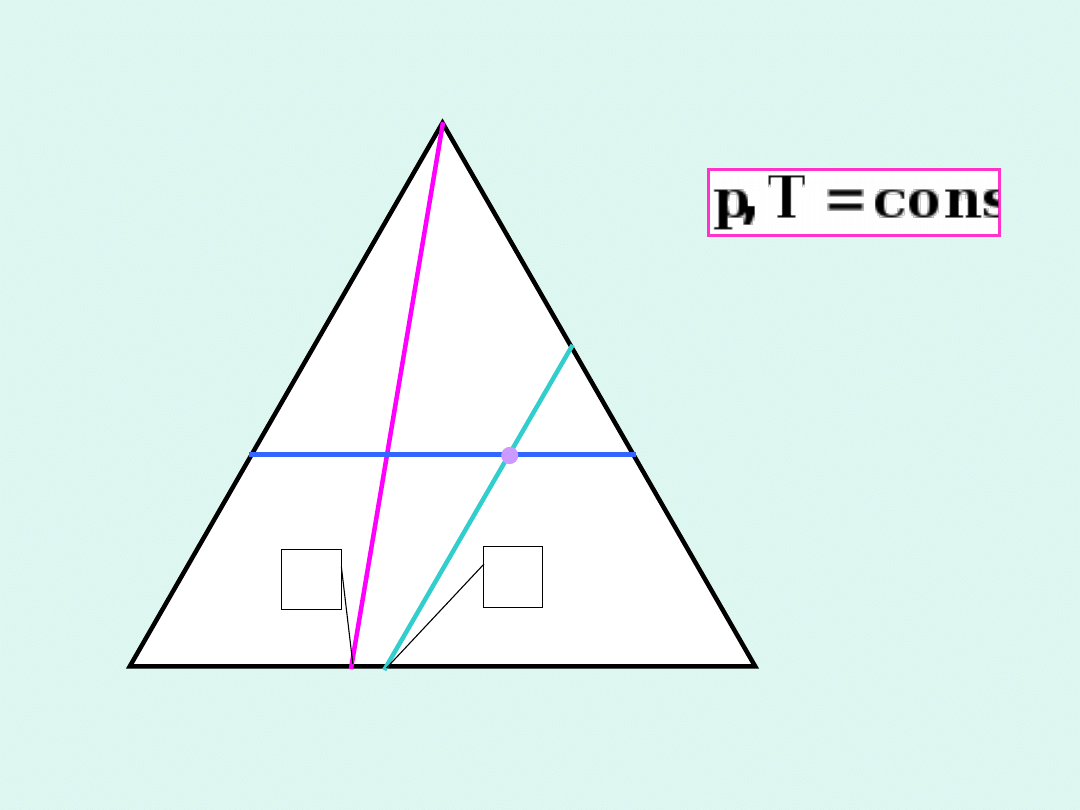
A
B
C
0 x
B
→
1
1 ← x
A
0
D
L
M
P
R
Trójkąt
Gibbsa
B
A
C
x
x
1
x
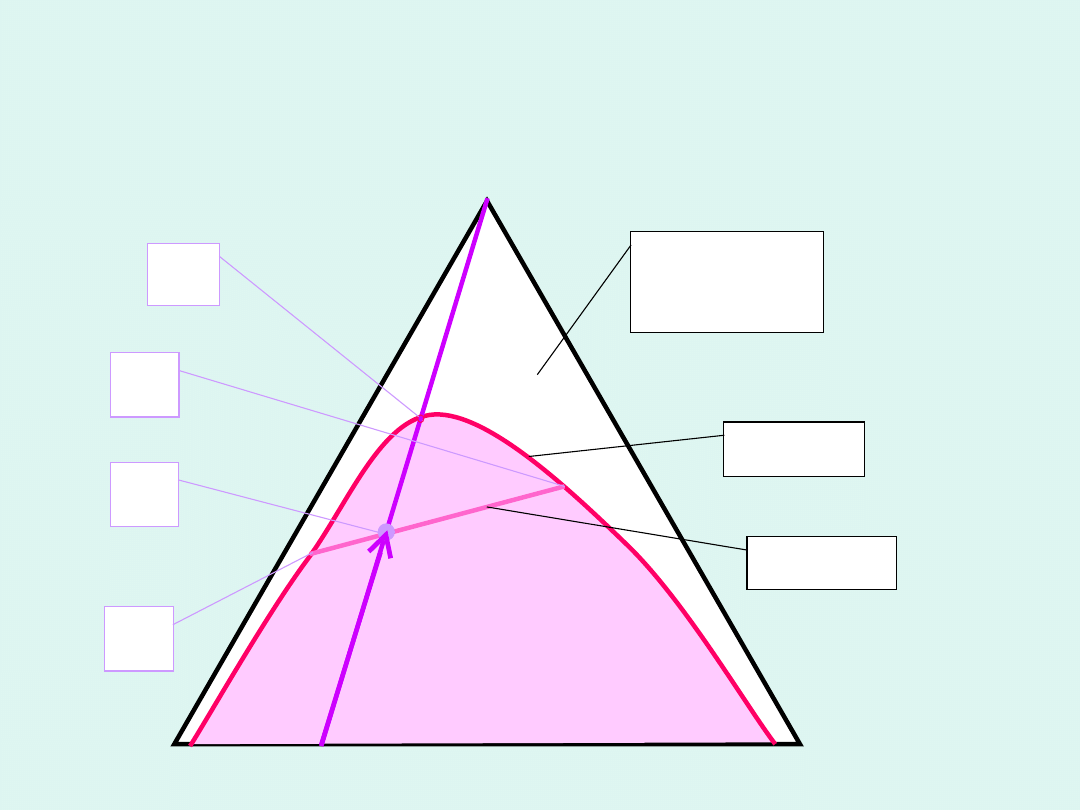
dwie fazy
ciekłe
jedna
faza
ciekła
A
B
C
D
(x
A
,x
B
)
H
binod
a
M'
M
M'
'
konod
a
Przykład wykresu fazowego w ciekłym układzie
trójskładnikowym
Dwie ciecze
A
i
B
wykazują ograniczoną mieszalność,
ciecz
C
wykazuje nieograniczoną mieszalność z
cieczami
A
i
B
.
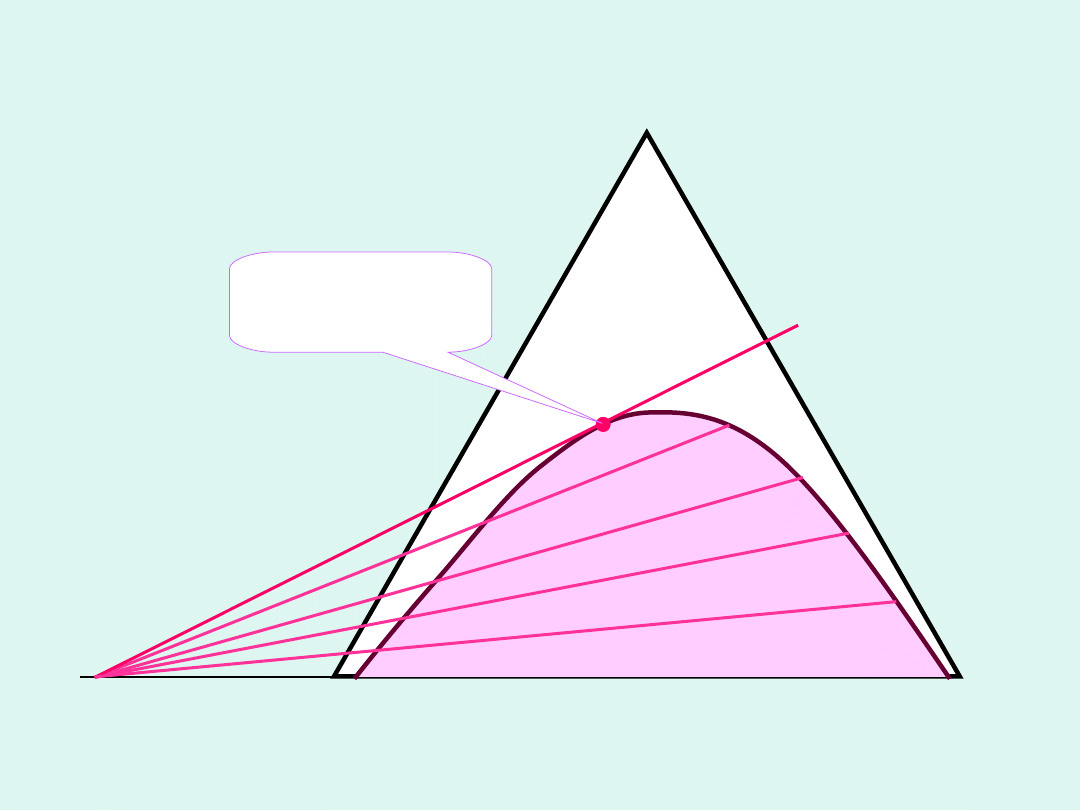
A
B
C
punkt
homogeniza
cji
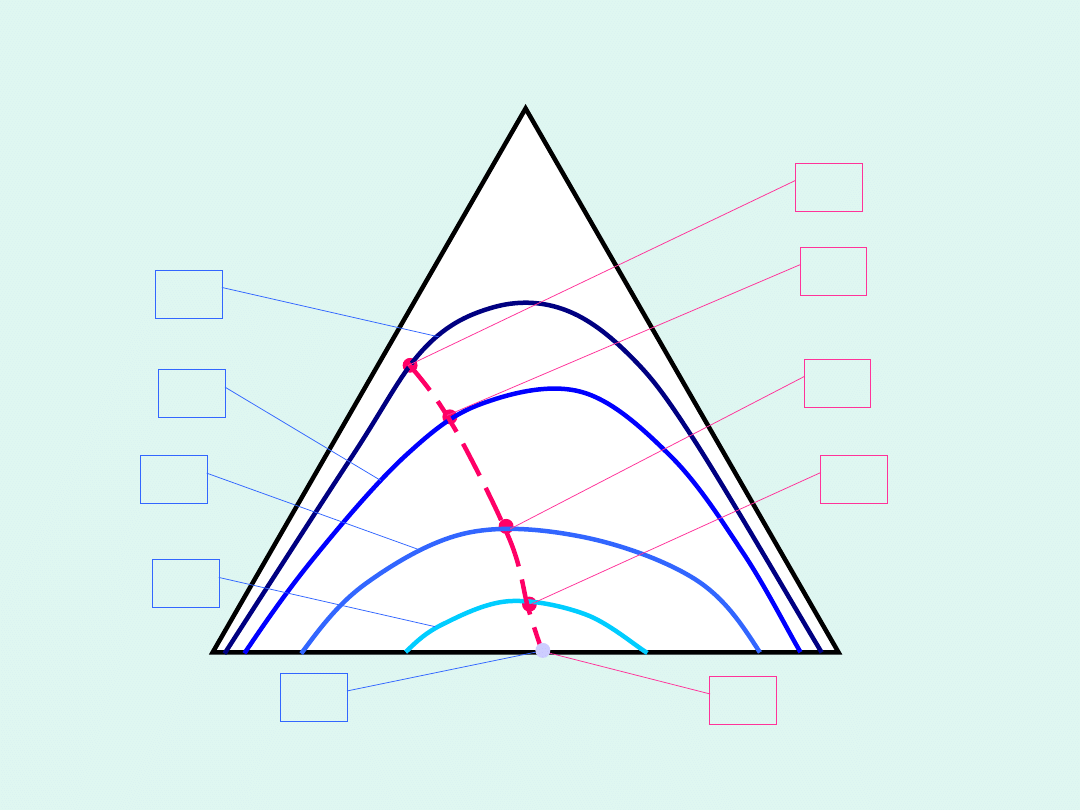
A
C
B
T
1
T
5
T
4
T
3
T
2
H
5
H
4
H
3
H
2
H
1
T
1
< T
2
< T
3
< T
4
<
T
5
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
Wyszukiwarka
Podobne podstrony:
Wykład Ch F równowagi chemiczne
wykład+nr+4+ +Wykresy+równowagi+fazowej+stopów
wykład+nr+5+ +Wykresy+równowagi+fazowej+stopów+c d
Równowagi fazowe, wykład
Wykład Ch F konduktometria
Wykład Ch F wielkości kol
Wykład Ch F I zasada
7 uklady rownowagi fazowej id 4 Nieznany
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
7 Analiza termiczna w zastosowaniu do wyznaczania wykresu równowagi fazowej
Wykład Ch F potencjometria
układy równowagi fazowej
więcej podobnych podstron